PROCESOS DE ADSORCIÓN PROCESOS DE ADSORCIÓN
Anuncio
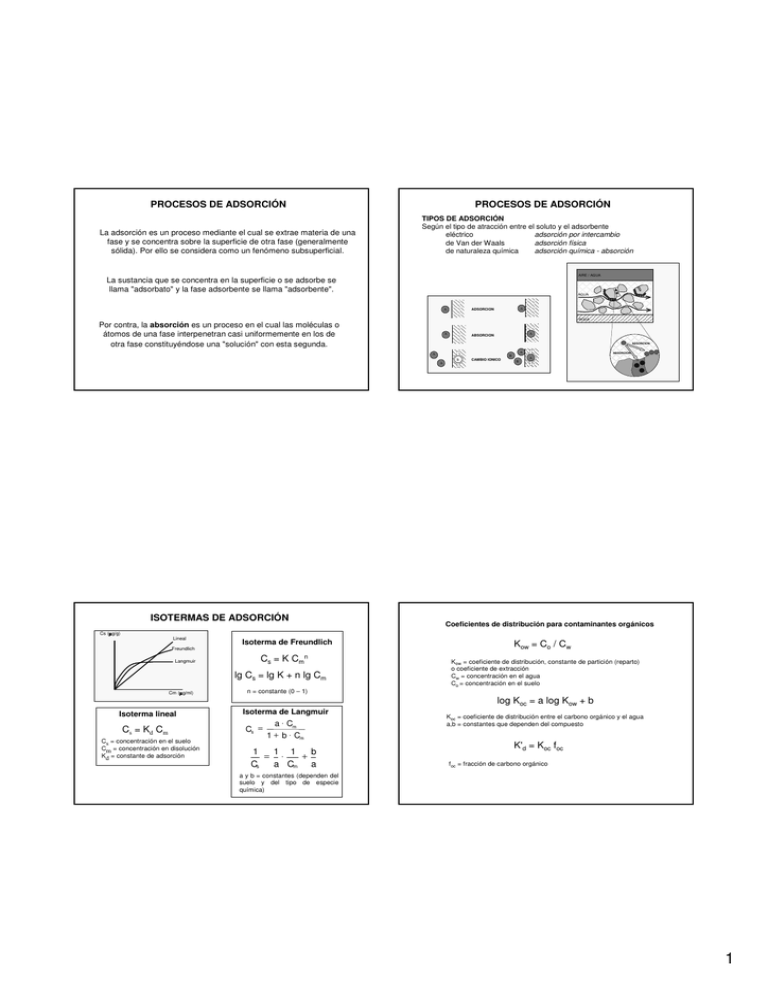
PROCESOS DE ADSORCIÓN La adsorción es un proceso mediante el cual se extrae materia de una fase y se concentra sobre la superficie de otra fase (generalmente sólida). Por ello se considera como un fenómeno subsuperficial. PROCESOS DE ADSORCIÓN TIPOS DE ADSORCIÓN Según el tipo de atracción entre el soluto y el adsorbente eléctrico adsorción por intercambio de Van der Waals adsorción física de naturaleza química adsorción química - absorción AIRE / AGUA La sustancia que se concentra en la superficie o se adsorbe se llama "adsorbato" y la fase adsorbente se llama "adsorbente". AGUA ADSORCION A A ROCA Por contra, la absorción es un proceso en el cual las moléculas o átomos de una fase interpenetran casi uniformemente en los de otra fase constituyéndose una "solución" con esta segunda. A A ABSORCION ADSORCION A A B B A ISOTERMAS DE ADSORCIÓN Cs (µ µ g/g) Lineal Freundlich Langmuir Isoterma de Freundlich Cs = K Cmn lg Cs = lg K + n lg Cm Cm (µ µ g/ml) Isoterma lineal Cs = Kd Cm Cs = concentración en el suelo Cm = concentración en disolución Kd = constante de adsorción CAMBIO IONICO ABSORCION A B Coeficientes de distribución para contaminantes orgánicos Kow = Co / Cw Kow = coeficiente de distribución, constante de partición (reparto) o coeficiente de extracción Cw = concentración en el agua Co = concentración en el suelo n = constante (0 – 1) log Koc = a log Kow + b Isoterma de Langmuir Cs = a ⋅ Cm 1 + b ⋅ Cm 1 1 1 b = ⋅ + Cs a Cm a Koc = coeficiente de distribución entre el carbono orgánico y el agua a,b = constantes que dependen del compuesto K'd = Koc foc f oc = fracción de carbono orgánico a y b = constantes (dependen del suelo y del tipo de especie química) 1 PROCESOS DE INTERCAMBIO INTERCAMBIO Na - Ca Si se considera la reacción de cambio binario entre dos cationes monovalentes A+ y B+ (intercambio monovalente), donde R representa la partícula sólida adsorbente, el intercambio puede ser descrito: Na + + 1 / 2 Ca − R 2 → Na − R + 1 / 2 Ca 2 + 1 / 2 Ca 2 + + Na − R → 1 / 2 Ca − R 2 + Na + A + + B−R ⇔ B+ + A−R Alcanzándose el equilibrio cuando: KA/ B = B+ A+ A B [A+] y [B+] actividades respectivas de los iones en la solución A y B fracciones molares de los iones adsorbidos por la fase sólida KA/B es la constante o coeficiente de selectividad si K>1 la permutita tiene preferencia por B+ si K<1 la tiene por A+ CAPACIDAD DE CAMBIO (CCI) Miliequivalentes que puede cambiar con la solución por cada 100 gr. Illitas 25 - 50 Montmorillonita 50 -150 Vermiculita 50 - 150 Suelos orgánicos 150 - 400 Series , teniendo en cuenta el tamaño de los iones Li+< Na+< K+<Cs+ Mg2+< Ca2+< Sr2+< Ba2+ Series de Hofmeister (entre diferentes cationes) Cationes Li+< Na+< K+< NH4+< Mg2+< Ca2+< Sr2+< Ba2+< Al3+< H+ Aniones SO42-> F-> NO3-> Cl-> Br-> I-> C y S > OHLa posición de los cationes mono y di en una serie combinada tiende a variar con la naturaleza del material de cambio y con la concentración y características de la solución en contacto * Caolinita * Montmorillonita * Moscovita * Ácidos húmicos Li+<Na+<H+<K+<Mg2+<Ca2+ Li+<Na+<K+<H+<Mg2+<Ca2+ Li+<Na+<Mg2+<Ca2+<K+<H+ Li+<Na+<K+<Mg2+<Ca2+<H+ Estas series se pueden considerar de orden normal. Sin embargo puede ocurrir una selección preferente de cationes que generalmente puede explicarse por la polarización y parcial deshitración de cationes. Arcilla-Na Na Ca Intercambio directo HCO3Na Intercambio inverso CaCl2 Agua-Ca Arcilla-Ca Ca Na Agua-Na FACTORES QUE OPERAN EN EL PROCESO Concentraciones respectivas del catión en el adsorbente y el líquido. La adsorción relativa es proporcionalmente más intensa en soluciones diluidas que concentradas Temperatura Las reacciones de adsorción son normalmente exotérmicas y por tanto, el grado de adsorción será presumiblemente mayor, al disminuir la temperatura La fuerza de enlace con que los iones son retenidos o adsorbidos en los lugares de cambio depende de: • Valencia y tamaño del ión • Densidad de carga, estructura y superficie específica del material de intercambio • Concentración relativa de los cationes presentes • Contenido de agua en el sistema (efecto dilución) 2 FACTORES QUE INFLUYEN EN LA FUERZA DEL ENLACE - Valencia Divalentes más fuertemente adsorbidos que los monovalentes - Tamaño del ión Menor radio hidratado, más retenidos (Ca>Mg) - Estructura Montmorillonita, todos los cationes son intercambiables. Illita, más difícilmente - Superficie específica del material de intercambio Aumenta con el tamaño de partícula Illita 80 m2 / kg Montmorillonita 800 m2 / kg - Concentración relativa de los cationes presentes - Contenido de agua en el sistema (efecto dilución) 3