Laboratorio 6
Anuncio

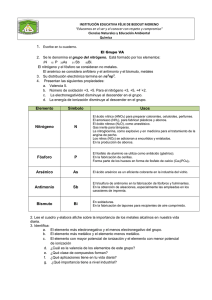
Laboratorio 6 FUSIÓN CON PRECIPITACIÓN PRECIPITACIÓN DE ANTIMONIO El principio de precipitación para la obtención de metales a partir de sulfuros, se basa en la reacción de desplazamiento del metal del sulfuro con ayuda de un metal más afín por el azufre que el metal valioso. Este proceso se utiliza sobre todo para la obtención de plomo y antimonio. En la metalurgia del hierro se utiliza al ferromanganeso como desulfurante del hierro: en este caso, se añade manganeso metálico. La fusión con precipitación de concentrados de antimonio fue desarrollada en Bretaña, donde se tenía una gran práctica en el tratamiento de concentrados de antimonio con chatarra de hierro para la producción directa de antimonio metálico. Esta forma de procesamiento es conocida con el nombre de método ingles. Aunque este método ha sido reemplazado en la actualidad por otro, se lo aplica aun en algunas plantas de la ex Unión Soviética, Checoslovaquia y algunos países europeos. En nuestro país existen algunas fundiciones pequeñas que utilizan este método, especialmente en la región de Tupiza. Este proceso se aplica a concentrados sulfurosos de alta ley, mayor a 50% Sb, y en un rango de tamaño de grano estrecho. El proceso tiene una relativa baja capacidad de tratamiento, pero es adecuado para producir pequeños tonelajes de antimonio por su simplicidad y también por tener pocos requerimientos de equipamiento. La principal reacción del proceso es una substitución del antimonio del sulfuro por hierro: Sb2S3 + 3 Fe 2 Sb + 3 FeS Para comprender mejor el proceso, es aconsejable un estudio del diagrama de equilibrio de fases del sistema Sb-Fe-S, en la región delimitada por Sb, Sb2S3, FeS y Fe. Esta zona se caracteriza por la presencia de un zona de inmisibilidad en la cual se tienen como fases líquidas antimonio y una mata constituida por sulfuros de antimonio y hierro. Esta zona de inmisibilidad parte de la esquina del antimonio y va creciendo en dirección del lado Fe-FeS. Las conodas que parten de la esquina del metal representan el equilibrio entre mata y metal para cada temperatura. Los datos termodinámicos conocidos a la fecha, muestran que la reacción que generalmente es llevada a cabo entre 1000 y 1200 ºC, es irreversible, y la recuperación de antimonio es favorecida por un decrecimiento de la temperatura. Tabla 1. Valores de energía libre y constante de equilibrio para la reacción de precipitación de antimonio. TEMPERATURA, ºC Gº, Kcal/mol K 900 -47,545 7,21 x 108 1000 -48,022 1.76 x 108 1100 -48,499 5,24 x 107 1200 -48,455 1,55 x 107 La reacción de precipitación tiene lugar en la interfase hierro/sulfuro, por lo cual un incremento en el área de esta interfase acelerará el proceso de obtención de antimonio. Por otra parte, debido al elevado peso específico del sulfuro de hierro, resulta dificil la separación posterior de antimonio, por su parecido valor de peso específico. Por esta razón, es necesaria la adición de carbonato de sodio o sulfato de sodio, los cuales se combinan con el sulfuro de hierro para dar el sulfuro de sodio, y de esta manera disminuir Figura 6.1. Diagrama de fases del sistema Sb-Fe-S la densidad de la mata. En consecuencia, esto asegura una separación limpia del antimonio de la mata de hierro formada. La figura 6.2. muestra una representación del sistema cuaternario Fe-Sb-S-Na, en el cual se puede ver claramente que la adición de carbonato de sodio para formar Na2S, ensancha la región de inmisibilidad, y por lo tanto, mejora fuertemente la separación de fases en el sistema. Entre las reacciones secundarias del proceso podemos mencionar: FeS + Na2CO3 = FeO + Na2S + CO2 FeO + SiO2 = FeSiO3 4 Fe + Na2SO4 = 4 FeO + Na2S FFeS + 2 NaCl = FeCl2 + Na2S Figura 6.2. Relaciones de fase en el sistema Sb-Fe-Na-S a 1200 ºC. Se puede añadir también carbón, el cual puede servir para dos propósitos:. Tomar parte de la reacción de precipitación reaccionando con el carbonato de sodio, y también para prevenir la volatilización de antimonio. Sb2S3 + 3 Na2CO3 + 6 C = 2 Sb + 3 Na2S + 9 CO OBJETIVO Aplicar en laboratorio los principios teóricos de la precipitación de antimonio por hierro, y relacionar los resultados obtenidos con el diagrama de fases del sistema Sb-FeS. MATERIALES Horno de temperatura regulable Crisoles de arcilla Balanza de precisión 0,1 gr Concentrado de antimonio Clavillo de hierro CÁLCULO DE LA CARGA El Dr. C. Y. Wang, en base a la estequiometría de la reacción de precipitación, y tomando como pérdidas de antimonio el 20% de la cantidad alimentada como consecuencia de la volatilización y la formación de mata, recomienda el siguiente cálculo aproximado:. Si X es el peso de antimonio contenido en el concentrado sulfuroso que se quiere fundir, entonces la cantidad de aditivos a añadirse es: Peso de hierro 0,56 X Peso de Na2CO3 0,266 X Peso de carbón 0,06 X PROCEDIMIENTO EXPERIMENTAL En este laboratorio, se estudiará la influencia de los diferentes aditivos dosificados, en la recuperación de antimonio y la calidad de régulo obtenido. Para esto, en base a la receta dada líneas arriba, calcule la cantidad de cada uno de los aditivos necesarios para la precipitación de 150 gr del concentrado de antimonio, y prepare los siguientes crisoles:. 1. 150 gr de concentrado + hierro 2. 150 gr de concentrado + hierro + carbonato de sodio Pese los componentes de la carga y mezclelos íntimamente antes de colocarlos en el crisol. Caliente el horno a 1100 ºC y tenga los crisoles en él por un tiempo de una hora. Al final del ensayo, se deben romper los crisoles y determinar los pesos de metal, mata y escoria obtenidos. Se deben tomar muestras representativas de cada fase para el análisis químico. VALORACIÓN DE RESULTADOS Realice el balance de antimonio para cada una de las pruebas realizadas. FASE PESO % PESO % Sb FINOS de Sb % DISTRIBUCIÓN Metal Mata Escoria Gas Alimentación 100,0 100,0 La respuesta de mayor importancia en este experimento es la cantidad de antimonio recuperado. Compare las recuperaciones obtenidas en cada uno de los crisoles y relacione con las reacciones propuestas para cada caso y con el diagrama de equilibrio del sistema Sb-S-Fe. Explique el desplazamiento del punto de trabajo en relación al teórico elegido en el diagrama Sb-Fe-S para la dosificación. Si se añadiera un exceso de hierro, como variaría la calidad y recuperación del régulo con el incremento de la cantidad de hierro dosificado?. Demuestre mediante cálculos adecuados, la validez del cálculo de dosificación propuesto por el Dr. Wang. REFERENCIAS Rovira Pereira, A., “Metalurgia General”, Ed. Doassat S. A., Madrid, España, 1982. Zhao Tian-cong, “The Metallurgy of Antimony”, Central South University of Technology Press, Changsha, República Popular China, 1988. Akkarapattanagoon N., Itagaki K., Yazawa A., “Phase relations and distribution of minor elements in the Fe-Sb-S and Fe-Sb-S-Na2S systems a 1473 ºK, Metallurgycal Review of MMIJ, Vol 6, Nº 2, Japón, 1989.