Aneurismas de la bifurcación de la carótida intracraneal
Anuncio

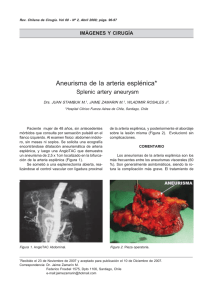
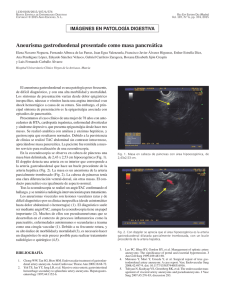
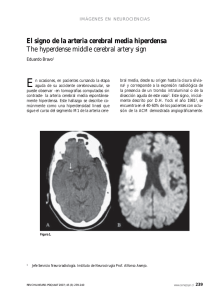
S.D. ORIGINAL VEGA-BASULTO, ET AL Aneurismas de la bifurcación de la carótida intracraneal S.D. Vega-Basulto, J. Montejo-Montejo INTRACRANIAL CAROTID ARTERY BIFURCATION ANEURYSMS Summary. Introduction. Intracranial carotid artery bifurcation aneurysms are infrequent but its clinical behavior, high risk of bleeding and complex anatomic relationships of the sac permit to consider these lesions as a challenge cases. Patients and methods. 497 patients harboring intracranial aneurysms were operated on at Manuel Ascunce Doménech Hospital, (Camagüey, Cuba) between January 1982 to August 2001. We utilized microsurgical procedures, optical magnification, specialized neuroanesthesia and Intensive Care Unit postoperatory following. All patients were evaluated clinically with World Federation Neurological Surgeon Scale and Glasgow Outcome Scale. Results. There were 16 patients with intracranial carotid artery bifurcation aneurysms (3.2%). 12 patients were under 40 years and 50% were between 16 and 30 years old. All patients present intracranial bleeding. There was 87.5% of total or partial recuperation. There was one death only. Postoperative deficit were observed at 44% but 31% disappeared thee month later. Conclusions. Intracranial carotid artery bifurcation aneurysms are complex anatomoclinical lesions. Clinically, we observed high tendency to bleed and multiplicity. Anatomically, these sacs have complex arterial relationship that difficult dissection and clipping. They have frequent postoperative morbility. Multiple or bilateral aneurysmal sacs will be clipped by one surgical procedure. [REV NEUROL 2002; 35: 1106-11] Key words. Carotid bifurcation. Contralateral approach. Intracranial aneurysms. Morbility. Subarachnoid hemorrhage. Vascular neurosurgery. INTRODUCCIÓN Walter Dandy, en 1944, comunicó por primera vez una serie de pacientes con aneurismas intracraneales (AIC) operados [1]. Desde esa publicación, un tercio de todos los AIC se han localizado en la carótida intracraneal interna. Las publicaciones posteriores han precisado con mayor claridad las particularidades clínicas y anatómicas de las distintas localizaciones de los sacos aneurismáticos a lo largo de la propia carótida interna, de tal manera que cada una tiene una forma distinta de presentación [2]. Los aneurismas de la bifurcación de la carótida interna (ABCI) son poco frecuentes; pero las complejas relaciones arteriales que tienen estas lesiones les confieren un particular riesgo. En esta localización, el neurocirujano vascular debe prestar atención a estructuras como: los vasos perforantes que se originan en la propia bifurcación, la arteria recurrente de Heubner, la arteria cerebral anterior, la arteria cerebral media y sus perforantes, la arteria coroidea anterior y la arteria hipofisaria superior. Los aneurismas de la bifurcación carotídea (ABC) se proyectan hacia arriba; pero también pueden dirigirse hacia delante o hacia atrás. Esos sacos que se dirigen hacia arriba y hacia delante, penetran en el espacio perforado anterior. La posición más medial o lateral del saco imprime otras complejidades a esta localización [1,3-9]. El interés neuroquirúrgico de los sacos de la bifurcación carotídea intracraneal no sólo está en su anatomía, sino en su comportamiento clínico, debido a su elevada tendencia a la hemorragia o a compresiones neurales. Su frecuencia elevada en la población infantil y la hemorragia subaracnoidea, muy grave antes de los 40 años, hace que su importancia sea notable [10-14]. Recibido: 06.03.02. Aceptado tras revisión externa sin modificaciones: 30.07.02. Servicio de Neurocirugía. Instituto Superior de Ciencias Médicas. Hospital Manuel Ascunce Doménech. Camagüey, Cuba. Correspondencia: Dr. Sergio Diego Vega Basulto. Domingo Puentes, 5. E/ San Joaquín y Carretera Central. La Caridad, Camagüey. 70300 Cuba. E-mail: nvega@reduc.cmw.edu.cu 2002, REVISTA DE NEUROLOGÍA 1106 Estos aneurismas pueden causar síntomas y signos de compresión neural, como hemiparesias, trastornos de la vía visual por afectación retroquiasmática o demencias. La tomografía computarizada simple permite observar la sangre en las cisternas subaracnoideas basales, más prominente en el área de rotura. El coágulo puede invadir el parénquima del lóbulo frontal, de manera que puede confundirse con las hemorragias intraparenquimatosas del hipertenso. La angiografía carotídea requiere de vistas oblicuas y de la base para confirmar la localización y, sobre todo, la proyección del saco. Este último aspecto es crítico para el planeamiento y práctica quirúrgica, ya que permite evitar roturas intraoperatorias o lesión de las importantes arterias que rodean al saco. Recientemente, los neurorradiólogos han resaltado la utilidad de la angiorresonancia y de la angiotomografía cerebral helicoidal, cuyas imágenes han permitido establecer el diagnóstico de estos aneurismas, precisar sus características anatómicas y han sido suficientes para guiar las técnicas quirúrgicas actuales, y sustituir o complementar la angiografía tradicional [15-17]. La práctica del neurocirujano durante las intervenciones sobre estos aneurismas requiere de una atención máxima y un conocimiento exacto de la microanatomía. Los ABC poseen en conjunto particularidades anatomoclínicas muy especiales, que los diferencian como un grupo muy especial dentro de todos los AIC, y hacia estos aspectos se dirige este trabajo. PACIENTES Y MÉTODOS Un total de 497 pacientes portadores de AIC fueron intervenidos en el Hospital Manuel Ascunce Doménech de Camagüey (Cuba), durante el período de enero de 1982 a agosto del 2001. Todos los pacientes se sometieron a cirugía con métodos microneuroquirúrgicos, magnificación óptica, neuroanestesia especializada, y el seguimiento postoperatorio se realizó en la sala de Terapia Intensiva. El autor principal participó directamente en la cirugía o en la supervisión de estas intervenciones. Los pacientes fueron evaluados a su llegada por personal médico entrenado en neurocirugía vascular, y estudiados con tomografía computarizada, angiografía cerebral de los cuatro vasos y angiotomografía cerebral helicoidal, en los últimos tres años. Los pacientes se evaluaron clínicamente con la escala REV NEUROL 2002; 35 (12): 1106-1111 ANEURISMAS DE LA BIFURCACIÓN CAROTÍDEA Tabla I. Frecuencia de los aneurismas de la bifurcación carotídea. Tabla IV. Resultados del tratamiento quirúrgico de los aneurismas de la bifurcación carotídea (según escala GOS). Total de pacientes Pacientes con ABACI % 497 16 3,2 Recuperación Recuperación completa parcial 10 ABACI: aneurismas de la bifurcación de la arteria carótida intracraneal. Tabla II. Edad (en años) de los pacientes con aneurismas de la bifurcación carotídea. <15 16-30 31-40 41-50 51-60 61-70 Total 1 8 3 2 1 1 16 Tabla III. Estado clínico de los pacientes con aneurisma de la bifurcación carotídea (según escala WFNS). Grado I Grado II Grado III Grado IV Grado V Total 5 5 6 – – 16 de la Federación Mundial de Neurocirujanos (WFNS) [14,18] y los resultados del tratamiento quirúrgico con la escala de pronósticos de Glasgow (GOS) [19] aplicada al alta y a los tres meses. Todos los pacientes entraron en el quirófano en las mejores condiciones clínicas posibles, es decir, con grado I-III de la WFNS. Hubo 16 pacientes con ABC: 15 unilaterales y uno bilateral. Los aneurismas se abordaron por craneotomía pterional, según la técnica de Yasargil modificada (Pevehouse) [20-23]. No utilizamos de forma sistemática drenaje continuo de LCR, hipotensión controlada ni ‘cócteles’ antisquémicos. Todos los pacientes fueron trasladados a la sala de Terapia Intensiva después de la intervención quirúrgica. El estado clínico, al alta y a los tres meses de la intervención, se evaluó con la GOC y se valoraron los déficit postoperatorios. RESULTADOS Durante los últimos 20 años se han intervenido quirúrgicamente en Camagüey 497 pacientes con AIC, de los que 16 tenían sacos en la bifurcación carotídea (Tabla I), lo que representa el 3,2% de todas las lesiones. En la tabla II agrupamos los pacientes de acuerdo a su edad. De los 16 pacientes comunicados en este trabajo, 12 eran menores de 40 años y cuatro se presentaron en la quinta, sexta y séptima década de la vida. Este dato revela una frecuencia elevada de estas lesiones en edades jóvenes. La paciente de menor edad tenía 13 años y la de mayor edad, 64. El 50% de los pacientes se encontraban entre los 16 y 30 años. Los AIC pueden provocar manifestaciones clínicas como hemorragias subaracnoideas, comprensiones neurales o, muy excepcionalmente, producir embolismos. En la tabla III se evidencia cómo todos los ABC se manifestaron por roturas y hemorragias, aunque cuatro de ellos presentaban, además, compresión neural asociada. En casos de hemorragias se aplicó la escala de la WFNS, y los pacientes se evaluaron en grados; todos se hallaban en grado I, II y III. No hubo pacientes en grado IV y V. Este elemento hizo más favorable su preparación para la cirugía intracraneal. Todos los pacientes fueron intervenidos quirúrgicamente en las mejores condiciones posibles. Resultaron muy favorables la edad de estos pacientes y la menor cantidad de enfermedades clínicas asociadas, ya que implicó un menor riesgo quirúrgico. La paciente de mayor edad tenía 63 años, fumaba más de 60 cigarrillos diarios y padecía enfermedad pulmonar obstructiva crónica, todo lo cual conllevaba un mayor riesgo quirúrgico. Los resultados del tratamiento quirúrgico se reflejan en la tabla IV. El 87,5% de los pacientes lograron una recuperación completa o parcial, con déficit menores y reincorporación total o parcial al trabajo y a su vida social. Un paciente, que sufrió dos sangrados antes de la intervención, quedó con una incapacidad grave. REV NEUROL 2002; 35 (12): 1106-1111 4 Incapacidad grave 1 Vegetativo Fallecido – 1 Tabla V. Déficit neurológicos postoperatorios en los aneurismas de la bifurcación carotídea. Al alta 3 meses Déficit motor transitorio 3 – Déficit motor definitivo 1 1 Trastornos campimétricos 1 1 Diabetes insípida 1 – Trastornos de la marcha 1 – Total 7 (44%) 2 (13%) Sólo tuvimos un fallecido en toda la serie, el caso de mayor edad; tenía una aneurisma sacular gigante de la bifurcación carotídea que ocupaba todo el espacio entre la cerebral anterior y cerebral media. Se sometió a cirugía con la técnica de descompresión-succión retrógrada [24-27]. Pudo graparse el saco, pero durante el procedimiento se ocluyó la arteria coroidea anterior, lo que ocasionó un infarto cerebral postoperatorio. La paciente estuvo 21 días en la sala de Terapia Intensiva y falleció a consecuencia de una neumonía nosocomial. La mortalidad de esta serie es baja, pero la morbilidad postoperatoria inmediata es elevada. En el 44% de los pacientes hubo algún tipo de déficit postoperatorio menor. Estos episodios (Tabla V) mostraron, tres meses después del alta, una notable mejoría. Los trastornos de la marcha, la diabetes insípida y tres defectos motores desaparecieron (31%). Hubo multiplicidad de lesiones aneurismáticas en tres pacientes (18,8%). Dos eran menores de 40 años y uno mayor de esta edad. En estos casos se pudo precisar por la clínica, la imaginología y la intervención quirúrgica que el saco aneurismático ubicado en la bifurcación de la arteria carótida intracraneal era la causa del sangrado. El primero de los pacientes tenía otro aneurisma ubicado en la arteria vertebral en la región de la cerebelosa posteroinferior y fue intervenido por dos abordajes distintos (pterional y suboccipital extralateral). El segundo tenía tres sacos más (comunicante anterior, comunicante posterior derecha e izquierda), que se resolvieron en un solo procedimiento con abordaje contralateral [28]. El tercer caso de multiplicidad era una mujer menor de 40 años, con un saco sintomático en la bifurcación carotídea derecha y otro en ‘espejo’ de igual ubicación, en la carótida interna contralateral. El saco derecho se grapó y en el mismo procedimiento tratamos de realizar un abordaje contralateral; pero esto fue imposible debido a dos factores: una bifurcación carotídea contralateral alta y numerosas perforantes anteriores y posteriores que dificultaban la disección y podían lesionarse. En esta paciente practicamos una segunda craneotomía tres semanas después y pudimos grapar el segundo saco sin dificultades. Se le dio el alta, con una recuperación clínica completa. DISCUSIÓN Los ABC constituyen el 3-7% de todas las estadísticas. El estudio Cooperativo Internacional de 1990 comunica un 7,3%, mientras que Ogilvy y Crowell encontraron un 15% de este tipo de aneurismas [29-31]. Lo poco frecuente de estas lesiones y las complejidades que entraña su tratamiento quirúrgico los hace más interesantes. Estas lesiones saculares producen síntomas a edades más tempranas que otras. Ogilvy y Crowell [31] y Ohno et al [32] encontraron que estos aneurismas producen manifestaciones clínicas antes de los 40 años, mientras que los aneurismas esporádicos 1107 S.D. VEGA-BASULTO, ET AL sangran o producen compresiones en la sexta década de la vida. Heiskanen [11] señala que los ABC representan más del 40% de los aneurismas en pacientes menores de 30 años. En nuestra serie de 497 pacientes, esta localización ocupó el segundo lugar en frecuencia, en los menores de 30 años, precedido por los aneurismas de la región de la cerebral anterior-comunicante anterior. Los ABC son una continuación directa del tronco de la arteria madre. En su extensión superior, anterior o posteroinferior hacen contacto con el lóbulo frontal, el espacio perforado anterior y con numerosos vasos arteriales principales o perforantes, que dificultan su disección o los hacen de acceso complicado. Los sacos aneurismáticos de esta localización, según Kasell et al [30], pueden ser pequeños, grandes o gigantes. Estos dos últimos tipos de lesiones pueden penetrar en el parénquima y el ventrículo e invadir el tálamo y los núcleos basales hasta en el 70% de los casos [1,2]. Los sacos gigantes se asocian a defectos del campo visual, hemianopsia homónima, hemiparesia, crisis convulsivas, demencia y raramente hipopituitarismo por afectación hipofisaria directa o de sus complejos sistemas de irrigación. Los AIC producen hemorragias en el 72% de los casos [1,29,30], pero en esta localización existe una elevada tendencia al sangrado. En nuestra serie, el 100% de los pacientes, independientemente del tamaño de la lesión, se presentaron como una hemorragia, como señalan Heiskanen [11], Ogilvy y Crowell [31], Ohno et al [32], y Heros y Morcos [33]. Esto ha hecho que algunos autores recomienden la intervención quirúrgica de estas lesiones, aun cuando sean asintomáticas o pequeñas, debido a esta elevada tendencia al sangrado [31,32]. El tratamiento quirúrgico de los ABC conlleva riesgos, debido a las estructuras vitales que rodean al saco y que lógicamente el cirujano debe preservar, antes de graparlo [3,6,34]. Estos sacos se proyectan superiormente hacia el espacio perforado anterior, pueden angularse lateral o medialmente, lo que los acerca a las arterias cerebral anterior y media, aunque la tendencia más habitual es acercarse a la unión carótida interna-A1. Durante la operación colocamos la cabeza del paciente en posición estándar para aneurismas, auxiliados con el soporte craneal de Sugita, lo que permite desplazar la cabeza, si fuera necesario. Usamos el abordaje pterional, un adecuado manejo neuroanestésico especializado para cirugía vascular y drenaje del LCR de las cisternas basales, lo que permite lograr una retracción cerebral de 3 cm entre la base craneal y la base del encéfalo y facilita colocar retractores cerebrales a ‘muy baja presión’. Algunos detalles técnicos comunes a los aneurismas de esta localización los hemos resumido en la tabla VI. Comenzamos con la abertura de la cisterna silviana con mucho cuidado; esto permite drenar LCR, lograr mayor relajación cerebral y llegar hasta la carótida supraclinoidea sin utilizar retractores. La abertura de la porción más medial de la cisura silviana, por lo general, requiere de una pequeña resección subpial, debido a la indentación normal entre el frontal y el temporal. La cisterna pericarotídea la abrimos, por lo general, transversal al eje del vaso madre y completamos la disección aracnoidea hacia arriba y hacia abajo. La disección gentil en dirección ascendente permite alcanzar la bifurcación carotídea con mayor o menor dificultad, según el volumen del saco y del tejido cerebral que lo envuelve. En casos de bifurcación carotídea baja, el proceder de disección es más fácil; pero en las bifurcaciones altas, resulta más laborioso o se requiere del auxilio de los retractores cerebrales. En este paso de la intervención, el estudio arteriográfico evaluado con exactitud resulta una fuente muy valiosa de información para los cirujanos. 1108 Tabla VI. Detalles técnicos esenciales en la cirugía de los aneurismas de la bifurcación de la arteria carótida interna. Abertura cuidadosa de la cisterna silviana Disección subpial de la porción medial de la fisura silviana Identificación y control de la carótida (arteria madre) Identificar los segmentos iniciales de la arteria cerebral anterior y media Disección del cuello y separarlo de las arterias cerebrales anterior y media Preservar los cinco grupos de perforantes Pared dorsal de la carótida Arteria coroidea anterior Arteria comunicante posterior Arteria cerebral anterior Arteria cerebral media Preservar la arteria de Heubner Evitar grapas innecesariamente largas Una vez alcanzada la bifurcación carotídea, es necesario identificar con claridad la arteria cerebral anterior (segmento Al), que se ‘aleja’ del cirujano, y la arteria cerebral media que ‘asciende’ hacia él. Debe identificarse la arteria recurrente de Heubner [35], que por lo general emerge desde la unión A1-A2 y ‘retrocede’ en busca del espacio perforado anterior, medial al saco que disecamos. Esta pequeña e importante arteria queda ocultada por la porción posteromedial de los aneurismas gigantes. La disección del cuello tiene el objetivo de separarlo de los vasos que lo rodean y del ‘penacho’ de vasos perforantes que emergen ascendentemente de esta bifurcación, y cuya anatomía normal se distorsiona lógicamente por el saco. En este paso de la operación debe evitarse el uso de coagulación bipolar o de maniobras que traumaticen o lesionen estas arterias perforantes. Durante la disección del cuello, debe prestarse particular importancia al estado anatómico de esta estructura, ya que pueden observarse placas de debilitamiento de la pared (afinamientos), que hacen el cuello muy frágil. Deben preservarse cinco grupos de perforantes que no se ven completamente sin magnificación óptica: las que se originan en la pared dorsal de la carótida, en la coroidea anterior, en la comunicante posterior, en la porción inicial de la arteria cerebral anterior o en la inicial de la arteria cerebral media. Antes de colocar el clip que ocluye el cuello aneurismático deben identificarse los cuatro vasos fundamentales de la región: cerebral anterior, cerebral media, arteria de Heubner y coroidea anterior [5,26,31,36,37]. El grapado transitorio del vaso madre puede ayudar en la disección del cuello, porque evita roturas intraoperatorias. Nosotros no utilizamos este proceder habitualmente, lo aplicamos en casos de pequeñas roturas o cuando observamos en el cuello pequeñas áreas de debilitamiento. Deben evitarse las grapas definitivas muy largas que involucren involuntariamente otros vasos, o que actúen en forma de palanca móvil, sobre el cuello del aneurisma, una vez grapado. Después de grapar el cuello, es fácil la disección del resto del saco y comprobar finalmente su oclusión eficaz con una peque- REV NEUROL 2002; 35 (12): 1106-1111 ANEURISMAS DE LA BIFURCACIÓN CAROTÍDEA a Tabla VII. Resultados del tratamiento microquirúrgico de varias series (1979-2001). 5 2 2 6 10 3 Autor Año N.º casos Mortalidad Morbilidad DePail et al [3] 1979 21 1 0 Yasargil [23] 1984 55 2 4 Laranjeira et al [7] 1990 18 0 1 Mass Gen Hospital [31] 1992 40 1 2 Vega (presente serie) 2001 16 1 2 – 150 5 (3%) 9 (6%) Total 1 4 9 7 8 b 5 6 2 2 3 10 7 1 9 4 8 c 5 2 2 6 10 3 7 1 4 9 8 Figura. a) Ohno tipo I hacia arriba; b) Ohno tipo II hacia delante; c) Ohno tipo III hacia atrás. 1: aneurisma; 2: arteria carótida interna; 3: arteria cerebral media; 4 y 9: arteria cerebral anterior y sus perforantes; 5: arteria comunicante posterior y sus perforantes; 6: arteria coroidea anterior y sus ramas; 7: perforantes de la arteria cerebral media; 8: arteria recurrente de Heubner; 10: quiasma óptico. ña punción con aguja n.º 26. En ninguno de estos casos resecamos el saco, para evitar dañar estructuras adyacentes y añadir mayor morbilidad al proceso. Los aneurismas dirigidos hacia arriba (Figura, a), los más frecuentes, pueden excluirse de la circulación con el procedimiento descrito anteriormente; pero un grupo reducido de pacientes presentan sacos dirigidos hacia delante, a cuyo fondo se puede llegar antes que al cuello, si no se aplican variantes de disección al proceder antes descrito o sacos dirigidos posteroinferiormente, más raros y de más difícil disección [32]. REV NEUROL 2002; 35 (12): 1106-1111 Un elemento auxiliar, en estas dos últimas variantes anatómicas de los sacos aneurismáticos, es el desplazamiento intraoperatorio de la cabeza con el soporte de Sugita y el cambio del ángulo de visión de la magnificación óptica. En este último caso, el cirujano debe renunciar a mantener una posición fija dentro del área operatoria. Su posición variará con la demanda que establezca la anatomía y el proceder. En los sacos dirigidos hacia delante (Figura, b), la disección la comenzamos por el área del lóbulo temporal adyacente a la carótida, con dos objetivos: controlar el vaso madre y evitar el fondo siempre más frágil. Luego, el sentido de la disección girará contrario a las manecillas del reloj, para terminar en el cuello. En los sacos dirigidos hacia atrás (Figura, c), puede verse el cuello y parte del saco a través del espacio triangular de la bifurcación, en el cual un ‘enrejado’ de perforantes obstruye la visión completa de la anatomía. Ohno et al [32] nos muestran un esquema muy exacto, que hemos observado en nuestros casos. Se requiere identificar muy bien la arteria coroidea anterior (única o múltiple) antes de colocar la grapa en el cuello aneurismático. En esta variante, la grapa se fenestrará-angulará, y avanzará en la bifurcación de proximal a distal, con las ramas paralelas al eje del vaso madre, que se encarcela en el anillo de la fenestración. Esta forma de grapado y este tipo de grapas evita lesionar perforantes y vasos principales. La morbilidad postoperatoria de estos sacos se relaciona de forma directa con la anatomía microvascular y el manejo quirúrgico. El contacto con los pequeños vasos, su manipulación, desplazamiento mínimo o su daño, aun cuando no se ocluyan, es capaz de producir morbilidad postoperatoria. Esto explica muchos de los déficit transitorios que desaparecen tres meses después de la intervención, como ocurrió en nuestra serie. La afectación de la irrigación hipofisaria o la cercanía de algunas de estas lesiones aneurismáticas al tallo hipofisario pueden determinar diabetes insípida postoperatoria transitoria. En la tabla VII se comparan los resultados quirúrgicos de cinco series de ABC, intervenidos quirúrgicamente entre 1979 y 2001, en la era de la magnificación óptica, soportes craneales eficientes, neuroanestesia especializada y grapas de formas variadas para aneurismas. En todos, la mortalidad es baja. Nuestra morbilidad es algo elevada, pero coincide con la comunicada por Heinkanen [11] y por Heros y Morcos [33]. Lynch y Andrade [28], Rinne [38] y Oshiro et al [39] señalan la existencia de multiplicidad en los sacos de la bifurcación carotídea intracraneal, lo que ocurre entre el 20 y el 40% de los casos. Nuestro porcentaje de multiplicidad es próximo a estas cifras. El elevado riesgo de sangrado de estos aneurismas puede justificar su grapado en condiciones difíciles. El tratamiento de 1109 S.D. VEGA-BASULTO, ET AL estos aneurismas múltiples se lograba tradicionalmente con craneotomías secuenciales; se comenzaba por el lado de la rotura y se realizaba la siguiente unas semanas después. Idealmente, si uno logra exponer adecuadamente la vasculatura de ambos lados del cerebro en un solo procedimiento quirúrgico, puede realizarse el grapado de todos los aneurismas homo y contralaterales con una sola craneotomía, hecho que simplifica notablemente el tratamiento y evita la necesidad de un segundo procedimiento. Se han comunicado distintas series de tratamiento quirúrgico de aneurismas con abordaje contralateral, tanto para lesiones supratentoriales como suprainfratentoriales [12,28,39]. El abordaje contralateral a las lesiones de la comunicante anterior, que se encuentra en la línea media, entraña pocas dificultades; pero el abordaje bilateral a los aneurismas de la carótida, desde su emergencia del seno cavernoso hasta la bifurcación carotídea, requiere de muy buenas condiciones de relajación cerebral, tejido aracnoideo fácilmente disecable y disposición ventajosa de las arterias perforantes y de las ramas que rodean los sacos aneurismáticos. Teóricamente al menos, casi todas las lesiones contralaterales, con inclusión de los aneurismas del primer segmento de la arteria cerebral media, pueden graparse en un solo proceder. Oshiro et al [39] comunican una serie de 23 casos de aneurismas múltiples bilaterales, y en 13 no pudo realizar el grapado de todas las lesiones, por dos causas fundamentales: edema cerebral y anatomía vascular compleja. De esta serie [39], cuatro pacientes tenían sacos contralaterales en la bifurcación de la arteria carótida, dos de los cuales pudieron graparse en una sola craneotomía; pero los dos restantes necesitaron de dos procedimientos. Otras condiciones particularmente importantes, para lograr el grapado contralateral, son el grado de relajación del cerebro, la cantidad de sangre subaracnoidea en casos agudos, el sellado regional de algunas de las cisternas basales y la anatomía microvascular con sus correspondientes variantes anatómicas. En nuestra serie pudo realizarse el grapado de los aneurismas contralaterales en uno de los casos; pero en el otro no, debido a condiciones anatómicas desfavorables. El caso restante requirió dos abordajes, uno supratentorial y otro infratentorial. El abordaje contralateral de los aneurismas múltiples lo realizamos desde hace 10 años en nuestra institución; pero la selección de los casos debe hacerse de acuerdo con las condiciones individuales de cada paciente y de cada saco en particular, de forma que este procedimiento no añada mayor morbilidad al proceso. Los métodos endovasculares han ganado terreno dentro de la cirugía de los AIC. No puede decirse que este método haya sustituido totalmente a los métodos tradicionales, pero se vislumbra ya un futuro donde se combinen convenientemente ambos métodos. La combinación inteligente de los métodos endovasculares y la cirugía tradicional puede ser una opción importante y valiosa en aquellos casos que requieran varios abordajes [40-42]. Los ABC intracraneales son lesiones poco frecuentes, pero con complejas características clinicoquirúrgicas. Las complejidades clínicas particulares son la temprana edad de rotura, la alta tendencia al sangrado y la multiplicidad. Las dificultades quirúrgicas se dan por la profunda localización del saco y las numerosas relaciones vasculares arteriales del aneurisma, que determinan una elevada tendencia a la morbimortalidad postoperatoria. El proceder quirúrgico debe dirigirse a grapar la lesión, sin afectar la vasculatura adyacente, y excluir de la circulación a otros sacos uni o bilaterales, en un solo proceder, siempre que sea posible y que no añada una mayor morbimortalidad postoperatoria. BIBLIOGRAFÍA 1. Carter LP, Spetzler RF. Vascular neurosurgery. Saccular aneurysms of the internal carotid artery. New York: McGraw-Hill Inc; 1995. p. 649-58. 2. Weir B. Aneurysms affecting the nervous system. Baltimore: William Wilkins; 1987. p. 456-61. 3. De Pail R, Pasqualini A, Scienza R. Direct microsurgical approach to aneurysms of the internal carotid bifurcation. Surg Neurol 1980; 13: 27-37. 4. Fox JL. Intracranial aneurysms. Vol. II. New York; Springer-Verlag; 1983. p. 569. 5. Gibo H, Lenkey C, Rhoton AL Jr. Microsurgical anatomy of the internal carotid artery. J Neurosurg 1981; 55: 560-74. 6. Kodoma N, Koshu K, Mineura K. Surgical treatment of internal carotid bifurcation aneurysms. Cerebral aneurysms. Suzuki: J Neuron Tokyo; 1999. p. 261-7. 7. Laranjeira M, Sadasivan B, Ausman JL. Direct surgery for carotid bifurcation artery aneurysms. Surg Neurol 1990; 34: 250-4. 8. Abe M, Tabuchi K, Yokohama H, Uchino A. Blister-like aneurysms of the internal carotid artery. J Neurosurg 1998; 89: 419-24. 9. Mc Neely DB, Clarke B, Baxter RA, Vanddorpe A, Mendez I. Blister-like aneurysms of the internal carotid artery. Can J Neurol Sci 2000; 27: 247-50. 10. Fuentes B, Díez-Tejedor E. Beneficio de la Unidad de Ictus en el tratamiento de la hemorragia cerebral. Rev Neurol 2000; 31: 171-4. 11. Heiskanen O. Ruptured intracranial artery aneurysms of childrens and adolescents. Surgical and total results. Childs Nerv Syst 1989; 4: 66-8. 12. Naso WB, Rhea AH, Poole A. Management and outcome in a low-grade cerebral aneurysms practice. Neurosurgery 2001; 48: 91-100. 13. Segupta RP, Lassam LP, De Moraes AA. Treatment of internal carotid bifurcation aneurysms by direct surgery. J Neurosurg 1975; 43: 343-5. 14. Teadsdale G, Knill-Jones RP, Lindsay KW. Clinical assessment of SAH. J Neurosurg 1983; 59: 550-5. 15. Forbes K, Pitt A, Mathew T, Blockburn M, Cameron N. CT angiography: a tool for managing cerebral aneurysms. BNI Quarterly 2001; 17: 28-36. 16. Prenger EC, Zambranski JM. CT perfusion imaging detects cerebral hipoperfusion caused by aneurysms clip. BNI Quarterly 2001; 17: 53-5. 1110 17. Yeo TA, Wallace R, Partovi S. CT angiography and stroke. BNI Quarterly 2001; 17: 4-14. 18. Hamilton MG, Williams FC. Perioperative management of subarachnoid hemorrhage. Vascular neurosurgery. New York: McGraw-Hill; 1995. p. 603-25. 19. Jennet B, Bond M. Assessment of outcome after severe brain damage. A practical scale. Lancet 1975; 1: 480-3. 20. Fox JL. Atlas of neurosurgical anatomy: the pterional perspective. New York: Springer Verlag; 1989. p. 39-41. 21. Koos WT, Spetzler RF. Cranial approaches. Color atlas of microneurosurgery. 2 ed. Stuttgart, New York: Thieme; 2000. p. 57-82. 22. Yasargil GM. Microneurosurgery. Vol. 1. Stuttgart: Thieme; 1984. p. 299-310. 23. Yasargil GM. Microneurosurgery. Management and surgical results for intracranial aneurysms. New York: Springer Verlag; 1987. p. 2-20. 24. Peerless SJ, Drake CG. Treatment of giant cerebral aneurysms of the anterior circulation. Neurosurg Rev 1982; 5: 149-56. 25. Sundt TM Jr. Aneurysms of the anterior circulation. Middle cerebral artery. In Sundt TM, ed. Surgical techniques for vascular and giant aneurysms. Baltimore: William and Wilkins; 1990. p. 179-212. 26. Taylor CL, Sellman WR, Kiefer SP, Ratcleson RA. Temporal vessels occlusion during aneurysms repair. Neurosurgery 1996; 39: 893-905. 27. Batjer HH, Samson DS. Retrograde-suction decompression of giant paraclinoid aneurysms. J Neurosurg 1990; 73: 305-8. 28. Lynch JC, Andrade R. Unilateral pterional approach to bilateral cerebral aneurysms. Surg Neurol 1993; 39: 120-7. 29. Kasell NF, Torner JC, Haley ED. The cooperative international study in the timing and aneurysms surgery. Part 1: Overall management results. J Neurosurg 1990; 73: 18-28. 30. Kasell NF, Torner JC, Jane JA. The international cooperative study on the timing of aneurysms surgery. Part 2: surgical results. J Neurosurg 1990; 73: 37-47. 31. Ogilvy CS, Crowell RM. Carotid bifurcation aneurysms. In Apuzzo MJ, ed. Brain surgery complication avoidance and management. New York: Churchill Livingston; 1993. p. 970-83. 32. Ohno K, Komatsu K, Aoyagi M, Takada Y, Aoyagi M, Wakabayashi S, et al. Aneurysms of the internal carotid bifurcation. Surg Stroke 1996; 24: 5-10. REV NEUROL 2002; 35 (12): 1106-1111 ANEURISMAS DE LA BIFURCACIÓN CAROTÍDEA 33. Heros RC, Morcos JJ. Cerebrovascular surgery: past, present and future. Neurosurgery 2000; 47: 1007-33. 34. Sundt TM, Kobayashi S, Fode NC. Results and complications of surgical management of 809 intracranial aneurysms in 722 cases. J Neurosurg 1982; 56: 753-58. 35. Haroun RI, Rigamondi D, Tamargo RJ. Recurrent artery of Heubner. J Neurosurg 2000; 93: 1084-8. 36. Redekop GP, Woodhurst B. Unusual aneurysms of the distal internal carotid artery. Can J Neurol Sci 1998; 25: 202-8. 37. Rhoton Al, Fujii K, Fradd B. Microsurgical anatomy of the anterior choroidal artery. Surg Neurol 1979; 12: 171-87. 38. Rinne J. Microanatomy of carotid bifurcation aneurysms. J Neurosurg 2000; 93: 1031-40. 39. Oshiro E, Rine DA, Tamargo RJ. Contralateral approaches to bilateral cerebral aneurysms: a microsurgical anatomy study. J Neurosurg 1997; 87: 163-9. 40. Mayer FB, Jonathan JA, Friedman A, Nichols DA, Windschitl L. Surgical repair of clinoidal segment carotid artery aneurysms for endovascular treatment. Neurosurgery 2001; 48: 476-86. 41. Carter BS, Budzik RF, Putman CM, Ogilvy CS. Results after surgical an endovascular treatment of paraclinoid aneurysms by a combined neurovascular team. Neurosurgery 2001; 48: 78-90. 42. Hopkins N, Lanzino G, Guterman LR. Treating complex nervous vascular disorders a needle steak: origins, evolution and future of neuroendovascular therapy. Neurosurgery 2001; 48: 463-75. ANEURISMAS DE LA BIFURCACIÓN DE LA CARÓTIDA INTRACRANEAL Resumen. Introducción. Los aneurismas de la bifurcación carótida (ABC) son poco frecuentes, pero su comportamiento clínico, con elevada tendencia al sangrado y las complejas relaciones arteriales de estos sacos, los hacen particularmente interesantes. Pacientes y métodos. Un total de 497 pacientes con aneurismas intracraneales fueron operados en el Hospital Manuel Ascunce Doménech, en Camagüey (Cuba), en el período de enero de 1982 a agosto del 2001. Se usaron métodos microneuroquirúrgicos, magnificación óptica, neuroanestesia especializada y seguimiento postoperatorio en terapia intensiva. Los pacientes se evaluaron clínicamente con la escala de la Federación Mundial de Neurocirujanos, y los resultados, con la escala de pronósticos de Glasgow. Resultados. Hubo 16 pacientes con ABC (3,2%), 12 tenían menos de 40 años y el 50% se encontraban entre 16 y 30 años. Todos los pacientes presentaron manifestaciones de sangrado. En el 87,5% hubo recuperación total o parcial. Sólo falleció un paciente. Los déficit postoperatorios aparecieron en el 44%, pero el 31% mejoraron tres meses después. Conclusiones. Los ABC intracraneal presentan complejidades anatomoclínicas elevadas. Clínicamente son aneurismas que sangran a edades muy tempranas y pueden ser múltiples. Las complejidades quirúrgicas se deben a sus numerosas relaciones arteriales, que dificultan la disección. Esto eleva la morbilidad postoperatoria. En casos de aneurismas múltiples uni o bilaterales deben graparse todas las lesiones en un sólo proceder quirúrgico. [REV NEUROL 2002; 35: 1106-11] Palabras clave. Abordajes contralaterales. Aneurismas intracraneales. Bifurcación carotídea. Hemorragia subaracnoidea. Morbilidad. Neurocirugía vascular. ANEURISMAS DA BIFURCAÇÃO DA CARÓTIDA INTRA-CRANIANA Resumo. Introdução. Os aneurismas da bifurcação carótida (ABC) são pouco frequentes, no entanto o seu comportamento clínico, com elevada tendência para a hemorragia e as complexas relações arteriais destes sacos, conferem-lhe um interesse particular. Doentes e métodos. Um total de 497 doentes com aneurismas intra-cranianos foram operados no hospital Manuel Ascunce Doménech, em Camagüey, Cuba, no período de Janeiro de 1982 a Agosto de 2001. Foram utilizados métodos microneurocirúrgicos, magnificação óptica, neuroanestesia especializada, e seguimento pós-operatório da terapia intensiva. Os doentes foram avaliados clinicamente com a escala da Federação Mundial de Neurocirurgiões, e os resultados com a escala de prognósticos de Glasgow. Resultados. Houveram 16 doentes com ABC (3,2%), 12 tinham menos de 40 anos e 50% tinha entre 16 e 30 anos. Todos os doentes apresentaram manifestações de hemorragia. Em 87,5% houve recuperação total ou parcial. Apenas um doente faleceu. Os défices pós-operatórios apareceram em 44%, mas 31% melhoraram após três meses. Conclusões. Os ABC intra-cranianos apresentam complexidades anatómo-clínicas elevadas. Clinicamente são aneurismas que sangram em idades muito precoces, e podem ser múltiplos. As complexidades cirúrgicas devem-se às suas numerosas relações arteriais, que dificultam a dissecção. Isto aumenta a morbilidade pós-operatória. Em casos de aneurismas múltiplos uni ou bilaterais, devem clipar-se todas as lesões numa só intervenção cirúrgica. [REV NEUROL 2002; 35: 1106-11] Palavras chave. Abordagens contralaterais, Aneurismas intra-cranianos. Bifurcação carotídea. Hemorragia subaracnoideia. Morbilidade. Neurocirurgia vascular. REV NEUROL 2002; 35 (12): 1106-1111 1111