Solución
Anuncio

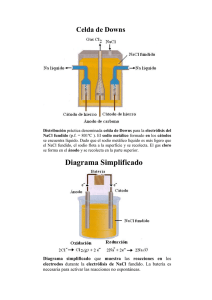
CASTILLA-LA MANCHA/ JUNIO 00. LOGSE / QUÍMICA / ELECTROQUIMICA / OPCION A / CUESTIÓN 4 4.- Razona los gramos de sodio que pueden obtenerse haciendo pasar una corriente de 6,5 amperios durante 45 minutos , a través de cloruro sódico fundido . ¿En qué electrodo se produce la reacción?. (Dato mas atómica de Na = 23) Solución: En el NaCl fundido los iones se encuentran dispersos (sal disociada) y al someterlos a corriente eléctrica se produce un fenómeno electrolítico, que de por sí no es espontáneo. 800 ºC Na+ + Cl- NaCl Las semirreacciones que tienen lugar son: Cátodo (-) Reducción: Na+ + e- " Na Ánodo (+) Oxidación: Cl- " ½ Cl2 + e- Reacción global: Na+ + Cl- " Na (s) + ½ Cl2 (g) Luego en la celda electrolítica se obtiene sodio metálico y se desprende cloro gaseoso. Como podemos observar la reacción de reducción de los iones sodio se produce en el cátodo, que es el polo negativo. La electrólisis se cuantifica con las Leyes de Faraday que se resumen en la siguiente fórmula: m = (Eq-g · I · t) / 96.500 Eq-g Na = M atómica / valencia redox = 23 / 1 = 23 m = (23 · 6,5 · (45·60)) / 96500 m = 4,18 g Na www.profes.net es un servicio gratuito de Ediciones SM