20 Noviembre 2008 - IES Francisco Grande Covián
Anuncio
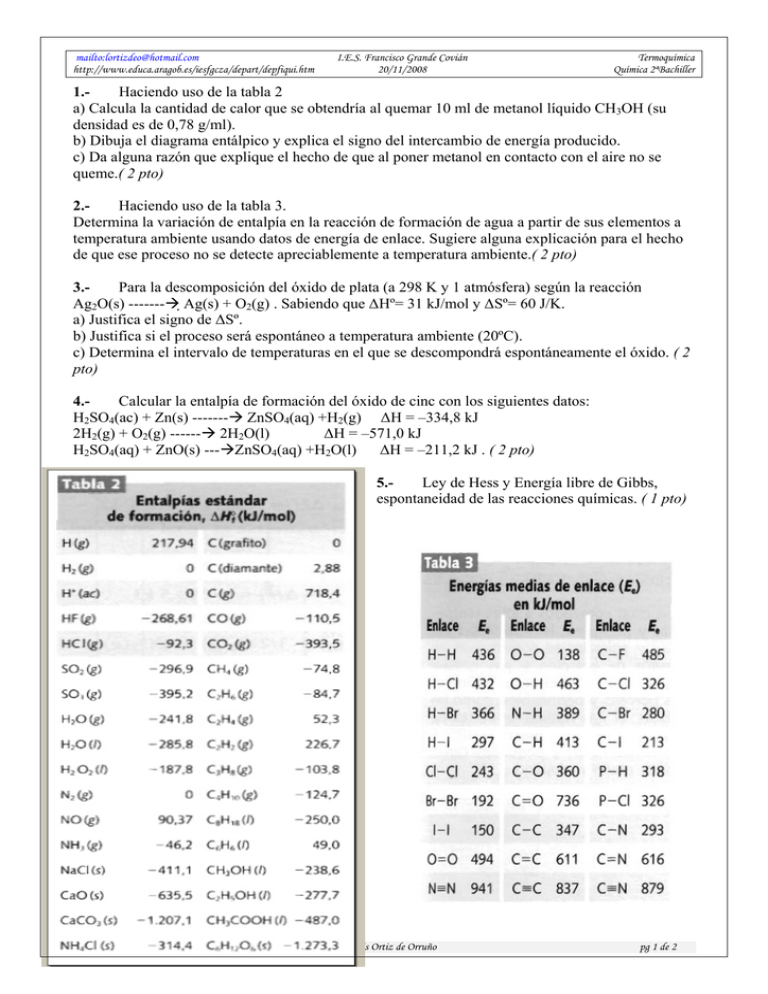
mailto:lortizdeo@hotmail.com http://www.educa.aragob.es/iesfgcza/depart/depfiqui.htm I.E.S. Francisco Grande Covián 20/11/2008 Termoquímica Química 2ªBachiller 1.Haciendo uso de la tabla 2 a) Calcula la cantidad de calor que se obtendría al quemar 10 ml de metanol líquido CH3OH (su densidad es de 0,78 g/ml). b) Dibuja el diagrama entálpico y explica el signo del intercambio de energía producido. c) Da alguna razón que explique el hecho de que al poner metanol en contacto con el aire no se queme.( 2 pto) 2.Haciendo uso de la tabla 3. Determina la variación de entalpía en la reacción de formación de agua a partir de sus elementos a temperatura ambiente usando datos de energía de enlace. Sugiere alguna explicación para el hecho de que ese proceso no se detecte apreciablemente a temperatura ambiente.( 2 pto) 3.Para la descomposición del óxido de plata (a 298 K y 1 atmósfera) según la reacción Ag2O(s) -------Æ Ag(s) + O2(g) . Sabiendo que ΔHº= 31 kJ/mol y ΔSº= 60 J/K. a) Justifica el signo de ΔSº. b) Justifica si el proceso será espontáneo a temperatura ambiente (20ºC). c) Determina el intervalo de temperaturas en el que se descompondrá espontáneamente el óxido. ( 2 pto) 4.Calcular la entalpía de formación del óxido de cinc con los siguientes datos: H2SO4(ac) + Zn(s) -------Æ ZnSO4(aq) +H2(g) ΔH = –334,8 kJ ΔH = –571,0 kJ 2H2(g) + O2(g) ------Æ 2H2O(l) H2SO4(aq) + ZnO(s) ---ÆZnSO4(aq) +H2O(l) ΔH = –211,2 kJ . ( 2 pto) 5.Ley de Hess y Energía libre de Gibbs, espontaneidad de las reacciones químicas. ( 1 pto) ExTermoquimica08.doc Luis Ortiz de Orruño pg 1 de 2 mailto:lortizdeo@hotmail.com http://www.educa.aragob.es/iesfgcza/depart/depfiqui.htm I.E.S. Francisco Grande Covián 20/11/2008 Termoquímica Química 2ªBachiller 6.El butano se suele vender licuado a presión en bombonas de 12 kg. Haciendo uso de la tabla 2 . a) Calcula el calor desprendido al quemar todo el butano contenido en una bombona. b) Dibuja el diagrama entálpico y explica el signo del intercambio de energía producido. 7.Cuando el etano reacciona con cloro (Cl2) se produce una reacción de sustitución, y se obtiene cloroetano y ácido clorhídrico, haciendo uso de la tabla 3 Determina el valor de ΔH de la reacción, y dibuja el diagrama entálpico. ( 2 pto) 8.En la reacción de formación del etanol a partir de sus elementos C(s) + H2(g) + O2(g) → C2H5OH(l) Sabiendo que ΔHº= -278 kJ/mol y ΔSº= -242 J/K. a) Justifica el signo de ΔSº. b) Justifica si el proceso será espontáneo a temperatura ambiente (20ºC). c) Determina el intervalo de temperaturas en el que se formará espontáneamente este alcohol ( 2 pto) 9.Determina la entalpía de reacción para el proceso: C3H4 (g) + 2 H2 (g) ----------Æ C3H8 (g) a partir de los siguientes datos: Entalpía estándar de combustión del C3H4 (g) = -1937 kJ/mol Entalpía estándar de combustión del C3H8 (g) = -2219 kJ/mol Entalpía estándar de formación del H2O (l) = -286 kJ/mol ( 2 pto) 10.- Entalpía estándar de formación. Energía libre de Gibbs, espontaneidad de las reacciones químicas ( 1 pto) ExTermoquimica08.doc Luis Ortiz de Orruño pg 2 de 2