Procesamiento de los frotis de Papanicolaou en el Laboratorio de
Anuncio

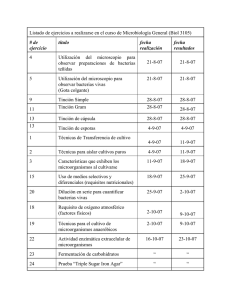
Procesamiento de los frotis de Papanicolaou en el Laboratorio de Citopatología Carlos Zamorano1 & Julieta Sepúlveda1 1 Licenciado en Tecnología Médica, U. de Concepción, Concepción, Chile Introducción La detección del cáncer cervicouterino en etapas tempranas es fundamental para evitar complicaciones posteriores o incluso la muerte por esa patología. Por esto es que se ha implementado en Chile el programa de pesquisa de cáncer de cuello uterino, el cual, mediante la técnica de Papanicolaou (PAP) realiza un screening citológico en la población femenina en busca de la detección de lesiones precursoras al cáncer. En el Laboratorio de Citopatología es donde se realiza todo el procesamiento del frotis de Papanicolaou (PAP), desde su recepción hasta el diagnóstico pasando por una serie de etapas de identificación de la muestra, ingreso al sistema computacional, tinción y observación al microscopio de la citología para detectar estructuras y cambios celulares que orienten al diagnóstico. En este artículo se abordara, de forma general, como se realiza el procesamiento de los frotis de PAP en el Laboratorio de Citopatología para obtener el diagnóstico citológico. Descripción del laboratorio y su funcionamiento El Laboratorio de Citopatología puede estar ubicado dentro de un complejo Hospitalario, dentro del Servicio de Anatomía Patológica de un Hospital o en alguna consulta privada. Por lo general, se encuentra dividido en 2 secciones o etapas: (1) “recepción, identificación y tinción de muestras” y (2) “microscopía”. El proceso comienza en la etapa de “recepción, identificación y tinción de muestras” donde la secretaría recibe las muestras, realiza el ingreso de las fichas de las pacientes a un sistema computacional (ej. Cito-Expert, AniTa), le asigna un número o folio y se indica la existencia de antecedentes previos cuando estos existan. Luego, las láminas son debidamente rotuladas por el Técnico Paramédico, o por alumnos en práctica. Los frotis de las pacientes provienen del mismo Hospital, de Consultorios y/o de otros centros de Salud y se obtienen extrayendo células del cuello uterino mediante la técnica de Papanicolaou, por Médicos especializados en Ginecología u Obstetras. Es fundamental llevar un registro diario de la cantidad de exámenes recibidos y organizar las solicitudes agrupándolas por lugar de proveniencia, código y fecha de ingreso. Esto será de utilidad para identificar los casos que presenten algún problema, ya sea, de rotulación, pérdida de muestras, láminas en mal estado (quebradas), etc. Una vez identificadas las láminas o portaobjetos el Tecnólogo Médico de la mención de Morfofisiopatología y Citodiagnóstico realiza el proceso de tinción de Papanicolaou, ya sea, de forma automatizada o manual. Posteriormente el Citotecnólogo realiza el screening citológico, y en conjunto con el Médico especializado en Patología o Citopatólogo, se determina el diagnóstico para posteriormente ingresarlos en el sistema computacional. Finalmente se entregan los informes de diagnósticos a su consultorio u hospital respectivo para informar al Médico y paciente sobre la situación. De esta forma se lleva a cabo el funcionamiento óptimo del Laboratorio de Citopatología permitiendo el diagnóstico oportuno, tanto de los casos negativos como positivos, y la derivación de estos últimos a la Unidad de Patología Cervical. Proceso de recepción e identificación de muestras El proceso de recepción de muestras es el primer paso dentro de la cadena y comienza al recibir las muestras de exámenes PAP de los distintos consultorios y/o hospitales de la región y/o comuna. Estos exámenes son entregados al personal encargado del transporte de biopsias y citologías y una vez recibidos, por la secretaria en el Laboratorio de Citopatología, estos se ingresan al sistema computacional registrando los datos que se requieran de la paciente. A continuación se toman los exámenes, se revisa que la cantidad entregada coincida con lo recibido y se identifica la unidad muestra-solicitud revisando que cada solicitud traiga la muestra rotulada de forma clara y legible y que los portaobjetos vengan adjuntos a la ficha que le corresponde. Luego se procede a foliar las solicitudes de examen con un número único para que ingresen al sistema de almacenamiento de datos. Luego de que las muestras fueron recibidas e identificadas se les aplica la tinción de PAP y las fichas son ingresadas en el programa computacional registrando los datos completos de las pacientes. Finalmente una vez que los exámenes han sido analizados por microscopía se ingresa el diagnóstico de cada paciente en el programa computacional, se imprime el informe para ser entregado al servicio correspondiente y se registra la entrega en un libro de “salida de informes”. Proceso de Tinción y montaje de frotis de Papanicolaou El proceso de tinción se puede dividir en 4 etapas principales: 1) Fijación 2) Coloración de núcleos 3) Coloración de citoplasmas 4) Aclaramiento La fijación se realiza al momento de la toma de muestra del Papanicolaou aplicándole Alcohol por Spray (CitoSpray) evitando una fijación inadecuada por exceso o falta de esta. Además, es fundamental que el tiempo entre la toma de muestra y fijación sea el mínimo posible (menos de 5 segundos). La coloración nuclear se realiza mediante la aplicación de Hematoxilina de Harris, la cual, es un colorante alcohólico basófilo. La tinción citoplasmática se realiza mediante colorantes alcohólicos los cuales tiñen de forma diferencial cada tipo celular de la muestra debido a la existencia de una diferencia en la afinidad electroestática por las proteínas que tiene cada colorante. Además, la diferencia en los tamaños moleculares de los colorantes determina la tinción diferencial de los citoplasmas según el grado de diferenciación celular. El Orange G, tiñe citoplasmas de células maduras bien diferenciadas con hiperqueratosis las que poseen queratinas de alto peso molecular generando una coloración orangeofílica. El colorante EA-50 es una mezcla de colorantes que tiñen el citoplasma y está compuesto por la Eosina, Verde luz y Contacto: carlzamorano@udec.cl Pardo Bismarck. La eosina posee mayor afinidad electroestática desplazando al Orange G, por lo que, tiñe los citoplasmas de todas las células pero finalmente son las superficiales e intermedias las que poseen coloración eosinófila o acidófila. El verde luz tiñe el citoplasma de las células menos diferenciadas ya que poseen una matriz permeable quedando finalmente las células basales y parabasales teñidas de azul (basófilas o cianófilas). El Pardo Bismarck tiene afinidad por la tinción de la mucina, por lo que, es el citoplasma de las células endocervicales las que se tiñen con este colorante. El aclaramiento es el paso final de la tinción donde se produce la transparencia celular, para lo cual, se utiliza xilol como solución aclaradora. Finalmente las muestras se montan por medio de la unión del portaobjeto y el cubreobjeto con una resina, la cual, es un medio de montaje soluble en el agente aclarante y debe tener un índice refracción que coincida con ambos. De esta forma se obtiene una muestra cubierta y protegida contra el arrugamiento, secado del material celular y oxidación de la muestra. Con esto se logra una imagen lo más transparente posible permitiendo la observación en el microscopio. El protocolo de tinción tiene variaciones en los tiempos, concentraciones y volúmenes de los reactivos según el Laboratorio donde se aplique pero se basa en los fundamentos explicados anteriormente. En la práctica por lo general se usan los siguientes pasos: 1) Lavado en agua corriente: utilizado para hidratar y limpiar las muestras, y darle cierto carácter acuoso. Es importante estilar bien las muestras para evitar la dilución y pérdida de capacidad de tinción del colorante utilizado en el paso siguiente. 2) Hematoxilina de Harris: utilizado para realizar la tinción nuclear de las células del frotis. 3) Lavado en agua corriente: utilizado para eliminar los excesos de colorante que queden en las muestras. Es importante estilar bien las muestras para evitar diluir y, por lo tanto, disminuir la concentración del reactivo del paso siguiente. 4) Agua ácida o Alcohol ácido: utilizado para realizar una diferenciación de la coloración nuclear por la Hematoxilina, proceso llamado “Coloración regresiva”. Es importante que las inmersiones sean rápidas para evitar una disminución excesiva de la tinción nuclear. 5) Alcohol 95%: utilizado para darle carácter alcohólico a las muestras para que reaccionen con el colorante del siguiente paso. Es importante estilar bien las muestras para evitar la dilución de los Alcoholes y la pérdida de capacidad de tinción del colorante utilizado en el paso siguiente. 6) Orange G: colorante alcohólico que tiñe el citoplasma de color anaranjado, el cual tiene afinidad electroestática con las proteínas, de todas las células en una primera instancia. Finalmente son las células escamosas superficiales queratinizadas las que obtienen una tinción orangeofílica. 7) Alcohol 95%: utilizado para eliminar el exceso de colorante de las muestras. Es importante estilar bien las muestras para evitar la dilución de los Alcoholes y la pérdida de capacidad de tinción del colorante utilizado en el paso siguiente. Contacto: carlzamorano@udec.cl 8) EA-50: EA-50 es una mezcla de colorantes con afinidad por los citoplasmas celulares compuestos por la Eosina que tiñe células superficiales e intermedias, el Verde luz que tiñe células basales y parabasales y el Pardo Bismarck que tiñe células endocervicales. 9) Alcoholes 95% y 100%: es importante estilar bien las muestras para evitar la dilución de los Alcoholes, alteración del Xilol y su pérdida de capacidad como mordiente. Las inmersiones no deben ser por mucho tiempo debido a que disminuyen la coloración de los colorantes citoplasmáticos. 10) Xilol: utilizado para el aclaramiento de la muestra. Debe cambiarse si aparece teñido con colorantes, y también, si tiene agua la solución (aspecto lechosa macroscópicamente) lo cual alteraría el proceso de tinción. El paso final del proceso consiste en el montaje del frotis de Papanicolaou. Para esto se le agregan un par de gotas de medio de montaje al cubreobjetos de vidrio y se presiona sobre el portaobjetos, o viceversa. Hay que evitar la formación de burbujas de aire en la lámina que se producen por la evaporación muy rápida del solvente o por la disposición irregular de la muestra. Además, hay que tener cuidado con el espesamiento del medio de montaje producto de la evaporación del solvente lo que dificulta su aplicación. También es importante evitar que los frotis se sequen antes de ser montados y cubiertos con resina porque esto produce una coloración café en el núcleo y/o citoplasma dificultando la posterior observación al microscopio. Es fundamental realizar una mantención de la batería de tinción filtrando la Hematoxilina todos los días y cambiándola, por lo menos una vez al mes. También se debe filtrar diariamente la última cubeta de xilol para retirar material celular que se haya desprendido o en el caso que sea necesario reemplazarlo por reactivo nuevo. Igual de importante es cambiar los colorantes Orange G y EA-50, por lo menos, cada 20 días ya que pierden su poder de tinción progresivamente después de este periodo. Hay que descartar los Alcoholes de enjuague cuando ya se encuentren sobresaturados de colorante, por lo menos, el primer día de cada semana y, además, cambiar la solución de HCl 0.5% (agua ácida), por lo menos, cada 15 días. El rol del Citotecnólogo en el diagnóstico Una vez procesada la muestra en el área u oficina de microscopía el Tecnólogo Médico especializado en Citología (Citotecnólogo), realiza el screening citológico, propiamente tal, mediante la observación célula por célula del frotis identificando variaciones en la morfología celular, presencia o ausencia de componentes inflamatorios, microoganismos, y cualquier característica que permita asignar un diagnóstico ya sea de lesiones precursoras, neoplasias, inflamación, calidad de muestra, entre otros. El informe del screening por lo general se entrega en una nomenclatura diagnostica que va de la A-Z donde cada letra corresponde a ciertas características observadas en el frotis. Finalmente el Patólogo determina y le asigna un diagnóstico final y en base a eso se determina el posible tratamiento en el caso que sea necesario. Conclusiones Es necesario que la muestra circule por una serie de pasos a lo largo del procesamiento en el Laboratorio de Contacto: carlzamorano@udec.cl Citopatología para poder realizar el diagnóstico. Es clave que el proceso se realice de la forma más rigurosa posible, ya que, cualquier error en alguno de los pasos podría generar una confusión a lo largo del procedimiento generando la pérdida de la muestra y la necesidad de volver a realizar el examen. Además, es fundamental que cada persona realice con la mayor eficiencia posible los roles que tienen designados. Cada día es importante realizar una rutina para ingresar las solicitudes y sus diagnósticos al programa computacional para tener una base de datos confiable y de fácil acceso. El trabajo que se realiza en el Laboratorio de Citopatología es indispensable dentro del programa de pesquisa de cáncer de cuello uterino y es posible gracias al trabajo multidisciplinario del equipo de salud especializado. Carlos Zamorano es el autor principal de este artículo realizado con la colaboración de Julieta Sepúlveda. Para mayor información sobre el tema contactar al correo ubicado al pie de página. www.morfocitologia.blogspot.com Contacto: carlzamorano@udec.cl