CONSTANTES DE ACIDEZ Ka DE ALGUNOS PARES ÁCIDO
Anuncio
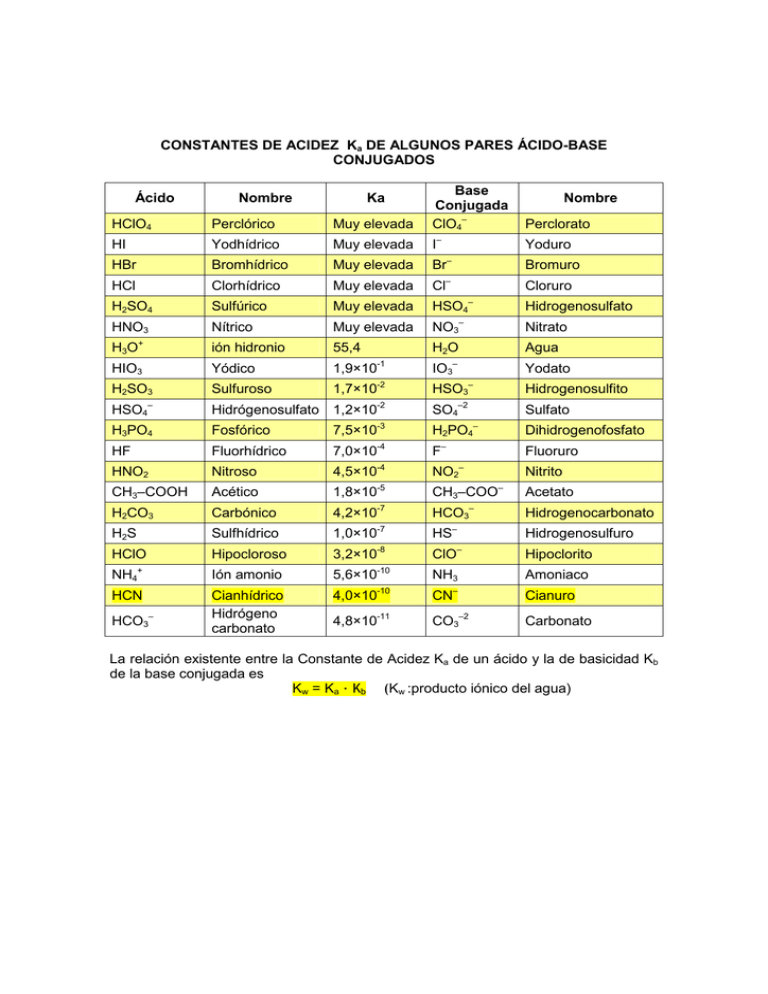
CONSTANTES DE ACIDEZ Ka DE ALGUNOS PARES ÁCIDO-BASE CONJUGADOS Ácido HClO4 HI Perclórico Yodhídrico HBr Bromhídrico HCl Clorhídrico H2SO4 HNO3 H3O Nombre + Ka Muy elevada Muy elevada Muy elevada Base Conjugada ClO4– I – Nombre Perclorato Yoduro – Bromuro – Br Muy elevada Cl Cloruro Muy elevada HSO4– Hidrogenosulfato Nítrico Muy elevada NO3– Nitrato ión hidronio 55,4 H2O Agua Yodato Sulfúrico HIO3 Yódico 1,9×10 IO3– H2SO3 Sulfuroso 1,7×10-2 HSO3– Hidrogenosulfito -2 SO4–2 Sulfato -3 H2PO4– Dihidrogenofosfato HSO4– H3PO4 HF HNO2 CH3–COOH H2CO3 -1 Hidrógenosulfato 1,2×10 Fosfórico Fluorhídrico Nitroso Acético Carbónico 7,5×10 -4 F -4 NO2– 7,0×10 4,5×10 – Fluoruro -5 CH3–COO -7 HCO3– -7 – 1,8×10 4,2×10 Nitrito – Acetato Hidrogenocarbonato H2S Sulfhídrico 1,0×10 HS Hidrogenosulfuro HClO Hipocloroso 3,2×10-8 ClO– Hipoclorito -10 NH3 Amoniaco -10 – NH4+ HCN HCO3– Ión amonio Cianhídrico Hidrógeno carbonato 5,6×10 4,0×10 CN Cianuro 4,8×10-11 CO3–2 Carbonato La relación existente entre la Constante de Acidez Ka de un ácido y la de basicidad Kb de la base conjugada es Kw = Ka Kb (Kw :producto iónico del agua)