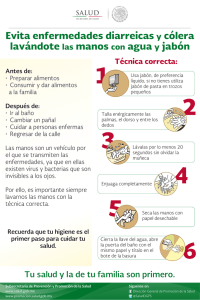
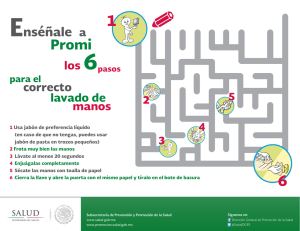
Jabon quemado - feriadelasciencias.unam.mx
Anuncio

::. UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO .:: XXI CONCURSO UNIVERSITARIO FERIA DE LAS CIENCIAS, LA TECNOLOGÍA Y LA INNOVACIÓN CARÁTULA DE TRABAJO QUÍMICA ÁREA LOCAL CATEGORÍA INVESTIGACIÓN EXPERIMENTAL MODALIDAD SÍNTESIS DE JABÓN A PARTIR DE ACEITE QUEMADO. TÍTULO DEL TRABAJO 0369489 FOLIO DE INSCRIPCIÓN JABÓN QUEMADO PSEUDÓNIMO DE INTEGRANTES 1 Resumen Nuestro principal objetivo es, que a partir del aceite quemado de la cafetería de nuestra preparatoria (el cual se tiene almacenado), y por medio de una reacción de saponificación podamos preparar jabón el cual podría ser utilizado en la misma preparatoria para la limpieza del laboratorio. Esta investigación experimental está enfocada en determinar las condiciones ideales para obtener un jabón de una calidad aceptable. La obtención de Jabón por medio de este método resulto exitosa aunque el jabón obtenido no tiene el mejor de los aspectos y es de baja calidad. Introducción. Lípidos Los lípidos se definen como substancias, que son insolubles en agua y pueden ser extraídas de las células con solventes orgánicos de polaridad baja, tales como el éter y el cloroformo. Los lípidos pueden comprender a muchos tipos de sustancias, por ejemplo los terpenos y los esteroides, en particular nos interesan los lípidos llamados grasas. Las grasas constituyen las reservas más importantes de energía que tiene el organismo, teniendo las grasas vegetales y las grasas animales, las grasas liquidas se les conoce comúnmente como aceites. Desde el punto de vista químico las grasas son esteres carboxílicos (Fig. 1) que se derivan de un solo alcohol, el glicerol, y se les conoce comúnmente como glicéridos y más específicamente se tratan de los triacilglicéroles (1). H2C O C R' O HC O C R' O H2C O C R' O Fig.1 Estructura química de un triacilglicerol. Aunque sintetizamos grasas en nuestros propios organismos, también lo obtenemos de nuestros alimentos con grasas sintetizadas en plantas y otros 2 animales; ellas contribuyen una de las tres clases principales de alimentos, entre los carbohidratos y las proteínas. Las grasas se utilizan en grandes cantidades como materias primas para muchos procesos industriales como pueden ser la síntesis de jabón y la obtención de detergentes. Ester Los esteres son un grupo funcional compuesto que tienen como formula general RCOOR’, en donde R y R’ son cadenas derivadas de algún hidrocarburo. Los esteres se pueden obtener a partir de la reacción de condensación entre ácidos carboxílicos y alcoholes, conocida como esterificación (2) (Fig.2): O C R OH ácido carboxilico + H2 C O H3O R HO R' alcohol C O ester H2 C R' Figura 2. Reacción de esterificación. Hidrólisis de grasas. Síntesis de jabón. La obtención de jabón es un proceso químico muy antiguo, desde las tribus germanas de César hasta la actualidad se realiza la misma reacción conocida en la actualidad como hidrólisis de glicéridos o reacción de saponificación. Esta produce sales de ácidos carboxílicos y glicerol (3). La reacción de saponificación se realiza al mezclar una grasa en una solución alcalina, comúnmente una solución de hidróxido de sodio, obteniendo como productos principales las sales del acido carboxílico correspondiente y el glicerol (Fig. 3). H2C O C R' O HC O C R' O H2C O C R' O Glicérido NaOH H2C OH Na O C R' HC OH O Na O C R' H2C OH Glicerol + O Na O C R' O Jabón 3 Figura 3. Reacción de saponificación. El oxigeno introduce su carga negativa, expulsando el ion metoxi. Mecanismo de la reacción. O R C O Na O R' R OH C OH O R' Ataque de la carga negativa del anión hidroxilo en el carbono del grupo carbonilo, con polarización del doble enlace hacia el oxigeno. O R C O Na HO O Na R' R C O OH Protonación del ion metoxi por medio del hidrogeno ácido. La base o álcali es fundamental para que se produzca esa reacción, pero hay que tener en cuenta que por sí solo es un compuesto muy peligroso, cuyo manejo implica tomar una serie de precauciones muy importantes para manipularlo con seguridad. Esto no significa que la saponificación sea un proceso terriblemente peligroso, sino más bien muy delicado de realizar: Así, por ejemplo, si en la reacción anterior hay un exceso de sosa, el producto resultante será una masa cáustica inservible; mientras que si por el contrario, la cantidad de sosa es insuficiente, el producto resultante será una mezcla grumosa de aceites, que en nada se parecerá tampoco al jabón. El jabón corriente actual es simplemente una mezcla de sales sódicas de ácidos grasos de cadenas largas. Es una mezcla por que la grasa de donde se obtiene es una mezcla de grasas. El jabón puede variar en su composición y su método de 4 R' obtención, por ejemplo si se utiliza hidróxido de potasio se obtiene el lo que se conoce como jabón blando. Objetivos Obtener jabón a partir de aceite quemado por medio de una reacción de saponificación. Encontrar las condiciones idóneas para la obtención de un jabón de buena calidad Problema: Se busca encontrar un uso alterno para el aceite usado por la cafetería escolar. Hipótesis: Si al aceite quemado le realizamos una reacción de saponificación obtendremos jabón para su uso normal, debido a que existe una cierta cantidad de glicéridos sin descomponerse en este aceite. Desarrollo Material y reactivos Tabla 1. Material Agitador de vidrio Vasos de precipitado de 500mL Vasos de precipitado de 200mL Vasos de precipitado de 100mL Vasos de precipitado de 50mL Mechero de bunsen Anillo metálico Recipiente de baño maría Soporte universal Tela de asbesto Molde 2 2 Reactivos Hidróxido de sodio Etanol Frasco 1L 2 Aceite quemado 2L 2 2 1 1 1 1 1 1 5 Procedimiento 1. En un vaso de precipitados de 150ml se mezclan 20 gramos de hidróxido de sodio con etanol en una concentración del 30% m/m (es decir 46.66 gramos de etanol). 2. Se pesan 20 gramos del aceite que se quiere reusar. 3. Se calienta la solución de NaOH por medio de calentamiento indirecto, por convección térmica del medio agua hasta el punto de ebullición mientras se revuelve hasta disolver el sólido completamente. 6 4. Se agrega el aceite a la solución caliente en el mismo envase y se mezcla hasta tener una solución homogenea sin extraerlo del calor del agua. 5. Pasado aproximadamente un minuto, se vierte al molde antes de su solidificación. 7 Procedimiento: NaOH + C2H6O Hidróxido de Sodio -­‐> 20 Gramos + Concentración 30% m/m <-­‐ Etanol 46.66 Gramos Se calienta hasta su punto de ebullición Se revuelve hasta disolver completamente Se agregan 20 gramos de Aceite Se mezclan hasta obtener una solución homogenea. Se calienta por aproximadamente un minuto. Se vierte en un molde Debe completarse antes de la solidificación de la solución. Se deja enfriar y neutralizarse (espera de 24 horas). 8 Resultados: Obtuvimos a través de este experimento un cuerpo sólido de color café claro que se disuelve con el agua formando burbujas lo que nos comprueba la formación de sales de ácidos carboxilicos. Este jabón resulta ser de baja calidad debido a que sigue teniendo aceite y al paso de 72 horas al revisarlo se vio un jabón extremadamente seco a tal grado que su estructura quedó fragil y podría ser usado como jabón en polvo. Por lo tanto hemos obtenido jabón a partir de aceite usado para freir por nuestra cafetería escolar. Conclusiones: Se logro a partir de aceite quemado obtener jabón de baja calidad por medio de una reacción de saponificación (hidrólisis de gases) comprobado que detro de la estructura del aceite se encuentran gliceridos que siguen sin decomponerse. Por lo tanto sui se mejoran las condiciones de la reacción podríamos obtener un jabón utilizable dentro de nuestra institución fortaleciendo así nuestras ideales con enfoque ecológico. Convertimos un químico potencialmente peligroso para el medio ambiente en un compuesto con un uso beneficial para la escuela. Bibliografía: (1) Bailey, Philip S., Bailey, Christina A. (1998) Quimica Organica. Pearson. (2) Morrison, Robert T., Boyd, Robert N. (1976) Quimica Organica. Fondo educativo interamericano. (3) Graham, Solomons (2004) fundamentos de quimica organica. Mexico. Limusa. 9