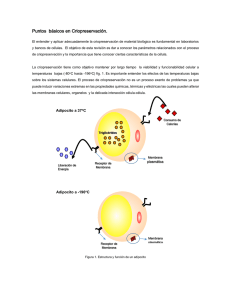
Análisis de la viabilidad celular ... criopreservación El rendimiento de un protocolo de criopreservación de células mononucleares... periférica (CMSP) es crítico cuando interesa conservar en N
Anuncio

Análisis de la criopreservación viabilidad celular tras aplicar distintas condiciones de Paternain R., Villar, V., Jauregui L., Armendáriz J., Fortuño M.A. Biobanco Universidad de Navarra. Pamplona El rendimiento de un protocolo de criopreservación de células mononucleares de sangre periférica (CMSP) es crítico cuando interesa conservar en N2-líquido subpoblaciones poco abundantes. Nuestro objetivo fue comparar distintas condiciones de criopreservación para optimizar el protocolo según la disponibilidad de células. Utilizando CMSP excedentes de experimentos de separación celular probamos dos concentraciones de DMSO (5% y 10%) para congelar las siguientes cantidades de células (millones): 0.5, 1.0, 2.5, 5.0 y 10. La velocidad de congelación se investigó aplicando tres métodos: a) congelación escalonada (Mr Frosty®), b) congelación a -80ºC y traspaso a N2-líquido y c) inmersión directa en N2 líquido. La viabilidad de las CMSP se midió mediante citometría de flujo previa incubación de las células con el marcador de DNA To-Pro 3, y se expresó como % de células viables. Como muestra la tabla, la congelación escalonada es el mejor método para crioconservar CMSP. Su buen rendimiento es independiente del número de células, y no se ve afectado por la concentración de DMSO. Si no se dispone de esta posibilidad, el paso por -80ºC antes de la inmersión en N2 -líquido resulta menos perjudicial, y en este caso una concentración de DMSO del 10% duplica la supervivencia celular, efecto que no se observa en la inmersión directa en N2. El pico de viabilidad detectado congelando 10 millones de CMSP en N2-líquido puede interpretarse como un umbral mínimo de células necesarias para la criopreservación o como un artefacto inherente a la metodología. DMSO 5% 10% Millones de células Mr. Frosty -80º N2 líquido 0,5 73,3 8,2 2,3 1,0 75,1 9,3 1,8 2,5 65,3 11,0 6,3 5,0 72,4 14,5 3,5 10,0 75,6 12,8 28,0 0,5 67,2 22,7 2,2 1,0 68,6 20,9 1,4 2,5 69,6 24,5 2,4 5,0 67,7 25,5 2,5 10,0 74,8 30,5 13,6