EFUSIÓN DE GASES
Anuncio

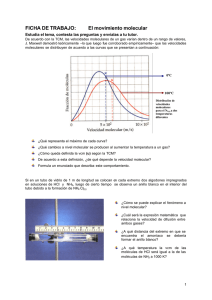
PRÁCTICA 8 EFUSIÓN DE GASES OBJETIVO Aplicación de una técnica de efusión a la determinación de masas moleculares. Estimación del diámetro molecular aproximado de las moléculas del gas mediante el estudio de la difusión a través de un tubo capilar. MATERIAL NECESARIO - Aparato de efusión (provisto de una entrada de gases y dos salidas a la atmósfera) - Soporte, llaves y pinzas - Bombonas de argón y CO2 - Cronómetro - Pera de goma INTRODUCCIÓN TEÓRICA Determinación de masas moleculares y densidades De acuerdo con la Teoría Cinética de los gases, la velocidad media vm de las moléculas de un gas viene dada por 8RT 8kT vm = (1) πM = πm R donde M es la masa molecular, k = NA es la constante de Bolzman, m es la masa de una molécula, y los otros símbolos tienen el significado habitual. Para una misma temperatura T, el cociente de las masas moleculares de dos gases viene dado por m2 vm1 2 m1 = vm2 (2) Por otra parte, el volumen V de gas que escapa a través de un orificio de área S en un tiempo t es proporcional a vm V = α S t vm (3) siendo α es una constante. Así, si consideramos el mismo volumen para dos gases diferentes que escapan a través de un mismo orificio invirtiendo tiempos t1 y t2 , de (2) y (3) se sigue que t1 vm2 t2 = vm1 = m1 m2 = ρ1 ρ2 (4) supuesto comportamiento ideal para ambos gases, y siendo ρ 1 y ρ 2 sus densidades respectivas. La ecuación (4) permite determinar el valor de M o ρ de un gas M, comparando con otro de 8.1 masa molecular o densidad conocida, a partir de la determinación experimental de los tiempos de efusión de ambos gases. Determinación del diámetro molecular El diámetro molecular se estima también mediante un procedimiento comparativo. Para ello se considera la relación entre los tiempos necesarios para que un volumen dado de dos gases escape a través de un tubo capilar. Esta relación se obtiene a partir de la fórmula de Poiseuille, que proporciona el volumen de un fluido que pasa a través de un tubo capilar, de radio R y longitud L, durante un tiempo t, bajo la acción de una diferencia de presión ∆p, π R4 ∆p t V = 8ηL . (5) Si se considera para dos gases la efusión de un mismo volumen V, para una misma diferencia de presiones ∆p, a través de un mismo capilar, siendo t 1 y t 2 los tiempos invertidos por cada uno se sigue de (5) que t1 η1 = (6) η2 t2 siendo 1 η = 3 vm λ ρ (7) la viscosidad y 1 λ= (8) 2 π n (2r)2 el recorrido libre medio de Maxwell, donde r el radio molecular y n el número de moléculas del gas por unidad de volumen. De (2), (6), (7) y (8), y habida cuenta que ρ = n M/N A, donde NA es el número de Avogadro, se sigue inmediatamente que d2 d1 = t1 t2 4 m2 m1 (9) donde di = 2 ri es el diámetro molecular. La ecuación (9) permite calcular el diámetro molecular de una especie gaseosa, conocido el de otra que se toma como referencia, y los tiempos invertidos en el proceso de efusión de cada una. PROCEDIMIENTO EXPERIMENTAL El montaje usado se muestra en la fig. 1. Consta de un tubo de efusión, cerrado en su parte superior mediante un tapón atravesado por un conducto provisto de dos llaves, la primera de las cuales permite la entrada de gas, y la segunda la salida de los mismos del tubo de efusión hacia el tubo d (provisto de una lámina de platino, con un pequeño orificio), o hacia el capilar c, según la disposición de la llave, b. 8.2 El tubo de efusión se mantiene verticalmente sumergido en agua, siempre a la misma profundidad, para que la presión media a la cual tiene lugar la efusión sea constante en todas las experiencias, manteniéndolo sujeto al recipiente mediante unas fijaciones horizontales. Al abrir la llave b, dispuesta convenientemente la llave a, el volumen de gas que escapa se determina por las marcas A y B del tubo de efusión. Figura 1.- Esquema del efusiómetro Dado que el agua tiene una presión de vapor apreciable, se introduce un cierto error en las medidas. Sin embargo, el error afecta aproximadamente con el mismo alcance al aire y a los gases problema, y por tanto, y al ser la técnica empleada un método relativo, se reduce considerablemente el error introducido en los resultados. Podría eliminarse este error, empleando un líquido de baja presión de vapor, tal como el ácido sulfúrico concentrado, pero dificultades experimentales hacen imposible el uso del mismo. Determinación de masas moleculares Para la determinación de las masas moleculares (o densidades) se utiliza el tubo d del dispositivo, que está provisto de una hoja de platino con un pequeño orificio por donde escapa el gas. Se procede de la siguiente manera: dispuestas las llaves a y b en la posición 1 de la fig. 2, se inyecta aire con la pera de goma hasta que el nivel del agua en el interior del aparato esté por debajo de la marca A. Entonces se disponen las llaves a y b en la posición 2 de la fig. 2 y el aire escapa a través del orificio de la lámina de platino. Con un cronómetro se mide el tiempo necesario para que el nivel del agua suba, desde la marca inferior A hasta la superior B, en el tubo de efusión. Se repiten después las medidas con los dos gases contenidos en las bombonas, conectando directamente las tuberías amarilla (argón) y gris (CO2) a la rama lateral del aparato de efusión. IMPORTANTE: Cada vez que se introduce un nuevo gas, se debe limpiar el aparato de efusión, haciendo que se escape gas burbujeando por la parte inferior del tubo. Para cada uno de los gases utilizados se repite la experiencia al menos tres veces. 8.3 Figura 2.- Posición de las llaves a y b en la determinación de masas moleculares Obtención de diámetros moleculares Para la determinación del diámetro molecular, se procede de igual manera, pero con las llaves situadas en las posiciones 1 y 2 de la fig. 3, midiendo los tiempos para que los distintos gases fluyan por el capilar c. Es posible que en las primeras determinaciones se obtengan lecturas erróneas debido a la eliminación de gases residuales del aparato. Para cada uno de los gases utilizados se repite la experiencia tres veces. Figura 3.- Posición de las llaves a y b en la determinación de diámetros moleculares Observaciones - Se tomará como patrón el argón: m = (39.9 ± 0.1) uma y d = (3.64 ± 0.03) 10-10 m. - El sentido de apertura de las llaves de los manómetros de las bombonas de gas está indicado en los mismos, ya que algunas se abren en sentido contrario al habitual. PRESENTACIÓN DE RESULTADOS a) Tiempos de efusión de los distintos gases por el capilar y por el orificio, con sus errores. b) Masas moleculares de los distintos gases con su error. Comparad los resultados con los valores tabulados para los tres gases. c) Diámetros moleculares de los distintos gases con su error. Discutid la plausibilidad de los resultados, teniendo en cuenta el número de átomos de las moléculas de cada uno de los gases. 8.4