Importancia de la sospecha clínica en el diagnóstico de la
Anuncio
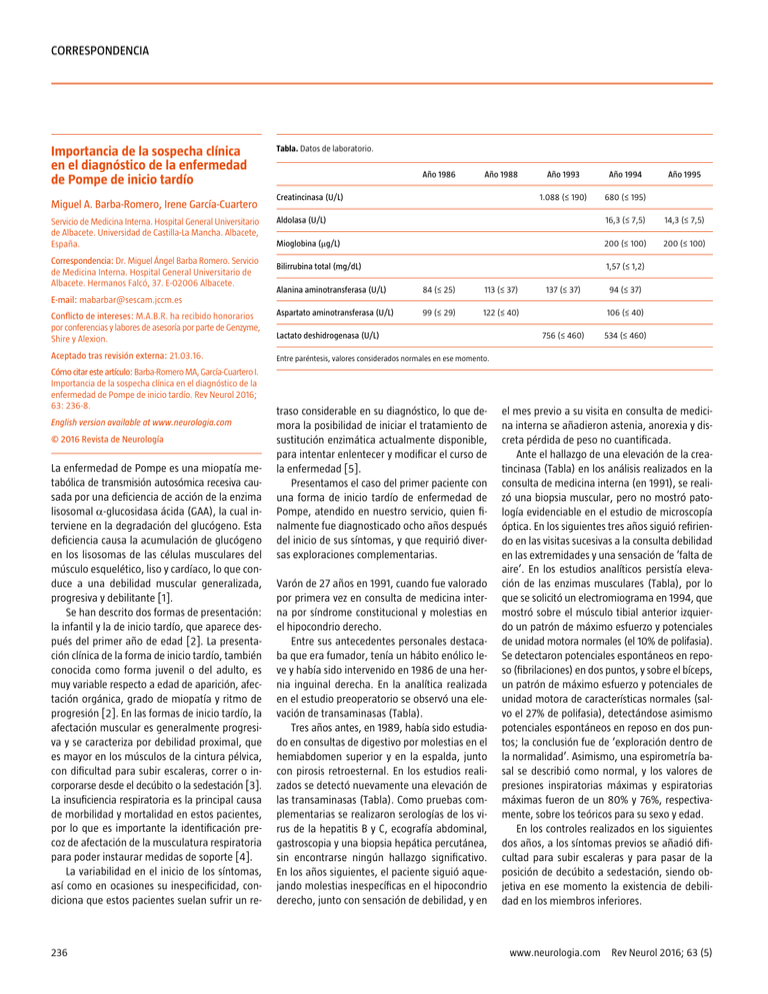
Correspondencia Importancia de la sospecha clínica en el diagnóstico de la enfermedad de Pompe de inicio tardío Miguel A. Barba-Romero, Irene García-Cuartero Servicio de Medicina Interna. Hospital General Universitario de Albacete. Universidad de Castilla-La Mancha. Albacete, España. Correspondencia: Dr. Miguel Ángel Barba Romero. Servicio de Medicina Interna. Hospital General Universitario de Albacete. Hermanos Falcó, 37. E-02006 Albacete. Tabla. Datos de laboratorio. Año 1986 Año 1988 Creatincinasa (U/L) Año 1993 Año 1994 1.088 (≤ 190) 680 (≤ 195) Año 1995 Aldolasa (U/L) 16,3 (≤ 7,5) 14,3 (≤ 7,5) Mioglobina (μg/L) 200 (≤ 100) 200 (≤ 100) Bilirrubina total (mg/dL) 1,57 (≤ 1,2) Alanina aminotransferasa (U/L) 84 (≤ 25) 113 (≤ 37) Conflicto de intereses: M.A.B.R. ha recibido honorarios por conferencias y labores de asesoría por parte de Genzyme, Shire y Alexion. Aspartato aminotransferasa (U/L) 99 (≤ 29) 122 (≤ 40) Aceptado tras revisión externa: 21.03.16. Entre paréntesis, valores considerados normales en ese momento. 137 (≤ 37) 94 (≤ 37) E-mail: mabarbar@sescam.jccm.es Cómo citar este artículo: Barba-Romero MA, García-Cuartero I. Importancia de la sospecha clínica en el diagnóstico de la enfermedad de Pompe de inicio tardío. Rev Neurol 2016; 63: 236-8. English version available at www.neurologia.com © 2016 Revista de Neurología La enfermedad de Pompe es una miopatía metabólica de transmisión autosómica recesiva causada por una deficiencia de acción de la enzima lisosomal α-glucosidasa ácida (GAA), la cual interviene en la degradación del glucógeno. Esta deficiencia causa la acumulación de glucógeno en los lisosomas de las células musculares del músculo esquelético, liso y cardíaco, lo que conduce a una debilidad muscular generalizada, progresiva y debilitante [1]. Se han descrito dos formas de presentación: la infantil y la de inicio tardío, que aparece después del primer año de edad [2]. La presentación clínica de la forma de inicio tardío, también conocida como forma juvenil o del adulto, es muy variable respecto a edad de aparición, afectación orgánica, grado de miopatía y ritmo de progresión [2]. En las formas de inicio tardío, la afectación muscular es generalmente progresiva y se caracteriza por debilidad proximal, que es mayor en los músculos de la cintura pélvica, con dificultad para subir escaleras, correr o incorporarse desde el decúbito o la sedestación [3]. La insuficiencia respiratoria es la principal causa de morbilidad y mortalidad en estos pacientes, por lo que es importante la identificación precoz de afectación de la musculatura respiratoria para poder instaurar medidas de soporte [4]. La variabilidad en el inicio de los síntomas, así como en ocasiones su inespecificidad, condiciona que estos pacientes suelan sufrir un re- 236 Lactato deshidrogenasa (U/L) traso considerable en su diagnóstico, lo que demora la posibilidad de iniciar el tratamiento de sustitución enzimática actualmente disponible, para intentar enlentecer y modificar el curso de la enfermedad [5]. Presentamos el caso del primer paciente con una forma de inicio tardío de enfermedad de Pompe, atendido en nuestro servicio, quien finalmente fue diagnosticado ocho años después del inicio de sus síntomas, y que requirió diversas exploraciones complementarias. Varón de 27 años en 1991, cuando fue valorado por primera vez en consulta de medicina interna por síndrome constitucional y molestias en el hipocondrio derecho. Entre sus antecedentes personales destacaba que era fumador, tenía un hábito enólico le­ ve y había sido intervenido en 1986 de una hernia inguinal derecha. En la analítica realizada en el estudio preoperatorio se observó una elevación de transaminasas (Tabla). Tres años antes, en 1989, había sido estudiado en consultas de digestivo por molestias en el hemiabdomen superior y en la espalda, junto con pirosis retroesternal. En los estudios realizados se detectó nuevamente una elevación de las transaminasas (Tabla). Como pruebas complementarias se realizaron serologías de los virus de la hepatitis B y C, ecografía abdominal, gastroscopia y una biopsia hepática percutánea, sin encontrarse ningún hallazgo significativo. En los años siguientes, el paciente siguió aquejando molestias inespecíficas en el hipocondrio derecho, junto con sensación de debilidad, y en 106 (≤ 40) 756 (≤ 460) 534 (≤ 460) el mes previo a su visita en consulta de medicina interna se añadieron astenia, anorexia y discreta pérdida de peso no cuantificada. Ante el hallazgo de una elevación de la creatincinasa (Tabla) en los análisis realizados en la consulta de medicina interna (en 1991), se realizó una biopsia muscular, pero no mostró patología evidenciable en el estudio de microscopía óptica. En los siguientes tres años siguió refiriendo en las visitas sucesivas a la consulta debilidad en las extremidades y una sensación de ’falta de aire’. En los estudios analíticos persistía elevación de las enzimas musculares (Tabla), por lo que se solicitó un electromiograma en 1994, que mostró sobre el músculo tibial anterior izquierdo un patrón de máximo esfuerzo y potenciales de unidad motora normales (el 10% de polifasia). Se detectaron potenciales espontáneos en reposo (fibrilaciones) en dos puntos, y sobre el bíceps, un patrón de máximo esfuerzo y potenciales de unidad motora de características normales (salvo el 27% de polifasia), detectándose asimismo potenciales espontáneos en reposo en dos puntos; la conclusión fue de ‘exploración dentro de la normalidad’. Asimismo, una espirometría basal se describió como normal, y los valores de presiones inspiratorias máximas y espiratorias máximas fueron de un 80% y 76%, respectivamente, sobre los teóricos para su sexo y edad. En los controles realizados en los siguientes dos años, a los síntomas previos se añadió dificultad para subir escaleras y para pasar de la posición de decúbito a sedestación, siendo objetiva en ese momento la existencia de debilidad en los miembros inferiores. www.neurologia.com Rev Neurol 2016; 63 (5) Correspondencia Con la sospecha de que el paciente sufría una posible distrofia muscular, se realizó en 1996 un nuevo electromiograma sobre la eminencia tenar izquierda y el músculo tibial anterior izquierdo, que resultó también informado como ‘dentro de la normalidad’. Asimismo, se realizó una nueva biopsia muscular en la que se observó: variación del tamaño de fibras musculares con patrón distrófico, irregularidad de distribución de enzimas oxidativas y presencia de vacuolas y de depósitos PAS positivos en las fibras, figuras de necrosis y de fagocitosis, fibrosis, ausencia de cambios inflamatorios y de cuerpos de inclusión, pero presencia de gran número de fibras festoneadas, y alteración focal de la distrofina 2 y la espectrina. En el microscopio electrónico aparecía depósito de glucógeno en citosomas rodeados de membrana y cuerpos residuales polimorfos; la conclusión del estudio fue de ‘miopatía compatible con glucogenosis de tipo Pompe del adulto’. En el año 2003 se realizó el estudio de la actividad enzimática en los fibroblastos, cuyo resultado fue compatible con la existencia de un déficit de α-glucosidasa (40,8 nmol/h/mg de proteínas frente al control de 543 nmol/h/mg de proteínas). En 2007 se efectuó estudio del ADN del paciente para la búsqueda de las mutaciones responsables en el gen de la GAA, y no se encontró ninguna de las mutaciones patogénicas conocidas asociadas a la enfermedad de Pompe. Se hallaron diversos polimorfismos, aparentemente con un patrón de homocigosidad (exones 3-5, 11, 13, 15, 16, 18), y una variante en el exón 15 que podría agravar el efecto de otro defecto genético. No se realizó un estudio de grandes reorganizaciones (deleciones-inserciones). Finalmente, ante la ausencia de un diagnóstico genético de certeza para una enfermedad de Pompe en el paciente, en 2014 se determinó la actividad de GAA total en los linfocitos, con un resultado de 0,02 nmol/min/mg de proteínas (rango normal: 0,15-1) y una actividad residual GAA intralinfocitaria del 13,3%, valores todos ellos claramente compatibles con el diagnóstico previo de enfermedad de Pompe de inicio tardío. Las enfermedades de depósito lisosomal son un gran grupo de trastornos genéticos caracterizados por la existencia de un defecto en el metabolismo de moléculas complejas dentro del lisosoma. La actividad deficiente de una enzima www.neurologia.com Rev Neurol 2016; 63 (5) lisosomal conduce a la acumulación de su correspondiente sustrato, no metabolizado en la mayoría de los tejidos [6]. Las enfermedades de depósito lisosomal pueden comenzar en adolescentes e incluso en adultos (formas de inicio tardío). En dichas formas de inicio tardío podemos encontrar una actividad enzimática residual que, junto con otros factores genéticos, epigenéticos e incluso extragenéticos, es la responsable de la elevada variabilidad que podemos encontrar en su fenotipo, la gravedad de las manifestaciones y el patrón evolutivo de la afectación orgánica. La enfermedad de Pompe es el único error congénito del metabolismo del glucógeno que se encuadra dentro de las enfermedades de depósito lisosomal [7]. La forma infantil incluye a pacientes con enfermedad rápidamente progresiva, caracterizada principalmente por afectación cardíaca, y a otros pacientes con progresión más lenta y cardiomiopatía menos grave, y puede presentarse en ambos casos de forma variable [8,9]. La presentación clínica de su forma de inicio tardío, juvenil o del adulto, es muy heterogénea [2], y se asemeja a otros trastornos neuromusculares más frecuentes, como polimiositis, miastenia grave o distrofias musculares de tipo Duchenne, lo cual dificulta su correcto diagnóstico [1]. La creatincinasa no siempre está elevada en los adultos [10], y los estudios histológicos o el electromiograma pueden ser normales, si no se han realizado sobre musculatura afecta [11]. Por dicho motivo se ha descrito en la bibliografía que hasta un tercio de los pacientes con este trastorno sufre una demora en el diagnóstico que oscila entre los 5 y los 30 años [10]. La enfermedad de Pompe debería sospecharse ante síntomas y signos tales como fatiga muscular, torpeza motora, dificultad respiratoria o elevación de las enzimas musculares [11]. Además, es extremadamente importante el diagnóstico precoz de esta enfermedad, ya que desde el año 2006 se encuentra disponible el tratamiento de sustitución enzimática con la enzima α-glucosidasa recombinante humana, que puede enlentecer la progresión de la enfermedad [5], lo que deberá evaluarse periódicamente durante el seguimiento [12]. El caso aportado refleja, por desgracia, el peregrinaje de estos pacientes en la obtención de un diagnóstico certero a sus síntomas. En es­ te paciente, la elevación de las transaminasas indujo inicialmente al cribado de una hepato- patía, ya que en ese momento no se determinó la cifra de creatincinasa. Cuando se objetivó la elevación de las enzimas musculares y la debilidad muscular, se realizaron estudios orientados a descartar una miopatía subyacente, pero las pruebas complementarias iniciales resultaron ‘normales’, probablemente porque se realizaron sobre musculatura no afectada (electromiograma, biopsia) o por no haberse efectuado un estudio completo en la primera muestra de biopsia muscular, con sólo el estudio de microscopía óptica. Una segunda biopsia muscular, en esta ocasión con su correspondiente estudio de microscopía electrónica e inmunohistoquímico, orientó finalmente al diagnóstico del paciente tras ocho años de evolución de sus síntomas, y se confirmó posteriormente la deficiencia en fibroblastos de la GAA. En el momento actual existe la posibilidad de determinar la actividad enzimática de la GAA mediante una muestra de sangre seca, y es aconsejable posteriormente su confirmación por otros métodos [11,13]. La eficacia y la fiabilidad del test en gota seca para la enfermedad de Pompe en pacientes con miopatía sospechosa se han confirmado recientemente [14]. Dado que existe un tratamiento de sustitución enzimática para este trastorno, resulta extremadamente importante que cualquier profesional de la medicina sospeche de la posibilidad de enfermedad de Pompe en los casos con los síntomas anteriormente reseñados o una elevación inexplicada de las enzimas musculares, lo que redundará en un diagnóstico precoz y en la posibilidad de ofrecer al paciente el beneficio de su tratamiento específico. Bibliografía 1. 2. 3. 4. 5. Van der Ploeg AT, Reuser AJ. Pompe’s disease. Lancet 2008; 372: 1342-53. Kishnani PS, Steiner RD, Bali D, Berger K, Byrne BJ, Case LE, et al. Pompe disease diagnosis and management guideline. Genet Med 2006; 8: 267-88. Dubrovsky A, Corderi J, Karasarides T, Taratuto AL. Pompe disease, the must-not-miss diagnosis: a report of 3 patients. Muscle Nerve 2013; 47: 594-600. Gaeta M, Musumeci O, Mondello S, Ruggeri P, Montagnese F, Cucinotta M, et al. Clinical and pathophysiological clues of respiratory dysfunction in late-onset Pompe disease: new insights from a comparative study by MRI and respiratory function assessment. Neuromuscul Disord 2015; 25: 852-8. Van der Ploeg AT, Clemens PR, Corzo D, Escolar DM, Florence J, Groeneveld GJ, et al. A randomized study of alglucosidase alfa in late-onset Pompe’s disease. N Engl J Med 2010; 362: 1396-406. 237 Correspondencia 6. Parker EI, Xing M, Moreno-De-Luca A, Harmouche E, Terk MR. Radiological and clinical characterization of the lysosomal storage disorders: non-lipid disorders. Br J Radiol 2014; 87: 20130467. 7. Hers HG. Alpha-glucosidase deficiency in generalized glycogenstorage disease (Pompe’s disease). Biochem J 1963; 86: 11-6. 8. Moreno-Medinilla E, Berzosa-López R, Mora-Ramírez MD, Blasco-Alonso J, Martínez-Antón J. Variabilidad en la presentación clínica de la enfermedad de Pompe infantil: presentación de dos casos y respuesta al tratamiento con enzima recombinante humana. Rev Neurol 2014; 59: 503-7. 9. Ley-Martos M, Salado-Reyes MJ, Espinosa-Rosso R, Solera-García J, Jiménez-Jiménez L. Variabilidad en la presentación clínica en la enfermedad de Pompe: evolución tras terapia de reemplazo enzimático. Rev Neurol 2015; 61: 416-20. 10. Winkel LP, Hagemans ML, Van Doorn PA, Loonen MC, Hop WJ, Reuser AJ, et al. The natural course of nonclassic Pompe’s disease; a review of 225 published cases. J Neurol 2005; 252: 875-84. 11. Barba-Romero MA, Barrot E, Bautista-Lorite J, GutiérrezRivas E, Illa I, Jiménez LM, et al. Guía clínica de la enfermedad de Pompe de inicio tardío. Rev Neurol 2012; 54: 497-507. 12. Gutiérrez-Rivas E, Illa I, Pascual-Pascual SI, PérezLópez J, Vílchez-Padilla JJ, Bautista-Lorite J, et al. Guía para el seguimiento de la enfermedad de Pompe de inicio tardío. Rev Neurol 2015; 60: 321-8. 13. Winchester B, Bali D, Bodamer OA, Caillaud C, Christensen E, Cooper A, et al. Methods for a prompt and reliable laboratory diagnosis of Pompe disease: report from an international consensus meeting. Mol Genet Metab 2008; 93: 275-81. 14. Gutiérrez-Rivas E, Bautista J, Vílchez JJ, Muelas N, Díaz-Manera J, Illa I, et al. Targeted screening for the detection of Pompe disease in patients with unclassified limb-girdle muscular dystrophy or asymptomatic hyperCKemia using dried blood: a Spanish cohort. Neuromuscul Disord 2015; 25: 548-53. Afectación de la segunda motoneurona y enfermedad de Creutzfeldt-Jakob Teresa Casadevall-Codina b, Cristina GuerreroCastaño b, Fernando Espada-Oliván b, Neus Ruscalleda-Morell a, Andrés M. Acosta-Peña c, Rafael Cuenca-Luque c a Servicio de Resonancia Magnética. QDiagnòstica. Hospital Comarcal de Blanes. Corporació de Salut del Maresme i La Selva. Blanes, Girona. b Servicio de Neurología. c Servicio de Medicina Interna. Hospital Comarcal Sant Jaume de Calella. Corporació de Salut del Maresme i La Selva. Calella, Barcelona, España. Correspondencia: Dra. Teresa Casadevall Codina. Servicio de Neurología. Hospital Comarcal Sant Jaume de Calella. Ctra. Sant Jaume, 207-209. E-08370 Calella (Barcelona). E-mail: tcasadevall@yahoo.com Agradecimientos: C. Nos, del Hospital Vall d’Hebron; E. Gelpi y el equipo del Banc de Teixits Neurològics (Biobanc Hospital Clínic. IDIBAPS); e I. Ferrer, del Instituto de Neuropatología del Hospital Universitari de Bellvitge, 238 por su colaboración en el estudio anatomopatológico del caso expuesto y de las enfermedades priónicas. Aceptado tras revisión externa: 24.05.16. Cómo citar este artículo: Casadevall-Codina T, GuerreroCastaño C, Espada-Oliván F, Ruscalleda-Morell N, AcostaPeña AM, Cuenca-Luque R. Afectación de la segunda motoneurona y enfermedad de Creutzfeldt-Jakob. Rev Neurol 2016; 63: 238-40. © 2016 Revista de Neurología Aunque la enfermedad de Creutzfeldt-Jakob está extensamente tipificada en la clínica y en la bibliografía [1-3], pocos casos descritos contemplan signos de afectación de la segunda motoneurona como uno de los datos principales que apoyan el diagnóstico. Consideramos la importancia de presentar un caso clínico de diagnóstico complejo debido a los antecedentes y síntomas concomitantes del paciente, en los que podemos documentar la afectación de la segunda motoneurona como causa del síntoma principal, que implica un diagnóstico diferencial amplio y una importancia patogénica que da soporte al mecanismo de propagación de la infección priónica a estructuras extracerebrales [4-6], y que permite ampliar datos fenotípicos en la enfermedad esporádica. Varón de 64 años, con antecedentes de enolismo y tabaquismo hacía 15 años, hepatopatía enólica, dos episodios de trombosis venosa superficial y dos de profunda en las extremidades inferiores en los últimos 20 años, hipercolesterolemia, infarto cerebral isquémico silviano izquierdo a los 40 años de edad, de etiología no determinada (estudio Doppler de los troncos supraaórticos normal y ecocardiograma con insuficiencia aórtica leve-moderada y fracción de eyección del 57%), con afasia de expresión y hemiparesia derecha residuales, y síndrome depresivo reactivo, en tratamiento con anticoagulantes orales, estatinas y antidepresivos. Funcionalmente era capaz de comunicarse verbalmente y de caminar de forma autónoma. Residía en un centro geriátrico. Ingresó por empeoramiento progresivo de la marcha de dos meses de evolución hasta no poder mantener la bipedestación, temblor en los brazos e imposibilidad actual para la comunicación verbal. La exploración mostraba un nivel de alerta fluctuante con períodos de somnolencia, actitud de indiferencia, afasia mixta con comprensión verbal limitada a órdenes sencillas, hemianopsia homónima derecha, paresia facial central dere- cha, plejía espástica en la extremidad superior derecha y fuerza conservada con movimiento apráxico en la izquierda, paresia 3/5 en la extremidad inferior derecha y proximal 4/5 en la izquierda, reflejos osteotendinosos apagados en las cuatro extremidades con aquíleos abolidos, sin Babinski, temblor postural en los brazos, ocasionales movimientos miocloniformes en la extremidad superior izquierda durante el movimiento dirigido, sensibilidad no evaluable, pies cianóticos y livedo reticularis. Desde urgencias se practicó una analítica de sangre con hemograma y bioquímica básica, radiografía de tórax y electrocardiograma que no mostraron alteraciones relevantes, y una tomografía computarizada cerebral en la que se objetivó una lesión hipodensa corticosubcortical frontoparietotemporal izquierda, compatible con el infarto antiguo conocido. A pesar de los datos exploratorios, ante el cuadro de confusión fluctuante y la extensa lesión en la tomografía computarizada se sospechó inicialmente un origen epiléptico o un nuevo ictus, por lo que se procedió a realizar una analítica general, un electroencefalograma y una resonancia magnética craneal. Entre los datos analíticos destacaron velocidad de sedimentación globular de 88 mm/h (normal < 20 mm/h), y unas enzimas hepáticas con aspartato aminotransferasa de 45 U/L (normal < 40 U/L) y alanino aminotransferasa de 85 U/L (normal < 40 U/L). El electroencefalograma mostró lentificación de la actividad en el hemisferio izquierdo con ritmo theta-delta de predominio frontotemporal. Se evaluó la respuesta a fármaco antiepiléptico (levetiracetam) sin éxito. La resonancia magnética craneal objetivó una extensa área encefalomalácica corticosubcortical frontotemporal y caudadolenticular izquierda en relación con un infarto antiguo. Considerando los antecedentes del paciente, e intentando correlacionar los síntomas cognitivos, el cuadro confusional, la alteración de la marcha con arreflexia aquílea y el resto de la exploración, nos dirigimos a descartar patología sistémica (toxicometabólica, infecciosa o parainfecciosa, autoinmunitaria o paraneoplásica), por lo que completamos la analítica y realizamos un análisis del líquido cefalorraquídeo y un estudio neurofisiológico con electroneurografía y electromiografía. Se evaluó en suero: auto­ inmunidad, creatincinasa, vitamina B12, ácido fó­lico, homocisteína, hormonas tiroideas, anticuerpos antitiroideos, anticardiolipina y onco­ www.neurologia.com Rev Neurol 2016; 63 (5)