EXAMEN DE QUÍMICA 1º BACH. GALICIA − FEBRERO
Anuncio

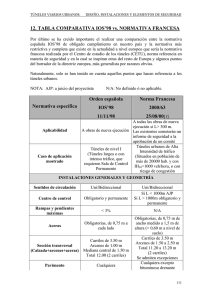
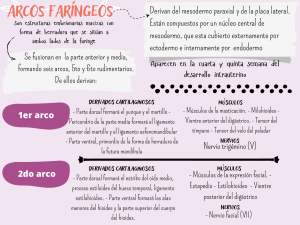
EXAMEN DE QUÍMICA 1º BACH. GALICIA − FEBRERO • Un elemento tiene la siguiente configuración electrónica: 1s2 / 2s2 2p6 / 3s2 3p6 / 4s2 ¿Cuál es el nombre del elemento? ¿Qué tipo de sólido formará? ¿Qué tipo de sólido formará al reaccionar con el oxígeno y cuál será la fórmula del compuesto obtenido? ¿Qué propiedades tendrá este último sólido? • Representa gráficamente las estructuras de Lewis de los siguientes compuestos: • S Cl2 • B F3 • C2 H2 • N H4+ • Cl2 O • El ácido sulfúrico reacciona con el aluminio para dar sulfato de aluminio e hidrógeno. Si partimos de 6 g de Al, con 50 ml de disolución 0'6 M de H2 SO4. • Escribe la reacción y ajústala. • Calcula cuál es el reactivo en exceso y cuál el limitante. • Calcula también el volumen de hidrógeno que se obtendrá medido en condiciones normales (1 atm.; 0 ºC). • Cuando se calienta carbonato cálcico, se descompone dando óxido de calcio y dióxido de carbono. • Escribe la reacción. • Calcula el rendimiento si al calentar 37'2 g de carbonato cálcico se obtienen 19'6 g de óxido de calcio. • Explica la hibridación que se da n la molécula C H2 % C H2, indicando la geometría molecular y los enlaces. • Nombra en cualquier nomenclatura y disocia: • H ClO3 • Ca (OH)2 • Fe S • K MnO7 • Mg CO3 • K BrO • H NO2 • Fe F3 • NH4 NO2 • Al2 (CO3)3 • Escribe y nombra ocho isómeros del C5H12O. 1− El elemento es el calcio, sólido metálico que formará CaO, sólido iónico de enlace iónico que conduce la electricidad disuelto o fundido. 2− Pura teoría. 3− 0'672 L de H2 / 3'42g de Al2 (SO4)3 / 3H2 (SO)4 + 2Al ! Al2 (SO4)3 + 3H2 • Rend. 94% / Ca CO3 ! CaO + CO2 5, 6, 7 − Pura teoría. 1