Ficha 18
Anuncio

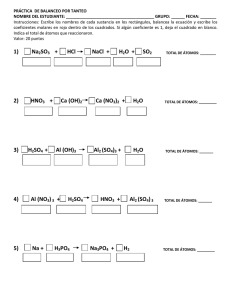
Ficha 18 1. Escribe y ajusta la ecuación química correspondiente a la siguiente reacción: El ácido sulfúrico, H2SO4, en disolución acuosa, reacciona con aluminio metálico, Al, y produce sulfato de aluminio, Al2(SO4)3, en disolución acuosa, y un desprendimiento de hidrógeno gas, H2. Procede del modo siguiente: — Identifica los reactivos y los productos: Reactivos: .................... y Productos: .................... .................... y .................... — Escribe la ecuación. No olvides indicar el estado físico de las sustancias. .................................................................................................................................................................................................................................... — Enumera los elementos presentes en cada miembro de la ecuación. Primer miembro: .........., .........., .......... y .......... Segundo miembro: .........., .........., .......... y .......... — Elige un elemento: el S. — Determina el número de átomos de S presentes en cada miembro de la ecuación. Primer miembro: .......... en H2SO4 Segundo miembro: .......... en Al2(SO4)3 — Asigna el coeficiente adecuado para igualar el número de átomos de S. .................................................................................................................................................................................................................................... — Elige otro elemento: el O. — Determina el número de átomos de O presentes en cada miembro de la ecuación. Primer miembro: .......... en ................. Segundo miembro: .......... en ................. — Asigna el coeficiente adecuado para igualar el número de átomos de O. Si no es necesario incorporar ningún coeficiente, vuelve a escribir la ecuación como antes. .................................................................................................................................................................................................................................... — Elige otro elemento: el Al. — Determina el número de átomos de Al presentes en cada miembro de la ecuación. Primer miembro: .......... en ................. Segundo miembro: .......... en ................. — Asigna el coeficiente adecuado para igualar el número de átomos de Al. .................................................................................................................................................................................................................................... — Elige el último elemento: el H. — Determina el número de átomos de H presentes en cada miembro de la ecuación. Primer miembro: .......... en ................. Segundo miembro: .......... en ................. — Asigna el coeficiente adecuado para igualar el número de átomos de H. ........................................................................................................................................................................................................................ ............ — Comprueba que el número de átomos de cada elemento es el mismo en los dos miembros: Primer miembro: S: .......... en ................. O: .......... en ................. Al: .......... en ................. H: .......... en ................. Segundo miembro: S: .......... en ................. O: .......... en ................. Al: .......... en ................. H: .......... en .................. — Finalmente escribe la ecuación debidamente ajustada. Solucionario de la ficha de refuerzo 18 1. — Reactivos: H2SO4 y Al. Productos: Al2(SO4)3 y H2. H2SO4 (aq) + Al (s) → Al2(SO4)3 (aq) + H2 (g) Primer miembro: H, S, O y Al. Segundo miembro: H, S, O y Al. — Elemento escogido: el S. Primer miembro: uno en H2SO4 Segundo miembro: tres en Al2(SO4)3 3 H2SO4 (aq) + Al (s) → Al2(SO4)3 (aq) + H2 (g) — Elemento escogido: el O. Primer miembro: doce en 3 H2SO4. Segundo miembro: doce en Al2(SO4)3. 3 H2SO4 (aq) + Al (s) → Al2(SO4)3 (aq) + H2 (g) — Elemento escogido: el Al. Primer miembro: uno en Al. Segundo miembro: dos en Al2(SO4)3. 3 H2SO4 (aq) + 2 Al (s) → Al2(SO4)3 (aq) + H2 (g) — Último elemento escogido: el H. Primer miembro: seis en 3 H2SO4. Segundo miembro: dos en H2. 3 H2SO4 (aq) + 2 Al (s) → Al2(SO4)3 (aq) + 3 H2 (g) — Comprobación: Primer miembro: S: tres en 3 H2SO4. O: doce en 3 H2SO4. Al: dos en 2 Al. H: seis en 3 H2SO4. Segundo miembro: S: tres en Al2(SO4)3. O: doce en Al2(SO4)3. Al: dos en Al2(SO4)3. H: seis en 3 H2. — Ecuación ajustada: 3 H2SO4 (aq) + 2 Al (s) → Al2(SO4)3 (aq) + 3 H2 (g) 66 Ficha 19 1. Observa atentamente la ficha siguiente y responde a las preguntas. El ácido clorhídrico, HCl, reacciona con el magnesio sólido, Mg, y produce cloruro de magnesio, en disolución acuosa, MgCl2, y un desprendimiento de hidrógeno gas, H2. Calcula la masa de cloruro de magnesio que podemos obtener si hacemos reaccionar 15 g de magnesio con exceso de ácido clorhídrico. Masas atómicas: Ar(Mg) 24,3 u Ar(Cl) 35,5 u Dato conocido Dato que se pretende conocer Masa de Mg 15 g Masa de MgCl2 x Determinación de masas molares: Ar(Mg) 24,3 u ⇒ 1 mol Mg 24,3 g Mr(MgCl2) Ar(Mg) 2 · Ar(Cl) 24,3 u 2 · 35,5 u 95,3 u ⇒ 1 mol MgCl2 95,3 g 2 HCl (aq) Ecuación ajustada Mg (s) Moles que intervienen Masas molares Datos conocidos y desconocidos Establecimiento de la proporción: 24,3 g Mg 15 g Mg → MgCl2 (aq) 1 1 24,3 g 95,3 g 15 g x H2 (g) 95,3 g MgCl2 x Resolución: 24,3 g Mg · x 15 g Mg · 95,3 g MgCl2 ⇒ x 15 g Mg · 95,3 g MgCl2 24,3 g Mg 58,8 g MgCl2 Respuesta: Podemos obtener 58,8 g de cloruro de magnesio. — Al confeccionar la tabla, sólo hemos completado los datos del magnesio y del cloruro de magnesio. Explica por qué: .................................................................................................................................................................................................. ....................................................................................................................................................................................................................................... — Si en vez de conocer la masa del magnesio conociéramos la del ácido clorhídrico, ¿qué cambios introduciríamos en la tabla? ............................................................................................................................................................................... ....................................................................................................................................................................................................................................... 2. Confecciona en tu cuaderno una ficha similar a la anterior para resolver los problemas siguientes: a) El carbonato de calcio sólido, CaCO3, se descompone por acción del calor en óxido de calcio sólido, CaO, y dióxido de carbono gas, CO2. Calcula la masa de CaO que podemos obtener por descomposición de 45 g de CaCO3. Ar(Ca) 40,0 u; Ar(C) 12,0 u; Ar(O) 16,0 u b) El azufre y el hierro, en estado sólido, reaccionan entre sí cuando se calientan para producir sulfuro de hierro (II) sólido, FeS. Calcula la masa de azufre necesaria para reaccionar totalmente con 25,0 g de hierro. Ar(S) 32,0 u; Ar(Fe) 55,8 u Solucionario de la ficha de refuerzo 19 1. • Sólo hemos comparado los datos del magnesio y del cloruro de magnesio porque la proporción que se establece entre sus masas no depende de las demás sustancias que intervienen en la reacción. • Si conociéramos los datos de la masa del ácido clorhídrico en vez de los del magnesio, tendríamos que comparar éstos con los del cloruro de magnesio. 2. a) Ar(Ca) 40,0 u; Ar(C) 12,0 u; Ar(O) 16,0 u Dato conocido Dato que se pretende conocer Masa de CaCO3 45 g Masa de CaO x Mr(CaCO3) Ar(Ca) Ar(C) 3 · Ar(O) 40,0 u 12, 0 u 3 · 16,0 u 100,0 u ⇒ 1 mol CaCO3 100,0 g CaCO3 Mr(CaO) Ar(Ca) Ar(O) 40,0 u 16,0 u 56,0 u CaCO3 (s) → Ecuación ajustada Masas molares 1 100,0 g 56,0 g 45 g x Datos conocidos y desconocidos 45 g CaCO3 x 45 g CaCO3 · 56,0 g CaO x 56,0 g CaO 100,0 g CaCO3 CaO (s) 1 Moles que intervienen 100,0 g CaCO3 ⇒ 1 mol CaO 56,0 g CaO CO2 (g) ⇒ 100,0 g CaCO3 · x 45 g CaCO3 · 56,0 g CaO 25,2 g CaO Podemos obtener 25,2 g de óxido de calcio. b) Ar(S) 32,0 u; Ar(Fe) 55,8 u Ar(S) 32,0 u ⇒ 1 mol S 32,0 g S Ar(Fe) 55,8 u ⇒ 1 mol Fe 55,8 g Fe Fe (s) Ecuación ajustada Moles que intervienen Masas molares Datos conocidos y desconocidos 55,8 g Fe 25,0 g Fe x 25,0 g Fe · 32,0 g S x 32,0 g S 55,8 g Fe Dato que se pretende conocer Masa de CaCO3 45 g Masa de CaO x S (s) 1 1 55,8 g 32,0 g 25 g x → ⇒ 55,8 g Fe · x 25,0 g Fe · 32,0 g S 14,34 g S Serán necesarios 14,34 g de azufre. 68 Dato conocido FeS (s) Ficha 20 1. Observa atentamente la ficha siguiente y responde a las preguntas. El clorato de potasio sólido, KClO3, se descompone por acción del calor y produce oxígeno gas, O2, y un residuo sólido de cloruro de potasio, KCl. Determina el volumen de oxígeno, medido en condiciones normales, que se obtendrá al descomponer 30 g de clorato de potasio. Masas atómicas: Ar(K) 39,1 u Ar(Cl) 35,5 u Ar(O) 16,0 u Dato conocido Dato que se pretende conocer Masa de KClO3 30 g Volumen de O2 en c. n. x Determinación de masas y volúmenes molares: 1 mol O2 en condiciones normales 22,4 L Mr(KClO3) Ar(K) Ar(Cl) 3 · Ar(Cl) 39,0 u 35,5 u 3 · 16,0 u 122,6 u ⇒ 1 mol KClO3 122,6 g Ecuación ajustada Moles que intervienen Masas y volúmenes molares Datos conocidos y desconocidos Establecimiento de la proporción: → 2 KClO3 (s) 2 KCl (s) 3 O2 (g) 2 3 2 · 122,6 g 245,2 g 3 · 22,4 L 67,2 L 30 g x 245,2 g KClO3 30 g KClO3 67,2 L O2 x Resolución: 245,2 g KClO3 · x 30 g KClO3 · 67,2 L O2 ⇒ x 30 g KClO3 · 67,2 L O2 245,2 g KClO3 8,22 L O2 Respuesta: Podemos obtener 8,22 L de oxígeno gas, medido en condiciones normales. — Al confeccionar la tabla, sólo hemos completado los datos del clorato de potasio y del oxígeno. Explica por qué: .................................................................................................................................................................................................. ....................................................................................................................................................................................................................................... — Hemos interpretado los moles de oxígeno en litros y los de clorato de potasio, en gramos. Explica por qué: .................................................................................................................................................................................................. ....................................................................................................................................................................................................................................... 2. Confecciona en tu cuaderno una ficha similar a la anterior para resolver los problemas siguientes: a) El carbono sólido, C, a elevadas temperaturas, reacciona con el vapor de agua, H2O, y produce los gases monóxido de carbono, CO, e hidrógeno, H2. Calcula el volumen de monóxido de carbono, medido, en c. n., que puede obtenerse a partir de 150 g de carbono. (Ar(C) 12,0 u) b) El gas metano, CH4, arde en presencia del oxígeno del aire, O2, y produce dióxido de carbono gas, CO2, y vapor de agua, H2O. Calcula el volumen de oxígeno, medido en c. n., necesario para quemar completamente 25 L de metano, medidos también en c. n. Solucionario de la ficha de refuerzo 20 1. • Sólo hemos comparado los datos del clorato de potasio y del oxígeno porque la proporción que se establece entre la masa del clorato de potasio y el volumen del oxígeno no depende de las demás sustancias que intervienen en la reacción. • Los moles de oxígeno se interpretan en litros porque se trata de un gas. Los moles de clorato de potasio se interpretan en gramos porque se trata de un sólido. 2. a) Ar(C) 12,0 u; Vm 22,4 L Dato conocido Dato que se pretende conocer Masa de C 150 g Volumen de CO x Ar(C) 12,0 u ⇒ 1 mol C 12,0 g C Mr(CaCO3) 1 mol CO en condiciones normales 22,4 L C (s) Ecuación ajustada 150 g C CO (g) Masas y volúmenes molares 12,0 g 22,4 L Datos conocidos y desconocidos 150 g x 22,4 L CO 12,0 g C H2 (g) ⇒ 12,0 g C · x 150 g C · 22,4 L CO x x 150 g C · → 1 22,4 L CO H2O (g) 1 Moles que intervienen 12,0 g C 280 L CO Podemos obtener 280 L de monóxido de carbono, medidos en condiciones normales. b) Vm 22,4 L Dato conocido Dato que se pretende conocer Volumen de CH4 25 L Volumen de O2 x 1 mol de CH4 en condiciones normales 22,4 L 1 mol de O2 en condiciones normales 22,4 L CH4 (g) Ecuación ajustada Moles que intervienen Volúmenes molares Datos conocidos y desconocidos 22,4 L CH4 25 L CH4 x 25 L CH4 · 44,8 L O2 x 44,8 L O2 22,4 L CH4 2 O2 (g) 1 2 22,4 L 2 · 22,4 L = 44,8 L 25 L x → CO2 (g) 2 H2O (g) ⇒ 22,4 L CH4 · x 25 L CH4 · 44,8 L O2 50 L O2 Serán necesarios 50 L de oxígeno gas, medidos en condiciones normales. 70