TEMA 2
Anuncio

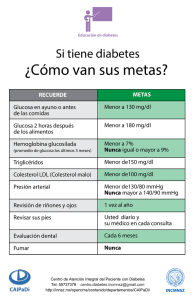
TEMA 2: ANÁLISIS RELACIONADOS DE LA GLUCEMIA Y PARÁMETROS 1. Alteraciones del metabolismo glucídico, la diabetes (clasificación, síntomas y diagnóstico). 2. Glucemia basal. 3. Pruebas de sobrecarga: Curva de glucemia y Test de O'Sullivan. 4. Determinació n de glucosa: métodos. 5. Otras pruebas: análisis de proteínas glicosiladas, péptido C, glucosuria, insulinemia y determinación de cuerpos cetónicos. Apéndice: Cromatografía. Introducción Los hidratos de carbono son compuestos orgánicos formados fundamentalmente por C, O e H a partir de los cuales se puede obtener energía con gran rapidez y que aportan, aproximadamente, el 50% de las calorías que recibimos de la dieta. Se ingieren en forma de polisacáridos (ej. almidón), disacáridos (ej. sacarosa y fructosa) o monosacáridos (ej. glucosa y galactosa). En cualquier caso, se desdoblan en el intestino hasta obtener monosacáridos que son absorbidos y transformados en glucosa a nivel hepático. Los niveles de glucosa en sangre (glucemia) se mantienen dentro de unos límites muy estrechos y constantes gracias, fundamentalmente, a la acción de dos hormonas: la insulina (hipoglucemiante) y el glucagón (hiperglucemiante). Así, tras la ingestión aumenta la glucemia pero, en las personas con un correcto metabolismo hidrocarbonado, estos niveles descienden rápidamente (gracias a la liberación de insulina) de manera que tras 1,5-2 horas la glucemia vuelve al nivel basal. 1. Alteraciones del metabolismo glucídico , la diabetes Aunque las patologías relacionadas con alteraciones del metabolismo glucídico son muy diversas, vamos a centrarnos en los trastornos en la regulación del nivel de glucosa en sangre Cuando la homeostasis de la glucosa se rompe por disfunción de cualquier elemento que la mantiene, sobrevienen los síndromes hiper o hipoglucémicos que, como su nombre indican, conllevan el aumento (>120 mg/dL en ayunas) o la disminución (<45-50mg/dL) de la glucemia, respectivamente. 1.1. Diabetes mellitus La diabetes mellitus es la causa más frecuente y grave de hiperglucemia. Es una metabolopatía crónica que aparece como consecuencia de la deficiencia absoluta o relativa de insulina. En estas condiciones, la entrada de glucosa en las células está disminuida y en consecuencia los niveles en sangre se mantienen elevados (hiperglucemia). Esta deficiencia da lugar a una serie 1 de complicaciones a largo plazo, lo que origina una gran morbilidad y mortalidad. Existe otro tipo de alteración denominada disminución de la tolerancia a la glucosa o tolerancia anormal a la glucosa que se caracteriza por valores de glucemia intermedios entre los normales y los de los diabéticos. 1.1.1. Clasificación: Actualmente la diabetes se clasifica en: • Diabetes tipo I (déficit total de insulina). • Diabetes tipo II (resistencia a la insulina o defecto secretor con resistencia a la insulina, los enfermos al principio no requieren la administración de insulina). • Diabetes secundaria (enfermedades pancreáticas, tumores endocrinos…). • Diabetes gestacional (se detecta durante el embarazo). 1.1.2. Síntomas La diabetes cursa con polifagia, polidipsia, poliuria, disminución del peso corporal, hiperglucemia y en ocasiones glucosuria. 1.1.3. Diagnóstico Las pruebas más utilizadas para el diagnóstico de la diabetes se basan en la demostración de una tolerancia anormal a la glucosa. Concretamente se suele: • Determinar la glucemia basal • Realizar pruebas de provocación o sobrecarga en las que se administra al paciente una cantidad conocida de glucosa y se analiza la evolución de la glucemia. Entra estas pruebas se incluyen la curva de glucemia y el test de O´Sullivan. Se considera diabetes si se cumple alguno de los tres puntos que se citan a continuación: • Nivel de glucemia > 200 mg/dL acompañado de los síntomas típicos de la enfermedad. • Glucemia en ayunas > 140 mg/dL, obtenida en dos ocasiones • Glucemia en ayunas entre 110 y 140 mg/dL y dos curvas de glucemia positivas 2. Determinación de la glucemia basal Esta prueba consiste en determinar la glucemia tras un ayuno de 10-16h). En general se considera que: • Valores menores de 110 mg/dL son normales. • Valores entre 110 y 140 mg/dL son dudosos y deben ser confirmados. • Valores mayores de 140 mg/dL son probablemente indicativos de diabetes. 3. Pruebas de sobrecarga: curva de glucemia y test de O´Sullivan 2 3.1. Curva de glucemia Esta prueba se realiza para comprobar definitivamente el diagnóstico de la diabetes y es obligatoria cuando la glucemia basal es dudosa. Consiste en la medición de la glucemia en ayuno y a intervalos regulares tras una sobrecarga de glucosa. Concretamente hay que considerar los siguientes aspectos: • Durante los tres días previos a la prueba el paciente debe tener una dieta sin restricción en hidratos de carbono (de al menos 150g de hidratos de carbono/día). • Se realiza por la mañana, después de 10-16h de ayuno. • Se obtiene una muestra de sangre en la que se determinará la glucemia basal. • Se administra (vía oral) al paciente 75g de glucosa disueltos en saborizante. (en niños la dosis se ajusta en función de su peso 1.75g glucosa/Kg) • Se extrae sangre cada 30 minutos durante 2h (puede variar en función del protocolo) para evaluar la modificación de la glucemia a lo largo del tiempo. • Cualquier nausea o vómito debe ser anotado. En la imagen inferior se han representado 2 curvas correspondientes a un paciente sano, diabético y con disminución de tolerancia a la glucosa. En un paciente sano: en ningún momento se superan los 200mg/dL En un paciente diabético: la glucemia a las 2 horas es superior a 200 mg/dL y al menos otro valor intermedio es también superior a 200 mg/dL. En un paciente con tolerancia anormal a la glucosa: • la glucemia basal es inferior a 140mg/dL • en la curva de glucemia el punto final es superior o igual a 140 mg/dL pero inferior a 200 mg/dL, pero algún punto intermedio es superior a 200 mg/dL. 3 3.2. Test de O´Sullivan Esta prueba se realiza rutinariamente en mujeres embarazadas (aproximadamente a las 23 semanas de gestación) como screening inicial para detectar diabéticas gestacionales. Consiste en determinar la glucemia basal y 1 hora tras la ingestión, vía oral, de 50g de glucosa disueltos en saborizante. Si la glucemia tras 1 hora supera los 140mg/dL es posible que exista diabetes gestacional aunque es imprescindible realizar una curva de glucemia para confirmar el diagnóstico. 4. Determinación de glucosa: métodos. De todo lo anterior se deduce que para el diagnóstico de la diabetes es necesario determinar la glucemia, pero ¿cómo se cuantifica el nivel de glucosa en una muestra? Los métodos para determinar la concentración de glucosa se clasifican en dos grandes grupos: a) Métodos basados en el poder reductor de los hidratos de carbono (reacción de Benedict, método de la o-toluidina) b) Métodos enzimáticos: son los más utilizados, utilizan enzimas como reactivos (ej. glucosa oxidasa, hexoquinasa) a fin de aumentar la especificidad. Los dos métodos que vamos a citar se pueden utilizar para determinar la glucosa en muestras de suero, orina y líquido cefalorraquídeo b.1.) Método de la hexoquinasa: Es el método de referencia y consiste en dos reacciones acopladas. En la primera reacción (específica), catalizada por la enzima hexoquinasa, se fosforila la glucosa formándose glucosa 6-fosfato. La glucosa 6-fosfato, en una reacción posterior (reacción indicadora), se transforma en 6-fosfogluconato produciéndose NADPH (1 mol por cada molécula de glucosa). La producción de NADPH origina un aumento de absorbancia a 340nm. El incremento de absorbancia a esta longitud de onda será directamente proporcional a la concentración de glucosa. 4 b.2.) Método de la glucosa oxidasa: Al igual que el anterior consiste en dos reacciones acopladas En la primera reacción (reacción específica), catalizada por la enzima glucosa oxidasa (GOD), se oxida la glucosa y se genera H2O2 . En la segunda reacción (reacción indicadora), la enzima peroxidasa (POD) cataliza la descomposición del H2 O2 lo que provoca oxidación de un cromógeno que pasa de su forma reducida (incolora) a su forma oxidada (coloreada). La aparición del cromógeno oxidado se evalúa mediante un espectrofotómetro y será directamente proporcional a la concentración de glucosa en la muestra. Este método (GOD/POD) presenta como desventaja que muchos compuestos presentes en el suero u orina (bilirrubina, ácido ascórbico y ácido úrico) pueden ser oxidados por el H2 O2 producido en la reacción catalizada por la enzima GOD y por tanto interfieren en el resultado (se da un resultado superior al real). También se puede cuantificar la concentración de glucosa de la muestra utilizando sólo la primera reacción y evaluando la cantidad de oxígeno consumido mediante un electrodo de oxígeno (lo estudiaremos más adelante). La cantidad de glucosa en la muestra es directamente proporcional a la cantidad de oxígeno consumido. Aspectos prácticos a considerar cuando se analiza la glucemia: 1. Centrifugar la sangre lo antes posible: los eritrocitos y leucocitos consumen glucosa, por tanto , si el contacto con las células es prolongado se pueden dar resultados falsamente bajos (a Tª ambiente puede incluso desaparecer al cabo de 6h). Actualmente, existen tubos con separador de suero que funciona como una interfase entre las células y el suero después de la centrifugación, haciendo que no sea necesario separar el suero en otro tubo. 2. Si no se van a analizar inmediatamente, se puede refrigerar la muestra o añadir un conservante ej. Fluoruro sódico. 3. La concentración de glucosa en suero refrigerado es estable durante 3 días. 5. Otras pruebas: análisis de proteínas glicosiladas, péptido C, insulinemia y determinación de cuerpos cetónicos, glucosuria. 5.1. Análisis de proteínas glicosiladas Las proteínas que están en contacto con concentraciones elevadas de glucosa durante un tiempo prolongado se glucosilan (unión covalente de glucosa a las proteínas) generando proteínas glicosiladas o glucosiladas. 5 La glucosilación depende de la concentración de glucosa y de la vida media de las proteínas. Puesto que la hiperglucemia es característica de la diabetes, la determinación de proteínas glucosiladas se utiliza como indicador restrospectivo del control de la diabetes. En el laboratorio clínico se suelen analizar la glucohemoglobina y fructosamina. 5.1.1. Glucohemoglobina La glucohemoglobina es una fracció n de hemoglobina A (principalmente A1C ) unida, de forma irreversible a la glucosa, que representa, en condiciones fisiológicas un 6-8% de la hemoglobina total. La vida media de la hemoglobina es de aproximadamente 2 meses, por tanto su cuantificación nos puede indicar el cumplimiento del tratamiento o el grado de control de la diabetes durante ese período de tiempo (la elevación de glucohemoglobina coincide con elevaciones de la glucemia en los dos meses anteriores). Es una prueba muy específica pero que no se utiliza para el diagnóstico puesto que es poco sensible. Los valores de personas sanas se solapan con los de aquellos que tienen intolerancia a la glucosa y los de éstos con los de los pacientes diabéticos. En general valores superiores al 12% indican un control deficiente de la diabetes. La determinación se suele hacer con bemolizado de eritrocitos, para ello: 1. La sangre se recoge con EDTA como anticoagulante. 2. Se centrifuga (ej. 5 min a 3000 rpm) 3. El sedimento (pellet) se resuspende en solución salina (ClNa 0.9%) y se vuelve a centrifugar. Este paso se repite varias veces (se “lava” el sedimento). 4. Se lisan los eritrocitos ej. se añade agua destilada y cloroformo se agita enérgicamente y se centrifuga de nuevo. El sobrenadante es el bemolizado de eritrocitos. Los métodos de determinación más utilizados son: 1. Métodos cromatográficos (HPLC, cromatografía de intercambio iónico, cromatografía de afinidad…). Ver el apéndice del tema 2. Métodos inmunológicos con lectura por turbidimetría (se estudiará en el tema siguiente). 3. Electroforesis (se estudiará en el tema siguiente). 5.1.2. Fructosamina Las proteínas plasmáticas también se glican y, puesto que la vida media de la albúmina y proteínas plasmáticas oscila entre 17 y 30 días, su determinación nos informa de la tasa de glucemia del paciente en las 2-3 semanas previas a la determinación (período más corto que la glucohemoglobina). Puesto que la albúmina es, con diferencia, la proteína sérica más abundante realmente se evalúa la albúmina glucosilada. 6 Método de determinación: método colorimétrico (espectrofotométrico) basado en la reducción del colorante nitroazul de tetrazolio (por acción de la fructosamina). Fructosamina + nitroazul de tetrazolio reducción del colorante Lectura en espectrofotómetro (530nm) 5.2. Péptido C El péptido C es el resto de cadena polipeptídica que se escinde de la proinsulina al convertirse en insulina. Su aparición en sangre nos indica que las células secretoras de insulina son funcionales. Puesto que los preparados comerciales de insulina no llevan péptido C, permite conocer por ej. si una hiperinsulinemia es de origen exógeno o endógeno . Además, es frecuente que los pacientes diabéticos desarrollen anticuerpos antiinsulínicos que interfieren en los ensayos inmunológicos para la cuantificación de insulina, por tanto, se utiliza como alternativa al análisis de insulina para valorar el funcionamiento de las células ß. Método de determinación: Inmunoanálisis (lo adelante en el tema) ej. RIA (radioinmunoanálisis). estudiaremos más 5.3. Insulinemia La determinación de insulina no suele hacerse de forma habitual puesto que su presencia no asegura que ésta sea funcional. Sin embargo, sí es útil en las hipoglucemias (ej. insulinemia elevada cuando la glucemia es baja puede indicar la existencia de un tumor productor de insulina). Método de determinación: Inmunoanálisis (lo estudiaremos adelante en el tema) ej. RIA o EIA (enzimoinmunoanálisis). más 5.4. Determinación de cuerpos cetónicos En la diabetes, la deficiencia de glucosa en las células, activa el catabolismo de los ácidos grasos generando mucha acetilCoA. El exceso de acetilCoA da lugar a la producción de cuerpos cetónicos (cetogénesis): acetoacético, y sus derivados acetona y ß-hidroxibutirato que aparecerán en sangre (cetonemia) y orina (cetonuria). Cetonemia Diabetes Lipólisis Acidos grasos Cetogénesis Cetonuria Es una prueba complementaria que corrobora el diagnóstico de la diabetes tipo I. Determinación: Aunque existen otros métodos (ej. enzimáticos), el más empleado es su determinación colorimétrica mediante la prueba del nitrofrerricianuro de 7 sodio. Este procedimiento no detecta ß-hidroxibutirato y es mucho menos sensible para la acetona que para acetoacético. El fundamento de este método consiste la aparición de un color rosado o purpúreo al reaccionar, fundamentalmente el acetoacético, con ferricianuro de sodio en medio alcalino. La prueba se puede llevar a cabo con una tira reactiva o una tableta sólida. Muestra: suero, plasma u orina. Precauciones: • Las orinas coloreadas o las muestras hemolizadas pueden dar falsos negativos. • La contaminación bacteriana de la orina aumenta la desaparición. • La acetona es volátil por tanto, la muestra debe refrigerarse. 5.5. Glucosuria La glucosa se filtra en el glomérulo pero es reabsorbida en los túmulos renales con lo que vuelve de nuevo a la sangre y no debe aparecer en orina. Sin embargo, si la glucemia es superior a 160mg/dL se supera el umbral renal para la glucosa y ésta aparece en la orina (glucosuria). La glucosuria tiene escaso valor puesto que es poco específica ej. también aparece en patologías cardiacas o renales Determinación: se utiliza el método GOD/POD en tiras reactivas. 8 Apéndice CROMATOGRAFíA La cromatografía agrupa un importante grupo de técnicas que permiten separar componentes de mezclas complejas. En todas las separaciones cromatográficas la muestra que se desea separar se disuelve en la "fase móvil" que normalmente está formada por un gas o un líquido. La fase móvil se hace pasar a través de una "una fase estacionaria", la cual se mantiene fija en una columna o en una superficie sólida que actúa como soporte. NOTA: Fase móvil: aquella en la cual están los solutos que se van a separar Fase estacionaria: lecho a través del que fluye la fase móvil Los componentes fuertemente retenidos por la fase estacionaria se mueven lentamente con el flujo de la fase móvil. Los componentes con baja afinidad por la fase estacionaria se desplazan con más rapidez al ser arrastrados por la fase móvil. Una vez que todos los componentes han atravesado la fase estacionaria, salen separados unos de otros lo que permite utilizar las fracciones en procesos de identificación o cuantificación. FASES DEL PROCESO CROMATOGRÁFICO 1. Preparación de la fase estacionaria 2. Introducción de la muestra vehiculada por una fase móvil 3. Paso a través de una fase estacionaria donde se producen las interacciones que más tarde llevarán a su separación 4. Elución (según en que técnica) 5. Lectura de los resultados para obtener el cromatograma MECANISMOS IMPLICADOS 1. Adsorción 2. Reparto 3. Intercambio iónico 4. Exclusión molecular 5. Afinidad Cromatografía de adsorción: poco usada en clínica Cromatografia de reparto: basada en las diferencias de solubilidad de las distintos analitos en dos fases inmiscibles Ejemplo: cromatografía en capa fina (ver la figura): • Sobre un cristal u otra superficie se deposita una suspensión uniforme de partículas (ej gel de sílice) que más tarde se seca y activa. En dicha placa se aplica la muestra y se deja secar. • Se introduce la placa en una cámara en cuyo fondo hay un disolvente que va subiendo por capilaridad y arrastrará a los componentes de la mezcla en función de la solubilidad de los mismos en la fase móvil. • Se deja hasta que el frente llegue al final 9 • Los resultados se visualizan por ejemplo por tinción con colorantes. Aparecerán unas manchas que se pueden identificar mediante el uso de patrones o cuantificar mediante densitometría o raspado de las manchas, disolución y determinación espectrofotométrica. Cromatografia de intercambio iónico: basada en un mecanismo electrostático por atracción entre iones de distinta carga. En el laboratorio clínico se utiliza en analizadores de aminoácidos, separación de Hb, isoenzimas y esteroides. Cromatografia de exclusión molecular: basadas en la diferencia de tamaño de las distintas sustancias a separar. En clínica se utiliza para purificaciones ej de hormonas. 10 Cromatografia de afinidad: basada en mecanismos que implican interacciones específicas entre dos moléculas como uniones enzimasustrato, hormona-receptor, antígeno-anticuerpo. HPLC o cromatografía líquida de alta presión (resolución): es un sistema de cromatografía en columna (la fase estacionaria se deposita en una columna) con un sistema inyector de la muestra y un impulsor de la fase móvil que acelera el proceso Preguntas de revisión a) Espectrofotometría 1. ¿Qué expresión matemática define la relación entre la concentración de una sustancia y su absorbancia? 11 2. Para trabajar en la zona UV por debajo de 320 nm se precisan cubetas de: a) Vidrio b) Poliestireno c) Polietileno d) Cuarzo e) Plástico 3. Un blanco de suero se emplea: a) Cuando tenemos prisa b) Cuando queremos eliminar interferencias por el reactivo c) Cuando queremos eliminar interferencias por el suero d) Cuando queremos eliminar interferencias de la fuente de luz e) Cuando hay que hacer una curva de calibración 4. Un blanco de reactivo se emplea: a) Cuando tenemos prisa b) Cuando queremos eliminar interferencias por el reactivo c) Cuando queremos eliminar interferencias por el suero d) Cuando queremos eliminar interferencias de la fuente de luz e) Cuando hay que hacer una curva de calibración 5. Desviaciones de la ley de Beer (desviaciones en la relación lineal entre concentración de una solución y absorbancia) se producen cuando: a) Se miden concentraciones muy elevadas de cromógeno b) La radiación incidente no es monocromática c) La luz es transmitida por otros mecanismos d) La cubeta está sucia e) Todos los anteriores 6. La curva de calibración: a) Describe la relación entre transmitancia y absorbancia b) Describe la relación entre absorbancia y concentración c) Describe la relación absorbancia y velocidad de reacción d) b y c son correctas 7. La longitud de onda a la que se mide una reacción es: a) Aquella a la que el cromógeno tienen menos absorción b) Aquella a la que el cromógeno tiene el máximo de absorción. c) Aquella a la que la lámpara da más luz. d) Aquella a la que se lee más deprisa 8. Construya una curva de calibración para una técnica de determinación de glucosa en suero con los siguientes datos: A Concentración (mg/dl) 0.05 50 0.1 100 0.150 150 0.250 250 0.500 500 0.600 800 A partir de ella: a) Calcule la concentración de glucosa en un suero que da una lectura de 0.125 b)¿Qué haría con un suero que diera una lectura de 0.7? ¿Interpolaría la lectura sin más o lo diluirías? 12 c) ¿Cuál se consideraría el limite de linealidad con arreglo a esta curva de calibración? ¿Por qué? 9. Vamos a hacer una determinación de glucosa en sangre, y para ello recurrimos al empleo de una solución estándar de glucosa de concentración 100mg/dl. Una vez llevada a cabo la lectura obtenemos los siguientes datos: Absorbancia del estándar: 0,2 Absobancia del problema-1: 0,4 Absorbancia del problema-2: 0,8 Absorbancia del problema-3: 1,5 a) Con estos datos, calcular las concentraciones que tendrían los tres sueros problema. b) Sabiendo que el límite de linealidad de la técnica es de 600mg/dl ¿habría que diluir alguna muestra y repetir la determinación? ¿Cuáles diluiría y qué factores de dilución emplearía? ¿Por qué? c) Diluimos la muestra número tres al 1/5, y repetimos la determinación. Ahora, la lectura que obtenemos es de 0,320 ¿Cuál será la concentración real de glucosa en ese suero? b) Otros contenidos teóricos del tema 1. Al hacer una determinación de glucosa es conveniente separar la células lo antes posible ¿por qué? ¿qué tipo de error cometeríamos si no lo hiciéramos? 2. Un paciente tiene una glucemia basal de 120mg/dl ¿Qué prueba llevaría a cabo para confirmar una posible diabetes? ¿Cómo realizaría dicha prueba? 3. ¿Cuáles son los dos métodos enzimáticos más utilizados para la determinación de glucosa en una muestra de suero? 4. ¿Qué utilidad tiene la cuantificación de proteínas glicosiladas? 5. ¿Cuáles son las dos determinaciones de proteínas glicosiladas más utilizadas en el laboratorio clínico? 6. Cite algún método para analizar hemoglobina glicosilada 7. En los métodos anteriores ¿Qué se utiliza como muestra? a) Suero b) Plasma c) Sangre completa d) Hemolizado de eritrocitos 8. ¿Cómo se llama la presencia de cuerpos cetónicos en orina? ¿Cómo se determinan habitualmente? a) Por cromatografía de afinidad b) Mediante espectrofotometría c) Mediante electroforesis d) Mediante inmunodifusión 9. Hemos determinado la glucosa en una muestra de orina recibida en el laboratorio por medio de dos técnicas: a) método de Benedict b) método GOD/POD. Los resultados obtenidos han sido: a) 200 mg/dL, b) 150mg/dL. ¿A qué puede ser debida la disparidad de ambos valores. 10. ¿Qué determinaciones harías a un paciente que llega al laboratorio para controlarse? 11. ¿Qué determinaciones harías a un paciente para diagnosticar una diabetes? 13 12. A un paciente le han solicitado una determinación de hemoglobina glicada para averiguar si tiene diabetes ¿Es correcta la petición? ¿Por qué? 13. A las cinco de la tarde llega una muestra de sangre al laboratorio que se extrajo a las ocho de la mañana, para determinar la glucosa, y que se había dejado olvidada encima de la mesa desde entonces. ¿Qué debemos hacer? ¿Por qué? 14. Un paciente viene al laboratorio para hacerse un análisis de glucosa, y nos explica que ha desayunado hace 20 minutos ¿Qué debemos hacer? ¿Por qué? 14