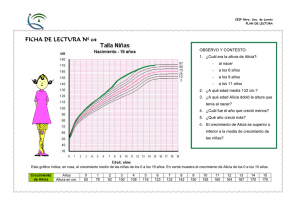
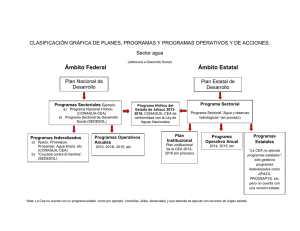
Balanceo de ecuaciones, Molécula gramo y mol
Anuncio

Balanceo de ecuaciones, Molécula gramo y mol M. en C. Alicia Cea Bonilla Coordinadora de Enseñanza de Bioquímica y Biología Molecular. Fac. de Medicina. UNAM Junio 2007 M. en C. Alicia Cea Bonilla Todos los derechos reservados 1 Balanceo de ecuaciones químicas • De acuerdo con la Ley de conservación de la • masa, debe existir el mismo número de átomos en el lado de los productos que del lado de los reactantes en una ecuación química, es decir, debe haber la misma masa total de productos que de reactantes. El proceso por el que se logra esto se conoce como Balanceo de ecuaciones Existen algunas reglas para balancear ecuaciones: Junio 2007 M. en C. Alicia Cea Bonilla Todos los derechos reservados 2 • 1. Escribir correctamente las fórmulas químicas de • • • • reactantes y productos. Al balancear, sólo cambiarán los coeficientes de dichas fórmulas. 2. Dejar el coeficiente de 1 al compuesto de fórmula más complicada. 3. Balancear cada elemento, dejando el oxígeno al final. 4. Los iones poliatómicos se tratan como una sola unidad, si no sufren cambios en la reacción Si la ecuación parece balanceada, verificar cada elemento. • Existen algunos métodos que ayudan a realizar el balanceo: uno es el de “tanteo” y otro, bastante seguro, es el del empleo de los números de oxidación en el caso de las reacciones de óxido-reducción Junio 2007 M. en C. Alicia Cea Bonilla Todos los derechos reservados 3 Reacciones de óxido-reducción • Las reacciones en las que se transfieren electrones de un • • • • • átomo a otro se llaman de óxido-reducción o redox. La oxidación es la pérdida de electrones por un átomo La reducción es la ganancia de electrones por un átomo. Ambos procesos son complementarios El elemento que gana electrones se llama agente oxidante y se reduce. El elemento que pierde electrones se llama agente reductor y a vez, se oxida. • Como el número total de electrones ganados debe ser igual al de los perdidos, el emplear los números de oxidación resulta una herramienta para balancear ecuaciones químicas. Junio 2007 M. en C. Alicia Cea Bonilla Todos los derechos reservados 4 Reglas para balancear empleando el número de oxidación • 1. Escribir las fórmulas de reactantes y • • • productos. 2. Indicar el número de oxidación de cada elemento y determinar cuáles elementos cambian de número de oxidación. 3. Escribir ecuaciones en las que se determine los elementos que ganaron o perdieron electrones, indicando cuántos fueron en cada caso. Buscar los coeficientes necesarios para hacer que el número de electrones ganados sea igual al de los perdidos. 4. Balancear las partes restantes de la ecuación y verificar. Junio 2007 M. en C. Alicia Cea Bonilla Todos los derechos reservados 5 Junio 2007 M. en C. Alicia Cea Bonilla Todos los derechos reservados 6 • Un mol es el número de átomos que • El mol existen en 12 g de C-12 y corresponde a 6.023 x 10 23 átomos (Número de Avogadro). Un mol de unidades corresponde al número de Avogadro de partículas, sean átomos, moléculas, iones, electrones, etc. El peso de un mol de átomos de un elemento es exactamente igual a su peso atómico expresado en gramos. Un mol de cualquier sustancia tendrá una masa igual al peso fórmula (entendido como la suma de los pesos atómicos de los átomos que forman dicha sustancia) expresado en gramos. M. en C. Alicia Cea Bonilla - Junio 2007 Todos los derechos reservados 7 Peso fórmula Junio 2007 M. en C. Alicia Cea Bonilla Todos los derechos reservados 8 Cálculo del número de moles • Nº de moles = gramos de la sustancia peso fórmula de la sustancia Junio 2007 M. en C. Alicia Cea Bonilla Todos los derechos reservados 9