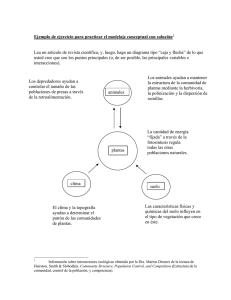
herbivoría en dos especies arbóreas nativas en - Eco
Anuncio

UNIVERSIDAD AUTÓNOMA DEL ESTADO DE MORELOS FACULTAD DE CIENCIAS BIOLÓGICAS HERBIVORÍA EN DOS ESPECIES ARBÓREAS NATIVAS EN PLANTACIONES DE RESTAURACIÓN ECOLÓGICA, EN LA SELVA TROPICAL DE LOS TUXTLAS, VERACRUZ, MÉXICO. TESIS PROFESIONAL QUE PARA OBTENER EL TITULO DE: B I O P R E L S O E N G O T A: JOSÉ FLAVIO MÁRQUEZ TORRES DIRECTORA: DRA. CRISTINA MARTÍNEZ-GARZA CUERNAVACA, MORELOS ABRIL, 2013 Porque ahora el caballero era el arroyo. Era la luna. Era el sol. Podía ser todas las cosas a la vez, y más, porque era uno con el universo. Era amor Robert Fisher “El Caballero De La Armadura Oxidada” 2 AGRADEZCO: A mis padres Teresa Torres Maldonado y Flavio Márquez Mateos, que me han brindado incondicionalmente su apoyo, empuje y cariño para ser una mejor persona. Los quiero mucho jefiñes. A la National Science Foundation de Estados Unidos (NSF-DEB # 0516259), 2005-2010. Por el apoyo financiero otorgado a la Dra. Cristina Martínez Garza. Que sin él no hubiera sido posible la realización de este y de varios trabajos más. A la Dra. Cristina Martínez-Garza, el poder darme la oportunidad de ser parte de su equipo de trabajo y el apoyo y dedicación que me brindo para elaborar esta tesis. Al Programa de Mejoramiento del Profesorado (PROMEP UAEMOR-CA-56), el apoyo financiero otorgado al Cuerpo Académico de Ecología Evolutiva. A mis sínodos, Dra. Marcela Osorio Beristain, M. en C. Patricia Valentina Carrasco, Dr. Alejandro Flores Palacios y al Dr. Raúl Ernesto Alcalá por todas las aportaciones y comentarios que hicieron a este trabajo. Al personal de la Estación de Biología Tropical de Los Tuxtlas, las atenciones otorgadas para la estancia y el trabajo de campo. Al Centro de Investigación en Biodiversidad y Conservación (CIByC), en especial a todos los del Departamento de Ecología Evolutiva. A mi amigo Eladio Velazco, su ayuda en la colecta de hojas y transmitirme parte de su conocimiento en el campo. 3 A la M. en C. Luz María Ayestarán (Técnico del Departamento de Ecología Evolutiva) y a la Biól. Alondra Nicolás Medina, su ayuda y sus comentarios para este trabajo. Prometo ya no preguntarte mucho Alo. A todos mis compañeros de laboratorio Miriam Montes de Oca, Leslie Alba, Lidia Gamboa, Iris Baeza e Israel Valencia, las buenas salidas de campo a Sierra de Huautla, y sus comentarios para mejorar mi trabajo. A mis hermanas Fabiola, Nallely y Mayra su comprensión y apoyo en todo momento, gracias, las quiero mucho. A mis amigos Gerardo y David, su gran amistad y compañerismo, no olvidare los buenos ratos que vivimos juntos. A todos los profesores de la Facultad de Ciencias Biológicas, su contribución a mi formación académica. Finalmente, quiero agradecer a todas las personas que han formado parte en alguna etapa de mi vida. Citar como: Marquez-Torres, José Flavio, 2013. Herbivoría en dos especies arbóreas nativas en plantaciones de restauración ecológica, en la selva tropical de Los Tuxtlas, Veracruz, México. Tesis de Licenciatura, Facultad de Ciencias Biológicas, Universidad Autónoma del Estado de Morelos. Cuernavaca, Morelos, México. 66 pp. 4 ÍNDICE GENERAL Índice de tablas __________________________________________________________ 6 Índice de figuras _________________________________________________________ 7 Índice de apéndices _______________________________________________________ 8 Resumen _______________________________________________________________ 9 Abstract _______________________________________________________________ 10 Introducción ___________________________________________________________ 11 Antecedentes ___________________________________________________________ 13 Objetivo general ________________________________________________________ 19 Objetivos específicos ___________________________________________________ 19 Hipótesis especificas _____________________________________________________ 20 Métodos _______________________________________________________________ 21 Sitio de estudio ________________________________________________________ 21 Diseño experimental ____________________________________________________ 23 Especies de estudio _____________________________________________________ 26 Selección de los individuos_______________________________________________ 28 Colecta de las hojas_____________________________________________________ 29 Estimación de la herbivoría ______________________________________________ 31 Análisis estadísticos ____________________________________________________ 32 Resultados _____________________________________________________________ 34 Discusión ______________________________________________________________ 39 Conclusiones. ___________________________________________________________ 47 Literatura citada ________________________________________________________ 48 Apéndices______________________________________________________________ 61 5 Índice de tablas Tabla 1. Familia, historia de vida y síndrome de dispersión de 24 especies de árboles nativos plantados en 16 parcelas de restauración ecológica experimental en junio del 2006 Los Tuxtlas, Veracruz, México.………...…………………...………………………...…...24 Tabla 2. Nombre científico, familia, nombre común, altura, usos, datos fenológicos, características foliares, mecanismo de dispersión y tasa de crecimiento de Cedrela odorata L. e Inga sinacae M. Sousa. (Sousa, 1993; Vázquez-Torres et al., 2010; Martínez-Garza et al., 2013).......................................................……………………...….................................27 Tabla 3. Estudios de herbivoría en especies con historia de vida contrastante. Se muestra el ecosistema, país, hábitat, el número de especies utilizadas para el estudio o en su caso la especie y el porcentaje neto, la tasa o el índice de herbivoría ± el error estándar………....42 6 Índice de figuras Figura 1. Localización de la región de Los Tuxtlas en el estado de Veracruz, México. Se muestra la ubicación de la Estación de Biología Tropical de los Tuxtlas (EBTLT) (Gónzales-Soriano et al., 1997)……………………………………………………………22 Figura 2. Diseño experimental de las plantaciones de restauración: (A) son las áreas excluidas plantadas con especies dispersadas por animales, (V) las dispersadas por viento y (C) los controles. (Tomado de de la Peña-Domene,, 2010………………………………...25 Figura 3. Hojas de Cedrela odorata………………………………………….....................30 Figura 4. Hojas de Inga sinacae…………………………………………………………...30 Figura 5. Herbivoría (arco seno √ proporción de herbivoría + 0.1) en Inga sinacae y Cedrela odorata en Los Tuxtlas, Veracruz, México. Las líneas representan el intervalo de confianza al 95%……………………….…………………………………………………..36 Figura 6. Herbivoría (arco seno √ proporción de herbivoría + 0.1) en los individuos de Inga sinacae y Cedrela odorata creciendo en plantaciones experimentales de restauración ecológica y dentro de la selva madura en Los Tuxtlas, Veracruz, México. Las líneas representan el intervalo de confianza al 95%……..………………………………………..37 Figura 7. Herbivoría (arco seno √ proporción de herbivoría +0.1) en Inga sinacae y Cedrela odorata en junio, agosto y octubre en Los Tuxtlas, Veracruz, México. Las líneas representan el intervalo de confianza al 95%. Las letras diferentes representan diferencias significativas evaluadas con la prueba post Hoc de Tukey………………………………...38 Figura 8. Herbivoría (arco seno √ proporción de herbivoría + 0.1) en Inga sinacae y Cedrela odorata durante junio, agosto y octubre en Los Tuxtlas, Veracruz, México. El estadístico muestra la interacción tiempo * especie. Las líneas representan el intervalo de confianza al 95%. Las letras diferentes representan diferencias significativas evaluadas con la prueba post Hoc de Tukey………………………….……………………………………39 7 Índice de apéndices Apéndice 1. Regresión lineal múltiple entre área-largo-ancho de Cedrela odorata. El eje X es el ancho en cm, el eje Y es el largo en cm, y el eje Z es el área en cm2………………...61 Apéndice 2. Regresión lineal múltiple entre área-largo-ancho de Inga sinacae. El eje X es el ancho en cm, el eje Y es el largo en cm, y el eje Z es el área en cm2…………………...62 Apéndice 3. Resultado de ANOVA de medidas repetidas con dos factores independientes: la especie y el hábitat. Como variable dependiente se tomó la herbivoría de los tres muestreos (Junio, Agosto y Octubre). Resaltan en negritas los resultados significativos (P < 0.05)………………………………………………………………………………………..63 Apéndice 4. Herbivoría (arco seno √ proporción de herbivoría + 0.1) en los individuos de Inga sinacae y Cedrela odorata creciendo en plantaciones experimentales de restauración ecológica y dentro de la selva madura en Los Tuxtlas, Veracruz, México. El estadístico muestra la interacción especie * hábitat. Las líneas representan el intervalo de confianza al 95%………………………………………………………………………………………...64 Apéndice 5. Herbivoría (arco seno √ proporción de herbivoría + 0.1) en los individuos de Inga sinacae y Cedrela odorata creciendo en plantaciones experimentales de restauración ecológica y dentro de la selva madura durante junio, agosto y octubre en Los Tuxtlas, Veracruz, México. El estadístico muestra la interacción tiempo * hábitat. Las líneas representan el intervalo de confianza al 95%………………………………………………65 Apéndice 6. Herbivoría (arco seno √ proporción de herbivoría + 0.1) en los individuos de Inga sinacae y Cedrela odorata creciendo en plantaciones experimentales de restauración ecológica y dentro de la selva madura durante junio, agosto y octubre en Los Tuxtla, Veracruz, México. El estadístico muestra la interacción tiempo * especie * hábitat. Las líneas representan el intervalo de confianza al 95%…………………………………...…..66 8 Resumen Debido a la problemática que enfrentan los ecosistemas por la deforestación y la fragmentación del hábitat, surge la ecología de la restauración. La finalidad de las plantaciones de restauración ecológica no solo se restringe a recuperar la cobertura vegetal, sino también a restaurar las interacciones bióticas. Las selvas tropicales presentan una explosión de interacciones donde resaltan las antagónicas entre plantas y animales, como lo es la herbivoría. De acuerdo con sus características de historia de vida podemos agrupar a las plantas en pioneras, que por lo general reciben mayor daño por herbívoros y en no pioneras. Se comparó la herbivoría en individuos de una especie pionera (Cedrela odorata, Meliaceae) y una no pionera (Inga sinacae, Fabaceae) creciendo en la selva y en plantaciones mixtas de 24 especies con cinco años de edad en la Reserva de la Biosfera Los Tuxtlas, Veracruz, México. Para evaluar la herbivoría en estos dos hábitats se colectaron hojas durante junio, agosto y octubre del 2011. La herbivoría fue cuatro veces mayor en Inga (8.40 ± 0.83%) que en Cedrela (2.09 ± 0.16%), siendo estadísticamente diferente (F (1, 23) = 57.1, P < 0.00001). La herbivoría fue mayor en los individuos creciendo en las plantaciones (5.77 ± 0.62%) que en aquellos creciendo en la selva (4.71 ± 0.67%), aunque las diferencias no fueron estadísticamente significativas (F (1, 23) = 0.28, P > 0.41). Contrario a nuestras hipótesis, la pionera Cedrela, fue la que presento un menor daño, probablemente debido a la producción de metabolitos secundarios que son defensa contra los herbívoros. Al tener valores similares de herbivoría en los dos hábitats, encontramos que esta interacción podría ya haberse recuperado en las plantaciones de restauración ecológica de solo cinco años de establecimiento, sin embargo es necesario investigar la similitud de la comunidad de herbívoros de cada hábitat. 9 Abstract Due to the problems that the ecosystems face because of the deforestation and the fragmentation of the habitat, restoration ecology has arisen. Restoration plantings have, as a goal, not only to recover vegetation but also the biotic interactions. Tropical rainforests show an explosion of interactions where the antagonistic between plants and animals, as herbivory, are the most important. Plants are classified as pioneers, which receive the highest damage by the herbivores compared to no-pioneers. I evaluated the herbivory in a pioneer (Cedrela odorata, Meliaceae) and a non-pioneer (Inga sinacae, Fabaceae) growing in the rainforest and in 5-years old restoration plantings of 24 species in the Biosphere Reserve of Los Tuxtlas, Veracruz, Mexico. To evaluate herbivory in these two habitats, leaves were collected during June, August and October of 2011. Herbivory was four times higher in Inga (8.40 ± 0.83%) than in Cedrela (2.09 ± 0.16%) and it was statistically different (F (1, 23) = 57.1, P < 0.00001). Also, herbivory was higher in individuals growing in the restoration plantings (5.77 ± 0.62%) than those growing within the rainforest (4.71 ± 0.67%) although these were not statistically different (F (1, 23) = 0.28, P > 0.41). Contrary to my hypothesis, the pioneer Cedrela showed lower herbivory due to the production of secondary metabolites used for defense against the herbivorous. There was similar herbivory in the two habitats, therefore this interaction seems to be recovered in the restoration plantings after five years of establishment. Nevertheless it is necessary to evaluate the similarity between the herbivorous communities in each habitat. 10 Introducción Las selvas húmedas también llamadas selvas altas perennifolias (sensu Miranda y Hernández-X., 1963), bosques tropicales perennifolios (sensu Rzedowski, 1978) o tropical rain forest (sensu Richards, 1996) albergan más de la mitad del número de especies de los sistemas terrestres conocidas a nivel mundial (Wilson, 1988). Las selvas húmedas sufrieron un proceso de deforestación extenso y acelerado durante el siglo pasado (Martínez-Ramos y García-Orth, 2007) causado por el avance de las actividades agropecuarias (De Jong et al., 2000), por lo que la deforestación y la fragmentación son las principales causas de perturbación de la selva húmeda. La perturbación es un cambio explícitamente definido de un estado, conducta o trayectoria que transforma la estructura de una población, comunidad o ecosistema y cambia los recursos, la disponibilidad de sustrato y el ambiente físico (Pickett y White, 1985). Cuando la perturbación se detiene puede iniciarse el proceso de sucesión ecológica. La sucesión ecológica es el cambio temporal en la composición de especies, fisionomía de la vegetación y en las funciones de un ecosistema después de que este ha sido perturbado (Whitmore, 1978; Finegan, 1984). La sucesión se divide en dos etapas, la sucesión temprana que ocurre cuando una comunidad de plantas de corta vida (especies pioneras) llegan a colonizar un sitio; la sucesión tardía ocurre cuando se presenta el recambio de las especies pioneras por las especies no-pioneras o tolerantes (Brown y Lugo, 1990; Guariguata y Kattan, 2002). La mayoría de los ecosistemas han sido perturbados en distintos grados, y es común encontrar sitios bajo sucesión natural. 11 Para acelerar el proceso de sucesión natural o comenzarlo cuando éste se encuentra detenido, surge la restauración ecológica, que se refiere a todas las actividades para contrarrestar la fuerte transformación de los ecosistemas debido a los cambios de uso de suelo (SER, 2007). La restauración ecológica se define como la ciencia que aporta conceptos, modelos, metodologías y herramientas para recuperar los ecosistemas que han sido degradados, dañados o destruidos (SER, 2007). La meta final de la restauración es intentar que las funciones y los procesos ecológicos sean similares a los del ecosistema original (SER, 2006). El proceso natural de sucesión se puede favorecer o acelerar mediante la restauración ecológica y se busca la recuperación de la comunidad original de plantas, animales y teóricamente, sus interacciones. La herbivoría es la interacción planta-animal más frecuente en la naturaleza (Weis y Berenbaum, 1989). La herbivoría se define como un antagonismo entre el herbívoro y la planta de la que se alimenta (Crawley, 1983; Rico-Gray, 2001).Esta interacción juega un papel importante en la estructuración de la vegetación de un bosque (Harper, 1969; Janzen, 1970; Roldan, 1997), ya que es un factor que puede modificar la tasa de mortalidad y de crecimiento de las plantas (Farnsworth y Ellison, 1993; Smith, 1992). Además, la herbivoría puede influir en la riqueza de plantas, la abundancia relativa de estas, y ser componente causal de la heterogeneidad espacial (Crawley, 1983). La herbivoría se considera una fuerza selectiva fundamental en la evolución de plantas y herbívoros (Marquis, 1992). La herbivoría puede afectar negativamente el establecimiento de plantaciones de restauración ecológica (Nepstad et al., 1996). Sin embargo, la recuperación de esta interacción biótica es una indicación de que el ecosistema está funcionando. Este trabajo evaluó la herbivoría en dos especies arbóreas, una pionera y una no pionera 12 establecidas en plantaciones de restauración ecológica de 5 años de edad durante tres meses (junio, agosto y octubre) de la época de lluvias del 2011. Para valorar si esta interacción ha alcanzado en las plantaciones de restauración los niveles encontrados en el bosque continuo, se evaluó la herbivoría en individuos creciendo naturalmente en el bosque continuo. Antecedentes La deforestación, sobrexplotación e introducción de especies son causas directas de la pérdida de los ecosistemas (CONABIO, 1998). La mayor parte de los cambios ocurridos en ecosistemas terrestres se debe a 1) la conversión de la cobertura del terreno, 2) la degradación del sustrato y 3) la intensificación en el uso del suelo (Lambin, 1997). La pérdida y la fragmentación de los ambientes naturales han sido consideradas las causas principales de extinción de especies a nivel global (Brooks et al., 2002). La deforestación causada por las actividades agropecuarias ha ocasionado la pérdida de una considerable parte de las selvas tropicales, que es donde se concentran la mayor parte de la biodiversidad terrestre (Houghton, 1994; Ojima et al., 1994; Myers et al., 2000; Montagnini y Jordan, 2005). La fragmentación de la vegetación tiene como consecuencia inmediata la reducción del hábitat para las especies, lo que puede ocasionar un proceso de defaunación o la desaparición parcial o total de comunidades de algunos grupos como insectos, aves y mamíferos (Dirzo y García, 1992). La fragmentación, la deforestación y los cambios de uso de suelo son las principales causas de la perdida de los ecosistemas y la extinción de las especies. 13 La deforestación ocasiona la pérdida de funciones del ecosistema y la desaparición de los recursos naturales (Chazdon, 2003; Bawa et al., 2004). Las funciones del ecosistema se refieren a todos aquellos aspectos de la estructura del ecosistema con capacidad de generar servicios ambientales que satisfagan necesidades humanas de forma directa o indirecta (de Groot, 1992). Entre los servicios ambientales más importantes se cuenta la regulación del clima, el reciclado de nutrientes, el procesado de contaminantes, la depuración del agua, la acumulación de carbono, la polinización y la prevención contra la erosión y las inundaciones (Daily, 1997). Las funciones del ecosistema se concretizan en beneficios reales una vez que son demandados, usados o disfrutados por las personas (Gómez-Baggethun y de Groot, 2007). Por lo tanto la pérdida de los ecosistemas a causa de la deforestación, conlleva la pérdida de funciones ecológicas importantes para las comunidades humanas, como son los servicios ambientales. La selva húmeda es rica y frágil, cubre 7% de la superficie de la tierra y contiene más de la mitad de las especies terrestres descritas en el mundo (Wilson, 1988). Los datos de la FAO (1997) indicaron que en la década de 1980 se perdió aproximadamente el 8% de los bosques tropicales del mundo, y que en el periodo de 1980 a 1990 se deforestaron anualmente 15.4 millones de hectáreas de selva, de las cuales 7.4 millones de hectáreas correspondían a América Latina y el Caribe. En México se estima que para los años 70 se había perdido el 10% de la selva húmeda (Rzedowski, 1978), que en la década de 1970 y principios de la década de 1980 se deforestó el 40% de selva húmeda (FAO, 1997), y se estimó que durante la época de los 90, ya el 31% de la superficie de selva se había perdido, principalmente por el avance de actividades agropecuarias (De Jong et al., 2000). Para el estado de Veracruz se estima que en la década de 1990 casi 2.9 millones de hectáreas, que 14 corresponden al 50% de la superficie del estado, estaba convertida en potreros (BarreraBassols y Rodríguez, 1993). En el caso especifico de la región de Los Tuxtlas se estima que había 250 000 hectáreas de selva hace 60 o 70 años, sin embargo en el periodo de 1960 a 1980 se redujo a sólo 40 000 ha debido a la colonización y al desmonte con fines agrícolas, pero sobre todo ganaderos (Dirzo, 2001). La deforestación representa una perturbación o un disturbio ocasionado ya sea por las actividades agrícolas, ganaderas, agropecuarias o de colonización. Después de una perturbación o algún disturbio da comienzo la sucesión natural en sus dos etapas, la sucesión temprana caracterizada por la llegada y colonización de especies llamadas secundarias como herbáceas y arbustivas de corta vida (Finegan, 1984) y la sucesión tardía que ocurre cuando la vegetación leñosas de especies llamadas primarias, principalmente árboles, colonizan un sitio perturbado (Brown y Lugo, 1990; Guariguata y Kattan, 2002). La vegetación secundaria o pionera se define como la vegetación que surge a partir de la degradación de un bosque primario (Brown y Lugo, 1990; Smith et al., 1997). La vegetación secundaria tiene una composición muy característica y bastante bien definida que generalmente son especies de corta vida, menos de un año o de algunos cuantos años, que son sustituidas por las especies primarias con el tiempo (Gómez-Pompa, 1971). Las especies primarias o no-pioneras, se caracterizan por estar adaptadas a vivir en forma relativamente estacionaria en un lugar y por no ser desplazadas por otras especies en alrededor de 50 a 100 años. (Gómez-Pompa, 1971). En la sucesión natural ocurre un recambio de especies regido por el tiempo y por los diferentes grupos de formas de vida, que va desde las especies pioneras como hierbas, arbustos y árboles de vida corta seguidas por las especies no-pioneras que son árboles de larga vida. 15 Cuando la sucesión no comienza o está detenida, se puede intervenir para favorecerla o acelerarla mediante la restauración ecológica. La restauración ecológica incluye actividades que buscan favorecer el secuestro de carbono de la atmósfera, la recuperación de hábitat para el mantenimiento de la biodiversidad y la provisión de bienes y servicios ecosistémicos (Chazdon, 2008). La meta final de la restauración es garantizar que las funciones y los procesos ecológicos sean similares a los del ecosistema original y que estos se mantengan a través del tiempo (SER, 2006). Una de las estrategias que se llevan a cabo para restaurar los ecosistemas, son las plantaciones mixtas de árboles nativos (Lamb et al., 2005; Vázquez-Yanes et al., 1999). Las plantaciones pueden ser combinaciones de especies pioneras, no-pioneras o una mezcla de ellas, dependiendo de las condiciones iniciales del sitio (revisado en Martínez-Garza y Howe, 2003). Dado que las plantaciones de restauración incrementan inmediatamente la riqueza, además de recuperar la cobertura vegetal, también se pueden recuperar las funciones del ecosistema, como las interacciones bióticas. El proceso natural de sucesión se puede favorecer o acelerar usando plantaciones mixtas de restauración, ya que se pueden obtener tasas más rápidas de recuperación de la comunidad original de plantas, animales y teóricamente sus interacciones. Las interacciones planta-animal son de vital importancia para el funcionamiento del ecosistema. Las selvas tropicales presentan una explosión de interacciones bióticas, entre las que sobresalen las interacciones antagónicas entre plantas y animales (GutiérrezGranados y Dirzo, 2009) y entre ellas la herbivoría es la interacción de mayor impacto en las comunidades naturales (Crawley, 1983; Dirzo, 1984). En las selvas tropicales las tasas de herbivoría son más altas comparadas que las de otros ecosistemas (Janzen, 1974), se ha 16 visto en estudios anteriores que los insectos son el agente causal de la herbivoría (Crawley, 1983; Dirzo, 1987; Janzen, 1981; Sánchez-Ramos et al., 1999) como lo son las larvas de lepidópteros, junto con algunos coleópteros (Chrysomelidae) y hormigas defoliadoras (Attini) que son los herbívoros más importantes (Dirzo y Domínguez, 1995). La herbivoría es la interacción antagónica más importante en los trópicos y es causada principalmente por insectos. La herbivoría puede tener un alto costo para la planta, afectando su sobrevivencia, crecimiento y reproducción. Frente a este panorama del daño por los herbívoros, las plantas responden con un despliegue de estrategias anti-herbívoros que pueden ser químicas, biológicas o morfológicas (Ricklefs, 2000). Las defensas químicas se refieren a la producción de metabolitos secundarios como los fenoles, terpenos, alcaloides entre otros (revisado en Coley y Barone, 1996). Algunas plantas tienen defensas biológicas, como es la relación que tienen algunas hormigas con las plantas, lo que es llamado mirmecofilia. En esta relación, las hormigas proveen defensa para la planta atacando a los herbívoros que intentan alimentarse de sus tejidos, ya sea hojas, tallos, flores o brácteas (revisado en delVal y Dirzo, 2004). Otras plantas tienen defensas morfológicas o físicas, que pueden ser la presencia de espinas en los tallos, la presencia de tricomas en las hojas, la dureza de las hojas, una corteza endurecida, gruesa o suberizada y paredes celulares lignificadas (revisado en Coley y Barone 1996; Anaya 2003). Otras plantas optan por la tolerancia, que se refiere a la capacidad que tienen las plantas para compensar el tejido removido por los herbívoros (Lennartsson et al., 1998, Paige y Whitham, 1987). La herbivoría ha resultado en una fuerte presión de selección para las plantas, al hacer que estas tengan diferentes estrategias de defensa contra los herbívoros. 17 La herbivoría ocurre de forma diferencial durante la sucesión natural. Sin embargo, la dinámica sucesional de la herbivoría (Pickett et al., 1987) y la que ocurre en plantaciones de árboles nativos (Folgarait et al., 1995) ha sido raramente estudiada. Las plantas pioneras, que son las primeras en establecerse en la sucesión, están adaptadas a los hábitats ricos en recursos, tienen gran potencial para colonizar lugares abiertos o claros de selvas donde hay gran intensidad de luz, presentan tasas elevadas de crecimiento, un gran número de semillas y hojas de longevidad corta. En contraste, las especies no-pioneras, que se establecen más tarde, tienen tasas de crecimiento bajas, son tolerantes a la sombra, se establecen principalmente en el sotobosque, presentan un número bajo de semillas y presentan hojas de longevidad mayor que pueden acumular compuestos secundarios (Connell y Slatyer, 1977; Smith y Smith, 2001). Las especies pioneras muestran hasta tres veces más alta herbivoría que las no-pioneras (Coley, 1983b; Coley y Barone, 1996). Las especies pioneras reciben mayor herbivoría que las no-pioneras, entonces los ecosistemas sucesionales tempranos dominados por pioneras tendrían mayor herbivoría que los ecosistemas tardíos dominados por no-pioneras. Los ecosistemas de mayor productividad como las selvas tropicales, son los que soportan mayores niveles de herbivoría (revisado en Dirzo y Boege, 2008; GutiérrezGranados y Dirzo, 2009; Simonetti et al., 2007; Vásquez et al., 2007; McNaughton et al., 1989). Una mayor herbivoría podría ser explicada por una mayor riqueza y abundancia de herbívoros en respuesta a una mayor disponibilidad de follaje en estos ambientes (revisado en Dirzo y Boege, 2008). La herbivoría puede afectar negativamente el establecimiento de plantaciones de restauración ecológica (Nepstad et al., 1996). Sin embargo, la presencia de 18 esta interacción en sitios sucesionales tempranos puede indicar que el ecosistema ha comenzado a recuperar su funcionalidad. Por otra parte, se sabe que la herbivoria varía de acuerdo a la variación estacional en la disponibilidad de agua y tiende a ser mayor en la temporada de lluvias en comparación con la temporada de secas (Coley, 1983, Filip et al., 1995) llegando a ser hasta dos veces más alta (Coley, 1990). Coley (1983) comparó hojas maduras y jóvenes y encontro un aumento en la tasa de herbivoría en la temporada húmeda respecto a la temporada seca. De manera similar en la palma Chamaedorea radicalis la herbivoría tendió a disminuir conforme avanzó la temporada de lluvias (Sánchez-Ramos et al., 2010). La herbivoría difiere con la temporada y también puede variar dentro de la temporada. Objetivo general Evaluar la herbivoría en dos especies arbóreas con distinta historia de vida (pionera y no pionera) en la selva madura y en plantaciones de restauración de 5 años con 24 especies (16 no-pioneras y 8 pioneras). Objetivos específicos 1.- Evaluar el porcentaje de área foliar consumida en individuos juveniles del árbol pionero Cedrela odorata y del no-pionero Inga sinacae. 19 2.- Evaluar el porcentaje de herbivoría en individuos creciendo dentro de plantaciones experimentales de restauración ecológica de 5 años de edad dominadas por especies nopioneras y dentro de la selva madura. 3.- Evaluar el porcentaje de herbivoría durante tres meses de la temporada de lluvias (junio, agosto y septiembre). 4.- Evaluar la interacción de los factores antes mencionados (especie, hábitat y el mes). Hipótesis especificas 1.- El porcentaje de herbivoría es mayor en la especie pionera Cedrela odorata que en la especie no-pionera Inga sinacae. 2.- El porcentaje de herbivoría es mayor en los individuos creciendo en la selva madura que en los de las plantaciones de restauración ecológica. 3.- El porcentaje de herbivoría disminuye conforme avanza la temporada de lluvias. 4.- La mayor herbivoría la presentará la especie pionera dentro de la selva madura al principio de la época de lluvias. 20 Métodos Sitio de estudio El estudio se llevó a cabo en el ejido de la colonia ganadera Adolfo Ruiz Cortines, en la región de Los Tuxtlas, Veracruz, México. Esta región está localizada entre los 18°10’ y 18°45’ de latitud norte y entre los 94°42’y 95°27’ de longitud oeste, abarcando un área de 90 por 50 km aproximadamente (Figura 1). La Sierra de los Tuxtlas inicia a partir de los 200 m s.n.m. y se eleva hasta poco más de 1700 m. El suelo en esta zona es arenoso, clasificado como andosol. La temperatura media anual es de 27°C y la precipitación promedio es de 4900 mm al año (Martin-Del-Pozzo, 1997). La región presenta tres meses de sequía (marzo, abril y mayo), seis meses de lluvias dividiéndose en lluvias tempranas (junio - agosto) y tardías (septiembre - noviembre), y tres meses de fuertes vientos (diciembre - febrero) (Gónzales-Soriano et al., 1997). La región se encuentra conformada por un gran número de conos volcánicos, lo que contribuye a que el relieve sea escarpado (Villalpando, 1972). 21 Figura 1. Localización de la región de Los Tuxtlas en el estado de Veracruz, México. Se muestra la ubicación de la Estación de Biología Tropical de los Tuxtlas (ELT; tomado de Gónzales-Soriano et al., 1997). 22 Diseño experimental El presente estudio se llevó a cabo en una plantación experimental de restauración ecológica, que se compone de 24 parcelas establecidas en junio del 2006 en un pastizal de 12 ha aledaño a la Estación de Biología Tropical “Los Tuxtlas” (EBTLT). El sitio donde se encuentran las parcelas de restauración, presenta un gradiente altitudinal que va de 180 a 260 m s.n.m. y ha sido utilizado para la ganadería desde hace 30 años (de la Peña-Domene, 2010). Cada parcela mide 30 X 30 m, y cada parcela está dividida en 4 subparcelas que se encuentran separadas por un pasillo central de 2 m de ancho. Adicionalmente hay un pasillo de 1 m a partir de la cerca rodeando a la parcela completa. Las parcelas de restauración están cercadas con estacas vivas de Gliricidia sepium (Fabaceae) y alambre de púas a tres niveles. De las 24 parcelas de restauración, ocho fueron plantadas con 12 especies arbóreas que tienen el síndrome de dispersión por animales (4 especies pioneras y 8 no-pioneras, ocho más fueron plantadas con 12 especies que son dispersadas por viento (4 pioneras y 8 no-pioneras, y las últimas ocho parcelas son controles y en ellas no se establecieron plantaciones (Tabla 1). En cada subparcela se plantaron 36 plantas de 12 especies (pioneras y no-pioneras) distribuidas al azar, con una separación de una a la otra de 2 m. En total se sembraron 4 608 plántulas de 24 especies arbóreas (Martínez-Garza et al., 2009) (Figura 2). 23 Tabla 1. Familia, historia de vida y síndrome de dispersión de 24 especies de árboles nativos plantados en 16 parcelas de restauración ecológica experimental en junio del 2006 Los Tuxtlas, Veracruz, México. Especie Dispersión por animales Cecropia obstusifolia Ficus yoponensis Rollinia jimenezii Stemmadenia donnell-smithii Amphitecna tuxtlensis Brosimum alicastrum Cojoba arborea Dussia mexicana Guarea grandifolia Inga sinacae Poulsenia armata Pouteria sapota Dispersión por viento Ceiba pentandra Cedrela odorata Heliocarpus appendiculatus Ochroma pyramidale Albizia purpusii Aspidosperma megalocarpon Bernoullia flammea Cordia megalantha Lonchocarpus guatemalensis Platymiscium pinnatum Tabebuia guayacan Vochysia guatemalensis Familia Historia de vida Cecropiaceae Moraceae Annonaceae Apocynaceae Bignoniaceae Moraceae Mimosaceae Fabaceae Meliaceae Fabaceae Moraceae Sapotaceae Pionera Pionera Pionera Pionera No-pionera No-pionera No-pionera No-pionera No-pionera No-pionera No-pionera No-pionera Bombacaceae Meliaceae Tiliaceae Bombacaceae Mimosaceae Apocynaceae Bombacaceae Boraginaceae Fabaceae Fabaceae Bignoniaceae Vochysiaceae Pionera Pionera Pionera Pionera No-pionera No-pionera No-pionera No-pionera No-pionera No-pionera No-pionera No-pionera 24 Figura 2. Diseño experimental de 24 parcelas de restauración ecológica en Los Tuxtlas, Veracruz, México: (A) son las áreas excluidas plantadas con especies dispersadas por animales, (V) las dispersadas por viento y (C) los controles. (Tomado de la Peña-Domene, 2010). 25 Especies de estudio Las especies que se seleccionaron para este estudio fueron los árboles Cedrela odorata L. (Meliaceae) e Inga sinacae M. Sousa. (Fabaceae) (Tabla 2). Estos árboles pueden llegar a medir 35 y 22 metros de altura respectivamente, Cedrela odorata es considerada una especie pionera e Inga sinacae es considerada una especie no-pionera. Cedrela odorata es dispersada por viento mientras que Inga sinacae es dispersada por animales. Cedrela odorata tiene hojas compuestas con foliolos delgados de longevidad relativamente corta, mientras que Inga sinacae presenta hojas compuestas con foliolos gruesos que presentan una gran abundancia de tricomas y la longevidad de las hojas es relativamente larga (Sousa, 1993; Vázquez-Torres et al., 2010). La tasa de carecimiento para Cedrela odorata es de 50.21 ± 31 cm año-1 y para Inga sinacae 84.79 ± 25 cm año-1 (Martínez-Garza et al., 2013) De aquí en adelante las especies serán nombradas solo por su género. 26 Tabla 2. Nombre científico, familia, nombre común, altura, usos, datos fenológicos, características foliares, mecanismo de dispersión y tasa de crecimiento de Cedrela odorata L. e Inga sinacae M. Sousa. (Sousa, 1993; Vázquez-Torres et al., 2010; Martínez-Garza et al., 2013). Cedrela odorata L. Meliaceae Cedro Inga sinacae M. Sousa. Fabaceae Vaina peluda 35 m 22 m Usos Datos fenológicos Importancia maderera Florece de mayo a agosto Características foliares Hoja compuesta, foliolos delgados de longevidad relativamente corta Viento Sombra de cafetos Florece de abril a junio, fructifica de junio a agosto Hoja compuesta, foliolos gruesos con presencia de abundantes tricomas, longevidad larga Animales 50.21 ± 31 cm año-1 84.79 ± 25 cm año-1 Familia Nombre común Altura Tipo de dispersión Tasa de crecimiento 27 Selección de los individuos De las 16 parcelas que tienen plantaciones, en ocho de ellas con tratamiento de dispersión por viento es donde se encuentra Cedrela, y en las ocho parcelas restantes con tratamiento de dispersión por animales es donde se encuentra Inga. Se revisó la base de datos del 2011 para saber la altura de los arboles de las dos especies seleccionadas y se decidió elegir árboles que en promedio tuvieran 3 m de altura. Se eligió un árbol por subparcela para así tener 4 árboles por parcela, en las ocho parcelas de las dos especies. La consideración de seleccionar arboles con promedio de 3 m de altura se hizo con el fin de colectar hojas de alrededor de toda la copa del árbol, pero en algunas parcelas no fue posible, ya que algunos árboles sobrepasaban ya los 3 m de altura (un caso para Cedrela, cinco casos para Inga). Debido a la sequia que se presentó en la región de Los Tuxtlas en el 2007 provocando la mortalidad del 72% de las plántulas establecidas en el 2006 (Martínez-Garza et al., 2011), algunas subparcelas no tenían árboles de las dos especies que seleccionamos para este estudio (cinco casos para Cedrela, un caso para Inga). En total hubo en las parcelas de restauración 27 individuos disponibles de Cedrela y 31 de Inga. Para la selección de individuos en la selva, se hizo un esfuerzo de muestreo de dos días el cual consistió en dos recorrido de cuatro horas en la selva para encontrar árboles de alturas similares a la de los arboles de las parcelas de restauración, lo cual no fue posible ya que los pocos árboles que encontramos sobrepasaban los 7 m de altura. Bajo la limitante de tener pocos árboles de tallas similares a las de las parcelas de restauración, se tomó la decisión de seleccionar a ocho individuos de Cedrela y ocho de Inga de tallas mayores, seleccionando cuatro ramas a cada individuo para representar a los cuatro individuos por parcela (ver Villa-Galaviz et al., 2012). 28 Colecta de las hojas Debido a que las dos especies presentan hojas compuestas (Figura 3 y 4), se colectaron foliolos para medir la herbivoría. La colecta de foliolos se realizó a lo largo de tres meses en la época de lluvias, en los meses de junio (primer colecta) agosto (segunda colecta) y octubre (tercer colecta) del 2011. Para usar hojas de la misma edad, se selecciono una rama al azar, en esta la rama se localizó el brote de hoja más joven y se colectó del brote anterior a éste. Se colectaron cinco foliolos de cada individuo de las dos especies por muestreo en los dos hábitats. Para colectar el foliolo se tomó la hoja compuesta con el haz de frente, y se numeraron los foliolos en sentido contrario a las manecillas del reloj, tomando como primer foliolo el que estaba en la parte inferior derecha de la hoja compuesta. La elección de la rama así como también elegir la posición de foliolo que tomamos de cada hoja se realizó al azar. Para la colecta de foliolos previamente se tomó la decisión de elegir un número de foliolo para cada muestreo, para Inga se tomó el quinto foliolo de la hoja para el primer muestreo, para el segundo muestreo se tomó el sexto foliolo y para el tercer muestreo se colectó el quinto nuevamente. Para Cedrela en el primer muestreo se colectó el quinto, el séptimo para el segundo muestreo y el noveno foliolo de la hoja para el tercer muestreo. El elegir diferente rama y tomar distintos foliolos en los tres muestreos se realizó con el fin de estimar el daño de la herbivoría de manera más homogénea. 29 Figura 3. Hojas de Cedrela odorata. Figura 4. Hojas de Inga sinacae. 30 Estimación de la herbivoría La estimación de la herbivoría se hizo en varios pasos, el primero de ellos fue recolectar foliolos intactos (sin herbivoría) de las hojas de distintos individuos de las dos especies en los dos hábitats. Se colectaron 40 foliolos para Cedrela y 60 para Inga. Se midió el área en cm2, el ancho y largo (cm) de cada foliolo con ayuda de un medidor de área foliar (CI 202 CID, Estados Unidos). Posteriormente se realizó una regresión lineal múltiple, obteniendo así una fórmula para poder estimar el área de cada especie. La variable dependiente fue el área y las variables independientes fueron el ancho y el largo de los foliolos. La fórmula para poder estimar el área fue: Yi= α + β1 * X1+ β2 * X2 Donde: Yi= área α= intercepto de la recta β1= coeficiente no estandarizado del ancho X1= Valor de ancho β2= coeficiente no estandarizado de largo X2= valor de largo Los resultados de la regresión lineal múltiple para estimar el área de Cedrela tuvo un coeficiente de r2 = 0.95, P < 0.0001 (Apéndice 1) y el de Inga fue de r2 = 0.96, P ˂ 0.0001 (Apéndice 2). Estas formulas se usaron para estimar el área original de cada uno de 31 los foliolos que presentaron herbivoría en los tres muestreos de las dos especies. A los foliolos que no presentaron rastros de herbivoría, no se les aplicó la formula y el daño a estas hojas fue estimado como 0%. A los foliolos que presentaron herbivoría y a los cuales se les estimó el área total que pudieron haber tenido con la fórmula de la regresión lineal, y teniendo el área observada con la medición del medidor de área foliar, se les estimo el porcentaje de área foliar perdida con la siguiente fórmula (revisado en Rodriguez-Auad y Simontti, 2001). % área foliar perdida = (área estimada – área observada) / área estimada * 100 Análisis estadísticos Para los análisis estadísticos se trabajó con el promedio de herbivoría de los 4 árboles por parcela o las 4 ramas por árbol en la selva en cada uno de los tres muestreos. Se realizó un análisis de varianza de medidas repetidas (ANOVAs de medidas repetidas) de dos vías, con la herbivoría por individuo como variable dependiente y el hábitat, con dos niveles (selva y parcelas de restauración) y las especies, con dos niveles (Inga sinacae y Cedrela odorata) como variables independientes. El mes fue la variable repetida con tres niveles (junio, agosto y octubre). Para cumplir con los supuestos que asume el ANOVA (Zar, 1996), el porcentaje de área foliar se convirtió en proporción y esta proporción se transformó con el arcoseno de la raíz cuadrada de la proporción de área consumida más 0.1 ( √ ). El programa utilizado para hacer todos los análisis fue STATISTICA 7.0 (Statsoft, Inc., 2004). En la sección de resultados se reporta el promedio 32 de herbivoría ± el error estándar en porcentaje de los datos transformados de vuelta a sus unidades originales para mayor claridad. 33 Resultados Para las dos especies en los tres muestreos de los dos hábitats se colectaron y midieron 1730 foliolos, 865 foliolos de cada especie de 35 individuos de Cedrela y 39 de Inga. La no-pionera Inga presentó cuatro veces mayor herbivoría (8.40 ± 0.83%) que la pionera Cedrela (2.09 ± 0.16%). El ANOVA de medidas repetidas mostró que Inga tuvo significativamente mayor herbivoría que Cedrela (F (1, 23) = 57.19, P < 0.00001, Figura 5; Apéndice 3). La herbivoría en los individuos creciendo en las plantaciones fue mayor (5.77 ± 0.62%) que la de los individuos creciendo dentro de la selva (4.71 ± 0.67%). El ANOVA de medidas repetidas mostró que la herbivoría fue estadísticamente similar en los dos hábitats (F (1, 23) = 0.28, P < 0.59; Figura 6; Apéndice 3). La herbivoría fue más alta en el mes de octubre (7.48 ± 1.14%), intermedia en junio (4.27 ± 0.47%) y más baja en agosto (3.84 ± 0.43%). El ANOVA de medidas repetidas mostró diferencias significativas en la herbivoría por efecto del mes (F (2, 46) = 10.55, P < 0.0001; Apéndice 3). La prueba post Hoc de Tukey reveló que la herbivoría en octubre fue significativamente mayor que en los meses de junio y agosto, estos dos últimos presentaron una herbivoría estadísticamente similar (Figura 7). La interacción tiempo * especie fue significativa (F (2, 46) = 11.57, P < 0.00008; Figura 8) y la prueba post Hoc de Tukey reveló que Cedrela tuvo una herbivoría similar durante los tres meses evaluados mientras que Inga mostró mayor herbivoría en octubre. El resto de las interacciones no fueron significativas (Apéndice 4, 5, 6). 34 0.50 0.48 ArcSin (raiz (herbivoria + 0.1)) F (1, 23) =57.19, P < 0.00001 0.46 0.44 0.42 0.40 0.38 0.36 0.34 0.32 Inga sinacae Cedrela odorata Especie Figura 5. Herbivoría (arco seno √ proporción de herbivoría + 0.1) en Inga sinacae y Cedrela odorata en Los Tuxtlas, Veracruz, México. Las líneas representan el intervalo de confianza al 95%. 35 0.41 F (1, 23) = 0.28, P < 0.59 ArcSin (raiz (herbivoria + 0.1)) 0.40 0.39 0.38 0.37 0.36 Plantaciones Selva Habitat Figura 6. Herbivoría (arco seno √ proporción de herbivoría + 0.1) en los individuos de Inga sinacae y Cedrela odorata creciendo en plantaciones experimentales de restauración ecológica y dentro de la selva madura en Los Tuxtlas, Veracruz, México. Las líneas representan el intervalo de confianza al 95%. 36 0.50 ArcSin (raiz (herbivoria + 0.1)) 0.48 F (2, 46) b = 10.55, P < 0.0001 0.46 0.44 0.42 a 0.40 a 0.38 0.36 0.34 junio agosto octubre Tiempo Figura 7. Herbivoría (arco seno √ proporción de herbivoría +0.1) en los meses de junio, agosto y octubre en Los Tuxtlas, Veracruz, México. Las líneas representan el intervalo de confianza al 95%. Las letras diferentes representan diferencias significativas evaluadas con la prueba post Hoc de Tukey. 37 0.54 0.52 F (2, 46) = 11.57, P < 0.00008 a 0.50 ArcSin (raiz (herbivoria + 0.1)) 0.48 Inga sinacae Cedrela odorata 0.46 0.44 b 0.42 bc 0.40 0.38 c c c 0.36 0.34 0.32 0.30 0.28 Junio Agosto Octubre TIEMPO Figura 8. Herbivoría (arcoseno √ proporción de herbivoría + 0.1) en Inga sinacae y Cedrela odorata durante junio, agosto y octubre en Los Tuxtlas, Veracruz, México. El estadístico muestra la interacción tiempo * especie. Las líneas representan el intervalo de confianza al 95%. Las letras diferentes representan diferencias significativas evaluadas con la prueba post Hoc de Tukey. 38 Discusión La herbivoría es una de las interacciones bióticas más frecuente entre plantas y animales. La disponibilidad de área foliar (Westoby, 1998), la dureza de la hoja (Coley, 1983), tipo de defensa, como químicas (Harborne, 1997), biológicas o morfológicas, (Ricklefs, 2000), la disponibilidad de recursos (Coley y Barone, 1996) o el estado ontogénico de la planta (Boege, 2005) son algunas fuentes de variación en el grado de herbivoría. Este trabajo busco comparar los niveles de herbivoría en parcelas de restauración ecológica experimental, y los niveles de herbivoría dentro de la selva, en una especie pionera y una no-pionera. La especie pionera presentó mayor daño que la no-pionera y hubo un nivel de daño similar en los dos hábitats evaluados. La mayor herbivoría se registró al final de la temporada de lluvias. Herbivoría por historia de vida Nuestra hipótesis de herbivoría se base en la historia de vida de las plantas que predice que las especies pioneras presentaran más herbivoría que las especies no-pioneras. Esta hipótesis a su vez se apoya en la teoría de disponibilidad de recursos (Coley et al., 1985), la cual plantea que las especies de crecimiento lento (no-pioneras), que están adaptadas a vivir en ambientes de baja disponibilidad de recursos (por ejemplo, sotobosque o áreas con suelos pobres), invierten más en defensas contra los herbívoros. Las especies no-pioneras, resisten la herbivoría mediante altas concentraciones de sustancias químicas como los metabolitos secundarios que son más efectivas contra los herbívoros (Kursar y Coley, 2003). Entre los metabolitos secundarios más efectivos encontramos a los fenoles y dentro 39 de este grupo están los taninos, que hacen que las proteínas ingeridas del tejido vegetal no se puedan digerir (Mangan, 1988), otro grupo importante en la defensa contra la herbivoría son los alcaloides, se ha visto que este grupo puede interferir a nivel del ADN, ARN, así como también en la síntesis de proteínas y el transporte de membrana (activo y pasivo) (revisado en del-Val y Boege, 2012), y finalmente están los terpenos, que tienen actividad repelente (Sinclair et al., 1988) y también tienen un rol impórtate en la polinización y la alelopatía (Gershenzon y Dudareva, 2007). Por otra parte, las especies de crecimiento rápido (pioneras), están adaptadas a ambientes con alta disponibilidad de recursos (por ejemplo los claros de bosque o suelos más fértiles) y no invierten en defensas (Coley et al., 1985; Connell y Slatyer, 1977; Smith y Smith, 2001). El crecimiento rápido de las especies pioneras implica un alto recambio foliar, por lo que presentan hojas con menor peso especifico y longevidad corta (King, 1994). En general, la estrategia de las especies pioneras para defenderse de la herbivoría es la tolerancia (Strauss y Agrawal, 1999), que es la capacidad que tienen las plantas para compensar el tejido removido por los herbívoros (Lennartsson et al., 1998, Paige y Whitham, 1987), sin que ello represente pérdidas en su adecuación. Los estudios que han comparado la herbivoría entre pioneras y no-pioneras muestran, en general, que las plantas pioneras presentan un mayor daño por herbívoros que las especies no-pioneras, lo que contrasta con los resultados de este trabajo (Tabla 3); Inga, el árbol no-pionero presento 4 veces más herbivoría que Cedrela, el árbol pionero. Un menor peso foliar por unidad de área (peso foliar específico) está asociado a una mayor palatabilidad, Cedrela presenta un menor peso foliar específico (55.75 gr m-2) en comparación con otras pioneras típicas como Heliocarpus appendiculatus (63.39 gr m-2) y 40 Tabla 3. Estudios de herbivoría en especies con historia de vida contrastante. Se muestra el ecosistema, país, hábitat, el número de especies utilizadas para el estudio o en su caso la especie y el promedio del porcentaje neto, la tasa o el índice de herbivoría ± el error estándar. Fuente Ecosistema, País Hábitat Especies Niveles de herbivoría (%) Este estudio Selva húmeda, Los Tuxtlas, México Plantaciones de restauración 1 pionera, Cedrela 1.93 ± 0.18 1 no pionera, Inga 9.04 ± 1.02 1 pionera, Cedrela 2.22 ± 0.26 1 no-pionera, Inga 7.65 ± 1.37 Claros (perturbado) 10 pioneras 2.45 ± 0.27∞ Bosque maduro (conservado) 10 no-pioneras 1.12 ± 0.09∞ 3 pioneras 3 no-pioneras 15 pioneras 9.50 ± 3.20 3.40 ± 1.80 10.00 15 nómadas 9.00 13 no-pioneras 8.00 22 pioneras 0.83 ¥* 0.24£* 24 no-pioneras 0.97 ¥* 0.04£* Cedrela odorata 0.44 ± 2.26 3 pioneras 2 no-pioneras 0.48 ± 1.37 2.62 ± 0.23 2.60 ± 0.21 Bosque maduro Casallas-Pabón et al., 2010 Selva húmeda, Reserva Forestal José Celestino Mutis, Colombia Sánchez-Ramos et al., 1999 Bosque mesófilo de montaña Tamaulipas, México Estudio de cafetería § De la Cruz y Dirzo 1987 Selva húmeda, Los Tuxtlas, México Conservado Coley 1983 Selva húmeda de Barro Colorado, Panamá Arteaga 2006 Selva húmeda, La Paz, Bolivia Paul et al., 2012 Selva húmeda, Provincia de Colon, Panamá Conservado Área abierta Regeneración natural Perturbado ∞ Índice de herbivoría * Tasa de herbivoría. ¥ Hojas jóvenes. £ Hojas maduras § Los estudios de cafetería se hicieron ofreciendo a larvas de lepidópteros las hojas de las especies seleccionadas. 41 Cecropia obtusifolia (84.11 gr m-2, Martínez-Garza et al., 2013). Sin embargo, Cedrela presentó menor herbivoría en este trabajo en comparación con los niveles de herbivoría reportados para Heliocarpus (26.14±0.96%) en una selva secundaria estacional (JuanBaeza, 2013) y en las plantaciones usadas en este estudio (22%) pero en plantade 2 años de edad (Mariano et al., 2008). Esta baja herbivoría en Cedrela, que es considerado un árbol pionero debido a sus tasas de crecimiento, puede deberse a la producción de metabolitos secundarios como los terpenoides que presenta una actividad insecticida frente un amplio espectro de insectos, y uno de los terpenoides más potentes que es la gedunina aislada de la corteza (Bevan et al., 1963 en Omar et al., 2007). La gedunina pertenece a una subclase de terpenoides, los denominados limonoides (tetranortriterpenos) (Omar et al., 2007). En plantaciones de Cedrela odorata en Panamá, esta especie tuvo un bajo número de insectos en comparación con otras especies evaluadas (Santos-Murgas, 2009) debido a la presencia de metabolitos secundarios. Los resultados de herbivoría para Inga en este estudio (8.40 ± 0.83%) es comparable con un trabajo en Colombia donde reportan que Inga sp. tuvo un índice de 1.6 que es equivalente a 6% de daño (Martínez-Pachon et al., 2010) y menor en comparación con un trabajo en Panamá donde reportan que Inga spectabilis tuvo un daño de alrededor de 13% (Brenes-Arguedas et al., 2006). En conclusión, aunque Cedrela es considerada pionera, su estrategia de defensa contra los herbívoros es mediante la resistencia química a base de terpenos, en lugar de la tolerancia como típicamente lo hacen las especies pioneras. Herbivoría por hábitat Para este estudio se esperaba que los individuos creciendo en la selva madura tuvieran mayores porcentajes de herbivoría debido a una mayor cantidad de recursos que mantendría una mayor densidad de herbívoros. Se ha visto que dentro de un mismo ecosistema, hábitats con mayores recursos reciben los niveles más altos de herbivoría (revisado en Dirzo y Boege, 2008; Gutiérrez-Granados y Dirzo, 2009; Simonetti et al., 2002; Vásquez et al., 2007). Por ejemplo, dentro del bosque maduro, los niveles de herbivoría puede aumentar en los claros debido al aumento en la abundancia de herbívoros asociado a la liberación de recursos como agua y luz (Gutiérrez-Granados y Dirzo, 2009). Las plantaciones de restauración ecológica de este estudio tenían 5 años de edad y presentaban una menor densidad de árboles en comparación con el bosque maduro; además, en el 2009 la caída de hojarasca en el bosque maduro fue 18 veces más alta (9.81 g-1 m-2 mes-1) que en las plantaciones de restauración (0.54 y 0.11 g-1 m-2 mes-1; Valencia-Esquivel y MartínezGarza, 2011) por lo que las plantaciones pueden ser consideradas hábitats con menor cantidad de recursos en comparación con la selva madura. Sin embargo, durante los meses de estudio no fue posible medir la densidad de herbívoros en las plantas estudiadas porque en las selvas húmedas los insectos no permanecen en las plantas donde se alimentan debido a la alta disponibilidad de recursos que ofrecen el hábitat (Ek del-Val, UNAM, comunicación personal). El daño por herbivoría fue estadísticamente similar en los dos hábitats. A pesar de una menor disponibilidad de recursos, los niveles de herbivoría en las plantaciones han alcanzado los niveles de la selva madura a solo 5 años de establecimiento de las plantaciones, lo que muestra que esta interacción se ha recuperado; el mecanismo detrás de esta observación necesita mayor investigación. 43 La herbivoría afecta de diferente manera a las plantas, dependiendo de factores bióticos y abióticos (Coley y Barone, 1996). La teoría de la apariencia establece que los mecanismos de defensa de las plantas responden a su grado de notoriedad y al riesgo de ser encontradas por los herbívoros, especies con mayor apariencia recibirán más daño por herbívoros que aquellas que no son tan aparentes (Feeny, 1976, Rhoades y Cates, 1976). Las plantas establecidas en las parcelas de restauración son aparentes para los herbívoros al ser el recurso más atractivo en un pastizal de 12 ha. Un estudio en una selva húmeda de Bolivia en plántulas de Cedrela mostró que los individuos creciendo en áreas abiertas presentaron mayores daños por herbivoría que aquellos creciendo en sitios bajo regeneración natural después de un año (Arteaga, 2006; Tabla 3). Los autores atribuyen ese resultado a que las plantas creciendo en claros de bosque son más fácilmente encontradas por los herbívoros (Barone y Coley 2002), que las del área bajo regeneración natural (Arteaga, 2006). Las plantaciones de restauración en sitios perturbados representan recursos visibles para los herbívoros lo que puede ocasionar una alta mortalidad de las especies sembradas (Nepstand et al., 1996; Barrales-Alcalá, 2013). El establecimiento de plantaciones mixtas en lugar de monocultivos disminuye el grado de apariencia de las especies y la mortalidad de plántulas debido a la herbivoría (Massad, 2012). Atraer insectos a plantaciones de restauración puede resultar en el restablecimiento de deseables interacciones planta-animal como la polinización, sin embargo, los polinizadores son, en sus estados tempranos de historia de vida, herbívoros que pueden afectar el éxito de la restauración debido a una alta mortalidad. El establecimiento de plantaciones mixtas puede disminuir la apariencia de las especies más palatables, favoreciendo la biodiversidad sin poner en peligro el éxito del establecimiento de las plantaciones de restauración ecológica. 44 Patrón temporal de herbivoría Contrario a lo que esperábamos, la herbivoría en Cedrela mostró niveles similares de herbivoría en los tres meses y para Inga la herbivoría aumentó con el avance de la temporada de lluvias. En la selva estacional de Chamela, Jalisco, se encontró que la herbivoría fue mayor a finales de la temporada de lluvias para el árbol pionero Cordia alliodora (Andrade-Ortiz, 2009). También se espera que haya una mayor densidad de herbívoros debido al aumento de la cantidad de recursos (ver arriba). En la selva húmeda hay una producción permanente de hojas y muy pocas especies son caducifolias (CarabiasLillo y Guevara-Sada, 1985). En general, las especies pioneras tienen una mayor producción y caída de hojas (King, 1984) que las especies no-pioneras (Chabot y Hicks, 1982). Una retención de hojas durante más tiempo en Inga podría explicar mayor herbivoría en esta especie al final de la temporada, ya que esa herbivoría sería la herbivoría acumulada de toda la temporada. Implicaciones para la restauración ecológica de la selva húmeda Las especies Cedrela odorata e Inga sinacae utilizadas en este trabajo pueden ser plantadas en pastizales para la restauración de la selva tropical ya que ambas especies soportan la herbivoría en estadio juvenil, que es donde se presenta la mayor tasa de mortalidad causada por la herbivoría. Además, Cedrela odorata e Inga sinacae presentaron mayores tasas de crecimiento (50.21 ± 31 y 84.79 ± 25 cm año-1, respectivamente; Martínez-Garza et al., 2013) que otras especies no-pioneras sembradas en estas plantaciones mixtas por lo que son buenas 45 opciones para establecer plantaciones de restauración ecológica de conectividad de paisaje. Los individuos de estas especies, plantados en lugares abiertos, podrían fungir como potenciales perchas para aves y murciélagos, así como también refugio para pequeños mamíferos y reptiles favoreciendo las interacciones bióticas, en mayor medida la dispersión de semillas. La evaluación de la restauración de las interacciones bióticas en proyectos de restauración ecológica, en este caso, la herbivoría, se podría hacer comparando los niveles de herbivoría que se presentan en las plantas del lugar que está siendo restaurado, con los niveles de herbivoría en las plantas del lugar conservado del mismo ecosistema. Es necesario también comparar la riqueza de insectos herbívoros en los hábitats conservados y en los que están bajo restauración para identificar si los insectos herbívoros de la interacción dentro de la selva son los mismos que mantienen este proceso en los sitios restaurados. 46 Conclusiones. 1. Inga sinacae presento mayor porcentaje de herbivoría que Cedrela odorata. 2. A cinco años del establecimiento de las parcelas de restauración ecológica, los porcentajes de herbivoría son similares en comparación con los de la selva madura 3. El porcentaje de herbivoría aumentó durante la temporada de lluvias para Inga, probablemente debido a la herbivoría acumulada en hojas que se retuvieron durante toda la temporada. 47 Literatura citada Anaya L. A. L. 2003. Ecología Química. Plaza y Valdes. Pp 349. Andrade-Ortiz, Z. 2009. Interacción hormigas-Cordia alliodora en diferentes estadios de sucesión vegetal: efectos sobre los patrones de herbivoría y calidad nutricional de la planta. Tesis de Licenciatura, Facultad de Biologia, Universidad Michoacana de San Nicolas de Hidalgo. Pp 70. Arteaga, L. 2006. Crecimiento y herbivoría de plántulas de Cedrela odorata (Meliaceae) comparando un área abierta y otras bajo regeneración natural en la Estación Biológica Tunquini. Ecología en Bolivia, vol.41 (2), Pp.130-137. Barrales-Alcalá, B. A. 2013. Evaluación de la utilidad de Jatropha curcas para la restauración ecológica de sitios perturbados en Morelos. Universidad Nacional Autónoma de México, México, D.F. Pp.53. Barrera-Bassols, N. y H. Rodríguez. 1993. Desarrollo y medio ambiente en Veracruz. Impactos ecológicos y culturales de la ganadería en Veracruz. CIESAS-GOLFO. Instituto de Ecología y Fundación Friedrich Eber. Pp 314. Barone, J. & P. D. Coley. 2002. Herbivorismo y las defensas de las plantas. Pp. 465-492. En: Guariguata M. R. & G. H. Catan. (eds.). Ecología y Conservación en bosques Neotropicales. Ed. LUR, Cartago. Basset Y. 1991. The spatial distribution of herbivory, mines and galls within an Australian rainforest tree. Biotropica 23: 271-281. Basset, Y. 1994. Palatability of tree foliage to chewing insects: a comparation between a temperate and tropical site. Acta Oecol. 15: 181-191. Bawa, K.S., Kress W. J., Nadkarni N.M. y Lele S. 2004. Beyond paradise–meeting the challenges in tropical biology in the 21st century. Biotropica 36:437-446. Bevan, C. W. L, Powell J. W, Taylor D. A. H. 1963. West African timbers part VI. Petroleum extracts from species of the genera Khaya, Guarea, Carapa and Cedrela. Journal of the Chemical Society.; 6: 980-984. 48 Boege, K. 2005. Influence of plant ontogeny on compensation to leaf damage. American Journal of Botany, 92 (10): 1632-1640. Brenes-Arguedas, T., M. Horton, D. Coley J. Lokvam A. Waddell E. Meizoso-O'Meara A. Kursar. 2006. Contrasting mechanisms of secondary metabolite accumulation during leaf development in two tropical tree species with different leaf expansion strategies." Oecologia 149(1): 91-100. Brooks T.M, Mittermeier R.A, Mitetermeier C.G, Dac Fonseca G.A.B, Rylands A.B, Konstant W. R, Flick P, Pilgrim J, Oldfield S, Magin G. Y Hilton-Taylor C. 2002. Habitat loss and extinction in the hotspots of biodiversity. Conservation Biology 16:909–923. Brown, S. y A. E. Lugo 1990: Tropical secundary forest. Journal of Tropical Ecology. Pp.6:1-32. Carabias-Lillo, J. y S. Guevara-Sada. 1985. Fenología de una selva tropical húmeda y en una comunidad derivada; Los Tuxtlas, Veracruz. Paginas 27-78 en Gómez-Pompa, A. y S. del Amo R., editors. Investigaciones sobre regeneración de selvas altas en Veracruz, México. Alhambra Mexicana México D.F. Casallas-Pabón, D. Rojas-Zamora, O Y Insuasty-Torres, J. 2010. Variación de la Herbivoría y Prueba de Aceptabilidad en Plantas con Estrategias de Crecimiento rápido y lento. Interacciones planta-animal: ecología evolutivaa y conservación. Universidad Nacional de Colombia. Pp.66. Chabot, B. F. y D. J. Hicks. 1982. The ecology of leaf life spans. Annual Review of Ecology and Systematics 13:229-259. Chazdon R.L. 2003. Tropical forest recovery: legacies of human impact and natural disturbances. Perspect ives in Plant Ecology, Evolution and Systematics 6:51-71. Chazdon, R. L. 2008. Beyond deforestation: restoring forests and ecosystem services on degraded lands. Science 320: 1458-1460. 49 Coley, P. D. 1983. Herbivory and defensive characteristics of tree species in a lowland tropical forest. Ecological Monographs 53:209-233. Coley, P. D. 1983b. Intraspecific variation in herbivory on two tropical tree species. Ecology 64:426- 433. Coley, P. D.1990. Tasas de herbivorismo en diferentes árboles tropicales. In: Leigh, E. G. Jr.; R. A. Stanley, D. M. Windsor, (Eds.). Ecología de un bosque tropical. The Smithsonian Tropical Research Institute, Balboa, Panamá. Pp. 191–200. Coley, P.D. y T. M. Aide 1991. Comparison of herbivory and plant defenses in temperate and tropical broad-leaved forests. In P. W. Price, T. M. Lewinsohn, G. W. Fernandes, and W. W. Benson (Eds.) Plant–animal interactions: Evolutionary ecology in tropical and temperate regions. John Wiley Y Sons. Pp 25–49. Coley, P.D. y T.A. Kursar 1996. Antiherbivor defenses of young tropical leaves: Physiological constraints and ecological tradeoffs. En: Smith, A. P., Mulkey, S. S. Y Chazdon, R. L. (eds.) 1996. Tropical Forest Plant Ecophysiology, Chapman Y Hall. Nueva York. Pp. 305-336. Coley, P.D. y J.A. Barone 1996. Herbivory and plant defenses in tropical forests. Annual Review Ecological Systematic 27: 305-335. Coley, P., Bryant, J. y Chapin, S. 1985. Resource availability and plant antiherbivore defense. Science. 4728: 895-899. CONABIO (Comisión Nacional para el Conocimiento y Uso de la Biodiversidad). 1998. La diversidad biológica de México: estudio de país. CONABIO. México. Pp. 341. Connell, J.H. y Slatyer, R.O. 1977. Mechanisms of succession in natural communities and their role in community stability and organization. The American Naturalist, 111: 1119-1144. Crawley, M. J. 1983. Herbivory, the dynamics of plant-animal interactions. Blackwell Science Ltd., Oxford. 50 Daily, G. C. 1997. Nature’s Services: Societal Dependence on Natural Ecosystems. Islan Press, EE.UU. de Groot, R.S. 1992. Functions of nature: evaluation of nature in environmental planning, management and decision making. Wolters-Noordhoff BV, Groningen, Holanda. De Jong B. H . J., Ochoa-Gaona S., Castillo- Santiago M.A., Ramírez-Marcial N. y Cairns M.A. 2000. Carbon flux and patterns of land-use/land-cover change in the Selva Lacandona, Mexico. Ambio 29:504-511. de la Cruz, M. y R. Dirzo. 1987. A survery of the standing levels of herbivory in seedlings from a Mexican rain forest. Biotropica 19: 98-106. de la Peña-Domene, M. 2010 Reclutamiento de plántulas en plantaciones jóvenes de especies arbóreas con diferente síndrome de dispersión. Tesis de Maestría. Universidad Nacional Autónoma de México. Pp 82. del-Val, E. y R. Dirzo.2004. Mimercofilia: las plantas con ejercito propio. Intercierncia 29: 673-679. del-Val, E. K. y K. Boege 2012, Ecología y evolución de las interacciones bióticas, Centro de investigaciones en Ecosistemas (UNAM). Mexico, Pp. 275. Dirzo, R. y C.A. Dominguez. 1995. Plant-herbivore interactions in Mesoamerican tropical dry forest. In: Bullock, S.H.; H.A. Mooney and E. Medina (Eds.). Seasonally Dry Tropical Forest. Cambridge University Press. Pp. 304-325. Dirzo, R. 1984. Herbivory: a phytocentric overview. In: Dirzo, R. y J. Sarukhán (Eds.) Perspectives in plant population ecology. Sinauer Associates Publishers. Sunderland. Massachussets. Pp. 141-165. Dirzo, R. 1987. Estudios sobre interacciones planta-herbívoro en Los Tuxtlas, Veracruz. Rev. Biol. Trop. 34: 119-131. 51 Dirzo, R. 2001. Tropical forests. In O. Sala, F. S. Chapin y E. Huber-Sannwald (Eds.). Global Biodiversity in a Changing Environment. Springer-Verlag, Nueva York. Pp. 251-276. Dirzo, R. y M.C. García .1992. Rates of deforestation in Los Tuxtlas, a Neotropical area in southeast Mexico. Conservation Biology 6(1):84-90. Dirzo, R. y K. Boege. 2008. Patterns of herbivory and defense in tropical dry and rain forests. En C. Walter and S. Schnitzer (Eds.). Tropical forest community ecology, Wiley-Blackwell, Chichester. U.K. Pp. 63–78. Domínguez, C. A. y R. Dirzo. 2002. Interacciones planta-herbívoro en la selva baja caducifolia de Chamela. In F. A. Noguera, J. H. Vega Rivera, A. N. García-Aldrete, y M. Quesada-Avedaño, eds. Historia Natural de Chamela. Instituto de BiologíaUNAM, México. Pp. 517-523. Domínguez, C. A. y R. Dirzo 1995. Plant herbivore interactions in Mesoamerican tropical dry forests. En: S.H. Bullock, E. Medina y H. A. Mooney (eds.) Seasonally Dry Tropical Forests. Cambridge University Press. Cambridge. Pp. 304–325. FAO (Food and Agricultural Organization) 1997. State of the World Forest in 1997. FAO, Roma. Farnsworth, E. J. y A. M. Ellison. 1993. Dynamics of herbivory in Belizean mangrove. Journal of Tropical Ecology 9: 435-453. Feeny, P. 1976. Plant apparency and chemical defense. In: Wallace J, R.L. Mansell (Eds.). Chemical interactions between plants and insects. Recent Advances of Phytochemistry, 10: Pp. 1–40. Filip, V., R. Dirzo, J. M. Maass y J. K. Sarukhán. 1995. Within- and among-year variation in the levels of herbivory on the foliage of trees from a Mexican tropical deciduous forest. Biotropica, 27:78-86. Finegan, B. 1984. Forest succession. Nature 312: 109-114. 52 Folgarait PJ, Marquis RJ, Ingvarsson P, Braker HE, Arguedas M (1995) Patterns of attack by insect herbivores and a fungus on saplings in a tropical tree plantation. Environ Entomol 24:1487–1494. Gentry, H. A. 1995. Diversity and Floristic composition of neotropical dry forests. In S. H. Bullock, H. A. Mooney y E. Medina (Eds.). Seasonally dry tropical forest. Cambridge University Press, England. Pp.146-220. Gershenzon, J. y N. Dudareva 2007, The function of terpene natural products in the natural world, Nature Chemical Biology, 3(7): Pp. 408-414. Gómez-Baggethun, E., de Groot, R., 2007. “Capital natural y funciones de los ecosistemas: explorando las bases ecológicas de la economía.” Ecosistemas 16: 4-14 Gómez-Pompa, A. 1971. Las regiones tropicales de México y el aprovechamiento de sus recursos. Boletín de divulgación No. 6. Edit. Soc. Hist. Natural, México, D.F, Pp.1-6. González-Soriano, E., R. Dirzo y R. C. Vogt (Eds), 1997. Historia Natural de Los Tuxtlas. Instituto de Biología CONABIO e Instituto de Ecología (UNAM). México, D. F. Pp. 647. Guariguata, M. R. y Kattan, G. H. 2002. Ecología y conservación de bosques tropicales. Costa Rica. Editorial Cartago. Pp.692. Gutiérrez-Granados, G. y R. Dirzo. 2009. Remoción de semillas, herbivoría y reclutamiento de plántulas de Brosimum alicastrum (Moraceae) en hábitats con manejo forestal contrastante de la selva maya, Quintana Roo, México. Boletín de la Sociedad Botánica de México. 85: 51-58. Harborne, J. B. 1997. Plant Secondary Metabolism, en M. J Crawley (ed), Plant Ecology, Blackwell Science, Cambridge, Pp. 132_155. Harper, J.L. 1969. The role of depredation in vegetational diversity. Brookhaven Symposia in Biology 22: 48-62. 53 Hernandez, Y. 2010. Restauración vs Sucesión secundaria: comparación en la herbivoría y en la diversidad de larvas de lepidópteros en un bosque tropical caducifolio. Tesis de Maestría. Universidad Nacional Autónoma de México. Pp. 58. Houghton, R. A. 1994. The world wide extent of land-use change. Bioscience 44: 305-313. Janzen, D. H. 1970. Herbivores and the number of tree species in tropical forests. The American Naturalist 104: 501-526. Janzen, D.H. 1981. Patterns of herbivory in a tropical deciduous forest. Biotropica, 13: 271282. Juan-Baeza, I. 2013. Efecto de tratamientos de restauración ecológica sobre la herbivoría y la comunidad de lepidópteros en dos árboles pioneros de una selva estacional de México. Tesis de Licenciatura, Facultad de Ciencias Biológicas, Universidad Autónoma del Estado de Morelos. Pp.84. King, D.A., 1994. Influence of light level on the growth and morphology of saplings in a Panamanian forest. Am. J. Bot. 81, 948-957. Kursar, T.A, T.L. Capson, P.D. Coley, D.G. Corley, M.B. Gupta, L.A. Harrison, E. OrtegaBarría y D.M. Windsor. 1999. Journal of Pharmaceutical Biology 37 (supplement): 114-126. Kursar, T.A., y Coley P.D. 2003. Convergence in defense syndromes of young leaves in tropical rainforests. Biochem. Syst. Ecol. 31: 929-949. Lamb, D., P. D. Erskine, y J. A. Parrotta. 2005. Restoration of degraded tropical forest landscapes. Science 310:1628-1632. Lambin E F. 1997. Modelling and monitoring land-cover change processes in tropical regions. Progress in Phisical Geography. 21, 3: 375-393. Lennartsson, T., P. Nilson y J. Toumi. 1998. Induction of overcaompesation in the field gentian, Genntianella campestris, Ecology, 79 (3): 1061-1072. 54 Lott, E.J., Bullock, S.H. y Solis-Magallanes, J.A. 1987. Floristic diversity and structure of upland and arroyo forests of Coastal Jalisco. Biotropica, 3, 228–235. Mangan, J. L. 1988, Nutritional effects of tannins in animal feeds, Nutritional research reviews, 1: Pp. 209-231. Mariano-Bonigo, N., Dirzo-Minjarez, R. y Martínez-Garza, C.2008. Impacto de la herbivoría sobre plantas pioneras y sucesionales tardías en parcelas de restauración de la selva húmeda. Segundo Congreso de la Sociedad Científica Mexicana de Ecología. Noviembre, 2008, Mérida, Yucatán, México. Marquis, R. J. 1992. The selective impact of herbivores. En R. S. Fritz, y E. L.. Pp. 301-325 Marquis, R. J. y H. E. Braker. 1994. Plant-herbivore interactions: diversity, Specificity, and impact. In L. A. McDade, K. S. Bawa, H. A. Hespenheide, y G. S. Hartshorn, editores. La Selva: ecology and natural history of a neotropical rain forest. University of Chicago Press, Chicago. Pp. 262-281. Martin-Del-Pozzo, A.L. 1997. Geología. En: González-Soriano E., Dirzo R. y Vogt R.C. eds. Historia Natural de Los Tuxtlas. UNAM-CONABIO, México, D.F. Pp.25-31. Martínez-Pachón, E. Moreno-Pallares, M. y Cuervo-Martínez, M.A. 2010, Herbivoría en plantas de crecimiento rápido y lento de un bosque húmedo tropical de Colombia: una prueba de la hipótesis de disponibilidad de recursos. Interacciones planta-animal: Ecología evolutiva y conservación. Universidad Nacional de Colombia. Colombia. Pp.66. Martínez-Garza, C., Bongers,. F. y Poorter, L. 2013 Are functional traits good predictors of species performance in restoration plantings in tropical abandoned pastures? Forest Ecology and Management, in press. Martínez-Garza, C. y H. F. Howe. 2003. Restoring tropical diversity: beating the time tax on species loss. Journal of Applied Ecology 40:423-429. Martínez-Garza, C., A. Flores-Palacios, M. de la Pena-Domene, y H. F. Howe, 2009. Seed rain in a tropical agricultural landscape. Journal of Tropical Ecology 25: 541-550. 55 Martínez-Garza, C., W. Tobon, J. Campos, y H. F. Howe. 2011. Drought mortality of tree seedlings in an eroded tropical pasture. Land Degradation & Development Publicado en línea 17 de mayo del 2011. Martínez-Ramos M y García-Orth X. 2007. Sucesión ecológica y restauración de las selvas húmedas. Boletín Sociedad Botánica de México 80(suplemento): 64-84. Massad, T. J. 2012. Interactions in tropical reforestation - how plant defence and polycultures can reduce growth-limiting herbivory. Applied Vegetation Science 15:338-348. McNaughton, S. J., M. Oesterheld, D. A. Frank, y K. J. Williams. 1989. Ecosystem-level patterns of primary productivity and herbivory in terrestrial habitats. Nature 341:142– 144. Miranda, F. y E. Hernández–Xolocotzi. 1963. Los tipos de vegetación de México y su clasificación. Boletín de la Sociedad Botánica de México, 29: 29-179. Montagnini, F. y C. F. Jordan. 2005. Tropical forest ecology: The basis for conservation and management. Springer Berlin Heidelberg New York, Netherlands. Myers M, Mittermeier RA, Mittermeier CG, Dac Fonseca GAB Y Kent J 2000. Biodiversity hotspots for conservation priorites. Nature 403:853–858. Nepstad, D. C., C. UHL, C. A. Pereira y J. M. C. Dasilva. 1996. A comparative study of tree establishment in abandoned pasture and mature forest of eastern Amazonia. Oikos 76: 25-39. Omar S., Marcotte M, Fields P., Sánchez P.E, Poveda L., Mata R., Jiménez A, Durst T, Zhang J, Mac Kinnon S, Leaman D, Arnason JT y Philogène B.J.R. 2007. Antifeedant activities of terpenoids isolated from tropical Rutales. Journal of Stored Products Research. 43: 92-96. Ojima, D. S., K. A. Galvin y B. L. Turner. 1994. The global impact of land-use change. Bioscience 44: 300-304. 56 Paige, K. y T. Whitham. 1987. Overcompensation in response to Mammalian herbivory: The advantage of being eaten, The American Naturalist, 129 (3): 407-416. Paul, G., F. Montagnini, G. Berlyn, D. Craven, M.Breugel y J. Hall. 2012. Foliar herbivory and leaf traits of five native tree species in a young plantation of Central Panama. New Forests 43(1): 69-87. Pickett S.T.A. y White P.S. 1985. Patch dynamics: a synthesis. En: Pickett S.T.A. y White P.S. Eds. The Ecology of Natural Disturbance and Patch Dynamics, Academic Press, NuevaYork. , Pp. 371-383. Pickett S.T.A., Collins S.L. y Armesto J.J. 1987. A hierarchical consideration of causes and mechanisms of succession. Vegetatio 69:109-114. Rhoades, D. F., y R. G. Cates. 1976. Toward a general theory of plant antiherbivore chemistry. Pages 168-213 in J. Wallace and R. L. Mansell, editors. Biochemical interactions between plants and insects. Recent Advances in Phytochemistry. Volume 10. Plenum Press, New York, New York, USA. Richards P.W. 1996. The Tropical Rain Forest. 2a ed. Cambridge Univesity Press, Cambridge. Ricklefs, R.E. 2000. Predation and herbivory. In: The economy of nature. Rico-Gray, V. 2001. Interspecific interaction. Macmillan Publisher Ltd. Rodríguez-Auad, K. y J.A. Simonetti. 2001. Evaluación de la folivoría: una comparación de dos métodos. Ecología en Bolivia 36:65-69 Roldan, A.I. 1997. El síndrome del bosque vacío: Es un fenómeno recurrente en los bosques neotropicales? Tesis de Magister en Ciencias. Universidad de Chile, Santiago. Pp.63. Rzedowski, J. 1978. Bosque tropical caducifolio. En: Vegetación de México. Limusa. D.F. México: 189-203. Sánchez-Ramos, G., R. Dirzo y M. A. Balcázar-Lara. 1999. Especificidad y herbivoría de 57 Lepidopteros sobre especies pioneras y tolerantes del bosque mesófilo de la Reserva de la Biosfera El Cielo, Tamaulipas, México. Avata Zoologica Mexicana 78:103-118 Sánchez-Ramos, G. Reyes-Castillo, P. Mora-olivo, A. Martínez-Aválalos, J. G. 2010. Estudio de la herbivoría de la palma camedor (Chamaedorea radicalis) Mart., en la Sierra Madre Oriental de Tamaulipas, México. Acta Zoológica Mexicana 26(1): Pp. 153-172. Santos-Murgas, A, E. Barrios y G.Luna. 2009. Diversidad de insectos en cuatros especies de plantas maderables nativas establecidas en monocultivos y cultivos mixtos en Sardinilla, Panamá. Entomotropica. Vol. 24(1): 11-22. SER (Society for Ecological Restoration), 2006. La restauración ecológica un medio para conservar la biodiversidad y mantener los medios de vida. En: https://www.ser.org/pdf/Global_Rationale_Spanish.pdf. SER. 2007. Principios de SER Internacional sobre la Restauración Ecológica. Society for Ecological Restoration International. EUA. Pp. 15. Sinclair, A. R., M. K. Jogia y R. J. Andersen. 1988. Camphor from juvenile white spruce as an antifeedant for snowshoe hares. Journal of Chemical Ecology. 14(6): 1505-1514. Simonetti, J., Grez, A., Celis-Diez, J. y Bustamante, R. 2007. Herbivory and seedling performance in a fragmented temperate forest of Chile. Acta Oecológica. 32: 312318. Smith III, T. J.1992. Forest Structure. In: Robertson, A. I. Y D.M. Alongi (Eds.). Tropical Mangrove Ecosystems. Ameri-can Geophysical Union. Washington, DC: 101-136. Smith, J., Sabogal, C. S., De Jong, W. y Kaimowitz, D. 1997. Bosques secundarios como recursos para el desarrollo rural y la conservación ambiental en los trópicos de América Latina. Center for International Forestry Research 13: 1-36. Smith, L. R. y Smith, M. T. 2001. Ecología 4ta. Edición. Person Education SA. Madrid. Pp. 3-26. 58 Sousa, M. 1993. El Genero Inga (Leguminosae: Mimosoideae) Del Sur de Mexico Y Centroamerica, Estudio Previo Para la Flora Mesoamericana. Missouri Botanical Garden, Vol. 80, No. 1. Pp. 223-269. Southwood. 1961. The number of species of insect associated with various trees. Journal of Animal Ecology 30 1-8. StatSoft, Inc. 2004. STATISTICA (data analysis software system), version 7. www.statsoft.com Strauss, S. Y. y A. A. Agrawal. 1999. The ecology and evolution of plant tolerance to herbivory. Trends in Ecology & Evolution 14:179-185. Turner, I. M. 1996. Species loss in fragments of tropical rain forest: a review of the evidence. Journal of Applied Ecology 33: 200-209. Valencia-Esquivel, J. I. y C. Martínez-Garza. 2011. PPN en plantaciones experimentales de restauración ecológica en un bosque tropical perene. Resumen de presentación oral en el III Congreso de la Sociedad Científica Mexicana de Ecología. 3-7 abril Boca del Rio, Veracruz. Vásquez, P. A., Grez, A., Bustamante, R. y Simonetti, J. 2007. Herbivory, foliar survival and shoot growth in fragmented populations of Aristotelia chilensis. Acta. Oecológica. 31: 48-53. Vázquez-Torres, W., Armenta-Montero, S., Campos-Jiménez, J. y Carvajal-Hernández , C. I. 2010. Árboles de la región de Los Tuxtlas. Pp 424. Vázquez-Yanes, C., A. I. M. Batís, M. I. S. Alcocer, M. D. Gual, y C. Sánchez. (1999) rboles y Arbustos nativos potencialmente valiosos para la restauración ecológica y la reforestación. Proyecto -084-C NABI . México, D. . Villa-Galaviz E, Boege K y del-Val E 2012. Resilience in plant-Herbivore networks during secondary succession. PLoS ONE 7(12): e53009. doi:10.1371/ 59 Villalpando, O.K. 1972. Consideraciones sobre el clima y el tiempo meteorológico en la Sierra de Los Tuxtlas, Veracruz. En problemas biológicos de la región de Los Tuxtlas, Veracruz. Facultad de Ciencias, Depto. De biología, UNAM, Mexico., D.F. Weis, A. E. y Berenbaum, M. R., 1989. Herbivorous insects and green plants. In: W. G. Abrahamson (ed.), Plant-animal interactions. McGraw Hill-Book Co., New York, Pp. 520. Westoby, M. 1998. A leaf-height-seed (LHS) plant ecology strategy scheme. Plant and Soil 199: 213-227. Whitmore, T.C. 1978. Gaps in the forest canopy. En P. B. Tomlinson y M. H. Zimmerman, editors. Tropical trees as living systems. Cambridge University Press, Cambridge, England. Pp. 639-655. Wilson, E.O. 1988. The current state of biological diversity. En: Wilson (ed.) Biodiversity. National Academic Press. Washington. Pp.3-18. Zar, J., 1996. Biostatistical Analysis. Prentice-Hall Inc., Englewood Cliffs, New Jersey, USA. 60 Apéndices Multiple R (z/xy) = 0.95, P < 0.0001 Area = -31.26 + 9.39 * Ancho + 2.36 * Largo Apéndice 1. Regresión lineal múltiple entre área-largo-ancho de Cedrela odorata. El eje X es el ancho en cm, el eje Y es el largo en cm, y el eje Z es el área en cm2. 61 Multiple R(z/xy) = 0.96, P < 0.0001 Area = -36.26 + 8.04 * Ancho + 3.24 * Largo Apéndice 2. Regresión lineal múltiple entre área-largo-ancho de Inga sinacae. El eje X es el ancho en cm, el eje Y es el largo en cm, y el eje Z es el área en cm2. 62 Apéndice 3. Resultado de ANOVA de medidas repetidas con dos factores independientes: la especie y el hábitat. Como variable dependiente se tomó la herbivoría de los tres muestreos (junio, agosto y octubre). Resaltan en negritas los resultados significativos (P < 0.05). Fuente de variación g.l F P Especie 1 57.19 0.0001 Hábitat 1 0.28 0.598 Especie * Hábitat 1 0 0.977 Error 23 Tiempo 2 10.55 0.0001 Tiempo * Especie 2 11.57 0.0001 Tiempo * Hábitat 2 0.38 0.681 Tiempo * Especie * Hábitat 2 0.03 0.969 Error 46 63 0.48 F (1, 23 ) = 0.001, P < 0.97 ArcSin (raiz (herbivoria + 0.1)) 0.46 Plantaciones Selva 0.44 0.42 0.40 0.38 0.36 0.34 0.32 0.30 Inga sinacae Cedrela odorata Especie Apéndice 4. Herbivoría (arcoseno √ proporción de herbivoría + 0.1) en los individuos de Inga sinacae y Cedrela odorata creciendo en plantaciones experimentales de restauración ecológica y dentro de la selva madura en Los Tuxtlas, Veracruz, México. El estadístico muestra la interacción especie * hábitat. Las líneas representan el intervalo de confianza al 95%. 64 0.48 ArcSin (raiz (herbivoria + 0.1)) 0.46 0.44 F (2, 46) = 0.38, P < 0.68 Plantaciones Selva 0.42 0.40 0.38 0.36 0.34 0.32 junio agosto octubre TIEMPO Apéndice 5. Herbivoría (arco seno √ proporción de herbivoría + 0.1) en los individuos de Inga sinacae y Cedrela odorata creciendo en plantaciones experimentales de restauración ecológica y dentro de la selva madura durante junio, agosto y octubre en Los Tuxtlas, Veracruz, México. El estadístico muestra la interacción tiempo * hábitat. Las líneas representan el intervalo de confianza al 95%. 65 0.60 ArcSin (raiz (herbivoria + 0.1)) 0.55 Inga sinacae Cedrela odorata F (2, 46) = 0.03, P < 0.96 0.50 0.45 0.40 0.35 0.30 0.25 Plantaciones Selv a Junio Plantaciones Selv a Agosto Plantaciones Selv a Octubre Apéndice 6. Herbivoría (arcoseno √ proporción de herbivoría + 0.1) en los individuos de Inga sinacae y Cedrela odorata creciendo en plantaciones experimentales de restauración ecológica y dentro de la selva madura en durante junio, agosto y octubre en Los Tuxtlas, Veracruz, México. El estadístico muestra la interacción tiempo * especie * hábitat. Las líneas representan el intervalo de confianza al 95%.