descripción de la tabla periódica
Anuncio

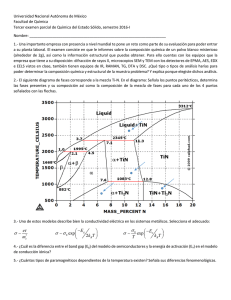
DESCRIPCIÓN DE LA TABLA PERIÓDICA 09 1 Reconoce y explica el significado de los datos de cada elemento que presenta la tabla periódica. En “Presentación de contenidos” se estudia qué es un elemento químico, qué es la tabla periódica y el significado de los datos que contiene esta tabla. En “Ejercicios” encuentran diferentes datos de ciertos elementos químicos. En “Aplico” juegan a representar en el modelo el número atómico, el periodo y el grupo (familia) de diferentes elementos químicos. DESCRIPCIÓN DE LA TABLA PERIÓDICA. Todo lo que nos rodea está formado por asociaciones (conjunto) microscópicas denominadas moléculas. Las moléculas se forman de átomos. Se han detectado algo más de 100 átomos (aunque existen muchísimas moléculas diferentes). El centro del átomo (llamado núcleo) está formado por 2 partículas: Protones: que tienen carga eléctrica positiva y Neutrones: que no tienen carga eléctrica. Alrededor del núcleo y girando a gran velocidad se encuentran los electrones que tienen carga eléctrica negativa. Al tipo de materia que está constituida por átomos de la misma clase se le llama “elemento químico”. La tabla periódica es un esquema formado de cuadros que presenta, organiza, clasifica y agrupa elementos químicos de acuerdo a sus características. Cada cuadro de la tabla periódica representa un elemento químico y ofrece información sobre uno de sus átomos. Por lo general, las tablas periódicas presentan en cada uno de los cuadros del esquema la siguiente información: Los elementos de la tabla periódica están ordenados de forma vertical y de forma horizontal. Las columnas (verticales) se llaman grupos y las filas (horizontales) se llaman periodos. ¿Cómo se organizan los elementos químicos en la tabla periódica?... 1. Elementos químicos organizados por su “masa atómica relativa”: “Masa atómica relativa” es el peso de cada átomo del elemento, es decir: “masa atómica relativa = peso atómico = peso de protones + peso de neutrones + peso de electrones”. Los elementos de la tabla periódica están ordenados de derecha a izquierda y de arriba abajo de acuerdo a su “masa atómica relativa”. 2. Elementos químicos organizados por el número atómico (Z): El número atómico es igual al número de protones de cada elemento. En todo átomo neutro el número de protones es igual al número de electrones. Por ejemplo, si el Oxígeno (O) tiene número atómico 8, significa que tiene 8 protones y 8 electrones. Por lo tanto el oxígeno tiene 8 protones y su número atómico es 8. Por lo tanto, O Z = 8 3. Elementos químicos organizados por Periodos: Los periodos son las filas horizontales de la tabla periódica, en total existen 7 periodos. Los periodos organizan a los elementos químicos de acuerdo al último nivel energético ocupado. Los niveles energéticos son órbitas entre los que están distribuidos los electrones. Cada átomo tiene tantos orbitales como su número de electrones lo requiera; en un átomo los niveles de energía son máximo 7 y se nombran de adentro hacia afuera con una letra mayúscula que va desde la K a la Q (observa la siguiente imagen). Cada nivel es capaz de contener tantos electrones como sus subniveles los permitan. Los subniveles energéticos son orbitales y a las que se les nombra con las letras “s”,”p”,”d”,”f”. Cada subnivel contiene un cierto número de electrones. El máximo de electrones que se aceptan en cada subnivel es: Para aclarar esto veamos un ejemplo: Observemos que el primer nivel (“K”) tiene un solo subnivel (“s”) y en el cuarto nivel (“N”) hay cuatro subniveles (“s, p, d, f”). El Cloro (Cl), por ejemplo, tiene como último nivel electrónico al nivel 3 o “M” y por ello está ubicado en el tercer periodo de la tabla periódica. 4. Elementos organizados por Grupos: Los grupos, son las columnas verticales de la tabla periódica; existen 18 grupos. En cada grupo se encuentran elementos que tienen la misma cantidad de electrones en su última capa. El último nivel electrónico ocupado de cada elemento (llamado capa electrónica de valencia) define la forma en que los átomos se enlazan entre sí para generar compuestos (la cantidad de electrones que existen en la última capa es conocida como valencia atómica). Los grupos se nombran de izquierda a derecha por lo que los elementos del grupo extremo izquierdo tienen valencia 1 (+1), es decir que tienen un electrón en la última capa y que son propensos a perderlo cuando se combinan con otro elemento, por lo que son altamente reactivos. Los elementos que se encuentran en el grupo 17 o VIIA tiene 7 electrones en su último nivel por lo que tiene valencia -1 (ya que al unirse con otro elemento es más fácil ganar un electrón que perder siete). Los elementos químicos que se encuentran en el extremo derecho (grupo 18 o VIIIA) sus átomos tienen 8 electrones en su último nivel por lo cual son extremadamente poco reactivos. En los grupos, existen 2 nomenclaturas gracias a la aportación que hacen 2 instituciones encargadas del estudio químico: a) La nomenclatura dada por la Unión Internacional de Química Pura y Aplicada (IUPAC ) quien nos dice que los grupos se deben nombrar con un número arábigo que asciende de izquierda a derecha desde el 1 hasta el 18 (clasificación de los grupos que está cada vez más en desuso). b) La segunda nomenclatura dada por la Chemical Abstracts Service (CAS) que propone que los grupos se nombren con un número arábigo y una letra mayúscula que puede ser A o B (antes se proponía un número romano y una letra mayúscula). El número se obtiene de la suma de los subniveles energéticos ”s” o “s,p”del último nivel que los contenga. La letra A se aplica si la configuración electrónica termina en “s” o “p”. La letra B se aplica si la configuración electrónica termina en el subnivel energético “d”. Si la configuración electrónica del elemento termina en el subnivel energético “f” es un elemento de transición interna o de tierras raras. 1) Colorea en la tabla periódica los siguientes elementos: Utilizar éste cuadro si es que existiera nota para el maestro. a) b) c) d) e) f) g) El elemento que tiene menor peso atómico. Colorea de otro color a Z=78 Colorea los elementos del tercer periodo. Colorea los elementos que correspondan al nivel de energía “L”. Colorea los elementos que correspondan con el subnivel “s”. Colorea los elementos del grupo 7B”. Colorea los dos elementos que tienen mayor masa atómica relativa. g 2) g RESPUESTA Contesta… h) ¿Cuáles son los elementos del primer periodo? Hidrógeno (H) y Helio (H). i) ¿Cuáles son los subniveles energéticos del nivel “N”? s, p, d, f. j) ¿Cómo se nombran los grupos de acuerdo a la nomenclatura propuesta por Ia CAS? Con un número arábigo que va del 1 al 8 y por una letra mayúscula que puede ser A o B. Equipos de tres integrantes. Recortables de la lección. Cinta adhesiva. Juegan a representar en el modelo número atómico, periodo y grupo de ciertos elementos químicos. 5 Minutos: Armado en equipos de 3 10 Minutos: Ensamblado de las partes. Modelo terminado DSC_0001 DSC_0002 DSC_0003 DSC_0004 DSC_0005 DSC_0006 DSC_0007 DSC_0008 DSC_0009 Alumno 01 DSC_0010 DSC_0063 DSC_0062 DSC_0061 DSC_0060 DSC_0059 DSC_0057 DSC_0058 DSC_0055 DSC_0056 DSC_0054 DSC_0053 DSC_0052 DSC_0051 DSC_0050 DSC_0048 DSC_0049 DSC_0047 DSC_0046 DSC_0045 DSC_0044 DSC_0043 DSC_0042 DSC_0041 DSC_0040 DSC_0039 DSC_0038 DSC_0037 DSC_0036 Alumno 02 DSC_0035 DSC_0034 DSC_0032 DSC_0033 DSC_0031 DSC_0030 DSC_0029 DSC_0028 DSC_0027 Alumno 03 X2 DSC_0026 X2 DSC_0025 X2 X2 DSC_0024 DSC_0023 DSC_0022 DSC_0021 DSC_0019 DSC_0018 DSC_0017 DSC_0016 DSC_0015 Integración Alumno 01, 02 y 03 DSC_0013 DSC_0012 DSC_0014 DSC_0011 DSC_0010 DSC_0007 DSC_0006 DSC_0002 El modelo incluye: 1 ruleta con un recortable que indica los grupos de la tabla periódica con su manivela e indicador. 1 ruleta con un recortable que indica los periodos de la tabla periódica con su manivela e indicador. Transmisión de número atómico con su manivela e indicador. Una tabla periódica (recortable). DSC_0001 Preparación del juego. Todos los equipos coloquen en un extremo del salón su modelo y en el otro extremo colóquense los integrantes del equipo con su tabla periódica. ¿Cómo jugaremos con el “modelo”? 1) 2) 3) 4) 5) El maestro dice un elemento de la tabla periódica. El equipo ubica en la tabla periódica el elemento químico y busca su número atómico, su periodo y el grupo o familia. Cuando el equipo tenga estos datos, uno de los integrantes del equipo corre al modelo e indica los tres datos En el siguiente ejercicio debe salir otro integrante y en el siguiente ejercicio el integrante que falta; después corre el primer integrante y así en todos los ejercicios. En cada ejercicio los 5 primeros equipos que muestren al maestro estos 3 datos representados en el modelo ganan 10 puntos. Ejemplo: 1) 2) 3) 4) Supongamos que el maestro dice: “Estaño”. El equipo ubica este elemento en su tabla periódica y busca el número atómico que tiene (“50”), a qué periodo corresponde (al “5”) y el grupo en el que se encuentra el Estaño (en el “4A”). Entonces el primer integrante memoriza estos datos y corre hasta el modelo para representarlos. Cuando el modelo esté listo muestra al maestro y si el ejercicio se respondió correctamente se otorga 10 puntos al equipo. DSC_0010 Comencemos... Antes de otorgar puntos al equipo que haya terminado el ejercicio, el maestro debe revisar que los datos que se presentan en el modelo son correctos y después dará 10 puntos a los primeros 5 equipos. Recomendamos escribir los resultados de los equipos en un lugar visible para todos. Ejercicios: El maestro dice el primer elemento... (sólo debe decir el primer elemento químico que será el ejercicio 1, el segundo elemento será el ejercicio 2 y así sucesivamente hasta completar los 10 ejercicios) EL MAESTRO DICE… # ATÓM. PERIODO GRUPO 1 CALCIO 20 4 2A 2 PLATA 47 5 1B 3 XENÓN 54 5 8A 4 SODIO 11 3 1A 5 PLOMO 82 6 4A 6 YODO 53 5 7A 7 FRANCIO 87 7 1A 8 ALUMINIO 13 3 3A 9 MERCURIO 80 6 2B 10 CARBONO 6 2 3A