APF 1.5 Reacciones Adversas-20160204-144855
Anuncio

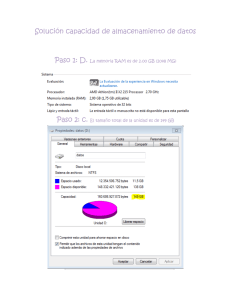
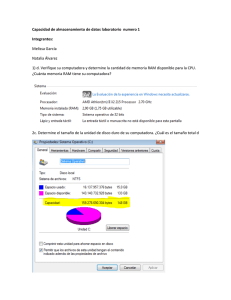
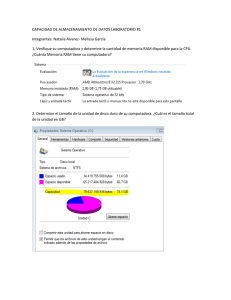
2015 [PROCEDIMIENTO DE NOTIFICACIÓN DE REACCIONES ADVERSAS A MEDICAMENTOS A LA AUTORIDAD PERTINENTE] COD CM/FAR/003 Versión: Nº 1.2 Característica: APF 1.5 Elaborado por: Q.F. Rosana Cartes C. Marzo 2015. Revisado por: Unidad de Calidad Marzo 2015. Aprobado por: Dirección Médica Abril 2015. Próxima Revisión: 2018. Nº Páginas: 10 [PROCEDIMIENTO DE NOTIFICACIÓN DE REACCIONES ADVERSAS A LA AUTORIDAD PERTINENTE] COD CM/FAR/003 Edición: Nº 1.2 Elaboración: 2015 Vigencia: 2018 Página: 2 de 10 CLÍNICA MAYOR ÍNDICE 1. INTRODUCCIÓN 2. OBJETIVO 3. ALCANCE 4. DOCUMENTOS DE REFERENCIA 5. RESPONSABLES DE LA EJECUCIÓN 6. DEFINICIONES 7. DESARROLLO 8. DISTRIBUCIÓN 9. RESPONSABILIDAD DEL ENCARGADO 10. ANEXO 2 [PROCEDIMIENTO DE NOTIFICACIÓN DE REACCIONES ADVERSAS A LA AUTORIDAD PERTINENTE] COD CM/FAR/003 Edición: Nº 1.2 Elaboración: 2015 Vigencia: 2018 Página: 3 de 10 CLÍNICA MAYOR 1. INTRODUCCIÓN Al momento de comercializar un medicamento se realizan diversos estudios en el ámbito científico, en un corto plazo y en un número reducido de personas. Por lo tanto, esta información no es suficiente para predecir lo que ocurrirá en la práctica clínica habitual en cuanto a las reacciones adversas poco frecuentes, que son más fáciles de detectar una vez comercializado. Como una manera de monitorear y evaluar el perfil de seguridad de los medicamentos, es que se implementa un programa de farmacovigilancia que tiene como objetivo evaluar, prevenir y/o reducir los efectos nocivos para el paciente. 2. OBJETIVO - Establecer un procedimiento de Notificación de Reacciones Adversas a Medicamentos. - Tener información sobre las reacciones adversas a medicamentos, principalmente de aquellos que forman parte del arsenal fármaco-terapéutico de la Clínica. 3. ALCANCE Este procedimiento se aplicará en la Unidad de Farmacia, Unidad de Paciente Crítico, Urgencia, Pabellón y recuperación y Servicio Médico Quirúrgico. 4. DOCUMENTOS DE REFERENCIA - Norma Técnica General Técnica 0140. Sistema nacional de farmacovigilancia de productos farmacéuticos de uso humano. - Instituto de Salud Pública http://www.ispch.cl/ctrl/cenimef/cenimef.html - Instructivo para la notificación de sospecha de reacciones adversas a medicamentos, ISP. - Formulario de Notificación de sospecha de reacción adversa. 5. RESPONSABLES DE LA EJECUCIÓN Químico Farmacéutico: - Deberá recepcionar todas las alertas de Reacciones Adversas a Medicamentos. Notificar Reacciones Adversas a Medicamentos al Centro Nacional de Información de Medicamentos y Farmacoviligancia del Instituto de Salud Pública. 3 [PROCEDIMIENTO DE NOTIFICACIÓN DE REACCIONES ADVERSAS A LA AUTORIDAD PERTINENTE] COD CM/FAR/003 Edición: Nº 1.2 Elaboración: 2015 Vigencia: 2018 Página: 4 de 10 CLÍNICA MAYOR - - Mantener un registro de lo reportado y de las respuestas recibidas del Centro Nacional de información de Medicamentos y Farmacoviligancia. Retroalimentar a los notificadores y Servicios Clínicos donde se pesquisó la Reacción Adversa a Medicamentos con la información recibida del Centro Nacional de Información de Medicamentos y Farmacoviligancia. Es responsable de participar en la elaboración, implementación y evaluación de planes de mejora asociados al presente documento Profesionales de la salud: - Notificar reacción adversa a medicamento a Químico Farmacéutico mediante formulario para este fin. 6. DEFINICIONES Reacción Adversa a Medicamentos (RAM): Todo efecto perjudicial o indeseado que aparece con las dosis usuales utilizadas en el hombre para profilaxis, diagnóstico o terapéutica (OMS). Centro Nacional de Información de Medicamentos y Farmacovigilancia (CENIMEF): Es la sección del Instituto de Salud Pública encargada de entregar información objetiva y evaluada de medicamentos, principalmente a los profesionales de la salud del país y al público general, además, tiene a su cargo del Programa Nacional de Farmacovigilancia Farmacovigilancia: Notificación, registro y evaluación sistemática de las Reacciones Adversas a los Medicamentos (RAM) y sus principales objetivos son determinar la frecuencia, gravedad e incidencia de las RAM para prevenir su aparición. Reacción Adversa Grave: Cualquier RAM que cumpla una de las siguientes condiciones: - Ponga en peligro la vida o sea mortal. Implique incapacidad o invalidez grave. Cause o prolongue la hospitalización. Reacción Adversa Inesperada: Es una reacción adversa que no se menciona en la monografía del producto, o en los folletos de información al paciente o al profesional autorizados en el respectivo registro sanitario. 4 [PROCEDIMIENTO DE NOTIFICACIÓN DE REACCIONES ADVERSAS A LA AUTORIDAD PERTINENTE] COD CM/FAR/003 Edición: Nº 1.2 Elaboración: 2015 Vigencia: 2018 Página: 5 de 10 CLÍNICA MAYOR 7. DESARROLLO Al existir sospecha de una RAM el profesional que la pesquisa, ya sea médico, enfermera, matrona u otro, debe completar y enviar Formulario de Notificación de Efectos Adversos a Medicamentos a Químico Farmacéutico. Los profesionales de la salud tienen el deber de comunicar todas las reacciones adversas de las que tengan conocimiento y que pudieran haber sido causadas por un determinado medicamento. Además de aquellas RAM que sean: - Graves: Peligre la vida o mortal, incapacidad o invalidez grave y aquellas que prolonguen la hospitalización del paciente. Inesperadas: No mencionadas en la monografía. Medicamentos de reciente incorporación. Medicamentos origen biológico Medicamentos con falta de eficacia Intoxicaciones agudas o crónicas Luego de recibir la información en farmacia, se debe revisar la literatura sobre las posibles RAM descritas para el fármaco en cuestión y el tratamiento a seguir, lo cual se debe informar para evaluar la situación del paciente. Posterior a ello el Químico Farmacéutico debe recopilar información para llenar el “Formulario de notificación de sospecha de reacciones adversas a medicamentos” proporcionado por el CENIMEF, en caso de que falten algunos datos deberá acudir al Servicio Clínico donde se pesquiso la RAM para obtener mayor información. Luego este formulario debe ser enviado al CENIMEF. El CENIMEF, recepciona las notificaciones de RAM, las cuales son valoradas y evaluadas. Posteriormente esta institución debe emitir un informe acerca de la RAM comunicada, al centro que realizó la notificación. Una vez recepcionada la respuesta del CENIMEF, el Químico Farmacéutico deberá informar la respuesta al notificante y al servicio clínico donde se pesquiso la RAM. Plazos para la Notificación de sospecha de RAM 5 [PROCEDIMIENTO DE NOTIFICACIÓN DE REACCIONES ADVERSAS A LA AUTORIDAD PERTINENTE] COD CM/FAR/003 Edición: Nº 1.2 Elaboración: 2015 Vigencia: 2018 Página: 6 de 10 CLÍNICA MAYOR Las RAM graves se deben informar inmediatamente, ya que al CENIMEF es obligación reportar dentro de las 72 horas siguientes de ocurrido el hecho. Aquellas sospechas de RAM que no sean consideradas graves deben notificarse lo antes posible, para enviar la información dentro del plazo de 30 días. Criterios mínimos para la Notificación de sospecha de RAM Todas las notificaciones deben contar como mínimo con los siguientes datos: Paciente identificable Identificación del medicamento sospechoso y la fecha de inicio y término de su administración Descripción de la sospecha de RAM, y su fecha de inicio Información del notificador 8. DISTRIBUCIÓN El presente procedimiento se distribuirá: - Unidad de Farmacia Servicio de Urgencia Servicio de Pabellón y Recuperación Servicio Médico Quirúrgico Unidad de Paciente Crítico Unidad de Calidad. 9. RESPONSABILIDAD DEL ENCARGADO. Director Médico es responsable de velar por el estricto cumplimiento del protocolo y junto a Químico Farmacéutico y Comité de Calidad efectuar y proponer modificaciones al documento que en la práctica se precisen. 6 [PROCEDIMIENTO DE NOTIFICACIÓN DE REACCIONES ADVERSAS A LA AUTORIDAD PERTINENTE] COD CM/FAR/003 Edición: Nº 1.2 Elaboración: 2015 Vigencia: 2018 Página: 7 de 10 CLÍNICA MAYOR 10.-ANEXO Anexo Nº 1: Instructivo para completar el Formulario de Notificación de Sospechas de Reacciones Adversas a Medicamentos (RAM) DATOS DEL PACIENTE. Nombre y apellidos: Puede colocar nombre o iniciales. Se recuerda que la información es absolutamente confidencial. Número de Ficha: Información necesaria para confirmar datos o hacer un seguimiento. Edad: Expresar en años. Utilizar meses (M) si el paciente es menor de 1 año (Ej.04 M) y días (D), si es menor de un mes (Ej. 15 D). Peso: Expresar en Kg. Esta información es particularmente importante en ancianos, niños y pacientes obesos. Si desconoce el peso exacto, por favor coloque el peso aproximado y entre paréntesis indique "aprox." Talla: Usar en cm. De gran importancia en niños y en el reporte de sospecha de RAM de fármacos oncológicos. Unidad/Servicio: Señalar la unidad o servicio en la que el paciente se encontraba al momento de presentar la RAM. DESCRIPCIÓN DE LA RAM. Describa detalladamente cuáles fueron los signos o síntomas que considere puedan estar relacionados con la administración del medicamento. Describa el evento resumiendo toda la información clínica relevante. FECHA DEL EVENTO. Es importante para la evaluación de causalidad, indique la fecha exacta en la cual se inició la reacción adversa de la siguiente manera DD-MM-AAAA. Si no tiene la fecha exacta puede señalar el mes y año de ocurrencia de la reacción. FÁRMACO(S) SOSPECHOSO(S) Y CONCOMITANTE(S) Indicar con una X, en el casillero correspondiente con la letra S = Fármaco Sospechoso y con la letra C = Fármaco Concomitante. Señale la marca comercial®; si la desconoce, señale el nombre genérico y el laboratorio, señalar el número de serie o lote si es posible. Si el fármaco sospechoso es un producto biológico, deberá hacer todo lo posible para señalar el número de serie o lote. Indique todos los otros fármacos (incluyendo analgésicos, vitaminas, “productos naturales” y hierbas) recetados o automedicados que el paciente esté consumiendo con sus respectivas dosis, vía de administración, razón de uso y fecha de inicio y término del tratamiento. Si el paciente no está consumiendo otros fármacos, señálelo explícitamente. 7 [PROCEDIMIENTO DE NOTIFICACIÓN DE REACCIONES ADVERSAS A LA AUTORIDAD PERTINENTE] COD CM/FAR/003 Edición: Nº 1.2 Elaboración: 2015 Vigencia: 2018 Página: 8 de 10 CLÍNICA MAYOR DOSIS Y VÍA DE ADMINISTRACIÓN Indicar la dosis administrada al paciente, en cantidad y unidades de medida y describa la vía de administración del medicamento. Ejemplos: 500 mg 3 veces al día, vía oral; 10 mg diarios infusión IV, bolus IV. FECHA DE INICIO. Indique la fecha en la que inició la administración tanto del fármaco bajo sospecha como de los medicamentos concomitantes. FECHA DE TÉRMINO. Indique la fecha en que dejó de administrarse cada uno de los medicamentos. Si el fármaco continúa siendo administrado, especificarlo en la casilla correspondiente a Fecha de Término de la siguiente manera: CONT RAZÓN DE USO. Señalar la enfermedad o patología del paciente para la cual fue prescrito cada medicamento. TRATAMIENTO DE LA RAM. Señalar las medidas adoptadas frente al evento adverso (por ej. suspensión del tratamiento, ajuste de dosis, administración de antídoto específico, administración de tratamiento paliativo, etc.). SUSPENSIÓN/READMINISTRACIÓN. Indicar con una X en el apartado si el fármaco fue suspendido a causa de la RAM. Si no es suspendido por esta causa marcar NO. En caso que el fármaco se suspenda, indicar si éste fue readministrado o no, e indicar si con la suspensión presenta o no mejoría. Señalar en el apartado correspondiente si existe reaparición de la RAM posterior a la readministración del medicamento. Detallar en el apartado “COMENTARIOS” el resultado de la readministración. RESULTADO DE LA RAM. Indicar con una X el resultado obtenido en el casillero correspondiente. Es relevante saber si al momento del reporte el paciente está recuperado, no recuperado, o si se sospecha que la reacción adversa ha causado la muerte al paciente. CONSECUENCIA DE LA RAM. Indicar con una X la consecuencia de la reacción adversa en el casillero correspondiente. Es relevante saber si originó una hospitalización, o prolongó los días de una hospitalización en curso. Este dato permitirá evaluar la gravedad del evento. 8 [PROCEDIMIENTO DE NOTIFICACIÓN DE REACCIONES ADVERSAS A LA AUTORIDAD PERTINENTE] COD CM/FAR/003 Edición: Nº 1.2 Elaboración: 2015 Vigencia: 2018 Página: 9 de 10 CLÍNICA MAYOR COMENTARIOS. Incluir cualquier antecedente clínico relevante, tales como patología de base, alergias previas, enfermedades concomitantes, exposición previa a los medicamentos, datos de análisis de laboratorio, etc. En este apartado puede complementar el caso y detallar el resultado de la suspensión y/o readministración del fármaco. Si necesita más espacio, agregar hoja anexa. Es especialmente relevante en este apartado el describir otras situaciones que pudieran constituir causas alternativas de la sintomatología que presenta el paciente; ejemplo: estados de estrés o ansiedad, excesos o desajustes alimenticios, exposición a alimentos o animales a los cuales es alérgico, etc. DATOS DEL INFORMANTE. Indique su nombre, profesión, ciudad, establecimiento a que pertenece, teléfono, FAX y correo electrónico. Esta información será de gran utilidad para obtener información adicional en el caso que sea necesario y para comunicarle si están descritos otros casos similares a los reportados por Ud. en el país o en el extranjero. Debe registrar la fecha de reporte. Es importante señalar en el casillero correspondiente si este reporte es inicial o es un seguimiento a un reporte anterior. 9 [PROCEDIMIENTO DE NOTIFICACIÓN DE REACCIONES ADVERSAS A LA AUTORIDAD PERTINENTE] COD CM/FAR/003 Edición: Nº 1.2 Elaboración: 2015 Vigencia: 2018 Página: 10 de 10 CLÍNICA MAYOR 10