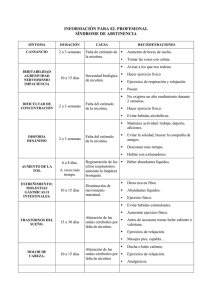
De la neurobiología de la adicción a la nicotina al
Anuncio

Prev tab 83 (56 pag) 26/10/06 13:24 Página 116 REVISIÓN De la neurobiología de la adicción a la nicotina al tratamiento del tabaquismo. Progresos terapéuticos J.I. de Granda Orive, S. Solano Reina1, J. Jareño Esteban, A. Pérez Trullén2, M. Barrueco Ferrero3, C.A. Jiménez Ruiz4 Servicio de Neumología, Hospital Central de la Defensa Gómez Ulla, (Madrid). 1Servicio de Neumología, Hospital Universitario Gregorio Marañón (Madrid). 2Servicio de Neumología, Hospital Clínico Universitario Lozano Blesa (Zaragoza). 3Servicio de Neumología, Hospital Clínico Universitario (Salamanca). 4Unidad Especializada de Tabaquismo, Dirección General de Salud Pública y Alimentación (Madrid) INTRODUCCIÓN La adicción es una enfermedad primaria, que afecta al sistema nervioso central, y está constituida por un conjunto de síntomas y signos característicos. El origen de la adicción es multifactorial, implicándose factores biológicos, genéticos, psicológicos y sociales. Adicción es, por lo tanto, la necesidad imperiosa o compulsiva de volver a consumir una droga para experimentar la recompensa que produce, y droga es toda sustancia natural o sintética que genera adicción1-3. Así, se puede decir que las drogas inducen adicción y refuerzan la conducta asociada a su uso (reforzador positivo). Cesar o reducir el consumo de la droga induce abstinencia, que es el conjunto de molestias emocionales y físicas que se caracterizan por un cambio desadaptativo del comportamiento, con alteraciones fisiológicas y cognitivas paralelas3. Evitar la abstinencia es también otra causa de búsqueda y recaída en la droga (reforzador negativo). Dependencia es el conjunto de cambios neurobiológicos que subyacen al consumo de la droga y que causan adicción, siendo la adicción un grado elevado de dependencia3. La diferencia entre los términos adicción y dependencia es confusa, considerándolos la clasificación DSM - IV - TR (criterios de la dependencia de sustancias: Tabla I)4 sinónimos en lo que se refiere a las drogas adictivas, y defiCorrespondencia: Dr. José Ignacio de Granda Orive. C/ Cavanilles 43, 7º E, 28007 Madrid Correo electrónico: igo01m@saludalia.com Recibido: Mayo 2006. Aceptado: Junio 2006 [Prev Tab 2006; 8(3): 116-128] 116 1. Tolerancia: que implica la disminución del efecto obtenido con una dosis constante de la droga, lo que hace que se incremente progresivamente la dosis para obtener el grado de satisfacción deseado 2. Privación: que implica la aparición de un síndrome de abstinencia ante la falta de la droga. 3. Fumar una cantidad mayor, o por un período de tiempo mayor que el que se desea. 4. Tener un deseo persistente de fumar e intentos fallidos para disminuir la cantidad que se fuma. 5. Utilizar considerables períodos de tiempo obteniendo o usando tabaco. 6. Rechazar o despreciar oportunidades sociales y de trabajo por fumar. 7. Continuar fumando aun a sabiendas del daño que ocasiona a la salud. Modificado de la referencia 4. TABLA I. Criterios de dependencia a la nicotina propuestos por la clasificación de enfermedades mentales DSM-IV-TR. niéndolos como un grupo de tres o más síntomas de los enumerados en la Tabla I y, que aparecen en cualquier momento dentro de un mismo período de doce meses. Las drogas que producen un estado intenso de euforia son aquellas que con mayor probabilidad serán consumidas repetidamente (propiedades reforzadoras) y aquellas que alcancen niveles cerebrales efectivos y, en forma rápida, son también las que ofrecen mayor potencial de abuso en la medida en que la cadena de eventos conducentes a una pérdida del control sobre su consumo es más probable que ocurra. La nicotina cumple todos los criterios que una sustancia debe presentar para ser considerada como droga adictiva: el De la neurobiología de la adicción a la nicotina al tratamiento del tabaquismo… J.I. de Granda Orive et al. Prev tab 83 (56 pag) 26/10/06 13:24 Página 117 consumo es más prolongado en el tiempo o en mayor cantidad de lo que inicialmente fue previsto (tolerancia), existe el deseo de abandonar el consumo e incluso se ha intentado en varias ocasiones el dejarlo previamente, empleo a diario de mucho tiempo en procesos relacionados con el consumo de la sustancia, incluso limitando las actividades diarias, mantenimiento del consumo aun cuando se conozcan ya efectos nocivos por la misma y, el desencadenamiento del síndrome de abstinencia al intentar dejarlo1. Por lo tanto, la nicotina es una droga psicoactiva, generadora de dependencia, con conductas y alteraciones físicas específicas. En los últimos 25 años se han identificado los receptores primarios de casi la mayoría de las drogas de abuso, localizándolas en el cerebro, conociéndose los neurotransmisores asociados a dichos receptores. Se demostró que la activación de esas áreas se producía durante la adicción, el síndrome de abstinencia y los deseos por las drogas; se identificaron los mecanismos íntimos de la conducta de búsqueda y la dependencia física a drogas y se demostró la importancia del sistema mesolímbico de la dopamina, en la disfunción adictiva producida por drogas de abuso. La nicotina es capaz de producir gradualmente alteraciones en la función cerebral en respuesta a períodos prolongados de exposición y, estas alteraciones cerebrales se convierten en constantes, en consecuencia, los cambios persisten en el tiempo al interrumpir la administración de la sustancia. Tanto la tolerancia como la reducción de los efectos de la droga requieren la administración repetida o el aumento de la dosis para mantener los mismos daños. Dentro de las acciones neurobiológicas del tabaco se destaca su acción sobre la vía mesolímbica, la más relacionada con la adicción nicotínica. Los cuerpos neuronales de esta vía se localizan en el área tegmental ventral y proyectan sus axones hacia el núcleo accumbens, en el que se diferencian dos zonas; la periférica y el núcleo. Esta última está implicada en el proceso de la adicción. La nicotina, por lo tanto, liberaría dopamina en el núcleo central del accumbens, al activar los receptores de la vía1,2. En la fase de abstinencia nicotínica se produce un déficit de dopamina a nivel del núcleo accumbens. Todo lo anterior habla a favor de la participación del sistema dopaminérgico en la generación de dependencia. Por otra parte, la vía amigdalina del sistema noradrenérgico también participa en el proceso de adicción nicotínica. Al activar la nicotina la síntesis de noradrenalina, por su efecto directo sobre el locus coeruleus, aumenta la actividad del eje hipotálamo - hipofisario liberando, así la hormona liberadora de corticotropina y la hormona adrenocorticotropa. Por otra parte, al dejar de fumar se descarga una gran cantidad de noradrenalina, lo que tiene que ver con situaciones de estrés y respuesta emocional (síndrome de abstinencia). El sisPREVENCIÓN DEL TABAQUISMO vol. 8 nº 3, julio-septiembre 2006 tema glutamatérgico, cuyo mecanismo de acción es por la vía dopaminérgica a través de los aminoácidos excitadores, también desempeña un papel en el proceso de la adicción, al ser activados por la nicotina los receptores NMDA (N Metil D Aspartamo) manteniendo ésta activación una alargada potenciación de las vías aferentes dopaminérgicas (área tegmental ventral y núcleo accumbens). Además, existe una disminución de la amplitud de la acción del sistema colinérgico, sistema que tiene una gran importancia en funciones cognoscitivas y afectivas. Por otro lado, al alcanzar la nicotina a los receptores de acetilcolina del área tegmental ventral, que se expresan mediante el ácido gamma amino butírico (GABA), aumentan la carga inhibitoria y son desensibilizados rápidamente, por lo que disminuye el efecto modulador negativo sobre las neuronas dopaminérgicas aumentando así el efecto excitatorio de éstas1,2,5. La nicotina incrementa la actividad dopaminérgica y del sistema opioide endógeno en el sistema mesolímbico. El sistema opioide endógeno regula la función de las vías nerviosas implicadas en los procesos de refuerzo y motivación, pudiendo ser denominado como el sistema opioide de recompensa. La liberación de los precursores del sistema opioide, por la acción directa de la nicotina, y su acción sobre los receptores opioides induce efectos reforzantes y de dependencia física. Recientemente se ha implicado al sistema endocannabinoide endógeno en la adicción a la nicotina. Hoy se conoce, en relación a los cannabinoides, que los receptores de membrana a los que se une el tetrahidrocannabinol y otros cannabinoides presentes en la Cannabis sativa, lo son para una serie de ligandos endógenos que por analogía funcional se les ha denominado cannabinoides endógenos o endocannabinoides6. Este sistema endocannabinoide endógeno esta formado por al menos dos tipos de receptores acoplados a proteínas, llamados CB1 (presente principalmente en el sistema nervioso) y CB2 (presente principalmente en el sistema inmune), y por los ligandos endógenos que activan estos receptores6 (derivados del ácido araquidónico). Desde hace poco tiempo se conoce cómo los endocannabinoides son sintetizados, liberados, recaptados y degradados a nivel de las células nerviosas, lo que confirma su función como neuromoduladores7. El sistema endocannabinoide juega un papel importante a nivel cerebral donde participa en la regulación de la actividad motora, del aprendizaje, la memoria, la nocicepción así como en el desarrollo cerebral. Igualmente tiene importancia en la regulación neurovegetativa y neuroendocrina así como cardiovascular. El sistema endocannabinoide formaría parte de la red de recompensa cerebral que activan diversos tipos de reforzadores, entre ellos la nicotina. Se ha verifi117 Prev tab 83 (56 pag) 26/10/06 13:24 Página 118 cado recientemente la inducción, por parte del sistema cannabinoide, de mecanismos de dependencia y tolerancia (lo que tiene una base farmacodinámica, es decir, sería como consecuencia de una reducción notable de la densidad, afinidad y/o eficacia de los receptores CB1) así como la facultad de producir refuerzo positivo identificándose su síndrome de abstinencia. El sistema actuaría de forma aguda y crónica sobre las neuronas del sistema dopaminérgico, modulando la transmisión de los circuitos de recompensa GABA y glutamato (receptores CB1 presinápticos regulan la liberación de glutamato y GABA) además de interactuar con neuropépticos relevantes en la motivación (péptidos opiodes y factor de liberación corticotropo). Existe, por lo tanto, un sustrato común neurobiológico para los procesos a las drogas adictivas con una interacción bidireccional a nivel cerebral, estando el sistema endocannabinoide implicado en esta vía común8,9. Más recientemente se ha podido demostrar que este sistema participaría en los efectos de recompensa primaría a los cannabinoides y opioides exógenos, nicotina y alcohol a través de la liberación de endocannabinoides en el área tegmental ventral. Asimismo, los endocannabinoides estarían implicados en la motivación para la búsqueda de las drogas de abuso por un mecanismo independiente de la vía dopaminérgica. También ha sido involucrado en las recaídas secundarias a una conducta de búsqueda mediando en los efectos motivacionales de los estímulos ambientales debidos a la droga y a su reexposición10. La nicotina, como droga adictiva que es, actúa sobre mecanismos neurofisiológicos comunes y en el estado de consumo agudo, el que se refiere a los primeros contactos con la droga, se establecen el conocimiento de sus efectos placenteros y el aprendizaje tendente a su consumo produciéndose una activación de la vía mesolímbica dopaminérgica. Esta activación inicial por la nicotina sobre las neuronas gabaérgicas del área tegmental ventral produciría un efecto reforzante a través de un sistema gabaérgico dependiente que proyectaría sobre el núcleo tegmental pedúnculo pontino. En este efecto podría estar envuelta la activación de receptores de acetilcolina presinápticos que contienen la subunidad alfa7, ya que al ser bloqueados se interfiere con el resultado reforzador de la nicotina dejando el efecto aversivo a la nicotina intacto. De todas maneras la nicotina también realizaría su efecto motivacional a través de una acción directa sobre receptores de acetilcolina que contienen la subunidad beta2 localizadas en neuronas gabaérgicas y dopaminérgicas, pues al ser bloqueadas estas subunidades (tanto con terapia farmacológica como genéticamente) se inhibe tanto el efecto reforzador como el aversivo de la nicotina11. Los efectos de la expo118 sición repetida a un agente con actividad biológica (en este caso la nicotina) sobre el sistema nervioso central, conduce al desarrollo de mecanismos neuronales de adaptación que modifican la actividad de las neuronas afectadas, lo cual, a su vez, altera la funcionalidad de los circuitos neuronales constituidos por las neuronas en cuestión. El resultado final y visible de los cambios mencionados puede expresarse a través de comportamientos más o menos complejos (dependencia, tolerancia, sensibilización y craving) que caracterizan a los estados de adicción3. Se produce, tras el consumo repetido de la droga, un incremento progresivo de sus efectos conductuales y de recompensa que se denomina sensibilización conductual seguramente mediado por el sistema mesolímbico dopaminérgico que nace en el área tegmental ventral y se dirige a áreas de control motor y límbico, como el núcleo accumbens y la amígdala. La administración aguda de una droga incrementa la liberación de dopamina en dichas áreas reforzándose la liberación con el consumo crónico, lo que se denomina sensibilización dopaminérgica, fenómeno paralelo a la sensibilización conductual. Esto último representa un hecho crucial de las drogas adictivas y diferencial respecto a reforzadores naturales (comida, bebida, sexo, etc.) donde no hay sensibilización dopaminérgica3. Con el consumo crónico de nicotina la señal gabaérgica de recompensa queda desensibilizada, primando entonces el efecto de la nicotina en dirección a las neuronas dopaminérgicas. Este cambio es mediado, al menos en parte, por el incremento de la señal glutamatérgica sobre el sistema dopaminérgico. Este cambio en el balance funcional entre neuronas gabaérgicas y dopaminérgicas del área tegmental ventral haría que primara una señal dopaminérgica desregulada sobre el área tegmental ventral primando los efectos aversivos psicológicos del craving y del síndrome de abstinencia por la nicotina y a su vez se potenciaría el efecto estimulador de la nicotina y su uso compulsivo (Figura 1)11. Al cesar el consumo crónico de la droga, los cambios celulares ya experimentados originarían la sintomatología de la abstinencia aguda. Se produce un incremento agudo de AMPc mesolímbico y amigdalino, siendo responsables, por lo tanto, de la sintomatología somática (conductual y vegetativa) y emocional de la abstinencia3,12. Una vez que el sujeto ha superado la fase aguda de abstinencia, comienza la fase asintomática de abstinencia a largo plazo. Durante dicha fase el sujeto puede superar definitivamente su drogadicción pero tienen lugar fenómenos que pueden ocasionar la recaída; el craving (ansia de droga) y la abstinencia condicionada que tienen un marcado carácter psicológico. El sujeto, en el craving, experimenta deseos vehementes de De la neurobiología de la adicción a la nicotina al tratamiento del tabaquismo… J.I. de Granda Orive et al. Prev tab 83 (56 pag) 26/10/06 13:24 Página 119 A Glutamate inputs VTA GABA Nucleus accumbens Acute nicotine aversion signal B Glutamate Acute nicotine reward signal TPP Dopamine VTA inputs Desensitization of acute nicotine reward signal GABA Aversive nicotine craving/ withdrawal Nucleus accumbens Sensitized incentive salience Dopamine TPP NMDA receptors α4β2- containing ACh receptors α7 -containing ACh receptors FIGURA 1. Modelo integrado del sistema de recompensa por la nicotina en el área tegmental ventral. A. Estado agudo, B. Estado crónico. (Tomada de Laviolette et al11). consumir la droga y en la abstinencia condicionada aparecen síntomas de abstinencia. Estos dos fenómenos se disparan en situaciones ambientales y emocionales, digamos, propicias como puede ser el estrés, y de la recreación de lugares y momentos en los que se fumaba. Estos fenómenos se los ha relacionado con los cambios permanentes que tras el consumo crónico de la droga se producen en los circuitos mesolímbicos, existiendo una liberación exagerada, que se mantiene en el tiempo, de CRF, ACTH y corticoides suprarrenales en situaciones de estrés3. Estudios en animales de laboratorio Los estudios realizados en animales de laboratorio, que incluyen modelos conductuales, neuroquímicos, neurofisiológicos y moleculares, han localizado los lugares sinápticos y mecanismos de transducción que son diana de las drogas en el cerebro y han detallado las adaptaciones crónicas tras el consumo prolongado. En los seres humanos resulta difícil comprobar los mismos hallazgos, dado que no se dispone de métodos inocuos para evaluar neurotransmisores en regiones concretas del cerebro, y cuando existen utilizan técnicas indirectas con baja resolución anatómica. A pesar de esto, los estudios disponibles indican que las áreas cerebrales más sensibles a las drogas son las mismas que en el animal de laboratorio. Diversos modelos animales de adicción que emplean metodologías conductuales han ayudado a entender las bases neurobiológicas de esta enfermedad y además han permitido predecir algunas estrategias farmacológicas útiles PREVENCIÓN DEL TABAQUISMO vol. 8 nº 3, julio-septiembre 2006 para el ser humano. Un modelo animal sería un preparado experimental desarrollado para el estudio de fenómenos hallados en los seres humanos, siendo suficientes para su validación los criterios de confiabilidad y valor predictivo. Los diseños más utilizados han sido la autoadministración intravenosa de una sustancia, en la que se somete al animal de experimentación a un esquema de refuerzo de razón fija. A dichos animales se les implanta un catéter intravenoso y se les entrena para autoadministrarse la droga siguiendo un esquema de refuerzo con una dosis estimulante. El animal necesita de un palanqueo para proporcionarse la droga, y se comprueba que si se emplea un antagonista de la droga aumentará el número de autoadministraciones (de palanqueos) y ello será debido a que la potencia reforzadora de la droga se ha reducido. Para revelar los efectos reforzantes positivos de las drogas se emplea la autoestimulación intracraneal o estimulación cerebral recompensante, este experimento se basa en el hecho de que al estimular un área concreta del cerebro se produce un estado emocional placentero de rápida adquisición (aprendizaje) y de intensa ejecución. La autoestimulación activaría los mismos lugares en donde actuarían reforzadores fisiológicos y permite evaluar los efectos de las drogas. El tercer método conductual para caracterizar las acciones reforzantes de una droga se denomina preferencia condicionada de sitio; se trata de un condicionamiento clásico o Pavloviano en el cual un distinto ambiente es apareado repetidamente con la administración de la droga, mientras que un ambiente diferente al anterior se asocia a un estado sin droga. Un efecto de refuerzo positivo por parte de la droga se reflejará en la preferencia del animal por permanecer más tiempo en el ambiente previamente asociado con la administración de la droga, aunque la situación inversa también puede ocurrir, es decir, una experiencia aversiva se torna un refuerzo negativo13,14. Estudios en animales con técnicas de microdiálisis, que miden la liberación de dopamina en los circuitos mesolimbocorticales, y con técnicas electrofisiológicas; que revelan la actividad eléctrica de las neuronas dopaminérgicas, han constatado el patrón común de acción de las sustancias de abuso. El creciente interés en los receptores de acetilcolina y en las vías implicadas en la adicción a la nicotina como dianas farmacológicas está generando una serie de nuevos componentes con posibilidades en el futuro como tratamiento de la deshabituación tabáquica. De forma general los fármacos empleados en estos estudios pueden clasificarse (Tabla II) como agonistas, se define a un agonista como aquella sustancia que es capaz de unirse a un receptor y provocar una respuesta. La acetilcolina sería, en este caso, el agonista fisiológico pero también la nico119 Prev tab 83 (56 pag) 26/10/06 13:24 Página 120 Receptores acetilcolina: – Agonistas: acetilcolina y nicotina. Epibatidina, ABT594 Anabasina y su derivado el GTS-21 (DMXB) Colina (alfa7), citisina (varenicline), RJR2403, SIB1508Y, A-85380, Lobelina, SSR591813. – Antagonistas competitivos: compiten con los agonistas Alfabungarotoxina (alfa7) MLA (alfa7) Dihidrobetaeritroidina (DHbE: alfa4beta2) Alfaconotoxinas – Antagonistas no competitivos: ocluyen el canal iónico central: Mecamilamina (alfa3, alfa4) Clorisondamina, MK 801 y PCP (NMDA). Vía glutamatérgica: LY354740 (Agonista del receptor) MPEP (antagonista del receptor) Vía Serotoninérgica: LY426965 (antagonista 5 hidroxitriptamina) Sistema opioide: Naltrexona y Naloxona Sistema cannabinoide: SR141716: Rimonabant Vía GABAérgica: Vigatrin (GVG, inhibidor irrev. de GABA transaminasa Baclofen y CGP44532 (agonistas del receptor GABAB). TABLA II. Diferentes agonistas y antagonistas utilizados en los estudios neurobiológicos. tina lo es y aunque todos los receptores de acetilcolina responden a la nicotina, el efecto de ésta varía dependiendo de la concentración de nicotina requerida para la activación o desensibilización del receptor. De las sustancias estudiadas ninguna presenta una especificidad única por un subtipo determinado de receptor, diferenciándose según su potencia15. También se dispone en la actualidad de agonistas parciales, que son sustancias que actúan sobre el receptor pueden y antagonizarlo o pueden activarlo, es decir, pueden actuar como agonista o como antagonista, y esto dependerá de la cantidad de agonista (ligando) disponible en un momento determinado. Por otro lado se dispone de antagonistas que a su vez pueden ser antagonistas competitivos que compiten con los agonistas por unirse en los puntos de anclaje en el receptor y, los antagonistas no competitivos que no se adhieren a los puntos de unión del agonista sino que actúan ocluyendo el canal iónico del recep120 tor o si se introducen en el receptor su acción será por un mecanismo voltaje dependiente15. La intención de los modelos comentados más arriba es por un lado esclarecer las vías y los neurotrasmisores implicados en la generación de la adicción a la nicotina y por otro la búsqueda de nuevos fármacos que pudieran en un futuro no muy lejano ser útiles en el tratamiento de dicha adicción. El mejor conocimiento de los efectos de la nicotina en las funciones cerebrales desembocará en la mejora de las intervenciones para ayudar a dejar de fumar. DE LA NEUROBIOLOGÍA AL TRATAMIENTO: PROGRESO CONTRA LA ADICCIÓN A LA NICOTINA Existen evidencias, según los modelos animales empleados, que demuestran que la dopamina liberada en el área tegmental ventral tiene que ver con las propiedades reforzadoras de la nicotina. Recientes estudios, en los que se emplea la tomografía por emisión de positrones, comprueban la veracidad de lo encontrado en los modelos animales. Brody et al.16 demuestran que los fumadores liberan mayor cantidad de dopamina en la región ventral estriada, concretamente en el caudado ventral izquierdo, núcleo accumbens y putamen ventral izquierdo. El mismo autor ha comunicado recientemente17, resumiendo todos los trabajos previos existentes sobre el tema, que la respuesta cerebral a la llegada aguda y por primera vez de la nicotina produce una reducción general de la actividad cerebral con activación del córtex prefrontal, tálamo y del sistema de la visión, y un incremento de la concentración de dopamina en el núcleo estriado ventral y núcleo accumbens. La respuesta a la exposición crónica se caracteriza por un descenso de la actividad de la monoaminooxidasa (MAO) A y B en los ganglios basales y una reducción del subtipo alfa4beta2 de receptores de acetilcolina localizados en el tálamo y putamen. Todo lo anterior indica que fumar aumenta la neurotransmisión a través de los circuitos de los ganglios talámicos córtico basales, tanto por estimulación de los receptores de acetilcolina como indirectamente a través de la liberación de dopamina o inhibición de la MAO, o por la combinación de ambos factores anteriores. Actualmente, al aumentar el conocimiento de la neurobiología de la adicción a la nicotina se encuentran en fase de investigación numerosas moléculas que podrían, en un futuro, ser empleadas como tratamiento para ayudar a dejar de fumar. De la neurobiología de la adicción a la nicotina al tratamiento del tabaquismo… J.I. de Granda Orive et al. Prev tab 83 (56 pag) 26/10/06 13:24 Página 121 Varenicline El Varenicline es un agonista parcial del receptor nicotínico alfa4beta2. La activación de los receptores alfa4beta2 por la nicotina incrementa la liberación de dopamina en el núcleo accumbens y córtex prefrontal, por lo que la hipótesis inicial de trabajo fue buscar una sustancia que se comportara como un agonista parcial de dichos receptores. Con ello, se buscaba favorecer un incremento de los niveles de dopamina a nivel mesolímbico contrarrestando así el descenso de esos niveles al dejar de fumar. Por otra parte, en el caso de que el paciente fumara, el agonista parcial, al competir por la unión al receptor, protegería al paciente del efecto reforzador de la nicotina18. El programa se inició eligiendo la citisina, producto natural que se encuentra en diferentes plantas, y que era conocido por su actividad agonista parcial sobre el receptor alfa4beta2 de la acetilcolina19. Los resultados de estos estudios previos sugerían que la combinación de un agonista y un antagonista, en esencia, la creación de un agonista parcial, podría tener utilidad en pacientes que realicen un serio intento para dejar de fumar18. Por lo tanto, sobre la base de la citisina se generó una nueva sustancia potente y eficaz, el varenicline, que demostró una alta y selectiva afinidad por los receptores alfa4beta2 de la acetilcolina, pero que también se comportaba como un antagonista de la nicotina, bloqueando a la nicotina al fumar se ayuda a mitigar los efectos reforzadores y de recompensa. Recientemente se han comunicado las rutas de excreción del varenicline y sus metabolitos tanto en humanos como en animales de experimentación. El varenicline, con una vida media de 17 a 30 horas, es altamente absorbido tras ingestión oral y escasamente metabolizado (menos del 10%) con una biodisponibilidad prácticamente del 100%, no se une a proteínas por lo que es excretado sin cambios por la orina20,21. Cinco ensayos han sido publicados empleando varenicline para ayudar a dejar de fumar22. Los dos primeros fueron realizados buscando la dosis apropiada con los menores efectos secundarios posibles y en uno de ellos el varenicline fue comparado con el bupropión23,24. En el primer estudio la tasa continua de abstinencia en las últimas cuatro semanas de tratamiento previas fue muy superior con varenicline [varenicline 1 mg; 45% (p < 0,001), varenicline 2 mg; 51% (p < 0,001) y placebo del 12%]23, en el segundo también fueron mejores los resultados con varenicline [varenicline 1 mg; 31%, varenicline 2 mg; 41%, varenicline 3 mg; 25%, bupropion 29% y placebo 14% (varenicline 2 mg vs placebo p < 0,001, varenicline 2 mg vs bupropion p < 0,05)]. Dos estudios en fase III25, con un diseño idéntico, comparan la eficacia del varenicline de 2 mg con placebo y buPREVENCIÓN DEL TABAQUISMO vol. 8 nº 3, julio-septiembre 2006 propion 150 mg dos veces al día. Todos los participantes en dichos trabajos fumaban más de 10 cigarrillos al día, tenían entre 18 y 75 años de edad y las tasas de abstinencia fueron definidas como abstinencia total entre la semana 9 y la 52 después de dejarlo. Los resultados tanto en el estudio 1 [varenicline 22,1%, bupropion 16,4% y placebo 8,4% (varenicline vs placebo; p < 0,001, varenicline vs bupropión; p < 0,07, Bupropión vs placebo p < 0,001)] como en el estudio 2 [varenicline 23%, bupropion 15% y placebo 10,3% (verenicline vs placebo; p < 0,001, varenicline vs bupropion; p < 0,01, bupropion vs placebo; p < 0,001) fueron favorables al varenicline, ya que la eficacia fue mayor que el placebo en 2,4 veces e incluso mejor que los resultados obtenidos con bupropion. Los efectos secundarios más frecuentemente citados con el empleo de varenicline han sido las naúseas (28%), la cefalea, y las pesadillas o malos sueños pero no se ha encontrado que los pacientes dejen los ensayos en una mayor proporción debido a dichos efectos adversos22. Rimonabant Como ya hemos comentado más arriba, recientes estudios han demostrado que el sistema endocannabinoide se encuentra implicado en los mecanismos comunes de desarrollo de la adicción al consumo de drogas de abuso. Este sistema participa en los efectos de recompensa primarios del cannabis, la nicotina, el alcohol y los opiáceos, a través de la liberación de endocannabinoides en el área tegmental ventral. Los endocannabinoides también se han visto implicados en la motivación de búsqueda de una droga a través de mecanismos dopamina independiente, asimismo también participa en los mecanismos relacionados con la búsqueda de la droga debido a condicionamientos mediados por estímulos ambientales y de exposición a la misma10. Fue en 1994 cuando se caracterizó el primer antagonista de los receptores cannabinoides, el SR141716 (llamado después rimonabant). El rimonabant se une selectivamente a los receptores CB1. Como ya hemos indicado más arriba los receptores CB1 se encuentran preferentemente concentrados en las terminaciones presinápticas del sistema nervioso central aunque también están presentes en terminaciones nerviosas que inervan órganos periféricos como el tracto gastrointestinal26. Al bloquear los receptores CB1 se produce una disminución de la motivación para paladear comida (núcleo accumbens), un efecto anorexígeno (hipotálamo), una estimulación de la señal de saciedad unida a receptores CB1 de terminales sensoriales del tracto gastrointestinal, un incremento de la producción de adiponectina, una inhibición de la lipogénesis (tejido adiposo e hígado) y un incremento en la incorporación de glucosa a 121 Prev tab 83 (56 pag) 26/10/06 13:24 Página 122 los músculos26. Se ha observado, en animales de experimentación, que el rimonabant reduce la ingesta de comida haciendo perder peso alterando el metabolismo del tejido adiposo induciendo la expresión del gen de la adiponectina27. Recientemente se ha podido demostrar que el rimonabant facilita la pérdida de peso también por un mecanismo independiente de los niveles de adiponectina en pacientes obesos con dislipemia, los cambios en la adiponectina se correlacionaban con cambios en los HDL colesterol y apolipoproteína AI28. Estudios en Fase III han demostrado la utilidad del rimonabant en el tratamiento de la obesidad, la dislipemia y la diabetes asociada a obesidad, en la prevención de la ganancia de peso asociada a la abstinencia tabáquica y, posiblemente, para ayudar a dejar de fumar26. Como ya se ha comentado la transmisión dopaminérgica en el núcleo accumbens es el sustrato primordial en el proceso de adquisición y mantenimiento de la adicción a una droga de abuso, incluyendo la nicotina. En el consumo crónico de nicotina se observa una mayor activación del sistema endocannabinoide, encontrándose un aumento de los niveles de anandamida en el núcleo accumbens. Al bloquear el sistema con un antagonista de los receptores cannabinoides, se produce la inhibición de la estimulación mesolímbica dopaminérgica mediada por la nicotina y la recompensa asociada a su uso29. Rimonabant reduce la respuesta a la nicotina en ratas abstinentes30. Ensayos en Fase II han demostrado que el empleo de rimonabant prolonga la abstinencia al dejar de fumar31. En un ensayo posterior en Fase III, aleatorizado y controlado (STRATUS - US)32, 787 pacientes fumadores, que querían dejar de fumar, fueron aleatorizados a placebo, o a rimonabant de 5 mg al día o de 20 mg al día, con un seguimiento de 42 semanas. Los resultados de abstinencia en las últimas 4 semanas de seguimiento de los pacientes fueron favorables a los que tomaron 20 mg de rimonabant con una tasa de cesación del 28% versus 16% con rimonabant de 5 mg y placebo. Al mismo tiempo se realizó, con el mismo diseño, el estudio en Europa (STRATUS Europe) sobre 789 pacientes fumadores pero no se encontraron diferencias significativas entre tomar rimonabant y el placebo26 en las tasas finales de abstinencia. Finalmente, 5.055 pacientes fumadores de Australia, Canadá y de Estados Unidos (STRATUS WORLDWIDE33, estudio supranacional, multicéntrico, aleatorizado, doble ciego, controlado con placebo y con 5 brazos de estudio paralelo y un seguimiento de 2 años) fueron incluidos en un estudio durante 10 semanas valorando los efectos de rimonabant de 5 mg al día y rimonabant de 20 mg comparados con placebo, a partir de aquí los 1.672 pacientes que dejaron de fumar fueron 122 re - aleatorizando de nuevo a placebo o rimonabant 5 mg (para los que ya recibían 5 mg previamente) o 5 mg o 20 mg (para los que ya recibían 20 mg), el tratamiento activo se realizó durante 42 semanas y el seguimiento posterior durante 50 semanas más. El primer punto a evaluar, cuando el trabajo este acabado, será valorar la eficacia del rimonabant en mantener la abstinencia a los 6 meses de la nueva aleatorización, y el segundo valorar los resultados sobre el peso, craving, calidad de vida, seguridad y tolerabilidad del fármaco. Aunque por ahora la eficacia de rimonabant para ayudar a dejar de fumar, no ha sido demostrada concluyentemente, no siendo mejor las tasas de abstinencia que con los fármacos ya disponibles, probablemente si será más efectivo en algunos subgrupos determinados de pacientes; obesos y diabéticos22,26,34. Otro aspecto interesante, en el momento actual, ha sido valorar la utilidad del rimonabant en modelos animales sobre los efectos subjetivos y de recompensa de la nicotina. En este sentido, Le Foll y Goldberg35, observaron que el rimonabant reducía selectivamente la influencia de los estímulos externos condicionados que mantienen la conducta de fumar, sin afectar la respuesta subjetiva a la nicotina. Fármacos en desarrollo preclínico • SSR591813: se trata de un agonista parcial y selectivo del receptor nicotínico alfa4beta2 que aumentaría la liberación de dopamina en el núcleo accumbens, por lo que pre - tratando al paciente con él reduciría la liberación de dopamina y sus efectos mediados por la nicotina. Por ello prevendría el síndrome de abstinencia (que es precipitado al utilizar mecamylamina en ratas dependientes de nicotina) y parcialmente su señal condicionada. En modelos animales se ha podido observar que reduce la autoadministración de nicotina, y antagoniza la sensibilización conductual inducida por la nicotina. Por todo lo anterior, el SSR591813 podría tener un uso potencial en el manejo del paciente fumador que quiere dejar de fumar36. • BP 807 y ST 198: el BP 807 es un agonista parcial del D3R (receptor de la dopamina), siendo el ST 198 un antagonista de dicho receptor. Es conocido que estímulos externos, como por ejemplo oler humo del tabaco, condicionan el craving en fumadores abstinentes, por lo que reducir los efectos asociados a estos estímulos podrían tener utilidad para ayudar a dejar de fumar manteniendo la abstinencia. Le Foll et al.37,38 observaron que en ratas a las que se les inyectaba repetidamente nicotina en un ambiente determinado, desarrollaban una res- De la neurobiología de la adicción a la nicotina al tratamiento del tabaquismo… J.I. de Granda Orive et al. Prev tab 83 (56 pag) • • • • • 26/10/06 13:24 Página 123 puesta locomotora condicionada, produciéndose un incremento de la expresión, en el núcleo accumbens, del receptor D3 de la dopamina. Esta conducta condicionada es inhibida por el BP 807 o por un antagonista selectivo de dicho receptor por lo que se sugiere que antagonizar el efecto de la dopamina en el receptor interrumpiría los efectos condicionados a la nicotina, por lo que podría ser de utilidad en el tratamiento de la cesación tabáquica37. En efecto, se sugiere que los ligandos D3R reducirían los estímulos motivacionales de la nicotina por un mecanismo distinto al bupropión y a la terapia sustitutiva con nicotina38. Análogos del 2´- fluoro - 3´ descloroepibatidina: presentan una alta afinidad por los receptores alfa4beta2 de la acetilcolina, pero no por el subtipo alfa7 comportándose como un potente antagonista de la antinocicepción inducida por la nicotina39. Estos compuestos podrían ser útiles para identificar que subtipos específicos de receptores estarían implicados en los efectos farmacológicos de la nicotina para poder ser empleados en el tratamiento de la cesación tabáquica. Anabasina, nornicotina, anatabina: la anabasina, la nornicotina y la anatabina son alcaloides procedentes de la planta Nicotiana tabacum y es conocido que presentan actividad como agonistas de los receptores nicotínicos al igual que la nicotina, pero con una menor potencia. Actualmente se desarrollan estudios para conseguir mejorar estos derivados con la intención de que pudieran ser empleados en el futuro en el tratamiento del tabaquismo40. Análogos carbonados de la citisina41, y 3,5 Bicyclic aryl piperidinas42: se trata de agonistas parciales del subtipo alfa4beta2 del receptor de la acetilcolina. Ambos han demostrado eficacia in vivo como agentes agonistas parciales en el sistema mesolímbico dopaminérgico, abriéndose así importantes expectativas para el empleo en la cesación tabáquica. Lobelina: la lobelina es un agonista parcial de la nicotina que ha sido ya empleado para ayudar a dejar de fumar. Stead y Hughes, en una revisión Cochrane43 en la que quisieron evaluar la eficacia de la lobelina para ayudar a dejar de fumar, concluyen que no existe ninguna evidencia de que ésta sea útil para el tratamiento de la cesación tabáquica. Mecamilamina: la mecamilamina es un antagonista nicotínico, siendo empleado para ayudar a dejar de fumar ya que podría bloquear la recompensa secundaria al consumo de tabaco. Lancaster y Stead44, en una revisión Cochrane, evaluaron la eficacia del empleo de la mecamilamina en promover la cesación tabáquica, PREVENCIÓN DEL TABAQUISMO vol. 8 nº 3, julio-septiembre 2006 tanto sola o combinada con terapia sustitutiva. Sugiere que la combinación de nicotina y mecamilamina presenta una mayor eficacia que la nicotina sola en promover la cesación del consumo, aunque se precisan más estudios. Recientemente, McClernon et al45, han sugerido que la mecamilamina podría moderar la respuesta emocional unida al deseo de fumar en una situación condicionada • Naltrexona y naloxona (antagonistas opiodes): ya hemos comentado más arriba que la nicotina incrementa la actividad del sistema opiode endógeno en el sistema mesolímbico, por lo que el interés en estos antagonistas opioides se centra en la posibilidad de que consigan atenuar el efecto de recompensa obtenido con el consumo de cigarrillos. Aunque basándose en una experiencia limitada con la naltrexona (dos trabajos) y ninguna con la naloxona, Lancaster y Stead46, en una revisión Cochrane, concluyen que no es posible confirmar ni refutar la utilidad de la naltrexona para ayudar a dejar de fumar, el intervalo de confianza fue compatible tanto para la posibilidad del beneficio en promover la abstinencia como para lo contrario. Krishnan et al47, en un estudio preliminar con escaso número de pacientes y en el que valoraban la eficacia de 50 mg de naltrexona combinada con terapia sustitutiva, y lo comparaban con placebo concluían que dicha combinación resultaría beneficiosa para ayudar a dejar de fumar. Epstein et al48, en un estudio en el que evaluaban la utilidad de la naltrexona para atenuar sensaciones subjetivas (abstinencia, craving, afectos) y la conducta de fumar observaron que la naltrexona aumentaba efectos como la sedación, los afectos totales pero disminuía los afectos positivos una hora después de fumar un cigarrillo. Por el contrario, la naltrexona no afectaba a los síntomas del síndrome de abstinencia ni la urgencia por fumar. Los autores concluyen, que sin conocer exactamente el mecanismo implicado la naltrexona produciría una atenuación de la conducta de fumar. En cambio, Roozen et al.49, en un estudio que valoraba la eficacia, en términos de craving y abstinencia, de la combinación de naltrexona con terapia sustitutiva y una intervención comunitaria psicosocial, encontraron una mayor efectividad con el tratamiento psicosocial que con el farmacológico. • Glicina - glutamina (inhibidor opioide): sintetizado desde la beta endorfina, la glicina glutamina (Gli - Glu) es un inhibidor opioide. Se había observado previamente que la Gli - Glu inhibía el reflejo condicionado, la tolerancia, la dependencia y el síndrome de abstinencia debido al consumo de morfina. Por ello, se estudió si la 123 Prev tab 83 (56 pag) 26/10/06 13:24 Página 124 Gli - Glu también pudiera ser eficaz en el consumo de nicotina, observándose que disminuía el efecto de recompensa a la nicotina y atenuaba el síndrome de abstinencia en ratas dependientes de la nicotina50. • Manipulación en las vías glutamatérgicas y gabaérgicas: como ya hemos indicado, tanto el ácido gamma amino butírico (GABA) como el glutamato tienen un papel en los efectos reforzadores de las drogas de abuso. Markou et al.51 investigaban, en un trabajo reciente, las consecuencias que tiene manipular las vías glutamatérgicas y gabaérgicas sobre los efectos reforzadores de la nicotina. En él emplearon el gamma - vinyl- GABA (Vigabatrin o GVG), inhibidor irreversible de la GABA transaminasa, el baclofen y la CGP44532, agonistas del receptor del GABA - B, y el MPEP, antagonista del receptor 5 glutamatérgico (mGluR5). Los autores observaron que el GVG, el CGP44532 y el baclofen, de forma dosis dependiente, disminuían la auto administración de nicotina en las ratas del modelo animal, pero también se reducía la respuesta a la necesidad de comida. El MPEP, en cambio, también de forma dosis dependiente, disminuía la auto administración de nicotina sin disminuir la necesidad de comida. Estos resultados demuestran que tanto la activación de los receptores GABA B o el bloqueo del receptor glutamatérgico mGluR5 disminuyen la auto administración de nicotina en ratas de laboratorio. Por lo tanto, tanto aquellos componentes que incrementen la neurotransmisión gabaérgica como aquellos que antagonicen los receptores mGluR5 glutamatérgicos tienen un potencial indiscutible como posibles medicaciones para ayudar a dejar de fumar. Hace ya algunos años, Helton et al52, estudiaron la posibilidad de emplear agonistas de los receptores glutamatérgicos con la intención de aliviar los síntomas del síndrome abstinencia por la nicotina. Para ello utilizaron el LY354740, análogo del glutamato y con una alta selectividad y actividad agonista por el receptor del glutamato mGluRs. Los autores concluyen que los datos encontrados soportan el papel funcional de los agonistas de los receptores mGluRs en el síndrome de abstinencia por la nicotina e indican que el LY354740 es eficaz para reducir los síntomas asociados a la falta de nicotina al dejar de fumar. • Antagonistas de la 5 Hidroxitriptamina: el LY426965 es un antagonista de la 5 Hidroxitriptamina (5 - HT), receptor de la serotonina, observándose que puede revertir efectos del síndrome de abstinencia por la nicotina, por lo que podría tener cierto interés como farmacológico para ayudar a dejar de fumar53. 124 Farmacogenética y farmacogenómica: trabajos de investigación La farmacogenética estudia las diferencias interindividuales en la respuesta a fármacos y las interacciones genético-ambientales, mientras que la farmacogenómica estudia las bases genético-moleculares de las enfermedades para definir nuevas dianas terapéuticas. Los estudios farmacogenéticos permiten identificar posibles causas genéticas para la diferencia en la respuesta de los individuos a un fármaco. Este tipo de estudios investiga la asociación entre el grado de respuesta al fármaco y las variantes o polimorfismos de genes del paciente implicados en la respuesta y el metabolismo del fármaco. Farmacogenética y bupropion Es conocido que los fumadores con una disminuida actividad del CYP2B6 [metabolizadores lentos; familia de enzimas metabolizadoras del citocromo P450 (CYP) gen 2B6] tienen más craving una vez que dejan el consumo de tabaco, por lo que presentan habitualmente más probabilidades de recaer54-56. En un trabajo54 realizado sobre 426 fumadores y que recibieron durante 10 semanas bupropion o placebo más terapia conductual, se observó cómo los fumadores con una actividad CYP2B6 disminuida (metabolizadores lentos) presentaban un mayor deseo de fumar (craving) después del día “D”, y tasas de recaída mayores de forma significativa. Este efecto se modificó por una interacción genotipo sexual de tratamiento sugiriendo que el bupropion atenuaría el efecto genotípico en mujeres fumadoras. El hallazgo de una asociación entre el genotipo CYP2B6 con la cesación tabáquica en el grupo placebo y la ausencia de una asociación genotípica con los efectos secundarios del bupropión sugieren que los efectos genotípicos en el desarrollo del tratamiento no pueden ser atribuidos a la farmacocinética del bupropion57. Por lo tanto, la mayor tasa de recaídas en los metabolizadores lentos sería atribuible a una acción más larga de la nicotina en el sistema nervioso central (por falta de conversión en cotinina) con cambios neuroadaptativos que facilitarían la dependencia y el craving57. Lerman et al58, en un trabajo que completaba el anterior examinaban las variaciones genéticas de las vías dopaminérgicas, basándose en la premisa de que los efectos del bupropión son atribuidos, al menos en parte, a la inhibición de la recaptación de la dopamina. El análisis genético se fijaba en los polimorfismos comunes del gen del transportador (DAT1) y del receptor (DRD2) de la dopamina, que ya previamente habían sido asociados a la conducta de fumar57. Aunque no se sostiene la hipótesis de la modulación genética como respuesta al bupropión los resultados revelaron que los fumadores con el genotipo DRD2 De la neurobiología de la adicción a la nicotina al tratamiento del tabaquismo… J.I. de Granda Orive et al. Prev tab 83 (56 pag) 26/10/06 13:24 Página 125 A2A2 (quienes portan el alelo DAT1 9) tienen mayores tasas de abstinencia (53 vs 39%) y mayores latencias para la recaída. En cambio, con el alelo DRD2 A1 no se encontró una asociación significativa. Swan et al59 en un estudio aleatorizado en el que investigaban la asociación del polimorfismo Taq1A con la cesación tabáquica siguiendo a fumadores con un tratamiento con bupropion y terapia psicológica observaron que las mujeres portadoras de al menos un alelo A1 del receptor de la dopamina tenían más posibilidades de dejar de tomar el bupropión debido a sus efectos secundarios, y de seguir fumando al año del seguimiento. No se observó lo anterior en hombres. Es decir que presentar el alelo A1 aumentaría las posibilidades de recaídas tras tratamientos con bupropión. Asimismo, los individuos con el genotipo DRD2 A2/A2 y al menos un alelo DAT1 10 repetido tendrían mayores puntuaciones en el Test de Fagerström comparado con aquellos que no presentan dicho alelo. Otros estudios han venido a demostrar lo anterior, David et al.60 estudiaron la asociación existente entre el polimorfismo DRD2 del receptor de la dopamina con los efectos del bupropión sobre diversos síntomas del síndrome de abstinencia. Los autores concluyen que el bupropión atenúa los síntomas del síndrome de abstinencia en los sujetos con el genotipo DRD2 Taq1 A2A2. (Concretamente craving, irritabilidad y ansiedad). En el grupo con el genotipo DRD2 A1A1 y en el A1A2 no se produjo alivio en los síntomas. En otro estudio61 los fumadores portadores del alelo DRD2 A1 presentan un incremento de la señal de recompensa a la comida indicando una influencia genética en la ganancia de peso secundaria a la abstinencia a la nicotina. Farmacogenética y terapia sustitutiva con nicotina En un ensayo realizado en el Reino Unido, y que englobó a más de 1.500 fumadores, con un diseño controlado con placebo, y que a 755 de ellos se les extrajo sangre para análisis genético62,63, fueron estudiados el polimorfismo TaqA1 del gen D2 (DRD2) del receptor de la dopamina. Los autores encontraron cómo el tratamiento con parches de nicotina fue más efectivo que en el grupo placebo en los portadores del alelo A1 del gen DRD2 del receptor de la dopamina, pero no en aquellos homocigóticos para el alelo A262. Las diferencias en odds ratio para el efecto del tratamiento en el grupo del genotipo fueron estadísticamente significativas después de la primera semana del mismo pero no al final del tratamiento. Se comprobó que el parche fue más efectivo (OR 3,6 parche vs placebo) en aquellos fumadores con el alelo DRD2 A1 y el DBH A [polimorfismo del gen de la dopamina beta hidroxilasa (DBH) que codifica la enzima envuelta en la conversión de dopamina en norepinefrina. Por PREVENCIÓN DEL TABAQUISMO vol. 8 nº 3, julio-septiembre 2006 lo que bajos niveles de DBH aumentan los niveles endógenos de dopamina] y menos efectivo en los portadores de otros genotipos. Esta asociación genética con el tratamiento fue significativa tanto en la primera como a las 12 semanas de tratamiento sugiriendo que la eficacia a corto plazo del parche de nicotina podría estar modulada por los alelos DRD2 y DBH. Un estudio a más largo plazo del ensayo anterior63 soporta el hecho de la asociación de la variante del alelo DRD2 con la abstinencia a los 6 y 12 meses de seguimiento, aunque esta asociación sólo fue observada en mujeres y no con el alelo DBH. En otro estudio farmacogenético64, realizado con parches de nicotina y espray nasal y en el que se examinaba el papel del gen del receptor μ opioide (OPRM1), que como es conocido, es el punto de anclaje de la betaendorfina para su efecto de recompensa, siendo liberada al administrar nicotina. El exon 1 del receptor OPRM1 incluye el Asn40Asp, la variante Asp40 incrementa la afinidad de unión de la beta endorfina por el receptor, prácticamente la triplica con respecto a la variante Asn40. Los Asp40 tienen mayores posibilidades de estar abstinentes al final del tratamiento para dejar de fumar, y estas diferencias son mayores si reciben parches (52 vs 33% para Asp40 y Asn40; OR 2,4), pero esto no se observó para espray de nicotina, placebo o bupropión. Además se pudo observar una relación dosis respuesta, a saber, a mayor concentración de nicotina en el parche mejor respuesta con la variante Asp40. Para confirmar lo anterior, Lerman et al65 analizando el papel de dos variantes genéticas del gen del receptor DRD2 de la dopamina en relación a la respuesta al tratamiento para dejar de fumar en dos ensayos aleatorizados con un seguimiento de 6 meses (doble ciego y controlado con placebo) empleando bupropión, y un ensayo abierto comparando parches y espray de nicotina, observaron que al final del estudio existió una interacción significativa entre el genotipo DRD2 - 141C Ins/Del y el tratamiento, y además, en los pacientes tratados con bupropión, una mejor respuesta en los homocigóticos que portaban el alelo Ins C que en los que portaban el Del C. Por el contrario, los portadores del alelo Del C tenían mejores tasas de abstinencia al ser tratados con terapia sustitutiva independientemente del dispositivo de liberación de ésta. También la variante C957T se asoció a la abstinencia en los tratados con terapia sustitutiva. A MODO DE CONCLUSIÓN En el año 1991, el chicle de nicotina era el único tratamiento farmacológico aprobado por la FDA de los Estados Unidos para el tratamiento de la dependencia ni125 Prev tab 83 (56 pag) 26/10/06 13:24 Página 126 cotínica. Se ha avanzado considerablemente, disponiendo hoy como primera línea de tratamiento, de chicles, parches, pastillas para chupar de nicotina, a diferentes dosis y en una amplia variedad de sabores además del bupropión. Como hemos repasado más arriba, mucha medicación, basada en estudios neurobiológicos, se encuentra en la actualidad en diferentes fases de estudio, con la esperanza que en el futuro estén disponibles varios fármacos para ayudar a dejar de fumar. El futuro del tratamiento de la adicción al tabaco será probablemente más individualizado, empleando la combinación de varios fármacos nicotínicos o no que actúen en diferentes lugares a nivel cerebral y finalmente profundizando en el conocimiento que actualmente se tiene de la farmacogenética y la farmacogenómica aplicada a los fármacos empleados para la cesación tabáquica. BIBLIOGRAFÍA 1. Granda Orive JI. Dependencia por el tabaco. El tabaquismo como enfermedad adictiva crónica. En: CA Jiménez Ruiz y S Solano Reina editores. Tabaquismo. Monografías NEUMOMADRID Vol VII. Ediciones ERGON Madrid 2004; 53-69. 2. Granda Orive JI. El tabaquismo como enfermedad adictiva crónica. En: CA Jiménez Ruiz y K Fagerström, eds. Tratado de Tabaquismo. Grupo Aula Médica, Madrid 2004. p. 89-106. 3. Fernández Espejo E. Bases neurobiológicas de la drogadicción. Rev Neurol 2002; 34: 659-64. 4. American Psychiatric Association. Diagnostic and statistical manual of mental disorders, 4th ed., text revision: DSM - IV - TR. Washington, D.C.: American Psychiatric Association, 2000. 5. Pérez Trullén A, Herrero I, Clemente ML, Pérez Trullén JM, Sánchez Agudo L. Bases neurobiológicas de la adicción a la nicotina: el por qué de un nuevo tratamiento para dejar de fumar. Arch Bronconeumol 2002; 38 (Supl 7): 30-5. 6. Martin BR, Mechoulam R, Razdan RK. Discovery and characterization of endogenous cannabinoids. Life Sci 1999; 65: 57395. 7. DiMarco V, Melck D, Bisogno T, De Petrocellis L. Endocannabinoids: endogenous cananbinoid receptor ligands with neuromoduladory action. Trends Neurosci 1998; 21: 521-28. 8. Maldonado R. The neurobiology of addiction. J Neural Transm Suppl 2003; (66): 1-14. 9. Maldonado R, Rodríguez de Fonseca F. Cannabinoid addiction: behavioral models and neural correlates. J Neurosci 2002; 22: 3326-31. 10. Maldonado R, Valverde O, Berrendero F. Involvement of the endocannabinoid system in drug addiction. Trends Neurosci 2006; 29: 225-32. 11. Laviolette SR, Van der Kooy D. The neurobiology of nicotina addiction: bringing the gap from molecules to behaviour. Nature Rev Neurosci 2004; 5: 55-65. 126 12. Nestler EJ. From neurobiology to treatment: progress against addiction. Nature Neurosci Supplement 2002; 5: 1076-79. 13. Koob GF. Animal models of drug addiction. En: Psychopharmacology: the fourth generation of progress. Bloom FE y Kupfer DJ Editores. Raven Press New York 1995, 759-72. 14. Pineda-Ortiz J, Torrecilla-Sesma M. Mecanismos neurobiológicos de la adicción a drogas. Trastornos Adictivos 1999; 1: 13-21. 15. Nicotine addiction in Britain. Physical and pharmacological effects of nicotine. Disponible en URL (Consultada el 15 de diciembre de 2005): http://www.rcplondon.ac.uk/pubs/books/nicotine/2-physical.htm 16. Brody AL, Olmstead RE, London ED, Karachi J, Meyer JH, Grossman P, et al. Smoking - induced ventral striatum dopamine release. Am J Psychiatry 2004; 161: 1211-8. 17. Brody AL. Functional brain imaging of tobacco use and dependence. J Psychiatr Res [abstract] 2005. doi: 10.1016/j-jpsychires.2005.04.012. 18. Coe JW, Brooks PR, Vetelino MG, Wirtz MC, Arnold EP, Huang J, et al. Varenicline: an alfa4beta2 nicotinic receptor partial agonist for smoking cessation. J Med Chem 2005; 48: 3474-77. 19. Papke RL, Heinemann SF. Partial agonist properties of cytisine on neuronal nicotinic receptors containing the beta2 subunit. Mol Pharmacol 1994; 45: 142-9. 20. Obach RS, Reed-Hagen AE, Krueger SS, Obach BJ, O’Connell TN, Zandi KS, et al. Metabolism and deposition of varenicline, a selective alfa4beta2 acetylcholine receptor partial agonist, in vivo and in vitro. Drug Metab Dispos 2006; 34: 121-30. 21. Foulds J, Steinberg MB, Williams JM, Ziedonis DM. Developments in pharmacotherapy for tobacco dependence: past, present and future. Drug Alcohol Reviews 2006; 25: 59-71. 22. Fagerström KO, Balfour DJK. Neuropharmacology and potencial efficacy of new treatments for tobacco dependence. Expert Opin Investing Drugs 2005; 15: 107-16. 23. Oncken C, Wastsky E, Reeves K, Anziano R. Proceedings of the 11 Annual Meeting of the Society for Research on Nicotine and Tobacco, Praga, República Checa 2005. 24. Oncken C, Wastsky E, Reeves K, Anziano R. Varenicline is efficacious and well tolerated in promoting smoking cessation: results from 7 - week, randomized, placebo and bupropion controlled trial. Proceedings of the 11 Annual Meeting of the Society for Research on Nicotine and Tobacco, Praga, República Checa 2005. 25. Tonstad S, Hays JT, Jorenby DE, Reeves K, Billing CB, Gong J, et al. Smoking cessation efficacy and safety of an alfa4beta2 nicotinic receptor partial agonist. Results from varenicline in cessation therapy. Annual Meeting of the American Heart Association, Chicago, USA (November 15) 2005. 26. Tonstad S. Rimonabant: A cannabinoid receptor blocker for the treatment of metabolic and cardiovascular risk factor. Nutr Metab Cardiovasc Dis 2006; 16: 156-62. 27. Bensaid M, Gary-Bobo M, Esclangon A, Maffrand JP, Le Fur G, Oury-Donat F, et al. The cannabinoid CB1 receptor antagonist SR141716 increases Acrp30 mRNA expression in adipose tissue of obese fa/fa rats and in cultured adipocyte cells. Mol Pharmacol 2003; 63: 908-14. De la neurobiología de la adicción a la nicotina al tratamiento del tabaquismo… J.I. de Granda Orive et al. Prev tab 83 (56 pag) 26/10/06 13:24 Página 127 28. Desprès JP, Golay A, Sjöström L, for the RIO - Lipids study group. Effect of rimonabant on body weight and the metabolic syndrome in overweight patients. N Engl J Med 2005; 353: 2121-34. 29. Cohen C, Perrault G, Voltz C, Steinberg R, Soubrie P. SR141716, a central cannabinoid (CB1) receptor antagonist, blocks the motivational and dopamine - releasing effects of nicotine in rats. Behav Pharmacol 2002; 13: 451-63. 30. Cohen C, Perrault G, Griebel G, Soubrie P. Nicotine -associated cues maintain nicotine - seeking behavior in rats several weeks alter nicotine withdrawal: reversal by the cannabinoid (CB1) receptor antagonist, rimonabant (SR 141716). Neuropsychopharmacology 2005; 30: 145-55. 31. Fernández JR, Allison DB. Rimonabant Sanofi - Synthelabo. Curr Opin Investig Drugs 2004; 5: 430-5. 32. Anthenelli R, Dale L. Rimonabant helps cigarette smokers stop smoking and prevents post cessation weight gain: results from the STRATUS - US trial. En: Abstracts of 6th Annual Conference of the SRNT Europe; Tübingen, Germany; 2004. p 35. 33. Niaura R. Long - term treatment with rimonabant for smoking cessation and the maintenance of abstinence: results from STRATUS - WORLDWIDE trial. En: Abstracts of the 11th Annual Meeting and 7th Annual SRNT European Conference: Prague, Czech Republic; 2005. 34. Jonsson KO, Holt S, Fowler CJ. The endocannabinoid system: current pharmacological research and therapeutic possibilities. Basic Clin Pharmacol Toxicol 2006; 98: 124-34. 35. Le Foll B, Goldberg SR, Rimonabant, a CB1 antagonist, blocks nicotine - conditioned place preferences. Neuroreport 2004; 15: 2139-43. 36. Cohen C, Bergis OE, Galli F, Lochead AW, Jegham S, Biton B, et al. SSR591813 a novel selective and partial alfa4beta2 nicotinic receptor agonist with potentialas an aid to smoking cessation. J Pharmacol ExpTher 2003; 306: 407-20. 37. Le Foll B, Schwartz JC, Sokoloff P. Disruption of nicotine conditioning by dopamine D(3) receptor ligands. Mol Psychiatry 2003; 8: 225-30. 38. Le Foll B, Sokoloff P, Stark H, Goldberg SR. Dopamine D3 receptor ligands block nicotine - induced conditioned place preferente through a mechanism that does not involve discriminative - stimulus or antidepressant - like effects. Neuropsychopharmacology 2005; 30: 720-30. 39. Carrol FI, Ware R, Brieaddy LE, Navarro HA, Damaj MI, Martin BR. Syntesis, nicotinic acetylcholine receptor binding, and antinociceptive properties of 2´fluoro 3´(substituted phenyl) deschloroepibatidine analogues. Novel nicotinic antagonist. J Med Chem 2004; 47: 4588-94. 40. Ayers JT, Xu R, Dwoskin LP, Crooks PA. A general procedure for enantioselective syntesis of the minor tobacco alkaloids nornicotine, anabasine, and anatabine. AAPS 2005; 7: E752 - 8. 41. Coe JW, Vetelino MG, Bashore CG, Wirtz MC, Brooks PR, Arnold EP, et al. In pursuit of alpha4beta2 nicotinic receptor partial agonist for smoking cessation: carbon analogs of (-) - cytisine. Bioorg Med Chem Lett 2005; 15: 2974-9. 42. Coe JW, Brooks PR, Wirtz MC, Bashore CG, Bianco KE, Vetelino MG, et al. 3,5 - Bicyclic aryl piperidines: a novel class PREVENCIÓN DEL TABAQUISMO vol. 8 nº 3, julio-septiembre 2006 43. 44. 45. 46. 47. 48. 49. 50. 51. 52. 53. 54. 55. 56. of alpha4beta2 neuronal nicotinic receptor partial agonists for smoking cessation. Bioorg Med Chem Lett 2005; 15: 4889-97. Stead LF, Hughes JR. Lobelina para dejar de fumar (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, número 2, 2006. Oxford, Update Software Ltd. Disponible en: http://www. update-software.com. Lancaster T, Stead LF. Mecamilamina (antagonista de la nicotina) para el abandono del hábito de fumar (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, número 2, 2006. Oxford, Update Software Ltd. Disponible en: http://www.update-software.com. McClernon FJ, Rose JE. Mecamylamine moderates cue- induced emotional responses in smokers. Addict Behav 2005; 30: 741-53. David S, Lancaster T, Stead LF. Antagonistas opiáceos para dejar de fumar (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, número 2, 2006. Oxford, Update Software Ltd. Disponible en: http://www.update-software.com. Krishnan-Sarin S, Meandzija B, O´Malley S. Naltrexone and nicotine match smoking cessation: a preliminary study. Nicotine Tob Res 2003; 5: 851-7. Epstein AM, King AC. Naltrexone attenuates acute cigarette smoking behavior. Pharmacol Biochem Behav 2004; 77: 29-37. Roozen HG, Van Beers SE, Weevers HJ, Breteler MH, Willemsen MC, Postmus PE, et al. Effects on smoking cessation: naltrexone combined with a cognitive behavioural treatment based on the community reinforcement approach. Subst Use Misuse 2006; 41: 45-60. Goktalay G, Cavun S, Levendusky MC, Hamilton JR,Millington WR. Glycyl - glutamina inhibits nicotine conditioned place preference and withdrawal. Eur J Pharmacol 2006; 530: 95102. Markou A, Paterson NE, Semenova S. Role of gamma - aminobutyric acid (GABA) and metabotropic glutamate receptors in nicotine reinforcement: potencial pharmacotherapies for smoking cessation. Ann N Y Acad Sci 2004; 1025: 491-503. Helton DR, Tizziano JP, Monn JA, Schoepp DD, Kallman MJ. LY354740: a metabotropic glutamate receptor agonist which ameliorates symptoms of nicotine withdrawal in rats. Neuropharmacology 1997; 36: 1511-6. Rassmussen K, Calligaro DO, Czachura F, Dreschfield - Ahmad LJ, Evans DC, Hemrick - Luecke SK, et al. The novel 5 Hidroxytriptamine1A antagonist LY426965: Effects on nicotine withdrawal and interactions with fluoxetine. J Pharmacol Exp Ther 2000; 294: 688-700. Lerman C, Shields P, Wileyto Audrain J, Pinto A, Hawk L, et al. Pharmacogenetics investigation of smoking cessation treatment. Pharmacogenetics 2002; 12: 627-34. Kirchheiner J, Klein C, Meineke I, Sasse J, Zanger UM, Murtder TE et al. Bupropion and 4-OH- bupropion pharmacokinetics in relation to genetic polimorphisms in CYP2B6. Pharmacogenetics 2003; 13: 619-26. Miksys S, Lerman C, Shields PG, Mash DC, Tyndale RF. Smoking, alcoholism and genetic polymorphism alter CYP2B6 levels in human brain. Neuropharmacology 2003; 45: 122-32. 127 Prev tab 83 (56 pag) 26/10/06 13:24 Página 128 57. Munafo M, Shields AE, Berrettini WH, Patterson F, Lerman C. Pharmacogenetics and nicotine addiction treatment. Pharmacogenomics 2005; 6: 211-23. 58. Lerman C, Shields PG, Wileyto EP, Audrain J, Hawk LH, Pinto A, et al. Effects of dopamine transporter and receptor polymorphism on smoking cessation in a bupropion clinical trial. Health Psychol 2003; 22: 541-48. 59. Swan GE, Valdes AM, Ring HZ, Khroyan TV, Jack LM, Ton CC, et al. Dopamine receptor DRD2 genotype and smoking cessation outcome following treatment with bupropion SR. Pharmacogenomics J 2005; 5: 21-9. 60. Davis SP, Niaura R, Papandonatos GD, Schadel WG, Burkholder GJ, Britt DM, et al. Does the DRD2-Taq1 A polymorphism influence treatment response to bupropion hydrochloride for reduction of the nicotine withdrawal syndrome? Nicotine Tob Res 2003; 5: 935-42. 61. Lerman C, Berrettini W, Pinto A, Patterson F, Crystal - Mansour S, Wyleito EP, et al. Changes in food reward following smoking cessation: a pharmacogenetic investigation. Psychopharmacology (Berl) 2004; 174: 571-7. 128 62. Johnstone EC, Yudkin PL, Hey K, Roberts SJ, Welch SJ, Murphy MF, et al. Genetic variation in dopaminergic pathways and shortterm effectiveness of the nicotine patch. Pharmacogenetics 2004; 14: 83-90. 63. Yudkin PL, Munafo M, Hey K, Roberts S, Welch S, Johnstone E, et al. Effectiveness of nicotine patches in relation to genotype in women versus men: randomised controlled trial. BMJ 2004; 328: 989-90. 64. Lerman C, Wileyto EP, Patterson F, Rukstalis M, Audrain McGovern J, Restine, et al. The functional mu opioid receptor (OPRM1) Asn40Asp variant predicts short- term response to nicotine replacement therapy in a clinical trial. Pharmacogenom J 2004; 4: 184-92. 65. Lerman C, Jepson C, Wileyto EP, Epstein LH, Rukstalis M, Patterson F, et al. Role of functional genetic variation in the dopamine D2 receptor (DRD2) in response to bupropion and nicotine replacement therapy for tobacco dependence: results of two randomized clinical trials. Neuropsychopharmacology 2006; 31: 231-42. De la neurobiología de la adicción a la nicotina al tratamiento del tabaquismo… J.I. de Granda Orive et al.