Aparato de Golgi, Lisosomas y vacuolas - U
Anuncio

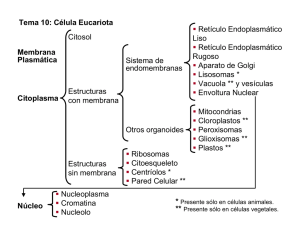
APARATO de GOLGI, LISOSOMAS, VACUOLAS Dr. M. T. Núñez Curso de Biología Celular 2009 Las proteínas sintetizadas en el RE pasan, mediante un tráfico vesicular, por el APARATO DE GOLGI antes de alcanzar su destino final El aparato de Golgi consiste en una serie de sacos aplanados o cisternas formando pilas. Cada pila consiste de 3 a 6 cisternas y su número depende del tipo de célula. Está compartimentalizado en tres regiones: cis, medial y trans. Historia … Este organelo fue descubierto por el médico e histólogo Camillo Golgi en 1898. Dibujos realizados por Golgi del aparato reticular interno (aparato de Golgi) observado en neuronas de ganglios espinales. Los diferentes dibujos ilustran la variedad de características que Golgi observó con su impregnación metálica con nitrato de plata. UBICACIÓN El aparato de Golgi se ubica cerca del núcleo y el RE y vecino al centrosoma En las células vegetales pueden existir cientos de estos apilamientos normalmente dispersos en el citoplasma. Estructura Cada pila de Golgi tiene dos caras: una de entrada o cis, adyacente al RE y una de salida o trans, dirigida hacia la MP. La cisterna más externa de cada cara esta comunicada a una red de túbulos y vesículas interconectados: la red Golgi cis (CGN), y la red Golgi trans (TGN). Secreción El aparato de Golgi es especialmente prominente en células especializadas en secreción como las células en copa del epitelio intestinal que secretan grandes cantidades mucus rico en polisacáridos o en células de los acinos pancreáticos que secretan jugo pancreático. Compartimentalización funcional Durante su paso a través del Golgi las proteínas sufren modificaciones covalentes de las cadenas de oligosacáridos. En las células vegetales el aparato de Golgi además está involucrado en la síntesis del los polisacáridos complejos de la pared celular. Alberts et al, 2002 Organización y transporte de proteínas en las cisternas del Golgi Alberts et al, 2002 El paso de material por el Golgi en la ruta secretora puede ser llevado a cabo por un proceso de tráfico vesicular, uno de maduración de cisternas o a una mezcla de ambos. En ambos casos hay un flujo retrógrado de tipo vesicular. Modelo de transporte vesicular: las cisternas son estructuras estáticas y las proteínas en tránsito se transportan en vesículas COP-I que yeman de un compartimento y se funden con el siguiente. El flujo retrogado se haría también a través de vesículas COP-I. Modelo de maduración de las cisternas: Las cistenas son estructuras dinámicas que maduran a medida que se movilizan al través de la pila. La compartimentalización de las enzimas del Golgi se haría por flujo retrógrado en vesículas COP-I. Flujo vesicular Las proteínas solubles y de membrana entran desde el RE al Golgi cis en vesículas de transporte que contienen una cubierta de proteína COP-II y la proteína G Sar I-GTP. COPI COPII ERGIC El flujo retrógrado, desde el CGN al RE se realiza por vesículas que salen de CGN que contienen la proteína de cubierta COP-I y la proteína G . Secuencias aminoacídicas en el C-terminal son señal de retención / recuperación de proteínas del RE. Ej., proteínas con la secuencia KDEL (Lis-Asp-Glu-Leu) vuelven al RE en vesículas que contienen COP-I y la proteína G ARF-GTP. Algunas proteínas de transmembrana retenidas en el RE poseen secuencias cortas en el C-terminal conteniendo dos lisinas (KKXX). Cooper, 2000 Transporte desde el aparato de Golgi La proteínas que salen por la red Golgi trans en vesículas de transporte son destinadas a la superficie celular, endosomas o lisosomas. En ausencia de señales específicas de destinación las proteínas son llevadas por la ruta de descarte (default). Las proteínas de la membrana plasmática y las proteínas secretadas por secreción constitutiva usan esta ruta. Cooper, 2000 Alternativamente, las proteínas pueden desviarse de la ruta de descarte y ser destinadas a otros organelos (lisosomas) y en ciertas células a una secreción regulada por señales (ver transducción de señales). Glicosilación de proteínas La función más importante (conocida) del aparato de Golgi es la modificación de proteínas por glicosilación. La gran mayoría de la proteínas que se sintetizan en el RE y pasan por el Golgi son glicoproteínas. El proceso de N-glicosilación (cadena azúcares unidos a una asparagina) proteínas se inicia en el RE, en donde adiciona a un residuo Asp oligosacárido precursor de 14 residuos azúcar: de de se un de 2 N-acetilglucosaminas 9 manosas 3 glucosas Esta composición, llamada rica en manosa, corresponde a la versión más inmadura de la cadena de azúcares de una glicoproteína Procesamiento en el RE La cadena de azúcares sufre una serie de modificaciones que resultan, finalmente, en un oligosacárido complejo o maduro. Este procesamiento se inicia en el mismo RE, con la remoción secuencial de tres residuos de glucosa y uno de manosa. Las enzimas involucradas son la glucosidasa I, la glucosidasa II y la manosidasa de RE. N-glicosilación - Golgi En el Golgi, los oligosacáridos son procesados en una secuencia ordenada de reacciones: 1. Remoción de tres residuos manosa (Golgi cis). 2. Adición de una N-acetilglucosamina 3. Remoción de otras dos manosas 4. Adición de dos N-acetilglucosaminamás. En esta etapa las proteínas se hacen resistentes a endoglicosidasas específicas (Endo H-resistant) 6. Adición de tres residuos galactosa 7. Adición de tres ácido siálico. Glicosilación de proteínas secretadas o destinadas a la membrana plasmática O H fucosa Cooper, 2000 ácido siálico Glicosilación de unión-O Las proteínas también pueden ser modificadas por adición de azúcares a residuos serina o treonina presentes dentro de secuencias específicas de AAs (Ej. CXSXPC; PTEIP, PTQA, PTQAP). A esto se le llama O-glicosilación o glicosilación de unión-O. El proceso comienza en el Golgi cis y finaliza en el trans. ¿Cuál es el propósito de la glicosilación? La N-glicosilación ocurre desde arqueas a eucariontes, una indicación de su antiguo origen evolutivo. La generalidad del proceso y el gran número de enzimas involucradas sugieren una función ventajosa. Además de ser parte del proceso de plegamiento en el RE, puede estar involucrada en el paso de las proteínas de membrana a través del Golgi. Una cubierta de oligasacáridos en la superficie celular (glicocalix) protege a las proteínas de ataques proteolíticos. Ciertos oligosacáridos de la superficie son reconocidos por lectinas, importantes en ciertas funciones celulares. Por ejemplo, en la respuesta inmune, las selectinas ayudan a anclar los linfocitos circulantes en determinados centros de producción de anticuerpos. Ciertas glicoproteínas participan como receptores de señales externas y la transmisión de estas al interior celular. Retención de proteínas del aparato de Golgi citosol Clase 1, TipoII lumen Golgi Alberts et al, 2002 Las señales de retención de varias proteínas de membrana del Golgi están localizadas en sus dominios de transmembrana, lo que previene que sean empacadas en vesículas que abandonan la red Golgi trans. Sin embargo, no hay una secuencia común y es posible que la señal sea la estructura secundaria o la terciaria. Varias enzimas localizadas en la membrana del Golgi como galactosiltransferasa y sialiltransferasa, tienen una estructura similar: un solo dominio de transmembrana con un corto N-terminal hacia el citosol y un largo dominio C-terminal, que contiene el sitio catalítico hacia el lumen. Modificación de proteínas destinadas a lisosomas Las proteínas destinadas a lisosomas son reconocidas y modificadas por la adición al oligosacárido de grupos fosfato en la posición 6 de residuos manosa. Primero se adiciona N-acetilglucosamina fosfato a residuos manosa en el Golgi cis. La enzima reconoce determinantes estructurales presentes en esas proteínas (i.e. hidrolasas lisosomales) no presentes en las proteínas secretadas o en las destinadas a membrana. Los grupos N-acetilglucosamina son luego removidos, dejando grupos manosa-6-fosfato (M6P) en el oligosacárido. Esta modificación impide la remoción de estos residuos durante el procesamiento posterior. Golgi cis Cooper, 2000 Destinación de proteínas a lisosomas lisosoma endosoma tardío Las proteínas con el marcador manosa 6-fosfato (M6P) son reconocidas por proteínas receptoras presentes en las membranas de la red trans Golgi y transportadas a lisosomas vía endosomas tardíos en vesículas de transporte recubiertas de la proteína clatrina. Las proteínas receptor M6P se unen a las proteínas (hidrolasas) lisosomales en el lado luminal de la membrana y a adaptinas de cubiertas de clatrina en formación por el lado citosólico. Esto ayuda a almacenar las hidrolasas en vesículas de clatrina que geman de la red trans Golgi. Lisosomas Los lisosomas son organelos limitados por una membrana que presentan una gran diversidad de formas y tamaños (0.25 to 0.5 μm) y que contienen un conjunto de enzimas hidrolíticas (~40 tipos), que catalizan la digestión controlada de macromoléculas tales como proteínas, ácidos nucleicos, carbohidratos y lípidos. Presentan gran diversidad morfológica y una variedad de funciones digestivas que incluyen la degradación de componentes obsoletos de la célula y de material extracelular (i.e. destrucción de microorganismos fagocitados). vesículas con hidrolasas desde el Golgi Visualización histoquímica de lisosomas: se observan precipitados de fosfato de plomo indicando la presencia de una fosfatasa ácida, marcadora de lisosomas. Lisosomas Son considerados como una colección de diferentes organelos que contienen hidrolasas ácidas (nucleasas, proteasas, glicosidasas, lipasas, etc), enzimas que requieren un pH de alrededor de 5,5 en su interior para su actividad óptima. La membrana del lisosoma normalmente mantiene estas enzimas digestivas fuera del citosol, aunque éstas no funcionarían allí pues éste tiene un pH de aprox. 7,2. El pH acídico del lumen del organelo se mantiene debido a la presencia de su membrana de una bomba de H+ tipo V que impulsa la acumulación de protones. H+ lumen citosol Los lisosomas están en equilibrio dinámico con los endosomas tardíos a través de mecanismos que involucran transporte vesicular, y fusión directa. Los endosomas tardíos contienen el 20% del pool de hidrolasa total y son el principal sitio de proteólisis. En contraste, los lisosomas contienen la mayor parte del pool de hidrolasa lisosomal pero solo el 20% de la proteólisis total se realiza en ellos. Esto ha llevado a postular que los lisosomas principalmente serían organelos de almacenamiento de estas hidrolasas Sistemas de transporte en lisosomas En la membrana de los lisosomas existen proteínas de transporte lo que permite que los productos finales de la digestión de las macromoléculas tales como amino ácidos, azúcares, nucleótidos, etc., sean transportados al citosol donde pueden ser reutilizados o exportados fuera de la célula. Ej.:El cotransportador LYAAT1/PAT1 que exporta aminoácidos neutros y H+s al citosol. Vacuolas Vacuolas Las vacuolas son organelos típicos de las células vegetales, limitados por una membrana denominada tonoplasto. Están relacionados con los lisosomas de las células animales y aunque contienen enzimas hidrolíticas tienen funciones muy diversas. Pueden actuar como un organelo de almacenamiento de nutrientes (i.e. acumulan sacarosa) y desechos, como compartimiento degradativo y como controlador de la presión de turgor. Vacuolas En las células grandes maduras, la vacuola puede llegar a ocupar el 90% del volumen celular, con al citoplasma confinado a una delgada capa periférica. Almacenan diferentes moléculas, iones, ácidos orgánicos, azúcares, enzimas, metabolitos secundarios, etc. Vacuolas meristemas En los tejidos en crecimiento como el meristema apical, las células contienen numerosas vacuolas que coalecen para formar una o pocas a medida que la célula madura y se expande. La vacuola en el crecimiento celular La acumulación de solutos impulsa la acumulación osmótica de agua produciendo presión de turgor necesario para el crecimiento celular. Se puede alcanzar un gran aumento del volumen celular sin aumentar el volumen del citosol. Zonas debilitadas de la pared celular orientan un crecimiento celular dirigido por el turgor que se acompaña de la acumulación de agua en la vacuola en expansión. Sistemas de transporte en vacuolas citosol +H +H lumen Poseen en su membrana una V-ATPasa y una pirofosfatasa (H+-PPasa) vacuolar que impulsan la acumulación de protones Esto genera un gradiente de potencial electroquímico de H+’s a través del tonoplasto (pH 3-6 interior y un ∆ψ ∼20 mV positivo en el interior). Este gradiente de potencial electroquímico impulsa el transporte y acumulación de diversos solutos desde el citosol: Cl- and NO3-, Na+, Ca2+, Mg2+ y azúcares como sacarosa. En transporte de agua se hace a través de acuaporinas (TIPs). PPi = P2O74− Pi = HPO42− En el tonoplasto existen diversos canales de iones y contratransportadores proton/X a través de los que se acumulan Na+, Ca2+ y sacarosa. Funciones de las vacuolas 1.- Almacenamiento: de azúcares, polisacáridos, aminoácidos y grandes cantidades de proteínas, especialmente en las semillas. 2.- Digestión: contienen hidrolasas ácidas, proteasas, nucleasas, glicosidasas y lipasas. 3.- Homeostasis iónica y de pH: típicamente mantienen pHs entre 5.0 y 5.5 pero algunas mucho mas bajo (limón: 2.5). 4.- Defensa contra patógenos y herbívoros: acumulan compuestos muy tóxicos que reducen la alimentación de los herbívoros y destruyen microbios patógenos. 5.- Secuestro de compuestos tóxicos: metales pesados y metabolitos como oxalato. Transportadores tipo ABC transportan a la vacuola compuestos xenobióticos (compuestos fabricados por el hombre). 6.- Pigmentación: contienen pigmentos de antocianina en pétalos y frutos. Otros pigmentos, en células de las hojas, empantallan los rayos UV. FIN