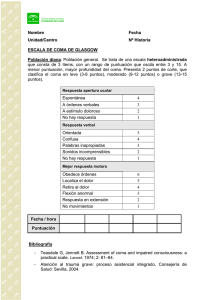
evaluacion clinica del sistema nervioso
Anuncio

EL PACIENTE EN COMA El presente artículo es una actualización al mes de enero del 2006 del Capítulo del Dr. Carlos Lovesio, del Libro Medicina Intensiva, Dr. Carlos Lovesio, Editorial El Ateneo, Buenos Aires (2001) ETIOPATOGENIA DE LAS ALTERACIONES DE CONCIENCIA El “estar conciente” es un concepto multifacético que puede ser dividido en dos componentes mayores: el nivel de conciencia (estado de vigilia o de despertar) y el contenido de conciencia (reconocimiento de sí mismo y del contexto). El estado de vigilia es mantenido por un sistema difuso de neuronas del tronco encefálico y del tálamo, conocido como formación reticular activadora ascendente, y sus conexiones con los hemisferios cerebrales. Por lo tanto la depresión, ya sea del tronco encefálico o de las funciones hemisféricas en forma global puede causar una reducción del estado de vigilia. Los reflejos del tronco encefálico son claves en la evaluación de la integridad funcional del sistema reticular activador. El contenido de conciencia o lucidez depende de la integridad funcional de la corteza cerebral y de sus conexiones subcorticales recíprocas; cada uno de sus múltiples aspectos reside en cierto modo en áreas anatómicamente definidas del cerebro. El coma es la ausencia de toda respuesta fisiológicamente comprensible a los estímulos externos o a las necesidades internas. Jennett define el coma como la incapacidad para obedecer órdenes, hablar y mantener los ojos abiertos. Los estudios clínicos y experimentales demuestran que el mantenimiento del estado de conciencia con un complemento intacto de sus funciones requiere una continua y efectiva interacción entre los hemisferios cerebrales relativamente intactos y ciertos mecanismos fisiológicos activadores no específicos situados en la parte alta del tronco encefálico (sistema reticular activador ascendente). La reacción de despertar está relacionada con la formación reticular activadora ascendente (FRAA), una red de neuronas originada en el tegmento de la protuberancia y del mesencéfalo, que se proyecta al diencéfalo y a las estructuras corticales. Los contenidos de conciencia dependen de la integridad de la corteza cerebral y sus conexiones subcorticales. El análisis bioquímico de la FRAA revela vías colinérgicas y glutamaérgicas (origen en la protuberancia y el mesencéfalo), adrenérgicas (locus ceruleus), serotonérgicas y dopaminérgicas (tronco encefálico), e histaminérgicas (hipotálamo). Muchas de estas neuronas convergen en el tálamo, que envía proyecciones a la corteza cerebral. Neuronas adicionales de la FRAA se proyectan directamente a la corteza cerebral o a otras estructuras diencefálicas tales como el hipotálamo. En relación con este concepto fisiológico, dos tipos generales de procesos patológicos pueden alterar la conciencia. Uno consiste en condiciones que directamente deprimen la función de los hemisferios cerebrales, y el otro incluye condiciones que deprimen o destruyen los mecanismos activadores del tronco encefálico. Se debe tener presente que lesiones focales de los hemisferios cerebrales producen afasia, apraxia, agnosia o defectos motores o sensitivos unilaterales, pero no producen estupor o coma, excepto que secundariamente alteren estructuras intracraneales remotas como para inducir cambios bilaterales difusos en ambos hemisferios, o que por compresión lesionan el tronco encefálico. La lesiones talámicas bilaterales y las lesiones hipotalámicas producen coma por interrupción de la activación de la corteza mediada a través de estas estructuras. En las lesiones hipotalámicas, los fenómenos asociados con el sueño, tales como el brusismo, son prominentes. La velocidad de comienzo, el sitio y el tamaño de una lesión en el tronco encefálico determinan que la misma resulte o no en coma. En este sentido, el infarto o hemorragia del tronco produce generalmente coma, mientras que otras condiciones tales como la esclerosis múltiple o los tumores rara vez lo hacen. Las lesiones por debajo del nivel de la protuberancia no resultan en coma. Las drogas y las enfermedades metabólicas producen coma por depresión tanto de la corteza como de la función del sistema reticular activador ascendente. Como ya se adelantó, el estado de coma implica la falla ya sea de la corteza cerebral de ambos hemisferios cerebrales o de la formación reticular activadora ascendente del tronco encefálico. A partir de este concepto, se pueden considerar tres causas fisiopatológicas de coma: 1. Masas lesionales supratentoriales. Por incremento de volumen, y a través de mecanismos de herniación, pueden distorsionar y comprimir la formación reticular ascendente del tronco encefálico, generando coma. Tal es el caso de los accidentes cerebrovasculares isquémicos o hemorrágicos voluminosos, abscesos cerebrales o tumores. 2. Masas infratentoriales o lesiones destructivas. Comprimen o destruyen directamente las estructuras del tronco encefálico, tal es el caso del infarto del tronco por oclusión de la arteria basilar o de la hemorragia cerebelosa. 3. Encefalopatías metabólicas. Producen coma por interferencia con el metabolismo, ya sea de las estructuras corticales o del tronco encefálico. Se define la encefalopatía metabólica como el conjunto de hallazgos neurológicos o neuropsiquiátricos que presentan una relación de causa a efecto definida con trastornos metabólicos. En un trabajo reciente de Becker y colaboradores, llevado a cabo en 42 unidades de terapia intensiva de Estados Unidos, sobre un total de 17.440 ingresos, el 16% correspondieron a padecimientos neurológicos o neuroquirúrgicos, discriminados tal como se describe en la Tabla 1. Las causas que producen coma variarán de acuerdo al tipo particular de población que se atiende en el servicio, pero las etiologías más frecuentes en general corresponden a los traumatismos de cráneo, hipoxia de causa respiratoria o hemodinámica, enfermedades cerebrovasculares, trastornos metabólicos e intoxicación por drogas. Tabla 1.- Diagnósticos de admisión a terapia intensiva en pacientes neurológicos y neuroquirúrgicos (Becker y col). Neurológicos Trauma cerrado Accidente cerebrovascular Convulsiones Hemorragia cerebral Trauma penetrante Neoplasias cerebrales Meningitis Hematoma epi o subdural Miastenia gravis Enfermedades neuromusculares Encefalitis % 26,2 19,7 18,5 11,7 7,6 2,4 2,1 2,1 1,1 1,0 0,7 Neuroquirúrgicos Craneotomía por neoplasias Lesión medular espinal Trauma cerrado Otra neurocirugía Hemorragia subaracnoidea Hematomas epi o subdurales Hemorragia intracraneal Cirugía transesfenoideal Trauma penetrante Abscesos cerebrales % 32,2 16,4 12,2 8,9 7,6 7,2 4,2 3,3 3,0 1,2 EL EXAMEN DEL PACIENTE CON DETERIORO DE CONCIENCIA El SNC es claramente el sistema orgánico cuya evaluación es con más frecuencia mal realizada en el paciente crítico. Esto es así a pesar de la alta prevalencia de disfunción neurológica en los pacientes en terapia intensiva. Existen varias razones para que el examen neurológico en la UTI frecuentemente se efectúe mal. La primera es una limitación curricular de muchos médicos en el conocimiento de la patología neurológica. La segunda es la dificultad para evaluar el sistema nervioso en los pacientes ventilados, restringidos y generalmente sedados. La tercera es la creencia de que los métodos complementarios pueden reemplazar al examen neurológico. No existe ningún procedimiento complementario de estudio que sustituya al examen clínico neurológico, y ninguno que tenga más valor pronóstico que la comparación evolutiva de los datos clínicos obtenidos. Los elementos de monitoreo son imprescindibles para anticipar eventos graves si no se corrigen las variables alteradas que ellos informan. El examen neurológico, en cambio, permite un diagnóstico. El examen neurológico en el paciente crítico debe estar destinado a responder a una serie de preguntas claves. El diagnóstico neurológico se basa en la historia, el examen minucioso, y la elección apropiada de los exámenes complementarios. El reconocimiento de las bases fisiopatológicas del coma dirige el examen neurológico y determina la selección de los exámenes complementarios. La aproximación diagnóstica a través de la evaluación clínica se utiliza para categorizar el coma en: • Coma sin signos focales ni meningismo. Esta es la forma más común de coma y resulta de lesiones isquémicas-anóxicas, metabólicas, tóxicas, o es inducido por drogas, infecciones o estados postconvulsivos. • Coma sin signos focales con meningismo. Este resulta de hemorragia subaracnoidea, meningitis y meningoencefalitis. • Coma con signos focales. Este resulta de hemorragia intracraneal, infarto, tumores o abscesos. El control del curso subsiguiente del coma con la evaluación clínica seriada es esencial, especialmente en los casos de lesiones expansivas donde es necesario el manejo del aumento de la presión intracraneana ya sea por métodos farmacológicos o por cirugía. La patología que afecta a múltiples estructuras, tales como la trombosis de los senos venosos, los hematomas subdurales bilaterales, la vasculitis o la meningitis, se pueden presentar con coma sin signos focales o meningismo y pueden simular patologías tóxicas o metabólicas. A la inversa, cualquier causa tóxica o metabólica de coma se puede asociar con hallazgos focales, tal el caso de la encefalopatía hepática o hipoglucémica. Los signos focales también pueden ser la consecuencia de enfermedades estructurales preexistentes; en el paciente hipoglucémico con un área de circulación crítica, es casi constante la aparición de signos focales. La evaluación del estado mental Tanto el estado de vigilia como los contenidos de la conciencia no son fenómenos del todo o nada, sino parte de un largo continuum. A la cabecera del paciente, el estado de vigilia se evalúa por la presencia de apertura ocular espontánea o inducida por estímulos. El mismo varía entre el estado de alerta (apertura ocular espontánea), sueño (apertura ocular luego de un estímulo externo moderado), estupor (apertura ocular luego de un estímulo externo vigoroso) o coma (ausencia de apertura ocular). El contenido de conciencia se refiere a la comprensión por parte del individuo de si mismo y del medio. Clínicamente, el médico está limitado a apreciar el potencial del paciente para percibir el mundo exterior y para interactuar voluntariamente con él (conciencia perceptiva). En la práctica, el contenido de conciencia es evaluado por un examen cuidadoso y repetido de la capacidad de formular respuestas conductuales reproducibles, voluntarias, con propósito y sostenidas ante estímulos auditivos, táctiles, visuales o nocivos. Preguntando al paciente si sabe o puede escribir su nombre se puede evaluar el conocimiento de sí mismo (autoconciencia). El paciente debe ser capaz de despertarse para realizar los procesos cognitivos requeridos para ejecutar sus contenidos de conciencia. En este sentido, el paciente en coma no tiene contenidos de conciencia evaluables debido a que no puede ser despertado. Sin embargo, como lo ilustran los pacientes en estado vegetativo, el estado de vigilia es necesario pero no suficiente para mostrar contenidos de conciencia. En efecto, los pacientes en estado vegetativo están despiertos, como lo muestra la preservación de la apertura espontánea de los ojos y los ciclos de sueño y vigilia, pero no muestran signos de actividad conciente. La conciencia esta íntimamente relacionada con funciones superiores tales como la percepción, atención, memoria de trabajo, memoria declarativa, conocimiento, imaginario mental, motivación, emoción y lenguaje. Los defectos visuales, auditivos o somatosensoriales pueden reducir considerablemente la conciencia perceptiva. La atención constituye un componente de la percepción en el sentido que es utilizada para seleccionar y dirigir la concentración en el procesamiento de cierta información con la exclusión de otros estímulos o datos relacionados. Del mismo modo participan en los contenidos de conciencia los otros elementos descriptos. El acto de pensar depende de todos los componentes de la conciencia previamente mencionados, pero también incluye un conocimiento de la propia actividad cognoscitiva. La confusión es un desorden del contenido de conciencia. Cualquier deterioro en la función cognoscitiva puede causar confusión, o sea deterioro de la percepción, atención, conocimiento, acción o coherencia del pensamiento. También puede ser el signo de presentación de una disfunción focal aislada como la afasia o la agnosia visuoespacial. Examen de los pares craneanos El examen de los pares craneanos puede brindar información valiosa sobre el nivel de lesión en el tronco encefálico responsable del coma, dada la localización de los centros de dichos nervios en el sistema nervioso. En la Tabla 2 se indican distintos aspectos de los nervios craneanos útiles en el reconocimiento del estado de coma. Tabla 2.- Reflejos del tronco encefálico en el paciente en coma. Técnica de examen Respuesta a la luz Pupilas Oculocefálico Mover la cabeza de lado a lado Vestíbulooculocefálico Irrigar el conducto auditivo externo con agua fría Reflejo corneano Estimulación de la córnea Reflejo de tos Estimulación de la carina Reflejo de Estimulación del arcada paladar blando Respuesta normal Constricción pupilar directa y consensual Los ojos se mueven en forma conjugada en dirección opuesta a la cabeza Nistagmus con componente rápido batiendo hacia el otro lado del estímulo Cierre palpebral Tos Elevación simétrica del paladar blando Vía aferente Retina, nervio óptico, quiasma, tracto óptico Canales semicirculares, nervio vestibular Canales semicirculares, nervio vestibular Nervio trigémino Nervios vago y glosofaríngeo Nervios vago y glosofaríngeo Tronco encefálico Vía eferente Núcleo Edinger-Westphal (mesencéfalo) Nervio oculomotor, fibras simpáticas Núcleo vestibular. Fascículo longitudinal medio. Formación reticular parapontina (protuberancia) Núcleo vestibular. Fascículo longitudinal medio. Formación reticular parapontina (protuberancia) Núcleo trigémino y facial (protube-rancia) Centro de la tos (bulbo) Nervio óculo-motor y VI par Bulbo Nervio óculo-motor y VI par Nervio facial Nervios vago y glosofaríngeo Nervios vago y glosofaríngeo Respuesta pupilar La respuesta pupilar al estímulo lumínico debe ser evaluada en todos los pacientes, ya que la misma provee una información importante con respecto al estado del cerebro así como de los sistemas simpático y parasimpático. Las modificaciones del tamaño pupilar son producidas por el estímulo lumínico. Cuando un haz de luz impresiona la retina de un ojo, ambas pupilas se contraen, denominándose a la reacción del ojo estimulado respuesta directa, y a la del ojo opuesto respuesta consensual. La vía aferente comienza en la retina, transcurre por el nervio óptico y continúa con la vía visual hasta el ganglio geniculado, en donde se conecta en forma bilateral con el núcleo de Edinger-Wesphal, porción parasimpática del núcleo del III par, saliendo con sus fibras y llegando hasta el ojo, donde inerva al músculo iridoconstrictor (Fig. 1). Con este simple examen se puede diagnosticar una lesión del nervio óptico o del tercer par. Si una pupila no responde a la luz pero se obtiene la respuesta consensual al iluminar el otro ojo, se admite que la vía efectora en el tercer par está intacta, existiendo una lesión en el nervio óptico homolateral, por el cual transcurre la vía aferente. Fig. 1. La vía parasimpática pupiloconstrictora. El tamaño de la pupila está determinado por el balance de los impulsos simpático y parasimpático. La estimulación parasimpática resulta en la constricción pupilar y es mediada por el núcleo de Edinger Westphal del tercer par craneal. Este núcleo está situado en la porción rostral del mesencéfalo, cercano al sistema reticular activador. Las fibras constrictoras de la pupila transcurren en forma circunferencial en la parte externa del III par y por ende se afectan antes que las fibras motoras por condiciones que comprimen el nervio. Esto tiene implicancias significativas en la hernia cerebral transtentorial, donde la dilatación pupilar generalmente precede a la parálisis oculomotora. En forma característica, la parálisis del tercer par tiene como resultado una pupila ipsilateral dilatada que no responde a la luz, en adición a una parálisis oculomotora. El sistema simpático, que determina la dilatación pupilar ante el dolor o la carencia de luz, es un sistema de tres neuronas (Fig. 2). Las neuronas de primer orden se originan en el hipotálamo y descienden a través del tronco encefálico adyacentes al sistema reticular activador. Estas neuronas terminan en la médula espinal cervical alta, en las células de la columna intermediolateral, al nivel aproximado de C8 y D1. Las neuronas de segundo nivel luego ascienden en la vía simpática hacia el ganglio cervical superior, donde hacen sinapsis. Las neuronas de tercer orden continúan alrededor de la arteria carótida hasta alcanzar la división oftálmica del V par craneal, desde donde acceden a la pupila. Una alteración unilateral del sistema nervioso simpático resulta en una pupila pequeña que no se dilata en la oscuridad. Generalmente, esto se asocia con una ptosis moderada y una anhidrosis alrededor del ojo (síndrome de Horner). Puesto que el tamaño de la pupila resulta de un balance entre los tonos simpático y parasimpático, es importante tener en cuenta que una serie de drogas pueden tener efecto significativo en este sentido. Las drogas tales como los narcóticos y sedantes producen miosis, mientras que las drogas anticolinérgicas tales como los derivados tricíclicos y de la belladona producen dilatación pupilar o midriasis. Las drogas adrenérgicas (adrenalina, noradrenalina, dopamina) pueden producir midriasis paralítica persistente (Fig. 3). Adicionalmente, varias anormalidades talámicas y del tronco encefálico pueden producir pupilas de varios tamaños y con respuestas variables a la luz, debido a la afectación preferencial de los tractos simpático o parasimpático (Fig. 4). Fig. 2.- La vía simpática pupilodilatadora. Fig. 3.- Dilatación pupilar máxima en paciente con intoxicación por βbloqueantes que requirió como terapéutica dosis elevadas de atropina, adrenalina y noradrenalina. En los momentos iniciales de la compresión talámica, por ejemplo, en el inicio de una hernia transtentorial, se presenta una pupila ligeramente disminuida de tamaño y reactiva, probablemente debido a la interrupción de las vías simpáticas descendentes. Pupilas dilatadas (5 a 7 mm), fijas, sin reacción a la luz, y en posición media son el resultado del daño a nivel mesencefálico o por debajo. Pupilas puntiformes (1 a 1,5 mm) indican daño focal de la protuberancia o una compresión protuberancial a partir de una lesión cerebelosa, pero no son producidas por el deterioro rostrocaudal inducido por una hernia. Fig. 4. Distintas respuestas pupilares ante estímulos orgánicos y metabólicos. Tozuda y col. han comprobado que la presencia o ausencia del reflejo lumínico es el signo clínico aislado más importante para distinguir el coma estructural del coma metabólico; las vías pupilares son relativamente resistentes a los insultos metabólicos. La presencia de una respuesta a la luz normal en cuanto a tamaño, forma y velocidad indica un tronco encefálico intacto y habitualmente excluye el daño estructural del cerebro medio como causa del coma. Una pupila unilateral dilatada, no reactiva, rara vez es causada por una lesión intrínseca ipsilateral del cerebro medio, resultando habitualmente de la compresión del tercer par craneal como ocurre en la hernia transtentorial. Motilidad ocular extrínseca Las anormalidades de los movimientos oculares extrínsecos tienen significativa importancia pronóstica en los pacientes críticos. Los ojos pueden moverse por varios mecanismos diferentes, cada uno de ellos involucrando vías neuroanatómicas particulares. Tres de estos movimientos (conjugados, sacádicos y de convergencia) requieren de un estímulo cortical, mientras que los movimientos reflejos son mediados totalmente por el tronco encefálico. Estos cuatro sistemas emplean los pares craneanos III (motor ocular común), IV (patético) y VI (motor ocular externo), en forma conjunta con el fascículo longitudinal medial para generar los movimientos oculares. La presencia de movimientos oculares sacádicos, es decir, la habilidad para mover los ojos en forma rápida y voluntaria hacia un punto en el espacio, establece la integridad de un gran área del cerebro y tronco encefálico. El control voluntario de los movimientos oculares sacádicos requiere la activación de los centros del lóbulo frontal, transmisión de este impulso hacia la formación reticular paramediana de la protuberancia y conexiones intactas en el tronco encefálico. Los movimientos conjugados son mediados a través de los lóbulos temporoparietooccipitales ipsilaterales, a través de conexiones a la formación reticular paramediana de la protuberancia y a las vías visuales del tronco encefálico. A nivel del área 8 cortical frontal, se encuentra el inicio de la vía que controla los movimientos voluntarios de los ojos; y a nivel parietooccipital, la vía optomotora que moviliza a los ojos posicionando a la mácula en el punto de atención. La vía de los movimientos horizontales desciende por el pie del tronco, se entrecruza a nivel pontino y llega al centro de la mirada lateral, acúmulo celular de la sustancia reticular pontina cercano al VI par, donde hace sinapsis. De allí una segunda neurona se conecta por una parte con el núcleo del VI par de ese lado y por otra, a través de la cintilla longitudinal posterior, con el subnúcleo del recto interno del III par del lado opuesto. Por lo tanto, un impulso originado en el hemisferio derecho estimulará al recto externo izquierdo y al recto interno derecho, lo que ocasionará el desplazamiento de los ojos hacia la izquierda. La lesión cortical, por ende, producirá una desviación de la mirada hacia el lado de la lesión. La presencia de un foco irritativo o epiléptico produce la desviación conjugada contralateral de los ojos. Esto puede ocurrir con o sin otras manifestaciones obvias de convulsiones, existiendo en ocasiones movimientos mínimos de los párpados, lengua, cara o mandíbula. La presencia de este desorden ocular debe alertar sobre la posibilidad de alguna forma de estado convulsivo parcial complejo que debe ser confirmado con un electroencefalograma. En ausencia de movimientos voluntarios y de vagabundeo ocular, el tronco puede ser evaluado a través de los reflejos oculovestibular y calórico. Las vías de estos reflejos se encuentran en el mesencéfalo y protuberancia, y están próximas al sistema reticular activador (Fig. 5). Es fácil comprobar que la evaluación de estos reflejos provee importante información pronóstica, debido a la estrecha proximidad de los mismos con los centros necesarios para la reacción de despertar. La evaluación del reflejo oculovestibular se logra por el movimiento rápido de la cabeza hacia un lado. La respuesta normal en un sujeto comatoso con un tronco encefálico intacto es una desviación conjugada de los ojos hacia la dirección contraria al movimiento. Los ojos luego retornan lentamente a la línea media en varios minutos. El test se repite moviendo la cabeza hacia el lado opuesto. Luego se puede evaluar el reflejo en el plano vertical de una manera similar. Estas maniobras no deben realizarse si se sospecha una lesión de la columna cervical. Los movimientos oculares que se observan durante el movimiento de la cabeza se derivan de dos orígenes: reflejos cervicoocular y oculovestibular. El reflejo cervicoocular se origina en impulsos propioceptivos a partir de los músculos y ligamentos del cuello que pasan a través de la vía aferente ascendente para conectar con los núcleos vestibulares, fascículo longitudinal medio, formación reticular y cerebelo. El reflejo oculovestibular se origina en el aumento del flujo de la endolinfa en los canales semicirculares, resultando en la estimulación de neuronas vestibulares que directamente activan la formación reticular paramediana en la protuberancia y causan la desviación ocular. En presencia de lesiones medulares cervicales, o si no se observan movimientos durante los tests reflejos oculovestibulares, el reflejo oculovestibular puede ser desencadenado con un estímulo calórico. Este evalúa solamente el reflejo oculovestibular y no el reflejo cervicoocular. Para realizar este test, la cabeza del paciente se eleva entre 30 y 50° y se instilan 50 a 100 ml de agua helada en el meato auditivo externo. Es importante excluir una lesión local a través de una otoscopía previamente a la realización del test. La respuesta normal es una lenta desviación conjugada de los ojos hacia el sitio donde se está instilando el agua. El test calórico es un potente estímulo para el movimiento ocular, y la presencia de un movimiento ocular conjugado implica que el troncoencefálico está intacto desde la parte alta del mesencéfalo hasta la parte baja de la otuberancia. Núcleo III Músculo oblicuo superior Nervio oculomotor (III) Núcleo IV N. patético Superior Medio Músculo recto Inferior M. recto lateral Cintilla longitudinal media Músculo oblicuo inferior Núcleo VI Nervio motor ocular externo Canal superior Canal posterior Núcleo vestibular Superior Medio Lateral Espinal Canal horizontal Utrículo Nervio vestibular (VIII) Tracto retículo espinal Núcleo XI Sáculo Ganglio vestibular Tracto vestíbulo espinal lateral Nervio espinal accesorio (XI) A músculos trapecio y esternocleidomastoideo Tracto longitudinal medio Medula cervical Columna gris intermediolateral Tracto longitudinal medio Médula dorsal Asta gris anterior Raíz anterior A los músculos el cuerpo y de los miembros Fig. 5. Los reflejos oculovestibulares y oculocervicales (Modificado de House E.) La ausencia completa de respuesta a los estímulos oculovestibulares implica una lesión difusa del tronco encefálico, ya sea de origen metabólico o estructural. La presencia de movimientos reflejos oculares conservados virtualmente elimina a la lesión de la fosa posterior como causa del coma. Respuestas corneanas El reflejo corneal es un reflejo oligosináptico consensual que evalúa la rama aferente del V par (trigémino) y la rama eferente del VII par (facial). Este test se realiza tocando la córnea suavemente con un algodón. La respuesta normal es que el paciente cierre ambos ojos. La presencia de este reflejo implica un V nervio ipsilateral intacto, una protuberancia central normal y un VII par bilateral intacto. El test se debe realizar en forma bilateral para evaluar los componentes aferentes de los dos trigéminos. Sumario de signos oculomotores en los pacientes con trastornos de conciencia En pacientes despiertos y alertas, los ojos están dirigidos directamente hacia delante en reposo y no presentan movimientos involuntarios. La respuesta oculocefálica no puede ser normalmente obtenida, y la estimulación calórica produce nistagmo más que una desviación definida. Los pacientes inconscientes que sufren disfunción cerebral hemisférica bilateral o difusa sin destrucción o compresión directa de las vías que influyen los movimientos oculares tienen los ojos dirigidos hacia delante o ligeramente divergentes, sin movimientos involuntarios, excepto un lento vagabundeo ocular. La respuesta oculocefálica es rápida, y la estimulación calórica determina una desviación ocular sostenida hacia el lado estimulado. Los pacientes inconscientes con daño agudo del campo ocular frontal tienen los ojos desviados hacia el sitio de la lesión, ocasionalmente con cierto nistagmo hacia ese lado. Las respuestas oculocefálicas y calóricas están usualmente presentes aunque puede ser difícil obtenerlas en las primeras horas que siguen a la injuria. En el coma metabólico, las respuestas a la estimulación oculocefálica y calórica son al principio rápidas, pero se hacen más difíciles de obtener a medida que el coma se profundiza. En el coma metabólico muy profundo, los ojos están fijos. Los ojos de los pacientes comatosos con lesiones del mesencéfalo están inmóviles y dirigidos directamente hacia adelante. Los ojos de pacientes con lesiones pequeñas que involucran el fascículo longitudinal medio miran directamente hacia delante, pero el globo del sitio de la lesión no aduce ante los estímulos oculocefálico y calórico (oftalmoplejía internuclear). Las lesiones protuberanciales unilaterales determinan que los ojos se desvíen en forma conjugada hacia el sitio contrario a la lesión con ausencia de respuestas oculocefálica y calórica del lado lesionado. La desviación oblicua resulta de lesiones protuberanciales dorsolaterales o del fascículo longitudinal medio. Los ojos que están dirigidos directamente hacia adelante no tienen valor localizador en pacientes en coma. Los ojos que presentan una desviación conjugada en el plano horizontal indican o una lesión hemisférica ipsilateral o una lesión protuberancial contralateral. Si los ojos están totalmente desviados pero pueden pasar la línea media en sentido contrario a la desviación con los movimientos pasivos de la cabeza o con la estimulacion calórica, la lesión es hemisférica. Si los ojos están parcialmente desviados pero no se logra de ningún modo que pasen la línea media hacia el otro lado, la lesión es protuberancial. Si los ojos están desviados en forma conjugada hacia abajo, la lesión es compresiva o por depresión metabólica del mesencéfalo. Si los ojos pueden superar el meridiano horizontal por estimulación oculocefálica o calórica, la lesión probablemente sea metabólica; caso contrario será estructural, probablemente compresiva. Excepto para una divergencia ocular mínima, la desviación ocular disconjugada en el coma establece una lesión estructural del tronco encefálico, siempre que se descarte un estrabismo divergente preexistente. El síndrome de enclaustramiento (locked-in syndrome) habitualmente involucra la base de la protuberancia; por lo tanto, la abducción ocular está comprometida, pero la función del tronco referida a los movimientos oculares verticales, reactividad pupilar y apertura ocular está preservada. El sueño y sus correlaciones en cuanto a la apertura ocular, mediadas por la función pontina, también son anormales, con una marcada reducción en los movimientos oculares rápidos durante el sueño REM. El electroencefalograma es normal. El “ocular bobbing” describe una sacudida rápida hacia abajo de ambos ojos con lento retorno a la posición media. Este desorden de los movimientos oculares es específico de las lesiones agudas protuberanciales. Se debe tener presente que en los enfermos en terapia intensiva, múltiples patologías y agentes farmacológicos o tóxicos pueden interferir con los movimientos oculares, dificultando su correcta interpretación (Tabla 3). Tabla 3. Patologías y drogas que pueden dificultar el estudio de los movimientos oculares en el paciente en coma Lesiones vestibulares periféricas, incluyendo agentes ototóxicos: antibióticos aminoglucósidos, diuréticos de asa, altas dosis de salicilatos, agentes antineoplásicos Drogas que suprimen el sistema vestibular: sedantes, antiepilépticos, antidepresivos tricíclicos, alcohol, sedantes vestibulares Desórdenes oculomotores supranucleares o infranucleares con oftalmoplejía externa: miopatías endocrinas, síndrome de Fisher, botulismo Agentes tóxicos que producen trastornos oculomotores actuando en el tronco encefálico o en el cerebelo: amitriptilina, haloperidol, litio, talio, opioideos, bromuro, barbitúricos Bloqueantes neuromusculares Comas metabólicos: coma hepático, hipercapnia Reflejo de arcada El reflejo de arcada debe ser evaluado en todos los pacientes. El mismo se obtiene bajando la lengua y estimulando un lado de la faringe posterior. Cada lado debe ser evaluado por separado. Una respuesta normal demuestra movimientos bilaterales de los músculos faríngeos posteriores e implica la presencia de pares craneales IX (glosofaríngeo) y X (neumogástrico) normales. La capacidad de desarrollar una respuesta de tos y succión puede ser evaluada en pacientes intubados y permite establecer la integridad del X par. Patente respiratoria El tronco encefálico es el sitio primario del control central de la respiración. Este control se produce a un nivel subconsciente y resulta en la contracción y relajación rítmica de los músculos respiratorios. El control automático de la respiración puede ser temporariamente superado por mecanismos voluntarios o por acciones reflejas tales como la tos y el estornudo; los mecanismos voluntarios son esenciales para la interrupción de la respiración durante el acto de hablar. Del mismo modo que otros sistemas de control central neurológico, los centros respiratorios reciben información aferente, relacionada con la respiración, integran la misma con datos de otras fuentes, emiten señales eferentes hacia los músculos respiratorios, y son modificados por estímulos provenientes de otras áreas del cerebro, tronco encefálico y médula espinal. La información aferente se origina en varias fuentes. Las mismas incluyen los quimiorreceptores centrales, situados en la superficie anterolateral del bulbo, los cuerpos carotídeos y aórtico, y los receptores de estiramiento y otros en el pulmón. Los centros respiratorios en el bulbo están compuestos por varios grupos nucleares que integran la información aferente y poseen las primeras neuronas emergentes que controlan la respiración. Estas neuronas emergentes envían sus axones hacia la médula espinal ventrolateral, donde hacen sinapsis con las células del asta anterior que inervan los músculos respiratorios. En los enfermos con trastornos neurológicos en UTI es frecuente que existan anormalidades respiratorias. Plum y Posner han descripto una serie de patentes clásicas de respiración alterada (Fig. 6). Algunas de ellas tienen valor de localización de áreas específicas del sistema nervioso, aunque se debe notar que pueden producirse influencias metabólicas y neurogénicas sobre la respiración que hacen perder especificidad a estas patentes. Esto es particularmente cierto cuando la congestión pulmonar y la hipoxia acompañan a la patente alterada. Fig. 6. Patentes respiratorias anormales asociadas con lesiones patológicas a varios niveles del SNC. A. Respiración de Cheyne-Stokes. B. Hiperventilación neurogénica central. C. Apneusis. D. Respiración agrupada (cluster). E. Respiración atáxica. El tipo más frecuente de alteración respiratoria observada en pacientes neurológicos es la respiración de Cheyne-Stokes, que consiste en fases de hiperpnea que regularmente alternan con apneas. Las ondas respiratorias ascienden lentamente, y luego de alcanzar un pico descienden del mismo modo. La respiración de Cheyne Stokes habitualmente es el resultado de patologías intracraneales, aunque la hipoxemia y la insuficiencia cardiaca también contribuyen a su aparición. La respiración de Cheyne Stokes se ha atribuido a la combinación de un aumento anormal de la respuesta ventilatoria al CO2, produciendo la hipernea, y un estímulo ventilatorio central anormalmente disminuido, que permite la apnea poshiperventilación. La presencia de esta patente implica una disfunción bilateral de estructuras neurológicas, habitualmente localizadas en posición profunda en los hemisferios cerebrales o diencéfalo, y en ocasiones en la protuberancia. La respiración de Cheyne Stokes también se observa frecuentemente en pacientes con lesiones cerebrales hipóxicas o isquémicas difusas, y en desordenes metabólicos tales como la uremia o la encefalopatía hepática. La hiperpnea profunda y sostenida genera una patente llamada hiperventilación neurogénica, localizándose la lesión productora habitualmente en el tegmentum rostral. Para certificar el diagnóstico de hiperpnea central se debe encontrar una patente de gases en sangre con PaO2 elevada y PaCO2 disminuida, con pH elevado. En ocasiones se observa una hiperpnea asociada a PaO2 baja, lo cual corresponde a una patología pulmonar asociada. La respiración apnéusica es una patente respiratoria consistente en una pausa prolongada en el punto de inspiración profunda. Su presencia es indicativa de lesión en la parte media o caudal de la protuberancia, cerca del núcleo parabrachialis. En general se asocia con infarto del tronco encefálico por obstrucción de la arteria basilar. La respiración atáxica, resultante de lesiones alrededor del bulbo en su parte media dorsal, consiste en una respiración totalmente irregular, con inspiraciones profundas y superficiales ocurriendo al azar. Resulta de la disrupción de las neuronas del bulbo que normalmente generan la respiración rítmica. Se observa en lesiones de la fosa posterior: hemorragia cerebelosa, hernia tonsilar cerebelosa o lesiones pontinas. Evaluación motora En todos los pacientes se debe realizar una evaluación motora completa. Ello permite una adecuada localización anatómica del sitio de lesión. La simetría y la patente de respuesta motora a los estímulos nocivos así como los síntomas neurológicos asociados, deben ser adecuadamente reconocidos en todos los pacientes. La función motora en los pacientes inconscientes debe ser estudiada mediante la aplicación de un estímulo nocivo a varias partes del cuerpo y detectada su respuesta. La respuesta motora puede ser de tres tipos: apropiada, inapropiada o ausente. La respuesta apropiada en un paciente con disfunción neurológica aguda implica que las vías sensoriales están funcionando y que las vías corticoespinales, desde la corteza cerebral hasta el efector están al menos parcialmente respetadas. El estímulo de provocación debe ser aplicado a ambos lados del cuerpo; la ausencia unilateral de respuesta es consistente con la interrupción del tracto corticoespinal en algún lugar de su trayecto. La ausencia bilateral de respuesta es índice de una de las siguientes posibilidades: a. Ambos tractos corticoespinales están interrumpidos a nivel del tronco encefálico. b. Existe depresión o destrucción de la formación reticular pontobulbar y vías extrapiramidales asociadas. c. Falta de respuesta psicogénica. Cuando existe falta de respuesta unilateral, es importante evaluar los movimientos oculares espontáneos. Si los ojos y la cabeza están desviados hacia el sitio opuesto a la hemiparesia, ello implica una lesión hemisférica, mientras que si la desviación es hacia el mismo lado de la hemiparesia es indicativa de una lesión pontina. Las respuestas motoras inapropiadas incluyen patentes de respuestas estereotipadas que dependen del nivel de lesión. Se describen tres tipos de respuestas principales, la rigidez de decorticación, la rigidez de descerebración y cambios de descerebración en los miembros superiores con respuestas flexoras en los miembros inferiores. La rigidez de decorticación consiste en flexión de brazos, muñecas y dedos con aducción de las extremidades superiores, y extensión, rotación interna y flexión plantar en las extremidades inferiores. En el hombre esta respuesta motora caracteriza a la hemiplejía espástica crónica y se produce típicamente en las lesiones de la cápsula interna o hemisferios cerebrales, que interrumpen las vías corticoespinales. La respuesta decorticada es característica de pacientes con moderada o gran lesión destructiva de la cápsula interna o del pedúnculo cerebral anterior (Fig. 7). A veces los ganglios basales adyacentes y el tálamo están involucrados. Para obtener la respuesta decorticada durante las horas inmediatas a una injuria cerebral aguda es necesario aplicar un estímulo nocivo mediante compresión supraorbital, succión traqueal o estimulación cutánea intensa. Fig. 7.- Rigidez decorticada en paciente con hematoma de mesencéfalo. La rigidez de descerebración consiste en opistótonos con los dientes apretados, los miembros superiores rígidamente extendidos, aducidos e hiperpronados, y los miembros inferiores extendidos con la superficie plantar flexionada (Fig. 8). La respuesta total solo emerge con la aplicación de un estímulo nocivo. En las lesiones agudas del cerebro, al espasmo de descerebración acompañan crisis de escalofríos, hipertensión arterial, sudoración e hiperpnea, particularmente cuando la causa es una hemorragia subaracnoidea o intracerebral. Las respuestas decorticada y descerebrada pueden aparecer conjuntamente. En estos casos, la respuesta descerebrada generalmente es contralateral a la lesión hemisférica. La rigidez descerebrada aparece en las siguientes circunstancias: 1) durante el deterioro rostrocaudal en el cual la disfunción diencefálica progresa produciendo daño en el mesencéfalo; 2) con lesiones destructivas o expansivas de la fosa posterior que dañan el cerebro medio y la protuberancia superior, y 3) con desórdenes metabólicos severos, tales como el coma hepático, la hipoglucemia, la anoxia o las intoxicaciones por drogas que deprimen la función del tronco alto. La postura descerebrada en las extremidades superiores combinada con flacidez o una débil respuesta flexora en las inferiores es una respuesta motora primitiva al estímulo nocivo hallada en pacientes con daño extenso del tronco encefálico, extendido a través o por debajo del nivel trigeminal de la protuberancia. Evaluación sensitiva La evaluación sensitiva debe ser realizada con todo el detalle que sea posible. En los pacientes con alteración significativa del estado de conciencia, es dificultoso realizar un examen sensorial detallado. Sin embargo, las respuestas a un estímulo nocivo, tal como la presión intensa y el pellizco, proveen importante información sobre el estado de las vías anatómicas que median la sensación. Fig. 8 - Rigidez de descerebración en paciente con gran hematoma cerebral con hemorragia intraventricular masiva. Evaluación cerebelosa Anatómicamente, el cerebelo puede ser considerado como constituido por tres áreas funcionalmente diferentes. El primer área, el lóbulo floculonodular, controla la coordinación de los movimientos oculares; las anormalidades en esta área resultan en trastornos de los movimientos conjugados y nistagmo. La segunda área, o vermis cerebeloso o zona medial, controla la bipedastación. Los desordenes en este área generan una gran base de sustentación con la incapacidad de realizar ciertos movimientos de desplazamiento. La tercer área, los hemisferios cerebelosos, mantienen el control ipsilateral de los movimientos finos y se encuentra estrechamente relacionada con el tracto corticoespinal. Los desórdenes de los hemisferios cerebelosos resultan en problemas ipsilaterales en la prueba dedo nariz, y presencia de movimientos alternantes rápidos. La evaluación de la función cerebelosa requiere un sujeto semicooperativo. Los movimientos oculares deben ser evaluados haciendo mirar al paciente en todas direcciones y observando el rango total de movimiento en la mirada conjugada y la ausencia de nistagmo. Los movimientos de desplazamiento exigen un paciente capaz de estar de pie y deambular. Los movimientos dedo nariz y dedo objeto en el espacio sirven para evaluar la función hemisférica. Tono y reflejos El tono y los reflejos deben ser evaluados en todos los pacientes. En general, la espasticidad y otros signos de aumento del tono se asocian con hiperreflexia y con respuestas extensoras tales como la respuesta de Babinski. La presencia y sitio del tono aumentado deben referirse en forma específica. Las lesiones hemisféricas cerebrales aumentan en forma característica el tono en un lado del organismo. Los trastornos de la médula cervical aumentan el tono en todas las extremidades, mientras que lesiones más bajas aumentan el tono y los reflejos en las extremidades inferiores. Los desórdenes neuromusculares que afectan la neurona motora inferior se presentan con pérdida del tono, hiporreflexia y eventualmente atrofia. En las lesiones medulares agudas, existe un período de hipotonia y arreflexia antes del desarrollo del aumento del tono y la espasticidad. Los trastornos de los ganglios basales generalmente se presentan con un aumento del tono denominado rigidez. La rigidez difiere de la espasticidad en que muestra un aumento del tono que es independiente de la velocidad o dirección en la cual se mueve la extremidad. La pérdida de fuerza muscular en los pacientes en UTI es un problema clínico común, y puede ser causado por desórdenes que precipitan la admisión o por enfermedades que causan debilidad muscular luego de la admisión a UTI. Hay que tener presente que, como muchos enfermos en UTI se encuentran intubados y sedados, los déficits neuromusculares pueden ser pasados por alto y hacerse evidentes recién cuando se intenta retirar al paciente de la ventilación mecánica. ESTADOS DE COMPROMISO CRONICO DE LA CONCIENCIA El despertar del estado de coma puede ser dramático e instantáneo, como cuando se realiza el tratamiento de un coma hipoglucémico, o muy lento, como en la injuria cerebral estructural. En algunos casos, por otra parte, la mejoría no se produce al cabo de meses, o incluso nunca. La evaluación de los estados prolongados de compromiso de la conciencia debe ser realizada por neurólogos experimentados que deben practicar un examen clínico neurológico detallado y luego deben interpretar estudios electrofisiológicos y de neuroimagen para establecer un diagnóstico definitivo. La clasificación de los estados de deterioro prolongado de la conciencia es difícil de realizar. Muerte cerebral. Los desordenes de conciencia deben distinguirse de la muerte cerebral, que es la pérdida irreversible de todas las funciones del cerebro y del tronco encefálico, diagnosticable clínicamente por la ausencia de conciencia, falta de respuesta motora a los estímulos nocivos, y desaparición de los reflejos del tronco y del estímulo respiratorio. Antes de su determinación se deben excluir como causas de coma fenómenos farmacológicos, fisiológicos y metabólicos. Estado vegetativo persistente. En el año 1972, Jennett y Plum acuñaron el término estado vegetativo persistente para enfatizar el componente vegetativo o no cognoscitivo del sistema nervioso central. Plum menciona que “el término estado autonómico persistente puede ser empleado de forma similar”, pero este término es menos flexible y puede ser menos comprensible para los familiares de los pacientes. Otros dos términos que se utilizan para hacer referencia a estados de deterioro crónico de la conciencia son el de mutismo aquinético y el de estado de conciencia mínima; cada uno de ellos presenta aparentemente distintas posibilidades evolutivas. En la Tabla 4 se indican los criterios para el diagnóstico del estado vegetativo persistente (EVP), tal como fueron formulados por un grupo de trabajo que incluyó a miembros de la American Academy of Neurology y de la American Neurological Association. El examen neurológico con el propósito de establecer el diagnóstico de un EVP debe ser pospuesto al menos un mes desde el momento en que se produce el episodio responsable del deterioro de conciencia. Tabla 4.- Criterios para el diagnóstico de un estado vegetativo persistente. 1. Ninguna evidencia de reconocimiento de si mismo o del entorno; el paciente es incapaz de interactuar con otros 2. Falta de evidencia de respuestas sostenidas, reproducibles, con propósito o voluntarias a estímulos visuales, auditivos, táctiles o nocivos 3. Falta de compresión o expresión del lenguaje 4. Despertar intermitente manifestado por la presencia de ciclos de sueño-vigilia 5. Preservación suficiente de las funciones hipotalámicas y autonómicas de tronco encefálico como para sobrevivir bajo un cuidado médico y de enfermería adecuado 6. Incontinencia de orina y de materia fecal 7. Preservación variable de las funciones de tronco (reflejos pupilar, oculocefálico, corneal, vestíbulo-ocular y de arcada) y de reflejos espinales El grupo de trabajo recomienda que se utilice el término estado vegetativo permanente, de preferencia a persistente, cuando la irreversibilidad es virtualmente cierta. El término permanente, una calificación pronóstica más que diagnóstica, debe ser aplicado luego de 12 meses cuando el episodio inicial haya sido traumático y luego de seis meses después de un daño cerebral de otra causa. Los pacientes con EVP habitualmente tienen mínimo soporte hemodinámico. Muchos pacientes requieren una traqueostomía en las etapa iniciales del coma para proteger la vía aérea o para realizar asistencia respiratoria mecánica, pero luego de algunas semanas la respiración se hace regular a través de la traqueostomía con algún requerimiento adicional de oxígeno. Más tarde el paciente puede ser decanulado. Cuando un paciente se encuentra en EVP, sus ojos pueden abrirse al contacto, pero no realizan un seguimiento con la mirada o éste es transitorio y no reproducible. Cuando se coloca un objeto grande delante del paciente o una persona aparece súbitamente, este puede dirigir brevemente la mirada y sugerir un movimiento voluntario, pero la respuesta se extingue rápidamente. En ocasiones presenta un movimiento disconjugado de la mirada, y se observan movimientos nistagmoides, pero en forma característica los ojos rotan sin propósito y sin mantener la fijación. En general existe una respuesta a los sonidos, y algunos pacientes pueden mostrar cierta respuesta de orientación. Sin embargo, la fijación hacia el origen del sonido no es compatible con el diagnóstico de EVP. La respuesta puede incluir mioclonos, en la primera etapa del curso clínico, o cierre de los ojos, flexión de la cabeza, o una respuesta decorticada, en particular en la fase crónica. Estas respuestas no requieren circuitos corticales y no implican una percepción auditiva intacta. Los estímulos dolorosos desencadenan una respuesta de retirada o ausencia de respuesta. Con más frecuencia producen un aumento de la frecuencia cardiaca, taquipnea, y flexión o extensión patológica de los miembros. La expresión facial puede cambiar cuando el paciente es movido o tocado. Cuando se remueve la traqueostomía, el paciente no habla pero puede emitir alguno sonido sin ningún significado. En casos muy excepcionales puede emitir alguna palabra aislada. Es habitual que pueda deglutir la saliva, pero los movimientos coordinados de la ingestión están alterados y ello lleva a la aspiración si se intenta la alimentación por vía oral. El tono muscular está aumentado. Muchos pacientes se encuentran en posición decorticada con los brazos flexionados y los miembros inferiores extendidos. La respuesta motora está ausente o corresponde a la rigidez descerebrada. Estas respuestas motoras se convierten progresivamente en espasticidad y contracturas. Los reflejos tendinosos son difíciles de obtener debido a las contracturas. Los pacientes varones pueden parecer que tocan sus genitales, y pueden producirse erecciones durante la fase lenta del sueño. En algunos pacientes se observan movimientos espontáneos de tipo coreifornes en cabeza, tronco y extremidades, posturas catatónicas súbitas, u opistótonos extremo. Estas manifestaciones son acompañadas por fenómenos disautonómicos tales como aumento de las secreciones bronquiales, crisis hipertensiva, taquicardia y taquipnea. En los pacientes en EVP, el ritmo circadiano de sueño-vigilia está preservado, pero en algunos está marcadamente disminuido con los ojos del paciente cerrados con breves episodios de apertura. En estos casos, las lesiones del tronco encefálico son más severas. El EVP sólo se presenta cuando se producen lesiones destructivas en áreas críticas que controlan el reconocimiento. Los cambios patológicos pueden ser clasificados en traumáticos o no traumáticos, aunque existe una superposición. El cambio patológico más frecuente en los casos traumáticos es una injuria axonal difusa, con una contribución variable de lesiones isquémicas superimpuestas. El daño talámico bilateral es constante y sugiere que el núcleo reticular talámico es operativo en la reacción de despertar. Cuando los casos de autopsia de pacientes con EVP son comparados con aquellos con estados menos severos de compromiso de la conciencia, se comprueba que las lesiones son más graves. Estos hallazgos incluyen lesiones talámicas más frecuentes y múltiples localizaciones de injuria axonal, incluyendo el cuerpo calloso y el tronco rostral. Las lesiones de anoxia-isquemia que producen un EVP habitualmente afectan toda la corteza, reemplazando las neuronas y las fibras nerviosas con gliosis, fagocitosis lipídica y colágeno. En la tomografía computada se comprueba una atrofia difusa y lesiones talámicas bilaterales. Independientemente de la causa, los pacientes que sobreviven algunos meses en EVP muestran una reducción marcada en el volumen de la sustancia blanca en tomografías sucesivas, con agrandamiento del sistema ventricular. Estado de conciencia mínima. Cuando los pacientes no reúnen los criterios del estado vegetativo, el Aspen Neurobehavioral Conference Workgroup sugiere reconocer una condición que denomina estado de conciencia mínima (ECM). Se estima que este trastorno patológico es 10 veces más común que el EVP. Los autores proponen que la distinción de un ECM de un EVP es la presencia parcial de contacto con el medio en el primer caso, siendo “importante para el pronóstico, las decisiones terapéuticas, la adjudicación de recursos y posee implicancias médico-legales”. En la Tabla 5 se indican los criterios propuestos para definir un ECM. Este conjunto de criterios describe a pacientes con alguna comunicación interactiva, uso potencial de objetos, y conductas específicas que demuestren reconocimiento, aunque sean lentas y espaciadas. Los pacientes rápidamente localizan un estímulo doloroso y pueden realizar una vocalización ocasional que establece cierta capacidad de reconocimiento. Sin embargo, están confinados en cama, tienen incontinencia fecal y urinaria, y generalmente requieren alimentación por sonda. Estos pacientes están abúlicos y con una disposición morosa. La diferencia clínica entre el ECM y el EVP, este último mucho más grave, es obvia. Tabla 5.- Criterios para definir el estado de conciencia mínimo (ECM). Para diagnosticar un estado de conciencia mínima, se debe demostrar una evidencia limitada pero claramente discernible de reconocimiento de si mismo o del medio en forma reproducible en base a una o más de las siguientes conductas: 1. Seguir comandos mínimos 2. Respuestas gestuales o verbales de si/no 3. Verbalización inteligible 4. Conducta con propósito, incluyendo movimientos o conductas afectivas que se produzcan en relación contingente con estímulos ambientales relevantes y que no sean debidas a una actividad refleja. Algunos ejemplos son: a. Llanto o gestos que se produzcan en respuesta directa a contenidos lingüísticos o visuales de índole emocional pero no a tópicos neutrales b. Intento de alcanzar un objeto que demuestre una relación clara entre la localización del objeto y la dirección de la búsqueda c. Relación con un objeto que se acomode a la forma y tamaño del mismo d. Movimientos de búsqueda de los ojos o fijación sostenida que se produzca en respuesta directa al movimiento o al retiro de un estímulo Mutismo aquinético. El mutismo aquinético es un estado de vigilia con limitada evidencia objetiva de contenidos de conciencia. Los pacientes con esta condición generalmente parecen incapaces de moverse o hablar y presentan periodos cíclicos de aumento de la reacción de despertar indicados por la apertura ocular. Algunos autores describen elementos de reconocimiento visual y una “promesa de hablar”. Al contrario del estado de conciencia mínimo, no existe respuesta motora a los estímulos verbales, táctiles o nocivos. Un hallazgo que lo distingue del estado vegetativo es que el paciente no tiene espasticidad ni reflejos anormales, sugiriendo una conservación relativa del tracto corticoespinal. El mutismo akinético se ha asociado con lesión bilateral del lóbulo frontal medial (gyrus cingulate), que produce una profunda deficiencia en la motivación y una incapacidad de planear e iniciar una actividad (disfunción ejecutiva). El término mutismo aquinético es problemático por dos razones. Primero, muchos pacientes no están aquinéticos, moviéndose en respuesta a los estímulos dolorosos. Segundo, algunos pacientes no están mudos, pudiendo emitir sólo palabras aisladas. Las características clínicas principales del mutismo aquinético son un estado de abulia emocional, falta de respuesta, siguiendo el movimiento de los objetos. Los estímulos dolorosos no provocan respuesta o una postura decorticada. Delirio. El delirio es sinónimo de estado confusional agudo y encefalopatía aguda. Se caracteriza por un deterioro de inicio agudo de la atención, asociado con cambios en el nivel de conciencia, pensamiento desorganizado y curso fluctuante. Hallazgos adicionales incluyen disturbios de la percepción, alteración de los ciclos sueño-vigilia, aumento o disminución de la actividad psicomotora, y deterioro de conciencia. El delirio es muy común en los pacientes hospitalizados en terapia intensiva. Puede preceder o continuar a otros trastornos de conciencia, en particular el coma. El delirio debe ser distinguido de la demencia. Ambos desordenes se caracterizan por deterioro de la conciencia, pero los pacientes con demencia están más comúnmente alertas y no presentan un comienzo agudo y un nivel fluctuante de la conciencia, que son característicos del delirio. El delirio se observa frecuentemente en alteraciones agudas tóxicas, metabólicas o endocrinas, pero también puede resultar de lesiones más focales de los lóbulos parietal derecho o frontales. Síndrome de enclaustramiento (Locked-In Syndrome). El síndrome de enclaustramiento consiste en una cuadriplejia con anartria en el contexto de un estado de vigilia con contenidos de conciencia preservados. La anartria es debida a una parálisis bilateral facio-gloso-faringo-laringea, que también produce disfagia y limita el empleo de la expresión facial en la comunicación. No se trata de un desorden de la conciencia per se pero puede ser confundido clínicamente debido a la limitada capacidad de expresión de estos pacientes. Se asocia con una injuria aguda de la parte ventral de la protuberancia, justo por debajo del nivel del núcleo del tercer par, que permite conservar los movimientos verticales de los ojos y que no interfiere con la FRAA, localizada más dorsalmente. Las lesiones más rostrales pueden inducir un síndrome de enclaustramiento total, en el cual se pierden también los movimientos oculares y de los párpados, impidiendo toda comunicación. Las etiologías más comunes del síndrome son el infarto, hemorragia o trauma de la protuberancia. Un estado análogo de conservación de la conciencia pero incapacidad de movimiento puede producirse en pacientes con síndrome de Guillain-Barré grave, botulismo, polineuropatia del paciente crítico, y en aquellos que reciben bloqueantes neuromusculares sin adecuada sedación. En la Tabla 6 se indican las diferencias entre los principales estados de alteración de la conciencia que pueden reconocerse en terapia intensiva. Tabla 6.- Comparación de los hallazgos clínicos asociados con el coma, estado vegetativo, estado de conciencia mínima y síndrome de enclaustramiento. Condición Conciencia Coma Ninguna Sueño/ vigilia Ausente Estado Ninguna vegetativo Presente Estado de Parcial conciencia mínima Presente Síndrome de enclaustra -miento Presente Total Función motora Sólo respuestas reflejas y posturales Retirada a los estímulos nocivos Ocasionales movimientos sin propósitos Localiza estímulos nocivos Se dirige a objetos Intenta reconocer forma y tamaño de objetos Cuadriplejia Función auditiva Ninguna Función visual Comunicación Ninguna Ninguna Emoción Ninguna Reactiva Reactiva Ninguna Breve orientación Breve fijación ante los sonidos visual Sonrisa o llanto reflejos Localiza estímulos auditivos Sigue a los comandos en forma inconsistente Sostiene la mirada Búsqueda visual sostenida Sonrisa o llanto contingentes Preservada Preservada Vocalización contingente Verbalización o gestos inconsistentes pero comprensibles Afonía/anartria Preservación de la mirada vertical Preservada EVALUACIÓN DE LA MAGNITUD LESIONAL El examen neurológico, por su naturaleza, es una evaluación subjetiva no paramétrica. La coincidencia de los datos obtenidos entre diferentes observadores es variable. A partir de ello, se ha comprobado que el disponer de una historia clínica aumenta considerablemente la consistencia del examen neurológico. Por otra parte, muchos clínicos e investigadores utilizan métodos cuantitativos o semicuantitativos para documentar el estado neurológico y establecer el seguimiento. Los métodos cuantitativos se han utilizado para la evaluación sensorial neurológica general, la evaluación de la respuesta pupilar y otros exámenes cliniconeurológicos. Otros han descripto técnicas para documentar en forma cuantitativa la función neurológica luego del trauma espinal. En adición, se han publicado una variedad de escalas para cuantificar la función neurológica con fines clínicos y de investigación. Estas escalas se han orientado al trauma encefálico, al accidente cerebrovascular, a la evaluación de la sedación y a la evaluación general. La mejor conocida y más utilizada de estas escalas es la Escala de coma de Glasgow (ECG). Teasdale y Jennett publicaron la ECG en el Lancet en 1974 como un instrumento para la evaluación clínica de los trastornos de conciencia postraumáticos (Tabla 6). La misma fue diseñada como un esquema formal para superar la ambigüedad que surgía de la información relacionada con pacientes comatosos. La ECG no tiene valor diagnóstico, pero es una forma adecuada de monitorizar en forma objetiva el curso clínico de un paciente con un insulto neurológico agudo sin delimitar la causa. La ECG tiene tres componentes: la respuesta ocular (E), verbal (V) y motora (M) a los estímulos externos. La mejor o más alta de las respuestas es la que se toma en consideración. La escala tiene un valor máximo de 15 puntos, tal como se muestra en la Tabla 7. Tabla 7. Escala de coma de Glasgow Observación 1.- Apertura ocular Espontánea A la voz Al dolor Ninguna 2.- Respuesta verbal Orientada Confusa Palabras inapropiadas Sonidos incomprensibles Ninguna 3.- Respuesta motora Obedece órdenes Localiza dolor Retirada al dolor Flexión al dolor (Rigidez decorticada) Extensión al dolor (Rigidez descerebrada) Ninguna Total (1 + 2 + 3) Puntaje 4 3 2 1 5 4 3 2 1 6 5 4 3 2 1 La Escala del grado de coma de Glasgow fue el primer intento para la valoración clínica de los pacientes con traumatismo de cráneo y para comparar los resultados de las distintas modalidades de tratamiento y el pronóstico evolutivo, sobre la base del puntaje establecido en ella. La Escala de coma de Glasgow es el método universalmente aceptado de gradación de la severidad del coma en los pacientes traumatizados, y se ha validado como una herramienta de pronóstico en el estudio del trauma encefálico. La escala de coma de Glasgow se ha correlacionado con la sobrevida y con escalas de secuelas, y es altamente exacta y reproducible. Champion incorporó la Escala de Glasgow en el Escore de Trauma original así como en el Escore de Trauma Revisado, ambos con alto poder predictivo de la evolución en todos los tipos de pacientes traumatizados, incluso aquéllos sin trauma encefálico. La Escala de coma de Glasgow fue incluida en el desarrollo del Acute Physiology and Chronic Health Evaluation (APACHE II) escore por Knaus y colaboradores. Estudios subsecuentes han demostrado que la Escala de Glasgow es el componente con mayor poder predictivo en el Escore APACHE II. La presencia de apertura ocular espontánea “indica que el mecanismo del despertar del tronco encefálico está activo”. Como ya se señaló, la preservación del estado de vigilia no implica la presencia de contenidos de conciencia. La apertura ocular en respuesta al estímulo verbal evalúa la reacción “a cualquier intento verbal, no necesariamente una orden de abrir los ojos”. La apertura ocular al dolor debe ser evaluada generando un estímulo doloroso en los miembros, ya que la presión en la zona supraorbitaria o en la mandíbula puede generar una respuesta de retirada con cierre forzado de los ojos. Luego de despertar al paciente, la presencia de respuestas verbales indica la restauración de un alto grado de interacción con el medio, o sea de contenido de conciencia. Una conversación orientada implica un conocimiento de si mismo (el paciente puede responder su propio nombre) y del medio (el paciente está ubicado en tiempo y espacio). Se considera un estado de confusión cuando el paciente es capaz de producir lenguaje, por momentos frases y sentencias, pero es incapaz de responder a las preguntas en forma adecuada. Cuando el paciente emite sólo palabras aisladas al azar, se considera “lenguaje inapropiado”. A ello le siguen vocalizaciones rudimentarias que no implican ningún contenido de conciencia y que dependen de funciones subcorticales; y por último una ausencia completa de emisión de sonidos. La respuesta motora se considera satisfactoria cuando el paciente responde comandos simples, emitidos en forma verbal, gestual o escrita. Si no se obtiene respuesta a estas órdenes, se deberá evaluar la respuesta al dolor. La secuencia de respuesta en función del grado lesional incluye localización del dolor, retirada con flexión normal, y respuestas estereotipadas de rigidez decorticada o descerebrada, que ya han sido descriptas. En general se expresan los tres componentes de la ECG en una suma total que varía entre 3 y 15. Sin embargo, teniendo en cuenta el empleo creciente de la intubación, ventilación y sedación de los pacientes con deterioro de conciencia antes del arribo a las unidades de cuidado crítico, puede ser difícil que se puedan evaluar todas las funciones. En tal sentido, es recomendable referir la ECG en términos tales como “paciente E2, V3, M4”, que es evidentemente más explicativa. A pesar de su documentada utilidad, la Escala de coma de Glasgow tiene algunas limitaciones significativas. Se debe advertir que la misma no evalúa la función del tronco cerebral. Para evitar esta limitación, se desarrolló en 1982 en Liege la conocida como Escala Glasgow Liege, que combina la escala de Glasgow con un análisis cuantificado de cinco reflejos de tronco encefálico: frontoorbicular, oculocefálico vertical, pupilar, oculocefálico horizontal y oculocardiaco. Se considera que el reflejo frontoorbicular está presente cuando la percusión de la glabella produce contracción del músculo orbicular. El reflejo oculocefálico (ojos de muñeca) se considera como presente cuando puede ser inducida la desviación de al menos un ojo por la flexión y extensión (vertical) o el movimiento del cuello horizontal (horizontal) realizados en forma repetitiva. Si no se pueden realizar estas movilizaciones, como en el caso de las fracturas cervicales, se recurrirá a la respuesta ocular a la irrigación del canal auditivo externo (reflejo oculovestibular). El reflejo pupilar se caracteriza por la miosis secundaria a la iluminación adecuada de la pupila. El reflejo oculocardiaco se evalúa como presente cuando la presión sobre el globo ocular produce la disminución de la frecuencia cardiaca. Los reflejos citados desaparecen en orden descendente durante el deterioro rostro-caudal. La desaparición del último reflejo, el oculocardiaco, coincide con la muerte cerebral. Uno de los problemas más importantes con el empleo de la Escala de coma de Glasgow es la incapacidad de evaluar alguno de los componentes en los pacientes intubados, sedados o bajo efectos de drogas bloqueantes neuromusculares. En una revisión de informes sobre el empleo de esta escala en la literatura neuroquirúrgica, Starmark y colaboradores hallaron que 44 de 56 estudios sobre lesiones cerebrales no informaban como utilizaban esta escala en los casos en que no se podía obtener la respuesta verbal. Por su parte, en un estudio reciente sobre 1.005 pacientes con traumatismo de cráneo en centros de Europa, la evaluación de los tres componentes de la ECG fue posible sólo en el 61% de los mismos antes del ingreso al hospital, en el 77% al arribo al primer hospital, en 56% al arribo a la unidad neuroquirúrgica, y en 49% luego de la resucitación. Se han utilizado varios métodos para superar este problema, incluyendo la asignación del escore posible más bajo a los componentes no mensurables, empleo de un pseudoescore, asignación de valores arbitrarios en los pacientes intubados tales como: 5, si el paciente parece ser capaz de hablar; 3, si es difícil establecer si puede hablar; 1, si demostradamente no puede hablar. El método que en el momento actual está siendo más evaluado es el empleo de un modelo de regresión que permite calcular el valor del escore verbal a partir de los valores obtenidos de respuesta ocular y motora, según la fórmula: Escore verbal derivado = -0.3756 + Escore motor * (0.5713) + Escore de respuesta ocular * (0.4233) El método derivado precedente es un excelente predictor del escore verbal actual. Ello hace que se pueda obtener una Escala de coma de Glasgow satisfactoria aun en ausencia del componente verbal. En un intento de superar los inconvenientes antes descriptos cuando se aplica la ECG, Wijdicks y col. han descrito una nueva escala de coma, denomina FOUR score. El FOUR score presenta cuatro componentes evaluables, en contraste con la ECG. El número de componentes y el grado máximo en cada una de estas categorías es cuatro (E4, M4, B4, R4). El FOUR score detecta un locked-in syndrome, así como la presencia de un estado vegetativo donde los ojos pueden estar espontáneamente abiertos pero no siguen el trayecto del dedo del examinador. La respuesta motora se obtiene preferentemente en las extremidades superiores. En la Tabla 8 se indican los componentes del FOUR Score. Tabla 8.- El FOUR score (Wijdicks y col.) Respuesta ocular: 4: los ojos están abiertos o pueden abrirse y siguen un trayecto al comando 3: los ojos se abren pero no siguen un trayecto 2: los ojos están cerrados pero se abren ante el estímulo vocal 1: los ojos están cerrados pero se abren ante el estímulo doloroso 0: los ojos permanecen cerrados ante el estímulo doloroso Respuesta motora: 4: motilidad espontánea ante las órdenes 3: localización del dolor 2: respuesta flexora ante el estímulo doloroso 1: respuesta extensora ante el estímulo doloroso 0: ausencia de respuesta ante el estímulo doloroso o status myoclonus generalizado Reflejos de tronco encefálico: 4: reflejo pupilar y corneano presente 3: una pupila dilatada y fija 2: reflejos pupilares o corneanos ausentes 1: reflejos pupilares y corneanos ausentes 0: reflejos pupilares, corneanos y de tos ausentes Respiración: 4: paciente no intubado, patente respiratoria regular 3: patente no intubado, patente de Cheyne-Stokes 2: paciente no intubado, respiración irregular 1: paciente intubado que respira por encima del ritmo del respirador 0: paciente intubado que respira al ritmo del respirador o esta en apnea Según los autores, el FOUR score presenta ventajas significativas sobre la ECG. El FOUR score continúa siendo utilizable en pacientes críticos que están intubados. El FOUR score evalúa los reflejos esenciales de tronco encefálico y provee información sobre los estados de lesión de tronco que no son evaluables con la ECG. El FOUR score reconoce el locked-in syndrome y un estado vegetativo posible. El FOUR score incluye signos sugestivos de hernia uncal. La atención a la patente respiratoria en el FOUR score no sólo puede indicar una necesidad de soporte respiratorio en pacientes estuporosos o comatosos, sino que también provee información sobre la actividad del centro respiratorio. Finalmente, la probabilidad de muerte intrahospitalaria es mayor con los escores FOUR bajos en comparación con la ECG. PRONOSTICO El paciente en coma puede evolucionar a la muerte, al estado vegetativo persistente, a varios grados de deterioro funcional, o a la recuperación completa neurológica. Estas categorías se han formalizado en sistemas de escore, tales como la Escala evolutiva de Glasgow (GOS) (Tabla 9) y la Escala evolutiva de Glasgow extendida. Existen otras complicaciones del coma incluyendo desordenes de los contenidos de conciencia y gradaciones de disfunción cognoscitiva que no son evaluados en los sistemas tales como el GOS. Tabla 9.- Escala evolutiva de Glasgow. 1 2 3 Muerte Estado vegetativo persistente Incapacidad severa 4 Incapacidad moderada 5 Buena recuperación El paciente no exhibe ninguna función cortical obvia Conciente pero incapacitado. El paciente depende de otros para el soporte diario debido a incapacidad física o mental o ambas Incapacitado pero independiente. El paciente es independiente para los actos de la vida diaria. Las incapacidades incluyen varios grados de disfasia, hemiparesia o ataxia, así como deterioro intelectual o deficits de memoria, o cambios de personalidad Reasunción de las actividades normales aun cuando pueden existir deficits neurológicos o psicológicos menores La predicción de la evolución neurológica es imprescindible en el manejo de los pacientes en coma. La información pronóstica, cuando está disponible, provee una base racional para la toma de decisiones respecto a la intensidad de tratamiento, el retiro del soporte vital, y la rehabilitación. El pronóstico de los pacientes en coma se basa en consideraciones de la etiología, signos clínicos, electrofisiológicos, neuroimagenológicos y datos bioquímicos. Etiología. El pronostico del coma está determinado en gran parte por la etiología de base. Es bien sabido que los comas de etiología tóxica o metabólica se acompañan de mejor pronóstico que los comas de origen estructural. Por otra parte, una serie de estudios demuestran que el coma traumático tiene mejor pronóstico que el coma anóxico. En adultos con estado vegetativo persistente secundario a un trauma encefalocraneano que fueron reevaluados a un año, la proporción con buena recuperación fue del 7%, moderada incapacidad 17%, severa incapacidad 28%, estado vegetativo persistente 15% y muerte 33%. En pacientes con estado vegetativo persistente no traumático, en especial isquémico-hipóxico, el pronóstico es significativamente peor. Signos clínicos. Los signos clínicos que se correlacionan con mal pronóstico luego del coma incluyen el componente motor de la escala de Glasgow, el tiempo de permanencia del paciente en coma, y signos de daño de tronco encefálico. En dos revisiones de coma postanóxico, la ausencia de respuestas motoras en el día tres fue altamente predictiva de mala evolución. La ausencia de respuesta corneal en el día uno también se correlacionó con mala evolución. Los signos clínicos son menos predictivos en el coma estructural por trauma de cráneo. Exámenes electrofisiológicos. Los exámenes electrofisiológicos que se han utilizado para predecir la evolución del coma incluyen el EEG, los potenciales evocados somatosensitivos, los potenciales evocados motores trascraneales, los potenciales evocados auditivos de tronco y los potenciales relacionados con eventos. En pacientes con coma postanóxico, un metaanálisis reveló que el EEG con una línea isoeléctrica o una patente de supresión de descarga se asocia con mal pronóstico. Los datos de los potenciales evocados son altamente predictivos de la evolución. En un estudio se comprobó que en pacientes comatosos con potenciales evocados somatosensitivos ausentes bilaterales, la incidencia de muerte o estado vegetativo fue del 100% luego del coma hipóxico-isquémico, del 99% luego de la hemorragia intracraneal, y del 95% luego del trauma craneoencefálico. Estudios de neuroimagen. Los estudios de neuroimagen son esenciales en el diagnóstico del coma y pueden tener valor pronóstico. En pacientes con coma traumático, las patentes que se han asociado con mal pronóstico incluyen lesiones en el tronco encefálico, desaparición de las cisternas basales e injuria axonal difusa. También se ha encontrado una relación entre las anormalidades en la RMI y la evolución en pacientes comatosos luego de un ACV isquémico o una injuria hipóxico-isquémica. Marcadores bioquímicos. La presencia de moléculas cerebrales específicas en la sangre o en el líquido cefalorraquídeo se ha relacionado con la severidad del daño cerebral. Las moléculas que se han estudiado en la evaluación pronóstica del coma incluyen la enolasa específica, la S100 beta, la proteína acídica glial fibrilar, y la isoforma BB de la CPK. Aunque sensibles a la injuria cerebral, la especificad y el valor predictivo de estos exámenes es insuficiente cuando se comparan con variables clínicas y estudios tales como los potenciales evocados. En estudios recientes se ha comprobado que la Escala evolutiva de Glasgow es muy poco sensible para detectar las pequeñas diferencias que existen en los estados de conciencia entre los pacientes con estado vegetativo persistente y aquellos con estado de conciencia mínima, por lo que se han sugerido otros instrumentos tales como la Coma Recovery Scale, Wessex Head Injury Matrix, Western NeuroSensory Stimulation Profile, Coma Recovery Scale Revised, Sensory Modality Assessment and Rehabilitacion Technique, Disorders of Consciousness Scale (Revision en Laureys y col.). BIBLIOGRAFÍA Balcer L.: Anatomic review and topographic diagnosis. Neurosurgery Clin North Amer 10:5411999 Bateman D.: Neurologica assessment of coma. Brit Med J 71:(Suppl 1)i13-2001 Becker R., Zimmerman J., y col.: Neurologic and neurosurgical intensive care patients: identification of candidates for step-down admission. 24th Educational and Scientific Symposium of the SCCM. San Francisco, California, 1995 Born J.: The Glasgow-Liege Scale. Act Neurochir (Wien): 91:1-1988 Cartlidge N.: States related to or confused with coma. J Neurol Neurosurg Psychiatry 71:(Suppl 1)i19-2001 Facco E.: The role of EEG in brain injury. Intensive Care Med 25:872-1999 Galetta S.: The neuro-ophtalmologic examination. Neurosurg Clin North Amer 10:563-1999 Giacino J., Ashwal S., Childs N.: The minimally conscious state: definition and diagnostic criteria. Neurology 58:349-2002 Giacino J., Whyte J.: The vegetative and minimally conscious states: current knowledge and remaining questions. J Head Trauma Rehabil 20:30-2005 House E.: A systemic approach to neuroscience. McGraw Hill, New York, 1979 Howard R., Kullmann D., Hirsch N.: Admission to neurological intensive care: who, when, and why? J Neurol Neurosurg Psychiatry 74(Suppl III):iii2-2003 Kelly B.: Clinical assessment of the nervous system. En Tobin M.: Principles and practice of intensive care monitoring. McGraw Hill, New York 1998 Knaus W.: Measuring the Glasgow Coma Scale in the Intensive Care Unit: potentials and pitfalls. Intensive Care World 11:102-1994 Kofke W., Yonas H., Wechsler L.: Neurointensive Care. En Albin M.S. (Edit.) Textbook of Neuroanesthesia. McGraw Hill, New York 1997 Laureys S., Majerus S., Moonen G.: Assessing consciousness in critically ill patients. En Vincent J.: Yearbook of Intensive Care and Emergency Medicine. Springer, Berlin 2002 Laureys S., Perrin F., Schnakers C.: Residual cognitive function in comatose, vegetative and minimally conscious states. Curr Opin Neurol 18:726-2005 Malik K., Hess D.: Evaluationg the comatose patient. Postgraduate Med 111:38-2002 Marion D.: The Glasgow Coma Scale Score: contemporary application. Intensive Care World 11:101-1994 Meredith W., Rutledge R., Fakhry S.: The conundrum of the Glasgow Coma Scale in intubated patients: a linear regression prediction of the Glasgow verbal score from de Glasgow eye and motor scores. J Trauma: Injury, Infec and Crit Care 44:839-1998 North J., Jennett B.: Abnormal breathing patterns associated with acute brain damage. Arch Neurol 31:338-1974 Pitts L.: Neurologic evaluation of the head injury patient. Clin Neurosurg 29:203-1981 Plum F., Posner J.: The Diagnosis of Stupor and Coma. Davis, Philadelphia 1990 Purvin V., Kawasaki A.: Neuro-ophthalmic emergencies for the neurologist. The Neurologist 11:195-2005 Rolak L.: Critical Care evaluation of coma. Critical Care State of the Art, SCCM, California 1991 Rutledge R., Lentz C., Fakhry S.: Appropiate use of the Glasgow coma scale in intubated patients: a linear regresssion prediction of the Glasgow verbal score from the Glasgow eye and motor scores. J Trauma: Injury, Infect and Crit Care 41:514-1996 Samuels M.: A practical approach to coma diagnosis in the unresponsive patient. Cleveland Clin J Med 59:257-1992 Simon R.: Breathing and the nervous system. En Aminoff M. (Edit.): Neurology and General Medicine. Churchill Livingstone, New York, 1989 Simon R.: Coma. En Albert R., Dries D. (Edit.). Combined Critical Care Course. ACCP-SCCM, Orlando, 1999 Smith E., Delargy M.: Locked-in syndrome. BMJ 330:406-2005 Starmark J., Homgren E., Stalhammar D.: Current reporting of responsiveness in acute cerebral disorders. A survey of the neurosurgical literature. J Neurosurg 69;692-1988 Stevens R., Bhardwaj A.: Approach to the comatose patient. Crit Care Med 34:31-2006 Teasdale G., Jennett B.: Assessment of coma and impaired consciousness: A practical scale. Lancet 2:81-1974 Tozuda Y., Nakazato N., Stein G.: Pupillary evaluation for differential diagnosis of coma. Postgrad Med J 79:49-2003 Wijdicks E., Bamlet W., Maramattom B.: Validation of a new coma scale: the FOUR score. Ann Neurol 58:585-2005 Wijdicks E., Cranford R.: Clinical diagnosis of prolonged status of impaired consciousness in adults. Mayo Clin Proc 80:1037-2005