Estructuras citoplásmicas afines a mitotracker red cm-h2xros
Anuncio

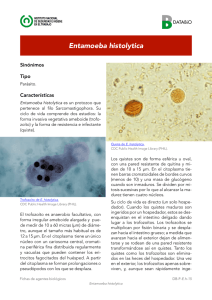
XII JORNADAS DE INVESTIGACIÓN Revista Investigación Científica, Vol. 4, No. 2, Nueva época. Mayo - Agosto 2008 ISSN 1870-8196 Estructuras citoplásmicas afines a mitotracker red cm-h2xros en entamoeba histolytica Mario Rodolfo Morales Vallarta María Porfiria Barrón González Dinora Janeth Pérez Terrazas Licet Villareal Treviño Jorge Armando Verduzco Martínez Facultad de Ciencias Biológicas Universidad Autónoma de Nuevo León María del Pilar Carranza Rosales Centro de Investigación Biomédica del Noreste del Instituto Mexicano del Seguro Social E– mail: mv_mario2000@yahoo.com.mx Introducción Entamoeba histolytica es un parásito microaerofílico intestinal patógeno en humanos causante de la amibiasis y sus múltiples manifestaciones clínicas, considerada a nivel mundial como la tercer causa de muerte ocasionada por protozoarios parásitos, afecta principalmente las regiones tropicales y subtropicales en las zonas donde las condiciones sanitarias son deficientes e inadecuadas. El protozoario parásito E. histolytica es considerado un eucariote ancestral por carecer de las características típicas de los eucariotes, tales como mitocondrias, aparato de golgi, flagelos y retículo endoplásmico rugoso y citoesqueleto microtubular (Martínez-Palomo,1986). La presencia de mitocondrias y organelos derivados de mitocondria no se habían observado previamente en esta amiba; originalmente E. histolytica fue incluida en el grupo de los Archeozoa debido a la carencia de mitocondrias, sin embargo, análisis filogenéticos basados en RNA ribosomal han colocado a este parásito en una rama reciente del árbol eucariota ya que se cree que sus antepasados tuvieron mitocondrias. Tal como fue evidenciado por Clark y Roger en 1995, ellos mostraron evidencia directa de la pérdida secundaria de la función mitocondrial en E. histolytica, a partir de este microorganismo se aislaron genes que codifican para proteínas que en otros eucariotes están localizadas en las mitocondrias, dichas proteínas son la enzima piridin nucleotido transhidrogenasa y las 1 XII JORNADAS DE INVESTIGACIÓN Revista Investigación Científica, Vol. 4, No. 2, Nueva época. Mayo - Agosto 2008 ISSN 1870-8196 chaperoninas cpn60 y la proteína de choque térmico (Hsp -70). Por otra parte Tovar y col (1999), reportaron la presencia de un organelo de posible origen mitocondrial en E. histolytica y lo denominaron Mitosma. En 1999 Mai y col. hicieron una asociación entre la proteína Hsp60 de E. histolytica con un organelo derivado de mitocondria al que denominaron crypton. En el 2000 Bakatselou y col. reportaron el aislamiento y la caracterización de un gen que codifica una proteína de choque térmico de tipo mitocondrial (mt -hsp70) de E. histolytica. En el 2002 Arisue y col. aislaron y secuenciaron genes que codifican para la proteína de choque térmico de tipo mitocondrial a partir de protozoarios amitocondriados como Giardia intestinalis, Entamoeba histolytica y los microsporidios Encephalitozoon hellem y Glugea plecoglosi. En el 2003 Bakatselou , Beste y Clark determinaron la presencia de 3 genes de origen mitocondrial, piridin nucleótido transhidrogenasa y las chaperoninas cpn60 y hsp70 en otras especies de Entamoeba sugiriendo que los genes no se adquirieron recientemente por transferencia lateral a través de otros organismos. La principal fuente de energía de E. histolytica lo constituyen los carbohidratos, los cuales son incorporados por la amiba a través de un sistema de transporte específico. La glucosa es degradada a piruvato por la vía Embden-Meyerhof, en la glucólisis de Entamoeba es utilizado el pirofosfato inorgánico (PPi) como fuente de energía en varias reacciones glicolíticas (Mertens E., 1993), aunque generalmente este es considerado como un producto final del metabolismo. Para la observación de organelos celulares con afinidad a colorantes específicos a mitocondrias, seleccionamos el colorante MitoTracker CM-H2XRos el cual es empleado para el estudio de análisis funcional y de morfología de las mitocondrias. Este colorante es derivado de clorometil-rosamina el cual se vuelve fluorescente sólo cuando es oxidado dentro de las células, debido a su potencial de membrana las mitocondrias funcionales incorporan el colorante y éste se acumula en su interior, ahí el grupo clorometil reacciona con grupos tiol presentes en péptidos y proteínas para formar un conjugado que pude ser fijado con aldehídos (De la Monte y Wands, 2001).La importancia de este trabajo radica en que viene a enriquecer el conocimiento acerca de la biología celular de E. histolytica, a través del aporte de información nueva, tal como la presencia de estructuras con afinidad a colorantes que tienen una alta 2 XII JORNADAS DE INVESTIGACIÓN Revista Investigación Científica, Vol. 4, No. 2, Nueva época. Mayo - Agosto 2008 ISSN 1870-8196 especificidad a mitocondrias en eucariotes superiores, tales como el MitoTracker Red CMH2Ros, lo cual aportaría evidencias que podrían ser utilizadas para una caracterización o clasificación de este organismo. nueva Por lo cual es posible encontrar estructuras con afinidad al MitoTracker Red CM-H2Ros, colorante específico a mitocondrias, en cultivos de Entamoeba.histolytica HM1-IMSS. Palabras claves: Mitotracker, Mitosomas, Entamoeba histolytica. Objetivo Establecer la presencia o ausencia de estructuras con afinidad al MitoTracker Red CMH2Ros colorante específico a mitocondrias, mediante microscopía óptica de campo claro y de fluorescencia en cultivos axénicos in vitro de Entamoeba histolytica. Metodología 1. Material biológico. Cepa amibiana HM1-IMSS de Entamoeba histolytica y suero bovino esteriL. 2. Medios de cultivo.- Se utilizó el medio de cultivoTYI-S-33 (Diamond, 1978) Cinéticas de crecimiento de E. histolytica Se inocularon 2x104 trofozoítos/mL de E. histolytica en tubos de 13 x 100 mm con 5 mL de medio TYI- S-33, agregando 0.5 mL de suero bovino estéril y 0.05 mL de antibiótico, y se incubaron a 37°C realizando cuentas cada 24 horas durante 6 días. Tinción de trofozoítos de E. histolytica con MitoTracker Red CM-H2XRos 1. Se inocularon 2x104 trof/mL de E. histolytica en tubos Leighton (anterior a la esterilización se le colocó en la base plana un cubreobjetos, el cual sería soporte para la 3 XII JORNADAS DE INVESTIGACIÓN Revista Investigación Científica, Vol. 4, No. 2, Nueva época. Mayo - Agosto 2008 ISSN 1870-8196 proliferación celular), con 5 mL de medio TYI- S-33, 0.5 mL suero bovino estéril, 0.05 mL de antibiótico y se incubaron a 37°C. 2. Las tinciones de los trofozoítos de E. histolytica se realizaron durante el día 1, 3 y 5 de la fase de crecimiento; cada día con 5 diferentes concentraciones (500, 250, 150, 100 y 50 nM) de colorante, con la finalidad de establecer la concentración de MitoTracker Red que produjera la menor fluorescencia del fondo. 3. Se retiró el medio de cultivo TYI-S3-3 de los tubos Leighton. 4. Las células adheridas al tubo se lavaron con PBS. 5. Se agregó el colorante MitoTracker Red CM-H2XRos a 500, 250, 150, 100 y 50 nM, disuelto en 1 mL de medio de cultivo TYI-S-33 y se incubaron a 37°C. 6. Se retiraron los tubos de la incubadora, se eliminó el colorante con el medio y las células se lavaron suavemente con PBS, se fijaron con formaldehído al 4% por 20 min, se retiró el formaldehído y se lavó 3 veces con PBS. 7. Cada cubreobjeto se retiró del tubo Leighton y se colocaron invertidos en un portaobjetos en medio de montaje especial (Dako Fluorescent Mounting Medio) y posteriormente se sellaron con esmalte fino. 8. Las laminillas fueron almacenadas a –20°C hasta su observación al microscopio de fluorescencia. Tinción con Mito-Tracker Red CM-H2XRos y homogeneización de trofozoítos de E. histolytica 1. Proceder de igual manera que en el punto III.1 2. Se centrifugaron los tubos a 1000 rpm durante 5 minutos para retirar el medio de cultivo y el pellet de amibas fue colocado en tubos eppendorf. 3. Se agregó PBS para lavar, se centrifugó a 1000 rpm por5 minutos y se retiró por inversión. 4. Las células fueron incubada a 37°C con MitoTracker Red CM-H2XRos 100 nM por 30 min. 5. Se centrifugaron a 1000 rpm para retirar el colorante. 6. Se agregó PBS para lavar y se centrífugo a 1000 rpm para retirarlo. 4 XII JORNADAS DE INVESTIGACIÓN Revista Investigación Científica, Vol. 4, No. 2, Nueva época. Mayo - Agosto 2008 ISSN 1870-8196 7. Las células fueron lisadas usando un homogenizador de vidrio (270 golpes) en 2 mL de buffer isotónico. Este paso y los siguientes se llevaron a cabo en un baño de hielo a 4°C. 8. Se colocaron dos gotas del homogeneizado en un portaobjetos; se dejaron secar y se agregó medio de montaje (Dako fluorescent Mounting Medio). 9. El homogeneizado restante se fijó con formaldehído al 4 % y se almacenó a –20°C al igual que las laminillas obtenidas. Fracción 3500 x g del homogeneizado de trofozoítos de E. histolytica previamente teñidos con MitoTrackerRed CM-H2XRos 1. Proceder de igual manera que en el punto III.1 2. Se centrifugaron los tubos a 1000 rpm durante 5 minutos para retirar el medio de cultivo; el precipitado se concentró en un solo tubo. 3. Se agregó PBS para lavar, se centrifugó a 1000 rpm por 5 minutos, se retiró el PBS y el pellet fue colocado en un homogeneizador de vidrio con 2 mL de Buffer isotónico. 4. Las células fueron lisadas usando un homogeneizador de vidrio (270 golpes) en 2 mL de buffer isotónico. Este paso y los siguientes se llevaron a cabo en un baño de hielo a 4°C. 5. Los extractos se fraccionaron por centrifugación diferencial a 1000 x g durante 5 minutos para obtener la fracción nuclear. 6. El sobrenadante obtenido se sometió a 3500 x g durante 10 min. para obtener la fracción mitocondrial (pastilla). 7. Se hicieron preparaciones en medio de montaje (Dako Fluorescent Mounting Medio) y se observaron por microscopía de fluorescencia. Microscopía electrónica de la fracción 3500x g delhomogeneizado de trofozoítos de E. histolytica Seguir los pasos del 1-7 del punto anterior. 8. La pastilla se lavó 2 veces con Buffer de fosfatos y se fijó con glutaraldehído al 2.5 % por 24 horas a 4°C. 5 XII JORNADAS DE INVESTIGACIÓN Revista Investigación Científica, Vol. 4, No. 2, Nueva época. Mayo - Agosto 2008 ISSN 1870-8196 9. Para retirar el glutaraldehído se lavó 3 veces con Buffer de fosfatos y se agregó buffer de fosfatos 0.12 M por partes iguales con OsO4, se incubó durante 30 minutos a 4°C. 10. Se centrifugó a 15000 rpm y se eliminó el sobrenadante (OsO4). 11. La muestra se deshidrató en alcoholes al 70, 80, 90, 95 y 100 % durante 5 minutos en cada uno, repitiendo 2 veces más en alcohol al 100 %. 12. Se agregó Oxido de propileno durante 10 minutos. Este paso se repitió 2 veces. 13. La muestra se incluyó en la resina spurr (Spurr, 1969) y se dejó polimerizar a 65 °C por 24 horas. 14. Se realizaron cortes finos contrastados con acetato de uranilo y citrato de plomo y fueron analizados en microscopio electrónico. Resultados Tinción de trofozoítos de E. histolytica con MitoTracker Red CM-H2XRos Las tinciones con MitoTracker Red CM-H2XRos 100 nM de los trofozoítos de E. histolytica resultaron positivos, ya que en el citoplasma de la amiba se observaron algunas estructuras con afinidad a este colorante, lo cual indica que son MitoTracker positivas (+). La figura 1A muestra una fotografía al microscopio de fluorescencia en donde pueden observarse claramente las zonas de fluorescencia intensa localizada en el citoplasma de E. histolytica. En algunas amibas se observaron áreas fluorescentes relativamente grandes, los sitios fluorescentes de afinidad por el MitoTracker presentan tamaños mayores que los observados en células eucariotas de organismos superiores. Tinción con MitoTracker Red CM-H2X Ros y homogeneización de trofozoítos de E. histolytica La homogeneización de los trofozoítos de E. histolytica se llevó a cabo con el fin de localizar e identificar las estructuras teñidas con MitoTracker Red CM-H2XRos en los trofozoítos (ver Fig. 1A) por lo que se tiñó previamente con MitoTracker Red CM-H2X Ros para que fuera posible su visualización a través de microscopía de fluorescencia. En la Fig. 1B es posible observar 6 XII JORNADAS DE INVESTIGACIÓN Revista Investigación Científica, Vol. 4, No. 2, Nueva época. Mayo - Agosto 2008 ISSN 1870-8196 una imagen de contraste de interferencia donde se distinguen restos de membrana que forman parte del homogeneizado crudo donde se observa además un agregado de vesículas en la parte central de la fotografía (recuadro). En la Fig. 1C éste mismo agregado se muestra por microscopía de fluorescencia, y muestra gran afinidad por el colorante a diferencia de los demás restos celulares los cuales no fluorescen. Fracción 3500 x g del homogeneizado de trofozoítos de E. histolytica teñidos previamente con MitoTracker Red CM-H2XRos La centrifugación a 3500 x g se llevó a cabo con el fin de obtener una fracción mas concentrada de vesículas con afinidad al MitoTracker. Las Fig. 1D y 1E muestran agregados de vesículas de esta fracción con afinidad por el colorante MitoTracker Red CM-H2XRos. En la fracción 3500 x g también se encontraron vesículas aisladas que muestran afinidad al colorante MitoTracker Red CM-H2XRos. La figura 1F muestra vesículas con fluorescencia en la membrana y presenta en su interior material que muestra una fuerte fluorescencia y que guardan correlación con la morfología de algunas vesículas observadas por microscopía electrónica (ver figuras 1I, 1J y 1K). La figura 1G muestra un campo donde se observa un agregado de vesículas de tamaños variables, algunas de las cuales contienen otras vesículas o inclusiones muy fluorescentes en su interior (flecha). En la figura 1H se aprecia la presencia de dos inclusiones fluorescentes en el interior de una vesícula (flecha). Microscopía electrónica de la fracción 3500 x g del homogeneizado de trofozoítos de E. histolytica La fracción 3500 x g observada a través de microscopía electrónica se realizó con el fin de b) conocer acerca de la ultraestructura de las vesículas observadas por microscopía de fluorescencia. Las fotografías muestran vesículas abundantes de diferentes tamaños, algunas de ellas formadas por una doble membrana tal y como se observa en la figura 1I y 1J, el diámetro de estas estructuras fue de aproximadamente 1-3 μm. En la figura 1J y 1K también pueden observarse estructuras membranosas internas que guardan correlación morfológica con las observadas por microscopía de fluorescencia (ver figura 1F). 7 XII JORNADAS DE INVESTIGACIÓN Revista Investigación Científica, Vol. 4, No. 2, Nueva época. Mayo - Agosto 2008 ISSN 1870-8196 A B 10μm C D E b a F G I J b H K c Fig 1.-A) imágenes de E. histolytica en presencia de mitoTracker Red CM-H2XRos. B-H) vesículas fluorescentes de E. histolytica en presencia mitoTracker Red CM-H2XRos. I-K) vesículas observadas al microscopio electrónico de transmisión, el rango de tamaño de las vesículas fue calculado de 1-3 μm. 8 XII JORNADAS DE INVESTIGACIÓN Revista Investigación Científica, Vol. 4, No. 2, Nueva época. Mayo - Agosto 2008 ISSN 1870-8196 Discusión Si bien Entamoeba histolytica tuvo una alta afinidad por el colorante MitoTracker Red CMH2XRos, el patrón de tinción no es igual al que se presenta cuando se tiñen células eucariotes de organismos superiores. En el caso de E. histolytica aparecen áreas fluorescentes más grandes y poco numerosas (de una a cuatro), aunque algunas veces también se observaron pequeños puntos fluorescentes. La tinción con MitoTracker Red CMH2XRos está basada en la asociación del colorante oxidado (fluorescente) con grupos tiol presentes en péptidos y proteínas mitocondriales; es posible entonces que estas proteínas, o semejantes a éstas, posiblemente remanentes de un estado mitocondrial anterior sean las responsables de la tinción con MitoTracker Red CM-H2XRos. El patrón de fluorescencia con MitoTracker Red CM-H2XRos en E. histolytica sugiere la posible presencia de una estructura u organelo con un tamaño considerablemente mayor que el de una mitocondria típica, lo cual se antojaba improbable por que no hay referencias de estructuras con características morfológicas de mitocondrias ni aun con observaciones al microscopio electrónico. Por otra parte, cuando se analizó la fracción 3500 x g del homogeneizado de trofozoítos de E. histolytica se pudo observar la presencia de vesículas de un rango de tamaño de 1-3 μm, pero además estas usualmente se encontraban formando agregados, lo cual explica la gran área fluorescente observada en trofozoítos intactos. Es posible entonces que si estas estructuras afines al MitoTracker Red CM-H2XRos representan a un solo tipo de organelo, éste se ha formado por un agregado de vesículas semejantes pero no iguales a como se encuentran asociadas las cisternas del Golgi. Por otra parte, la observación al microscopio electrónico confirmó la presencia de estructuras que guardan correlación con la morfología de las vesículas y agregados observados por microscopía de fluorescencia. La microscopía electrónica también demostró la presencia de vesículas con doble membrana, además de que algunas presentan también estructuras internas de membrana que podrían ser vesículas o septos de la membrana interna. 9 XII JORNADAS DE INVESTIGACIÓN Revista Investigación Científica, Vol. 4, No. 2, Nueva época. Mayo - Agosto 2008 ISSN 1870-8196 Las enzimas mitocondriales piridina-nucleótido transhidrogenasa y la chaperonina mitocondrial cpn60 están codificadas en el genoma de E. histolytica y esta última enzima ha sido identificada en un organelo de este parásito, al cual se le ha dado el nombre de Mitosoma (Tovar y cols., 1999) y en el cual se ha determinado también la presencia de DNA de doble hélice (Ghosh y cols., 2000). Estos hallazgos han hecho suponer que el Mitosoma es un organelo putativo de la mitocondria ya que por otra parte los árboles filogenéticos basados en el análisis de RNA ribosmal, muestran que Entamoeba histolytica es un organismo más bien reciente en la escala evolutiva y no ancestral como era considerado anteriormente. Una situación semejante ocurre en Giardia intestinalis con el descubrimiento de genes nucleares de un posible ancestro mitocondrial (Tovar J, 2003). Sin embargo, en estos organismos no se ha reportado ningún estudio con colorantes afines a mitocondria. Jorge Tovar (1999) muestra que el Mitosoma se presenta visualmente en número de uno (una vesícula) por trofozoíto, pero lo encontrado en este trabajo indica que existen un gran número de vesículas con afinidad al MitoTracker formando agregados. Aunque por otra parte, las vesículas aquí estudiadas presentan también una doble membrana (véase Figs. 1I, 1J, 1K) como lo encontrado en mitosomas. En síntesis, los hallazgos de este trabajo concuerdan con las características del Mitosoma o Crypton en que posee una doble membrana, pero no concuerdan en el número de vesículas presentes por trofozoítos, ni con la presencia de vesículas internas. Por otra parte no está determinado si las vesículas afines al MitoTracker Red CM-H2XRos poseen la chaperonina cpn60 y/o la piridin-nucleótido transhidrogenasa ni si poseen DNA. Por lo tanto tampoco está determinado si las estructuras identificadas en este trabajo corresponden al Mitosoma o Crypton o a un nuevo organelo o estructura del citoplasma amibiano. 10 XII JORNADAS DE INVESTIGACIÓN Revista Investigación Científica, Vol. 4, No. 2, Nueva época. Mayo - Agosto 2008 ISSN 1870-8196 Conclusiones 1. Existen vesículas citoplasmáticas afines al Mitotracker Red CM-H2XRos en trofozoítos de Entamoeba histolytica y Entamoeba invadens. 2. Las vesículas citoplásmicas están formadas por una doble membrana y son semejantes a las descritas por otros autores como Mitosomas, pero difieren en cuanto a que las descritas en este trabajo presentan vesículas internas que también podrían representar septos formados por la membrana interna 3. El patrón de tinción de Mitotracker Red CM-H2XRos difiere del marcado con anticuerpos contra la proteína cpn-60 y contra mitocondrias de células eucariotas de organismos superiores. 4. Las vesículas teñidas Mitotracker Red CM-H2XRos podrían representar la presencia de un organelo diferente al Mitosoma. 11 XII JORNADAS DE INVESTIGACIÓN Revista Investigación Científica, Vol. 4, No. 2, Nueva época. Mayo - Agosto 2008 ISSN 1870-8196 Bibliografía Martínez Palomo, A. (1986) Biology of Entamoeba histolytica. In amebiasis. Martínez- Palomo, A. (ed.). Amsterdam: Elsevier Science, pp. 11-43. Clark C.G. and Roger, A.J. (1995) Direct evidence for secondary loss of mitochondria in Entamoeba histolytica. Procedure National Academic Science USA, 92: 6518-6521. Tovar J, Fischer A and Clark G. (1999) The mitosome, a novel organelle related to mitochondria in the amitochondrial parasite Entamoeba histolytica. Molecular microbiology, 32:1013-1021. Mai Z; Ghosh S; Frisardi M; Rosenthal B; Rogers R and Samuelson J. Hsp60 Is Targeted to a Cryptic Mitochondrion-Derived Organelle (“Crypton”) in the microaerophilic protozoan parasite Entamoeba histolytica. Molecular and Cellular Biology. (1999). 19: 2198- 2205. Bakatselou C, Beste D, Kadri AO, Somanath S, Clark CG. Analysis of genes of mitochondrial origin in the genus Entamoeba. J Eukaryot Micribiol. (2003), 50(3): 210-4. Arisue N, Sanchez L, Weiss L, Muller M, Hashimoto T. Mitochondrial – type hsp 70 genes f the amitochondriate protists, Giardia intestinalis, Entamoeba histolytica and two microsporidians. Parasitol Int. (2002), 51 (1): 9-16. 7. Bakatselou Ch, Kidgell C, Clark G. A mitochondrial – type hsp70 gene of Entamoeba histolytica. Molecular and Biochemical Parasitology. (2000), 110: 177-182. Mertens, E. “ATP versus pyrophosphate: glycolysis revisited in parasitic protists”, Parasitol Today, (1993), 9: 122-126. De la Monte S, Wands JR. Mitochondrial DNA damage and impaired mitochondrial function contribute to apoptosis of insulin-stimulated ethanol-exposed neuronal cells. Alcohol Clin Exp Res. (2001), 25(6):898-906. Diamond L.S., Harlow D. y Cunnick C.C., 1978. A new medium for the axenic cultivation of Entamoeba histolytica and other Entamoeba. Transactions of the Royal Society of Tropical Medicine and Hygiene 72:431-432. 12 XII JORNADAS DE INVESTIGACIÓN Revista Investigación Científica, Vol. 4, No. 2, Nueva época. Mayo - Agosto 2008 ISSN 1870-8196 Spurr A. A low-viscosity epoxy resin embedding medium for electron microscopy. J Ultrastruct Res. (1969), 26: 31-43. Ghosh S, Field J, Rogers R, Hickman M, and Samuelson J. The Entamoeba histolytica mitochondrion-derived organelle (Crypton) contains double-stranded DNA and appears to be bound by a double membrane. Infection and inmunity. (2000), 43194322. Tovar J, León-Avila G, Sanchez L, Sutak R, Tachezy J, Van der Giezen M, Hernandez M, Muller M, Lucocq JM. Mitochondrial remnant organelles of Giardia function in iron–sulphur protein maturation. Nature. (2003), 13; 426 (6963): 172-6. 13