ELECTROFORESIS EN GELES SDS
Anuncio
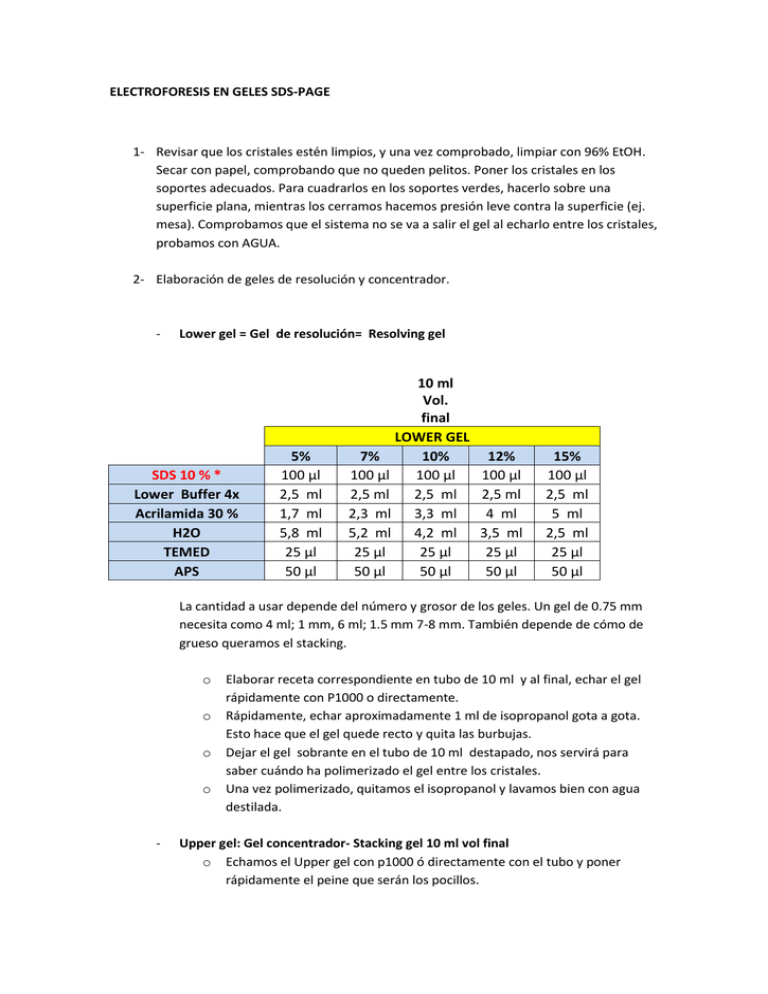
ELECTROFORESIS EN GELES SDS-PAGE 1- Revisar que los cristales estén limpios, y una vez comprobado, limpiar con 96% EtOH. Secar con papel, comprobando que no queden pelitos. Poner los cristales en los soportes adecuados. Para cuadrarlos en los soportes verdes, hacerlo sobre una superficie plana, mientras los cerramos hacemos presión leve contra la superficie (ej. mesa). Comprobamos que el sistema no se va a salir el gel al echarlo entre los cristales, probamos con AGUA. 2- Elaboración de geles de resolución y concentrador. - Lower gel = Gel de resolución= Resolving gel SDS 10 % * Lower Buffer 4x Acrilamida 30 % H2O TEMED APS 5% 100 µl 2,5 ml 1,7 ml 5,8 ml 25 µl 50 µl 10 ml Vol. final LOWER GEL 7% 10% 12% 100 µl 100 µl 100 µl 2,5 ml 2,5 ml 2,5 ml 2,3 ml 3,3 ml 4 ml 5,2 ml 4,2 ml 3,5 ml 25 µl 25 µl 25 µl 50 µl 50 µl 50 µl 15% 100 µl 2,5 ml 5 ml 2,5 ml 25 µl 50 µl La cantidad a usar depende del número y grosor de los geles. Un gel de 0.75 mm necesita como 4 ml; 1 mm, 6 ml; 1.5 mm 7-8 mm. También depende de cómo de grueso queramos el stacking. o o o o - Elaborar receta correspondiente en tubo de 10 ml y al final, echar el gel rápidamente con P1000 o directamente. Rápidamente, echar aproximadamente 1 ml de isopropanol gota a gota. Esto hace que el gel quede recto y quita las burbujas. Dejar el gel sobrante en el tubo de 10 ml destapado, nos servirá para saber cuándo ha polimerizado el gel entre los cristales. Una vez polimerizado, quitamos el isopropanol y lavamos bien con agua destilada. Upper gel: Gel concentrador- Stacking gel 10 ml vol final o Echamos el Upper gel con p1000 ó directamente con el tubo y poner rápidamente el peine que serán los pocillos. SDS 10 % * Upper Buffer 4x Acrilamida 30 % H2O TEMED APS 100 µl 2,6 ml 1,2 ml 6,2 ml 20 µl 40 µl * sólo si no está en la composición del lower o upper buffer. 3- Preparación de la muestra para cargar en gel. - Si procede, añadir al lisado el volumen de buffer de lisis correspondiente, para cargar los mismos µg de proteína (solo en caso en que esto sea necesario). - Añadir al lisado de proteínas Laemmli que está a una concentración 3X y lo queremos a 1x. Ejemplo : Tenemos un volumen de lisado de 50 µl y añadimos 25 µl de laemmli , así tenemos 2 partes de lisado y 1 parte de laemmli (1x). En cualquier caso, añadir el Laemmli dependiendo de su concentración: si es x2, echamos el mismo volumen de muestra, etc… - Calentar en termobloque a 95 ºC, exactamente 5 minutos. - Homogeneizar con vortex 4- Mientras se calientan las muestras, montar la cubeta de electroforesis. Añadimos Running buffer 1x, de manera que cubra la cámara formada entre los dos cristales y en la parte de abajo, hasta que cubra el hilo conductor de Pt. 5- Cargar muestras con el volumen correspondiente al experimento que estemos realizando, incluyendo como mínimo un pocillo con un marcador de peso molecular conocido y anotando el orden de carga de las muestras. Usar, si es posible, gel tips (capilares). Con los geles de 1.5 mm no hace falta, se pueden usar puntas amarillas. 6- Conectar los electrodos a la fuente y correr la electroforesis a voltaje constante de 180 voltios, y estando pendiente de que el amperaje no suba en exceso, y siempre esté por debajo del voltaje. Si el stacking nos ha salido muy delgadito, comenzar la carrera a 100V, y subir a 150-180V cuando la muestra haya rebasado el stacking. Puede ocurrir que durante la carrera, el amperaje decaiga rápidamente y la muestra deje de migrar: esto ocurre cuando el reservorio central de buffer 1x se sale, y el nivel de buffer baja por debajo de la muestra entre cristal pequeño y grande. Si esto ocurre, detener la carrera y añadir buffer hasta que el reservorio esté lleno de nuevo. Dejar correr las muestras hasta que el frente desaparezca por abajo. Esto suele durar aproximadamente una hora. Vigilar en todo caso el proceso de electroforesis, ya que corremos el riesgo de que la muestra que nos interesa se nos salga del gel, ó no corra lo suficiente para poder distinguir la banda. Running buffer: 1 litro - 100 ml Tris Glicina 10X 890 ml H2O destilada 10 ml SDS 10 % (tendremos una concentración final de SDS 0.1 %) Nota: ¡¡Adecuarlo a nuestras moléculas! CUADRO APROXIMADO DE SEPARACIÓN DE PESOS MOLECULARES % ACRILAMIDA Rango óptimo de separación de pesos moleculares (kDa) 5 75-300 7 50-250 10 30-150 12 15-100 15 10-75


