Orexina - Revista de Neurología
Anuncio

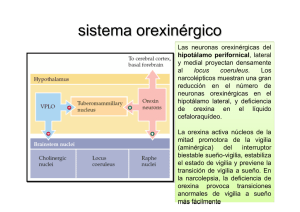
rEVISIÓN Orexina: implicaciones clínicas y terapéuticas Cristina Mediavilla, Severiano Risco Introducción. Se ha descrito recientemente una nueva clase de neuropéptidos, las orexinas, también llamadas hipocretinas, producidos por un reducido grupo de neuronas hipotalámicas y cuyas acciones son mediadas por dos tipos de receptores, OX1R y OX2R. En concreto, las neuronas orexinérgicas se han localizado en exclusiva en células de áreas del hipotálamo lateral, dorsomedial y perifornical. A pesar de este origen anatómico tan localizado, las neuronas orexinérgicas se proyectan ampliamente a numerosas regiones troncoencefálicas, corticales y límbicas. Departamento de Psicobiología; Facultad de Psicología (C. Mediavilla). Departamento de Farmacología; Facultad de Farmacia (S. Risco). Universidad de Granada. Granada, España. Desarrollo. Este patrón difuso de distribución de las fibras orexinérgicas estaría indicando la intervención de este sistema peptídico en una amplia variedad de funciones y, de hecho, se ha relacionado con los mecanismos que permiten la regulación del ciclo sueño-vigilia, la ingesta de comida y de bebida y determinados aprendizajes como el aprendizaje de preferencias gustativas. Se ha sugerido también que la alteración en el funcionamiento del sistema orexinérgico explicaría la aparición de determinados trastornos clínicos como la narcolepsia, la obesidad o la adicción a drogas de abuso. Correspondencia: Dra. Cristina Mediavilla García. Departamento de Psicobiología. Facultad de Psicología. Universidad de Granada. Campus de Cartuja, s/n. E-18071 Granada. Conclusiones. Nuevas investigaciones ayudarán a conocer el funcionamiento de las neuronas orexinérgicas y la interacción entre los sistemas que regulan la emoción, la homeostasis energética y los mecanismos de recompensa con los sistemas que regulan el ciclo de sueño-vigilia. Se confía en que ese conocimiento permita desarrollar nuevos fármacos que, actuando sobre el sistema orexinérgico, sean eficaces en el tratamiento de las alteraciones del sueño como el insomnio o la narcolepsia, de los trastornos de la alimentación o de la drogadicción. Palabras clave. Drogadicción. Hipotálamo lateral. Narcolepsia. Obesidad. Orexina. Receptores OX1R y OX2R. Fax: +34 958 246 186. E-mail: cristina@ugr.es Financiación: Trabajo financiado por la ayuda PSI2012-37987 del Ministerio de Economía y Competitividad. Aceptado tras revisión externa: 30.09.13. Introducción En 1998, dos laboratorios identificaron simultánea e independientemente dos nuevos neuropéptidos, la orexina A y la orexina B, también llamados hipocretinas, que procedían de un mismo precursor, la preproorexina [1,2]. El gen de la preproorexina, localizado en el cromosoma 11 del ratón y en la región 17q21-q24 del cromosoma 17 humano, codifica una proteína formada por 130 aminoácidos en roedores y 131 en humanos que mediante proteó­ lisis origina ambos neuropéptidos [1,2]. La orexi­ na A, muy conservada entre mamíferos, está constituida por una cadena de 33 aminoácidos y presenta dos puentes intracatenarios de disulfuros, lo que le confiere gran estabilidad estructural. La orexina B, por su parte, está constituida por una cadena lineal de 28 aminoácidos que carece de puentes disulfuros y presenta un 46% (13/28) de homología con la secuencia aminoacídica de la orexina A [2]. Estos estudios determinaron, además, que la preproorexina y los neuropéptidos derivados de ella se localizaban exclusivamente en células del hipotálamo lateral (HL), dorsomedial (DMH) y perifornical (PFA). Posteriores trabajos confirmaron la lo- www.neurologia.com Rev Neurol 2014; 58 (3): 117-124 calización altamente restringida de las células orexinérgicas y comprobaron que, a pesar de este origen tan localizado, las fibras orexinérgicas hipotalá­ micas se distribuyen por prácticamente todo el neuroeje [3]. Así, se ha demostrado la existencia de proyecciones orexinérgicas en zonas troncoencefálicas como el locus coeruleus, los núcleos del rafe, el área parabraquial, el área tegmental ventral (ATV) o el núcleo del tracto solitario, entre otras. Fibras orexinérgicas finalizan igualmente en núcleos hipotalámicos, como el núcleo arqueado o los núcleos tuberomamilares, en núcleos talámicos, como el núcleo paraventricular, o en regiones límbicas, como la amígdala [3,4]. La orexina se une selectivamente a dos tipos de receptores, OX1R y OX2R (también llamados HCRTR1 y HCRTR2), acoplados a proteínas G y altamente conservados en las distintas especies [2,5]. El OX1R presenta mucha más afinidad para la orexina A que para la orexina B, mientras que el OX2R tendría una afinidad similar para ambos péptidos [2,6]. Ambos tipos de receptores, además, parecen tener una distribución anatómica diferente en el sistema nervioso, lo que indica que pueden desempeñar papeles diferentes en las funciones fisiológicas de la orexina Cómo citar este artículo: Mediavilla C, Risco S. Orexina: implicaciones clínicas y terapéuticas. Rev Neurol 2014; 58: 117-24. © 2014 Revista de Neurología 117 C. Mediavilla, et al Figura 1. Figura que representa el papel regulador que ejercería la orexina sobre las regiones cerebrales responsables de los estados de sueño y vigilia. Las flechas indican señales excitadoras y las barras, señales inhibidoras. El grosor de las líneas representa la fuerza relativa de cada una de las señales. Las regiones enmarcadas en forma de estrella indican las zonas más activas en cada estado. Así, en el estado de vigilia, las señales orexinérgicas aumentan la actividad de las neuronas promotoras de vigilia que, a su vez, inhiben a las neuronas del área preóptica ventrolateral (APVL). La ausencia del mecanismo estabilizador que proporciona la orexina permitiría la formación de un sistema inestable, mutuamente inhibidor, entre APVL y las regiones promotoras de la vigilia que explicaría las abruptas transiciones entre estados características de la narcolepsia (adaptado de [5]). Sueño Vigilia Neurona orexinérgica Neurona orexinérgica APVL Regiones que inducen vigilia APVL Regiones que inducen vigilia Neurona orexinérgica Regiones que inducen vigilia APVL Narcolepsia [6-8]. La orexina sería así un ejemplo de neuropéptido que, mediante una inervación difusa, controla la función de numerosos grupos neuronales e interviene de esta manera en funciones diversas. De hecho, se la ha relacionado con funciones como el ciclo sueño-vigilia, la ingesta de alimentos y líquidos, la regulación autonómica o funciones neuroendocrinas, entre otras. Por ello, se considera que la alteración de los niveles o del funcionamiento del sistema orexinérgico es la responsable de la aparición de determinados trastornos clínicos, algunos de los cuales se van a analizar a continuación. Orexina y narcolepsia Una de las funciones que con más consistencia se atribuye a la orexina es su papel en el control del nivel de activación (arousal) y de vigilia [9,10]. Así, se ha comprobado que la administración intracerebroventricular de orexina prolonga el período de vigilia y reduce el tiempo de sueño REM y no REM 118 [11]. Técnicas inmunohistoquímicas han determinado también que las neuronas orexinérgicas están activas durante el período de oscuridad en roedores, momento en el que estos animales están más activos y despiertos, e inhibidas mientras duermen [11,12]. Estudios optogenéticos más recientes han observado que silenciar las neuronas orexinérgicas durante el período nocturno en ratones aumenta el tiempo que pasan en sueño de ondas lentas y disminuye el tiempo total de vigilia, lo que incrementa además el número de transiciones sueño-vigilia [13]. Células orexinérgicas del HL mandan proyecciones excitadoras a núcleos noradrenérgicos (locus coeruleus), serotoninérgicos (núcleos del rafe), co­ linérgicos (núcleos laterodorsal tegmental y pe­ dunculopontino) e histaminérgicos (núcleo tuberomamilar), regiones todas ellas relacionadas con el mantenimiento de la actividad y la vigilia. Al mismo tiempo, neuronas orexinérgicas perifornicales reciben proyecciones inhibidoras del área preóptica ventrolateral, región cerebral promotora del sueño no REM y que mantiene conexiones inhibidoras recíprocas con todos los núcleos anteriores [5,10,14]. Estas conexiones anatómicas llevaron a Saper et al [15] a proponer un mecanismo oscilador (flip-flop) del sueño-vigilia con dos sistemas antagónicos y mutuamente inhibidores, uno que facilita la vigilia y otro que la inhibe, y que sería regulado y estabilizado por neuronas orexinérgicas (Fig. 1). La pérdida de ese mecanismo estabilizador explicaría los síntomas de la narcolepsia [11]. La narcolepsia es un trastorno caracterizado por una irresistible necesidad de dormir durante el día que provoca que una persona se duerma incluso en momentos y circunstancias inapropiados (ataque de sueño). Junto a esto, se aprecia una patológica intrusión del sueño REM durante el estado de vigilia. Así, las personas con narcolepsia pueden experimentar durante unos pocos minutos alucinaciones hipnagógicas o parálisis del sueño durante la transición de la vigilia al sueño o del sueño a la vigilia respectivamente. En ocasiones, pueden sufrir también cataplejía, un síntoma específico de la narcolepsia y que suele ser provocada por emociones como la risa. Este síntoma se caracteriza por una súbita pérdida del tono muscular que puede provocar la caída y la parálisis del paciente durante unos pocos minutos y mientras permanece plenamente consciente. La narcolepsia tiene un tratamiento sintomático, de manera que la somnolencia diurna excesiva se trata con psicoestimulantes como modafinilo o metilfenidato mientras que la cataplejía, las alucinaciones hipnagógicas y la parálisis del sueño se tratan con oxibato sódico, antidepresivos tri- www.neurologia.com Rev Neurol 2014; 58 (3): 117-124 Orexina: implicaciones clínicas y terapéuticas cíclicos e inhibidores de la recaptación de serotonina [11,16,17]. En 1999, los estudios de la narcolepsia en modelos experimentales animales fueron los primeros en relacionar el sistema orexinérgico con este trastorno. Estos estudios comprobaron que mutaciones del receptor OX2R en perros o la ausencia de orexina en ratones knockout para el gen prepro-Orexin o en ratones transgénicos orexin/ataxin-3 producían fenotipos muy similares a la narcolepsia en humanos [18-20]. La orexina, además, es prácticamente indetectable en el líquido cefalorraquídeo del 90% de individuos con cataplejía y los análisis post mortem de pacientes narcolépticos revelan una pérdida específica de neuronas orexinérgicas en el cerebro [17,21,22]. De hecho, presentar bajos niveles de orexina A es uno de los criterios que se utiliza en la actualidad para el diagnóstico de la narcolepsia [23]. No se conoce la causa de esta pérdida selectiva de neuronas orexinérgicas, aunque se ha sugerido que los responsables podrían ser determinados mecanismos inmunológicos [24]. En concreto, se ha propuesto que estaría asociada a antígenos del sistema mayor de histocompatibilidad (HLA) en leucocitos y de receptores de células-T (TCR), de manera que un proceso autoinmune se produciría en células orexinérgicas mediante interacciones en vías específicas HLA-péptido-TCR [10,25,26]. En cualquier caso, dado que en la narcolepsia existe una deficiencia de orexina, una terapia sustitutiva mediante agonistas de los receptores orexinérgicos podría ser un tratamiento adecuado [22]. Los estudios en animales parecen avalar esta propuesta, ya que la administración de orexina A reduce los síntomas de narcolepsia observados en ratones transgénicos orexin/ataxin-3 [5,27]. Hasta la fecha, no se dispone de fármacos agonistas de receptores orexinérgicos que atraviesen la barrera hematoencefálica y que se puedan utilizar en una enfermedad para la que, como se ha comentado, sólo existen tratamientos sintomáticos pero se confía en que la investigación en modelos experimentales animales permitirá avanzar en el desarrollo de fármacos eficaces en el tratamiento de la narcolepsia humana. Orexina y obesidad El HL se ha considerado tradicionalmente una región crítica en la conducta alimentaria [28]. Por ello, el hecho de que las neuronas orexinérgicas se concentren en el HL llevó desde un principio a relacionar a este neuropéptido con la ingesta de alimentos (orexis significa ‘apetito’ en griego) [1,2]. En www.neurologia.com Rev Neurol 2014; 58 (3): 117-124 efecto, se ha comprobado que la administración intracerebroventricular de orexina estimula la ingesta de alimentos en animales saciados entre 1 y 4 horas después de su administración, pero es mayor el efecto con la orexina A que con la orexina B [2,29]. Las principales aferencias de las neuronas orexinérgicas del LH se originan en regiones troncoencefálicas implicadas en el procesamiento de señales autonómicas y viscerales [14]. Condiciones hipoglucémicas o un período de ayuno de 48 horas provocan un aumento de la preproorexina en el hipotálamo de animales privados [2]. Además, la ablación genética de neuronas orexinérgicas o la administración de SB-334867-A, un antagonista selectivo de los receptores OX1R, produce hipofagia y alteraciones en el peso corporal [19,30,31]. Curiosamente, se ha observado obesidad a pesar de la hipofagia tanto en pacientes narcolépticos como en ratones con deficiencia crónica de orexinas probablemente como efecto de una reducción en la tasa metabólica o en la actividad locomotora [19,32]. El aumento de la ingesta provocado por la administración de orexina es bloqueado tanto por el SB-334867-A como por un antagonista de los receptores Y1 de NPY, hecho que relaciona el sistema de orexina con las redes hipotalámicas que regulan la conducta nutritiva [5,33,34]. Las neuronas orexinérgicas son inhibidas por la glucosa y la leptina, importantes señales metabólicas implicadas en nutrición [5]. En definitiva, las neuronas de orexina A podrían integrar señales centrales y periféricas (neurales y humorales) necesarias para la nutrición y el equilibrio energético [6,29]. Sin embargo, y dado que la orexina intracerebroventricular produce hiperactividad [35] y que los ratones transgénicos orexin/ataxin-3 reducen la actividad anticipatoria ante la provisión de comida [36], algunos autores consideran que, con respecto a la ingesta, la orexina desempeñaría un papel mucho más amplio y relacionado con procesos de activación y motivación [5,6,37]. Según esta interpretación, las neuronas orexinérgicas serían reguladas por señales indicativas del estado nutricional del organismo de manera que, ante un balance energético negativo, la orexina actuaría incrementando los niveles de alerta en un animal hambriento y reforzando las vías de búsqueda de alimento e ingesta [5,37]. De ser esto cierto, podría explicar por qué las dietas restrictivas no tienen en ocasiones éxito en el tratamiento de la obesidad [11]. No obstante, un papel específico de este neuropéptido en la ingesta de comida no puede descartarse puesto que el SB-334867-A reduce tanto la hiperfagia como los cambios conductuales relacio- 119 C. Mediavilla, et al Figura 2. Ingesta de sacarina 50 minutos después de la administración intraperitoneal de SB-334867-A. a p < 0,05. Ingesta de sacarina (mL) 15 a a 10 5 0 Salino Vehículo SB-334867 nados exclusivamente con los mecanismos de saciedad que origina la orexina [33]. En el mismo sentido, la orexina A administrada en el núcleo accumbens (NAc), una región esencial en los circuitos de recompensa cerebrales, incrementa la ingesta de comida y la locomoción, pero la administración previa del SB-334867-A en NAc solamente atenúa el aumento de la ingesta e indica de nuevo que la orexina puede tener diferentes funciones al actuar sobre distintos receptores [38]. Es más, se ha propuesto una dicotomía entre la orexina que se origina en las neuronas de zonas perifornicales y del hipotálamo dorsomedial (PFA/DMH) y la orexina que se produce en el HL, así la primera está relacionada con los procesos homeostáticos que ponen en marcha mecanismos de activación y estrés, mientras que la segunda intervendría en nutrición y en mecanismos de búsqueda de recompensa [39,40]. Neuronas orexinérgicas del HL mandan proyecciones excitadoras al ATV, parte integrante también del sistema de recompensa cerebral, de manera que la orexina podría regular aspectos emocionales y motivacionales de la ingesta al interactuar con el sistema mesolímbico dopaminérgico [41,42]. Por ejemplo, se ha comprobado que la autoadministración de reforzadores positivos como alimentos grasos y sabrosos (chocolate) potencia de manera selectiva la plasticidad de los receptores NMDA mediada por la orexina A en el ATV y que ratas tratadas con SB-334867-A reducen la motivación por conseguir esa misma comida sabrosa [43]. La orexina parece promover también el consumo de sabores dulces como soluciones de sacarina, consumo que, a su vez, incrementa los niveles de ARNm de orexina y NPY [44]. Por el contrario, la ingesta de sacarina se redu- 120 ce cuando se administra previamente SB-334867-A [45] (Fig. 2). Así, un circuito anatómico constituido por NAc, neuronas orexinérgicas de HL y ATV podría estar relacionado con los aspectos de recompensa de la ingesta de alimentos especialmente sabrosos o dulces [46]. Es más, se ha comprobado que el grado de activación de las neuronas orexinérgicas del HL correlaciona con la preferencia desarrollada por un lugar –conditioned place preference (CPP)– asociado con reforzadores positivos como la comida relacionando así el sistema orexinérgico con mecanismos de aprendizaje [41]. Por tanto, las neuronas orexinérgicas podrían activarse en respuesta a la comida como estímulo condicionado y contribuir de ese modo a una sobrealimentación aprendida (condicionada) y, en último término, a la obesidad [24]. En tal contexto, no sería extraño proponer un papel de la orexina A en los aprendizajes gustativos, es decir, en las preferencias o aversiones que desarrollamos por ciertas comidas a lo largo de nuestra vida mediante la asociación de determinados sabores con las consecuencias experimentadas tras su ingesta. Así, el aprendizaje aversivo gustativo se manifiesta en la tendencia a rechazar comidas que se han asociado previamente a malestar visceral, mientras que el aprendizaje de preferencias gusta­ tivas es el mecanismo mediante el cual los organismos aprenden a preferir un sabor que se ha aso­ ciado con consecuencias positivas (orales o visce­ rales) tras la ingestión. En las sociedades desarrolladas, estas aversiones y preferencias gustativas aprendidas provocan que, en ocasiones, las señales hedónicas de los alimentos prevalezcan sobre sus características nutricionales. En este caso, la dieta no sólo no tiene como objetivo satisfacer nuestras necesidades metabólicas sino que puede contribuir a la aparición de enfermedades como la obesidad [47,48]. Pues bien, recientemente se ha observado que la administración intracerebroventricular de SB-334867-A impide de manera específica el aprendizaje de preferencias gustativas inducido por la sacarina [49]. Es posible, por lo tanto, que la orexina endógena y señales gustativas y viscerales converjan en centros cerebrales relevantes no sólo para la ingesta de comida sino también para el establecimiento de determinados aprendizajes gustativos. El sistema orexinérgico se convertiría así en una señal que reforzaría la asociación entre dichos estímulos, asociación necesaria para que se desarrollen estos aprendizajes. En definitiva, las neuronas orexinérgicas actúan no sólo como sensores de las necesidades metabólicas del organismo, sino también en respuesta a estímulos asociados con la comida, de manera que pue- www.neurologia.com Rev Neurol 2014; 58 (3): 117-124 Orexina: implicaciones clínicas y terapéuticas de modificar la actividad del sistema de recompensa y contribuir, por ejemplo, a la hiperfagia asociada a la obesidad [46,50]. De confirmarse estos datos, existiría la posibilidad de desarrollar fármacos agonistas y antagonistas de los receptores orexinérgicos adecuados para el tratamiento de las alteraciones metabólicas y de los trastornos de la alimentación, como la bulimia o la obesidad [6,32,46,51]. Figura 3. Esquema de un corte sagital medial del encéfalo de rata que representa las conexiones existentes entre las neuronas orexinérgicas del hipotálamo lateral (HL) y el sistema mesocorticolímbico dopaminérgico. Las proyecciones orexinérgicas (líneas rojas) finalizan en el área tegmental ventral (ATV), la amígdala (A), el núcleo accumbens (NAc) y el córtex prefrontal (PFC). La activación del ATV producida por la orexina provoca un incremento de dopamina (líneas azules) en el NAc y en el PFC (adaptado de [53]). H: hipocampo; CS: colículo superior; CI: colículo inferior. Orexina y drogadicción Como ya se ha indicado antes, las neuronas orexinérgicas del HL se relacionan anatómicamente con regiones como el NAc y el ATV, que forman parte de los sistemas de recompensa cerebrales repeti­ damente relacionados con la adicción a drogas de abuso [52] (Fig. 3). Estas conexiones anatómicas determinaron el estudio del sistema orexinérgico en relación con mecanismos de recompensa y drogadicción y se comprobó así que las neuronas orexinérgicas del HL se activan por estímulos que predicen recompensa mediada tanto por comida como por drogas de abuso y pueden ser relevantes en la dependencia de drogas como morfina, heroína o cocaína [40,42,46,53]. Georgescu et al [54] fueron los primeros en relacionar el sistema orexinérgico con la dependencia a la morfina y, con posterioridad, Harris et al [41] comprobaron que los animales que desarrollaban preferencias por lugares (CPP) asociados a morfina, cocaína y comida incrementaban la activación de cFos (un factor de transcripción que correlaciona con la actividad neural) específicamente en neuronas orexinérgicas del HL; que la administración de SB-334867-A reducía el CPP por morfina, y que la activación química de neuronas orexinérgicas del HL o la administración de orexina A en ATV reinstauraba una preferencia por el lugar asociado a la morfina que ya había sido extinguida. En el mismo sentido, otros estudios han puesto de manifiesto que las lesiones bilaterales de las neuronas orexinérgicas del HL impiden el CPP [55] y que la introducción del antagonista orexinérgico SB-334867-A reduce la autoadministración de heroína y de alcohol en ratas [56,57]. Recientemente, la utilización de un nuevo antagonista de los receptores OX1R, el GSK1059865, con una alta selectividad por estos receptores, ha relacionado de nuevo a estos receptores con procesos de recompensa [7]. El sistema orexinérgico también se ha relacionado con los cambios neuroadaptativos producidos por el consumo de drogas. Así, Borgland et al [58] demostraron que, tras la administración in vitro de orexi­ na A, se observan nuevos receptores de NMDA en www.neurologia.com Rev Neurol 2014; 58 (3): 117-124 PFC CS H Bulbo olfatorio CI Cerebelo NAc ATV A Quiasma óptico HL Protuberancia células dopaminérgicas de ATV, un mecanismo relacionado con el desarrollo de conductas adictivas. Comprobaron asimismo que la administración intraperitoneal o en ATV de SB-334867-A impedía la plasticidad neural asociada tanto a los cambios conductuales (sensibilización locomotora) como a los cambios neurofisiológicos indicativos de adicción [58]. La orexina, además, podría ser relevante para explicar la recaída que se observa con frecuencia en drogodependientes tras un período de abstinencia, ya que la estimulación exógena de las neuronas orexinérgicas en animales restituye el comportamiento previamente extinguido de búsqueda de la droga [41,59]. La administración de SB-334867-A impide esa recuperación de búsqueda de la droga ante la presencia de estímulos o contextos que fueron asociados a cocaína o heroína, pero no afecta a la recaída inducida por la droga misma [24,57]. Sin embargo, al igual que en el caso de la nutrición, la interpretación de la relación de la orexina con las adicciones no es unánime, ya que algunos autores consideran que, dado que la intoxicación crónica con drogas de abuso produce un cambio en la prioridad de las necesidades básicas, las neuronas orexinérgicas actuarían aumentando los niveles de alerta y de estrés para dirigir la atención y la conducta hacia objetivos más acordes con las nuevas prioridades [37,59]. Con independencia de que se asigne un papel más general o específico del sistema orexinérgico en relación con las conductas adictivas, hay acuerdo en considerar a los recepto- 121 C. Mediavilla, et al res OX1R como potencial diana farmacológica para el tratamiento de la recaída en la adicción por alcohol, morfina o nicotina [37,57]. Conclusiones Han pasado relativamente pocos años desde la identificación de la orexina, a pesar de ello y como hemos visto, son numerosos los estudios que han intentado establecer con claridad las funciones de unas neuronas que ocupan una posición estratégica para la comunicación entre núcleos troncoencefálicos, que controlan mecanismos homeostáticos y áreas corticales y límbicas relacionadas con procesos motivacionales. Así, la orexina, fundamentalmente a través de los receptores OX2R [6,8], tiene un papel primordial en los sistemas de activación, vigilia y actividad locomotora dentro del ciclo sueño-vigilia. La alteración de este sistema estaría en la base de un trastorno del sueño como la narcolepsia. La orexina también ha sido implicada en la ingesta, tanto homeostática como relacionada con procesos de recompensa, a través de receptores OX1R situados en regiones como NAc o ATV. El sistema orexinérgico, por último, interviene también en el establecimiento de asociaciones entre recompensas (naturales como la comida o drogas de abuso) y estímulos relevantes que permiten aprendizajes como el CPP o las preferencias gustativas. La orexina podría así modificar la actividad de los sistemas de recompensa y contribuir de este modo a la obesidad y a la drogadicción. Técnicas novedosas como la optogenética [34] ayudarán a conocer el funcionamiento de las neuronas orexinérgicas y permitirán entender cómo interactúan los sistemas que regulan la emoción, la homeostasis energética y los mecanismos de recompensa con los sistemas que regulan el ciclo de sueño-vigilia [60]. La relación entre el sistema orexinérgico y el sistema límbico podría explicar, por ejemplo, por qué emociones fuertes y positivas como la risa pueden desencadenar un ataque de cataplejía en pacientes con narcolepsia. Mientras tanto, numerosos laboratorios están trabajando en el estudio y desarrollo de fármacos con actividad orexinérgica susceptibles de ser utilizados en aquellos trastornos en los que se sospeche un mal funcionamiento del sistema orexinérgico. Por ejemplo, antagonistas duales (que bloquean tanto el OX1R como el OX2R) de los receptores orexinérgicos, co­ mo almorexant y MK-4305, podrían ser eficaces en el tratamiento del insomnio, tanto en animales como en humanos, y con menores efectos secundarios que los fármacos convencionales [6]. Atendiendo a 122 los resultados en la investigación con animales, antagonistas selectivos de los receptores OX1R como el SB-334867-A o el GSK1059865, podrían ayudar a mantener la abstinencia y reducir las recaídas en procesos adictivos y aumentar la saciedad y la pérdida de peso en el tratamiento de la obesidad. Bibliografía 1. De Lecea L, Kilduff TS, Peyron C, Gao X, Foye PE, Danielson PE, et al. The hypocretins: hypothalamus-specific peptides with neuroexcitatory activity. Proc Natl Acad Sci U S A 1998; 95: 322-7. 2. Sakurai T, Amemiya A, Ishii M, Matsuzaki I, Chemelli RM, Tanaka H, et al. Orexins and orexin receptors: a family of hypothalamic neuropeptides and G protein-coupled receptors that regulate feeding behaviour. Cell 1998; 92: 573-85. 3. Peyron C, Tighe DK, Van den Pol AN, De Lecea L, Heller HC, Sutcliff JG, et al. Neurons containing hypocretin (orexin) project to multiple neuronal systems. J Neurosci 1998; 18: 9996-10015. 4. Nambu T, Sakurai T, Mizukami K, Hosoya Y, Yanagisawa M, Goto K. Distribution of orexin neurons in the adult rat brain. Brain Res 1999; 827: 243-60. 5. Tsujino N, Sakurai T. Role of orexin in modulating arousal, feeding, and motivation. Front Behav Neurosci 2013; 7: 28. 6. Scammell TE, Winrow CJ. Orexin receptors: pharmacology and therapeutic opportunities. Annu Rev Pharmacol Toxicol 2011; 51: 243-66. 7. Gozzi A, Turrini G, Piccoli L, Massagrande M, Amantini D, Antolini M, et al. Functional magnetic resonance imaging reveals different neural substrates for the effects of orexin-1 and orexin-2 receptor antagonist. PLoS One 2011; 6: e16406. 8. Marcus JN, Aschkenasi CJ, Lee CE, Chemelli RM, Saper CB, Yanagisawa M, et al. Differential expression of orexin receptors 1 and 2 in the rat brain. J Comp Neurol 2001; 435: 6-25. 9. Alexandre C, Andermann ML, Scammell TE. Control of arousal by the orexin neurons. Curr Opin Neurobiol 2013; 23: 752-9. 10. Del Cid-Pellitero E, Garzón M. El sistema de neurotransmisión hipocretinérgico/orexinérgico en la regulación de los estados de vigilia y sueño. Rev Neurol 2007; 45: 482-90. 11. Sakurai T. The neural circuits of orexin (hypocretin): maintaining sleep and wakefulness. Nature Rev Neurosci 2007; 8: 171-81. 12. Estabrooke IV, McCarthy MT, Ko E, Chou TC, Chemelli RM, Yanagisawa M, et al. Fos expression in orexin neurons varies with behavioural state. J Neurosci 2001; 21: 1656-62. 13. Tsunematsu T, Tabuchi S, Tanaka KF, Boyden E, Tominaga M, Yamanaka A. Long-lasting silencing of orexin/hypocretin neurons using archaerhodopsin induces slow-wave sleep in mice. Behav Brain Res 2013; May 21. [Epub ahead of print]. 14. Yoshida K, McCormack S, España RA, Crocker A, Scammell TE. Afferents to the orexin neurons of the rat brain. J Comp Neurol 2006; 494: 845-61. 15. Saper CB, Chou TC, Scammell TE. The sleep switch: hypothalamic control of sleep and wakefulness. Trends Neurosci 2001; 24: 726-31. 16. De Vicente Álvarez-Manzanera EE. Avances en el diagnóstico y tratamiento del síndrome de narcolepsia-cataplejía. Rev Neurol 2008; 46: 550-6. 17. Santamaría-Cano J. Actualización diagnóstica y terapéutica en narcolepsia. Rev Neurol 2012; 54 (Supl 3): S25-30. 18. Chemelli RM, Willie JT, Sinton CM, Elmquist JK, Scammell T, Lee C, et al. Narcolepsy in orexin knockout mice: molecular genetics of sleep regulation. Cell 1999; 98: 437-51. 19. Hara J, Beuckmann CT, Nambu T, Willie JT, Chemelli RM, Sinton CM, et al. Genetic ablation of orexin neurons in mice results in narcolepsy, hypophagia, and obesity. Neuron 2001; 30: 345-54. www.neurologia.com Rev Neurol 2014; 58 (3): 117-124 Orexina: implicaciones clínicas y terapéuticas 20. Lin L, Faraco J, Li R, Kadotani H, Rogers W, Lin X, et al. The sleep disorder canine narcolepsy is caused by a mutation in the hypocretin (orexin) receptor 2 gene. Cell 1999; 98: 365-76. 21. Nishino S, Ripley B, Overeem S, Lammers GJ, Mignot E. Hypocretin (orexin) deficiency in human narcolepsy. Lancet 2000; 355: 39-40. 22. Peyron C, Faraco, J, Rogers W. Ripley B, Overeem S, Charnay Y, et al. A mutation in a case of early onset narcolepsy and a generalized absence of hypocretin peptides in human narcoleptic brains. Nat Med 2000; 6: 991-97. 23. American Academy of Sleep Medicine, Diagnostic Classification Steering Committee. The International Classification of Sleep Disorders, 2nd edition revised (ICSD). Westchester, IL: American Academy of Sleep Medicine; 2005. 24. Aston-Jones G, Smith RJ, Sartor GC, Moorman DE, Massi L, Tahsili-Fahadan P, et al. Lateral hypothalamic orexin/hypocretin neurons: a role in reward-seeking and addiction. Brain Res 2010; 1314: 74-90. 25. Kornum BR, Faraco J, Mignot E. Narcolepsy with hypocretin/ orexin deficiency, infections and autoimmunity of the brain. Curr Opin Neurobiol 2011; 21: 897-903. 26. Sakurai T. Orexin deficiency and narcolepsy. Curr Opin Neurobiol 2013; 23: 760-6. 27. Mieda M, Willie JT, Hara J, Sinton CM, Sakurai T, Yanagisawa M. Orexin peptides prevent cataplexy and improve wakefulness in an orexin neuron-ablated model of narcolepsy in mice. Proc Natl Acad Sci U S A 2004; 101: 4649-54. 28. Bernardis LL, Bellinger LL. The lateral hypothalamic area revisited: ingestive behaviour. Neurosci Biobehav Rev 1996; 20: 189-287. 29. Haynes A, Jackson B, Overend P, Buckingham RE, Wilson S, Tadayyon M, et al. Effects of single and chronic intracerebroventricular administration of the orexin on feeding in the rat. Peptides 1999; 20: 1099-105. 30. Ishii Y, Blundell JE, Halford JCG, Upton N, Porter R, Johns A, et al. Differential effects of the selective orexin-1 receptor antagonist SB-334867 and lithium chloride on the behavioural satiety sequence in rats. Physiol Behav 2004; 81: 129-40. 31. Ishii Y, Blundell JE, Halford JCG, Upton N, Porter R, Johns A, et al. Anorexia and weight loss in male rats 24 h following single dose treatment with orexin-1 receptor antagonist SB-334867. Behav Brain Res 2005; 157: 331-41. 32. Sakurai T. Orexin system and feeding behaviour. In Nishino S, Sakurai T, eds. The orexin/hypocretin system. Physiology and pathophysiology. Totowa, NJ: Humana Press; 2006. p. 99-106. 33. Rodgers RJ, Halford JCG, Nunes de Souza RL, Canto de Souza AL, Piper DC, Arch JRS, et al. SB-334867, a selective orexin-1 receptor antagonist, enhances behavioural satiety and blocks the hyperphagic effect of orexin-A in rats. Eur J Neurosci 2001; 13: 1444-52. 34. Yamanaka A, Tsunematsu T. New approaches for the study of orexin function. J Neuroendocrinol 2010; 22: 818-24. 35. Nakamura T, Uramura K, Nambu T, Yada T, Goto K, Yanagisaka M, et al. Orexin-induced hyperlocomotion and stereotypy are mediated by the dopaminergic system. Brain Res 2000; 873: 181-7. 36. Mieda M, Williams SC, Sinton CM, Richardson JA, Sakurai T, Yanagisawa M. Orexin neurons function in an efferent pathway of a food-entrainable circadian oscillator in eliciting foodanticipatory activity and wakefulness. J Neurosci 2004; 24: 10493-501. 37. Boutrel B, Cannella N, De Lecea L. The role of hypocretin in driving arousal and goal-oriented behaviours. Brain Res 2010; 1314: 103-11. 38. Thorpe AJ, Kotz CM. Orexin A in the nucleus accumbens stimulates feeding and locomotor activity. Brain Res 2005; 1050: 156-62. 39. Boutrel B, De Lecea L. Addiction and arousal: the hypocretin connection. Physiol Behav 2008; 93: 947-51. www.neurologia.com Rev Neurol 2014; 58 (3): 117-124 40. Harris GC, Aston-Jones G. Arousal and reward: a dichotomy in orexin function. Trends Neurosci 2006; 29: 571-7. 41. Harris GC, Wimmer M, Aston-Jones G. A role for lateral hypothalamic orexin neurons in reward seeking. Nature 2005; 437: 556-9. 42. Narita M, Nagumo Y, Hashimoto S, Narita M, Khotib J, Miyatake M, et al. Direct involvement of orexinergic systems in the activation of the mesolimbic dopamine pathway and related behaviours induced by morphine. J Neurosci 2006; 26: 398-405. 43. Borgland S, Chang SJ, Scott Bowers M, Thompson JL, Vittoz N, Floresco SB, et al. Orexin/Hypocretin-1 selectively promotes motivation for positive reinforcers. J Neurosci 2009; 29: 11215-25. 44. Furudono Y, Ando C, Yamamoto C, Kobashi M, Yamamoto T. Involvement of specific orexigenic neuropeptides in sweetenerinduced overconsumption in rats. Behav Brain Res 2006; 175: 241-8. 45. Risco S, Mediavilla C. Effects of the selective orexin-1 receptor antagonist SB-334867-A on feeding and drinking behaviours and taste aversion learning. Behav Pharmacol 2009; 20: S95. 46. Cason AM, Smith RJ, Tahsli-Fahadan P, Moorman DE, Sartor GC, Aston-Jones G. Role of orexin/hypocretin in reward-seeking and addiction: implications for obesity. Physiol Behav 2010; 100: 419-28. 47. Berthoud H. Metabolic and hedonic drives in the neural control of appetite: who is the boss? Curr Opin Neurobiol 2011; 21: 888-96. 48. Cooper SJ. Pharmacology of food, taste, and learned flavour preferences. In Kirkhan TC, Cooper SJ, eds. Appetite and body weight. Integration system and the development of antiobesity drugs. Burlington, MA: Academic Press; 2007. p. 217-45. 49. Mediavilla C, Cabello V, Risco S. SB-334867-A, a selective orexin-1 receptor antagonist, enhances taste aversion learning and blocks taste preference learning in rats. Pharmacol Biochem Behav 2011; 98: 385-91. 50. Kenny PJ. Reward mechanisms in obesity: new insights and future directions. Neuron 2011; 69: 664-79. 51. Tsujino N, Sakurai T. Orexin/hypocretin: a neuropeptide at the interface of sleep, energy homeostasis, and reward system. Pharmacol Rev 2009; 61: 162-76. 52. Wise RA. Brain reward circuitry: insights from unsensed incentives. Neuron 2002; 36: 229-40. 53. Sharf R, Sarhan M, Dileone RJ. Role of orexin/hypocretin in dependence and addiction. Brain Res 2010; 1314: 130-8. 54. Georgescu D, Zachariou V, Barrot M, Mieda M., Willie JT, Eisch AJ, et al. Involvement of the lateral hypothalamic peptide orexin in morphine dependence and withdrawal. J Neurosci 2003; 23: 3106-11. 55. Harris GC, Wimmer M, Randall-Thompson JF, Aston-Jones G. Lateral hypothalamic orexin neurons are critically involved in learning to associate an environment with morphine reward. Behav Brain Res 2007; 176: 251-8. 56. Jupp B, Krivdic B, Krstew E, Lawrence AJ. The orexin1 receptor antagonist SB-334867 dissociates the motivational properties of alcohol and sucrose in rats. Brain Res 2011; 1391: 54-9. 57. Smith RJ, Aston-Jones G. Orexin/hypocretin 1 receptor antagonist reduces heroin self-administration and cue-induced heroin seeking. Eur J Neurosci 2012; 35: 798-804. 58. Borgland SL, Taha SA, Sarti F, Fields HL, Bonci A. Orexin A in the VTA is critical for the induction of synaptic plasticity and behavioural sensitization to cocaine. Neuron 2006; 49: 589-601. 59. Boutrel B, Kenny PJ, Specio SE, Martin-Fardon R, Markou A, Koob GF, et al. Role for hypocretin in mediating stress-induced reinstatement of cocaine-seeking behaviour. Proc Natl Acad Sci U S A 2005; 102: 19168-73. 60. Saderi N, Escobar C, Salgado-Delgado R. La alteración de los ritmos biológicos causa enfermedades metabólicas y obesidad. Rev Neurol 2013; 57: 71-8. 123 C. Mediavilla, et al Orexin: clinical and therapeutic implications Introduction. Recent research has reported the existence of a new class of neuropeptides, called orexins or hypocretins, which are produced by a small group of neurons in the hypothalamus and whose actions are mediated by two types of receptors: OX1R and OX2R. More specifically, the orexinergic neurons have been located exclusively in cells in the lateral, dorsomedial and perifornical areas of the hypothalamus. Despite this highly specific anatomical origin, the orexinergic neurons are projected widely into a number of brainstem, cortical and limbic regions. Development. This fuzzy pattern of distribution of the orexinergic fibres would be indicating the involvement of this peptidic system in a wide range of functions; indeed, it has been related with the mechanisms that enable regulation of the sleep-wake cycle, the ingestion of food and drink, and some particular types of learning, such as learning certain preferences regarding tastes. It has also been suggested that upsets in the functioning of the orexinergic system would explain the appearance of certain clinical disorders like narcolepsy, obesity or addiction to drug of abuse. Conclusions. Further research will help to determine the functioning of orexinergic neurons and the interaction between the systems that regulate emotion, energetic homeostasis and the reward mechanisms, on the one hand, and the systems that regulate the sleep-wake cycle on the other. That knowledge would almost certainly make it possible to develop new drugs that, by acting upon the orexinergic system, would be effective in the treatment of sleep disorders such as insomnia or narcolepsy, eating disorders or drug addiction. Key words. Drug addiction. Lateral hypothalamus. Narcolepsy. Obesity. Orexin. OX1R and OX2R receptors. 124 www.neurologia.com Rev Neurol 2014; 58 (3): 117-124