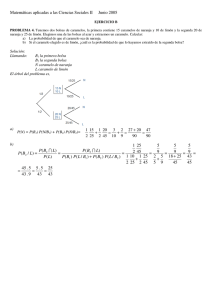
2. revisión bibliográfica - Repositorio Digital UTE
Anuncio

UNIVERSIDAD TECNOLÓGICA EQUINOCCIAL FACULTAD DE CIENCIAS DE LA INGENIERÍA CARRERA DE INGENIERÍA DE ALIMENTOS DETERMINACIÓN DE CURVAS DE CALENTAMIENTO Y PUNTOS CRÍTICOS DE COCCIÓN DE DIFERENTES TIPOS DE JARABES PARA LA ELABORACIÓN DE CARAMELOS DUROS, SUAVES Y GOMAS EN LA PLANTA PILOTO DE ALIMENTOS DE LA UNIVERSIDAD TECNOLÓGICA EQUINOCCIAL TRABAJO PREVIO A LA OBTENCIÓN DEL TÍTULO DE INGENIERO DE ALIMENTOS RENATO DAVID GRIJALVA CALVACHI DIRECTORA: ING. YOLANDA ARGUELLO Quito, Abril 2012 © Universidad Tecnológica Equinoccial. 2012 Reservados todos los derechos de reproducción DECLARACIÓN Yo RENATO DAVID GRIJALVA CALVACHI, declaro que el trabajo aquí descrito es de mi autoría; que no ha sido previamente presentado para ningún grado o calificación profesional; y, que he consultado las referencias bibliográficas que se incluyen en este documento. La Universidad Tecnológica Equinoccial puede hacer uso de los derechos correspondientes a este trabajo, según lo establecido por la Ley de Propiedad Intelectual, por su Reglamento y por la normativa institucional vigente. _________________________ Renato David Grijalva Calvachi C.I. 1720994704 CERTIFICACIÓN Certifico que el presente trabajo que lleva por título “Determinación de curvas de calentamiento y puntos críticos de cocción de diferentes tipos de jarabes para la elaboración de caramelos duros, suaves y gomas en la Planta Piloto de Alimentos de la Universidad Tecnológica Equinoccial”, que, para aspirar al título de Ingeniero/a de Alimentos fue desarrollado por Renato David Grijalva Calvachi, bajo mi dirección y supervisión, en la Facultad de Ciencias de la Ingeniería; y cumple con las condiciones requeridas para su aceptación como Trabajo de Titulación. _____________________________ Ing. Yolanda Arguello DIRECTORA DEL TRABAJO C.I.1801626464 ÍNDICE DE CONTENIDOS PÁGINA RESUMEN x ABSTRACT xi 1. INTRODUCCIÓN 1 2. REVISIÓN BIBLIOGRÁFICA 3 2.1. HIDRATOS DE CARBONO 3 2.1.1. SACAROSA 5 2.1.2. GLUCOSA 6 2.2. SOLUBILIDAD DEL AZÚCAR 7 2.3. EFECTO DE LA SACAROSA SOBRE EL PUNTO DE EBULLICIÓN DEL AGUA 9 2.4. FUSIÓN Y PUNTO DE CARAMELO DEL AZÚCAR 10 2.5. JARABE 12 2.5.1. PROCEDIMIENTO PARA OBTENER LAS PROPIEDADES FÍSICAS DEL JARABE 12 2.5.2. GRADOS BEAUMÉ 13 2.5.3. GRADOS BRIX 13 2.5.4. RELACIÓN ENTRE GRADOS BRIX Y BEAUMÉ 14 2.5.5. ACTIVIDAD DE AGUA 14 2.5.6. HUMEDAD RELATIVA DE EQUILIBRIO 15 2.5.7. EQUIVALENTE DE DEXTROSA 17 2.5.8. PUNTO CRÍTICO DE CONTROL: TEMPERATURA 17 2.5.9. COMPORTAMIENTO DE LA SACAROSA ANTE EL CALOR 18 2.5.10. AZÚCAR INVERTIDO 19 2.5.11. RECRISTALIZACIÓN 20 v PÁGINA 2.5.12. TIPOS DE JARABES EN RELACIÓN A LOS GRADOS BEAUMÉ 20 2.5.13. FASES DEL JARABE SEGÚN LA TEMPERATURA Y BRIX 2.6. CONDICIONES CLIMÁTICAS- CLIMA 2.7. 2.8. 22 26 2.6.1. ELEMENTOS DEL CLIMA 27 2.6.2. FACTORES QUE MODIFICAN EL CLIMA 28 2.6.3. ALTITUD DE LA PLANTA PILOTO UTE 28 PROPIEDADES DE LAS SOLUCIONES 29 2.7.1. PRESIÓN DE VAPOR 29 2.7.2. LEY DE RAOULT 30 2.7.3. ELEVACIÓN DEL PUNTO DE EBULLICIÓN 30 CARAMELO 32 2.8.1. DEFINICIÓN DE NORMA INEN 32 2.8.2. CLASIFICACIÓN POR SU FORMA 32 2.8.3. FUNCIÓN DE MATERIAS PRIMAS EN LA ELABORACIÓN DE CARAMELOS 2.9. 33 CARAMELO DURO 36 2.9.1. CARACTERÍSTICAS 37 2.9.2. DEFINICIÓN DE NORMA INEN 37 2.9.3. REQUISITOS ESPECÍFICOS 37 2.9.4. REQUISITOS TÉCNICOS 37 2.9.5. CARACTERÍSTICAS DE LA SACAROSA PARA CARAMELO DURO 2.9.6. TEMPERATURA VÍTREO DE TRANSICIÓN 2.10. CARAMELO KRAMEL 38 38 39 2.10.1. REQUISITOS ESPECÍFICOS 39 2.10.2. PUNTOS CRÍTICOS DE CONTROL 40 2.10.3. REQUISITOS TÉCNICOS 40 2.10.4. REACCIÓN DE MAILLARD 41 vi PÁGINA 2.11. TOFFEE DE VAINILLA 43 2.11.1. REQUISITOS ESPECÍFICOS 43 2.11.2. PUNTOS CRÍTICOS DE CONTROL 44 2.11.3. REQUISITOS TÉCNICOS 45 2.12. MASMELO- MASMALLOWS 45 2.12.1. REQUISITOS ESPECÍFICOS 45 2.12.2. PUNTOS CRÍTICOS DE CONTROL 46 2.12.3. REQUISITOS TÉCNICOS 46 2.13. GOMAS 47 2.13.1. REQUISITOS ESPECÍFICOS 47 2.13.2. PUNTOS CRÍTICOS DE CONTROL 48 2.13.3. REQUISITOS TÉCNICOS 48 3. METODOLOGÍA 3.1. FORMULACIONES EXPERIMENTALES 3.2. DETERMINACIÓN DE RANGOS DE TEMPERATURA DE 49 49 PROCESO A 2944 m.s.n.m. 50 3.3. PROCEDIMIENTO DE EXPERIMENTACIÓN 50 3.4. OBTENCIÓN DE DATOS EXPERIMENTALES 54 3.4.1. OBTENCIÓN DE TEMPERATURAS DEL JARABE 54 3.4.2. OBTENCIÓN DE DATOS DE S. SOLUBLES 54 3.4.3. DETERMINACIÓN DE ACTIVIDADES DE AGUA DE JARABES DE PROCESO 54 3.5. OBTENCIÓN DE GRÁFICAS EXPERIMENTALES Y ECUACIONES DE CALENTAMIENTO 55 3.6. DETERMINACIÓN DE DATOS MEDIANTE LA TENDENCIA DE LA CURVA 55 3.7. ANÁLISIS DE HUMEDAD 55 3.8. PROCESAMIENTO ESTADÍSTICO DE DATOS 55 vii PÁGINA 4. RESULTADOS Y DISCUSIÓN 57 4.1. RANGOS DE TEMPERATURAS EXPERIMENTALES A 2944 m.s.n.m. 4.2. DATOS EXPERIMENTALES 57 58 4.3. GRÁFICAS EXPERIMENTALES Y ECUACIONES DE EVAPORACIÓN DE JARABES A 2944 msnm 60 4.3.1. CARAMELOS DUROS 60 4.3.2. CARAMELO KRAMEL 65 4.3.3. CARAMELO TOFFEE DE VAINILLA 70 4.3.4. MASMELOS 72 4.3.5. GOMAS 78 4.4. RESULTADOS DE CALIDAD DE LOS CARAMELOS Y TEMPERATURAS DE PROCESO 5. CONCLUSIONES Y RECOMENDACIONES 80 84 5.1. CONCLUSIONES 84 5.2. RECOMENDACIONES 85 BIBLIOGRAFÍA 86 ANEXOS 91 viii ÍNDICE DE TABLAS PÁGINA Tabla 1. Relación de la temperatura con la sacarosa, fructosa y cloruro de sodio Tabla 2. 8 Puntos de ebullición para soluciones de sacarosa a diferente concentración 10 Tabla 3. Humedad relativa de los caramelos 2200 m.s.n.m. 16 Tabla 4. Grados tradicionales observables durante el calentamiento de los jarabes 26 Tabla 5. Índices físico- químicos del azúcar de caña 33 Tabla 6. Especificaciones físico- químicas de la glucosa utilizada 34 Tabla 7. Requisitos Técnicos Obligatorios para caramelo duro 37 Tabla 8. Requisitos Técnicos Obligatorios para caramelo kramel Tabla 9. 40 Requisitos Técnicos Obligatorios para toffee de vainilla 44 Tabla 10. Requisitos Técnicos Obligatorios para masmelos 46 Tabla 11. Requisitos Técnicos Obligatorios para gomas 48 Tabla 12. Formulación para caramelos duros, blandos y gomas 49 Tabla 13. Rangos de temperatura experimentales a 0 m.s.n.m. y a 2944 m.s.n.m. 57 Tabla 14. Resultados de concentración y actividad de agua en función de la temperatura para cada tipo de caramelo 58 Tabla 15. Temperaturas, sólidos solubles, actividades de agua y humedades de los caramelos tratados experimentales 80 Tabla 16. Variables de la comparación entre formulaciones de caramelo duro 83 Tabla 17. Variables de la comparación entre formulaciones de Masmelo 83 ix ÍNDICE DE FIGURAS PÁGINA Figura 1. Estructura de la sacarosa. 6 Figura 2. Estructura de la glucosa. 7 Figura 3. Jarabe de azúcar y agua sobre los 350°F. 10 Figura 4. Actividad acuosa, estados físicos, reactividad y desarrollo microbiano en dulces. 16 Figura 5. Termómetro para caramelo 18 Figura 6. Comportamiento del jarabe al ser sometido al calor. 18 Figura 7. Texturas del caramelo. 22 Figura 8. Prueba manual de la fase de bola dura. 23 Figura 9. Prueba manual de la fase de lámina quebradiza. 24 Figura 10. Fotografía satelital de la Universidad Tecnológica Equinoccial con coordenadas y latitud msnm. 29 Figura 11. Caramelo duro 36 Figura 12. Caramelo con Reacción de Maillard. 39 Figura 13. Toffee de vainilla. 43 Figura 14. Marshmallow. 45 Figura 15. Gomas comestibles. 47 Figura 16. Curva de calentamiento promedio de la tendencia de la relación temperatura- S. solubles del c. duro Figura 17. Curva de calentamiento promedio de la tendencia de la relación temperatura- Aw del C. duro 1 Figura 18. 62 Curva de calentamiento promedio de la tendencia de la relación T- Aw del caramelo duro 2 Figura 20. 61 Curva de calentamiento promedio de la tendencia de la relación T- S. solubles del C. Duro 2 Figura 19. 60 63 Curva de calentamiento promedio de la tendencia de la relación T- S. solubles del c. duro 3 64 x PÁGINA Figura 21. Curva de calentamiento promedio de la tendencia de la relación T- Aw del caramelo duro 3 Figura 22. Gráfica de la relación temperatura- sólidos solubles de caramelo duro. Figura 23. 77 Curva de calentamiento promedio de la tendencia de la relación T°- sólidos solubles de las gomas Figura 35. 76 Gráfica de la relación T- Aw que muestra las curvas de las medias de los dos tipos de masmelo. Figura 34. 75 Gráfica de la relación T- S. solubles de los dos tipos de masmelo Figura 33. 74 Curva de calentamiento promedio de la relación T- Aw del masmelo sin glucosa Figura 32. 73 Curva de calentamiento promedio de la relación Tsólidos solubles del masmelo sin glucosa Figura 31. 72 Curva de Calentamiento promedio de la relación Temperatura- Aw del masmelo con glucosa Figura 30. 71 Curva de calentamiento promedio de la relación Temperatura- S. solubles del masmelo con glucosa Figura 29. 70 Curva de calentamiento promedio de la tendencia de la relación T- Aw del toffee de vainilla Figura 28. 69 Curva de calentamiento promedio de la tendencia de la relación T- Sólidos solubles del toffee Figura 27. 68 Curva de calentamiento promedio de la tendencia de la relación T- Aw del caramelo kramel Figura 26. 67 Curva de calentamiento promedio de la tendencia de la relación T- S. solubles del c. kramel Figura 25. 66 Gráfica de la relación T- Aw que muestra las curvas de tendencia de los tres tipos de caramelo duro. Figura 24. 65 78 Curva de calentamiento promedio de la relación T°- Aw de gomas 79 xi ÍNDICE DE ANEXOS PÁGINA ANEXO 1. Conversión entre el porcentaje de sacarosa en peso y la densidad evaluados a una temperatura menor o igual a 20°C. 91 ANEXO 2. Equivalencia entre la presión de vapor de agua (mmHg) y la altitud (msnm). 93 ANEXO 3. Equivalencias entre la temperatura de ebullición del agua (°C) y la presión (mmHg). 94 ANEXO 4. Muestras de caramelo duro 1 95 ANEXO 5. Muestras de caramelo duro 2 97 ANEXO 6. Muestras de caramelo duro 3 99 ANEXO 7. Muestras de caramelo Kramel 101 ANEXO 8. Muestras de Toffee 103 ANEXO 9. Muestras de Masmelo con Glucosa 105 Anexo 10. Muestras de Masmelo sin Glucosa 107 Anexo 11. Muestras de Gomas 109 Anexo 12. Manual de Temperaturas Óptimas de cocción de los diferentes tipos de jarabe para la elaboración de caramelos duros, suaves, masmelos y gomas 111 xii RESUMEN El objetivo de este trabajo fue determinar las curvas de evaporación de jarabes para la elaboración de los diferentes tipos de caramelos: duros, blandos, masmelos y gomas desarrollados en la Planta Piloto de Alimentos UTE. La relación entre la altitud barométrica y la temperatura de ebullición del agua permitió definir que por cada 500 pies de altitud se debe restar aproximadamente 1°F. Esto permitió obtener los rangos de temperaturas para la altitud que tiene la Planta de Alimentos UTE. Se realizó la experimentación por triplicado para cada caramelo en donde: se determinó datos de sólidos solubles cada dos minutos. Se obtuvo muestras de cada repetición y se determinó los niveles de humedad de los caramelos obtenidos a diferentes temperaturas experimentales mediante análisis de laboratorio. En base a los datos de sólidos solubles se obtuvieron los datos de actividad de agua del jarabe en proceso. Al poseer todos los datos se realizó las curvas de calentamiento con la finalidad de obtener la temperatura de proceso para cada caramelo a través de la recta que define la tendencia de los datos en base a sus variables: sólidos solubles, humedad y actividad de agua. Posteriormente se desarrolló un análisis de varianza con las variables involucradas en la calidad de cada caramelo con la finalidad de determinar la mejor temperatura de proceso que permita obtener los estándares de calidad. Se elaboró un Manual Técnico de Confites en base a los datos obtenidos en la Planta Piloto de Alimentos UTE (2944 m.s.n.m.). xiii ABSTRACT The goal of this study was to determine optimal heating curves of syrups for the preparation of different types of candy such as hard candy, soft candy, marshmallow, and gummy candy developed at the UTE’s Food Plant. We used the relationship between the barometric altitude and the temperature of boiling water to obtain possible optimal temperatures of heating in terms of the altitude of the UTE’s Food Plant. It was confirmed that for every 500 feet of height, we must subtract 1°F. The experiment was performed in triplicate for each candy, where it was determined: (1) Brix degrees’ data, and (2) processing times every two minutes from each repetition. Each Syrup reached the desired temperatures according to the previous extrapolation. A sample of each repetition was obtained, and the humidity levels of each candy were determined through a laboratory analysis. Additionally, by using the temperature and the Brix data, we got the the water’s activity data at different temperatures the syrup reached. Having all the data, heating curves were performed in order to obtain the optimum temperature for each candy through a line that defines the tendency of the data based on their variables of Brix degrees, percentage of humidity, and water activity Subsequently, an analysis of variance from the variables involved in the quality of each candy was developed in order to determine an optimal temperature of the process to obtain the standards of quality (Humidity and percentage of soluble solids of the Norm NTE INE 2 217 2000). xiv 1. INTRODUCCIÓN 1. INTRODUCCIÓN La temperatura de proceso de un jarabe determina los parámetros de calidad del caramelo como son: sólidos solubles, humedad y actividad de agua final. Tecnológicamente varios autores han estimado las temperaturas de proceso para obtener jarabes de diferentes texturas a la presión de 1 atm, por lo tanto, es necesario obtener experimentalmente las temperaturas de proceso a una altitud de 2944 metros sobre el nivel del mar donde está ubicada la Planta Piloto de la Universidad Tecnológica Equinoccial. Como antecedentes se considerarán las formulaciones y procedimientos de todos los tipos de caramelos que se realizan en las prácticas de la Tecnología de Confites en la Planta Piloto de Alimentos de la Universidad. Todos los parámetros de temperaturas de diferentes tipos de jarabes obtenidos a nivel del mar, las tablas que relacionan la altitud con la presión y el punto de ebullición del agua, son también antecedentes científicos que sirven como base para este estudio. Este estudio es de utilidad ya que permite obtener experimentalmente las curvas de calentamiento de los jarabes, estandarizar la calidad de los caramelos en base a requerimientos de sólidos solubles y humedad de la norma INEN 2 217 y también permite obtener un manual estandarizado de elaboración de confites de calidad que servirá como base de aplicación para los estudiantes de Ingeniería de Alimentos. La hipótesis planteada indica que las temperaturas de cocción óptimas de diferentes tipos de caramelos pueden ser obtenidas mediante la experimentación de las curvas de calentamiento de los diferentes jarabes a la altitud barométrica de la Planta de Proceso. Este trabajo constará de cinco etapas. 1 En la primera etapa se obtendrán las posibles temperaturas de proceso en base a la altura barométrica de la Planta Piloto de Alimentos de la UTE, estas se lograrán mediante un cálculo que relaciona los puntos de ebullición del agua a nivel del mar con los puntos de ebullición a distinta altitud. En la segunda etapa se realizará la obtención de los jarabes de todos los caramelos que se realizan en la Planta Piloto de Alimentos. La experimentación constará en alcanzar las tres temperaturas definidas en la primera etapa para cada tipo de caramelo, este proceso se lo realizará por triplicado. De esas muestras se generará los datos de humedad y sólidos solubles. En la tercera etapa los resultados experimentales relacionados a las variables dependientes (sólidos solubles y humedad) se obtendrán por medio de las ecuaciones de cada curva, la actividad de agua se obtendrá mediante la Ley de Raoult que relaciona el incremento de punto de ebullición en función de la presión parcial de los componentes de la solución. En la cuarta etapa se realizará un análisis de varianza mediante un diseño unifactorial para cada uno de los caramelos, con la finalidad de conocer si existen diferencias significativas entre los datos. Las variables dependientes del análisis serán: sólidos solubles, humedad y actividad de agua. Para el caramelo duro y el masmelo se realizará un diseño multifactorial para cada uno por contar con otro factor que es la formulación. De este diseño se analizará la varianza de los datos para identificar si hay diferencias significativas entre ellos. En la quinta etapa se tabularán los resultados en un manual de temperaturas. 2 2. REVISIÓN BIBLIOGRÁFICA 2. REVISIÓN BIBLIOGRÁFICA 2.1. HIDRATOS DE CARBONO Según Badui Salvador (2004), Los carbohidratos son uno de los principales nutrientes que contienen los alimentos. Son compuestos con estructura de polihidroxialdehído o polihidroxiacetona. Existe un gran número de hidratos de carbono; los más conocidos son la sacarosa, la glucosa, el almidón y la celulosa; existen otros que, aunque se encuentren en menor concentración en los productos que consumimos diariamente, tienen mucha importancia debido a sus propiedades físicas, químicas y nutricionales. De acuerdo con Coultate T. (2007) la estructura química de los hidratos de carbono determina la funcionalidad y las características que repercuten de diferente manera en los alimentos, principalmente en el sabor, la viscosidad, la estructura y el color. Es decir, las propiedades de los alimentos tanto naturales como procesados, dependen del tipo de hidratos de carbono que contengan y de las reacciones en que estos intervengan. Su clasificación se define de acuerdo a su estructura química, que se basa en el tamaño de la molécula o en el número de átomos de carbono que contiene, según la cual, los hidratos de carbono pueden ser monosacáridos, oligosacáridos y polisacáridos (Eyzaguirre Jaime, 1974). De acuerdo con Charley Helen (1991), los monosacáridos tienen entre tres y ocho átomos de carbono, pero los más comunes poseen entre 5 y 6. La cadena de átomos de carbono es siempre recta, nunca ramificada. Únicamente un átomo de carbono forma el grupo carbonilo, los otros contienen un grupo hidroxilo cada uno. El grupo carbonilo le confiere las propiedades reductoras a los monosacáridos y otros azúcares. 3 Según Eyzaguirre Jaime (1974), los monosacáridos son los que no pueden ser hidrolizados en otros azúcares más simples como los de tres átomos llamados triosas, o los de cuatro, cinco o seis que son llamados: tetrosas, pentosas y hexosas, respectivamente. De acuerdo con Badui Salvador (2004), las hexosas son las de mayor importancia dentro de estos azúcares simples, y, en especial, la glucosa o dextrosa con fórmula C6H12O6, ya que esta es la parte fundamental para formar a los disacáridos y polisacáridos. De las cetohexosas, la más importante es la llamada fructosa, levulosa o azúcar de fruta, esta aparece como azúcar libre en frutas y en la miel, al combinarse con glucosa constituye el disacárido sacarosa (C12H22O11). De acuerdo con Charley Helen (1991), la unión del grupo reductor de un monosacárido a un grupo hidroxilo genera la formación de un disacárido. Nuevas uniones de este tipo generarían: trisacáridos, tetrasacáridos, oligosacáridos y finalmente polisacáridos. La hidrólisis de los disacáridos se da en dos monosacáridos. Entre los más importantes se encuentran: la maltosa, lactosa y sacarosa. La sacarosa que es la más común no es un azúcar reductor, está compuesta por una unidad de glucosa y una de fructosa, al enlazarse el grupo aldehído de la glucosa se une al grupo cetona de la fructosa. Según Coultate T. (2007), los dos azúcares más importantes de los alimentos son la lactosa y la sacarosa. La lactosa (un 5% aproximadamente p/v en la leche de vaca) es el azúcar de la leche y, por supuesto, es un azúcar reductor. La sacarosa es el azúcar de cocina o azúcar comercial. La sacarosa que compramos como azúcar en el mercado procede de la caña de azúcar o de la remolacha azucarera, pero la sacarosa abunda de la mayor parte de los vegetales, especialmente en las frutas. 4 Según Charley Helen (1991), comenta que los polisacáridos se pueden hidrolizar de moléculas de monosacáridos. Entre los más importantes están los almidones y la celulosa. Al unir muchas unidades de glucosa se forma un polímero llamado almidón. Es el principal elemento de reserva que tienen las plantas, lo almacenan en forma de gránulos, en las semillas, frutas, tubérculos o raíces. El glucógeno de forma similar, actúa como el carbohidrato de reserva en los animales, se almacena en el hígado y en los músculos. 2.1.1. SACAROSA En un estudio sobre la Producción de Dextrán como derivado de la sacarosa realizado en la Escuela de Ingeniería Química de la Universidad de San Carlos de Guatemala, se indica que la sacarosa es menos abundante en las regiones que se encuentran en crecimiento activo, especialmente las porciones blandas del extremo del tallo y las hojas enrolladas (Echeverría Emmet, 2011). Según Potter N. (1999), para formar la sacarosa y agua se deben condensar los azúcares monosacáridos, glucosa y fructosa. La fórmula empírica de la sacarosa es: C12H22O11 y su peso molecular es de 342.3. La sacarosa posee cristales denominados monoclínicos con densidad de 1.588; una solución al 26% (p/p) tiene una densidad de 1.18175 a 20 ºC. De acuerdo con Christein H. (1986), el punto de fusión de la sacarosa es de 188 ºC y se descompone al fundirse. El índice de refracción es de 1.3740 para una solución de 26% (p/p). La sacarosa es soluble tanto en agua como en etanol; pero también es ligeramente soluble en metanol e insoluble en éter o cloroformo. De acuerdo con Echeverría Emmet, (2011) a pesar de que la sacarosa es dextrógira, y esta característica se utiliza para medir la cantidad de sacarosa 5 en solución, la rotación específica del azúcar invertido es [α]D 20-39.7 debido a que la actividad levógira de la fructosa es mayor que la actividad dextrógira de la glucosa. Según Christein H. (1986), la sacarosa al momento de hidrolizarse, produce glucosa y fructosa en cantidades iguales o equimolares, a partir de este momento toma el nombre de azúcar invertida. Sin embargo, estos azúcares no se presentan siempre en cantidades iguales en sus fuentes. Figura 1. Estructura de la Sacarosa (Coultate, 2007) 2.1.2. GLUCOSA Astiasarán et al. (2003) concluyeron que la glucosa o dextrosa es el azúcar de fécula refinado y cristalizado. Su poder edulcorante es menor que el de la sacarosa. La glucosa abunda en los almidones de maíz, fruta, maíz dulce, jarabe de maíz, miel, patata y trigo. Debido a su rápida absorción la dextrosa se utiliza mucho como producto energético incorporado a preparados nutritivos y farmacológicos. Se emplea también en bebidas, dulces, reposterías y mermeladas. Según Potter Norman (1999), la glucosa produce, en la elaboración de caramelo duro, el efecto de cristalinidad y ayuda a retardar el efecto de cristalización de la sacarosa, actuando como inhibidor y retardante de las reacciones de inversión. 6 Figura 2. Estructura de la glucosa (Perafán, 2011) Astiasarán et al. (2003), definen que la glucosa se oxida en las células como fuente de energía y se almacena en el hígado como glucógeno. El peso molecular de la glucosa es de 180,2. La fórmula empírica de la glucosa es C6H12O6. La forma de los cristales de la glucosa es rómbica. Su punto de fusión es a 146ºC y tienen una densidad de 1.544. El monohidrato de glucosa produce un cristal monoclínico esfenoidal, un extremo del cual se disuelve con mucha rapidez que el otro; se funde a 83ºC. La glucosa es menos soluble en agua que la sacarosa. Es soluble en etanol e insoluble en éter. Las moléculas de glucosa se condensan en diferentes maneras para formar almidón, dextrana y celulosa. 2.2. SOLUBILIDAD DEL AZÚCAR De acuerdo con Aguilar Noe (2006), el alto grado de solubilidad que tiene la sacarosa es esencial al elaborar cualquier tipo de jarabe, para lo cual se debe comenzar disolviendo los cristales gruesos y secos de azúcar granulada en agua. Es recomendable utilizar un exceso de agua para asegurar una completa solución. La sacarosa es altamente soluble en el agua, más que en la glucosa, aunque menos que la fructosa. La lactosa es el menos soluble de los azúcares comunes. La solubilidad de cualquier azúcar en el agua aumenta con un incremento en la temperatura. 7 De acuerdo con Charley Helen (1991), a 20°C (68°F), un 67 % de la solución de la sacarosa está saturada; a 115°C, la concentración de sacarosa en una solución saturada es de 87 porciento. También se muestra la solubilidad de la fructosa a dos temperaturas, y el cloruro de sólido a tres temperaturas. La Tabla 1 muestra la solubilidad de la sacarosa en el agua a diferentes temperaturas. Cuando la cantidad de sacarosa específica en la tabla se disuelve en 100 g de agua a una temperatura determinada, se desarrolla una solución saturada. Según Charley Helen (1991), la solubilidad es una característica innata de los grupos hidroxilo de las moléculas de azúcar. Si se eleva la temperatura se produce poca diferencia en la solubilidad del cloruro de sodio donde hay enlaces iónicos, pero existe una marcada diferencia en la solubilidad del azúcar donde se encuentran puentes de hidrógeno. Tabla 1. Relación de la Temperatura con la Sacarosa, Fructosa y Cloruro de Sodio Temperatura Sacarosa Fructosa Cloruro de sodio (°C) (gramos) (gramos) (gramos) 0 179.2 10 190.5 20 203.9 30 219.5 40 238.1 50 260.4 100 287.2 115 669 35.6 374.0 36.0 538.0 37.8 (Charley, 1991) 8 La alta solubilidad de la sacarosa en el agua es una ventaja en la elaboración de dulces, pero una desventaja cuando el dulce absorbe humedad de la atmósfera ya que se hace pegajoso o suave. Es más probable que los dulces con una alta proporción de fructosa capten la humedad. Una diferencia de uno por ciento de humedad relativa cuando se elabora un dulce puede alterar la consistencia del preparado una vez terminado (Charley Helen, 1991). 2.3. EFECTO DE LA SACAROSA SOBRE EL PUNTO DE EBULLICIÓN DEL AGUA De acuerdo con Charley Helen (1991), una sustancia que se disuelve en el agua como el azúcar, eleva el punto de ebullición. Cada mol de sacarosa (342g) disuelto en un litro de agua eleva el punto de ebullición en 0,52°C Una mol de sal (58g) por litro de agua eleva el punto de ebullición en lo doble, o sea 1,04°C, debido a que cada molécula de sal se ioniza para dar lugar a unión sodio y un ion cloruro. En base a un análisis de Potter desarrollado en 1999, se puede concluir que el punto de ebullición de un jarabe de sacarosa es un índice de su concentración. Uno puede medir indirectamente la concentración de azúcar en un jarabe midiendo la temperatura en la cual hierve el jarabe. Por este medio es posible determinar cuando un jarabe de azúcar ha alcanzado la concentración deseada. Se deben considerar las variaciones de la presión barométrica, de la presencia de otros azúcares y de la altitud. La tabla 2 proporciona los puntos de ebullición para soluciones de sacarosa a diferentes concentraciones. Nótese la elevación en el punto de ebullición luego de que la concentración de sacarosa en el jarabe alcanza el 80 porciento. 9 Tabla 2. Puntos de Ebullición para soluciones de sacarosa a diferente concentración Sacarosa Punto de ebullición (porciento) (°C) 0 100 10 100.4 20 100.6 40 101.5 60 103.0 80 112 85 114 (punto de bola suave para los dulces) 90.8 130 100 160 (azúcar fundida) (Charley, 1991) 2.4. FUSIÓN Y PUNTO DE CARAMELO DEL AZÚCAR Figura 3. Jarabe de Azúcar y Agua que ha sobrepasado los 350°F (Sánchez, 2011) 10 Según Charley Helen (1991), a medida que el agua de una solución se evapora y la concentración de sacarosa aumenta, la temperatura del jarabe se eleva y continuará haciéndolo hasta que toda el agua se haya evaporado. Cuando esto sucede, el líquido que aparece es azúcar fundida. El punto de fusión del azúcar es de 160°C (320°F). Los cristales de azúcar pueden fundirse colocando azúcar seca en un recipiente de calor de fuego lento y agitando para que el azúcar del fondo no se sobrecaliente antes que el resto tenga la oportunidad de alcanzar su punto fusión. El azúcar fundida, una vez que se ha retirado de la fuente de calor y se ha dejado reposar, se sobreenfría. Se convierte en un sólido claro vidrioso y quebradizo no cristalino. La descomposición de la sacarosa por el calor produce un aumento en una mezcla compleja de aldehídos y cetonas en las cuales los constituyentes principales son el 5-hidroximetilfurfural y furfural. Los productos de la pirolisis de la sacarosa incluyen, además, un grupo de cresoles. Cuando se añade el bicarbonato de sodio al azúcar caramelizado, el calor más los ácidos presentes, liberan bióxido de carbono, cuyas burbujas inflan la masa derretida. Cuando se enfría queda porosa y quebradiza (Charley Helen, 1991). Cuando un jarabe de sacarosa y agua se han calentado hasta el punto de crujiente suave (por el sonido que el jarabe caliente hace cuando se coloca una pequeña cantidad de él en agua fría), lleva un color ámbar pálido. Esto no se debe al punto de caramelo sino a la liberación de furfural del azúcar por la alta temperatura seguida por la formación de polímeros que tiñen el jarabe (Charley Helen, 1991). 11 2.5. JARABE El almíbar es una solución de agua y azúcar, que se obtiene a distintas densidades. Al cocer esta solución se va adquiriendo una graduación diferente. La densidad del almíbar se debe medir teniendo a 20°C al jarabe, de lo contrario se arrojará resultados imprecisos. El jarabe se gradúa en grados Baumé, esto se lo puede lograr a partir de los datos obtenidos del brixómetro o realizando una prueba sensorial. La comprobación de sólidos solubles da mayor calidad a los preparados obtenidos (Marchense Pasqualino, 2011). 2.5.1. PROCEDIMIENTO PARA OBTENER LAS PROPIEDADES FÍSICOQUÍMICAS DE UN JARABE Formoso (1999) describe el siguiente procedimiento: En un recipiente de acero inoxidable colocar en relación 1Kg: 1L el azúcar y el agua. (1 Kg de azúcar y 1 litro de agua). Remover hasta obtener una solución homogénea Al tener la solución homogénea se debe medir datos de densidad, sólidos solubles y T ºC. Vaciar el contenido en una olla de acero inoxidable y llevar al fuego Alcanzar el punto de ebullición Registrar la temperatura y grados brix y obtener muestras para determinar densidad (°Bé) Registrar estos datos cada dos minutos. Evitar con un lienzo húmedo que se formen cristales en los bordes de la olla y en los utensilios que se usan, para evitar que los cristales vuelvan al jarabe y lo estropeen. Grafique los grados Beaumé vs Temperatura o Grados Brix vs T. Determine las ecuaciones de calentamiento de los jarabes. 12 2.5.2. GRADOS BEAUMÉ Peynaud y Blouin (2004) aseguran que los grados Beaumé son definidos como una escala que mide la densidad de un concentrado como lo es la solución agua- azúcar. Además, consideran que un grado Baumé equivale a 17 gramos de azúcar por litro de solución. Con esta relación podemos obtener el peso del azúcar de un litro de jarabe, multiplicando el número de grados del almíbar por 25. Para obtener los grados Bé de un producto se utiliza el densímetro o comúnmente llamado Pesajarabes. Lo que se logra es identificar las cantidades de azúcar presentes en cierto producto. Según Marchese Pasqualino (2011), para determinar el rango de los almíbares, se lo debe fijar al jarabe entre 10º a 33ºC. Por lo que una muestra que tenga 33° de temperatura sería definida como aséptica. De acuerdo con Marchese Pasqualino (2011), para fijar una constante en el almíbar del volumen que ocupan en el agua, se debe saber que un gramo de azúcar ocupa 0,06 centilitros en el agua, y a esta constante se la debe multiplicar por el número de gramos de azúcar. 2.5.3. GRADOS BRIX Los grados Brix representan el porcentaje de sólidos solubles totales en una determinada solución. Es un representante de la unidad de azúcar contenido en una solución acuosa (Nielsen Suzanne, 2009). En un artículo publicado por la Asociación de Cerveceros Artesanales de la República de Argentina (2006), se indica que un grado Brix corresponde a un gramo de sacarosa u otros solutos en 100 gramos de solución y por tanto representa la fuerza de la solución como un porcentaje en peso. En otras palabras si poseemos un jarabe únicamente con agua y azúcar que posee 10°Brix, significa que ese jarabe contiene 10g de azúcar y 90 g de agua. 13 2.5.4. RELACIÓN ENTRE GRADOS BRIX Y BEAUMÉ A partir de la tabla que relaciona °Brix y °Beaumé desarrollada por la Asociación de técnicos azucareros de México (Anexo 1), se logra concluir que existe una relación para obtener la densidad (°Bé) a partir del porcentaje de sólidos solubles [1]. °𝐵é × 1.8 = °𝐵𝑟𝑖𝑥 [1] Donde: °Bé= Grados Beaumé °Brix= Porcentaje de Sólidos Solubles 2.5.5. ACTIVIDAD DE AGUA (Aw) La actividad acuosa o Aw se define como la relación que existe entre la presión de vapor del alimento en relación con la presión de vapor del agua pura a la misma temperatura. La actividad acuosa es una variable estrechamente ligada a la humedad del alimento, que para fines de microbiología se estudia actualmente como uno de los factores importantes del desarrollo microbiano. Según este autor, la actividad acuosa se define como el cociente que existe entre la presión de vapor del alimento y la presión de vapor del agua a la misma temperatura (Curiel José, 2011). 𝐴𝑤 = 𝑃 𝑃𝑜 [2] Donde: Aw= Actividad de Agua P= Presión de Vapor del alimento Po= Presión de Vapor del Agua 14 La actividad acuosa se puede expresar como la Humedad Relativa de Equilibrio (HRE) cuando se la divide para 100: 𝐴𝑤 = 𝐻𝑅𝐸 [3] 100 Donde: Aw = Actividad de Agua HRE = Humedad relativa de equilibrio. 2.5.6. HUMEDAD RELATIVA DE EQUILIBRIO EN LOS JARABES Según Curiel José (2011), la humedad relativa de equilibrio es la humedad a la cual se igualan: la humedad del alimento con la humedad del aire ambiente. 𝐻𝑅𝐸 = 𝑃𝑎𝑔𝑢𝑎 𝑃𝑎𝑖𝑟𝑒 [4] Donde: HRE= Humedad relativa de equilibrio. Pagua= Presión de Vapor de agua Paire= Presión de Vapor del aire La evaluación de la Humedad relativa de equilibrio es de primordial importancia para la formulación de productos de confitería, ya que a través de ella se puede predecir el comportamiento del producto elaborado y su vida útil. Cuando un caramelo tiene una humedad relativa de equilibrio superior a la humedad relativa del aire ambiente, el producto tiende a ceder su humedad y después a cristalizarse. Por lo contrario, cuando la Humedad relativa de equilibrio es inferior a la humedad del aire ambiente, el producto tenderá a hidratarse. (Curiel José, 2011). 15 Según Curiel (2011), a nivel del mar la humedad es elevada, lo que se dificulta la elaboración de dulces de calidad, porque el aire está saturado. Lo mismo sucede cuando llueve. Más aun, un proceso tecnificado debe modificar la formulación de los productos en función de su destino o consumo final. La Tabla 3 presenta algunas humedades relativas recomendadas para productos específicos si se tiene una altitud aproximada a 2200 metros sobre el nivel del mar. Tabla 3. Humedad Relativa en los caramelos obtenida a 2200 msnm Tipo de Caramelo Caramelo Duro Malvavisco Gomitas Fondant Humedad Relativa (%) 20 a 25 65 a 70 55 a 60 80 a 85 (Curiel, 2011) En la figura 4 se relacionan los puntos clásicos del dulce que se alcanzan a diferentes temperaturas y que corresponden a niveles específicos de humedad. Figura 4. Actividad acuosa, estados físicos, reactividad y desarrollo microbiano en dulces (Curiel, 2011) 16 2.5.7. EQUIVALENTE DE DEXTROSA (ED) García et al. (2004) concluyeron que el Equivalente de Dextrosa es el factor que representa el poder reductor considerando a todo el carbohidrato presente fuera de la glucosa. Es decir, el equivalente de dextrosa de un jarabe es el contenido de glucosa, más un medio del contenido de maltosa, y un tercio del contenido de maltotriosa, y así de todos los otros azucares reductores. García et al. (2004) también definieron que para la caracterización de los productos de hidrólisis del almidón, se emplea este parámetro que define el grado de hidrólisis. El Equivalente de Dextrosa es igual a unidades masa de glucosa pura requeridas para reducir la misma cantidad de Reactivo de Fechling que 100 unidades masa del hidrolizado seco. García et al. (2004) concluyeron que a menudo se incurre en el error de pensar que un jarabe glucosado de ED 20 contiene un 20% de glucosa, pero de acuerdo con la definición, debe entenderse como un jarabe que presenta un poder reductor similar al de una solución con 20% de glucosa. 2.5.8. PUNTO CRÍTICO DE CONTROL: TEMPERATURA En la Enciclopedia Formoso (1999), se identifica que mientras la concentración de azúcar va aumentando, la temperatura de ebullición también sube. La temperatura superior máxima que alcance el jarabe de azúcar representará la textura del jarabe cuando enfríe. En el caso de obtener 113° C, se obtiene la denominada “bola suave”. Eso significa que cuando usted deja caer una gota del jarabe en un vaso con agua fría, formará una bola suave. (Formoso, 1999). 17 La Figura 5 muestra un termómetro de caramelo, el más óptimo para jarabes de confites por su resistencia al calor. Es recomendable realizarle una calibración periódica al termómetro. Figura 5. Termómetro para caramelo (resistente a temperaturas altas) (Gallardo, 2007) 2.5.9. COMPORTAMIENTO DE LA SACAROSA ANTE EL CALOR Al momento de colocar el azúcar sobre el agua, los cristales tienden a disolverse alcanzando una disolución homogénea. Sin embargo no se puede disolver una cantidad infinita de azúcar en un volumen fijo de agua ya que se satura la solución. El punto de saturación varía en temperaturas diferentes. La temperatura más alta alcanzada es aquella en la que el azúcar puede sostenerse en solución. (Potter Norman, 1999) Figura 6. Comportamiento del jarabe al ser sometido al calor 18 Potter (1999), concluye que a temperaturas altas, la solución permanece estable, pese a que gran cantidad del agua se evapora. Pero si en el dulce al alcanzar la cocción y al enfriarse, hay más azúcar en la solución de lo que es posible, se genera una solución sobresaturada de sacarosa. Este factor es negativo en la obtención del caramelo ya que la sobresaturación es un estado inestable. Las moléculas de azúcar se recristalizan, de este modo al revolver o restregar los bordes del recipiente o de cualquier tipo de acciones similares se pueden causar que el azúcar empezara a recristalizar. 2.5.10. AZÚCAR INVERTIDO Según Badui Salvador (2006), el azúcar invertido se da cuando se mezclan ciertos azúcares al hidrolizarse la sacarosa, química o enzimáticamente. El nombre de inversión se refiere al cambio de poder rotatorio que se observa durante dicha hidrólisis: la sacarosa es dextrorrotatoria (+66°), pero al transformarse en glucosa (+52°) y en fructosa (-92°), la mezcla resultante desarrolla un poder levorrotatorio (-20°) a lo que se le llama inversión. De acuerdo con Badui Salvador (2006), el azúcar invertido se produce naturalmente en la miel, ésta es razón por la cual es tan dulce; por otro lado, en los jugos de fruta con pH ácido y que sufren algún tratamiento térmico (como se da en los almíbares de los caramelos), también se produce un ligero incremento de la dulzura debido a la hidrólisis de la sacarosa. Según Badui Salvador (2006), al existir fructosa, el azúcar invertido es más dulce que la sacarosa. Obteniendo una relación de 100-127 entre el dulzor de la sacarosa y el azúcar invertido; por lo que si consideramos un valor arbitrario de 100 para el poder edulcorante, el de la fructosa es de 180 y el de la glucosa de 74; consecuentemente, el del azúcar invertido será promedio: (180+74)/2=127; es decir, es 27% más dulce que la sacarosa. Otra característica es que no cristaliza, por lo que se utiliza en algunos derivados de la confitería. 19 2.5.11. RECRISTALIZACIÓN Una forma para evitar la recristalización de sacarosa en el dulce es incluir otra variedad de azúcar en la formulación, como la fructosa o la glucosa. Los cristales de la sacarosa forman estructuras exactas. Si alguna de las moléculas tiene un tamaño diferente no encaja y no forma el cristal. Para poder ingresar otras azúcares a la mezcla se puede invertir el azúcar por medio de un ácido. (Formoso, 1999) Otra forma se da al agregar un monosacárido, el jarabe de maíz es un buen ejemplo, que también se lo conoce como glucosa. Algunas recetas de chupetes utilizan hasta un 50% jarabe de maíz; éste no permite que se formen los cristales de azúcar que podrían estropear la textura. (Formoso, 1999) Según Formoso (1999), es recomendable usar grasas en el dulce. La mantequilla y otras grasas interfieren con el inicio de cristalización, Por lo que los cristales exactos no se pueden formar, generalmente el caramelo blando posee una gran cantidad de mantequilla, lo que le permite poseer una textura lisa y una fácil fracturabilidad. 2.5.12. TIPOS DE JARABES EN RELACIÓN A LOS GRADOS BEAUMÉ Según Formoso (1999) los jarabes se pueden clasificar de la siguiente manera: • Jarabe cero: Se obtiene al inicio exacto de la ebullición. • Jarabe punto primero: Se lo reconoce porque se pega en los dedos. Se lo denomina siruposo o jarabe de almíbar corriente. En el pesajarabes se generará un resultado entre 18 y 28Be según el tiempo de cocción. 20 • Jarabe equivalente a hebra fina (29): Al momento de introducir los dedos índice y pulgar en agua fía, se los retira del agua y se forma inmediatamente un hilillo de poca resistencia, rompiéndose instantáneamente, el almíbar se llama hebra fina o floja. • Jarabe equivalente a hebra gruesa o fuerte (30): A diferencia del anterior se obtiene un hilo fuerte de mayor resistencia que no se rompe fácilmente. • Jarabe equivalente a perlita (33): Se lo reconoce cuando el jarabe empieza a burbujear en forma de perlitas redondas, al hacer la prueba de los dedos el hilo presenta más resistencia que en la etapa anterior a esta. • Jarabe equivalente a gran perla (35): El jarabe al hervir con más fuerza que las anteriores, forma burbujas gruesas que saltan del líquido. Al hacer la prueba de los dedos el hilo no se rompe, Este almíbar lleva el nombre de “pluma” • Jarabe equivalente a goma blanda (37): Al realizar la prueba de los dedos, se forma una bola blanda. Este punto es denominado de bola. • Jarabe equivalente a goma dura o gran bola (38): Al efectuar la prueba de los dedos se debe formar una bola con el almíbar un poco más compacta. • Jarabe equivalente a lámina (39): Se obtiene un poco de jarabe con los dedos, la bola se formará manipulando el almíbar, y una vez formada se morderá, la bola se pega a los dientes y ofrecer cierta resistencia. A este punto se denomina A este punto se lo denomina “escarchado”. 21 • Jarabe equivalente a lámina quebradiza, punto de caramelo (40): Se reconoce este punto, ya que al manipular, se forma una bola que se parte en distintas secciones, no se pega a los dedos y hace un pequeño ruido o chasquido. Si se lo coloca en una superficie lisa, se afirma y no se pega. Al pasar los 40° se quema el caramelo 2.5.13. FASES DEL JARABE EN FUNCIÓN DE TEMPERATURA Y PORCENTAJE DE SÓLIDOS SOLUBLES Figura 7. Texturas del caramelo (Sánchez, 2011) Según Candymaking (2011), las temperaturas especificadas son para el nivel del mar. A las altitudes mayores, substraiga 1° F de cada temperatura listada para cada 500 pies sobre el nivel del mar. Este portal propone las fases siguientes fases que se pueden dar en un jarabe: La Fase del hilo 230° F-235° F. Concentración de azúcar: 80% A esta temperatura relativamente baja, Hay gran cantidad de agua en el jarabe, al poner en agua fría, formará un hilo líquido de jarabe que no se mezclará con el agua. No tiene una textura de caramelo pero se lo utiliza para verter sobre los helados. 22 Fase de la bola suave 235° F-240° F. Concentración de azúcar: 85% Si obtenemos esta temperatura, al dejar caer el jarabe de azúcar en el agua fría se forma una bola suave, esta bola es bastante flexible y al retirarla del agua podrá formar una bola suave después de unos momentos en su mano. Los ejemplos de confites que usan este tipo de bola son: el dulce de chocolate, pralinés. Fase de la bola maleable o semidura 245° F-250° F. Concentración de azúcar: 87% Al colocar el jarabe a esta temperatura en agua fría se obtiene una bola firme semidura. Fase de la bola dura 250° F-265° F. Concentración de azúcar: 92% En esta fase, el jarabe formará los hilos espesos, "viscosos" cuando gotea de la cuchara; la concentración de azúcar es ahora bastante alta significa que cada vez hay menos humedad en el jarabe de azúcar; al dejar caer en el agua fría un poco de este jarabe formará una bola dura; si usted saca la bola del agua, la bola será dura, pero todavía puede cambiar su forma aplastándolo. Figura 8. Prueba manual de la fase de bola dura (Morales, 2007) 23 Fase de lámina no quebradiza suave 270° F-290° F. Concentración de azúcar: 95% Cuando el jarabe alcanzó la fase de lámina suave no quebradiza, las burbujas en la superficie del jarabe se pondrán más pequeñas, más espesas, y más íntimamente juntas. En esta fase, el volumen de humedad está bajo; cuando usted deja caer una porción de este jarabe en el agua fría, solidificará en hilos que, y cuando se retiren del agua, serán flexibles y no quebradizos; pues ellos doblarán ligeramente antes de romperse. Con la fase de lámina no quebradiza se elabora toffes de sal y caramelos de mantequilla. Fase de lámina quebradiza dura 300° F-310° F. Concentración de azúcar : 99% La fase de lámina quebradiza dura probablemente es la temperatura más alta que se ha visto especificado en una receta de caramelos; a estas temperaturas, casi no hay agua en el jarabe; la gota del jarbe en el agua fría y formará hilos duros, quebradizos que rompen cuando se doblan. Figura 9. Prueba manual de la fase de lámina quebradiza (Morales, 2007) 24 Azúcar caramelizado Si usted calienta un jarabe de azúcar superior a las temperaturas que cualquiera de las fases del dulce, usted estará camino a crear el azúcar caramelizado líquido castaño que se suma a muchos postres. Fase de líquido claro 320° F. Concentración de azúcar: 100% A esta temperatura toda el agua ha hervido lejos. El azúcar restante es el ámbar líquido y ligero en el color. La Fase de líquido – castaño 338° F. Concentración de azúcar: 100% Ahora el azúcar licuado se pone castaño cambiando de color al de caramelización. El azúcar está empezando a estropearse y formar muchos compuestos complejos que contribuyen a un sabor más rico. Se usa el azúcar caramelizado para las decoraciones del postre y también puede usarse para dar un dulce que cubre a las nueces. La Fase de azúcar quemado 350° F. Concentración de azúcar : 100% El azúcar empieza a quemar y desarrolla un sabor amargo, quemado. Por otro lado Según Hayes (1987), las temperaturas que corresponden a cada tipo de hebra de jarabe son presentadas en la tabla 4 25 Tabla 4. Grados tradicionales observables durante el calentamiento de los jarabes (Hayes, 1987) 2.6. CONDICIONES CLIMÁTICAS- CLIMA Según Álvarez Génesis (2008), el clima es el estado medio de los fenómenos meteorológicos durante un largo espacio de tiempo, determinado por los factores y elementos climáticos e influjos cósmicos. Dicho de otra manera, es la condición atmosférica que en un tiempo definido tiene una determinada región. 26 2.6.1. ELEMENTOS DEL CLIMA En el mismo estudio denominado: El clima de Venezuela (2008), se identifican los siguientes elementos del clima: Temperatura: factor atmosférico representado por una magnitud escalar que se toma directamente del medio ambiente y representa la cantidad de energía interna de un sistema. Precipitación: es el término utilizado para definir las formas de agua en estado líquido o sólido que caen directamente sobre la superficie terrestre o de otro planeta. Humedad atmosférica: es la cantidad de vapor de agua existente en el aire. Es directamente proporcional a la temperatura de la región, de forma que resulta mucho más elevada en las masas de aire caliente que en las de aire frío. Presión Atmosférica: representa el peso del aire sobre la superficie terrestre. La media del peso de la atmósfera es de 1013 milibares (o hectopascales) al nivel del mar, esto significa que aproximadamente representa un kilogramo por centímetro cuadrado. Las masas de agua: Cuando estas masas de agua están cerca a una región elevan la temperatura o a su vez si no hay presencia de estos fenómenos la baja, esto se da por ser menos compactas que la tierra, generando que la irradiación de calor sea más lenta y mantenga el calor por más tiempo. Las corrientes marinas: A diferencia del anterior fenómeno, las corrientes marinas desplaza el calor con ellas. Los vientos que se encuentran presentes en el fenómeno también aportan en el cambio de temperatura producto de la transferencia de calor que existe en ellas. 27 2.6.2. FACTORES QUE MODIFICAN EL CLIMA Otro punto importante detallado en el estudio realizado por Álvarez Génesis (2008), son los factores que pueden modificar el clima de una determinada región, estos son: Latitud: A medida de que la latitud aumente, las condiciones climáticas cambian, esto se debe a que la cantidad de radiación solar disminuye. Esta reacción del clima genera las estaciones climáticas. En el Ecuador no tiene mayor importancia porque nos encontramos en plena zona intertropical (0º) y generalmente las estaciones no son diferenciadas y el clima es variable para todo el año. Altitud: Es un factor imprescindible a la hora de identificar las variaciones del clima. A medida que aumenta la altura de un lugar, es decir, los metros sobre el nivel del mar, la temperatura se hace más fría. Por eso podemos sentir en la región costa del país un gran calor mientras que en las alturas de los andes la temperatura es muy baja. Por lo que se confirma el enunciado: "A mayor altura menor temperatura" 2.6.3. ALTITUD DE LA PLANTA PILOTO DE ALIMENTOS UTE La Planta de Alimentos UTE, se encuentra en una zona de gran altitud de Quito, por lo que existe una variación considerable entre la temperatura aplicada en un lugar a nivel del mar y la que se debe utilizar en la Planta. Esta diferencia es de 19,3 °F. Para lo cual es muy importante calcular las nuevas temperaturas, ya que si se usa las relacionadas a nivel del mar, los caramelos sobrepasan su punto óptimo de caramelización y se queman. Según Candymaking (2011), se define que para obtener la temperatura real a la que los caramelos deben ser sometidos, se debe conocer la altitud del lugar donde se realiza el caramelo. 28 Figura 10. Fotografía satelital de la Universidad Tecnológica Equinoccial con coordenadas y latitud msnm (Google Earth, 2011) Según Charley Helen (1999), existe una relación entre los puntos de ebullición del agua y las altitudes en donde se sometió a ebullición. Este cálculo indica que por cada 500 pies de altura se debe restar 1°F. 2.7. PROPIEDADES DE LAS SOLUCIONES 2.7.1. PRESIÓN DE VAPOR Según Rosemberg, y Epstein (1992) definen que las presiones de vapor de todos los solutos no volátiles en un disolvente son menores que las del disolvente puro. Si se preparan soluciones de diferentes solutos en un disolvente dado agregando números iguales de moléculas de soluto a una cantidad fija de disolvente, como se hace el preparar soluciones de la misma molalidad, se encuentra que el descenso de la presión de vapor es el mismo en todas las soluciones diluidas de no electrolitos no volátiles 29 2.7.2. LEY DE RAOULT Jerome et al. (2009) concluyeron que La ley de Raoult establece que en soluciones diluidas de no electrolitos no volátiles el descenso de la presión de vapor es proporcional a la fracción molar del soluto, o la presión de vapor de la solución es proporcional a la fracción molar del disolvente. 𝑃𝑣𝑑 = 𝑃𝑣𝑑𝑝 × (𝑓𝑚𝑑) 5 Donde: Pvd= Presión de Vapor del disolvente Pvdp= Presión de Vapor del disolvente puro Fmd= Fracción molar del disolvente Rosemberg et al. (1992) identifican que en la segunda forma, la presión de vapor de la solución se ha identificado con la presión de vapor del disolvente sobre la solución, puesto que se supone que el soluto es no volátil. En los sistemas de líquidos que se mezclan entre sí en todas proporciones para formar soluciones ideales, la Ley de Raoult, en la forma de la segunda ecuación anterior, se aplica a la presión parcial de cada componente por separado. 𝑃𝑝𝑐𝑠 = 𝑃𝑣𝑐 𝑥 (𝐹𝑚𝑐) 6 Donde: Ppcs=Presión Parciál de cualquier componente de la solución Pvc= Presión de vapor de ese componente puro Fmc= Fracción Molar del Componente 2.7.3. ELEVACIÓN DEL PUNTO DE EBULLICIÓN. ∆Tb Según Burns Ralph (2003), el punto de ebullición de un líquido es la temperatura a la cual su presión de vapor iguala la presión atmosférica. Esto se debe a que la presión atmosférica varía con la altitud y las condiciones meteorológicas. Los puntos de ebullición de los líquidos también son variables. 30 La temperatura a la cual se hierve una solución es más alta que la del disolvente puro si el soluto es relativamente no volátil. En soluciones diluidas, la elevación del punto de ebullición es directamente proporcional al número de moléculas de soluto (o moles) en una masa dada de disolventes. (Rosemberg et al. 1992) Durante la ebullición, la vaporización se lleva a cabo en la superficie y en la masa del líquido donde se forman burbujas de vapor que suben a la superficie. Por lo tanto para cocer un alimento en este caso el jarabe de caramelos, es necesario suministrar al balance una cierta cantidad de energía. (Burns Ralph, 2003) Según Burns Ralph (2003), si se tiene una presión reducida el agua hierve a una temperatura más baja y posee menos energía calórica. Como dato estándar, si la presión es de 1 atm, el agua hierve a 100°C. El punto de ebullición aumenta cuando se incrementa la presión que se ejerce sobre el líquido. De nuevo se utiliza generalmente la escala de molalidad y la ecuación es: ∆𝑇𝑏 = 𝐾𝑏𝑚 = 𝑃𝑒𝑏𝑠 − 𝑃𝑒𝑏𝑑 7 Donde: ∆Tb= Elevación del punto de ebullición Kbm= Constante Molal del punto de ebullición del disolvente Pebs= Punto de Ebullición de la Solución Pebd= Punto de ebullición del disolvente Kb se llama constante molal del punto de ebullición del disolvente. Como en Kf, el valor numérico de Kb es una propiedad tan solo de disolvente y es independiente de la naturaleza del soluto, dentro de los requisitos generales de no volatilidad y no disociación en iones. (Burns Ralph, 2003) 31 2.8. CARAMELO Al revisar definiciones de varios autores entre ellos el más importante Formoso (1999), se ha concluido que el caramelo es un producto de consistencia sólida o semisólida que se forma al mezclar principalmente agua y azúcar. En su formulación pueden existir aditivos siempre y cuando sean permitidos como: saborizantes, preservantes y sustancias que mejoren la textura del producto. Sirve para realizar una gran variedad de confites dependiendo del punto en que se encuentre. Para cada tipo de caramelo el jarabe debe alcanzar un punto crítico de calentamiento. También, si se alcanza el estado liquido viscoso se puede emplear como revestimiento de moldes en los que se van a elaborar postres. Para aromatizar cremas pasteleras, helados, pasteles, y como recurso para eliminar sabores amargos. 2.8.1. DEFINICIÓN DE NORMA INEN Caramelos: Son productos de consistencia sólida o semisólida que se obtienen del cocimiento de un almíbar de azúcares y agua, y que pueden contener o no otras sustancias y aditivos alimenticios permitidos. 2.8.2. CLASIFICACIÓN POR SU FORMA Formoso (1999), considera que los caramelos duros pueden llegar a tener su más común estructura que es la cristalina dependiendo de que el azúcar de donde parte sea un cristal pero también puede obtener estructuras amorfas o no cristalinas. Los caramelos con estructuras amorfas pueden llegar a formarse por una disminución de temperatura por debajo del punto de fusión y sometiendo al producto a una evaporación del agua contenida en el mismo. 32 2.8.3. FUNCIÓN DE MATERIAS PRIMAS EN LA ELABORACIÓN DE CARAMELOS. Según Formoso (1999), cada materia prima tiene una función en la realización de caramelo duro: AZUCAR DE CAÑA: Se usa el azúcar de tipo refinado, también es posible utilizar azúcar morena siempre y cuanto se utilice un blanqueador. Los productos de confitería están elaborados a partir de azúcar, la cual puede presentarse en diferentes estados: cauchoso, vítreo o cristalino. Generalmente se usa azúcar cristalina. Se utilizo para todos los experimentos azúcar blanca granulada, la que según el estudio “Determinación de la Temperatura Vítreo de Transición en Caramelos Duros”, realizado en la Escuela Politécnica del Litoral debe cumplir con los requerimientos Físico químicos mostrados en la tabla 5. Tabla 5. Índices Físico- Químicos del Azúcar de Caña ANÁLISIS RESULTADO Polarización Humedad Color Sólidos Solubles Azúcares Reductores Tamaño de grano TAMIZ 20 TAMIZ 25 TAMIZ 30 TAMIZ 35 TAMIZ 40 Base 99,75 ° S 0,03% 180,02 UMA 53,57 PPM 0,04% 15,74 36,2 56,16 76,74 88,71 100 (Cedeño, 2005) 33 GLUCOSA: Generalmente se la usa para controlar la recristalización de los productos terminados, ya que le da una textura más homogénea, le da transparencia y le regula el nivel de dulzura de la mezcla. Se encuentra de forma natural en la uva, la miel y en el maíz. El jarabe de glucosa se logra por la hidrólisis del almidón de maíz. El jarabe de glucosa tiene algunas funcionalidades en el caramelo: se reemplaza de un 20 a un 30 % de sacarosa con la finalidad de mejorar la consistencia, obtener la textura óptima del producto final, y evitar la cristalización. Además, es más económico que la sacarosa. En la realización del toffee, el jarabe de maíz o glucosa aporta una característica anti cristalizante. El jarabe de maíz tiene cadenas largas de moléculas de glucosa que no permiten a las moléculas de sacarosa cristalizar el jarabe del toffee. La glucosa permitida para utilizarla en caramelos debe poseer las especificaciones Físico químicas expuestas en la Tabla 6. Tabla 6. Especificaciones Físico- Químicas de la Glucosa utilizada Especificación Color y Transparencia: Dextrosa Equivalente: Tipo de Hidrólisis Aspecto: Poder edulcorante: Punto de fusión: Resultado Glucosa Des ionizada. “DE” 37 - 44 Obtenida por hidrólisis ácida o enzimática de una materia amilácea. Viscoso, Incoloro. 0,5 (la mitad que la sacarosa) 100-110°C. (Hoja Técnica de Glucosa de la Casa del Químico, 2011) AGUA: La cantidad de agua no debe ser excesiva ya que se dará un excesivo cocimiento, ni escasa ya que se puede generar la formación de “Núcleos” o “Semillas” de sacarosa que se traducen en cristalización incipiente que afecta la estabilidad de los productos de 34 Confitería. Se podría generalizar el porcentaje de agua para caramelos entre un 20 y un 25% del peso del azúcar. Por lo que la concentración de sólidos que se obtenga sea de un 75% a 80% de sólidos. ACIDULANTES: Estos aditivos son utilizados con la finalidad de alargar la vida útil del producto y hacer más notorios ciertos sabores. Los ácidos más utilizados son: el Ácido Cítrico, Málico, Tartárico y Láctico COLORANTES Y SABORIZANTES: Son muy importantes ya que son los que generan las tendencias y modas en el consumo. Los colorantes se agregan en solución, preferentemente en dilución con glicerina o propilenglicol. También existen colorantes ya listos para adicionarlos directamente al caramelo. Por otro lado los saborizantes se adicionan al momento que el jarabe sale del fuego, posteriormente al cocimiento, con la finalidad de evitar su alteración o pérdida de sabor por efecto de la temperatura. BLANQUEADOR DEL AZÚCAR: En el caso de que el azúcar se utilice sea morena, se puede añadir blanqueador. Este producto no solo blanquea el jarabe, sino también colabora en que el caramelo se mantenga seco. MANTEQUILLA: En la composición del toffee, la mantequilla también actúa como un agente que no permite la cristalización del jarabe. Sus proteínas son las que impiden la cristalización CREMA DE LECHE: Es una sustancia emulsionada de consistencia grasa y tonalidad blanquecina que se obtiene de la leche. Lo que permite en el proceso del toffee es generar una inestabilidad a la cristalización y lo más importante es darle una textura suave y un gran sabor. 35 2.9. CARAMELO DURO Según Formoso (1999) y reuniendo concepto de otros autores, el caramelo duro es aquel producto que se logra a partir de una masa evaporada de azúcar cristalizada y glucosa a la cual se la evapora hasta obtener una alta concentración de sacarosa, se la moldea y enfría. De este modo toma la textura dura y poco viscosa. Adicionalmente al caramelo duro se añade productos como: ácido cítrico, colorante, saborizante y en algunos casos rellenos a base de frutas y licores. La humedad residual de los caramelos duros es de máximo 3% y la óptima entre 2.5 - 3.0 %. Si se logra valores mayores de humedad se genera alteraciones en la vida útil del producto. Figura 11. Caramelo Duro (Blogsfarm, 2011) 2.9.1. CARACTERÍSTICAS Según Formoso (1999), existen recomendaciones técnicas para obtener un caramelo duro de calidad: • Se debe procurar usar el menor tiempo posible en la cocción con la finalidad de obtener caramelos blancos, secos y firmes. Para esto se debe aumentar la llama. • La forma de comprobar sensorialmente que el caramelo ha llegado a su punto óptimo es tomando muestras del jarabe con un pequeño utensilio, esperar que enfríe y llevar a la boca. Si el caramelo no se pega a los dientes, la cocción puede terminar. 36 2.9.2. DEFINICIÓN DE NORMA INEN Caramelos Duros: Son productos elaborados a base de azúcar en forma de almíbar, que obtienen una consistencia sólida y quebradiza al enfriarse 2.9.3. REQUISITOS ESPECÍFICOS La mayoría de los requerimientos específicos se han definido en base a la norma INEN para productos de confitería, las temperaturas de calentamiento se han obtenido del portal especializado en caramelos (Candymaking, 2011). Los niveles de sacarosa del caramelo duro alcanzan el 90 - 92 % máximo, si se obtiene valores mayores no será posible manipular al caramelo ni someterlo a etapas posteriores como relleno y moldeo. El almíbar debe alcanzar la fase de bola dura que se encuentra en las temperaturas (250 y 265) °F a nivel del mar. Para la altitud de la Planta Piloto de Alimentos el rango de temperatura en grados centígrados será: (110- 119) ° C. La densidad que generalmente se obtiene con la formulación de la planta es de 38 ° Baumé. La humedad residual de los caramelos duros es de máx. 2.5 - 3.0 %, y valores mayores en esta alteran la vida de anaquel de estos productos. 2.9.4. REQUISITOS TÉCNICOS Tabla 7. Requisitos Técnicos Obligatorios para Caramelo Duro Requisito Humedad, % Sacarosa, % Azúcares Reductores Totales, % Dióxido de Azufre, mg/kg Contenido Máximo 3.0 90.0 23.0 15.0 Método de Ensayo NTE INEN 265 NTE INEN 266 NTE INEN 274 (INEN, 2011) 37 2.9.5. CARACTERÍSTICAS DE LA SACAROSA PARA CARAMELO DURO Según Charley Helen (1991), el caramelo duro requiere del uso de la sacarosa en gran porcentaje, ya que la solución es una solución saturada de azúcar. Aportando en el caramelo el cuerpo y dureza característicos de este tipo de productos, además del nivel de dulzura. Se debe usar el azúcar refinado para optimizar la transparencia del producto. Las características del caramelo que dependen directamente del azúcar son las siguientes: Color y transparencia Ph y acidez Contenido de impurezas Cenizas y proteína Presencia de azúcar invertido 2.9.6. TEMPERATURA VÍTREO DE TRANSICIÓN Según Cedeño M. y Cornejo F. (2005), los caramelos duros generalmente son productos estables por tener un bajo contenido de agua (w). Es importante obtener un producto poco higroscópico, ya que de no darse esta condición, se lograría un caramelo muy poco estable y pegajoso. En un estudio acerca de la determinación de la temperatura vítreo de transición en caramelos duros, identificamos que el estado de los caramelos duros es el llamado vítreo, pero, si alguno de los procesos como: temperatura o contenido de humedad en el producto varían, esto causaría alcanzar el estado cauchoso, es decir habría una transición de fases provocando cambios físico-químicos importantes. (Cedeño M, 2005) 38 Según Cedeño M. (2005), la temperatura a la cual se da la transición en la región amorfa entre el estado vítreo y el cauchoso se denomina temperatura vítreo de transición. Esta transición es una propiedad única de la porción amorfa de un sólido. Las estructuras amorfas poseen una temperatura vítreo de transición baja, por lo que se encuentran en un estado estable. Por encima de la temperatura vítreo de transición el agua se incrementara, su viscosidad bajara y por lo tanto el producto empezara a desarrollar una pegajosidad no característica del mismo. 2.10. CARAMELO KRAMEL Al revisar definiciones de varios autores entre ellos el más importante Formoso (1999), se ha concluido que el caramelo Kramel es aquel confite que se obtiene mediante la reacción bioquímica entre el azúcar y la proteína de la crema de leche a temperaturas altas llamada la reacción de Maillard, es un caramelo con delicioso sabor y suave textura. Figura 12. Caramelo con Reacción de Maillard (Kramel, 2007) 2.10.1. REQUISITOS ESPECÍFICOS La mayoría de los requerimientos específicos se han definido en base a la norma INEN para productos de confitería, las temperaturas de calentamiento se han obtenido del portal especializado en caramelos (Candymaking, 2011). 39 Alcanzar la denominada fase de la bola maleable o semidura (240° F245°F) a nivel del mar y (108- 110 °C) a la altitud de la Planta de Alimentos UTE. Su color es el denominado tostado, ya que se lo obtiene en base a la Reacción de Maillard Obtener una concentración de 65% de Azúcar Obtener una densidad de 35° Bé Para comprobar que el caramelo ha alcanzado su punto óptimo de cocción se debe colocar al jarabe en agua fría, se produce una bola firme semidura. 2.10.2. PUNTOS CRÍTICOS DE CONTROL Alcanzar la ebullición del jarabe aproximadamente a 90°C Obtener la temperatura del proceso a 240- 245°F Tiempo de enfriamiento del caramelo (30 min) 2.10.3. REQUISITOS TÉCNICOS Tabla 8. Requisitos Técnicos Obligatorios para Caramelo Kramel Contenido Contenido Método de Requisito Mínimo Máximo Ensayo Humedad, % 4.0 10.0 NTE INEN 265 Sacarosa, % - 65.0 NTE INEN 265 Azúcares Reductores Totales, % - 22.0 NTE INEN 266 Grasa Total, % 3.0 - NTE INEN 265 Dióxido de Azufre, mg/kg - 15.0 NTE INEN 274 (INEN, 2011) 40 2.10.4. REACCIÓN DE MAILLARD De acuerdo con Saldaña Ernesto, (2011), la Reacción de Maillard es la glucosilación no enzimática de proteínas, es decir, una modificación proteínica que se produce por el cambio químico de los aminoácidos que las constituyen. A esta reacción también se la puede definir como la caramelización de los alimentos que busca dar a los mismos el color tostado. La Reacción de Maillard se da cuando las azúcares y las proteínas presentes en los alimentos reaccionan químicamente al someterlos a altas temperaturas. Según Zavala José (2009), cuando los compuestos nitrogenados conteniendo grupos amino (--NH2) reaccionan con los azúcares reductores, se forma toda una serie de sustancias, que si bien son incoloras por sí, pronto se polimerizan formando compuestos de marcada coloración. El calor y el pH elevado (por encima de 7) aceleran la reacción. Por otro lado, Zavala José (2009), asegura que esta interesante reacción, cuyo mecanismo no es aún totalmente conocido, ha sido la causa de graves problemas en la tecnología alimenticia donde se hallan presentes en medio alcalinos, proteínas, azúcares y calor. Según Saldaña Ernesto (2011), la reacción de Maillard deriva en moléculas cíclicas y policíclicas, en el primer caso se podría nombrar como ejemplo a la unión de los azúcares monosacáridos a causa de la pérdida de una molécula de agua para formar un nuevo tipo de azúcar disacárido (azúcares dobles como podría ser la sacarosa, la maltosa, etc.), en el segundo caso serían proteínas de bajo peso molecular que inciden en la síntesis de otras proteínas. Algunas de estas reacciones son responsables de aportar a los alimentos cocinados el característico sabor y aroma. (ZavalaJosé, 2009) 41 De acuerdo con Saldaña Ernesto (2011), la reacción de Maillard permite a moléculas simples como carbohidratos y proteínas derivar a moléculas cíclicas y policíclicas. El médico y Químico Camille Maillard, logró definir la reacción, fue uno de los pioneros de la denominada “Gastronomía Molecular”, esto quiere decir que se genera resultados organolépticos a partir de reacciones químicas y físicas al momento de la cocción de los mismos. El químico generó el pigmento marrón, de la reacción de un grupo de aminoácidos con un grupo carbonilo de los azúcares. A parte del carbono, hidrógeno y oxígeno, se pueden añadirse átomos de azufre o nitrógeno esto gracias a los aminoácidos. Dándonos a entender que cada alimento posee su propia Reacción de Maillard. Según Zavala José (2009), también existen excepciones en esta reacción, ya que, para que se obtenga resultados de pardeamiento, aromas y colores con alimentos cocidos en medios como el agua, se debe realizar cocciones prolongadas y tomar en cuenta que en ello intervienen factores como las condiciones alcalinas, el contenido en hidratos de carbono y el contenido en aminoácidos. Según Saldaña Ernesto (2011), esta reacción es la responsable del color del pan, el color tostado de las galletas, del color de la cerveza influyendo en el proceso de malteado de los granos de cebada. El caramelo Kramel es otro ejemplo de alimento obtenido con esta reacción, ya que en su composición posee la proteína de la leche y obviamente los azúcares que permiten que se realice. Un ejemplo de compuestos que contienen grupos amino que cita Zavala José (2009) en su estudio, son los aminoácidos o componentes simples de las proteínas como los péptidos. 42 2.11. TOFFEE DE VAINILLA Según Formoso (1999) y otros autores, se ha concluido que el Toffee de vainilla es un caramelo blando cremoso que tiene como ingrediente diferenciado la mantequilla o la leche, estos componentes le otorgan una textura blanda y masticable. Además posee un delicioso sabor. Para obtener las características organolépticas del toffee se debe alcanzar unos grados menos que la fase de bola dura. Por esta razón y por la presencia de mantequilla en la composición, se alcanza una consistencia blanda pese a que la temperatura que se obtiene es un poco menor a la fase de bola dura. Figura 13. Toffee de Vainilla (Dairy, 2011) 2.11.1. REQUISITOS ESPECÍFICOS La mayoría de los requerimientos específicos se han definido en base a la norma INEN para productos de confitería, las temperaturas de calentamiento se han obtenido del portal especializado en caramelos (Candymaking, 2011). El toffee de vainilla debe alcanzar la fase de bola meleable, la temperatura de proceso que se debe obtener a nivel del mar se encuentra entre 245°F-250° F y a la altitud de la Planta Piloto UTE se debe alcanzar 108- 110 °C. La humedad permitida se encuentra entre 4 a 10%. 43 La textura del toffee tiene que ser suave pero no debe desprenderse en los dedos, debe deshacerse en los dientes y no debe pegarse. En esta fase la concentración de azúcar alcanza un 65% de azúcar y 35° Baumé. El color del caramelo es tostado. El porcentaje de lactosa es de mínimo 3%. El porcentaje de grasa total es de mínimo 3%. El porcentaje de grasa láctea es del 2%. El porcentaje de proteína mínimo es de 2.5%. Para comprobar que se llegó al punto exacto, se debe llenar un vaso de agua fría, se deja caer una pequeña cantidad de la mezcla en el vaso, y si se endurece y formar una textura dura, entonces se ha obtenido un caramelo de calidad. 2.11.2. PUNTOS CRÍTICOS DE CONTROL Alcanzar la ebullición del jarabe aproximadamente a 90°C. Obtener la temperatura de proceso de 245-250°F Tiempo de enfriamiento (30 min) 2.11.3. REQUISITOS TÉCNICOS SEGÚN LA NORMA INEN 2 217: 2000 Tabla 9. Requisitos Técnicos Obligatorios para Toffee de Vainilla Requisito Humedad, % Sacarosa, % Azúcares Red. Totales, % Lactosa, % Grasa Total, % Proteína, % (% N x 6,38) Contenido Mínimo 4.0 3.0 3.0 2.5 Contenido Máximo 10.0 65.0 22.0 - Método de Ensayo NTE INEN 265 NTE INEN 266 (INEN, 2011) 44 2.12. MASMELO- MARSHMALLOWS Al revisar definiciones de varios autores entre ellos el más importante Formoso (1999), se ha concluido que el masmelo es un producto de confitería que tiene como base: azúcar y goma. Generalmente se utiliza gelatina sin sabor. Tiene un sabor muy agradable, una textura esponjosa, muy ligero y de color blanco .Este tipo de confite tiene su acabado en un fondo de azúcar impalpable que sirve para aislarlos y a mantenerlos separados. Adicionalmente se le puede añadir un producto espumante para tener mayor esponjosidad. Figura 14. Marshmallow (Bigoven, 2011) 2.12.1. REQUISITOS ESPECÍFICOS La mayoría de los requerimientos específicos se han definido en base a la norma INEN para productos de confitería, las temperaturas de calentamiento se han obtenido del portal especializado en caramelos (Candymaking, 2011). El almíbar del masmelo debe ser de hilo fuerte, esto quiere decir que debe alcanzar una temperatura de 103-110 ◦C a la altura de la Planta Piloto de Alimentos UTE. La humedad máxima permitida es de 4 a 10% El porcentaje de azúcar debe ser de un 50% Debe poseer un color banquecino Debe ser masticable y no debe pegarse en los dientes 45 La forma de identificar si el jarabe está listo es tomando con una espátula una pequeña cantidad de jarabe y tratando de escribir sobre una superficie plana. Si se puede escribir se ha alcanzado el punto de letra y está listo el jarabe. Otra forma es cuando al tomar un poco de almíbar entre la yema de los dedos y, al separarlos se forma un hilo fuerte que no se rompe. 2.12.2. PUNTOS CRÍTICOS DE CONTROL Alcanzar la ebullición del jarabe aproximadamente a 90°C. Obtener la temperatura de proceso 103-110°C. Tiempo de enfriamiento (30 min) 2.12.3. REQUISITOS TÉCNICOS Tabla 10. Requisitos Técnicos Obligatorios para Masmelos Contenido Contenido Requisito Mínimo Máximo Humedad, % mlm 4.0 10.0 (ICONTEC, 2007) 46 2.13. GOMAS Al revisar definiciones de varios autores entre ellos el más importante Formoso (1999), se ha concluido que las gomiolas se obtienen de soluciones concentradas de azúcar y a los que se incorpora un gelificante que puede ser la grenetina o gelatina. El producto base contiene todavía entre un 20 y un 30% de agua que se evapora durante el proceso de cocción, la masa es dulce, pegajosa y no tiene color. Su aspecto final puede ser abrillantado o azucarado. Figura 15. Gomas Comestibles (Blogsfarm, 2011) 2.13.1. REQUISITOS ESPECÍFICOS La mayoría de los requerimientos específicos se han definido en base a la norma INEN para productos de confitería, las temperaturas de calentamiento se han obtenido del portal especializado en caramelos (Candymaking, 2011). La temperatura de proceso que se debe obtener para la realización de gomas comestibles es la denominada: Fase de Hebra y Perla, para lo que se debe obtener una temperatura de 103 a 110°C. La humedad máxima permitida es de 10 a 25% El porcentaje de azúcar debe ser de un 50% Debe poseer una textura suave, esponjosa, masticable y no se debe pegar en los dientes Debe tener un sabor agradable La forma de identificar si el jarabe está listo es cuando vierte una pequeña porción en un vaso con agua fría y la gotita del jarabe al llegar al fondo mantiene su forma 47 2.13.2. PUNTOS CRÍTICOS DE CONTROL Alcanzar la ebullición del jarabe aproximadamente a 90°C. Obtener la temperatura de proceso 103-110°C. 2.13.3. REQUISITOS TÉCNICOS Tabla 11. Requisitos Técnicos Obligatorios para Gomas Contenido Método de Requisito Máximo Ensayo Humedad, % 3.0 NTE INEN 265 Pérdida de peso por rozamiento, % 10.0 Dióxido de azufre, mg/kg 15.0 NTE INEN 266 (INEN, 2011) 48 3. METODOLOGÍA 3. METODOLOGÍA La presente investigación se llevó a cabo en la Planta Piloto de Alimentos de la Universidad Tecnológica Equinoccial que se encuentra ubicada a 2944 msnm. La altitud fue un parámetro fundamental en esta investigación. 3.1. FORMULACIONES EXPERIMENTALES Para la obtención experimental de las muestras de caramelo en el presente estudio se utilizó las formulaciones aplicadas en la Planta de Alimentos UTE (Formoso, 1999). Tabla 12. Formulación de caramelos duros, blandos, masmelos y gomas Caramelo duro Caramelo blando Masmelo Con Sin glucosa glucosa (%) (%) Materia Prima F. 1 (%) F. 2 (%) F. 3 (%) Kramel (%) Toffee (%) Gomas (%) Azúcar 60 60 50 35.5 40 25 64 43 Agua 20 15 30 - - 53 32 28 Glucosa Crema de Leche 20 25 20 18 19.5 17 - 21 - - - 35.5 40 - - - Mantequilla - - - 10 - - - - Vainilla - - - 1 0.35 1.3 2 - Sal - - - - 0.15 0.2 0.25 - Gelatina - - - - - 3.5 1.75 8 (Formoso, 1999) 49 3.2. DETERMINACIÓN DE RANGOS DE TEMPERATURA DE PROCESO A 2944 m.s.n.m. Según Formoso (1999); Charles Helen (1991), los rangos de temperaturas de proceso para la elaboración de caramelos están determinados a nivel del mar; por tanto; fue necesario obtener los rangos de temperatura a 2944 metros (9656.32 pies), considerando el comportamiento similar al del punto de ebullición del agua, donde se considera que por cada 500 pies de altura se debe disminuir aproximadamente 1 grado Fahrenheit, mediante la relación: 𝑇() = 𝑇𝑜 − 500 6 Donde: h= Altitud de trabajo expresada en pies T(h)= Temperatura de proceso a la altitud de trabajo expresada en grados Fahrenheit. To= Temperatura de proceso a nivel del mar expresada en grados Fahrenheit. A partir de la temperatura obtenida mediante este cálculo se adicionó una temperatura superior y una inferior con la finalidad de identificar cual fue la temperatura de proceso que mejor cumple con los requerimientos de calidad de los caramelos. 3.3. PROCEDIMIENTO DE EXPERIMENTACIÓN Los datos experimentales se obtuvieron siguiendo los procedimientos de elaboración de cada tipo de confites obtenidos de Formoso (1999) y Candymaking (2011), que se encuentran detallados a continuación: 50 3.3.1. CARAMELO DURO Homogenizar el azúcar y el agua Colocar la mezcla en un pozuelo de aluminio Someter a calor a la muestra hasta ebullición (aproximadamente 90°C). Incorporar la glucosa y mezclar hasta que homogenice (aproximadamente 90°C). Concentrar la mezcla hasta alcanzar las temperaturas de proceso del caramelo duro (119, 120, 121°C). Someter a frío. Troquelar. 3.3.2. CARAMELO KRAMEL Someter a calor a todos los componentes excepto la mantequilla y la vainilla. Añadir la mantequilla y mezclar Someter a calor a la muestra hasta ebullición (aproximadamente 90°C). Incorporar la glucosa y mezclar hasta que homogenice (aproximadamente 90°C). Concentrar la mezcla hasta alcanzar las temperaturas de proceso del caramelo kramel (106, 107 y 108°C). Someter a frío (30 minutos). Troquelar. 51 3.3.3. TOFFEE DE VAINILLA Homogenizar el 50% de la crema de leche, la glucosa, la sal y el azúcar. Someter a ebullición (aproximadamente 90°C) por 10 minutos. Incorporar el 50% de la crema de leche lentamente para que no reduzca la temperatura de la mezcla y no deje el hervor. Concentrar la mezcla hasta alcanzar las temperaturas de proceso del toffee (108,109 y 110°C). Someter a frío. Agregar vainilla Troquelar. 3.3.4. MASMELOS 3.3.4.1. Masmelo sin glucosa Homogenizar el azúcar y el agua Colocar la mezcla en un pozuelo de aluminio Concentrar la mezcla hasta alcanzar las temperaturas de proceso del masmelo (103, 105, 107°C). Hidratar la gelatina por 5 minutos e incorporar la esencia, la sal y el 50% del agua. Incorporar la mezcla en la gelatina hidratada Mezclar hasta obtener una sustancia blanquecina Moldear y someter a frío por una hora. Troquelar. 52 3.3.4.2. Masmelo con glucosa Homogenizar el azúcar y el agua Someter a ebullición (aproximadamente 90°C) Incorporar la glucosa a la mezcla. Concentrar la mezcla hasta alcanzar las temperaturas de proceso del masmelo (103, 105, 107°C). Hidratar la gelatina por 5 minutos e incorporar la esencia, la sal y el 50% del agua. Incorporar la mezcla en la gelatina hidratada Mezclar hasta obtener una sustancia blanquecina Moldear y someter a frío por una hora. Troquelar. 3.3.5. GOMAS COMESTIBLES Humectar la gelatina con el 50% del agua por 30 minutos. Homogenizar el azúcar y el 50% del agua. Someter a ebullición (aproximadamente 90°C) Incorporar la glucosa Concentrar la mezcla hasta alcanzar las temperaturas de proceso de las gomas (103, 104 y 105°C). Incorporar la gelatina hidratada en el almíbar obtenido Homogenizar la mezcla. Someter a frío hasta obtener textura de goma Troquelar 53 3.4. OBTENCIÓN DE DATOS EXPERIMENTALES 3.4.1. OBTENCIÓN DE TEMPERATURAS DEL JARABE DE CARAMELO. Se registraron los datos a partir de que el jarabe alcanzó la ebullición, a este punto lo denominamos “tiempo 0”. Posteriormente se puso en marcha al cronómetro y se registró los datos de temperatura que alcanzó el jarabe cada dos minutos. De esta manera los datos de tiempo se registrarán en minutos como: (t0, t2, t4, t6, t8) y para temperatura en °C como: (T0, T2, T4, T6, T8). 3.4.2. OBTENCIÓN DE DATOS DE SÓLIDOS SOLUBLES DEL JARABE De la misma manera, en los tiempos: (t0, t2, t4, t6, t8), se obtuvo una muestra de jarabe. Posteriormente se dejó en reposo las muestras para que lleguen a una temperatura menor a 20°C. Mediante el brixómetro se determinó la concentración de sólidos solubles del jarabe. Se repitió este proceso por triplicado para cada muestra. 3.4.3. DETERMINACIÓN DE ACTIVIDADES DE AGUA DE LOS JARABES EN EL PROCESO Para obtener los datos de actividad de agua, se utilizó los datos de sólidos solubles para definir la fracción molar de la solución relacionada a cada muestra. Posteriormente se encontró la presión de vapor de la solución de cada muestra mediante la ecuación 5 relacionada a la Ley de Raoult. Se utilizó la ecuación 2 y se obtuvo las actividades de agua de los jarabes en proceso. 54 3.5. OBTENCIÓN DE GRÁFICAS EXPERIMENTALES Y ECUACIONES DE CALENTAMIENTO Se realizó una grafica que relaciona las variables: sólidos solubles y actividad de agua en función de la temperatura para cada caramelo. Se obtuvo la ecuación de la tendencia y el factor de correlación de las gráficas. 3.6. DETERMINACIÓN DE DATOS MEDIANTE LA TENDENCIA DE LA CURVA Utilizando las ecuaciones obtenidas de las gráficas entre Temperatura- Sólidos Solubles y Temperatura- Actividad de Agua, se reemplazó la variable X con las temperaturas de proceso de caramelo para 2944 m.s.n.m. Se repitió para cada caramelo. De esta manera se obtuvieron los datos de actividad de agua y sólidos solubles. Se identificó cual temperatura generó una muestra con mejores resultados de sólidos solubles y humedad relacionándolos a la norma INEN 2 217. 3.7. ANÁLISIS DE HUMEDAD Según el Instituto de Normalización Ecuatoriano (1978), se determinó la humedad de las muestras relacionadas a cada temperatura. El análisis utilizado es el que se encuentra descrito en la norma INEN 265. 3.8. PROCESAMIENTO ESTADÍSTICO DE LOS DATOS Se experimentó con tres temperaturas diferentes para cada caramelo y por triplicado. El factor determinante fue la temperatura de proceso que varía 55 dependiendo del tipo de caramelo, y tres variables dependientes que fueron: el porcentaje de humedad, el porcentaje de sólidos solubles, y la actividad de agua del jarabe. Al poseer un solo factor se utilizó un Diseño Unifactorial completamente al azar y se obtuvo la diferencia mínima significativa (LDS) de los datos con la finalidad de conocer si existen diferencias entre ellos. Posteriormente se realizó un diseño multifactorial para caramelo duro y masmelo por poseer la formulación como segundo factor. Los factores del diseño fueron: temperatura y formulación, y las variables dependientes fueron: sólidos solubles, actividad de agua y porcentaje de humedad. Se trabajó por triplicado con tres temperaturas diferentes para cada caramelo, con 3 formulaciones para caramelo duro y 2 para masmelo. Para el procesamiento estadístico de los datos se utilizó el software de cómputo Statgraphics Centurion XV (Versión 1.0). Mediante esta herramienta se obtuvieron las diferencias mínimas significativas entre los tratamientos. 56 4. RESULTADOS Y DISCUSIÓN 4. RESULTADOS Y DISCUSIÓN En el presente capítulo se describen los resultados de acuerdo a la metodología antes explicada. Los resultados obtenidos se basan en los requerimientos técnicos establecidos en la NORMA INEN 2 217 relacionada a confites. 4.1. RANGOS DE TEMPERATURA DE PROCESO A 2944 m.s.n.m. La Tabla 13 muestra las temperaturas de proceso que se utilizaron para la experimentación; estas temperaturas son las correspondientes a 2944 m.s.n.m. de altitud. También muestra las temperaturas que se usan a nivel del mar para identificar la influencia de la altitud en el lugar de trabajo. Tabla 13. Rangos de temperatura a 0 m.s.n.m. y a 2944 m.s.n.m. Tipo de caramelo Temperaturas de proceso a nivel del mar (°F) Temperaturas de proceso a nivel del mar (°C) Caramelo Duro 265-270 129- 132 Caramelo Kramel 240-245 115,5- 118 Toffee 245-250 118- 121 Masmelo 235-245 113- 118 Gomas 235-240 113- 115,5 Temperaturas de proceso a 2944 m (°C) 119 120 121 106 107 108 108 109 110 103 105 107 103 104 105 57 4.2. DATOS EXPERIMENTALES Tabla 14. Resultados de concentración y actividad de agua en función de la temperatura para cada tipo de caramelo t °T °Bx (°C) (°Bx) (min) R1 R2 R3 R1 R2 R3 R1 0 90.0 90.0 90.0 60.0 60.0 60.0 0.927 2 93.0 93.2 93.3 61.4 61.5 63.0 0.923 Caramelo 4 95.0 96.3 96.9 63.2 63.2 64.8 0.917 Duro 1 6 97.3 98.0 98.9 65.6 65.5 67.2 0.909 8 99.4 100.0 100.0 67.6 67.7 68.6 0.901 0 90.1 90.2 90.0 60.0 60.0 60.2 0.927 2 93.0 93.1 93.1 62.0 63.1 63.2 0.921 Caramelo 4 95.6 95.3 95.8 64.2 65.2 65.4 0.914 Duro 2 6 97.0 97.3 97.2 65.8 66.4 66.3 0.908 8 99.3 99.2 99.0 67.2 67.0 68.0 0.903 0 90.0 90.0 90.0 62.0 61.8 61.0 0.921 2 94.1 93.5 92.4 64.3 64.0 62.9 0.913 Caramelo 4 95.0 96.0 95.0 66.2 66.0 64.4 0.907 Duro 3 6 97.0 97.3 98.0 67.5 67.1 66.7 0.901 8 100.0 100.5 100.0 69.0 69.3 68.0 0.895 0 90.0 90.0 90.0 50.0 51.0 49.2 0.950 2 92.5 92.1 92.3 52.0 53.0 50.1 0.946 Caramelo 4 94.6 93.9 94.3 54.0 54.2 51.5 0.942 Kramel 6 96.3 95.8 96.0 55.0 56.2 54.3 0.940 8 98.3 98.6 98.4 57.1 57.6 56.7 0.935 0 90.0 90.0 90.0 50.5 50.0 51.0 0.949 2 91.4 91.8 92.3 51.5 51.0 52.4 0.947 4 93.8 93.9 94.2 53.0 52.9 54.3 0.944 Toffee 6 96.2 96.2 96.2 55.2 55.2 56.1 0.939 8 98.2 98.3 98.4 56.6 56.1 57.0 0.936 0 90.0 90.0 90.3 30.0 31.0 31.0 0.978 2 92.3 92.5 92.3 33.0 34.0 33.5 0.975 Masmelo 4 94.5 94.2 94.2 35.4 35.8 36.0 0.972 con 6 96.4 96.2 96.5 38.2 37.5 38.0 0.968 Glucosa 8 98.6 98.6 98.4 41.0 41.8 41.3 0.965 Aw (Aw) R2 0.927 0.922 0.917 0.909 0.901 0.927 0.917 0.910 0.906 0.903 0.922 0.914 0.907 0.903 0.894 0.948 0.944 0.941 0.937 0.933 0.950 0.948 0.944 0.939 0.937 0.977 0.974 0.971 0.969 0.964 R.3 0.927 0.918 0.912 0.903 0.897 0.926 0.917 0.910 0.906 0.899 0.924 0.918 0.913 0.905 0.899 0.951 0.950 0.947 0.941 0.936 0.948 0.945 0.941 0.937 0.935 0.977 0.974 0.971 0.969 0.964 58 t (min) Masmelo sin Glucosa Gomas 0 2 4 6 8 0 2 4 6 8 R1 90.0 92.2 94.2 96.0 98.6 90.0 93.0 95.0 97.0 99.0 °T (°C) R2 90.0 91.9 94.1 96.3 98.2 90.0 92.0 94.5 97.0 99.0 R3 90.6 92.7 94.5 96.4 98.6 90.0 93.0 95.0 96.8 99.2 R1 33.0 36.2 37.8 40.0 41.0 39.4 41.5 43.0 44.8 46.0 °Bx (°Bx) R2 31.0 33.0 35.0 38.0 40.1 37.4 39.0 41.9 44.2 45.0 R3 R1 30.0 0.975 31,4 0.971 33.0 0.969 34.8 0.966 37.0 0.965 32.0 0.967 35.5 0.964 39.0 0.962 41.0 0.959 43.4 0.957 Aw (Aw) R2 0.977 0.975 0.972 0.969 0.966 0.970 0.967 0.963 0.960 0.959 R.3 0.978 0.976 0.975 0.973 0.970 0.976 0.972 0.967 0.965 0.961 Utilizando los datos de sólidos solubles, humedad y actividad de agua descritos en la tabla 14 se realizaron las gráficas de evaporación de los jarabes a 2944 msnm explicadas a continuación. 59 4.3. GRÁFICAS EXPERIMENTALES Y ECUACIONES DE EVAPORACIÓN DE JARABES A 2.944 msnm. 4.3.1. CARAMELO DURO 1 4.3.1.1. Efecto de la temperatura sobre el porcentaje de sólidos solubles del caramelo duro 1 90 80 Sólidos Solubles (°Brix) 70 y = 0,8172x - 14,001 R² = 0,9987 60 50 40 30 20 10 0 90 92 94 96 98 100 102 104 106 108 110 112 114 116 118 120 122 124 Temperatura (°C) Figura 16. Curva de calentamiento promedio de la tendencia de la relación temperatura- sólidos solubles del caramelo duro 1. La Figura 16 representa la tendencia lineal de la concentración de sólidos solubles en función de la temperatura, lo que permite determinar niveles de concentración en el caramelo duro 1 utilizando la ecuación que relaciona las variables. 60 4.3.1.2. Efecto de la temperatura sobre la actividad de agua del jarabe 0,940 0,920 Actividad de Agua 0,900 0,880 y = -0,0036x + 1,2421 R² = 0,9974 0,860 0,840 0,820 0,800 0,780 90 92 94 96 98 100 102 104 106 108 110 112 114 116 118 120 122 124 Temperatura (°C) Figura 17. Curva de calentamiento promedio de la tendencia de la relación temperatura- actividad de agua del caramelo duro 1 En la figura 17 se puede identificar que la actividad de agua del caramelo duro 1 tiene un comportamiento descendente, lo que permite identificar los datos del jarabe en el proceso relacionadas a las temperaturas experimentales. 61 4.3.2. CARAMELO DURO 2 4.3.2.1. Efecto de la temperatura sobre el porcentaje de sólidos solubles del Jarabe 90 80 Sólidos Solubles (°Brix) 70 y = 0,7996x - 11,725 R² = 0,9997 60 50 40 30 20 10 0 90 92 94 96 98 100 102 104 106 108 110 112 114 116 118 120 122 124 Temperatura (°C) Figura 18. Curva de calentamiento promedio de la tendencia de la relación temperatura- sólidos solubles del caramelo duro 2 La Figura 18 muestra la tendencia lineal de los grados Brix del caramelo duro 2 en función de la temperatura, y se identifica las concentraciones que alcanzó el jarabe sometiéndolo a las tres temperaturas experimentales. También fue posible obtener la ecuación de esta relación que permite encontrar los grados Brix para la temperatura que sea necesaria. 62 4.3.2.2. Efecto de la temperatura sobre la actividad de agua del jarabe 0,920 0,900 Actividad de Agua 0,880 y = -0,0037x + 1,2418 R² = 0,9982 0,860 0,840 0,820 0,800 0,780 90 92 94 96 98 100 102 104 106 108 110 112 114 116 118 120 122 124 Temperatura (°C) Figura 19. Curva de calentamiento promedio de la tendencia de la relación temperatura- actividad de agua del caramelo duro 2 La Figura 19 representa las actividades de agua en proceso del caramelo duro 2 en función de la temperatura. Se puede identificar que la actividad de agua desciende cada que la temperatura aumenta. La tendencia de esta relación permite obtener los datos relacionados a las temperaturas experimentales. 63 4.3.3. CARAMELO DURO 3 4.3.3.1. Efecto de la temperatura sobre el porcentaje de sólidos solubles del Jarabe 90 80 y = 0,7631x - 7,3989 R² = 0,9993 Sólidos Solubles (°Brix) 70 60 50 40 30 20 10 0 90 92 94 96 98 100 102 104 106 108 110 112 114 116 118 120 122 124 Temperatura (°C) Figura 20. Curva de calentamiento promedio de la tendencia de la relación temperatura- sólidos solubles del caramelo duro 3 La Figura 20 permite identificar la tendencia lineal de la concentración del caramelo duro 3 bajo el efecto de la temperatura, en donde se puede apreciar un comportamiento ascendente que alcanza las concentraciones de sólidos solubles para cada temperatura experimental mediante la ecuación descrita. 64 4.3.3.2. Efecto de la temperatura sobre la actividad de agua del jarabe 0,920 0,900 Actividad de Agua 0,880 0,860 0,840 y = -0,0037x + 1,2365 R² = 0,9974 0,820 0,800 0,780 90 92 94 96 98 100 102 104 106 108 110 112 114 116 118 120 122 124 Temperatura (°C) Figura 21. Curva de calentamiento promedio de la tendencia de la relación temperatura- actividad de agua del caramelo duro 3 La Figura 21 muestra a la actividad de agua del caramelo duro 3 en función de la temperatura de proceso. Este comportamiento tiene una tendencia lineal que permite obtener los datos relacionados a las temperaturas experimentales. 65 4.3.4. COMPARACIÓN ENTRE FORMULACIONES DE CARAMELO DURO 4.3.4.1. Efecto de la temperatura sobre el porcentaje de sólidos solubles Figura 22. Gráfica de la relación temperatura- sólidos solubles que muestra las curvas de tendencia de las medias de los tres tipos de caramelo duro. La Figura 22 representa la relación de los sólidos solubles y la temperatura para las tres formulaciones de caramelo duro, en donde es posible identificar que existe una tendencia lineal muy similar entre las formulaciones. 66 4.3.4.2. Efecto de la temperatura sobre la actividad de agua del jarabe del caramelo duro Figura 23. Gráfica de la relación temperatura- actividad de agua que muestra las curvas de tendencia de las medias de los tres tipos de caramelo duro. La Figura 23 representa la relación entre la temperatura y la actividad de agua de las tres formulaciones de caramelo duro. Es posible identificar que la tendencia es lineal en los tres caramelos y muy similar, sin embargo el caramelo duro 3 alcanza una actividad de agua inferior al alcanzar la temperatura experimental. 67 4.3.5. CARAMELO KRAMEL 4.3.5.1. Efecto de la temperatura sobre el porcentaje de sólidos solubles del jarabe 70 Sólidos Solubles (°Brix) 60 y = 0,7011x - 13,439 R² = 0,9933 50 40 30 20 10 0 90 92 94 96 98 100 102 104 106 108 110 Temperatura (°C) Figura 24. Curva de calentamiento promedio de la tendencia de la relación temperatura- sólidos solubles del caramelo kramel En la Figura 24, se puede identificar la tendencia de la concentración del jarabe del caramelo Kramel en función de la temperatura de proceso. Se obtuvo una ecuación que permite alcanzar los grados Brix relacionados a las temperaturas experimentales. 68 4.3.5.2. Efecto de la temperatura sobre la actividad de agua del jarabe 0,955 0,950 y = -0,0014x + 1,0746 R² = 0,9859 Actividad de Agua 0,945 0,940 0,935 0,930 0,925 0,920 0,915 0,910 0,905 90 92 94 96 98 100 102 104 106 108 110 Temperatura (°C) Figura 25. Curva de calentamiento promedio de la tendencia de la relación temperatura- actividad de agua del caramelo kramel La Figura 25 muestra la relación entre la actividad de agua del caramelo Kramel y la temperatura, en donde se puede identificar que existe un descenso de la actividad de agua al alcanzar los 98°C, esto se da porque se redujo la cantidad de agua del alimento. La tendencia es lineal lo que permitió obtener los datos de actividad de agua relacionados a las temperaturas experimentales. 69 4.3.6. TOFFEE DE VAINILLA 4.3.6.1. Efecto de la temperatura sobre el porcentaje de sólidos solubles del jarabe 70 Sólidos Solubles (°Brix) 60 50 y = 0,6409x - 7,6362 R² = 0,9951 40 30 20 10 0 90 92 94 96 98 100 102 104 106 108 110 112 Temperatura (°C) Figura 26 Curva de calentamiento promedio de la tendencia de la relación temperatura- sólidos solubles del caramelo toffee de vainilla La Figura 26 presenta la concentración de sólidos solubles del caramelo toffee de vainilla en relación de la temperatura, en donde se puede identificar una tendencia lineal ascendente que permitió obtener los grados brix del jarabe cuando fueron sometidos a las temperaturas experimentales. 70 4.3.6.2. Efecto de la temperatura sobre la actividad de agua del jarabe 0,955 0,950 Actividad de Agua 0,945 y = -0,0015x + 1,0832 R² = 0,9938 0,940 0,935 0,930 0,925 0,920 0,915 90 92 94 96 98 100 102 104 106 108 110 112 Temperatura (°C) Figura 27. Curva de calentamiento promedio de la tendencia de la relación temperatura- actividad de agua del toffee de vainilla. La Figura 27 muestra el comportamiento de la actividad de agua del toffee de vainilla al ser influenciada por la temperatura, también se identifica la ecuación que representa la tendencia descendente lineal de esta relación. 71 4.3.7. MASMELO CON GLUCOSA 4.3.7.1. Efecto de la temperatura sobre el porcentaje de Sólidos Solubles del Jarabe 60 Sólidos Solubles (°Brix) 50 40 y = 1,0298x - 62,431 R² = 0,9913 30 20 10 0 90 92 94 96 98 100 102 104 106 108 Temperatura (°C) Figura 28. Curva de calentamiento promedio de la tendencia de la relación temperatura- sólidos solubles del masmelo con glucosa La Figura 28 muestra la tendencia lineal que tienen los sólidos solubles del masmelo con glucosa en función de la temperatura de proceso. La ecuación del comportamiento permitió obtener los datos de grados brix relacionados a las temperaturas experimentales. 72 4.3.7.2. Efecto de la temperatura sobre la actividad de agua del jarabe 0,975 0,970 Actividad de Agua 0,965 y = -0,0017x + 1,1245 R² = 0,9865 0,960 0,955 0,950 0,945 0,940 90 92 94 96 98 100 102 104 106 108 Temperatura (°C) Figura 29. Curva de calentamiento promedio de la tendencia de la relación temperatura- actividad de agua del masmelo con glucosa En la Figura 29 se puede identificar la tendencia lineal de la actividad de agua del masmelo con glucosa en función de la temperatura de proceso. El comportamiento permite obtener las actividades de agua relacionadas a las temperaturas experimentales. 73 4.3.8. MASMELO SIN GLUCOSA 4.3.8.1. Efecto de la temperatura sobre el porcentaje de sólidos solubles del jarabe 50,0 45,0 Sólidos Solubles (°Brix) 40,0 y = 0,8081x - 41,688 R² = 0,9955 35,0 30,0 25,0 20,0 15,0 10,0 5,0 0,0 90 92 94 96 98 100 102 104 106 108 Temperatura (°C) Figura 30. Curva de calentamiento promedio de la tendencia de la relación temperatura- sólidos solubles del masmelo sin glucosa La Figura 30 representa la tendencia del comportamiento entre la concentración de sólidos solubles y la temperatura del jarabe en proceso, se puede identificar que este tipo de masmelo no sobrepasa los cincuenta grados Brix. 74 4.3.8.2. Efecto de la temperatura sobre la actividad de agua del jarabe 0,980 Actividad de Agua 0,975 0,970 y = -0,0012x + 1,0892 R² = 0,9779 0,965 0,960 0,955 90 92 94 96 98 100 102 104 106 108 Temperatura (°C) Figura 31. Curva de calentamiento promedio de la tendencia de la relación temperatura- actividad de agua del masmelo sin glucosa En la Figura 31 se puede identificar el comportamiento de la actividad de agua del masmelo sin glucosa en función de la temperatura, también se identifica la ecuación que representa la tendencia descendente lineal de esta relación. 75 4.3.9. COMPARACIÓN ENTRE FORMULACIONES DE MASMELO 4.3.9.1. Efecto de la temperatura sobre el porcentaje de sólidos solubles Figura 32. Gráfica de la relación temperatura- sólidos solubles que muestra las curvas de tendencia de las medias de los dos tipos de masmelo. La Figura 32 muestra la relación entre las dos formulaciones de masmelo, en donde se puede identificar que pese a tener una tendencia similar al relacionar los grados brix con la temperatura, el masmelo de calidad alcanza concentraciones superiores que el masmelo sin glucosa. Esto podría darse porque se le adiciona otro soluto a la solución. 76 4.3.9.2. Efecto de la temperatura sobre la actividad de agua del jarabe Figura 33. Gráfica de la relación temperatura- actividad de agua que muestra las curvas de tendencia de las medias de los dos tipos de masmelo. La Figura 33 identifica la tendencia lineal que los dos tipos de masmelo tienen al relacionar la actividad de agua y la temperatura. El masmelo con glucosa alcanza una actividad de agua inferior con respecto al masmelo sin glucosa, esto podría darse porque la glucosa le estabiliza a la solución. 77 4.3.10. GOMAS 4.3.10.1. Efecto de la temperatura sobre el porcentaje de sólidos solubles del jarabe 60 Sólidos Solubles (°Brix) 50 y = 0,8828x - 43,364 R² = 0,9992 40 30 20 10 0 90 92 94 96 98 100 102 104 106 Temperatura (°C) Figura 34. Curva de calentamiento promedio de la tendencia de la relación temperatura- sólidos solubles de las gomas La figura 34 representa la tendencia lineal de la concentración de sólidos solubles en función de la temperatura, lo que permite determinar niveles de concentración en las gomas comestibles utilizando la ecuación que relaciona las variables. 78 4.3.10.2. Efecto de la temperatura sobre la actividad de agua del jarabe 0,975 Actividad de Agua 0,970 0,965 y = -0,0011x + 1,0698 R² = 0,9926 0,960 0,955 0,950 90 92 94 96 98 100 102 104 106 Temperatura (°C) Figura 35. Curva de calentamiento promedio de la tendencia de la relación temperatura- actividad de agua de gomas La Figura 35 representa las actividades de agua en proceso de las gomas en función de la temperatura. Se puede identificar que la actividad de agua desciende cada que la temperatura aumenta. La tendencia de esta relación permite obtener los datos relacionados a las temperaturas experimentales. 79 4.4. RESULTADOS DE CALIDAD DE LOS CARAMELOS Y TEMPERATURAS DE PROCESO Tabla 15. Temperaturas, sólidos solubles, actividades de agua y humedades de los caramelos tratados experimentalmente Temperatura (°C) Requerimientos de Norma Caramelo Duro Caramelo Duro 1 Caramelo Duro 2 Caramelo Duro 3 Sólidos Solubles (°Bx) L. Máximo 90°Bx 84.80 ± 0.07c 0.8036 ± 0.0030c Humedad (%) Límite máximo: 3% 2.712 ± 0.029c 84.37 ± 0.08b 0.8073 ± 0.0029b 4.120 ± 0.028b 119 83.54 ± 0.09a 0.8109 ± 0.0028a 6.105 ± 0.029a 121 84.89 ± 0.05c 0.7956 ± 0.0014c 1.845 ± 0.133c 120 84.20 ± 0.05b 0.7992 ± 0.0015b 2.380 ± 0.004b 119 83.30 ± 0.06a 0.7992 ± 0.0027a 5.383 ± 0.468a 121 84.28 ± 0.25c 0.7984 ± 0.0003c 1.209 ± 0.064c 120 84.10 ± 0.23b 0.8019 ± 0.0003b 2.132 ± 0.024b 82.81 ± 0.20a 0.8053 ± 0.0003a 5.172 ± 0.053a - 108 L. Máximo: 65°Bx 62.30 ± 0.04c 0.9155± 0.00492c Rango 4-10% 7.678 ± 0.303c 107 61.72 ± 0.10b 0.9173± 0.00492b 11.151 ± 0.029b 60.49 ± 0.18a 0.9192± 0.00489a 16.509 ± 0.033a - 110 L. Máximo: 65°Bx 63.70 ± 0.077c 0.9155 ± 0.0043c Rango 4-10% 3.666 ± 0.173c 109 62.80 ± 0.080b 0.9172 ± 0.0043b 7.591 ± 0.058b 61.60 ± 0.084a 0.9188 ± 0.0042a 10.935 ± 0.017a - - 47.50±0.15c 0.9370 ± 0.0031c Rango 4-10% 2.474 ± 0.016c 45.73±0.08b 0.9408 ± 0.0030b 8.209 ± 0.013b 44.55±0.03a 0.9447 ± 0.0028a 13.024 ± 0.059a 44.80 ± 0.23c 0.9574 ± 0.0052c 6.280±0.031c 43.71 ± 0.49b 0.9597 ± 0.0050b 11.806±0.049b 42.15 ± 0.81a 0.9621 ± 0.0049a 14.129±0.062a 121 120 119 Requerimientos de Norma Caramelo Kramel Caramelo Kramel 106 Requerimientos de Norma Caramelo Toffee Toffee de Vainilla 108 Requerimientos de Norma Masmelo Masmelo 107 con 105 glucosa 103 Masmelo 107 sin 105 glucosa 103 Actividad de Agua (Aw) 80 Temperatura (°C) Requerimientos de Norma Masmelo Requerimientos de Norma Gomas Gomas Sólidos Solubles (°Bx) - Actividad de Agua (Aw) - 105 L. Máximo 50°Bx 49.87±0.29c 0.9513 ± 0.0039c Humedad (%) Rango 4-10% Límite máximo 25% 9.334± 0.020c 104 48.40±0.07b 0.9527 ± 0.0040b 16.248± 0.020b 103 47.32±0.27a 0.9540 ± 0.0042a 27.056± 0.025a La Tabla 15 presenta los resultados experimentales promedio de la concentración, actividad de agua y humedad de todos los caramelos presentando mediante letras distintas las diferencias significativas de los parámetros evaluados en las diferentes temperaturas de proceso. El caramelo duro Formulación 1 obtenido a la temperatura de calentamiento de 121°C en la Planta Piloto de Alimentos UTE, cumple con los requerimientos técnicos de la norma Inen NTE INEN 2 217 2000 como: (2.7%H, 84.8°Brix). Por lo tanto la temperatura óptima para realizar Caramelo Duro Formulación 1 es 121°C. La temperatura óptima para obtener un caramelo duro Formulación 2 en la Planta Piloto de Alimentos UTE es 120°C, ya que por medio de la misma se obtuvo (2,38 %H; 84,2°Brix) que cumple con los requerimientos técnicos que la Norma Inen NTE INEN 2 217 2000, por lo tanto se asegura la calidad del caramelo obtenido a esta temperatura. La temperatura óptima para obtener un caramelo duro de calidad mediante la tercera formulación en la Planta Piloto de Alimentos UTE es de 120°C, puesto que al alcanzarla se logra cumplir con los requerimientos técnicos específicos de la Norma relacionada a productos de confitería. Los datos arrojados fueron los siguientes: (2.13%H; 84.1 °Brix). 81 El caramelo con reacción de Maillard (kramel) que cumple con los requerimientos regidos en la Norma 2 217 es el que ha alcanzado una temperatura de calentamiento de 108°C en su proceso experimental. Siempre y cuando se obtenga a la altura de la Planta Piloto de Alimentos UTE. Los resultados obtenidos son (7.68%H; 62.3 °Brix) La temperatura óptima de calentamiento para realizar toffee de vainilla en la Planta Piloto de Alimentos UTE es 109°C, puesto que la misma permitió obtener los siguientes resultados (7.59%H; 62,8 °Brix) alcanzando requerimientos específicos que son parte de la Norma Inen NTE INEN 2 217 2000. El masmelo con glucosa desarrollado en la Planta Piloto de Alimentos UTE que cumplió con los requerimientos técnicos (8,21%H; 45,7 °Brix) de la Norma Inen NTE INEN 2 217 2000 es aquel que alcanzó una temperatura experimental de calentamiento de 105°C. El masmelo cuya fórmula no incluye glucosa desarrollado en la altitud barométrica de la Planta Piloto UTE que cumplió con los requerimientos técnicos de la Norma NTE INEN 2 217 2000, es aquel que alcanzó 107°C puesto que se obtuvo los siguientes resultados: (6.28%H; 44.8 °Brix). La temperatura óptima de calentamiento para obtener gomas en la Planta Piloto de Alimentos UTE es 104°C, por lo tanto la goma que se obtiene al alcanzar esta temperatura cumple con todos los requerimientos de calidad establecidos en la Norma NTE INEN 2 217 2000. Los resultados fueron: (16,24%H; 48,4 °Brix). 82 Tabla 16. Temperaturas, sólidos solubles, actividades de agua y humedades de la comparación entre formulaciones de caramelo duro Caramelo Duro 3 2 Formulación 1 °Brix 83.549 ± 0.665c 84.094 ± 0.691b 84.373 ± 0.722a Aw 0.8019± 0.0030c Humedad 2.84 ± 1.80c 0.7992± 0.0033b 3.20 ± 1.67b 0.8073± 0.0041a 4.31 ± 1.48a De las tres formulaciones de caramelo duro, la que mejores resultados da en base a los requerimientos de norma es la formulación 3, ya que logró estar dentro de los parámetros de humedad y porcentaje de sólidos solubles. Las formulaciones 1 y 2 alcanzan concentraciones de sólidos solubles que cumplen con norma pero sus humedades medias no cumplen, sin embargo, al alcanzar 121°C en la formulación 1 y 120°C en la formulación 2 se obtiene la humedad adecuada. Tabla 17. Temperaturas, sólidos solubles, actividades de agua y humedades de la comparación entre formulaciones de masmelos Masmelo Formulación °Brix b Con Glucosa 47.36 1.98 a Sin Glucosa 49.03 2.14 Aw 0.94080.0042a Humedad 7.804 3.492b 0.95970.0048b 18.807 4.574a La mejor formulación de masmelo fue la que posee glucosa ya que se encuentra cumpliendo con los parámetros de calidad y tiene una humedad muy inferior al dato que arrojó la formulación sin glucosa. Pero, el masmelo sin glucosa se encuentra también dentro de los parámetros de calidad que exige la norma pese a no haber obtenido una textura tan homogénea como el masmelo con glucosa. 83 5. CONCLUSIONES 5. CONCLUSIONES Y RECOMENDACIONES 5.1. CONCLUSIONES La temperatura óptima para realizar un caramelo duro 1 a 2944 msnm es de 121°C La temperatura de proceso que permite realizar un caramelo duro con la segunda formulación a 2944 msnm es de 120°C La temperatura que permite obtener un caramelo duro con la tercera formulación a una altitud de 2944 msnm es de 120°C La tercera formulación de caramelo duro fue la que dio mejores resultados de sólidos solubles, humedad, actividad de agua y características organolépticas La temperatura para obtener caramelo kramel de alta calidad a una altitud de 2944 msnm es de 108°C La temperatura que se debe alcanzar a 2944 msnm para obtener un toffee que cumpla con la norma es 109°C Para obtener un masmelo con glucosa que cumpla con los parámetros de calidad se debe someter al jarabe a una temperatura de 105°C La temperatura que permite obtener un masmelo sin glucosa de alta calidad es 107°C El mejor masmelo fue el que en su formulación tiene glucosa. La temperatura que permite obtener gomas de calidad a una altura de 2944 msnm es de 104°C. 84 5.2. RECOMENDACIONES En próximas investigaciones se recomienda obtener isotermas de sorción entre la actividad del agua y la humedad de todos los caramelos. Es recomendable hacer un estudio del tiempo de vida útil de todos los caramelos realizados en la planta en función del tipo de material del empaque. Se recomienda realizar un estudio del trabajo en la tecnología de confites para reducir tiempos muertos en el proceso de cada uno de los caramelos. Se recomienda adquirir un penetrómetro para realizar análisis de dureza para caramelos que se desarrollan en la Planta Piloto de Alimentos UTE. Se recomienda adquirir un equipo que determine la actividad de agua de los alimentos en la Planta Piloto de Alimentos UTE con la finalidad de relacionar los datos experimentales con normas. Se recomienda a los estudiantes de la Tecnología de Confites, determinar la actividad de agua de los caramelos para relacionarla con la humedad relativa del lugar de producción y comercialización para evitar deterioro en el producto. 85 BIBLIOGRAFÍA BIBLIOGRAFÍA Academia del Área de Plantas Pilotos de Alimentos. (2004). Introducción a la tecnología de alimentos. México, Editorial Limusa. Álvarez, G. (10/02/2008). (18/05/2011), El clima de Venezuela. Recuperado el de http://www.plusformacion.com/Recursos/r/clima- Venezuela-1 Astiasarán, I. & Martínez, A. (2003). Alimentos. Composición y Propiedades. México, Editorial Mc Graw Hill Azúcar. (04/04/2007). Recuperado el 4 de Agosto de http://reposteria2uaem.blogspot.com/ Badui, S. (2006). Química de los alimentos (4ta edición). Madrid, Editorial Pearson Bairgian, A. (2006).Tabla de conversión de gravedad específica. Recuperado el (19/04/2011), de http://www.cervezas-argentinas.com.ar/Tabla_de_ Conversion_de_Gravedad_Especifica_a_Baume_Brix_Alcohol.htm Brennan. J. (2008). Manual del procesado de los alimentos. Zaragoza. Editorial Acribia S.A. Burns, R. (2003). Fundamentos de química. México, Candy Making. (s.f). Recuperado de el 10 Editorial Pearson. agosto del 2011, de http://www.candymaking.net/page4/Contents.html 86 Caramelo. (s.f.). Recuperado el 4 de Agosto de http://zasp.tumblr.com/ Cedeño M, Cornejo F. (13/07/2011). Determinación de la temperatura vítreo de transición en caramelos duros. Recuperado el (13/07/2011) de http://www.dspace.espol.edu.ec/bitstream/ 123456789/2403/1/4743.pdf Charley, H. (1991). Tecnología de Alimentos. Procesos químicos y físicos en la preparación de alimentos. México. Editorial Limusa. Christein, H. (1986). Fundamentos de la química general e inorgánica. Barcelona, Editorial Reverté S.A. Coultate. T. (2003). Manual de química y bioquímica (3ra edición). Zaragoza, Editorial Acribia S.A. Curiel. J. (12/08/2011). Actividad acuosa y los efectos del agua en confitería. Recuperado el (12/08/2011), de http://www.alfa- editores.com/alimentaria/Julio%20-%20Agosto%2005/TECNOLOGIA %20La%20Actividad%20Acuosa.htm Echeverría, E. Producción de dextrán, a nivel laboratorio, como derivado de la sacarosa, usando jugo de caña. Recuperado el (18/04/2011), del sitio Web de la Escuela de Ingeniería Química de la Universidad de San Carlos de Guatemala: http://biblioteca.usac.edu.gt/tesis/08/ 08_0991_ Q.pdf Elaboración de Caramelos. (s.f.). Recuperado el 9 de Agosto del 2011, de http://www.alimentariaonline.com/desplegar_nota.asp?did=288 Eyzaguirre, J. (1974). Química de los hidratos de carbono. Santiago, Editorial Andrés Bello. 87 Formoso. (1999). Procedimientos Industriales al alcance de todos. Enciclopedia FORMOSO (Vol. 2, pp. 34-44). Lima. Editorial Ediciones Limusa 13ava edición. García, G. & Quintero, R. & López, M. (2004). Biotecnología alimentaria. México, Editorial Limusa Noriega Editores. Gianola, G. (1990). Repostería industrial. Madrid, Editorial Paraninfo S.A. Gomitas. (s.f.). Recuperado el 3 de Agosto del 2011, de http://bibliotecadi gital.conevyt.org.mx/colecciones/consumir_bien/confites/gomitas.htm Griffin, R. (1981). Química orgánica moderna. Barcelona, Editorial Reverté S.A. Gutiérrez, H. (2008). Análisis y Diseño de Experimentos. México. Mc GrawHill. Haber-Schaim, U. (1979). Curso de introducción a las ciencias físicas. Barcelona, Editorial Reverté. S.A. Hayes, G. (1987). Manual de datos para Ingeniería de los alimentos. Zaragoza, Editorial Acribia. INEN, (2000). NTE INEN 2 217. Productos de confitería. Caramelos, pastillas, grageas, gomitas y turrones. Quito, Norma Técnica Ecuatoriana Obligatoria. INEN, (1978). NTE INEN 265. Azúcar. Determinación de la humedad. Método de rutina. Quito, Norma Técnica Ecuatoriana Obligatoria. 88 Jerome, R & Lawrence, E. (2009). Química. Madrid. Editorial McGrawHill. Larocca, Silvia (2011). Recuperado el 16 de Julio de 2011, de http://www.tutiempo.net/silvia_larocca/Temas/ecuaciones.htm# presion Marchense, Pasqualino. (24/07/2011). El azúcar. Recuperado el (22/04/2011), de http://www.pasqualinonet.com.ar/el_azucar.htm Miller, D. (2002). Química de alimentos. México, Editorial Limusa Nielsen, S. (2009). Análisis de los alimentos. Zaragoza, Editorial Acriba S.A. Nielsen, S. (2008). Análisis de los alimentos: Manual de Laboratorio. Zaragoza. Author. Orrego, C. (2003). Procesamiento de los alimentos. Manizales, Editorial Universidad Nacional de Colombia. Perafán, F. (01/11/2009). Azúcar de caña. Recuperado el 23 de Agosto del 2011, de http://www.perafan.com/. Peynaud J, & Blouin E. (2004). Enología práctica. Conocimiento y elaboración del vino. Madrid. Editorial MundiPrensa. Potter, N. (1999). Ciencia de los alimentos. Zaragoza, Editorial Acribia S.A. Saldaña, E. Reacción de Maillard. Recuperado el (09/07/2011), de https: //sites. google.com / site/ cocina 4 ingenieros / ciencia –y tecnologia/conceptos-basicos/ Alimentacion/reaccion-de-maillard Sánchez, M. (2003). Proceso de elaboración de alimentos y bebidas. Madrid, Editorial Mundi- Prensa 89 Sánchez, E. (2010). Todo sobre los puntos de azúcar y caramelo. Recuperado el 24 de Julio del 2011, de http://www.chocolatisimo. es/azucar-y-caramelo-todo-sobre-los-puntos-de-azucar-y-caramelo/ Silva, G. (2002, septiembre). Clasificación de pisos térmicos en Venezuela. Revista Geográfica Venezolana, Vol. 43(2), 311- 328. Recuperado el 20 de Agosto del 2011, de http://www.saber.ula. ve/bitstream/12345 6789/24575/ 2/nota43-2-2.pdf StatPoint (2006). Statgraphics Canturion XV (Versión 1.0) [Software de Cómputo ]. E.U. StatPoint Inc. Universidad de la Frontera. (2007). El refractómetro. Recuperado el 26 de Agosto del 2011, de http://dungun.ufro.cl/~explora/index_archivos/ refractometro.pdf Vaclavik, V. (2000). Fundamentos de ciencia de los alimentos. Zaragoza. Editorial Acribia S.A. Velásquez, G. Fundamentos de alimentación saludable. Primera edición. [En línea]. Editorial Universidad de Antioquia. Recuperado el 5 de Junio del 2011, de http://books.google.com.ec/books?id=8eFgyw pXq8EC&pg=PA68&dq=sacarosa+estructura&hl=en&ei=twBcTrnXH4 LHgAft3LmTDA&sa=X&oi=book_result&ct=result&resnum=1&ved=0C CYQ6AEwAA#v=onepage&q=sacarosa%20estructura&f=false Zavala, J. (08/2009). Dulces de leche. Recuperado el (29/05/2011), de http://www.minag.gob.pe/download/pdf/direccionesyoficinas/dgca/dulc es-base-leche. pdf 90 ANEXOS ANEXO 1. CONVERSIÓN ENTRE EL PORCENTAJE DE SACAROSA EN PESO Y LA DENSIDAD EVALUADOS A UNA TEMPERATURA MENOR O IGUAL A 20°C. Grados Brix 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 .0 .1 .2 .3 16.57 17.11 17.65 18.19 18.73 19.28 19.81 20.35 20.89 21.43 21.97 22.50 23.04 23.57 24.10 24.63 25.17 25.70 26.23 26.75 27.28 27.81 28.33 28.86 29.38 29.90 30.42 30.94 31.46 31.97 32.49 33.00 33.51 34.02 16.62 17.16 17.70 18.25 18.79 19.33 19.87 20.41 20.94 21.48 22.02 22.55 23.09 23.62 24.16 24.69 25.22 25.75 26.28 26.81 27.33 27.86 28.39 28.91 29.43 29.95 30.47 30.99 31.51 32.02 32.54 33.05 33.56 34.07 16.67 17.22 17.76 18.30 18.84 19.38 19.92 20.46 21.00 21.54 22.07 22.61 23.14 23.68 24.21 24.74 25.27 25.80 26.33 26.66 27.39 27.91 28.44 28.06 29.48 30.00 30.52 31.04 31.56 32.07 32.59 33.10 33.61 34.13 16.73 17.27 17.81 18.36 18.90 19.44 19.98 20.52 21.05 21.59 22.13 22.66 23.20 23.73 24.26 24.79 25.32 25.86 26.38 26.91 27.44 27.96 28.49 29.01 29.53 30.05 30.57 31.09 31.61 32.13 32.61 33.15 33.67 34.18 .4 .5 .6 Grados Beaumé 16.78 16.84 16.89 17.33 17.38 17.43 17.87 17.92 17.98 18.41 18.46 18.52 18.95 19.00 19.06 19.49 19.55 19.60 20.03 20.08 20.14 20.57 20.62 20.68 21.11 21.16 21.21 21.64 21.70 21.75 22.18 22.23 22.29 22.72 22.77 22.82 23.25 23.30 23.36 23.78 23.84 23.89 24.32 24.37 24.42 24.85 24.90 24.95 25.38 25.43 25.48 25.91 25.96 26.01 26.44 26.49 26.54 26.96 27.02 27.07 27.49 27.54 27.60 28.02 28.07 28.12 28.54 28.59 28.65 29.06 29.12 29.17 29.59 29.64 29.69 30.11 30.16 30.21 30.63 30.68 30.73 31.15 31.20 31.25 31.66 31.71 31.76 32.18 32.23 32.28 32.69 32.74 32.79 33.20 33.26 33.31 33.72 33.77 33.82 34.23 34.28 34.33 .7 .8 .9 16.95 17.49 18.03 18.57 19.11 19.65 20.19 20.73 21.27 21.80 22.34 22.88 23.41 23.94 24.48 25.01 25.54 26.07 26.59 27.12 27.65 28.17 28.70 29.22 29.74 30.26 30.78 31.30 31.82 32.33 32.85 33.36 33.87 34.38 17.00 17.54 18.08 18.63 19.17 19.71 20.25 20.78 21.32 21.86 22.39 22.93 23.46 24.00 24.53 25.08 25.59 26.12 26.65 27.18 27.70 28.23 28.75 29.27 29.80 30.32 30.83 31.35 31.87 32.38 32.90 33.41 33.92 34.43 17.05 17.60 18.14 18.68 19.22 19.76 20.30 20.84 21.38 21.91 22.45 22.98 23.52 24.05 24.58 25.11 25.64 26.17 26.70 27.23 27.75 28.28 28.80 29.32 29.85 30.37 30.89 31.40 31.92 32.43 32.95 33.46 33.97 34.48 91 Grados Brix 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 .0 .1 .2 .3 34.53 35.04 35.55 36.05 36.55 37.06 37.55 38.06 38.55 39.05 39.54 40.03 40.53 41.01 41.50 41.99 42.47 42.95 43.43 43.91 44.38 44.86 45.33 45.80 46.27 46.73 47.20 47.66 48.12 48.58 49.03 49.49 49.94 50.39 50.84 51.28 51.73 34.58 35.09 35.60 36.10 36.61 37.11 37.61 38.11 38.60 39.10 39.59 40.08 40.57 41.06 41.55 42.03 42.52 43.00 43.48 43.96 44.43 44.91 45.38 45.85 46.31 46.78 47.24 47.71 48.17 48.62 49.08 49.53 49.99 50.43 50.88 51.33 34.64 35.14 35.65 36.15 36.66 37.16 37.68 38.16 38.65 39.15 39.64 40.13 40.62 41.11 41.60 42.08 42.57 43.05 43.53 44.00 44.48 44.96 45.42 45.89 46.36 46.83 47.29 47.76 48.21 48.67 49.12 49.58 50.04 50.48 50.93 51.37 34.69 35.19 35.70 36.20 36.71 37.21 37.71 38.21 38.70 39.20 39.69 40.18 40.67 41.16 41.65 42.13 42.61 43.10 43.57 44.05 44.53 45.00 45.47 45.94 46.41 46.87 47.34 47.80 48.26 48.72 49.17 49.62 50.08 50.52 50.97 51.42 .4 .5 .6 Grados Beaumé 34.74 34.79 34.84 35.24 35.29 35.34 35.75 35.80 35.85 36.25 36.30 36.35 36.76 36.81 36.86 37.26 37.31 37.36 37.78 37.81 37.86 38.25 28.30 38.35 38.75 38.80 38.85 39.25 39.30 39.35 39.74 39.79 39.84 40.23 40.28 40.33 40.72 40.77 40.82 41.21 41.26 41.31 41.70 41.74 41.79 42.18 42.23 42.28 42.66 42.71 42.76 43.14 43.19 43.24 43.62 43.67 43.72 44.10 44.15 44.19 44.57 44.62 44.67 45.05 45.09 45.14 45.52 45.57 45.61 45.99 46.03 46.08 46.45 46.50 46.55 46.92 46.97 47.01 47.38 47.43 47.48 47.84 47.89 47.94 48.30 48.35 48.40 48.76 48.81 48.85 49.22 49.26 49.31 49.67 49.71 49.75 50.12 50.16 50.21 50.57 50.61 50.65 51.02 51.06 51.10 51.46 51.50 51.55 .7 .8 .9 34.89 35.39 35.90 36.40 36.91 37.41 37.91 38.40 38.90 39.39 39.89 40.38 40.87 41.36 41.84 42.32 42.81 43.29 43.77 44.24 44.72 45.19 45.66 46.13 46.59 47.06 47.52 47.98 48.44 48.90 49.35 49.80 50.25 50.70 51.15 51.59 34.94 35.45 35.95 36.45 36.96 37.46 37.96 38.45 38.95 39.44 39.94 40.43 40.92 41.40 41.89 42.37 42.85 43.33 43.81 44.49 44.76 45.24 45.71 46.17 46.64 47.11 47.57 48.03 48.49 48.94 49.40 49.85 50.30 50.75 51.19 51.64 34.99 35.50 36.00 36.50 37.01 37.51 38.01 38.50 39.00 39.49 39.99 40.48 40.96 41.45 41.94 42.42 42.90 43.38 43.86 44.34 44.81 45.48 45.75 46.22 46.69 47.16 47.61 48.08 48.53 48.99 49.44 49.90 50.34 50.79 51.24 51.68 (Norma NMX, 2011) 92 ANEXO 2. EQUIVALENCIA ENTRE LA PRESIÓN DE VAPOR DE AGUA (mmHg) Y LA ALTITUD (msnm). Altitud (m) 0 100 200 300 400 500 600 700 800 900 0 760 751 743 734 725 716 708 700 691 676 1000 674 666 658 650 642 634 626 619 612 604 2000 596 589 582 575 568 560 554 547 539 533 3000 526 520 513 507 500 494 488 481 475 468 4000 462 456 450 445 439 433 428 422 416 410 5000 405 400 395 389 384 379 374 369 364 359 (Larocca, 2011) 93 ANEXO 3. EQUIVALENCIAS ENTRE LA TEMPERATURA DE EBULLICIÓN DEL AGUA (°C) Y LA PRESIÓN (mmHg). T °C -15 -14 -13 -12 -11 -10 -9 -8 -7 -6 -5 -4 -3 -2 -1 0 1 2 3 4 5 6 7 8 9 10 11 P mmH g 1,4 1,6 1,7 1,8 2,0 2,1 2,3 2,5 2,7 2,9 3,2 3,4 3,7 4,0 4,3 4,6 4,9 5,3 5,7 6,1 6,5 7,0 7,5 8,0 8,6 9,2 9,8 T °C 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 P mmH g 10,5 11,2 12,0 12,8 13,6 14,5 15,5 16,5 17,5 18,7 19,8 21,1 22,4 23,8 25,2 26,7 28,3 30,0 31,8 33,7 35,7 37,7 39,9 42,2 44,6 47,1 49,7 T °C 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 P mmH g 52,4 55,3 58,3 61,5 64,8 68,3 71,9 75,7 79,6 83,7 88,0 92,5 97,2 102,1 107,2 112,5 118,0 123,8 129,8 136,1 142,6 149,4 156,4 163,8 171,4 179,3 187,5 T P T P T P °C 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 89 90 mmHg 196,1 205,0 214,2 223,7 233,7 243,9 254,6 265,7 277,2 289,1 301,4 314,1 327,3 341,0 355,1 369,7 384,9 400,6 416,8 433,6 450,9 468,7 487,1 506,1 525,8 506,1 525,8 °C 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106 107 108 109 110 111 112 113 114 115 120 125 mmHg 546,1 567,0 588,6 610,9 633,9 657,6 682,1 707,3 733,2 760,0 787,6 815,9 845,1 875,1 906,1 937,9 970,6 1004,4 1038,9 1074,6 1111,2 1148,7 1187,4 1227,3 1268,0 1489,4 1740,9 °C 130 135 140 145 150 175 200 225 250 275 300 325 350 360 365 366 367 368 369 370 371 372 373 374 mmHg 2026,1 2347,2 2710,9 3116,7 3570,8 6694,0 11659,2 19123,1 29817,8 44580,8 64432,8 90447,6 124001,6 139893,2 148519,2 150320,4 152129,2 153960,8 155815,2 157692,4 159584,8 161507,6 163468,4 165467,2 (Larocca, 2011) 94 ANEXO 4. MUESTRAS DE CARAMELO DURO 1 95 96 ANEXO 5. MUESTRAS DE CARAMELO DURO 2 97 98 ANEXO 6. MUESTRAS DE CARAMELO DURO 3 99 100 ANEXO 7. MUESTRAS DE CARAMELO CON REACCIÓN DE MAILLARD 101 102 ANEXO 8. MUESTRAS DE TOFFEE DE VAINILLA 103 104 ANEXO 9. MUESTRAS DE MASMELO SIN GLUCOSA 105 106 ANEXO 10. MUESTRAS DE MASMELO SIN GLUCOSA 107 108 ANEXO 11. MUESTRAS DE GOMAS COMESTIBLES 109 110 ANEXO 12. MANUAL DE TEMPERATURAS ÓPTIMAS DE COCCIÓN DE LOS DIFERENTES TIPOS DE JARABE PARA LA ELABORACIÓN DE CARAMELOS DUROS, SUAVES, MASMELOS Y GOMAS. 111 UNIVERSIDAD TECNOLÓGICA EQUINOCCIAL FACULTAD DE CIENCIAS DE LA INGENIERÍA PLANTA PILOTO DE ALIMENTOS MANUAL DE TEMPERATURAS ÓPTIMAS DE COCCIÓN DE LOS DIFERENTES TIPOS DE JARABE PARA LA ELABORACIÓN DE CARAMELOS DUROS, SUAVES Y GOMAS RENATO DAVID GRIJALVA CALVACHI 2012 112 ÍNDICE DE CONTENIDOS 1. INTRODUCCIÓN 1.1. Tabla de puntos de Jarabes y características técnicas de los caramelos duros, blandos, masmelos y gomas a nivel del mar 2. PUNTOS DE EBULLICIÓN DE JARABES A LA ALTURA DE LA PLANTA PILOTO DE ALIMENTOS UTE 2.1. Tabla Equivalencia entre la Presión de vapor de agua y la altitud barométrica 2.2. Tabla de equivalencias que presenta la Temperatura de ebullición del agua a diferentes Presiones 2.3. Extrapolación de tablas y obtención de ecuación de temperatura de ebullición según la altitud barométrica 2.4. Gráficas de relación entre la altitud y la temperatura de ebullición 2.5. Ecuación que relaciona variables de evaporación del agua 3. CÁLCULO PARA OBTENER LA ACTIVIDAD DE AGUA DEL JARABE EN PROCESO 3.1. Ecuaciones de Ley de Raout y Actividad de Agua 3.2. Ejemplo 4. CURVAS DE CALENTAMIENTO Y VARIABLES EXPERIMENTALES 4.1. Caramelo Duro 4.1.1. Caramelo Duro (Formulación 1) 4.1.2. Caramelo Duro (Formulación 2) 4.1.3. Caramelo Duro (Formulación 3) 4.2. Caramelo kramel 4.3. Toffee de Vainilla 4.4. Masmelo con Glucosa 4.5. Masmelo sin Glucosa 4.6. Gomas 113 1. INTRODUCCIÓN Este Manual contiene los requerimientos necesarios para obtener: caramelos duros, caramelos blandos, masmelos y gomas a cualquier altitud. En este se puede obtener principalmente: los diagramas de flujo de proceso de los confites, curvas de calentamiento, ecuaciones y los resultados obtenidos en el estudio previo. Previamente muestra otros datos como: los tipos de hebra, temperaturas a nivel del mar, tipos de pruebas sensoriales, ecuaciones que permiten obtener la temperatura a la que se le debe someter al almíbar dependiendo de la altitud barométrica,. La finalidad del mismo es establecer una referencia técnica para sus lectores y así se pueda obtener un producto de alta calidad. 1.1. Tabla de puntos de Jarabes y características técnicas de los caramelos duros, blandos, masmelos y gomas a nivel del mar Tabla 1. Puntos de Jarabes y características técnicas de los caramelos duros, blandos, masmelos y gomas a nivel del mar. Tipo de Hebra Densidad (°Bé) Temperatur a (°C) Temperatur a (°F) Prueba Sensorial Tipo de Caramelo Bola Dura 38 116-119 212- 246 Forma bola dura entre los dedos Caramelo Duro Bola Floja 37 110-115 230- 239 Forma bola blanda entre los dedos C. Kramel Toffee Perla 33-35 105- 110 221- 230 Forma hebras si se enfría y estira Masmelo Hebra 29 103 217,5 Forma hebras si se enfría y estira Gomas 114 2. PUNTOS DE EBULLICIÓN DE JARABES A LA ALTURA DE LA PLANTA PILOTO DE ALIMENTOS UTE 2.1. Gráficas de relación entre la Altitud Barométrica y la Temperatura de Ebullición del Agua. Por medio de los datos obtenidos en la tabla (2.4) se obtuvo las gráfica que definen la relación entre estas variables Altitud- Temperatura. Temperatura (°C) 120 100 80 y = -0,0034x + 99,591 R² = 0,9968 60 40 20 0 0 1000 2000 3000 4000 5000 6000 Altitud (m.s.n.m.) Figura 1. Relación y tendencia entre la Altitud Barométrica y la Temperatura en °C Temperatura (°F) 250 200 150 y = -0,0061x + 211,26 R² = 0,9968 100 50 0 0 1000 2000 3000 4000 5000 6000 Altitud (m.s.n.m.) Figura 2. Relación y tendencia entre la Altitud Barométrica y la Temperatura en °F 115 El comportamiento muestra una tendencia de línea recta con lo que se puede obtener un modelo matemático para obtener la temperatura óptima de ebullición en °C y °F reemplazando la variable x con una determinada altitud barométrica en m.s.n.m. 2.2. Ecuación que relaciona variables de evaporación del agua. Para determinar la temperatura de ebullición del agua en grados centígrados a una altitud distinta a la del mar, se debe reemplazar la variable x con la altitud del lugar donde se realice expresada en msnm. y = -0,0034x + 99,591 Estas relaciones son fundamentales en la obtención de la temperatura óptima de caramelos, puesto que en la literatura se determina que por cada 500 pies de altura se debe restar 1 ° F a la temperatura del caramelo. Esta ecuación se obtuvo al relacionar las variables Altitud- Presión y Temperatura de Ebullición del Agua. La Planta Piloto de Alimentos se encuentra a 2944 m.s.n.m., utilizando la ecuación se determina que el agua hierve a 89,6°C. 116 3. CÁLCULO PARA OBTENER LA ACTIVIDAD DE AGUA DEL JARABE EN PROCESO 3.1. Ecuaciones de Ley de Raout y Aw para calcular la actividad de agua del jarabe en proceso Para determinar la actividad de agua de un alimento se debe realizar la siguiente ecuación: 𝑃 𝐴𝑤 = 𝑃𝑜 [1] Para determinar la presión de vapor de nuestro jarabe se debe aplicar la siguiente ecuación que corresponde a la Ley de Raoult: 𝑃𝑣𝑑 = 𝑃𝑣𝑑𝑝 × (𝑓𝑚𝑑) 2 Donde: Pvd= Presión de Vapor del disolvente Pvdp= Presión de Vapor del disolvente puro Fmd= Fracción molar del disolvente 3.2. Ejemplo La presión de vapor del agua a 28°C es 28,35 mmHg. Calcule la presión de vapor a 28°C de una solución que contiene 68 g de caña de azúcar, C12H22O11, en 100g de agua. Número de moles de C12H22O11 en 68g = (68g)/ (342 g/mol)= 0,20 moles de C12H22O11 Número de moles de H2O en 1000g = (1000g)/ (18,02 g/mol)= 55,49 moles de H2O Número total de moles = 0,20 + 55,49 = 55,69 moles Fracción Molar C12H22O11 = 0,20/ 55,69 = 0,0036 Fracción Molar H2O = 55,49/ 55,69 = 0,9964 Pvdisolvente= (28,35 mmHg)(0,9964) = 28,35 mmHg Obteniendo la presión de vapor del jarabe se puede obtener la Aw del jarabe mediante la ecuación. 117 4. CURVAS DE CALENTAMIENTO Y VARIABLES EXPERIMENTALES 4.1. Caramelo duro 4.1.1. Diagrama de flujo Azúcar y agua MEZCLA CALENTAMIENTO Glucosa CONCENTRADO P.C. 119 120 121 °C ENFRIAMIENTO MOLDEADO TROQUELADO CARAMELO DURO Figura 3. Diagrama de flujo del proceso de elaboración de caramelo duro 118 4.1.2. Curvas de proceso del caramelo duro (formulación 1) S. Solubles ( °Brix) 100 80 60 ECUACIÓN DE LA RECTA 40 y = 0,8173x - 14,014 20 R² = 0,9869 0 90 95 100 105 110 115 120 125 Temperatura ( °C) Figura 4. Curva de proceso promedio de la tendencia de la relación temperatura- sólidos solubles del caramelo duro 1 Actividad de Agua 0,940 0,920 0,900 0,880 ECUACIÓN DE LA RECTA 0,860 y = -0,003x + 1,1982 0,840 0,820 R² = 0,9724 0,800 0,780 90 95 100 105 110 115 120 125 Temperatura ( °C) Figura 5. Curva de proceso promedio de la tendencia de la Densidad ( °Bé) relación temperatura- actividad de agua del caramelo duro 1 50 45 40 35 30 25 20 15 10 5 0 ECUACIÓN DE LA RECTA y = 0,4155x - 5,1303 R² = 0,9874 90 95 100 105 110 115 120 125 Temperatura ( °C) Figura 6. Curva de proceso promedio de la tendencia de la relación temperatura- densidad del caramelo duro 1 119 Temperatura ( °C) 140,0 120,0 100,0 80,0 ECUACIÓN DE LA RECTA 60,0 y = 1,2676x + 90,406 40,0 20,0 R² = 0,9894 0,0 0 2 4 6 8 10 12 14 16 18 20 22 24 26 Tiempo (min) Figura 7. Curva de proceso promedio de la tendencia de la relación tiempo- temperatura del caramelo duro 1 4.1.2.1. Características técnicas y resultados del caramelo duro 1 Tabla 5. Características técnicas óptimas y resultados del caramelo duro formulación 1 Parámetro Técnico Temperatura Óptima (°C) Humedad (%) °Brix Actividad de Agua °Beaumé Tiempo de Proceso (min) Resultado 121 2.7 84.8 0.805 45.14 Discusión Cumple con norma Cumple con norma Aw del jarabe en proceso - 24.1 Sólidos Solubles ( °Brix) 4.1.3. Curvas de proceso del caramelo duro (formulación 2) 90 80 70 60 50 40 30 20 10 0 ECUACIÓN DE LA RECTA y = 0,7996x - 11,73 R² = 0,997 90 95 100 105 110 115 120 125 Temperatura ( °C) Figura 8. Curva de proceso promedio de la tendencia de la relación temperatura- sólidos solubles del caramelo duro 120 Actividad de Agua 0,920 0,900 0,880 0,860 ECUACIÓN DE LA RECTA 0,840 0,820 y = -0,0035x + 1,2209 0,800 R² = 0,9836 0,780 90 95 100 105 110 115 120 125 Temperatura ( °C) Densidad ( °Bé) Figura 9. Curva de proceso de la tendencia de la relación temperatura- actividad de agua del caramelo duro 2 50 45 40 35 30 25 20 15 10 5 0 ECUACIÓN DE LA RECTA y = 0,3948x - 2,9805 R² = 0,996 90 95 100 105 110 115 120 125 Temperatura ( °C) Figura 10. Curva de proceso de la tendencia de la relación temperatura- densidad del caramelo duro 2 Temperatura ( °C) 140,0 120,0 100,0 ECUACIÓN DE LA RECTA 80,0 60,0 40,0 y = 1,2271x + 90,259 20,0 R² = 0,982 0,0 0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 Tiempo (min) Figura 11. Curva de proceso de la tendencia de la relación tiempo- temperatura del caramelo duro 2 121 4.1.3.1. Características técnicas y resultados del caramelo duro 2 Tabla 6. Características técnicas óptimas y resultados del caramelo duro formulación 2 Parámetro Técnico Temperatura Óptima (°C) Humedad (%) °Brix Actividad de Agua °Beaumé Tiempo de Proceso (min) Resultado 120 2.38 84.2 0,800 44.4 24.2 Discusión Cumple con norma Cumple con norma Aw del jarabe en proceso - Sólidos Solubles ( °Brix) 4.1.4. Curvas de proceso del caramelo duro (formulación 3) 90 80 70 60 50 40 30 20 10 0 ECUACIÓN DE LA RECTA y = 0,7631x - 7,394 90 95 100 105 110 115 120 125 R² = 0,9926 Temperatura ( °C) Figura 12. Curva de proceso de la tendencia de la relación temperatura- sólidos solubles del caramelo duro 3 Actividad de Agua 0,920 0,900 0,880 0,860 ECUACIÓN DE LA RECTA 0,840 0,820 y = -0,0036x + 1,2297 0,800 0,780 R² = 0,9728 90 95 100 105 110 115 120 125 Temperatura ( °C) Figura 13. Curva de calentamiento promedio de la tendencia de la relación temperatura- actividad de agua del caramelo duro 3 122 Densidad ( °Bé) 50,00 45,00 40,00 35,00 30,00 25,00 20,00 15,00 10,00 5,00 0,00 ECUACIÓN DE LA RECTA y = 0,3858x - 1,5667 90 95 100 105 110 115 120 125 R² = 0,9932 Temperatura ( °C) Figura 14. Curva de proceso de la tendencia de la relación temperatura- densidad del caramelo duro 3 Temperatura ( °C) 140,0 120,0 100,0 ECUACIÓN DE LA RECTA 80,0 60,0 40,0 y = 1,3133x + 90,122 20,0 0,0 R² = 0,9896 0 2 4 6 8 10 12 14 16 18 20 22 24 26 Tiempo (min) Figura 15. Curva de calentamiento promedio de la tendencia de la relación tiempo- temperatura del caramelo duro 3 4.1.4.1. Resultados experimentales del caramelo duro 3 Tabla 7. Características técnicas óptimas y resultados del caramelo duro formulación 3 Parámetro Técnico Temperatura Óptima (°C) Humedad (%) °Brix Actividad de Agua °Beaumé Tiempo de Proceso (min) Resultado 120 2.1 84.1 0.79 44.7 22.7 Discusión Cumple con norma Cumple con norma Aw del jarabe en proceso - 123 4.2. Caramelo kramel 4.2.1. Procedimiento Crema de Leche, Agua y Glucosa MEZCLA CALENTAMIENTO Mantequilla CONCENTRADO P.C. 106 107 108 °C ENFRIAMIENTO TROQUELADO CARAMELO KRAMEL Figura 16. Diagrama de flujo de proceso de la elaboración de caramelo kramel. 124 Sólidos Solubles ( °Brix) 1.1.1. Curvas de proceso del caramelo kramel 70 60 50 40 ECUACIÓN DE LA RECTA 30 20 y = 0,7012x - 13,45 10 0 90 92 94 96 98 100 102 104 106 108 110 R² = 0,9664 Temperatura ( °C) Actividad de Agua Figura 17. Curva de proceso de la tendencia de la relación temperatura- sólidos solubles del caramelo kramel 0,955 0,950 0,945 0,940 0,935 0,930 0,925 0,920 0,915 0,910 0,905 ECUACIÓN DE LA RECTA y= -0,0015x + 1,0876 R² = 0,9521 90 92 94 96 98 100 102 104 106 108 110 Temperatura ( °C) Figura 18. Curva de proceso de la tendencia de la relación temperatura- actividad de agua del caramelo kramel Densidad ( °Bé) 40 35 30 25 20 ECUACIÓN DE LA RECTA 15 10 y = 0,3722x - 6,4333 5 0 90 95 100 105 110 R² = 0,971 Temperatura ( °C) Figura 19. Curva de calentamiento promedio de la tendencia de la relación temperatura- densidad del caramelo kramel 125 Temperatura ( °C) 110 105 100 ECUACIÓN DE LA RECTA 95 90 y = 1,03x + 90,087 85 0 2 4 6 8 10 12 14 16 18 20 R² = 0,9976 Tiempo (min) Figura 20. Curva de proceso de la tendencia de la relación tiempo- temperatura del caramelo kramel 1.1.1.1. Resultados experimentales del caramelo kramel Tabla 8. Características técnicas óptimas y resultados del caramelo kramel Parámetro Técnico Temperatura Óptima (°C) Humedad (%) °Brix Actividad de Agua °Beaumé Tiempo de Proceso (min) Resultado 108 7.68 62.3 0.925 33.7 17.4 Discusión Cumple con norma Cumple con norma Aw del jarabe en proceso - 126 1.2. Toffee de vainilla 1.2.1. Procedimiento 50% crema de leche, glucosa, sal y azúcar MEZCLA CALENTAMIENTO 50% de crema de leche CONCENTRADO P.C. 108 109 110 °C ENFRIAMIENTO TROQUELADO TOFFEE Figura 21. Diagrama de flujo de proceso de la elaboración de toffee. 127 Sólidos Solubles ( °Brix) 1.1.1. Curvas de proceso del caramelo toffee 70 60 50 40 ECUACIÓN DE LA RECTA 30 20 y = 0,6408x - 7,6232 10 0 90 92 94 96 98 100 102 104 106 108 110 112 R² = 0,9681 Temperatura ( °C) Figura 22. Curva de proceso de la tendencia de la relación temperatura- sólidos solubles del toffee Actividad de Agua 0,955 0,950 0,945 0,940 0,935 ECUACIÓN DE LA RECTA 0,930 0,925 0,920 y = -0,0014x + 1,075 0,915 90 92 94 96 98 100 102 104 106 108 110 112 R² = 0,9592 Temperatura ( °C) Figura 23. Curva de proceso de la tendencia de la relación temperatura- actividad de agua del toffee 40 Densidad ( °Bé) 35 30 25 20 ECUACIÓN DE LA RECTA 15 10 y = 0,3347x - 2,8176 5 0 90 92 94 96 98 100 102 104 106 108 110 112 R² = 0,9687 Temperatura ( °C) Figura 24. Curva de proceso de la tendencia de la relación temperatura- densidad del toffee 128 Temperatura ( °C) 120 100 80 ECUACIÓN DE LA RECTA 60 40 y = 1,0483x + 89,867 20 0 0 2 4 6 8 10 12 14 16 18 20 22 R² = 0,9989 Tiempo (min) Figura 25. Curva de proceso de la tendencia de la relación tiempo- temperatura del toffee 1.2.1.1. Resultados experimentales del toffee Tabla 9. Características técnicas óptimas y resultados del toffee Parámetro Técnico Temperatura Óptima (°C) Humedad (%) °Brix Actividad de Agua °Beaumé Tiempo de Proceso (min) Resultado 109 7.6 62.8 0,921 33.6 18.2 Discusión Cumple con norma Cumple con norma Aw del jarabe en proceso - 129 1.3. Masmelo con glucosa 1.3.1. Procedimiento Azúcar y el 50% del agua MEZCLA CALENTAMIENTO Glucosa CONCENTRADO P.C. 103 105 107 °C Grenetina y 50% del agua HIDRATACIÓN Grenetina hidratada BATIDO MOLDEADO TROQUELADO MASMELO CON GLUCOSA Figura 26. Diagrama de flujo de proceso de la elaboración de Masmelo con glucosa. 130 Sólidos Solubles ( °Brix) 1.1.1. Curvas de proceso del masmelo con glucosa 60 50 40 ECUACIÓN DE LA RECTA 30 20 10 y = 1,0301x - 62,463 0 90 92 94 96 98 100 102 104 106 108 R² = 0,9666 Temperatura ( °C) Figura 27. Curva de proceso de la tendencia de la relación temperatura- sólidos solubles del masmelo con glucosa Actividad de Agua 0,975 0,970 0,965 0,960 ECUACIÓN DE LA RECTA 0,955 0,950 0,945 y = -0,0016x + 1,1144 0,940 90 92 94 96 98 100 102 104 106 108 R² = 0,9481 Temperatura ( °C) Densidad ( °Bé) Figura 28. Curva de proceso de la tendencia de la relación temperatura- actividad de agua del masmelo con glucosa 28 26 24 22 20 18 16 14 12 10 8 6 4 2 0 ECUACIÓN DE LA RECTA y = 0,5556x - 33,253 90 92 94 96 98 100 102 104 106 108 R² = 0,9669 Temperatura ( °C) Figura 29. Curva de proceso de la tendencia de la relación temperatura- densidad del masmelo con glucosa 131 Temperatura ( °C) 108 106 104 102 100 98 96 94 92 90 88 ECUACIÓN DE LA RECTA y = 1,0433x + 90,16 0 2 4 6 8 10 12 14 16 18 R² = 0,9995 Tiempo (min) Figura 30. Curva de proceso de la tendencia de la relación tiempo- temperatura del masmelo con glucosa 1.3.1.1. Resultados experimentales del masmelo con glucosa Tabla 10. Características técnicas óptimas y resultados del masmelo con glucosa Parámetro Técnico Temperatura Óptima (°C) Humedad (%) °Brix Actividad de Agua °Beaumé Tiempo de Proceso (min) Resultado 105 8.2 45.7 0.94 25.0 14.2 Discusión Cumple con norma Cumple con norma Aw del jarabe en proceso - 132 1.4. Masmelo sin Glucosa 1.4.1. Procedimiento Azúcar y el 50% del agua MEZCLA Grenetina y 50% del agua CALENTAMIENTO HIDRATACIÓN CONCENTRADO Grenetina hidratada P.C. 103 105 107 °C BATIDO MOLDEADO TROQUELADO MASMELO SIN GLUCOSA Figura 31. Diagrama de flujo de proceso de la elaboración de masmelo sin glucosa. 133 S. Solubles ( °Brix) 4.2.2. Curvas de proceso del masmelo sin glucosa 50,0 45,0 40,0 35,0 30,0 25,0 20,0 15,0 10,0 5,0 0,0 ECUACIÓN DE LA RECTA y = 0,8083x - 41,711 90 92 94 96 98 100 102 104 106 108 R² = 0,9824 Temperatura ( °C) Figura 32. Curva de proceso de la tendencia de la relación temperatura- sólidos solubles del masmelo sin glucosa Actividad de Agua 0,980 0,975 0,970 ECUACIÓN DE LA RECTA 0,965 0,960 y = -0,001x + 1,0639 0,955 90 92 94 96 98 100 102 104 106 108 R² = 0,9745 Temperatura ( °C) Figura 33. Curva de proceso de la tendencia de la relación temperatura- actividad de agua del masmelo sin glucosa Densidad ( °Bé) 30,0 25,0 20,0 15,0 ECUACIÓN DE LA RECTA 10,0 5,0 y = 0,4353x - 21,987 0,0 90 92 94 96 98 100 102 104 106 108 R² = 0,9829 Temperatura (°C) Figura 34. Curva de proceso de la tendencia de la relación temperatura- densidad del masmelo sin glucosa 134 Temperatura ( °C) 108 106 104 102 100 98 96 94 92 90 ECUACIÓN DE LA RECTA y = 1,025x + 90,187 0 2 4 6 8 10 12 14 16 18 R² = 0,9996 Tiempo (min) Figura 35. Curva de proceso de la tendencia de la relación tiempo- temperatura del masmelo sin glucosa 1.4.1.1. Resultados experimentales del masmelo sin glucosa Tabla 11. Características técnicas óptimas y resultados del masmelo con glucosa Parámetro Técnico Temperatura Óptima (°C) Humedad (%) °Brix Actividad de Agua °Beaumé Tiempo de Proceso (min) Resultado 107 6.2 44.8 0.96 24.6 16.4 Discusión Cumple con norma Cumple con norma Aw del jarabe en proceso - 135 1.5. Gomas 1.5.1. Procedimiento Azúcar y el 50% del agua MEZCLA Grenetina y 50% del agua CALENTAMIENTO HIDRATACIÓN CONCENTRADO Grenetina hidratada P.C. 103 104 105 °C MEZCLA MOLDEADO TROQUELADO GOMAS Figura 36. Diagrama de flujo de proceso de la elaboración de gomas comestibles. 136 Sólidos Solubles ( °Brix) 1.1.1. Curvas de proceso de gomas 60 50 40 30 ECUACIÓN DE LA RECTA 20 10 y = 0,8831x - 43,396 0 90 92 94 96 98 100 102 104 106 R² = 0,9975 Temperatura ( °C) Figura 37. Curva de proceso de la tendencia de la relación temperatura- sólidos solubles de gomas Actividad de Agua 0,975 0,970 0,965 ECUACIÓN DE LA RECTA 0,960 0,955 y = -0,0012x + 1,0804 0,950 90 92 94 96 98 100 102 104 106 R² = 0,993 Temperatura ( °C) Figura 38. Curva de proceso de la tendencia de la relación temperatura- actividad de agua de gomas Densidad ( °Bé) 30 25 20 15 10 ECUACIÓN DE LA RECTA 5 y = 0,4743x - 22,792 0 90 95 100 105 110 R² = 0,9978 Temperatura ( °C) Figura 39. Curva de proceso de la tendencia de la relación temperatura- densidad de gomas 137 Temperatura ( °C) 106 104 102 100 ECUACIÓN DE LA RECTA 98 96 94 y = 1,12x + 90,22 92 90 0 2 4 6 8 10 12 14 R² = 0,9976 Tiempo (min) Figura 40. Curva de proceso de la tendencia de la relación tiempo- temperatura de gomas 1.5.1.1. Resultados experimentales de gomas Tabla 12. Características técnicas óptimas y resultados de gomas Parámetro Técnico Temperatura Óptima (°C) Humedad (%) °Brix Actividad de Agua °Beaumé Tiempo de Proceso (min) Resultado 104 16.24 48.4 0.955 27.00 12.3 Discusión Cumple con norma Cumple con norma Aw del jarabe en proceso - 138