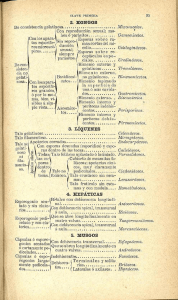
Borasso de Zaixso, A. 2013. Elementos para el estudio de las
Anuncio

VERSION ON LINE: ISBN 978-987-1937-14-1 FORMATO CD: ISBN 978-987-1937-15-8 FORMATO PAPEL: ISBN 978-987-1937-13-4 Publicaciones del IDC Manuales Nº1 ELEMENTOS PARA EL ESTUDIO DE LAS MACROALGAS DE ARGENTINA. Alicia L. Boraso INSTITUTO DE DESARROLLO COSTERO (IDC) UNPSJB 2013 Boraso de Zaixso, Alicia. Elementos para el estudio de las macroalgas de Argentina / Alicia Boraso de Zaixso ; con colaboración de Juan Manuel Zaixso. - 1a ed. - Comodoro Rivadavia : Universitaria de la Patagonia, 2013. E-Book. ISBN 978-987-1937-14-1 1. Algas Marinas. I. Zaixso, Juan Manuel, colab. CDD 579.88 Fecha de catalogación: 10/06/2013 Fecha de catalogación: 10/06/2013 Serie: Publicaciones del IDC: Manuales nº 1. Instituto de Desarrollo Costero de la UNPSJB (IDC) aboraso09@gmail.com VERSION ON LINE, Primera Edición: ISBN 978-987-1937-14-1 FORMATO CD, Primera Edición: ISBN 978-987-1937-15-8 FORMATO PAPEL, Primera Edición: ISBN 978-987-1937-13-4 Editorial Universitaria de la Patagonia (EDUPA). http://www.infoweb.unp.edu.ar edupa@unp.edu.ar Universidad Nacional de la Patagonia San Juan Bosco. Ciudad Universitaria Km 4. (9000) Comodoro Rivadavia, Chubut, Argentina. © 2013 , Queda hecho el depósito que marca la ley 11.723 Prohibida la reproducción total o parcial Por cualquier medio gráfico o virtual. 2 A la querida memoria de la Dra. Delia Rabinovich de Halperín, maestra generosa y amiga fiel, que nos supo mostrar las escondidas bellezas de la naturaleza y los caminos de la ética profesional. El Autor Alicia Boraso de Zaixso, nacida el 7 de Junio de 1946, en San Fernando, Provincia de Buenos Aires. Doctora en Ciencias Biológicas (FCEN, UBA). Su trabajo de Investigación se ha centrado en la ecología y taxonomía de las algas marinas del bentos. Investigadora del CONICET (1974-). Se desempeñó en el Centro de Investigación de Biología Marina (INTI) (1968-1977), en el Centro Nacional Patagónico (CENPATCONICET) (1977-1989) y como docente investigador en la sede Comodoro Rivadavia de la Universidad Nacional de la Patagonia San Juan Bosco desde 1989. Fue presidente de la Asociación Argentina de Ficología y directora de la Revista Naturalia Patagónica (FCN, UNPSJB), de la licenciatura en Gestión Ambiental (FHCS, UNPSJB) y de la Maestría en Ecología Marina Bentónica (FCN, UNPSJB). Cuenta con 80 participaciones en reuniones científico- técnicas y 70 trabajos publicados. Dirección: aboraso09@gmail.com 4 CONTENIDOS CAPÍTULO 1: COMO COMENZAR ...........................................................................1 LAS FUENTES TRADICIONALES ....................................................................................1 Catálogos, expediciones y floras australes. ........................................................1 Revistas especializadas .....................................................................................2 Los trabajos locales ............................................................................................2 LOS ESTUDIOS MOLECULARES....................................................................................2 Polimorfismos en la longitud de los fragmentos de restricción (RFLP) ...............3 ADN polimórfico amplificado al azar (RAPD) ......................................................3 Las repeticiones en tándem ................................................................................3 Las secuencias repetidas simples (SSR o microsatélites) ..................................4 Las regiones espaciadoras .................................................................................4 Los espaciadores internos transcriptos (ITS o espaciador de la RuBisCo) ........4 Las secuencias repetidas Inter-simples (ISSR) ..................................................4 El ARN de las subunidades ribosomales. ...........................................................5 ALGUNOS CONSEJOS.................................................................................................5 Observar en vivo .................................................................................................5 Conservar. ..........................................................................................................6 Fotografiar y dibujar ............................................................................................6 CONTENIDO Y LIMITACIONES DE ESTE TEXTO ...............................................................7 AGRADECIMIENTOS ...................................................................................................7 BIBLIOGRAFÍA RECOMENDADA EN EL CAPÍTULO 1 .........................................................7 CAPÍTULO 2: LOS ELEMENTOS ...........................................................................14 LOS TALOS .............................................................................................................14 ELEMENTOS DE MORFOLOGÍA Y ANATOMÍA ................................................................15 Organización celular .........................................................................................15 Estructura básica del talo..................................................................................15 Talos postrados, erectos y heterotricos ............................................................15 Crecimiento y meristemas ................................................................................16 Cladomas..........................................................................................................16 Extensión del concepto de cladoma. ................................................................17 Variabilidad morfológica ...................................................................................18 ESTRUCTURAS REPRODUCTIVAS ..............................................................................18 CICLOS DE VIDA ......................................................................................................21 Ciclos monogenéticos .......................................................................................21 Ciclos digenéticos .............................................................................................22 Ciclos trigenéticos .............................................................................................22 BIBLIOGRAFÍA RECOMENDADA EN EL CAPÍTULO 2 ......................................................23 CAPÍTULO 3: ALGAS VERDES. .............................................................................27 CARACTERÍSTICAS GENERALES ................................................................................27 CLASES, ÓRDENES, FAMILIAS Y GÉNEROS. ................................................................27 CLASE PRASINOPHYCEAE ........................................................................................28 Orden Tetraselmidales .....................................................................................28 CLASE CHLOROPHYCEAE ........................................................................................28 Orden Chlorococcales ......................................................................................28 CLASE PLEURASTROPHYCEAE .................................................................................28 Orden Prasiolales .............................................................................................29 CLASE ULVOPHYCEAE .............................................................................................29 Orden Ulotrichales ............................................................................................29 Orden Ulvales ...................................................................................................33 Orden Cladophorales ........................................................................................45 Orden Siphonocladales ....................................................................................50 CLASE BRYOPSIDOPHYCEAE: ...................................................................................51 Orden Bryopsidales ..........................................................................................51 REFERENCIAS BIBLIOGRÁFICAS DEL CAPÍTULO 3. .......................................................56 i CAPÍTULO 4: ALGAS PARDAS.............................................................................62 CARACTERÍSTICAS GENERALES ...............................................................................62 CLASE PHAEOPHYCEAE: ÓRDENES, FAMILIAS Y GÉNEROS: .........................................62 Orden Ectocarpales ..........................................................................................63 Orden Scytosiphonales ....................................................................................87 Orden Ralfsiales ...............................................................................................88 Orden Scytothamnales ....................................................................................90 Orden Desmarestiales ......................................................................................92 Orden Cutleriales ..............................................................................................93 Orden Dictyotales .............................................................................................96 Orden Fucales ..................................................................................................96 Orden Ascoseirales..........................................................................................97 Orden Sporochnales .........................................................................................97 Orden Sphacelariales .......................................................................................98 Orden Laminariales.........................................................................................100 REFERENCIAS BIBLIOGRÁFICAS DEL CAPÍTULO 4. .....................................................104 CAPÍTULO 5 ALGAS ROJAS (I) ...........................................................................110 LAS ANTIGUAS BANGIACEAE...................................................................................110 ÓRDENES, FAMILIAS Y GÉNEROS ............................................................................110 CLASE RHODELLOPHYCEAE ...................................................................................111 Orden Porphyridiales, .....................................................................................111 Orden Stylonematales ....................................................................................111 CLASE COMPSOGONOPHYCEAE.............................................................................112 Orden Erythropeltidales ..................................................................................112 CLASE BANGIOPHYCEAE ........................................................................................112 Orden Bangiales .............................................................................................112 REFERENCIAS BIBLIOGRÁFICAS DEL CAPÍTULO 5. .....................................................116 CAPÍTULO 6: ALGAS ROJAS (II) .........................................................................117 CARACTERÍSTICAS GENERALES DE LAS FLORÍDEAS..................................................117 SUBCLASES, ÓRDENES Y FAMILIAS ..........................................................................120 SUBCLASE AHNFELTIOPHYCIDAE ............................................................................121 Orden Ahnfeltiales ..........................................................................................122 SUBCLASE HILDENBRANDIOPHYCIDAE ....................................................................122 Orden Hildenbrandiales. .................................................................................122 SUBCLASE NEMALIOPHYCIDAE ...............................................................................122 Orden Acrochaetiales .....................................................................................123 Orden Colaconematales .................................................................................125 Orden Palmariales ..........................................................................................126 Orden Nemaliales ...........................................................................................127 Orden Balliales ...............................................................................................128 SUBCLASE CORALLINOPHYCIDAE ...........................................................................129 Orden Corallinales ..........................................................................................129 SUBCLASE RHODYMENIOPHYCIDAE ........................................................................136 Orden Gelidiales .............................................................................................136 Orden Bonnemaisoniales ................................................................................137 Orden Rhodymeniales ....................................................................................138 Orden Peyssonneliales ...................................................................................142 Orden Cryptonemiales ....................................................................................142 Orden Gracilariales .........................................................................................143 Orden Plocamiales..........................................................................................144 Orden Gigartinales ..........................................................................................146 Orden Ceramiales ...........................................................................................156 REFERENCIAS BIBLIOGRÁFICAS DEL CAPÍTULO 6. .....................................................185 GLOSARIO ............................................................................................................192 INDICE TAXONÓMICO ..........................................................................................201 ii Capítulo 1: COMO COMENZAR Por Alicia L. Boraso y Juan Manuel Zaixso. Este texto reúne información correspondiente al taller: “Reconocimiento de Macroalgas Marinas Patagónicas”, llevado a cabo durante las VIII Jornadas Nacionales de Ciencias del Mar, en la sede Comodoro Rivadavia de la Universidad Nacional de la Patagonia San Juan Bosco (UNPSJB) durante el mes de diciembre de 2012. Los objetivos del taller fueron, por un lado, compartir una visión de la biodiversidad de las algas marinas bentónicas de la costa de Argentina, organizada en un esquema taxonómico tan actualizado a la fecha como nos ha sido posible y por otro, facilitar materiales bibliográficos de utilidad. El primer objetivo se aborda a lo largo de todos los capítulos, pero en este primero se intenta resumir la variedad de fuentes complementarias que son necesarias hoy en día para iniciarse en el estudio de la flora de macroalgas marinas. Las fuentes tradicionales La bibliografía de partida para iniciar el estudio de las algas abarca tres fuentes principales, sin que ninguna sea más o menos importante que la otra: Los catálogos, expediciones y floras australes. Las revistas especializadas. Los trabajos locales. Catálogos, expediciones y floras australes. Para nuestra zona la consulta de los catálogos de Papenfuss (1964) y Pujals (1963, 1977) es esencial, ya que estas obras son un valioso aporte para localizar las descripciones originales que se han realizado de las diferentes especies que se encuentran en la costa de Argentina, Uruguay y en las zonas subantártica y antártica, con una cuidadosa revisión de lo publicado en las principales expediciones australes. En la página correspondiente a las algas marinas del “Atlas de Sensibilidad Ambiental de la Costa argentina” (Boraso & Zaixso, 2007) se señala la distribución conocida de numerosas especies con algunas descripciones e ilustraciones, pero el esquema general de la página web obligó a poner las especies en orden alfabético, lo que no resulta apropiado para un estudio ordenado de la flora. De todas maneras esa publicación ha sido tomada como fuente de información por la base internacional de algas en INTERNET (Guiry & Guiry, 2003 - 2013) con lo que la información allí volcada cuenta hoy con amplia difusión. Muchas de las obras citadas en los catálogos, solo brindan ampliaciones del rango de distribución de las especies o descripciones muy sucintas y rudimentarias, frecuentemente sin ilustraciones, por lo que aportan pocos elementos para determinar los materiales que manejamos; pero otras son útiles, al menos como punto de partida de los estudios. Por eso hemos incluido en la bibliografía recomendada de este capítulo una selección de las obras florísticas que, aun siendo antiguas, aportan información valiosa acerca de las especies de nuestra zona, por lo que vale la pena contar con ellas. También listamos algunas obras generales sobre la flora subantártica, publicadas posteriormente a los mencionados catálogos de Papenfuss y de Pujals, principalmente en nuestro país, Australia, Nueva Zelandia y Chile. Destacamos especialmente la gigantesca labor de los ficólogos australianos, que se puede consultar en la web, en la página de algas marinas del sur de Australia: eFlora SA (http://www.flora.sa.gov.au/index.html) 1 Revistas especializadas Entre las revistas especializadas en ficología en general se destacan: Botanica Marina; Botaniste; British Phycological Journal (ahora el European Jounal of Phycology); Journal of Phycology (Phycological Society of America); Phycologia; El Boletín de la Sociedad Ficológica de Francia (Bull. Soc. Phycol. France); Cryptogamie, Algologie (actualmente Algologie); Revue Algologique. (N. S.); Algae (Corea); Phycological Research; Journal of Applied Phycology y SÔRUI (The Japanese Journal of Phycology). También se han publicado trabajos importantes sobre macroalgas en revistas de botánica general. Para ubicar estas revistas en nuestras bibliotecas se puede consultar el Catálogo Colectivo on line de Publicaciones periódicas del CAYCIT y luego solicitar copias de los artículos de interés a través del servicio interbibliotecario, muy pocas de ellas se pueden consultar en la Biblioteca Digital de la SECYT. Una gran cantidad de contribuciones en una variedad de revistas se puede consultar en http://www.phycology.ugent.be/ de la Universidad de Ghent. Es frecuente encontrar acceso a publicaciones en revistas latinoamericanas en el portal SCIELO. Los trabajos locales La tercera fuente de información son los trabajos realizados por autores locales sobre diversas especies de nuestras costas, a los que haremos mención en los capítulos 3 a 6, los cuales se encuentran dispersos en publicaciones extranjeras y nacionales como el Boletín de la Sociedad Argentina de Botánica; Darwiniana; Physis; Naturalia patagónica (Serie Biológica) e Historia Natural, Segunda Serie. Se han realizado también en el litoral de Argentina no pocos trabajos acerca de la composición de diversas asociaciones biológicas que mencionan algas marinas y pueden ser utilizados para ampliar la distribución de las especies, entre las que se pueden destacar las siguientes: Asensi &. Küpper (2012); Boraso de Zaixso (1995); Boraso de Zaixso & Zaixso (1996); Boraso de Zaixso et al. (1999); Croce & Parodi (2012); D'Antoni (1973); Díaz et al (2002). Kühnemann (1969, 1972., 1976); Mendoza et al. (2005); Olivier et al. (1966); Quartino et al. (2005); Ragonese & Piccinini (1972); Sar et al.. (1984); Zaixso et al. (1978) y Zaixso & Pastor (1977). Si bien no se incluyeron en el taller que dio origen a este texto conviene tener presente los trabajos de Halperín (1967, 1970) como guías indispensables para la identificación de las Cyanophyta de nuestras costas. Los estudios moleculares Desde hace varias décadas la comparación de las secuencias de ADN se ha convertido en un medio para para reconstruir árboles filogenéticos y reflejar relaciones evolutivas entre organismos, ya que pueden hacerse ensayos cuantitativos a partir de cambios discretos entre secuencias homólogas alineadas, o sea las secuencias que comparten un mismo ancestro. Para ello se han desarrollado numerosas técnicas para extraer el ADN de diferentes grupos de algas (Hu et al., 2004) Entre los enfoques ya aplicados al estudio de las macroalgas se pueden señalar los siguientes, que no son todos los posibles: Polimorfismos en la longitud de los fragmentos de restricción (RFLP) ADN polimórfico amplificado al azar (RAPD) Las repeticiones en tándem Las secuencias repetidas simples (SSR o microsatélites) Las regiones espaciadoras Los espaciadores internos transcriptos (ITS o espaciador de la RuBisCo) Las secuencias repetidas Inter-simples (ISSR). El ARN de las subunidades ribosomales. Se presenta aquí una breve reseña de las mismas, mencionando en cada caso algún ejemplo de su aplicación. 2 Polimorfismos en la longitud de los fragmentos de restricción (RFLP) Una forma común de examinar el ADN es utilizando enzimas que actúan sobre secuencias de corte conocidas. Mediante cortes de determinadas secuencias del ADN con enzimas que reconocen específicamente tales sitios se generan fragmentos cortos y largos (fragmentos de restricción), los que hibridan con sondas de ADN construidas específicamente para reconocerlos. En una población dada de una especie, algunas secuencias de ADN contienen sitios particulares de restricción, mientras que en otras poblaciones estos sitios pueden faltar a causa de mutaciones. Los patrones de bandas producidos por este método son utilizados para visualizar polimorfismos de longitud en los fragmentos de restricción (RFLP) y pueden ser característicos de especies, de poblaciones o de individuos, dependiendo de la enzima utilizada y del nivel de parentesco buscado. Se ha utilizado el análisis de RFLP de ADN de cloroplasto para el estudio de procesos microevolutivos en Ceramium (Rhodophyta) (Wattier et al., 2000). ADN polimórfico amplificado al azar (RAPD) Con este método no se requieren sondas específicas de ADN, ni tampoco información previa acerca de la secuencia, como en el caso de los RFLPs. El mismo se basa en el uso de un conjunto de iniciadores de la reacción en cadena de la polimerasa (polimerasa chain reaction) (PCR) consistentes en 8 a 10 pares de bases cuya secuencia es aleatoria, con los cuales se obtienen un gran número de copias de un fragmento de ADN utilizando ADN polimerasas (procedimiento conocido como “amplificación”). Bajo temperaturas específicas tales fragmentos se unen a muchas regiones del ADN. Si los iniciadores de PCR se encuentran correctamente posicionados y a la distancia es adecuada se amplifican fragmentos de ADN de diversos tamaños. En aquel individuo cuyas secuencias homólogas no se amplifiquen a causa de una mutación que hizo perder el sitio de acoplamiento de los iniciadores de la replicación del ADN, no se amplificarán algunos de los fragmentos, lo que permitirá separarlo del resto de la población. Estudios combinados de morfología y RAPDs se llevaron a cabo para lograr un mejor entendimiento de la taxonomía de Sargassum (Wong et al.; 2004, 2007; Ho et al. 1995). Esta técnica también ha demostrado su utilidad para la caracterización de germoplasma de Laminaria (Wang; Yang et al., 2004), para su cultivo y selección (Peng et al. 2005) y para la caracterización de sus cultivares (Shi et al., 2004). Martínez et al. (2003), encontraron con este método una disminución de la variabilidad genética en las poblaciones de Lessonia nigrescens más afectadas por un evento “El Niño”. En estudios realizados para evaluar variaciones genéticas y relaciones filogenéticas en el género Porphyra, algunos resultaron concordantes en buena parte con la taxonomía clásica (Song et al., 1998), mientras que Huh et al. (2006) indican algunas discrepancias con la clasificación basada en la morfología. Las repeticiones en tándem La naturaleza de las familias de genes repetidos en tandem los hace muy convenientes para observar divergencias de secuencias. Por ejemplo, la familia génica que codifica para la unidad mayor y menor del ARN ribosomal está bien estudiada y caracterizada en muchos organismos. Una diferencia común entre individuos es el número de copias en el rRNA. Estudios realizados en Alaria utilizando el gen 18s como sonda encontraron diferencias en el número de repeticiones en su rDNA utilizando RFLP, pudiéndose diferenciar cinco variantes (Mróz, 1985). En otros casos el número de copias puede resultar muy variable para resultar de algún uso en la distinción de poblaciones o especies, pero podría ser de utilidad para establecer diferencias a nivel de familia o superior. 3 Las secuencias repetidas simples (SSR o microsatélites) Los microsatélites son secuencias de ADN en las que un fragmento cuyo tamaño va desde un par de bases hasta cuatro pares de bases, se repite de manera consecutiva. La variación en el número de repeticiones crea diferentes alelos los cuales se distinguen entre sí por la longitud total del fragmento. Un microsatélite está típicamente conformado por un motivo repetitivo, en el cual se encuentra contenido la secuencia repetida, y dos regiones flanqueantes, las cuales se encuentran a ambos lados del motivo repetitivo. Para que un microsatélite sea considerado útil como marcador molecular, toda la variación de la secuencia (o polimorfismo) debe hallarse dentro del motivo repetitivo, y por el contrario, las regiones flanqueantes deben estar altamente conservadas, al punto de no presentar ninguna variación de secuencia. Partiendo de esta hipótesis se diseñan iniciadores que tienen la misma secuencia que los extremos de las regiones flanqueantes para poder amplificar un microsatélite a través de una PCR. Estudios recientes en filogenia, sistemas de cruzamiento e hibridización en especies de Fucus han demostrado la utilidad de los marcadores SSR. (Coyer et al., 2008). Las regiones espaciadoras La evolución del rRNA (RNA ribosomal) ha dado como resultado una región codificante del mismo, la que tiene espaciadores internos pequeños (ITS), los que se encuentran altamente conservados y funcionalmente restringidos. Esta región codificante se alterna con regiones intergénicas espaciadoras (ETS y NTS) menos conservadas. Los NTS y ETS tienen poca restricción de secuencia y por lo tanto, una tasa de evolución mayor que las regiones codificantes adyacentes. Las regiones codificantes y espaciadoras son denominadas colectivamente: la unidad repetitiva rRNA. Las unidades repetitivas son generalmente similares en el genoma de un individuo y dentro de los grupos reproductivos, pero pueden divergir en cambio entre diferentes grupos reproductivos. Los análisis de los ITS, más conservados, podrían usarse para separar taxa de nivel más alto, mientras que los NTS y ETS, menos conservados, podrían diferenciar poblaciones, variedades o cultivares. Los espaciadores internos transcriptos (ITS o espaciador de la RuBisCo) De Clerck et al. (2001) han intentado reconstruir las relaciones filogenéticas en el género Dictyota utilizando análisis de RFLP del espaciador interno transcripto 1 de la región ribosomal (ARDRA-ITSI). Esta región presentó longitudes variables entre especies, lo cual causó una mala alineación de secuencias y resultó en una pobre definición de relación entre especies, lo que pone en duda su utilidad para analizar ese género. Kawai et al. (2008) tampoco tuvieron éxito en la utilización los ITS para determinar la posición taxonómica de una especie de Aureophycus (Laminariales, Phaeophyceae), ya que las limitaciones de esta región solo permitieron la asignación a una familia. En los casos de revisión taxonómica de Soranthera ulvoidea (Cho et al., 2005), se obtuvieron resultados que no sostienen su clasificación actual, pero los autores reconocen la falta de variación entre secuencias, por lo que también se generan algunas dudas. Análisis filogenéticos basados en el espaciador de la RuBisCo plastídico y de la región rRNA ITS nuclear de Alariaceae, Laminariaceae, y Lessoniaceae han demostrado en cambio ser satisfactorios en cuanto a la resolución que presentan. (Yoon et al., 2001; Boo & Yoon, 2000), en esa serie de trabajos se discuten posibles cambios en el sistema de clasificación actual. Las secuencias repetidas Inter-simples (ISSR) Estos polimorfismos se encuentran entre las repeticiones de microsatélites. Se pueden diseñar primers que hibriden dentro de estas regiones para que sólo se amplifique la región que se encuentra entre dichas secuencias. Las técnicas de Inter-Simple Sequence Repeat (ISSR) son 4 prácticamente iguales a los RAPDs, con la excepción de que la secuencia de los primers está diseñada a partir de dichas regiones. Se han realizado estudios basados en RAPDs y marcadores ISSR en donde se investigó la estructura genética de cuatro poblaciones de Sargassum muticum y un outgrup de S. fusiforme (Harv.) Setchell, pudiéndose diferenciar mediante estos marcadores a las poblaciones estudiadas (Zhao et al., 2008). El ARN de las subunidades ribosomales. Los genes para el ARN ribosomal están entre los más estables e inmutables genes conocidos, y el arreglo repetitivo de su secuencia en el genoma provee un importante marcador objetivo para análisis basados en PCR. Los genes para la subunidad menor ribosomal han sido ampliamente utilizados en numerosos trabajos de filogenia como, por ejemplo: la revisión del orden Bangiales, utilizando la secuencia de la rbcL y el ARNr (Sutherland et al., 2011); la determinación de afinidades filogenéticas del género Polysiphonia mediante el análisis basados en la SSU rARN (Choi, et al., 2001); igualmente para las familias Dasyaceae, Delesseriaceae y Rhodomelaceae (Choi et al., 2002) y las relaciones evolutivas entre los órdenes de Phaeophyta utilizando secuencias del ADN 18S ribosomal (Ian, 1995; Harper & Saunders, 2001). De la misma forma, las secuencias para el ARN de la subunidad mayor del ribosoma ha sido utilizado para estudiar relaciones filogenéticas en Cladophorophyceae (Leliaert et al., 2003), y las porciones variables de la subunidad mayor del cistrón ribosomal para el género Plocamium (Saunders & Lehmkuhl, 2005). Como sale de los pocos ejemplos mencionados, la utilidad de la aplicación de estas metodologías depende de los objetivos buscados y el grado de detalle que se busca en la diferenciación de los materiales a analizar. En algunos casos interesa separar poblaciones por su diferente interés económico biogeográfico o ecológico, mientras en otro estaremos comparando géneros o familias para establecer líneas filogenéticas. El avance en la determinación de líneas filogenéticas a través de estudios moleculares en macroalgas es importante, muchas veces en combinación con estudios ultraestructurales y morfológicos. En los siguientes capítulos se hará referencia a algunos de los trabajos que han contribuido a delinear los actuales esquemas filogenéticos, los cuales se han publicado mayormente en las revistas especializadas en ficología ya mencionadas y en otras más generales, como Molecular Ecology Resources. Algunos consejos. Si bien cada tipo de estudio determinará los detalles de procedimiento del muestreo y el tipo de análisis, existen algunas rutinas comunes, que usualmente no se mencionan, ya sea por ser obvias, o porque su sencillez las descalifica como procedimiento técnico que merezca ser descripto. Las nombramos aquí porque no hay demasiadas oportunidades para dejarlas señaladas. Observar en vivo Los materiales de herbario son indispensables documentos, pero no lo ideal al momento de abordar el estudio de un grupo por primera vez. Por eso, para lograr una familiaridad con la flora de la propia zona no hay mejor método que la observación directa de todos los materiales vivos que sea posible, ya que los conservados en fijadores pierden muchas de las características necesarias para una fácil identificación. Conocer el hábitat de una especie que colectamos con nuestras propias manos nos indicará cuáles crecen en cada sitio y en que condiciones y nos permitirá decidir luego si una unidad muestral colectada por otra persona puede contener elementos arrojados a la costa por el oleaje, o si su etiquetado presenta alguna duda. Como las algas marinas tienden a descomponerse rápidamente una 5 vez extraídas del agua, es conveniente separar y limpiar porciones pequeñas para la observación en vivo y mantenerlas en recipientes relativamente grandes, con abundante agua de mar y refrigeración. La implementación de algunas facilidades para mantener vivo parte del material colectado es el primer paso para poder llevar posteriormente a cabo cultivos de laboratorio, útiles para entender los mecanismos reproductivos y ciclos de vida de las especies. Conservar. Mientras se están estudiando las muestras conviene mantenerlas en conservadores líquidos, los que deforman menos las estructuras, pero acabado el estudio conviene muchas veces herborizarlas sobre papel, ya que es difícil el mantenimiento a largo plazo de las colecciones en frascos. Para comenzar a armar un herbario seco de macroalgas se puede consultar el método a seguir en la página del Museo Virtual de Algas Marinas de la UNPSJB (Boraso de Zaixso et al., 2003). Para preservar detalles anatómicos el medio adecuado es la formalina de buena calidad, sin precipitados, en solución acuosa, al 4% para materiales delicados y al 5% los talos más gruesos. Siempre conviene neutralizar el formol con aproximadamente una cucharada de bórax por litro de líquido, cantidad que se puede graduar usando un indicador o papel indicador de pH neutro. Si se quiere estudiar los cromosomas se deben preservar porciones del talo en alcohol 70% u otro fijador específico.Igualmente, si se planea realizar estudios ultraestructurales se deben fijar los materiales con los fijadores indicados, como el ácido ósmico. Los materiales más pequeños y detalles anatómicos que requieren preparados microscópicos a veces es mejor conservarlos directamente entre portaobjetos y cubreobjeto, en algún medio de montaje. Si se usa Kero como medio de montaje se le debe adicionar fenol para evitar el desarrollo de hongos. El bordeado del cubreobjetos con laca no es indispensable si el preparado es autosellante. La conservación de pequeñas porciones de muestras bien identificadas en abundante silicagel o en un fijador adecuado permitirá relacionar los estudios morfológicos con eventuales estudios moleculares. Si bien nos estamos refiriendo al herbario como un elemento previo al comienzo del estudio, es posible que no exista un herbario de algas marinas organizado en la institución o cátedra donde se trabaja. El herbario para investigación no puede ser el mismo que el de docencia, y cuando se va a publicar, los materiales estudiados, o al menos parte de los mismos a deben ser depositados en un herbario reconocido y con sigla internacional. En Argentina podemos depositarlo entre otros en el del Museo Argentino de Cs. Naturales Bernardino Rivadavia (CABA), donde funciona el herbario de algas marinas fundado por la Dra. Carmen Pujals y en el Herbario Regional Patagónico (HRP) de la Facultad de Ciencias Naturales de la UNPSJB en Comodoro Rivadavia, donde se ha previsto la sección de algas marinas y cuenta con curadores permanentes. Fotografiar y dibujar Fotografiar los materiales vivos antes de fijarlos, o apenas fijados es una muy buena manera de contar con datos sobre colores y texturas y para poder compartir la información. Cuando se fotografían materiales en preparados microscópicos hay que tener la precaución de numerar cada foto y anotar el aumento con que fueron tomadas y la posición del zoom utilizada, de forma de poder anexarles las escalas correctas. Al ser la fotografía digital más económica y rápida que la tradicional sobre película, es más fácil descuidar estos detalles y perder información valiosa de las imágenes. Los microscopios y lupas que se utilicen deben estar calibrados, de forma de saber cuál es el aumento real con que trabajamos, lo mismo que las cámaras claras y las cámaras fotográficas. Para ello se debe contar con las imágenes de la escala de un micrómetro objetivo, fotografiadas o dibujadas, según el caso, con las diferentes combinaciones de objetivos y oculares que se tengan disponibles. En los equipos más nuevos y específicos las escalas suelen ser provistas por los programas de computación de las cámaras adosadas a los microscopios, pero no siempre se cuenta con esos elementos. Aunque pueda parecer anticuado frente a las posibilidades actuales de documentación, el dibujo en cámara clara de una estructura observada en el microscopio óptico obliga a entenderla con 6 profundidad y da la posibilidad de anotar, anexo al mismo, los datos de la muestra, dibujos de las escalas, los números de herbario relacionados y otros comentarios, como la bibliografía utilizada al momento de realizar la determinación o las dudas que hayan surgido. Esta forma de guardar la información puede parecer trabajosa, pero en el mediano y largo plazo nos permitirá volver a los materiales por información adicional y contar con los datos de herbario del material estudiado al momento de publicar los resultados. Las frecuentes modificaciones del esquema taxonómico ocurridas en las dos últimas décadas debidas a los aportes de los estudios a nivel molecular hacen que el contenido de los textos para enseñanza pierda actualidad con rapidez, por lo cual sabemos que el esquema que hoy utilizamos probablemente pierda vigencia en un corto período. Sin embargo, si se logra internalizar un esquema general y aplicarlo a la flora de la zona de estudio, se puede mantener una razonable actualización consultando como primera herramienta la base de datos on line de Guiry & Guiry (2003-2013) y profundizando luego en las diversas fuentes. Contenido y limitaciones de este texto En este primer capítulo mencionamos las fuentes de información general más relevantes para nuestra zona y algunas aproximaciones a la ficología a través de estudios moleculares. En el capítulo 2 resumimos una serie de conceptos necesarios para poder leer la literatura especializada y abordar las descripciones de las especies, en el capítulo 3 tratamos a las algas verdes de la costa de Argentina, en el 4, las algas pardas y en los capítulos 5 y 6, las algas rojas. Este texto solo es una introducción al estudio de las algas marinas de Argentina que debe ser necesariamente completado con la lectura de la bibliografía que se recomienda en cada capítulo, la cual está lejos de ser exhaustiva. Igualmente, las ilustraciones no pretenden tener valor documental sino el de complemento de las descripciones de las especies. Respecto al esquema taxonómico seguido se ajusta, en lo posible, a las sugerencias de Guiry & Guiry (2013). Salvo en caso necesario, se omitieron deliberadamente las distribuciones geográficas de las especies porque estimamos que, de ser necesario, la información existente referida a las mismas puede ser rastreada en bibliografía accesible, como los catálogos de Papenfuss y Pujals, en Boraso y Zaixso (2007) y en Algaebase. No hemos tratado las algas que se encuentran solamente en Antártida por no contar con suficiente experiencia acerca de las mismas, pero nombramos las especies que han sido citadas para esa zona, para que los interesados puedan rastrear la literatura pertinente más reciente desde Algaebase. Al final del texto incluimos un glosario de los términos más utilizados, a los que hemos añadido unas pocas propuestas de términos en castellano, que entendemos pueden contribuir a la formación de una cultura ficológica local, necesaria si hemos de profundizar en la divulgación de los conocimientos que se tienen en el área. Agradecimientos Agradecemos a la Comisión organizadora de las VIII Jornadas de Ciencias del Mar por el apoyo brindado para la publicación de este libro, a la Dra. Liliana Quartino por el acceso a varias de las fotografías de algas de la región antártica depositadas en el Museo Argentino de Ciencias Naturales. Bibliografía recomendada en el capítulo 1 Adams, N. M. 1994. Seaweeds of New Zealand. An illustrated guide. Canterbury Univ. Press. 360 p. 7 Asensi, A. O. 1966. Guía para reconocer los géneros de algas pardas de la Argentina. Contribución del Instituto Antártico Argentino Nro.103: 51 p. Asensi, A. O.; Küpper, F. C. 2012. Seasonal periodicity and reproduction of brown algae (Phaeophyta) at Puerto Deseado. Bot Mar 55(3): 217-228. Boo S.M.; Yoon H.S., 2000.Molecular relationships of Giant Kelp (Phaeophyceae). Algae15(1): 13-16. Boraso de Zaixso, A.L. 1995. Algas bentónicas de Puerto Deseado (Santa Cruz). Composición de la flora luego de la erupción del volcán Hudson (1991). Naturalia patagónica 3(1-2): 129-15. Boraso de Zaixso, A. L. 2004. Chlorophyta marinas de Argentina. Historia Natural- Segunda Serie (Bs.As.) 3 (11): 95-119. http://www.fundacionazara.org.ar/Down/HN2_11.pdf Boraso de Zaixso, A. L.; Quartino M. L. 1993. Estudios sobre algas marinas bentónicas en la República Argentina. Naturalia Patagonica Serie Biológica 1: 35-57. Boraso, A. L.; Rico. A. E.; Perales. S.; Pérez, L.; Zalazar, H. 2005. Algas marinas de la Patagonia. Una guía ilustrada. Texto de extensión para docentes secundarios y guías de turismo. Asoc. de Cs. Naturales Félix de Azara. 56 p. http://www.fundacionazara.org.ar/Down/Guia_Algas.pdf Boraso de Zaixso, A.L. Rico. A.E., Perales. S. Pérez, L., Zalazar, H 2003. Museo Virtual-Algas Marinas. http://www.unp.edu.ar/museovirtual/Algasmarinas/presentacion.htm Boraso de Zaixso, A.L.; Zaixso, H.E. 1996 (1998) Asociaciones de algas bentónicas intermareales en el golfo San José (Chubut, Argentina). Naturalia patagónica. Ser. Cs. Biológicas. 4: 47-64. Boraso de Zaixso, A.L.; Zaixso, H.E.; Casas, G. 1999. Asociaciones de algas bentónicas submareales en el golfo San José (Chubut, Argentina). Physis secc. A 57(132-133): 17-27. Boraso de Zaixso, A.L.; Zaixso, J. M. 2007. Algas Marinas Bentónicas. En. Demetrio Boltovskoy (Ed.) (PNUD). Atlas de Sensibilidad ambiental del mar y de la costa. http://atlas.ambiente.gov.ar/tematicas/mt_02/macroalgas.htm Clayton, M. N.; Wiencke, C.; Klöser, H. 1997. New records of temperate and sub-Antarctic marine benthic macroalgae from Antarctica. Polar Biol. 17 (2): 141-149 Coll, J.; Oliveira, E. C. 1999. The benthic marine algae of Uruguay. Botanica Marina 42: 129-135. Cotton, A. D. 1915. Cryptogams from the Falkland Islands collected by Mrs. Vallentin. J. Linn. Soc. Bot. 43: 137-231, 7pls. Coyer, J.A.; Hoarau, G.; Beszteri, B.; Pearson, G. Expressed sequence tag-derived polymorphic SSR markers for Fucus serratus and amplification in other species of Fucus. Molecular Ecology Resources. 9(1):168-170 Croce, M.E.; Parodi, E. R. 2012. Seasonal dynamic of macroalgae in intertidal pools formed by beds of Crassostrea gigas (Mollusca, Bivalvia) on the north Patagonian Atlantic coast. Botanica Marina. 55(1): 49-58. Chapman, V. J. 1956. The Marine algae of New Zealand. Chlorophyceae. J. Linn. Soc. of London. 55 (360): 373-501 + 50 pls. Chapman, V. J. 1979. The marine algae of New Zealand. Part III. Rhodophyceae. 4. Gigartinales. Cramer. Vaduz. 279-510. Cho G.Y.; Kim M.S.; Boo S.M., 2005. Phylogenetic relationships of Soranthera ulvoidea (Chordariaceae, Phaeophyceae) on the basis of morphology and molecular data. Algae, 20(2): 91-97. Choi; H. G.; Kim, M. S.; Guiry, M. D; Saunders, G. W. 2001. Phylogenetic relationships of Polysiphonia (Rhodomelaceae, Rhodophyta) and its relatives based on anatomical and nuclear small-subunit rDNA sequence data. Can. J. Bot. 79: 1465-1476 Choi; H. G.; Kraft, G.T.; Lee, E.K. ; Saunders, G.W. 2002. Phylogenetic analyses of anatomical and nuclear SSU rDNA sequence data indicate that the Dasyaceae and Delesseriaceae (Ceramiales, Rhodophyta) are polyphyletic. European Journal of Phycology, 37:551-569. D'Antoni, E. 1973. Sobre un interesante complejo epifítico en Codium vermilara (Chlorophyta). Bol. Soc. Arg. Bot. 15 (2-3): 157-174. De Clerck O.; De Vos P.; Gillis M.; Coppejans E., 2001. Molecular systematics in the genus Dictyota (Dictyotales, Phaeophyta): a first attempt based on restriction patterns of the Internal Transcribed Spacer 1 of the rDNA (ARDRA-ITSl). Systematics and Geography of Plants. 71: 25-35. 8 Delépine, R.; Hureau, J. 1963. La végetation marine dans l' Archipiel de Pointe Géologie (Térre Adélie) (Aperçu preliminaire). Bull. Mus. Nat. Hist. Nat. París Sér. 2, 35: 108-115. Delépine, R.; Mackenzie Lamb, I.; Zimmerman, M. H.1966. Preliminary report on the marine vegetation of the Antarctic Peninsula. Proc. of the 5th. Intl. Seaweed Symp.: 107-116. De Toni, G. B.1889. Über einige Algen aus Feuerland un Patagonien. Hedwigia 28: 24-26. Díaz, P.; López Gappa, J. J.; Piriz, M. L. 2002. Symptoms of eutrophication in intertidal macroalgal assemblages of Nuevo Gulf (Patagonia, Argentina). Botanica Marina, 45:267-273. Dumont D'Urville, J. S. C.1841-1846. Voyage au Pöle sud et dans I'Océanie sur les corvettes I'Astrolabe et la Zelée, exécute par ordre du Roi pendant les années 1837-38-39-40. Paris, 1841-46, 20 vol y 1 atlas. Etcheverry, H. D.1986. Algas marinas de Chile. Oficina Regional de Ciencia y Tecnología de la UNESCO para América Latina y el Caribe. ROSTLAC. 379 p. FAO.1987. Fiches FAO d´identification des espèces pur les besoins de la péche. Ocèan Austral. Zone de la Convention CCAMLR. Zones de pêche 48, 58 et 88. Foslie, M. 1900. Calcareous algae from Fuegia. En O. Nordenskjöld, Wiss. Ergeb. Schwed. Sudp. Exped. Magellansländern 1895-1897. Botanik 3: 65-75. Stockholm. Foslie, M. 1907. Antarctic and Subantarctic Corallinaceae. En O. Nordenskjöld, Wiss. Ergeb. Schwed . Sudp. Exped. 1901-1903. Botanik 4 (5): 1-16, 2 pls. Stockholm. Gallardo, T.; Pérez Ruzafa, I. M.; Flores Moya, A; Conde, F. 1999. New collections of benthic marine algae from Livingston and Deception Islands (South Shetland Islands) and Trinity Island (Bransfield Strait) Antarctica. Botanica Marina 42:61-69. Gain, M. L. 1911. Note sur trois espèces nouvelles d' algues marines provenant de la région antarctique sud-americaine. Bull. Mus. Hist. Nat. París 17 (6): 482-484. Gain, M. L. 1912. La flore algologique des régions antarctiques et subantarctiques. En J. B. Charcot, Deuxieme expedition antarctique francaise 1908-1910. Sci. Nat. Doc. Sci. Paris: 1-218, 8 pl., 1 cart. Gaudichaud, C. 1826. Botanique. En L. C. Freycinet, Voyage autour du monde fait par la ordre du Roy sur les corvettes "L'Uranie" et "Le Physicienne" pendant les années 1817-1820, 4, vii + 522 p., 120 pl. Gepp, A.; Gepp, E. S. 1905. Antarctic algae. List of Marine algae from the South Orkneys by the Scottish Antarctic Expedition. J. Bot. London 43: 105-109, 1 pl. Gepp, A.; Gepp, E. S. 1917. Marine Algae in British Antarctic ("Terra Nova") Expedition, 1910, Bot. 2: 17-22. London. Guiry, M. D.; Guiry, G. M. 2003 - 2013. AlgaeBase. World-wide electronic publication, National University of Ireland, Galway. http://www.algaebase.org. Halperín, D. R. de.1967. Cianofíceas marinas de Puerto Deseado (provincia de Santa Cruz, Argentina), II. Darwiniana 14: 273-354. Halperín, D. R. de.1970. Cianofíceas marinas del Chubut (Argentina). I Golfo San José, Golfo Nuevo y alrededores de Rawson. Physis 30 (80): 33-96. Hariot, P. 1887. Algues magellaniques nouvelles. J. Bot. París 1: 55-59, 72-74. Hariot, P. 1889. Algues. En Mission Scientifique du Cap Horn (1882-83). Bot. 5: 1-109, 9 pl. Hariot, P. 1891. Contribution a la flore cryptogamique de la Terre de Feu. Bull. Soc. Bot. France 38: 416-422. Hariot, P. 1892. Complément a la flore algologique de la Terre de Feu. Notarisia 7: 1427-1435. Hariot, P. 1895. Nouvelle contribution a l'étude des algues de la région magellanique. J. Bot. París 9: 95-99. Hariot, P. 1907. Algues. En J. Charcot, Expédition antarctique française (1903-1905). Sci. Nat. Doc. Sci.: 1-9. Masson et Cie. Harper, J. T.; Saunders, G. W. 2001.The application of sequences of the ribosomal cistron to the systematics and classification of the florideophyte red algae (Florideophyceae Rhodophyta). Cah. Biol. Mar. 42, 25–38. Harvey, W. H. 1847. Nereis Australis, or algae of the southern ocean. viii + 124 p, 50 pl. Londres. 9 Heydrich, F. 1900. Les Lithothamniées de l' expedition antarctique. En E. de Wildeman, Expédition antarctique belgue. Note préliminaire sur les algue rapportées par M. E. Racovitza, nat. de l'expédition. Bull. Class. Sci. Acad. Roy. Belgique 1900 7: 560-566. Ho C.; Phang S.; Pang T. 1995. Molecular characterisation of Sargassum polycystum and S. siliquosum (Phaeophyta) by polymerase chain reaction (PCR) using random amplified polymorphic DNA (RAPD) primers. J. Appl. Phycology 7: 33-41 Hoffmann, A.; Santelices, B. 1997. Flora Marina de Chile Central.Ediciones Universidad Católica de Chile. 430 p. Hooker, J. D. 1844-1847. The botany of antarctic voyage. I. Flora antarctica. 1: xii + 208, 80 pl., 2: 209-574, 28 pl. Hooker, J. D. 1847. The botany of the Antarctic voyage of H.M.S. "Erebus" and "Terror" in the years 1839-43. Flora Antarctica; part 2; Botany of Fuegia, The Falklands; Kerguelen Island, etc. (1845-47). Algae : 454-502, pls. 165-194. London. Hooker, J. D.; Harvey, W. H. 1845. Algae antarctica. discovered during the voyage of H.M. discovery Ships "Erebus" and "Terror". J. Bot. London 4: 249-276. Howe, M. A. 1914. Marine Algae of Perú. Mem. Torrey Bot. Club 15: 180 p., 50 pl. Howe, M. A. 1930. Notes on the algae of Uruguay. Bull. Torrey Bot. Club 52: 605-610., 1pl. Hu, Z.; Zeng, X.; Wang, A.; Shi, C.; Duan, D.. 2004. An efficient method for DNA isolation from red algae Journal of Applied Phycology 16: 161–166. Huh M.K.; Lee B.K.; Lee H.Y., 2006. Genetic diversity and phylogenetic relationships in five Porphyra species revealed by RAPD analysis. Protistology 4 (3), 245_250. Hylmö, D. 1919. Zur Kenntnis der subantarktischen und antarktischen Meeresalgen. III. Chlorophyceen. En O. Nordenskjöld, Wissenschaftliche Ergebnisse der schwedischen Südpolar Expedition 1901-1903. 4: 2 (16): 20 p, 33 fig. Hylmö, D. 1938. Botanische Ergebnisse der schwedishen Expedition nach Patagonien und dem Feuerlande, 1907-1909. XI. Meeresalgen 3 Chlorophyceae. K. Sv. Vet. Akad. Handl. ser.3, 17 (1): 23 p., 5 figs. Ian H.A T. 1995. Ribosomal DNA phylogeny of the plant division Phaeophyta. Simon Fraser University, Tesis Doctoral. Kawai, H.; Hanyuda, T.; Lindeberg, M.; Lindstrom, S.C., 2008. Morphology and molecular phylogeny of Aureophycus aleuticus gen. et sp. nov. (Laminariales, Phaeophyceae) from the Aleutian Islands. Journal of Phycology. 44, 1013–1021. Kühnemann, O.1969. Vegetación marina de la ría de Puerto Deseado. Opera Lilloana 17:1-169,132 pl. Kühnemann, O. 1972. Bosquejo fitogeográfico de la vegetación marina del litoral argentino. Physis 31 (82): 117-142 y 31 (83): 295-325. Kühnemann, O. 1976. Observaciones ecológicas sobre la vegetación marina y terrestre de la Isla de los Estados (Tierra del Fuego, Argentina). Ecosur 3 (6): 121-248. Lamb, I.; Zimmermann, M. H. 1977. Benthic marine algae of the Antarctic Peninsula. A preliminary guide to the commoner benthic marine algae of the antarctic Peninsula and adjacent Islands. Biology of the Antarctic Seas 5. Antarctic Res. Ser. 23: 129-229. Leliaert F., Rousseau, F.; De Reviers, B.; Coppejans, E. 2001. Phylogeny of the Cladophorophyceae (Chlorophyta) inferred from partial LSU rRNA gene sequences: Is the recognition of a separate order Siphonocladales justified?. European Journal of Phycology, 38: 233 – 246. Lemoine, P. 1915. Melobesiae. En A. D. Cotton, Cryptogams from the Falkland Island. J. Linn. Soc. London 43: 193-200. Lemoine, P. 1920. Botanische Ergegnisse der schwedische Expedition nach Patagonien und Feuerlande 1907-1909. VII. Les Mélobesiées. Kgl. Sven. Vetens. Akad. Hand. 41 (4): 1-17, 1pl. Levring, T. 1945. Marine algae from some Antarctic and Subantarctic islands. Lunds Univ. Årsskr. N.F. Avd. 2, 41 (7): 1-36, 1pl. Lindauer, V. W.; Chapman, V. J.; Aiken, M. 1961. The marine algae of New Zealand. II. Phaeophyceae. Nova Hedwigia 3 (2/3): 350 p + 41 pl. Llaña, A. H. 1948. Primera expedición antártica chilena. Algas Marinas. Rev. Biol. Mar. (Univ. de Chile) 1 (1): 19-31 + IV. 10 Martinez E.; Cárdenas, L.; Pinto, R. 2003. Recovery and genetic diversity of the intertidal kelp Lessonia nigrescens (Phaeophyceae) 20 years after el niño 1982/83. Journal of Phycology 39, 504–508. Mendoza M.L.; Boraso De Zaixso, A.L.; Zaixso, H. E.; Nizovoy, A.; Ramos, L. 2005. Composición estacional del estrato herbáceo- mucinal en un bosque de Macrocystis pyrifera de Isla Despard (Canal de Beagle, Argentina)” XI Congreso Latinoamericano de Cienciass del Mar. Viña del Mar, Chile. 16-20/05/05. Resumenes p 168. http://www.alicmar.org/congresos/documentos/decimoPrimero/Resumenes.pdf Mendoza, M.L.; Nizovoy, A. 2000. Géneros de Macroalgas Marinas de la Argentina, fundamentalmente de Tierra del Fuego. Tierra del Fuego, Argentina. Informe CADIC. 142 p. Montagne, C. 1839. Sertum patagonicum. Cryptogames de la Patagonie. En A. D'Orbigny, Voyage dans l' Amerique méridionale, 7 (1): 1-19, 7 pls. Montagne, C. 1845. Plantes cellulaires. En V. S. C. Dumont D'Urville, Voyage au Pôle Sud et dans l'Océanie sur les corvettes "L'Astrolabe" et la "Zelée" pendant les années 1837-1840. Botanique 1: xiv + 349 p., 20 pl. Montagne, C. 1846. Cryptogames cellulaires et vasculaires. En Voyage autour du monde (1836-1837) sur la corvette "la Bonite". Botanique 1, 355 p. Mróz, L. W., 1985. Tesis Master. Ribosomal DNA assessment of genetic relationships among Alaria Greville (Phaeophyta) stands from Vancouver Island and vicinity. Simon Fraser University. Negri, R. M.; Benavides, H. R.; Akselman, R. 2004. Algas del litoral marplatense. En Boschi, E. E. & M. B. Cousseau (ed.) “La vida entre mareas: vegetales y animales de las costas de Mar del Plata, Argentina”. Publicaciones especiales INIDEP, Mar del Plata: 73-86. Ohno, M. 1976. On the seaweeds from the coast of Lützow-Holm Bay, Antarctica. Antarctic Record (Nat. Inst. Polar Res. Tokyo) 57: 136-140. Olivier, S. R.; Kreibohn de Paternoster, I.; Bastida R. 1966. Estudios biocenóticos en las costas de Chubut (Argentina). I. Zonación biocenológica de Puerto Pardelas (Golfo Nuevo). Bol. del Instituto de Biología Marina Mar del Plata.10, 74 pp. Papenfuss, G. F. 1964. Catalogue and bibliography of antarctic and subantarctic benthic marine algae. Antarctic. Res. Ser. American Geophys. Union 1: 1-76. Parma, A.; Pascual, M.; Sar, E. 1987. Clave para el reconocimiento de los géneros de algas macrofitas del intermareal rocoso bonarense. Serie Técnica y Didáctica, Serie aperiódica de la Facultad de Cs. Nat. y Museo de La Plata, Argentina 15, 29 p. Pearson, G.; Lago-Leston, A.; Valente, M.; Serrão, E. 2006. Simple and rapid RNA extraction from freeze-dried tissue of brown algae and seagrasses, European Journal of Phycology, 41:1, 97-104 Peng X.; Wang X.; Li X.; Zhao Y.; Yao L.; Duan D., 2005. Genetic study of Kelp “901” strain. Chinese Journal of Oceanology and Limnology 23 (2):152-157. Piriz, M. L. Algas Marinas, Clave ilustrada para identificación de los géneros más frecuentes en Goilfo Nuevo y alrededores. http://www.cenpat.edu.ar/geac/PDFs/Macroalgas.pdf Pujals, C. 1963. Catálogo de Rhodophyta citadas para Argentina. Rev. Museo Argentino de Ciencias naturales Bernardino Rivadavia. serie Cs. Bot. 3 (1): 1-139. Pujals, C. 1977. Adiciones y correcciones al "Catálogo de Rhodophyta citadas para la Argentina". Revista del Museo Argentino de Ciencias Naturales Bernardino Rivadavia 5 (6): 123-163. Provan, J.; Murphy, S.; Maggs, Ch. A. 2004. Universal plastid primers for Chlorophyta and Rhodophyta, European Journal of Phycology, 39:1, 43-50 Quartino, M .L.; Klöser, H.; Boraso de Zaixso, A. L.; Zaixso, H. E. 1998. Communities of Benthic marine macroalgae at sheltered site in Potter Cove, King George Island, South Shetland, Antarctica. In Wiencke,C: Ferreyra, G.; Amtz, W. And C. Rinaldi Eds. The Potter Cove Coastal Ecosystem, Antarctica. Reports on Polar Research 299: 74-81. Quartino, M .L.; Zaixso, H. E.; Boraso de Zaixso, A. L. 2005. Biological and environmental characterisation of marine macroalgae assemblages in Potter cove, South Shetland Islands, Antarctica. Botanica Marina. 98(3):187-197. Ragonese, A. E.; Piccinini, B. 1972. La vegetación de la Isla de los Pájaros (Provincia del Chubut). IDIA 291: 31-50. 11 Reinbold, T. 1907. Die Meeresalgen der deutschen Tieffse-Expedition, 1898-1899. Wiss. Ergeb. deutsch. Tieffse-Exped. "Valdivia" 1898-1899. 2 (2): 549-586. Reinbold, T. 1908. Die Meeresalgen. En E. von Drygalsky, Deutsche südpolar Exped. 1901-1903. Botanik 8 (2): 179-202. Reinsch, P. F. 1888. Species et genera nova algarum ex insula Georgia Australi. Ber. deutsch. Bot. Ges. 6 (4): 144-156. Reinsch, P. F. 1890. Zur Meeresalgenflora von Süd-Georgia. En G. Neumayer, Die Internat. Polarforschung 1882-1883. Die deutsch. Exped. 2 (15): 366-454. Ricker, R. W. 1987. Taxonomy and biogeography of Macquarie Island Seaweeds. British Museum (Nat. Hist.) London, 344p., 126 figs. Sar, E.; Pascual, M.; Parma, A. 1984. Consideraciones ecológicas sobre las algas del litoral rocoso bonaerense. Rev. Mus. de La Plata (n.s.) Botánica 13 (75): 143-147. Saunders, G. W.; Lehmkuhl, K. V. 2005.Molecular divergence and morphological diversity among four cryptic species of Plocamium (Plocamiaceae, Florideophyceae) in northern Europe. European Journal of Phycology 40: 293-312. Shi, C.; Hu Z.; He Y.; Zou Y.; Zhang D.; Duan D., 2004. Identification and assessing the cultivars of Laminaria Lamx. (Phaeophyceae) with molecular markers. J. Aquaculture. Skottsberg, C. 1906. Observations on the Vegetation of the Antarctic Sea. Botaniska Studier, Uppsala: 245-264, 3pl. Skottsberg, C. 1941. Communities of Marine Algae in Subantarctic and Antarctic waters. K. Svenska Vetenkapasakad. Handlingar. ser. 3, 19 (4): 92 p., 7 figs., 3 pls. Skottsberg, C. 1953. On two collections of Antarctic marine algae. Ark. Bot., Ser II, 2: 531-566, 23 figs., 1 pl. Skottsberg, C. 1964. Antarctic Phycology. En R. Canick, M. W. Holdgate, I. Prevost (ed.). Biologie Antartique. Comp. Rend. Premier Symp. S.C.A.R., Hermann, París: 147-154. Song L.; Duan D.; Li X; Li C., 1998. Use of RAPD for detecting and identifying Porphyra (Bangiales, Rhodophyta). Chin. J. Oceanol. Limnol. 16 (3): 237-242. Sutherland, J. E.; Lindstrom, S. C.; Nelson, W. A.; Brodie, J.; Lynch, M . D.; Hwang, M. S.; Choi, H. G., Miyata, M.; Kikuchi, N.; Oliveira, M. C.; Farr, T.; Neefus, C.; Mols-Mortensen, A.; Milstein, D.; Müller, K. M. 2011. A new look at an ancient order: generic revision of the Bangiales (Rhodophyta). Journal of Phycology 47(5): 1131-1151. Svedelius, N. 1900. Algen aus den Ländern der Magellanstrasse und Westpatagonien. I. chlorophyceae. En O. Nordenskjöld, Wiss. Ergeb. schwed. Exped. nach den Magellansländern (1895-1897). 3 (8): 283-316, 16 pl. Stockholm. Taylor, W. M. 1939. Algae collected by the "Hassler", "Albatross" and "Schmitt" expeditions. II. Algae from Uruguay, Argentina, The Falklands and the Strait of Magellan. Mich. Acad. Sci. Arts Letters 24 (1): 127-164. Wang X.; Liu C.; Li X.; Cong, Y.; Duan D. 2005. Assessment of genetic diversities of selected Laminaria (Laminariales, Phaeophyta) gametophytes by Inter-Simple Sequence Repeat Analysis. J of integrative Plant Biology 47 6 753-758. Wang X.; Yang Y.; Cong Y.; Duan D. 2004. DNA fingerprinting of selected Laminaria (Phaeophyta) gametophytes by RAPD markers. Wattier, R. A.; Davidson, A. L.; Wardy, B. A.; Maggs, Ch. A. 2000. cpDNA-RFLP in Ceramium (Rhodophyta): intraspecific polymorphism and species-level phylogeny. American Journal of Botany 88:(7): 1209-1213. Wattier, R. A.; Prodöhl, P.; Maggs, Ch. A. 2000. DNA Isolation Protocol for Red Seaweed (Rhodophyta). Plant Molecular Biology Reporter 18: 275–281, Wiencke, C.; Clayton, M. N. 2002. Antarctic seaweeds. In J. W. Wägele. Synopses of the antarctic benthos. vol. 9. 237 p. A. R. G. Gantner Verlag KG Ruggell/Lichtenstein. Womersley, H. B. S. 1984. The Marine benthic flora of Southern Australia, Part I. South Australian, D. J. Woolman, Government Printing, Adelaide, South Australia, 329 p. Womersley, H. B. S. 1987. The Marine benthic flora of Southern Australia, Part II. South Australian. D. J. Woolman, Government Printing Division, Adelaide, South Australia, 484 p. 12 Womerley, H. B. S. 1994. The Marine benthic flora of Southern Australia, Part III A. Flora of Australia Supplementary series N° 1. Australian biological resources study. Canberra, 508 p. Womersley, H. B. S. 1996. The marine benthic flora of Southern Australia. Rhodophyta. Part IIIB. Gracilariales, Rhodymeniales, Corallinales and Bonnemaisoniales. Flora of Australia Supplementary series, N° 5. Australian biological resources study. Canberra. 392 p. Womersley, H. B. S. 1998. The marine benthic flora of Southern Australia. Rhodophyta. Part IIIC. State Herbarium of South Australia. 535 p. Wong, C.L.; Gan, S.Y.; Phang, S.M. 2004. Morphological and molecular characterisation and differentiation of Sargassum baccularia and S. polycystum (Phaeophyta). Journal of Applied Phycology (16): 6, pp. 439-445. Wong, C.L.; Ng, S.M.; Phang, S.M. 2007. Use of RAPD in differentiation of selected species of Sargassum (Sargassaceae, Phaeophyta). J. Appl. Phycol. 19:771–781. Yoon, H.S.; Lee, J.Y.; Boo, S.M.; Bhattacharya, D. 2001. Phylogeny of Alariaceae, Laminariaceae, and Lessoniaceae (Phaeophyceae) Based on Plastid-Encoded RuBisCo Spacer and NuclearEncoded ITS Sequence Comparisons. Molecular Phylogenetics and Evolution 21 (2,): 231– 243. Zaixso, H. E., Boraso, A. L., López Gappa, J. J. 1978. Observaciones sobre el mesolitoral rocoso de la zona de Ushuaia (Tierra del Fuego) Argentina. Ecosur 5 (10): 119-130. Zaixso, H. E.; Pastor, C. T. 1977. Observaciones sobre la ecología de los mitílidos de la ría Deseado. I. Distribución y análisis biocenótico. Ecosur 4: 1-46. Zhao, F.; Liu, F.; Liu, J.; Ang, Jr. O; Duan, D. 2008. Genetic structure analysis of natural Sargassum muticum (Fucales, Phaeophyta) populations using RAPD and ISSR markers. J. Appl. Phycol. 20:191–198. 13 Capítulo 2: LOS ELEMENTOS A lo largo de la historia de la ficología se ha intentado integrar en textos los conocimientos que se tenían hasta ese momento. De estas obras nos parece relevante la mención de algunas que resultaron en su época hitos de la mayor importancia como introducciones generales al estudio de las algas: Harvey (1849); Oltmanns (1904); Fritsch (1943 y 1945); Chadefaud (1960); Chapman (1962); Feldmann (1963) y Bold & Wynne (1985). Estas obras están escritas en idioma inglés, alemán y francés y existen textos en japonés, coreano y chino a los que usualmente solo se tiene acceso a través de traducciones al inglés. En las revistas especializadas durante las últimas décadas se ha publicado mayoritariamente en idioma inglés, por lo que casi todos los términos especializados, aún los de raíz latina, han sido adaptados a ese idioma. Estas circunstancias, si bien facilitan el intercambio entre especialistas, dificultan enormemente la evolución en los aspectos de la didáctica y la divulgación de los avances en los países de habla hispana. Para abordar el estudio inicial de las macroalgas es necesario conocer las definiciones de los términos utilizados y también contar con un marco de referencia para su aplicación que se apoye en forma equilibrada en las diferentes líneas de pensamiento que han construido el conocimiento actual de esta especialidad. El marco de referencia básico que se intenta esbozar en este capítulo abarca una serie de elementos y definiciones esenciales para la lectura de la bibliografía actual, recupera algunas ideas de la escuela ficológica francesa del siglo XX, que a nuestro entender poseen indudable valor conceptual y propone, en la medida que ha parecido de utilidad, algunos términos en idioma español que pueden contribuir a elaborar textos útiles para la enseñanza inicial de la ficología en los países de habla hispana. Para facilitar la lectura fluída de este capítulo y los siguientes, será probablemente de utilidad la consulta del glosario que se adjunta al final del texto. Los talos El cuerpo de las algas se denomina talo y está constituido por una o muchas células que pueden ser uninucleadas o multinucleadas, o por cenocitos. En esta ocasión nos enfocaremos principalmente en los talos multicelulares de las macroalgas. Las características externas de los talos son reflejos de las estructuras internas, de las relaciones entre sus partes y de la forma de crecimiento. La morfología externa de los talos afecta a la capacidad de la función fotosintética, la absorción de nutrientes, la resistencia a la herbivoría y a los disturbios físicos, como el oleaje y la desecación, por lo que los talos, especialmente los más grandes y complejos, requieren un equilibrio delicado entre la forma y la función de sus partes. Cuando deseamos desarrollar la habilidad de identificar las especies de las macroalgas a través de su morfología y anatomía debemos conocer las características propias del grupo taxonómico al que pertenece y estar preparados para analizar todos los ejemplares posibles, de forma de entender los aspectos de la variabilidad de la especie que puedan provenir tanto de las diferencias genéticas, como de la influencia del ambiente, o del estadio de desarrollo del talo o de la fase del ciclo de vida representada en la muestra. En este capítulo se expone la variedad de anatomías de los talos de las macroalgas; se describe como éstos se llegan a estructurar a partir de las esporas o cigotas que los originan y se señalan los ciclos de vida básicos. 14 Elementos de morfología y anatomía Organización celular Las algas pueden producir tejidos de naturaleza polística o haplóstica. En los tejidos polísticos las divisiones celulares tienen lugar en varios planos, como resultado de las diferentes orientaciones del huso durante la división mitótica. Estos tejidos corresponden frecuentemente a formas laminares (Ulva, Porphyra) o macizas (Prasiola, Dyctyota, Sphacelariales). En los tejidos haplósticos en cambio predominan las divisiones celulares transversales a la dirección de crecimiento de un filamento, las que son alteradas en su dirección solo en los puntos de formación de ramas laterales. Los pseudoparénquimas son tejidos de apariencia parenquimatosa, pero formados totalmente por estructuras originalmente filamentosas, es decir que son estructuras haplósticas en las que, por engrosamiento y mutua compresión de sus células, éstas adquieren un aspecto globoso o hasta isodiamétrico. Estos tejidos constituyen talos laminares, cilíndricos o macizos. Estructura básica del talo Las formas más sencillas de los talos son los arqueotalos (talos unicelulares; los coloniales filamentosos o masivos y los filamentosos simples). Le siguen en complejidad los prototalos (talos filamentosos simples o ramificados, a veces heterotricos y talos polísticos, laminares, cilíndricos o masivos) y finalmente los cladomas, los que pueden ser filamentosos o pseudoparenquimatosos y con diversos grados de organización morfológica. Algunas especies poseen diferente grado de complejidad externa en las diferentes fases de sus ciclos de vida, de los que se dice entonces que son heteromórficos. Es frecuente que una fase del ciclo de vida de un alga no supere la categoría de arqueotalo, mientras que la fase alternante esté constituida por cladomas o talos fucoides de alta complejidad. Talos postrados, erectos y heterotricos Desde el momento en que germina una espora o cigota quedan determinadas algunas características que influirán en la forma de vida del talo adulto. Las primeras células podrán ser todas parte de un sistema postrado o producir un filamento erecto, o se repartirán entre un sistema postrado y uno erecto. La comprensión de los estadios por los que pasa el talo de un alga desde su reclutamiento hasta alcanzar su pleno desarrollo y madurez reproductiva es esencial para establecer una acabada descripción de cada especie; pero también debemos conocer sus características en la senectud, ya que en esa etapa puede persistir en el terreno como estructuras perennes, rastreras o costrosas, más resistentes durante la estación desfavorable. Los talos postrados pueden provenir de un crecimiento primario en el plano horizontal o de un talo primariamente erecto que adquiere secundariamente una posición postrada. El crecimiento de los talos postrados puede compararse con el de los talos erectos en complejidad, ya que abarca desde simples filamentos rastreros que pueden radiar desde un centro, conservando su naturaleza filamentosa, hasta pseudoparénquimas de estructura compleja, con porciones vegetativos y fértiles. Los talos primariamente heterotricos poseen una porción filamentosa postrada de la que surgen filamentos erectos, esta característica se aplica a muchas especies de algas Chaetophorales y Ectocarpales pequeñas. Por extensión se ha aplicado el término “heterotricho” a talos de mayor desarrollo, en los que se encuentra una parte postrada y una erecta formadas ambas por la combinación de estructuras de origen complejo, a esta condición se la denomina “heterotriquia secundaria”. En las Corallinales en especial encontramos un gran desarrollo en la variedad de talos total o parcialmente postrados 15 Los talos pueden desarrollarse en longitud y ramificarse como monopodios o simpodios. Aquellos ejes de crecimiento que cuentan con una célula o zona apical de crecimiento y forman las ramificaciones en células por debajo de las mismas se denominan monopodios; es decir que el eje principal se mantiene como eje principal de crecimiento en tanto no se rompa su ápice . Simpodios son aquellos ejes que, una vez crecida una porción apical, reasumen el crecimiento en longitud a través del primer primordio de una rama lateral, hasta que éste produce a su vez, un nuevo primordio lateral; de esta manera, lo que se observa como eje en el talo desarrollado, es en realidad la suma de las porciones basales de las sucesivas ramas laterales. Crecimiento y meristemas El crecimiento del talo procede por el aumento de número de células por división celular y por el aumento en volumen de las células. Frecuentemente las divisiones que llevan al crecimiento del talo son más frecuentes en una o varias células del talo (meristemas), las que pueden estar dispersas o concentradas en alguna región del mismo (regiones meristemáticas). La forma de crecimiento de los tejidos tiene relación con características celulares muy básicas, como la capacidad de las paredes celulares para estirarse, permitir la deposición de más material, formar conexiones, cicatrizar, acompañar o no a la citocinesis o la formación de callos. Detalles como la forma de división celular por formación de protuberancias o por división longitudinal o transversal de la célula, la presencia de celulosa II o regenerada, la cantidad relativa de celulosa, manosa y xilosa, la regeneración de la pared, el crecimiento en H de las paredes, y muchos otros aspectos relacionados con la composición química de las paredes de las células vegetativas y reproductivas son de primera importancia al momento de relacionar forma y función de los talos. En muchos casos, como en las Ceramiales, las células maduras del centro y la base del talo son mucho más voluminosas que las apicales. En algunos casos las células pueden aumentar su tamaño estirando sus paredes distalmente (apicalmente) y en otros lo hacen proximalmente (hacia la base) determinandp un crecimiento por aumento de volumen celular respectivamente acropeto y basipeto. En prototalos es frecuente la división intercalar sin ningún esquema regular aparente asociado, pero en los cladomas en cambio, suele haber zonas meristemáticas bien definidas. Por su posición los meristemas pueden ser: apicales, subapicales (los que pueden producir crecimiento tricotálico), intercalares o meristodermas asociados a las zonas corticales. Los meristodermas proceden por división de las células epidérmicas en sentido periclinal (paralelas al cline de la superficie del talo) y anticlinal (perpendicular al cline de la superficie del talo). El crecimiento en grosor de talos cilíndricos puede darse por aparición de nuevas células en los ápices de los filamentos que conforman las cortezas y/o por aumento en volumen de las células internas del talo. En los talos más complejos es a veces bastante difícil interpretar si el tipo de crecimiento corresponde a estructuras polísticas o haplósticas, ya que células producidas en meristemas y meristodermas a través de divisiones en varios planos, al madurar se alargan en forma de filamentos sugerentes de pseudoparénquimas, ejemplos de esta dificultad se han encontrado en el orden Scytothamnales de las algas pardas. Cladomas La máxima complejidad en los tejidos de naturaleza haplóstica se encuentra en la estructura de cladoma. Los cladomas son básicamente estructuras filamentosas, ramificadas regularmente, con ejes de crecimiento indeterminado y ramas laterales de crecimiento determinado, denominadas pleuridios (whorl branches). Que los pleuridios sean de crecimiento definido, da a los talos cierta regularidad en su aspecto externo. En la bibliografía anglosajona se ha ignorado el concepto de cladoma prefiriéndose describir a los talos en función de la naturaleza del crecimiento determinado o indeterminado de cada una de sus partes y su relación con la dominancia apical. 16 Cuando un cladoma está organizado sobre un eje central formado por un solo filamento con verticilos de pleuridios, se considera uniaxial. Cuando el eje central está formado por varios filamentos más o menos paralelos se considera multiaxial. Tanto los ejes, como los pleuridios pueden ser de primer orden o estar insertos en otro eje o rama, por lo que se suele hacer referencia a ejes primarios y secundarios y pleuridios primarios, secundarios o de orden superior. En la lámina 2.1 se muestran varios tipos de cladomas de tipo uniaxial (a-i) y multiaxial. (j-l). Los pleuridios se pueden insertar en forma opuesta sobre el eje uniaxial (lám 2-1 a y d, en vista lateral y en corte transversal respectivamente). Otros esquemas posibles podrán mostrar a los pleuridios insertos unilateralmente o en forma alterna. En la lám 2-1 (b) algunos de los pleuridios han sido reemplazados por ejes secundarios (ramas de crecimiento indeterminado) y en (c) se observan pleuridios de segundo orden. En (g) y (f) la inserción de los pleuridios es radial, otros esquemas de inserción podrían ser en helicoide o con algunos pleuridios reducidos a una o pocas células, como en la lám 2-1 (e). En la lámina 2-1(h) las profusas divisiones distales de los pleuridios, acompañadas de un aumento en volumen de las células proximales de los mismos dan lugar a pseudoparénquimas, lo que confiere al talo un aspecto externo cilíndrico y se visualiza en corte como una zona cortical pigmentada y una medular generalmente desprovista de cromatóforos. En (i) se muestra al pseudoparénquima desarrollado mayormente en un plano de una o pocas células de grosor, dando un talo folioso, con un cladoma secundario. En (j) se muestra un aspecto análogo al de (f), pero correspondiente a un talo multiaxial. En (k) se muestran varios filamentos axiales (eje multiaxial) creciendo paralelamente, con pleuridios primarios y secundarios hacia la parte externa del talo, y con un cladoma secundario. En (l) se muestra un corte transversal esquemático de un talo multiaxial, con pleuridios formando un pseudoparénquima, a la altura del nacimiento de un eje secundario, también multiaxial. En la formación de los cladomas se ha desarrollado una nomenclatura bastante específica; por ejemplo la formación de los pleuridios puede originarse por divisiones perpendiculares al eje (división ortómera) las que producen verticilos semejantes entre sí, o puede ser ligeramente inclinada y siguiendo una helicoide (división helicómera) o en orden lateral alternante (división escorpioidea). El juego de dominancia entre el eje y las ramas laterales de crecimiento determinado o indeterminado de diferentes órdenes, modificado por las influencias ambientales, lleva a la enorme variedad de estructuras de las especies y sus expresiones fenotípicas. Extensión del concepto de cladoma. La aplicación del concepto de cladoma se podría ampliar hasta abarcar varios tipos de talos, algunos de aspecto externo macizo y que a a primera vista parecen formados por estructuras polísticas. En estos talos macizos, las células con cromatóforos de la superficie del talo son normalmente más pequeñas que las hialinas internas y su formación se podría interpretar como divisiones transversales de pleuridios (divisiones periclinales en el meristoderma). Las divisiones anticlinales del meristoderma, serían homólogas por su parte, a la ramificación de los pleuridios, esto podría ejemplificarse con el talo hueco de las Scytosiphonales. En varias de las Sphacelariales el eje es claramente polístico, pero se encuentra revestido de filamentos cortos de crecimiento definido, reminiscentes de un cladoma. La estructura polisifónica de las Rhodomelaceae se puede pensar como un eje con verticilos de pleuridios (Chondria) o formada solo por las células basales de los pleuridios en los casos más reducidos (Polysiphonia.). Algunos interpretan el crecimiento de Dictyota como el de un cladoma reducido al eje, polístico, dicotómico y sin pleuridios. 17 También se puede llegar a describir el talo de las Laminariales y Durvilleales como un eje polístico sin pleuridios, con tejido muy modificado internamente. En las especies erectas de Codium se puede visualizar un eje multiaxial de filamentos finos los que dan ramas laterales que forman una empalizada de pleuridios sifonales (utrículos). En las especies cerebroides del mismo género, igual que en Leathesia, en algunas Scytosiphonales y Punctariales, el eje multiaxial se encontraría reducido a algunos tejidos que recubren por dentro a la corteza pleuridiana. Si se decidiera inscribir toda la interpretación de las estructuras de las algas en la teoría del cladoma se debería aceptar que en algunas Rodophyceae se desarrollan caulidios y filidios laterales como expresión de los cladomas y de los pseudoparénquimas resultantes y que en las Fucoides predominan las cintas y cordones sin pleuridios bien definidos. Tanto el concepto de cladoma como las descripciones de la literatura anglosajona permiten comprender la naturaleza haplóstica de una gran cantidad de formas macizas y laminares y también la importancia de la dominancia relativa del eje y de las ramas en la forma final de los talos pseudoparenquimatosos. Sin embargo, no se puede ignorar que, en definitiva, ambas visiones son abstracciones de la realidad y que dentro de algunos tipos de talo coexisten estructuras de naturaleza polística con otras zonas en los que predominan las divisiones celulares en un plano. Variabilidad morfológica Las características finales de los talos de las algas de una misma especie son influenciadas por la plasticidad fenotípica y las pérdidas de tejido. La alta plasticidad fenotípica, fisiológica y morfológica, es una característica genética muy común que permite diferentes respuestas a las fracciones de la población que viven en diferentes partes del rango del hábitat. La pérdida de las porciones del talo, usual al llegar la madurez reproductiva y liberarse esporas y gametas, hace que los talos vayan cambiando su aspecto juvenil a otros de formas menos gráciles, con partes basales proporcionalmente más importantes y mayor importancia relativa de las zonas rizoidales. La acción de los herbívoros ramoneadores y raspadores puede modificar también el aspecto, tanto de los talos erectos, como de los postrados. De allí la importancia de contar con colecciones que abarquen las etapas de crecimiento, reproducción y senectud de los talos. Estructuras reproductivas En la literatura inglesa se prefiere el uso de los términos “gametangium”, “sporangium” y otros similares, cuya traducción más cercana podría ser “esporangio, “gametangio”, etc. Si bien el uso de los mismos se encuentra hoy muy extendido, se ha preferido el uso de términos alternativos como “gametocisto” y “esporocisto”, cuyos equivalentes han sido extensamente utilizados en la literatura ficológica francesa (Feldmann, 1963). Estos términos resultan a nuestro parecer más adecuados en los casos en que las esporas y gametas se forman dentro de células (cistos), modificadas para la función reproductiva, como ocurre usualmente en las algas, y no en estructuras multicelulares. A lo largo de los siguientes capítulos aparecen numerosas menciones a estructuras reproductivas, cuyas definiciones pueden encontrarse en el glosario. En la tabla 2.1 resumimos y ejemplificamos las características morfológicas y morfogenéticas que se encuentran en las algas marinas, ejemplificando con algunos de los géneros que veremos en los siguientes capítulos. 18 Figura 2.1: Cladomas uniaxiales (a - i) y multiaxiales (j - l). Ver explicaciones en el texto. 19 20 Ciclos de Vida A mediados del siglo XX se develaron muchos detalles de los ciclos de vida de las algas a través del desarrollo de su cultivo en laboratorio y esto llevó a considerarlos de importancia taxonómica (Irvine & Price, 1978). Sin embargo los ciclos de vida de especies emparentadas entre sí pueden diferir marcadamente, siendo además un carácter hasta cierto punto plástico, que responde a la variabilidad ambiental dentro del rango del hábitat de una misma especie. Es por eso que hoy en día no se da a los ciclos de vida la misma importancia filogenética. Durante varias décadas se ha preferido el uso de la denominación “historia vital”, o “historia de vida” (life history) a la de “ciclo de vida” aduciendo que el término “ciclo” sugiere una obligatoriedad en la repetición de un cierto esquema, la cual no necesariamente se cumple. Como los ciclos o historias de vida, son solo esquemas de referencia sujetos a variabilidad, no vemos razón para adoptar otros términos, también ambiguos, ya que han sido usados en otros contextos. Uno de los puntos cruciales en los ciclos es la fecundación durante la reproducción sexual, momento en que las dos gametas provenientes de los progenitores unen sus informaciones y producen la cigota. La cigota cuenta con la suma de las informaciones genéticas contenidas en los cromosomas de ambas gametas. Para mantener el número de cromosomas en las especies con repoducción sexual, en algún punto del ciclo debe ocurrir una reducción del número de cromosomas a través de meiosis. Los esquemas de ciclos de vida son útiles para visualizar básicamente en que punto ocurren eventos como la formación de esporas o gametas, la meiosis y la fecundación Como existen varios sistemas de nomenclatura paralelos referidos a los ciclos de vida damos algunas equivalencias para facilitar la lectura de la bibliografía de mediados del siglo XX. Para un tratamiento general de ciclos de vida en vegetales se puede consultar a Coccucci & Hunziker (1994) Se distinguen tres modelos básicos de ciclos de vida: Monogenético: abarcando una generación; Digenético: abarcando dos generaciones Trigenético: abarcando tres generaciones. Sobre estos tres modelos básicos se encuentran numerosas variaciones que responden tanto a aspectos genéticamente determinados como a las condiciones ambientales. Ciclos monogenéticos También denominados ciclos haplobiontes; se distinguen dos modalidades (figs. 2.2 y 2.3.) Ciclo monogenético haploide (= haplobionte-haploide): Los individuos son haploides (haplontes), las meiosis se da en la cigota. Ciclo monogenético diploide (=haplobionte-diploide) Los individuos son diploides (diplontes), la meiosis se da al formarse las gametas.(Codium) Figura 2.2: Ciclo monogenético haploide. 21 Figura 2.3: Ciclo monogenético diploide. Ciclos digenéticos En el ciclo digenético alterna una generación de individuos haploides con una de individuos diploides, también ha sido denominado ciclo diplobionte o ciclo haplodiplobionte. Las gametas se producen por mitosis a partir del talo haploide y las esporas meióticas en el talo diploide. Estos ciclos pueden resultar más complejos por la presencia de esporas mitóticas (figura 2.4). Si las dos generaciones tienen talos de tamaño y aspecto semejantes se dice que es un ciclo isomórfico (Ulva), si no los son, se lo denomina heteromórfico (Macrocystis). Figura 2.4: Ciclo digenético general, en este caso se ha incluído la posibilidad de desarrollo partenogenético de las gametas (en línea de puntos). Ciclos trigenéticos Los ciclos trigenéticos abarcan tres generaciones que difieren por sus características reproductivas y vegetativas El ciclo trigenético es típico de las algas rojas florídeas y puede ser considerado bifásico de acuerdo al número de fases de vida libre (no dependiente de otro talo para su nutrición) que lo constituyen. Este ciclo en su forma general, comprende un tetrasporofito macroscópico (2n), con meiosis en los tetrasporocistos, produciéndose tetrasporas (n). Las tetrasporas germinan dando gametofitos macroscópicos, dioicos o monoicos (n). Los talos masculinos producen espermacios en espermatocistos y los femeninos carpogonios. Luego de la fecundación, la cigota (2n) produce un tejido (2n) denominado gonimoblasto, que constituye el carposporofito, el que se desarrolla parásito en el gametofito femenino y produce carposporas mitóticas (2n), las que germinan dando nuevamente el tetrasporofito independiente El ciclo trigenético bifásico típico de Polysiphonia se muestra en la figura 2.5, existiendo numerosas variaciones causadas por la reducción de una u otra parte del ciclo. 22 Figura 2.5: Ciclo trigenético general Bibliografía recomendada en el capítulo 2 Bold, H. C., Wynne, M. J. 1985. Introduction to the algae. Prentice Halls, XVI +720p. Coccucci, A. E.; Hunziker, A. T. 1994. Los ciclos biológicos en el reino vegetal. Academia Nacional de Ciencias. 89 p. Chadefaud, M. 1960. Les végétaux non vasculaires (Cryptogamie) T1 du Traité de Botanique systématique de M. Chadefaud et L. Emberger. París. xv + 10128 p. Chapman, V. J. 1962. The algae. Mc Millan, 472 p. Harvey W.H. 1849 British Seaweeds. A Manual of the British Marine Algae John Van Voorst, Paternoster Row. 252 p + 27 pl. Feldmann, J. 1963. Les algues. In: Botanique: 83-249. Masson et Cie. Edit. París. Fritsch F. E. 1943. The Structure and Reproduction of the Algae. Vol. 1. Cambridge University Prees,Cambridge, xvii + 791 p. Fritsch F. E. 1945. The Structure and Reproduction of the Algae. Vol. 2. Cambridge University Prees,Cambridge, xiv + 939 p. Irvine, D. E. G.; Price, J. H. Eds 1978 Modern approaches to the taxonomy of red and brown algae. Acad. Press. 484 pp. Oltmanns, F.1904 Morphologie und Biologie der Algen. Jena, Verlag von Gustav Fischee.733 pp. 23 24 25 26 Capítulo 3: ALGAS VERDES. Características generales El Phyllum Chlorophyta abarca numerosas especies tanto de agua dulce como marinas, con formas unicelulares, colonias, filamentos simples o ramificados, y láminas parenquimatosas de uno o dos estratos celulares. Tienen gran plasticidad en su desarrollo y metabolismo, por lo que han colonizado ambientes marinos costeros, lagos, ríos y ambientes terrestres (rocas, lodos, troncos de árboles). Algunas extremófilas crecen en desiertos donde soportan largos períodos de desecación y temperaturas extremas y otras forman asociaciones simbióticas con hongos constituyendo la parte fotosintética (ficobionte) de los líquenes, otras viven como epibiontes o endobiontes. La mayoría tiene células uninucleadas o con varios núcleos, pero otras presentan estructura cenocítica con muchos núcleos dispersos en el citoplasma. Como pigmentos fotosintéticos presentan clorofila "a" y "b", alfa, beta y gamma caroteno y diversas xantofilas. Como materia de reserva almacenan almidón asociado al cloroplasto. La pared celular está compuesta mayoritariamente por celulosa. La forma del cloroplasto es un criterio taxonómico importante, los tilacoides están dispuestos de una manera desorganizada o anastomosada formando pilas de 2-6 tilacoides, los grana. En gran parte de las clorofitas aparecen en los cloroplastos estructuras relacionadas con la síntesis de almidón denominados pirenoides, estos pueden dividirse con la bipartición de la célula, pero también pueden originarse de nuevo En su mayoría las gametas y esporas son móviles, isocontas o heterocontas y sin mastigonemas. La división nuclear en los grupos marinos bentónicos que se tratan en este texto es una mitosis intranuclear, la membrana nuclear está cerrada en metafase, o abierta en los polos. En Ulvophyceae durante la mitosis se ve un huso cerrado céntrico persistente y en la citocinesis se observa un surco centrípeto que no esta asociado ni con microtúbulos de ficoplasto ni fragmoplasto En otros grupos perpendiculares a los microtúbulos del huso, aparecen en telofase otros microtúbulos que formarán el ficoplasto. En las Charales de agua dulce la pared nuclear se deshace, no hay ficoplasto y se forma un fragmoplasto a partir de micotúbulos paralelos a los de huso mitótico. Entre las contribuciones dedicadas a las algas verdes marinas podemos señalar la de Hoek et al. (1988). En general los trabajos realizados sobre las algas verdes confirmaron los esquemas taxonómicos ya develados por los estudios ultraestructurales. (Zechman et al., 1990). Clases, órdenes, familias y géneros. Clase Prasinophyceae: Orden Tetraselmidales:Tetraselmis Clase Chlorophyceae, Orden Chlorococcales: Coccomyxa Rosenvinge Clase Trebouxiophyceae Orden Prasiolales: Prasiola Meneghini, Rosenvingiella Silva Clase Ulvophyceae Orden Ulotrichales: Ulothrix Kützing; Monostroma Thuret; Protomonostroma Vinogradova; Capsosiphon Gobi; Urospora Areschoug; Acrosiphonia J. Agardh; Spongomorpha Kützing. Orden Ulvales : Familia Ulvaceae: Percursaria Bory; Ulva L; Ulvaria Ruprecht Familia Kornmaniaceae: Blidingia Kylin 27 Familia Ulvellaceae Entocladia Reinke; Ulvella P. L. Crouan y H. M. Crouan; Sporocladopsis Nasr Clase Siphonocladophyceae Orden Cladophorales: Rhizoclonium Kützing; Lola A. Hamel y G. Hamel; Cladophora Kützing; Rama Chapman; Wittrockiella Wille; Chaetomorpha Kützing: Orden Siphonocladales: Cladophoropsis Borgesen Clase Bryopsidophyceae Orden Bryopsidales Familia Codiaceae: Codium Stackhouse Familia Bryopsidaceae: Bryopsis Lamouroux Familia Derbesiaceae: Derbesia Solier Clase Prasinophyceae Orden Tetraselmidales Tetraselmis F. Stein Flagelados unicelulares de células desde cordiformes hasta ovoides, comprimidas. Extremo anterior invaginado, con 4 flagelos de igual longitud en pares opuestos. Cloroplasto cupuliforme, con un pirenoide. Mancha ocular en el lado plano de la célula. División asexual en las fases no móviles. A veces las células hijas yaciendo en direcciones opuestas dentro del periplasto paterno. En las fases no móviles se acumulan las paredes vacías formando un pedicelo hialino, a veces ramificado. Referencia: Guiry & Guiry (2013). Tetraselmis marina (Cienkowski) Norris, Hori & Chihara Lam 3-1-fig. 1 Colonia sedentaria, frecuente en acuarios con una forma unicelular tetraflagelada móvil. Cualquier célula de la colonia es potencialmente móvil, nadando un tiempo corto antes de asentarse y producir una nueva colonia pedicelada. Referencias: Boraso, (1975b, 1984); Boraso & Zaixso (2007) (como Prasinocladus marinus) Clase Chlorophyceae Orden Chlorococcales Coccomyxa Rosenvinge Abarca formas de ambientes continentales y también en simbiosis liquénicas; algunas especies se encuentran en equinodermos y moluscos marinos. Coccomyxa parasitica Stevenson and South Vive en el manto de moluscos bivalvos (Placopecten, Mytilus, Panopea). Talos unicelulares, con células desde esféricas hasta alargadas, con diámetros menores de 1,5 µm y diámetros mayores de 2 - 4,5 µm. Paredes lisas y delgadas. Con dos o tres cromatóforos parietales por célula, los que no alcanzan a cubrir la pared; no se evidencian pirenoides.Cada célula produce entre 2 y 16 autosporas, siendo la primera división ligeramente oblicua respecto al eje mayor de la célula. Referencias: Boraso & Zaixso (1979); Bala (1995); Boraso (2004); Boraso & Zaixso (2007). Clase Pleurastrophyceae Durante varias décadas se estuvo en duda si los géneros Prasiola y Rosenvingiella (=Gayella) eran dos entidades diferentes, pero la existencia de ambas entidades fue confirmada por Rindi et al (2004) sobre evidencia morfológica, molecular y ecológica. 28 Orden Prasiolales Familia Prasiolaceae. Prasiola Meneghini: Talos foliáceos, monostromáticos, láminas usualmente estipitadas y adheridas por rizoides. Células desde cúbicas hasta redondeadas, comúnmente en grupos de a cuatro, dividiéndose repetidamente y formando filas transversales y longitudinales. Cromatóforo axial con un pirenoide. Propagación vegetativa por desprendimiento de tiras marginales. Reproducción asexual por aplanosporas o acinetas. Algunas especies con zoosporas y planogametas, con alternancia isomórfica de generaciones. Las formas marinas se desarrollan generalmente en niveles altos del intermareal, también existen formas de agua dulce. Prasiola crispa (Lightfoot) C. Agardh subsp. antarctica (Kützing) Knebel Lam 3-1- fig. 5: Talos desde acintados hasta laminares o arriñonados, pequeños, sésiles, verde oscuro, densamente agrupados, adheridos por rizoides. Células isodiamétricas en grupos poco definidos. Células con un solo cloroplasto axial. Referencias: Boraso, (2004); Boraso & Zaixso (2007) Rosenvingiella Silva Talos pequeños filamentosos o macizos; frecuentemente, aunque no siempre presentan rizoides laterales. Células con cloroplasto axial. Reproducción por aplanosporas. Las esporas se producen primariamente en filamentos por división transversal, por lo que se dice que son pseudoparenquimatosas. Rosenvingiella polyrhiza (Kolderup) Silva Lam 3-1-figs. 6-7 Filamentos desde uniserados y con rizoides laterales. Células muy cortas respecto al largo, aplanosporas esféricas. Cloroplasto axial con un pirenoide. Referencias: Boraso de Zaixso (2002, 2004); Boraso & Zaixso (2007). Clase Ulvophyceae El concepto de la clase Ulvophyceae, la que comprende a la gran mayoría de las especies de algas verdes marinas y es actualmente aceptada por la mayoría de los ficólogos, fue esbozado sobre la base de características de la ultraestructura. Entre los criterios ultraestructurales propuestos por estos autores se pueden mencionar los aparatos flagelares de las células móviles y el tipo de citocinesis (O´Kelly & Floyd, 1984). Orden Ulotrichales Las características distintivas de las Ulotrichales abarcan los siguientes aspectos: zoosporas tretraflageladas y gametas biflageladas, capuchas denso-electrónicas, simples, terminales sobre los cuerpos basales y vainas proximales bajo los cuerpos basales. Probablemente también serían características la presencia de sifoneína, la apertura irregular de los esporocistos y las vesículas rodeando a los elementos reproductivos flagelados. 29 Lam 3-1: fig. 1: Tetraselmis marina; fig. 2: Ulothrix australis; figs. 3-4: Ulothrix flacca, 3: gametocistos, .4: bases.; fig. 5: Prasiola crispa; fig. 6-7:Rosenvingiella polyrhiza; fig. 8: Urospora penicilliformis; fig. 9: Percursaria percursa. figs. 10-13 Blidingia minima, 10-11: talos jóvenes con disco basal y comienzo de talo erecto tubular , .12: células en vista superficial.; figs. 13- 15:Blidingia marginata, 13: detalle de talo erecto y corte en disco basal. 14: césped sobre Sarcocornia, 15: detalle de células ordenadas en filas: fig. 16: Protomonostroma undulatum; figs. 17—19: Undaria obscura, .17: corte de talo monostromático, 18: células en el borde, 19: células en centro del talo; fig. 20: Acrosiphonia arcta; fig. 21: Spongomorpha pacifica; figs. 22-23: Capsosiphon fulvescens sobre Rhodomelaceae 30 Ulothrix Kützing. Muestran filamentos uniseriados, no ramificados, de células uninucleadas, con cloroplasto parietal entero, con uno a varios pirenoides. Ciclo de vida heteromórfico con esporofito unicelular. Las especies más frecuentemente encontradas en el intermareal de la costa de Patagonia son Ulothrix australis Gain (Lam 3-1-fig. 2), que muestra células normalmente con un solo pirenoide y cuadradas en vista lateral y Ulothrix flacca (Dillwyn) Thuret, con células más cortas que anchas (Lam 3-1-figs. 3-4). Referencias: Sar (1985); Boraso, (2004); Boraso & Zaixso (2007) Ulothrix consociata Wille sería una forma de U. flacca. Referencias: Boraso (2004). Monostroma Thuret Talo en forma de lámina monostromática, a veces en forma de saco. Con alternancia heteromórfica de generaciones sexuales y asexuales. Monostroma hariotii Gain Frondes uniestratificadas, delicadas, verde pálido, cilíndricas a obovadas, simples, de 20-40 cm de largo y 3-6 (-7) cm de ancho, que pueden permanecer cerradas o abrirse y lacerarse, con pequeño pedúnculo basal, de 25-35 µm de grosor. Células isodiamétricas hacia el ápice y muy alargadas longitudinalmente en la base, cloroplasto masivo con uno o más pirenoides. Zooides biflagelados isocontas, con una mancha ocular, producidos en zoosporocistos liberados a través de un poro irregular. Rupícola o epífita sobre Desmarestia e Iridaea, intermareal y submareal. Referencias: Hylmö (1919); Lamb & Zimmerman (1977); Boraso (2004). Protomonostroma Vinogradova Se diferencia de Monostroma por el ciclo de vida. Se reproduce por zoosporas tetraflageladas, sin estigma, liberadas por gelatinización de las paredes del talo, las esporas originan un talo unicelular o cisto, que engrosa sus paredes y forma en su interior zoosporas tetraflageladas que germinan dando la lámina monostromática. La especie tipo es P. undulatum (Wittrock) K.L. Vinogradova (Boraso, 1977) Protomonostroma undulatum (Wittrock) Vinogradova Lam 3-1-fig. 16:; Lam 3-2-Figs. 1-2 Talos laminares, sedosos, orbiculares, de hasta 10-20 cm de alto, con zona rizoidal bien desarrollada. Se la encuentra en el intermareal rocoso en primavera y verano. Referencias: Hylmö (1938) (como M. lactuca); Papenfuss (1964); Boraso (1977, 2004) (como Monostroma undulatum); Boraso & Zaixso (2007). Capsosiphon Gobi Talos simples con células en series longitudinales y transversales muy marcadas, las primeras laxamente unidas, lo que produce a veces falsas ramificaciones. Paredes celulares gelatinosas, observándose frecuentemente 2-4 células hijas dentro de las paredes de la célula que les dio origen. Sin rizoides diferenciados. Especies dioicas, reproducidas por gametas biflageladas. Cigotas y partenogametas pueden dar origen tanto a talos iguales a los maternos como cistos que producen zooides. Los zooides luego de su liberación quedan un tiempo dentro de una vesícula hialina. 31 Capsosiphon fulvescens (C. Agardh) Setchell y Gardner Lam 3-1-figs. 22-23: Esta especie no es frecuente, se la ha encontrado solo en ambientes portuarios. En la zona se presenta como talos pequeños, de color verde amarillento. La parte superior del talo se presenta en forma de tubos, mientras que la base está formada sólo por una o dos filas de células. Referencias: Boraso, (2004); Boraso & Zaixso (2007). Urospora Areschoug Filamentos uniseriados, no ramificados, usualmente con varias células de la región basal modificadas como rizoides. Crecimiento intercalar. Células uninucleadas o multinucleadas. Cloroplasto en forma de banda parietal y entero al principio, perforado cuando adulto, con pocos a numerosos pirenoides polipiramidales. Propagación por fragmentación. Reproducción asexual del talo macroscópico por zoosporas tetraflageladas con un largo proceso posterior en forma ahusada, o por acinetas. Reproducción sexual por gametas biflageladas, acuminadas o no. Las esporas pueden dar un nuevo talo macroscópico o talos microscópicos. La cigota da un estado codioloide que produce zoosporas acuminadas. El desarrollo partenogenético de las gametas da una generación codioloide que esporula y regenera los esporofitos. Referencias: Guiry & Guiry (2012). Urospora penicilliformis (Roth) J. E. Areschoug Lam 3-1- fig. 8 Especie intermareal con filamentos simples de hasta 30 centímetros de largo. Varias células de la región basal se alargan como rizoides descendentes. El cloroplasto tiene forma de banda parietal, entera al principio y luego perforada con pocos a numerosos pirenoides. Se propaga por fragmentación y se reproduce por zoosporas con una prolongación aguzada posterior formadas en zoosporocistos en series. Referencia: Hylmö (1919); Boraso (2004); Boraso & Zaixso (2007). Acrosiphonia J. Agardh Este género se separó inicialmente de las Cladophorales por presentar un ciclo de vida digenético heteromórfico o un ciclo monogenético y por el tipo de cromatoforo. Gametofitos compuestos por filamentos con numerosas ramas laterales alternas u opuestas, y rizoides multicelulares descendentes. Crece por división y elongación de células apicales Filamentos de diámetro uniforme o algo más anchos en los ápices. Células maduras multinucleadas. El cloroplasto es parietal y perforado, con muchos pirenoides polipiramidales. Gametocistos formados generalmente en filas intercalares Gametas liberadas en vesículas, por aberturas crenadas que pueden mostrar un opérculo. Esporofito de tipo Codiolum, que produce zoosporas tetraglageladas. Referencias: Guiry & Guiry (2012). Acrosiphonia arcta (Dillw.)Kützing Lam 3-1-fig. 20 Talos formando céspedes o mechones densos, en el intermareal bajo. Talos de color verde brillante, de hasta 6 cm de alto, células maduras multinucleadas Talos en céspedes de color verde brillante, o en mechones densos de hasta 6 cm de alto; filamentos erectos, ramas insertas en ángulos pequeños, unidas por rizoides abajo, células apicales cilíndricas o en forma de clava, con ápices redondeados, de 65 - 100 µm de diámetro, desde 1-2 veces en la parte apical hasta 9-10 veces tan largas como anchas en las partes más basales. Hylmö (1938) piensa que las citas de esta especie para la zona austral corresponden en realidad a S. pacifica, pero hemos observado en Puerto Deseado y en 32 Punta Maqueda (Santa Cruz) poblaciones que corresponden a la descripción de esta especie. Referencias: Boraso (2004); Boraso & Zaixso (2007) (como Spongomorpha arcta). Spongomorpha Kützing Gametofitos de hasta 4 cm de alto, esponjosos o rígidos en textura, compuestos de filamentos uniseriados muy entremezclados entre sí ramificados adheridos por rizoides multicelulares. Algunas especies muestran ramas laterales en forma de ganchos. Ramificaciones por un tabique oblicuo en la zona apical de la célula axial. Células uninucleadas. Cloroplasto laminar perforado, con numerosos pirenoides polipiramidales, más denso en las partes en crecimiento. Gametocistos terminales o intercalares en las ramas, gametas liberadas por un orificio circular. Reproducción sexual isógama. Esporofitos unicelulares endófitos del tipo Codiolum (con pedicelo) o Chlorochytrium (sésiles). Referencia: Guiry & Guiry (2012) Spongomorpha pacifica (Montagne) J. Agardh Lam 3-1-fig. 21 Talos formando cojines esponjosos confluentes, color verde oliva, hasta de 10 cm de alto, compuestos de filamentos rígidos muy ramificados, que muestran células apicales de ápice redondeado mientras son jóvenes y se encuentran en activo crecimiento, luego con rámulas terminadas en puntas agudas, erectas o en forma de ganchos. Con frecuentes rámulas rizoidales hacia la zona basal. Diámetros celulares de (56-) 90-100 (-130) µm; células de los ejes hasta tres veces tan largas como anchas. Los talos forman en las zonas apicales, largas series de gametocistos con dehiscencia lateral. Referencias: Hylmö (1938); Chapman (1956); Ricker (1987); Boraso (2004); Boraso & Zaixso (2007). Orden Ulvales El orden Ulvales ha sido aceptado por mucho tiempo y comprende a las algas verdes que presentan un talo tubular, membranoso o filamentoso monostromático o distromático. Las células son uninucleadas con un cloroplasto parietal o cupuliforme conteniendo usualmente uno o más pirenoides. Las algas comprendidas en este orden, se reproducen sexualmente por isogamia, anisogamia u oogamia. Algunas especies presentan ciclos de vida con dos fases isomórficas y otras son monofásicas. Las gametas presentan dos flagelos y las zoosporas usualmente cuatro o, a veces, solo dos flagelos. Familia Ulvellaceae Comprende talos muy pequeños, usualmente epífitos, totalmente postrados o heterotricos de células cilíndricas, uninucleadas, que no producen vainas ni cubiertas mucilaginosas notables, con un cloroplasto con uno o varios pirenoides bilenticulares por célula. Entocladia Reinke Algas verdes, postradas, epífitas, diminutas, filamentosas, ramificadas, compuestas de células cilíndricas, uninucleadas, que no producen vainas ni cubiertas mucilaginosas notables, con un cloroplasto con uno o varios pirenoides bilenticulares por célula. Pueden presentar sedas. Esporocistos y gametocistos similares, desde forma de ampolla hasta cilíndricos, con una sola papila de salida, dando zoosporas tetraflageladas y gametas biflageladas por clivaje sucesivo secuencial de su contenido. Los zooides son liberados sin vesícula envolvente. Gametas isógamas o anisógamas. Alternancia isomórfica de generaciones. Referencias: O'Kelly & Yarish (1981). Nota: El criterio de presencia de pelos para separar las especies de Epicladia de las de Entocladia parece no estar vigente en la actualidad. 33 Lam 3-2: Figs. 1-2: Protomonostroma undulatum 1:: Ciclo de vida, 2 corte transversal en centro del talo; figs. 3-6 Ulvaria obscura, 3: corte transversal en base, 4 células en vista superficial, 5 borde del talo, 6 talo joven; fig. 7-10: Bryopsis rhizophora: 7: aspecto general, .8: cloroplastos, 9: detalle de pina, 10 eje con pinas.; fig. 11: utrículo de Codium decorticatum; fig. 12-13: utrículos de Codium fragile; fig. 14: utrículo de Codium vermilara; fig. 15- 16: Entocladia maculans en centro y borde; fig. 17-24: Sporocladopsis novae zelandiae: 17: talo postrado y filamentos erectos jóvenes, 18-19: detalles de filamento maduro al centro y en la base, 20: esporocisto apical, 21: ápice con cloroplastos, 22-24: detalles de la base monostromática y distromática. Fig. 26: borde de Ulvella lens.; figs. 27-28: Cladophora falklandica, fig 27: rama, 28.29 ápices con cloroplastos. 34 Lam 3-3: figs. 1-4: Ulva compressa, 1: vista superficial de células, 2: aspecto general, 3-4: cortes del tubo; fig. 6: Ulva torta; fig. 7: Ulva clathrata; figs. 8-9 Ulva intestinalis: .8: aspecto general, 9: células en vista superficial, figs. 10-12: Ulva prolifera: 10: aspecto general, 11: orden celular, 12: detalle de ramificación, figs 5 y.13: Ulva hookeriana: 5: corte del talo, 13: aspecto superficial de las células; figs. 14-17: Ulva linza: 14- 15: cortes en el borde y en el centro del talo, 16: células en vista superficial, 17: aspecto general; fig. 18: Ulva flexuosa: aspecto general. 35 Entocladia maculans Cotton Lam 3-2-fig. 15- 16; Lam 3-5-figs. 1-2 Epífita sobre Delesseriaceae y sobre Aphanocladia robusta, formando manchas orbiculares de 0,5-1 cm de diámetro, filamentos monoseriados confluentes, formando un pseudoparénquima de células irregulares que no siguen el contorno de las células del huésped, de 15-20 μm en el centro, filamentos radiantes con células de 8-12 µm de diámetro, de 2-3 veces tan largas como anchas. Sin pelos. En el centro se forman esporocistos irregulares de 20-30 µm de diámetro con 16 - 32 esporas de 3-4 µm de diámetro. Referencias Boraso (2004) (como Epicladia maculans). Ulvella P. L. Crouan y H. M. Crouan: Alga postrada disciforme, monoestratificada al principio, que puede luego engrosarse en el centro. Células uninucleadas, con o sin pirenoide, las células del borde típicamente bifurcadas. Ulvella lens P.L. Crouan & H. M. Crouan Lam 3-2-fig. 26 Discos de 1- 2 µm de diámetro, frecuentemente sobre Ulva rigida, con borde continuo, monosetratificado, células del borde bifurcadas, alargadas, de 8-20 µm de largo y 5 - 6 µm de ancho; centro del talo biestratificado por división de las células basales, células del estrato superior poligonales, de 5-10 µm de diámetro. Cloroplastos parietales, pirenoides pequeños más visibles en las células del centro del talo. Referencias: Papenfuss (1964); Boraso (2004). Sporocladopsis Nasr La delimitación de este género es algo difusa, contribuyen a esto: que su especie tipo (S. erythrea) parece haber sido muy poco estudiada; la propuesta de Papenfus de ubicar a S. novae zelandiae en el género Pilinia de algas pardas (Papenfuss, 1962) y la ubicación de la especie S. jackii en las Chroolepidaceae (Chaetophorales) (Garbary et al, 2009). Hasta tanto no se aclaren estas diferencias ubicamos a la especie S. novaezelandiae en Ulvellaceae sobre la base de las observaciones de Leonardi et al. (2002) quienes mostraron que pertenece a las Ulvophyceae, y también por sus características morfológicas y reproductivas. Sporocladopsis novaezelandiae Chapman Lam 3-2- fig. 17-24 Pequeños discos verde amarillentos epífitos sobre Iridaea, Gigartina, Durvillaea y Lessonia, formando manchas circulares o anillos, de hasta 1,5 cm de diámetro,a veces confluentes. La porción postrada está bien desarrollada y muchas de sus células llevan filamentos erectos, de hasta cuarenta células de largo. Las células llevan un cloroplasto parietal que cubre toda la célula o forma una banda en el centro de la misma, con un pirenoide bilenticular no muy conspicuo. Abundantes esporocistos con un poro apical se observan tanto sobre la porción postrada como laterales o terminales sobre los filamentos erectos, sésiles o sobre un pedúnculo de una o dos células, ocasionalmente dos sobre el mismo pie. Se forman aproximadamente dieciseis esporas biflageladas por esporocisto. Es frecuente la formación de un nuevo esporocisto en el mismo punto luego de liberarse los zooides. Referencias Boraso (1973) (como Pilinia novae zelandiae (Chapman) Papenfuss et Fan); Boraso & Zaixso (2007); Leonardi et al. (2002). 36 Lam 3-4: figs. 1-7: Ulva rigida, 1:-2: aspecto general, 3: bordes con dientes, 4-5: cortes transversales en zona reproductivo y vegetativo, 6-7; células en vista superficial al centro del talo y en zona basal; figs. 8- 12: Ulva lactuca: aspectos generales; figs. 13-22: Ulva californica: 13- 16: aspectos generales, 17-18: células en vista superficial al centro del talo y cerca de la base; 19-22: cortes transversales del talo desde el borde hasta cerca de la base 37 Familia Kornmanniaceae Esta familia ha sido redefinida en base a estudios moleculares. Referencias: Golden & Cole (1986). Blidingia Kylin Talo tubular, gregario, simple o ramificado, inicialmente con varios tubos erectos emergiendo de un cojín parenquimatoso polistromático, formados por proliferación de las células centrales del cojín, las que forman áreas elevadas que devienen finalmente tubulares, en un principio sin células rizoidales. Cuando el talo tubular crece, la zona basal deviene relativamente inconspicua y se forman rizoides hacia la base. Células desde angulares hasta redondeadas, con un solo cloroplasto axial con un pirenoide. Reproducción por zoosporas tetraflageladas sin mancha ocular.Referencias: Bliding (1963). Blidingia marginata (J. Agardh) P. Dangeard subsp. marginata Lam 3-1-figs. 13- 15 Talos cilíndricos filiformes con células más ordenadas longitudinalmente que en B. minima especialmente en las partes angostas y discos más reducidos Largo celular 4-6 µm, ancho de 3-5 µm, alto de 5 µm. Referencias: Boraso (1975a, 2004); Boraso & Zaixso (2007) Blidingia minima (Nägeli ex Kützing) Kylin var. minima Lam 3-1-figs. 10-13 Talos erectos tubulares desde cespitosos cortos de hasta 8 cm de alto y un cm de ancho, generalmente simples, a veces con una o dos ramas. Células generalmente no ordenadas, diámetro celular de alrededor de 5 µm, alto celular de unos 8 µm y grosor del talo de 10 µm. Paredes internas del talo no engrosadas en las formas típicas. Cloroplasto axial con un pirenoide. Las zoosporas producen un disco postrado que puede propagarse a través de filamentos uniseriados rastreros que se originan en el borde del disco y producen nuevos discos a partir de su célula apical. El talo erecto comienza como una proliferación de células en el centro de los discos, esta proliferación crece apicalmente dando una estructura tubular cerrada en el ápice. Cuando el talo madura, las células de la zona apical devienen esporocistos, los que, al liberar los zooides se rompen, abriéndose entonces el ápice del talo. Referencias: Boraso (1970, 1975a, 2004); Perales y Boraso (2006); Boraso & Zaixso (2007) En Boraso (2004) se cita B. chadefaudii (Feldman) Bliding que sería solo una forma atípica de B. minima con las paredes internas del talo engrosadas. Familia Ulvaceae Los talos de esta familia presentan en común un talo tubular al principio y laminar o filamentoso en la madurez. Las células poseen un cloroplasto parietal, laminar o en forma de copa, con uno a varios pirenoides. Algunos representantes de esta familia desarrollan un disco basal, otros forman directamente un filamento monoseriado erecto por el que se fijan o por células rizoidales La reproducción suele ser por zoosporas tetraflageladas o biseriadas y gametas biseriadas Referencias: Hayden et al. (2000). Ulva Linneo. De acuerdo a Hayden et al. (2000) y a Guiry & Guiry (2012) este género actualmente abarcan no sola las especies distromáticas sino también las especies tubulares tradicionalmente ubicadas en el género Enteromorpha. Frondes tubulares simples o ramificadas o laminares y distromáticas, desde acintadas hasta expandidas, con o sin márgenes huecos; con zona basal rizoidal. Células generalmente de paredes firmes, uninucleadas, con cloroplasto parietal con uno a varios pirenoides. Alternancia isomórfica de generaciones o reproducción solamente asexual. 38 Esporocistos y gametocistos formados en los márgenes de las láminas o zonas distales de ejes y ramas tubulares. Zoosporas tetraflageladas, gametas isógamas o anisógamas, biflageladas. La germinación de los zooides puede producir directamente filamentos erectos o dar primero un estadio postrado y luego, a partir del mismo, un filamento uniseriado erecto que deviene tubular. El tubo inicial puede persistir hasta la madurez y producir ramas (especies enteromorfoides) o adhiere sus paredes, perdiendo todo indicio de cavidad desde muy temprano en el desarrollo (especies laminares distromáticas) o puede producir formas intermedias donde quedan restos del tubo en los bordes de la lámina y en la base del talo. Para facilitar la transición hacia el concepto amplio de Ulva, aquí adoptado, tratamos primeramente las especies enteromorfoides y luego las distromáticas. En Boraso & Zaixso (2007) y se citan las siguientes especies de Ulva de talos enteromorfoides: Ulva hookeriana (Kützing) Hayden, Blomster, Maggs, P. C. Silva, M. J. Stanhope & J. R. Waaland (como Enteromorpha bulbosa); Ulva clathrata (Roth) C. Agardh (como Enteromorpha clathrata); Ulva compressa Linnaeus (como Enteromorpha compressa); Ulva flexuosa Wulfen (como Enteromorpha flexuosa y como E. lingulata); Ulva flexuosa Wulfen subsp. pilifera (Kützing) Wynne (como Enteromorpha flexuosa var. pilifera); Ulva intestinalis L. (como Enteromorpha intestinalis); Ulva linza Linnaeus (como Enteromorpha linza); Ulva prolifera O. F. Müller (como Enteromorpha prolifera); Ulva torta (Mertens) Trevisan En Boraso (2004) se citan además las especies: Enteromorpha ahlneriana (Bonnemaison) Bliding considerada actualmente sinónimo de Ulva linza y Enteromorpha compressa var. usneoides, considerada actualmente sinónimo de Ulva compressa. Ulva hookeriana (Kützing) Hayden, Blomster, Maggs, Silva, Stanhope & Waaland Lam 3-3- figs. 5 y.13 Talos intermareales, de hasta 17 cm de alto, generalmente simples o con alguna rama simple, con la base afinada y el ápice ensanchado. El grosor del talo es de 30-75 µm y el alto celular de 15-30 µm. A veces los lados del tubo se acercan formando una lámina distromática de unos 60 µm de grosor. Células de ángulos redondeados, en filas longitudinales con el orden a veces oscurecido en las partes anchas del talo. Diámetro celular pequeño, de (4-) 5-8(-10) µm. Cloroplasto abarcando toda la pared celular, con un pirenoide, ocasionalmente dos. En algunas localidades hemos observado individuos con forma de trompeta y tamaño diminuto asignables a esta especie por sus características citológicas. Referencias: Hylmö (1919); Taylor (1939); Boraso (1975, 2004), Ricker (1987); Boraso & Zaixso (2007). Como Enteromorpha bulbosa. Ulva clathrata (Roth) C. Agardh Lam 3-3- fig. 7: Talos filamentosos, de apecto lanoso, repetidamente ramificados, ramas de último orden uniseriadas o con un filamento apical uniseriado. Grosor del talo de alrededor de 27 µm y alto celular de alrededor de 25 µm. Células cuadrangulares, de paredes delgadas, ordenadas en filas longitudinales, de (7-) 14-15(-20) µm de largo y (13-) 16-18(-26) µm de ancho, relación largo ancho en la parte superior del talo de 0,3 - 1,2. En la porción basal del talo se observan células de hasta 50 µm de largo. El cloroplasto es poco voluminoso y no alcanza a cubrir la pared, frecuentemente está ubicado sobre las paredes laterales y lleva usualmente varios pirenoides (1- ) 3 (-6). Referencias: Papenfuss (1964); Boraso & Zaixso (2007). 39 Lam 3-5: figs. 1-2: Entocladia maculans: borde vegetativo y centro fértil; figs. 3-7: Lola implexa : 3: cloroplasto, 4: extremo de filamento reproductivo con esporas liberadas, 5: base, 6: filamento retorcido, 7: filamento al centro ; fig. 8-9: Wittrockiella lyallii : detalle de cloroplasto y aspecto general; fig. 10: Chaetomorpha aerea: aspecto general; figs. 11-13: Chaetomorpha linum, 11: aspecto general, 12- células, 13: detalle de cloroplasto; fig. 14: Rhizoclonium ambigum; figs. 15-17: Rama antarctica: 15-16: rizoides y ramificaciones, 17: detalle de cloroplasto. 40 Ulva compressa Linnaeus Lam 3-3-figs. 1-4 Talos de 5-15 cm de alto, generalmente con ramas sólo de primer orden, ensanchadas o no hacia el ápice, ubicadas a lo largo de todo el eje o localizadas en la base. Grosor del talo en las porciones más anchas de 15-37 µm y alto celular de 10-27 µm. En algunos puntos las paredes pueden acercarse aparentado una lámina distromática, en la base se puede engrosar hasta 50 µm. Células poliédricas, en las formas típicas no ordenadas en filas ni dameros excepto en ramas muy finas o en regiones reducidas del talo. A los talos con células más ordenadas en filas y ramas más finas los determinamos anteriormente como E. compressa var usneoides, considerada actualmente sinónimo de U. compressa Cloroplasto parietal mediano a pequeño, localizado lateralmente en la célula, generalmente con un solo pirenoide. Diámetro celular de 5-22 µm. Alternancia isomórfica de generaciones, zoosporas tetraflageladas de 7,8 µm de largo y 3,1 µm de ancho, gametas femeninas de 6-15 µm de largo y 4-5 µm de ancho, y masculinas de 5-8 µm de largo, 1,5- 3,5 µm de ancho, con formación normal de cigotas. Vive en el intermareal, sobre Brachidontes y Corallina. Referencias: Cotton (1915); Boraso (1975, 1979, 2004). Ulva flexuosa Wulfen En su forma más frecuente en la costa patagónica esta especie se presenta como talos de color verde brillante, de hasta 15 cm de alto, provistos cerca de la base de ramas simples, tan largas como el eje, y de hasta 3 mm de ancho, los ápices son al principio redondeados y luego truncos. En algunas ramas ensanchadas las paredes del tubo pueden acercarse y adherirse ligeramente entre sí. Grosor del talo 32-41 µm. Células en filas longitudinales en todo el talo, especialmente en las partes ensanchadas; en la base del eje y de las ramas el orden se ve frecuentemente oscurecido. Las células en las porciones donde se encuentran ordenadas son rectangulares de 5 µm por 9 µm hasta 12 µm por 27 µm, con relación de largo - ancho de (0,45) 0,6-1 (-2). Alto de las células 20-28 µm. Cloroplasto parietal muy bien desarrollado, cubriendo totalmente la pared celular, con 2-4 pirenoides en el 80% de las células y un pirenoide en 20% de las células, proporciones que suelen mantenerse a lo largo del talo. Gametas anisógamas, las femeninas de 10,7 µm de largo y 3,6 µm de ancho, las masculinas de 6,4 µm de largo. No se observaron zoosporas tetraflageladas. En la costa de Provincia de Buenos Aires hemos observado talos tubulosos menos robustos, de hasta 7 cm de alto, simples o con alguna ramificación cerca de la base. Grosor de la pared monostromática 14-15 µm, en algunos puntos adheridas en una lámina distromática de 32-65 µm con un lumen celular de 12- 20 µm. Las células se encuentran ordenadas longitudinal y transversalmente en la parte superior del talo, con diámetros de 7 por 11 µm hasta 19 por 22 µm, hacia la base cuadrangulares de 30 por 30 µm hasta alargadas de 35 por 10 µm. La relación largo - ancho puede variar entre 2,5 y 4,4. En las ramas el diámetro celular puede alcanzar un mínimo de 5 µm de diámetro. Cloroplasto bien desarrollado en forma de banda parietal ancha. En la parte superior del talo se observa un pirenoide por célula, más raramente 2-3; en las partes más basales el número de pirenoides varía entre 4-7. Rupícolas, fuera y dentro de piletas de marea en niveles medios del intermareal. Referencias: Boraso (1975a, 1979, 2004); Boraso & Zaixso (2007) (como E. flexuosa y como E. lingulata J. Agardh). Ulva flexuosa Wulfen subsp.pilífera (Kützing) Winne. Lam 3-3- fig. 18 Talos profusamente ramificados hasta el cuarto orden. Eje desde filiforme hasta de 1 cm de ancho, tanto el eje como las ramas cubiertos por numerosas ramas filiformes, cortas, uniseriadas o multiseriadas, en este último caso con el ápice uniseriado de varias células de largo. Pueden encontrarse talos que han perdido la mayor parte de las ramas filiformes, conservando solo ramas cortas, simples, multiseriadas, en forma de 41 espinas y algunas ramas más finas y ramificadas. Células ordenadas en filas longitudinales, especialmente en las ramas, donde suelen ser más anchas que largas, con largo celular de (5-)9-10 (-14) µm y ancho de (7-) 15-16 (-28) µm. En las ramas más anchas el orden suele ser menos claro y las células son poligonales. Grosor del talo de 20- 22 µm, altura celular de 18-20 µm. Cloroplasto parietal voluminoso, cubriendo toda la pared, pirenoides 1-2-3(-6). Referencias: Boraso (2004) Ulva intestinalis Linneo. Lam 3-3-figs. 8-9 Talos simples de 5-30 cm de largo y hasta 2 cm de ancho. Tubulares, afinándose paulatinamente hacia la base o con un contracción acentuada y un pequeño estipe macizo, de hasta 25-45 µm de grosor. Cerca de la base las paredes internas pueden estar algo engrosadas. Células de 6 µm por 8 µm hasta 16 µm por 17 µm de diámetro. Células sin orden determinado, a veces algo circular en áreas pequeñas. Cloroplasto parietal con un pirenoide. Reproducción por zoosporas tetraflageladas de 5-10 µm de longitud y 1,3-4 µm de ancho, gametas biflageladas de 5,7- 7,5 µm de longitud y 2-3 µm de ancho que produjeron cigotas normales. Especie intermareal, sobre rodado con limo. Referencias: Svedelius (1900); Cotton (1915); Papenfuss (1964); Boraso (1975a, 1979, 2004); Boraso & Zaixso (2007). Ulva linza Linneo Lam 3-3- figs. 14-17 Esta especie abarca en su forma más frecuente en toda la costa a talos simples, sedosos, distromáticos excepto en la base y el borde, de bordes ondulados, a veces acintados o en forma de abanico, de hasta 15 (-18) cm de largo. Grosor de la lámina distromática 35-45 µm y del tubo de 45 µm. Alto celular desde 12 µm en la lámina hasta 20 µm en la base. Células rectangulares a poligonales, generalmente en filas, en regiones pequeñas en dameros, de 6-18 µm de diámetro. Cloroplasto parietal con un pirenoide. Reproducción asexual por zooides tetraflagelados de aspecto y tamaño muy variable, de 9-14 µm de largo y 4-8 µm de ancho. Se encuentra en piletas de marea y encharcados del intermareal. De acuerdo a Guiry & Guiry ( 2013) actualmente se ha ampliado el concepto de esta tradicional especie a otros tipos morfológicos, históricamente asignados a Enteromorpha ahlneriana (Bonnemaison) Bliding (= E. procera Ahlner), con ramas diferenciables del eje, afinadas en los ápices, terminando en una sola célula apical o en un filamento uniseriado, o con con eje y ramas muy finos de hasta de cuarto orden, éstas frecuentemente uniseriadas. También abarcaría talos con un eje largo y grueso, con ramas simples espaciadas a lo largo del mismo. Entre estos tres tipos existen todas las formas intermedias. El grosor del talo es moderado, de 20-30 µm, el alto celular de 10-15 µm. El largo celular de (4-) 9, 8(-11) µm, relación largo - ancho de (0,5-) 1,1-2 (- 2,2). Se observa orden celular en filas longitudinales y transversales. Más del 90% de las células con un solo pirenoide Este nuevo concepto de E. linza no invalida los trabajos ecológicos realizados en la zona, ya que las formas ramificadas que hemos asignado a E. ahlneriana solo se han encontrado esporádicamente. Referencias como E. linza: Cotton (1915); Taylor (1939); Boraso (1975a, 1979, 2004); Boraso & Zaixso (2007). Referencia (como E ahlneriana): Boraso (2004). Ulva prolifera O. F. Müller Lam 3-3- figs. 10-12 Talos de hábito variado, pudiéndose establecer un primer tipo de talo simple o con pocas proliferaciones en la base, un segundo tipo con un eje más o menos ancho con ramas de menor diámetro ubicadas a lo largo del mismo y un tercer tipo consistente en un eje cubierto con numerosas ramas filiformes muy largas; en los dos últimos tipos las ramas pueden llevar ramas de orden superior sucesivamente de menor diámetro. Las 42 células son normalmente cuadrangulares o rectangulares con (4-) 6-9(-16) µm de largo, y (5-) 7-8 (-11) µm de ancho, con relación largo ancho (0,4-) 0,5-1(-2,1). Células ordenadas longitudinalmente en casi todo el talo, el orden oscurecido en las partes más ensanchadas del mismo. Grosor de la lámina de 17-20 µm en el ápice hasta 30 µm en la base, alto celular de 10-14 µm en el ápice hasta 18 µm en la base. Proporción de células con un solo pirenoide (75-) 85-95(-98) %. Zoosporas tetraflageladas de 8,8 µm de largo y 4,6 µm de ancho con tendencia a la agregación al fijarse; gametas femeninas de 10-11 µm de largo y 2-4 µm de ancho, las masculinas de 5-8 µm de largo y 1,5-3,5 µm de ancho. Las formas más prolíferas son las que muestran menos tendencia a formar zooides, se observan más comúnmente en verano, en el intermareal, en encharcados sobre grava. Referencias: Boraso (1975a, 1979, 2004); Boraso & Zaixso (2007). Ulva torta (Mertens) Trevisan Lam 3-3-fig. 6 Talos filiformes de 30-45 µm de diámetro con células cuadrangulares o rectangulares, en filas longitudinales, de 15-16 µm de ancho y 1-1,5 veces tan largas como anchas; con un solo pirenoide en la mayoría de las células. Se encuentra sobre sustrato cenagoso, al pie de Salicornia mezclada con otras algas filamentosas y en piletas de marea del intermareal. Referencias: Boraso (1975a, 2004) (como Enteromorpha torta). Ulva californica Wille Lam 3-4-figs. 13-22 Talos de 1,5 a 10 cm de altura, excepcionalmente hasta 17 cm, flabeliformes, lanceolados o triangulares y con la base afinada, a veces con profundas hendiduras, de color verde claro, con grosor de talo distromático de 18-30µm en la lámina, de 35-55 µm por encima de la base y hasta 100 µm en la base, el alto celular de 5-10 µm en la lámina hasta 10-18 µm en la base. Borde del talo liso. Células en el borde y centro del talo isodiamétricas sin orden definido, con diámetros de 6-24 µm; en la zona rizoidal se alargan paulatinamente hasta los 30 µm de largo, no mostrando células más pequeñas entre las rizoidales. El cloroplasto es parietal llenando el interior de las células, con un solo pirenoide de 2,5-3 µm de diámetro en 90% de las células. Se observó reproducción por germinación directa de zooides biflagelados. Se ha encontrado intermareal sobre superficies verticales Referencias: Boraso (1977b, 2004); Boraso & Zaixso (2007). Ulva lactuca L. Lam 3-4-figs. 8 a 12 Talos polimórficos, ovales cuando jóvenes, formando luego láminas muy extendidas, lobadas o profundamente hendidas, con o sin perforaciones, de hasta 30 cm de largo. Base en forma de cuña. Borde del talo liso y más o menos ondulado. Color desde verde claro a oscuro. Células dispuestas irregularmente o en pequeños campos circulares o cuadrangulares. Forma celular cuadrangular a poligonal. Grosor del talo desde 30 µm en el borde de la lámina hasta 40-65 µm en el centro del talo y hasta 100265 µm en la base. En los talos jóvenes y lóbulos recién formados el grosor puede ser de solo 20 µm. El alto celular de 7 µm en el borde hasta 35 µm en la base, en el centro 17-30 µm Diámetros celulares (6-)8-20(-25) µm En los lóbulos de la base y en ejemplares jóvenes los diámetros celulares pueden ser de hasta 30 µm. Un pirenoide en 85-95 % de las células, hacia la base y en algunos ejemplares aislados hasta 40% con dos pirenoides y 10% con tres pirenoides. En los talos jóvenes las células rizoidales no se diferencian en tamaño de las que las rodean, a medida que el talo crece las células entre las rizoidales presentan diámetros más pequeñas que aquellas. Vive en piletas de marea en niveles medios y bajos del intermareal, sobre rocas en niveles bajos del intermareal. Referencias: Boraso (1977b, 2004); Boraso & Zaixso (2007). 43 Ulva rigida (C. Agardh) Thuret Lam 3-4-figs. 1-7 Talos de color verde brillante, ovales o ligeramente asimétricos cuando jóvenes, usualmente robustos luego, formando luego una lámina ensanchada, o con una porción basal de la que suelen nacer lóbulos, éstos, cuando son largos se disponen helicoidalmente en el agua; en algunas áreas de la costa son ramoneadas hasta la base,quedando los individuos apretadamente arrepollados y muy cortos. En el borde se presenta una denticulación de desarrollo variado, desde fina y con dientes simples hasta gruesa y con dientes ramificados. Grosor de la lámina distromática en el centro del talo de (29-) 45-50 (65) µm, y altura de las células (10-)15-20(-24) µm; por encima de la región rizoidal el grosor de la lámina es de 70-120 µm con altura celular de 25-35 µm y en la región rizoidal el grosor es de 110-220 µm con altura celular de 36-40 µm. Las células suelen ser poligonales, ocasionalmente cuadrangulares y en dameros pequeños, con diámetros de 6,5 por 9,5 µm hasta 11,4 por 16,6µm. La proporción de células con un solo pirenoide varía entre el 53% y el 95%, con dos pirenoides entre 5% y 46%, ocasionalmente se observan células con tres pirenoides. El cloroplasto es parietal y bien desarrollado. Alternancia isomórfica de generaciones, produce 8 gametas biflageladas femeninas o 16 masculinas por gametocisto y 4-8 esporas tetraflageladas por esporocisto. Vive en piletas de marea del intermareal medio y bajo y sobre Brachydontes purpuratus y Corallina officinalis. Referencias: Boraso (1977b, 2004); Boraso & Zaixso (2007). En el submareal de Golfo Nuevo solía desarrollarse en las últimas décadas una población muy extensa de una especie de Ulva de aspectos muy variable según el estadío de desarrollo, abarcado desde talos pequeños, ovales o curvados hasta talos de grandes dimensiones, muy perforados. Actualmente las arribazones de esta especie han sido reemplazadas por las de Undaria pinnatifida. Percursaria Bory: Género monotípico con la características de P. percursa. (C. Agardh) Rosenvinge Percursaria percursa (C. Agardh) Rosenvinge Lam 3-1-fig. 9 Talos filamentosos, no ramificados, formados por dos filas de células 1-2 veces tan largas como anchas, que se corresponden una a una en la mayoría de los casos, a veces dos a una, porción basal no discoidal, sin células rizoidales bien diferenciadas. El ancho del filamento biseriado en el material de Patagonia es de 25-33 µm, con células de 11-15 µm de ancho y 5-20 µm de largo. Un cloroplasto parietal por célula, en forma de banda mediana, con 1-2 (-5) pirenoides. Alternancia isomórfica de generaciones, con zoosporas pequeñas de hasta 4 a 5 µm de largo, tetraflageladas y gametas biflageladas, ligeramente anisógamas. Los filamentos erectos se forman a partir del borde de un disco postrado laminar. Referencias: Bliding (1963); (Boraso, 1975a, 1984); Boraso & Zaixso (2007). Ulvaria Ruprecht Talos laminares monostromáticos. Células uninucleadas con un cloroplasto parietal con pirenoides. Ciclos de vida con alternancia isomórfica de generaciones. Ulvaria obscura (Kützing) Gayral Lam 3-1-figs. 17—19; Lam 3-2-figs. 3-6 Talo de 8-10 cm de alto, orbicular o hendido en mayor o menor grado cuando adulto, de color pardo oscuro, tiñendo el papel al secarse. Células poligonales, algo ordenadas en regiones del centro del talo, desordenadas en el resto de la lámina. Grosor del talo de 32-55 µm, diámetros celulares de 6µm por 10 µm hasta 9 µm por 12 µm; en el borde de la lámina se observan usualmente de una a tres filas de células con paredes 44 engrosadas, de 20-28 µm de diámetro. Las células poseen un solo cloroplasto parietal, grueso sobre las paredes externas y algo más delgado sobre las laterales, con uno hasta (1-)2-3(-6) pirenoides. Es un alga submareal. Referencias: Papenfuss (1964); Boraso & Zaixso (2007). Orden Cladophorales Comprende especies de talo filamentoso, simple o ramificado, con células multinucleadas. Con ciclo digenético isomórfico. Familia Cladophoraceae Células multinucleadas con cloroplasto reticulado parietal, con pirenoides, usualmente muy cargado de almidón. Reproducción por zoosporas tetraflageladas y gametas biflageladas, propagación vegetativa por segmentos de talo o acinetas poco diferenciadas. Rhizoclonium Kützing Filamentos delgados simples, con rizoides laterales, de pocas células. (estamos considerando que las especies sin rizoides laterales pertenecen al género Lola Hamel & Hamel., con eje de de menos de 60 de diámetro, adherido por una célula basal o grampón multilobado, libres o adheridos por la célula basal. Rhizoclonium riparium (Roth) Harvey Son filamentos uniseriados, de color verde claro, flexuoso, muy finos, de 15- 25 (31) µm de diámetro, con frecuentes ramas laterales cortas, generalmente unicelulares, hasta de 2-3 células. Células de 1-3 veces tan largas como anchas, paredes no lameladas, cloroplasto reticulado grueso con varios (5-8) pirenoides. Referencias. Boraso (2004); Boraso & Zaixso (2007). Rhizoclonium tortuosum (Dillwyn) Kützing Se encuentran entremezclados con Bostrychia y Catenella, filamentos simples, de hasta 40 µm de diámetro y paredes engrosadas, con rizoides unicelulares frecuentes y células con relación largo ancho entre 1-2. Referencias. Boraso (2004); Boraso & Zaixso (2007). Rhizoclonium ambiguum (Hook. & Harv.) Kütz (= R. hookeri) Lam 3-5-fig. 14 Filamentos mayormente simples, verde oscuro, rígidos, enredados con otras algas filamentosas, células de 47-70 µm de diámetro, células 1-2 veces tan largas como anchas, paredes gruesas y lameladas. Rizoides unicelulares afinados o frecuentemente peltados. Frecuente en Tierra del Fuego. Referencias. Boraso (2004); Boraso & Zaixso (2007). Rama Chapman Filamentos gruesos, predominantemente postrados, ralamente ramificados en la base o a lo largo de los ejes, con algunos crecimientos rizoidales en células individuales. Paredes celulares gruesas. Cloroplasto generalmente muy oscurecido por el almidón Frecuentemente se lo considera sinónimo de R. ambiguum, pero, a nuestro entender, las especies del género Rama conforman, por lo menos en el hemisferio sur, una unidad natural, cuya delimitación no se ha podido aún completar por falta de datos referentes a reproducción, ultraestructura y moleculares. 45 Rama antarctica Chapman Lam 3-5-figs. 15-17: Filamentos gruesos, preponderantemente postrados, los principales de 110-130 µm de diámetro, en ápices de últimas ramas de unos 70 µm de diámetro, paredes muy gruesas y amarillentas, rizoides relativamente cortos y robustos uniendo los filamentos lateralmente. Cloroplasto arqueoplastidio parietal, perforado, con pirenoides relativamente pequeños y numerosos. Hemos observado de 12 a 15 núcleos parietales en células intercalares del filamento principal. Propagación por fragmentación del talo y brotación de partes basales, reproducción por esporas o sexual desconocida. Viven en el intermareal. Referencias: Boraso (1974, 2004). Boraso & Zaixso (2007). Rama novaezelandiae (J. Agardh) Chapman Filamentos poco ramificados, de entre 70- 80 µm de grosor, células de 1-2 veces tan largas como anchas, ramas postradas o erectas, generalmente simples, de 1- 5 células, más gruesas en la zona media, con paredes gruesas y lameladas. Con frecuentes rizoides unicelulares, gruesos o finos, generalmente peltados en los extremos, de unos 200 µm de longitud. Cloroplasto parietal, arqueoplastidio, perforado, con numerosos pirenoides bilenticulares. Propagación por fragmentación del talo, reproducción por esporas o sexual desconocida. Viven en el intermareal, formando céspedes enmarañados o entremezcladas con otras algas. Frecuente en Tierra del Fuego. Referencias:: Hoffmann y Santelices (1997); : Boraso (1974, 2004); Boraso & Zaixso (2007). Lola A. Hamel y G. Hamel: El género Lola se caracteriza por la anisogamia de sus gametas y no es un género aceptado por todos los autores. Por ahora preferimos mantener en este género a las especies con filamentos simples y de pequeño diámetro, adheridos por sola una célula rizoidal basal o libres y absolutamente carente de rizoides laterales y de rámulas. Lola implexa (Dillwym) Hamel Lam 3-5-figs. 3-7 Es una especie muy frecuente en la costa de Patagonia. Filamentos rectos no ramificados y sin rizoides laterales, de color verde claro hasta mediano, cloroplasto parietal espeso, con varios (2-6) pirenoides, células de paredes no engrosadas, de diámetro poco variable a lo largo de cada filamento, de 18-30 µm de diámetro y 1-4 veces tan largas como anchas. Adherida al sustrato por una sola célula poco diferenciada. Esporocistos intercalares poco engrosados respecto a las células vegetativas. Produce esporas que germinan en un filamento erecto. Viven en el intermareal, favorecida en lugares calmos, en piletas de marea, al principio epífita o sobre sustratos inertes, luego entremezclada con otras algas vedes filamentosas. Referencias. Chapman (1956); Boraso (2004); Boraso & Zaixso (2007). También ha sido descripta para la zona antártica la especie Lola irregularis Zaneveld. Chaetomorpha Kützing: Talos no ramificados, sin rizoides laterales, solitarios o en grupos, adheridos o flotantes. Célula basal alargada. Células multinucleadas, cloroplasto parietal reticulado, fragmentándose con la edad, con numerosos pirenoides. Propagación por fragmentación. Reproducción asexual por zoosporas, sexual por gametas biflageladas isógamas. En general, se diferencia de Lola por los mayores diámetros de los filamentos, la célula basal robusta y la mayor cantidad de núcleos por célula. 46 Chaetomorpha aerea (Dillwyn) Kützing Lam 3-5-fig. 10 Talos entre 5 y 35 cm de longitud aislados o en mechones erectos de color verde oscuro. Filamentos algo constrictos en las paredes intercelulares, adheridos al sustrato por una sola célula alargada con algunas proyecciones de 1,0 a 1,5 mm de longitud. Diámetro celular en la base de alrededor de 190 µm y en el ápice de alrededor de 330 µm en el filamento vegetativo. El largo celular varía de alrededor de 170 µm en la base hasta aproximadamente 230 µm en el ápice. La relación largo ancho en la base es de aproximadamente 1, y en la región apical de alrededor de 0,7. El cloroplasto es reticulado parietal hasta fragmentado con numerosos pirenoides bilenticulares. La reproducción observada en provincia de Buenos Aires es por zoosporas biflageladas directas con estigma, de unos 10,4 µm de largo y 5,3 µm de ancho que dan lugar a un talo idéntico al originario. Se encuentran intermareales, sobre sustrato rocoso. Referencias: Sar (1985); Boraso (2004); Boraso & Zaixso (2007). Chaetomorpha linum (Müll.) Kütz Lam 3-5-11-13 Talos rígidos al tacto, formando masas esponjosas muy entremezcladas de filamentos muy largos y enrulados, de 120-150 µm de diámetro. Se encuentran generalmente fuertemente enganchadas en otras algas, en piletas de marea poco profundas. Referencias. Hylmö (1916); Chapman (1956); Sar (1985); Boraso (2004); Boraso & Zaixso (2007). También se han mencionado Ch. nodosa Kützing para Río Negro, Tierra del Fuego e Isla de los Estados y Ch. dubyana Kützing para Santa Cruz y Tierra del Fuego. Cladophora Kützing: Cuenta con especies marinas y de agua dulce. Talo desde escasamente hasta muy ramificado, a veces con porciones basales bien desarrolladas. Paredes celulares frecuentemente lameladas. Los esquemas y grado de ramificación varían con las especies y son modificados por el ambiente. Células con varios núcleos. Cloroplastos reticulados y con numerosos pirenoides bilenticulares, aunque a veces se observan fragmentados. Alternancia isomórfica de generaciones, con zoosporas tetraflageladas y gametas biflageladas. Posibilidad de propagación vegetativa por células engrosadas o porciones basales perennes. Se encuentra en el intermareal, en piletas de marea y encharcados. Referencias: Hoek van den (1963, 1984). Cladophora albida (Huds.) Kützing var. refracta. Lam 3-6-figs. 1-2 Talos de aspecto esponjoso, arborescente, color verde claro a verde seco, con organización al principio acropétala y luego también intercalar, ápices de las ramas con tendencia a formar sistemas pectinados, apenas retroflexos. Ejes ramificados seudodicotómicamente, con ramas de varios largos, con abundantes rámulas laterales insertadas al principio subapicalmente, tomando luego todo el lado de la célula del eje. Células apicales cilíndricas, de ápices redondeados, sin engrosamientos ni mucrones. Diámertro de los ejes de hasta 80 µm, diámetro de las células de las ramas apicales 2530 µm, relación largo a diámetro de 3 a 1. Pueden formar cadenas moniliformes en el momento de la esporulación Esporas tetraflageladas. Referencias: Hoek (1963); Chapman (1956); Boraso (2004); Boraso & Zaixso (2007). 47 Lam 3-6: figs. 1-2: : Cladophora albida: 1: aspecto general, 2: detalle de cloroplasto; figs. 3-5: Cladophora falklandica: 3: aspecto general, 4: detalle de ramificación, 5: cloroplasto; figs. 6-7: Cladophora lehmanniana: 6: aspecto general, 7 detalle de ramificación; fig. 8: Cladophora coelothrix, ápices; figs. 9-12: Cladophora subsimplex:, 9-10: ramificación y rizoides, 11-12 detalles de cloroplastos 48 Cladophora coelothrix Kützing, Lam 3-6-fig. 8: Talos con organización irregular, la organización acropétala se oscurece desde un principio por divisiones transversales y formación de nuevas rama a la altura de los tabiques. Las ramas en la parte superior de las células pueden desplazarse hacia el ápice de la célula para dar pseudodicotomías. Otras ramas, frecuentemente de carácter rizoidal, pueden quedar insertas lateralmente hacia la mitad de la longitud de la célula madre o cerca de su base, por crecimiento en longitud de ésta. En el ápice las células miden 50 µm- 78 µm de diámetro y 450 µm - 1500 de longitud, con relación largo - ancho de 4-30; en el centro del talo el diámetro celular es de 100-120 µm (-200 µm) y la longitud de 200- 500 µm, con relación del largo al ancho de 8-10. Es una especie submareal. Referencias: Svedelius (1900); Chapman (1956); Boraso (2004); Boraso & Zaixso (2007). Cladophora falklandica (Hooker & Harvey.) Lam 3-2-figs. 26-28; Lam 3-6-figs 3-5: Talo adulto de color verde claro a verde seco en vivo, o desde verde claro a verde oscuro al secarse, textura firme, ni gelatinosa ni lúbrica. Talos de hasta 5-10 (-20) cm de altura, en mechones ligeramente retorcidos en las más grandes. Eje principal con relativamente pocas ramas primarias pero numerosas ramas intercalares secundarias con rámulas cortas, frecuentemente unicelulares, insertas unilateralmente en filas, o alternas. No se observan rizoides laterales Se encuentran también talos poco ramificados. Los talos jóvenes presentan una leve organización acropétala y ramas escasas. A medida que el talo se desarrolla se forman ramas intercalares quedando la organización acropétala limitada a regiones apicales o absolutamente oscurecida. Angulo de inserción de las ramas generalmente menor de 45°, aunque en ocasiones la ramificación en las regiones apicales puede devenir algo pectiniforme y con ramas abiertas y algo retroflexas. En las porciones basales, secundariamente semipostradas, pueden darse ángulos de ramificación muy abiertos y ocasionales ramas en forma de gancho. Cuando el talo está completamente desarrollado se pueden observar en las zonas inferiores y medias del talo hasta tres ramas, más raramente cuatro, saliendo de una misma célula madre, ubicadas apicalmente sobre la misma y algo soldadas lateralmente entre sí. Célula apical de las ramas desde redondeada a mucronada, de 15-50 µm de diámetro por 60-90 µm de largo, porciones apicales de las talos desde suave hasta marcadamente afinadas. Relación del largo al ancho celular en las ramas generalmente de 2.5:1 hasta 4,5:1. Diámetro del eje desde 5070 µm en talos jóvenes hasta 100 (-150) µm en los viejos. Los filamentos no muestran constricciones entre las células. Paredes de las porciones erectas en general delgadas; en las ramas que han detenido su crecimiento se pueden engrosar las paredes apicales de la célula apical formando un mucrón, característica ésta variable aún entre ramas de un mismo talo. Cloroplasto verde brillante cubriendo usualmente la pared celular, aunque se observa su naturaleza reticulada en algunas porciones del talo. Pirenoides numerosos, observándose en el mismo talo desde claramente bilenticulares hasta de contorno redondeado, de 4,5 µm a 9,5 µm en su mayor dimensión. Esporocistos de 60-85 µm de ancho por 120 µm de largo. Los mismos se forman generalmente en ramas largas, poco o nada ramificadas, presentándose ordenados en cadenas moniliformes apicales o intercalares que dan al talo un aspecto flexuoso y un color oscuro, característicos en la época reproductiva. La célula apical de las ramas fértiles es siempre de contorno globoso. Esporas tetraflageladas 6,25 - 12,5 µm de ancho 7,5-19,5 µm de ancho con una mancha ocular lateral. Los zooides son liberados a través de un poro lateral. Se observan talos fértiles en verano e invierno. Cuando el talo ha liberado masivamente las esporas queda reducido a las zonas basales, especialmente en el período invernal, pudiendo observarse el rebrote de estas porciones dando nuevas porciones erectas al llegar la primavera. Ocasionalmente se han encontrado trozos de talo sueltos en buen estado vegetativo, llevando incluso porciones con esporocistos. Se encuentran 49 intermareales y submareales. Referencias: Taylor (1939); Boraso (1999a, 2004); Boraso & Zaixso (2007) Cladophora lehmanniana (Lindenberg) Kützing Lam 3-6- figs. 6-7: Talos densamente arbustivos, de hasta 5 cm de alto, ramificados en forma alterna. Ramas menores algo recurvadas, frecuentemente llevando 1-2 (-5) rámulas en un nodo, rámulas de la zona apical tendiendo a ser unilaterales sobre el lado superior de la rama. Eje principal de 325 µm o más de ancho, con relación largo a ancho de 3-5 ; ramas de 60-100 µm de ancho en los ápices y alrededor de 150 µm en el centro del talo, con relación largo- ancho de las células de 2,5 - 3, células terminales romas a ligeramente globosas. Es submareal, poco frecuente. Referencias: Taylor (1939); Boraso (2004); Boraso & Zaixso (2007) (como Cladophora utriculosa). Cladophora subsimplex Kützing Lam 3-6-Figs. 9-12 Filamentos de color verde claro a oscuro, desde rígidos a flexuosos, con una porción basal que puede alcanzar los 70 µm de diámetro, y ejes erectos poco e irregularmente ramificados, de 37 a 45 µm de diámetro, hasta 20 µm en las regiones apicales, con algunos rizoides delgados. Ramas muy largas o cortas; simples o con escasas rámulas, raramente pectinadas, sus bases no están adheridas lateralmente al eje, insertas en ángulos mayores de 45º. Células 1-2 (-3) veces tan largas como anchas. Ápices de las células apicales redondeados. Paredes algo engrosadas solo en la base. Se encuentran: intermareales, entremezcladas con otras algas filamentosas. Referencias Hylmö (1919) y Chapman (1956) (como C. simpliuscula) Boraso (2004); Boraso & Zaixso (2007). Familia Pithophoraceae Wittrockiella Wille Talos filamentosos y ramificados dorsal o lateralmente, con formas erectas de células grandes o rizoidales. Algunas especies pueden llevar pelos. Pueden producer acinetas. Referencias: Guiry & Guiry (2012). Wittrockiella lyallii (Harvey) Hoek, Ducker & Womersley Lam 3-5- fig. 8-9 Talos cespitosos, cartilaginosos al tacto, irregularmente ramificados, con numerosas ramas laterales, con tendencia a ser unilaterales, más abundantes distalmente, redondeadas y algo engrosadas en los ápices ligeramente corimbosos; con algunas ramas dirigidas lateralmente algo afinadas hacia el ápice. A veces con conexiones laterales entre ramas. Los tabiques de la célula proximal de las ramas son perpendiculares a la dirección de la misma. Células de hasta 300-400 µm de diámetro, de 1,5 hasta 2,5 veces tan largas como anchas. Células apicales redondeadas hasta globosas, de contenido denso y de color pardo verdoso oscuro. Cloroplastos discoides, pequeños, los más grandes con pirenoides visibles, unidos por hilos de citoplasma. Reproducción no observada. Paredes relativamente finas. Con tendencia del talo a romperse a la altura de los tabiques con las células permaneciendo cilíndricas luego de la ruptura. Referencias: Svedelius (1900); Boraso de Zaixso (2001, 2004); Boraso & Zaixso (2007) (como Cladophoropsis brachiartra); Guiry & Guiry (2012). Orden Siphonocladales Se separan usualmente de las Cladophorales por el tipo de formación de ramas, que es por separación y segregación de partes del talo sifonal. 50 Familia Boodleaceae Cladophoropsis Borgesen Talos filamentosos, ramificados, con divisiones segregativas perpendiculares a los ejes y ramas, con parte del citoplasma de las células de los ejes o ramas mayores formando parte de la base de las ramas. La orientación inicialmente apical del crecimiento es reemplazada por crecimiento difuso en los talos adultos. Sin constricciones anulares. Frecuentemente con rizoides adhesivos. Numerosos cloroplastos con un pirenoide Cladophoropsis voluticola (Hariot) Börgensen Talo de pequeñas dimensiones, maculiforme, orbicular, radiando del centro, se encuentran sobre conchillas o en su capa externa. Filamentos de primer orden de 6-8 µ de ancho, rámulas frecuentemente unilaterales hacia abajo a veces opuestas, de unos 5 µ de ancho. Células cilíndricas, de 44-51 µm de longitud, sin tabiques en las bases de las ramas. Referencias: Hariot (1887); Boraso (2004). Clase Bryopsidophyceae: Comprende talos sifonales, prototalos (Derbesia), cladomas uniaxiales (Bryopsis) y talos multiaxiales (Codium). laxos Orden Bryopsidales Abarca a las Familias Bryopsidaceae, Codiaceae y Derbesiacea Familia Bryopsidaceae: Comprende géneros con talos sifonales con las características de Bryopsis Bryopsis Lamouroux: Talos erectos, de organización cladomiana, densamente ramificados, pero en pocos órdenes de ramificación. Ejes frecuentemente percurrentes, ramificación pinnada o radial. Neoplastidio formado por numerosos cloroplastos discoides, con pirenoide conspicuo. Talos monoicos o dioicos, con las gametas liberándose a través de poros en la pared. Cigota desarrollándose directamente sin producir esporofito o dando un protonema uninucleado que, o bien germina directamente produciendo el talo adulto o produce esporas estefanocontas que dan el talo erecto. Referencias: Jönsson (1980). Bryopsis australis Sonder Lam 3-7-figs. 10-12: Talos de hasta 10-12 cm de alto, verde oscuros, ejes poco o nada divididos y frecuentemente provistos abajo de abundantes rizoides, llevando hacia el ápice rámulas insertas radialmente, de 120-160 µm de diámetro, afinadas hacia el ápice, sucesivamente más cortas, formando mechones de aspecto lanceolado. La disposición de las pinas es irregularmente radial, aunque en algunas zonas, especialmente de los ápices, puede ser en un plano, pudiendo observarse ambos esquemas aún en ramas del mismo talo. Nunca hemos observado ejemplares fértiles. Abarca desde talos con dominancia del eje sobre las laterales hasta otros donde éstas se desarrollan en tamaño y dan a su vez sistemas de uno y dos órdenes de pinas. Frecuentemente todo el eje y las ramas primarias se encuentran totalmente tapizados de pinas, pero en otros casos las pinas se insertan solo distalmente, quedando los ejes parcialmente desnudos. Se encuentran en piletas de marea del intermareal, de volúmenes grandes y niveles bajos y en el submareal superior. Referencias: Hylmö (1919, 1938); Taylor (1939); Boraso de Zaixso (2004); Boraso & Zaixso (2007). Bryopsis rhizophora Howe Lam 3-2- fig. 7-10 Es una especie poco frecuente. El aspecto de los individuos es de corimbo, con las pinas creciendo radialmente. Los talos alcanzan de 2 a 4 cm de alto y presentan un eje casi desnudo en la porción basal; en la porción distal lleva pinas largas y poco ramificadas 51 hacia la mitad del talo y más cortas en el ápice. Las pinas llevan a asu vez penachos distales de pinas de hasta tercer orden. El diámetro de las pinas varía entre 65 µm y 150 µm y el de los ejes entre 300 µm y 400 m (-650µm en la descripción original). Presenta neoplastidio formado por numerosos cloroplastos discoides con uno, o a lo sumo dos pirenoides. El aspecto de las pinas es rústico y con marcadas variaciones morfológicas, lo que contrasta con las especies en general de las especies de Bryopsis, ser más homogéneas en este aspecto. En su forma más regular el talo termina en una porción apenas afinada respecto del eje. En ocasiones el ápice muestra un conjunto de pinas globulares densamente agrupadas, a veces con algún rizoide. Las pinas pueden formar frecuentemente rizoides en su base, a veces ramificados, finos o casi tan gruesos como la pina misma. El talo puede mostrar numerosos tabiques, asociados muchas veces a la base de las pinas o atravesando el eje principal o a los rizoides. Howe (1914) observó la formación de gametocistos poco diferenciados en las zonas apicales. Se observan zonas apicales con un domo de sustancia amorfa, amarillenta. Al retomar el talo el crecimiento apical, dicha estructura queda en una posición lateral. La repetición del proceso produce estructuras simpodiales apicales en la que los sucesivos ápices engrosados quedan como apéndices laterales de forma lenticular. El talo puede también presentar tapones a la altura de la base de las pinas o en el medio de las mismas Referencias: Howe (1914); Hoffman y Santelices (1997); Boraso de Zaixso (1999b, 2004); Boraso & Zaixso (2007). Bryopsis rosae Gaudichaud ex Agardh Talos de 15-17 cm, verde oscuros, ramificados libremente abajo, sin rizoides, con ejes gruesos de hasta 600 µm y paredes de hasta 35 µm, ramas laterales formando grandes racimos, con rámulas más cortas, bilaterales, 240-275 µm de diámetro, 3-7 µm de largo, muy contraídas en la base, afinándose distalmente, con forma roma en el ápice. Referencias: Cotton (1915); Hylmö (1919); Taylor (1939); Boraso (2004). Bryopsis magellanica Hylmö. De acuerdo a la descripción original esta especie corresponde a talos de hasta 3 cm de alto, dísticas, de ápice fuertemente percurrente. Pinas generalmente simples o poco compuestas, las superiores de longitud similar entre sí. El carácter de ápice percurrente se encuentra frecuentemente en el material correspondiente a B. australis, pero no está en ese caso asociada a la disposición en un plano de las pinas, ni a las pinas de longitud semejante entre sí, ni a talos pequeños. No contando con material representativo de esta especie nos referimos a la Lámina 33 de Hylmö (1919). Bryopsis plumosa (Hudson) C. Agardh El concepto de B. plumosa comprende generalmente talos delicados, regulares, color verde claro a mediano, de hasta unos 8-10 cm de alto, con un eje y pinas laterales dispuestas en forma dística, en un plano, en forma de pluma afinada en el ápice. A veces las pinas repiten el esquema de ramificación del eje. Sin embargo, las ilustraciones de la misma en diferentes floras y trabajos muestran claramente que se ha observado en la misma mayor variación que la usualmente aceptada. Hemos encontrado solo muy raramente en las costas patagónicas ejemplares que puedan ser asignados a esta especie, correspondiendo siempre a talos juveniles de ubicación dudosa; las ilustraciones de Parma et al. (1987) podrían corresponder a la misma. Referencias: Papenfuss (1964). Familia Derbesiaceae: Derbesia Solier Esporofitos diploides formados por filamentos sifonales erectos, desde escasamente hasta muy ramificados, de hasta unos 5 cm de alto, con esporocistos laterales con esporas estefanocontas. Gametofitos constituídos por vesículas esféricas a piriformes (Fase Halicystis) de hasta varios centímetros de diámetro dando gametas 52 biflageladas en compartimentos internos a la vesícula. El neoplastidio está constituído por numerosos plástidos, con o sin pirenoides. Derbesia furcata Ricker Lam 3-7-fig. 8 Talos diminutos, de hasta 8-9 mm de alto, con una porción basal pequeña y una porción erecta compuesta por filamentos desde simples hasta bifurcados una o dos veces, que se afinan suavemente hacia el ápice, con diámetros hasta de 100 µm en la base hasta 30 µm en los ápices. Septos relativamente frecuentes en las porciones basales, no necesariamente asociados a las bases de ramas, presentes ocasionalmente en las porciones distales de los talos más desarrollados. Cloroplastos de 2- 3 µm de diámetro, usualmente con un pirenoide según la especie. Referencias: Boraso (2004); Boraso & Zaixso (2007). Derbesia marina (Lyngbye) Solier, Lam 3-7-fig. 7 Especie tipo del género, con las características señaladas para el mismo, se presenta como matas color verde claro de hasta unos 4 cm de alto. Se ha encontrado en Canal Beagle bajo la canopia de Macrocystis. Referencias: Mendoza et al. (2005); Boraso & Zaixso (2007) También se ha descripto para la zona antártica la especie Lambia antarctica (Skottsberg) Delepine Referencias: Skottsberg (1953) (como Derbesia antarctica); Delépine (1968); Boraso (2004). Familia Codiaceae: Abarca numerosos géneros de talos multiaxiales macizos a veces calcificados. Codium Stackhouse Talo multiaxial no calcificado, formado por numerosos filamentos cenocíticos, con una médula incolora y una empalizada externa de ramas de crecimiento determinado, o utrículos, provistos de numerosos cloroplastos discoidales sin pirenoide. Talos erectos, cerebroides o pulvinados. Gametofitos dioicos, con gametocistos desde fusiformes hasta cilíndricos, separados basalmente del utrículo por engrosamientos anulares de la pared. Meiogametas biflageladas, anisógamas. Cigota desarrollándose directamente en un nuevo gametofito. Codium decorticatum (Woodward) Howe; Lam 3-2- fig. 11:; Lam 3-7-fig. 3: Talos de hasta un metro de largo, con pocas ramificaciones irregularmente dicotómicas de hasta el cuarto orden, las interdicotomías más cortas en la base y más espaciadas en las porciones distales. Ramas cilíndricas de 5-7 mm de diámetro, frecuentemente aplanadas en las dicotomías, donde pueden medir hasta 25 mm de ancho. Utrículos cilíndricos, algo dilatados en el ápice, de mayor tamaño en la región apical donde miden entre 0,7 y 3 mm de largo y 130-700 µm de ancho, en la base del talo miden de 670-1070 µm de largo y 60-350 µm de ancho. Pared apical de los utrículos ligeramente engrosada, hasta de 10 µm, nunca con mucrón. No se observan pelos ni cicatrices dejadas por los mismos. Gametocistos ovoides a ampuliformes de 230-360 µm de largo y 50-150 µm de ancho, naciendo a unos 430-650 µm del ápice del utrículo, generalmente uno, a veces dos por utrículo. Vive en el submareal, sobre substratos rocosos, canto rodado y conchillas. Referencias: Boraso & Piriz (1975); Boraso (2004); Boraso & Zaixso (2007). 53 Lam 3-7: fig. 1: Codium fragile; Fig. 2: Codium vermilara; fig. 3: Codium decorticatum; figs. 4-6:: Codium subantarcticum: 4: utrículos con gametocistos, 5: base de ramificación de utrículo, 6: racimo de utrículos; fig. 7 Derbesia marina; fig. 8- Derbesia furcata; figs. 10-12: Brypsis australis, 10-11: aspectos generales, 12: detalle de cloroplasto. 54 Codium fragile (Suringar) Hariot Lam 3-2- fig. 12-13; Lam 3-7-fig. 1 Talos de hasta 30 cm de alto, con numerosas ramas cilíndricas, ramificadas dicotómicamente hasta el décimo orden. Diámetro de los filamentos medulares de 20-55 µm. Utrículos simples, cilíndricos, ligeramente ensanchados en el ápice, de 800-1700 µm de largo y 70-400 µm de ancho, con un mucrón desde muy prominente hasta solo como una pequeña prominencia apical. Pelos frecuentes, de hasta 1,3 mm de largo, insertos en el tercio superior del utrículo. Gametocistos de 180-600 µm de largo y 80-140 µm de ancho, uno o a veces dos por utrículo, ubicados a 320-890 µm de su ápice. Habita los niveles inferiores del intermareal. Referencias: Boraso & Piriz (1975); Boraso (2004); Boraso & Zaixso (2007). Miravalles et al. (2012). Codium vermilara (Olivi) Delle Chiaje. Lam 3-2-fig. 14; Lam 3-7- Fig. 2 Talos erectos de hasta 16 cm, hasta con ocho órdenes de ramificación Filamentos medulares de 15-45 µm de diámetro. Utrículos simples, cilíndricos hasta piriformes de 325 - 650 µm de largo y 175-275 µm de ancho, sin mucrón apical. Pared apical de los utrículos algo más engrosada en los utrículos basales, de hasta 25 µm, que en los distales, de 7,7 µm en promedio. Se observan pelos de hasta 3 mm de largo, insertos a una distancia de 30-100 µm del ápice de los utrículos, los pelos pueden caer dejando una cicatriz. Gametocistos fusiformes con la base ligeramente ensanchada, de 200-330 µm de largo y 80- 180 µm de ancho, generalmente uno por utrículo y ubicados a 270-340 µm de los ápices de los mismos. Poblaciones submareales. Referencias: Boraso & Piriz (1975); Boraso (2004); Boraso & Zaixso (2007). Codium subantarcticum Silva Lam 3-7-figs. 4-6 Talo postrado, aplanado, ligeramente cerebriforme, de hasta 2 cm de grosor, y hasta 5 (-50) cm de diámetro, de color verde oscuro intenso, adherido al sustrato por filamentos terminados en hapterios, con una franja angosta del borde del talo no adherida y lobulada. Utrículos cilíndricos, sin engrosamiento en la pared apical, organizados en racimos. Utrículos primarios de 1350 a 2800 µm de largo y 120-340 µm de ancho, algo ensanchadas en la mitad proximal. A una distancia de alrededor de 1100 µm del ápice del utrículo primario nacen hasta 8 utrículos secundarios de 920- 2000 µm de longitud y 100-300 µm de ancho, los más pequeños ubicados en posición más distal. Pueden frecuentemente encontrarse utrículos terciarios de 850-1500 y 80-200 µm de ancho y ocasionalmente utrículos de cuarto orden. En la base de cada utrículo maduro se desarrolla un solo rizoide descendente. Ocasionalmente se observa a 90-130 µm del ápice de los utrículos, la inserción de pelos de 20-40 µm de ancho, ligeramente bulbosos en la base. Los gametocistos son piriformes, de 340- 500 µm de ancho, generalmente se observa uno por utrículo, ubicado hacia la mitad de la longitud del mismo. Se encuentra en Tierra del Fuego en el submareal y en los niveles inferior y medio del intermareal. Referencias: Boraso y Piriz (1975) (como Codium difforme); Boraso (2004); Boraso & Zaixso (2007). De acuerdo a Ricker (1987) C. difforme Kützing, incluído actualmente en la sinonimia de Codium effusum (Rafinesque) Delle Chiaje, presenta engrosamiento en los ápices de los utrículos, característica que no se observa en los materiales estudiados de la zona. 55 Referencias bibliográficas del capítulo 3. Bala, L. O. 1995. Especificidad y prevalencia de la endobiosis de Coccomyxa parasitica (Chlorophyta, Chlorococcales) en Mytilus edulis platensis (Mollusca, Bivalvia). Naturalia Patagónica 3: (1-2): 1-9. Bliding C. 1963. A critical survey of European taxa in the Ulvales. Part. I. Capsosiphon, Percusaria, Blidingia, Enteromorpha. Opera Botánica 8 (3):1-160. Boraso, A. L. 1970. Sobre la presencia de Blidingia minima var. minima (Chlorophyta Boraso, A. L. 1973. Pilinia novaezelandiae (Chapman) Papenfuss et Fan (Chlorophyta) en la Argentina. Physis sec. A 32 (84): 47-50. Boraso, A. L. 1974. El género Rama Chapman en Argentina. Physis 33 (86): 33-35. Boraso, A. L. 1975a. Los géneros Enteromorpha, Blidingia y Percursaria (Chlorophyta) en el litoral argentino. Darwiniana 19: 285-311. Boraso, A. L. 1975b. Prasinocladus marinus (Cienk.) Waern (Prasinovolvocales, Chlorophyta) en la Argentina. Physis sec. A 34 (88): 207-209. Boraso, A. L. 1977a. Reproducción de Ulvales de Puerto Deseado (prov. de Sta. Cruz, Rep. Argentina). II. Monostroma undulatum Wittrock. Physis sec. A 36 (92): 1-7. Boraso, A. L. 1977b. El género Ulva (Algae, Chlorophyta) I. Ulva en Puerto Deseado (provincia de Santa Cruz). Darwiniana 21 (1): 162-171. Boraso, A. L. 1979. Reproducción de Ulvales de Puerto Deseado (prov. de Sta Cruz) I. Consideraciones generales y reproducción en Enteromorpha. Darwiniana 22 (1-3): 241-253. Boraso de Zaixso, A.L. 1999a. Cladophora falklandica (Hook. Et Harv.) Hooker et Harvey en la costa argentina. Physis secc.A 57(132-133): 55-59. Boraso de Zaixso, A. L. 1999b. Presencia de Bryopsis rhizophora Howe (Siphonales) en Argentina. Physis secc. A 57 (132-133): 61-63. Boraso de Zaixso, A.L. 2002. Rosenvingiella polyrhiza (Rosenvinge) Silva (Prasiolales, Prasiolaceae) en Tierra del Fuego (Argentina). Naturalia Patagónica (NS) (Diciembre 2002) 1: 46-50. Boraso de Zaixso A. L. 2001 2004. Cladophoropsis brachyarthra (Svedelius) Börgesen en la costa de Argentina. Physis. Secc. A (59):136-137. Boraso, A. L., Piriz, M. L. 1975. Las especies del género Codium (Chlorophyta) en el litoral argentino. Physis sec. A 69: 245-256. Boraso, A. L., Zaixso, H. E. 1979. Coccomyxa parasitica endófita en Mytilus edulis. Physis 38 (94): 131-136. Boraso de Zaixso, A.L., Zaixso, J. M. 2007. Algas marinas bentónicas. En. Atlas de Sensibilidad ambiental del mar y de la costa. Demetrio Boltovskoy (Ed.) (PNUD). Chapman, V. J. 1956. The Marine algae of New Zealand. Chlorophyceae. J. Linn. Soc. of Bot. London. 55 (360): 373-501 + 50 pls. Gain, M. L. 1912. La flore algologique des régions antarctiques et subantarctiques. En J. B. Charcot, Deuxieme expedition antarctique francaise 1908-1910. Sci. Nat. Doc. Sci. Paris: 1-218, 8 pl., 1 cart. Garbary, D.J.; Bird, C.J.; Kim, K.Y. 2009. Sporocladopsis jackii (Chroolepidaceae, Chlorophyta): A new species from eastern Canada and Maine symbiotic woth the mud snail, Ilyanassa obsolete (Gastropoda). Rhodora 9 Gauna, M. C. & Parodi. E. R. 2008. Epi-endophytic symbiosis of green algae in Hymenena falklandica(Rhodophyta) from the patagonian coasts of Argentina. Phycological Research 56(2) 182-191 Gauna, M. C., Parodi, E. R.; Cáceres, E. J. 2009. Epiphytic relationships in Rhodymenia pseudopalmata. (Rhodophyta) from the patagonian coasts of Argentina: the occurrence of the epiphyte alga Pseudendoclonium submarinum Wille (Ulvophyceae). Phycological Research 57: 313-322. Golden, L.; Cole, K.M. 1986. Studies on the green algae Kornmannia (Kornmanniaceae, fa.nov., Ulotrichales) i9n British Columbia. Japanese J. of Phycology. 34:263-274. 56 Guiry, M. D. & Guiry, G. M. 2003- 2013. AlgaeBase. World-wide electronic publication, National University of Ireland, Galway. http://www.algaebase.org. Hariot, P. 1887. Algues magellaniques nouvelles. J. Bot. París 1: 55-59, 72-74. Hoek, van den, C. 1963. Revision of the european species of Cladophora. E. J. Brill, Leiden. 248 pp + 55 pl. Hoek, van den, C. 1984. The systematics of the Cladophorales. In D. E. G. Irvine & D. M. John Systematics of the green algae. Systematics Association Special Volume Nº 27 : 157-178. Hoek C. van den, C.; Stam , W. T. ; Olsen J.L. 1988 The emergence of a new chlorophytan system, and Dr. Kornmann's contribution thereto. Helgoländer Meeresuntersuchungen. 42: 339-383. Hoffmann, A.; Santelices, B. 1997. Flora Marina de Chile Central. Ediciones Universidad Católica de Chile. 430 p. Howe, M. A. 1914. Marine Algae of Perú. Mem. Torrey Bot. Club 15: 180 p., 50 pl. Hylmö, D. 1919. Zur Kenntnis der subantarktischen und antarktischen Meeresalgen. III. Chlorophyceen. En O. Nordenskjöld Wissenschaftliche Ergebnisse der schwedischen Südpolar Expedition 1901-1903. 4: 2 (16): 20 p, 33 fig. Hylmö, D. 1938. Botanische Ergebnisse der schwedishen Expedition nach Patagonien und dem Feuerlande, 1907-1909. XI. Meeresalgen 3 Chlorophyceae. K. Sv. Vet. Akad. Handl. ser.3, 17 (1): 23 p., 5 fig. Jónsson, S. 1980. Le cycle de développement du Bryopsis plumosa (Hudson) C. Agardh (Chlorophyta) d' Islande, en culture: un cycle monogénétique dans la population nord- atlantique. Cryptogamie: Algologie 1(1): 51-60. Leonardi, P. I.; Caceres, E. J.; Correa, J. A. 2002, Ultrastructure and taxonomy of Sporocladopsis novae-zelandiae (Ulvophyceae, Chlorophyta) Botanica marina 45 (4)::324-330. Mendoza M.L.,Boraso De Zaixso, A.L.; Zaixso, H. E. ; Nizovoy, A.; Ramos L. 2005. Composición estacional del estrato herbáceo- mucinal en un bosque de Macrocystis pyrifera de Isla Despard (Canal de Beagle, Argentina)” XI Congreso Latinoamericano de Cs. del Mar. Viña del Mar, Chile. 16-20/05/05. Resumenes p 168 http://www.alicmar.org/congresos/documentos/decimoPrimero/Resumenes.pdf Miravalles A. B., Leonardi P. I.; Cáceres. E. J. 2012. Female gametogenesis and female gamete germination in the anisogamous green alga Codium fragile subsp. novaezelandiae (Bryopsidophyceae, Chlorophyta) Phycological Research 60(2): 77-85. O'Kelly, C. J. ; Floyd, G.L. 1984 Correlations among patterns of sporangial structure and development, life histories, and ultrastructural features in the Ulvophyceae. In D. E. G. Irvine & D. M. John Systematics of the green algae. Systematics Association Special Volume Nº 27 :121- 156. Papenfuss, G.F. 1962. On the circunscription of the green algal genera Ulvella and Pilinia. Phykos 1(1): 6-12. Papenfuss, G. F. 1964. Catalogue and bibliography of antarctic and subantarctic benthic marine algae. Antarctic. Res. Ser. American Geophys. Union 1: 1-76. Parma, A., Pascual, M.; Sar, E. 1987. Clave para el reconocimiento de los géneros de algas macrofitas del intermareal rocoso bonarense. Serie Técnica y Didáctica, Serie aperiódica de la Fac. de Cs. Nat. y Museo de La Plata, Argentina 15, 29 p. Perales S. G.; Boraso A L 2006 Relación de Blidingia minima (Ulvales, Chlorophyta) con factores ambientales en Punta Maqueda (golfo San Jorge, Argentina) Revista de Biología Marina y Oceanografía 41(1): 21 – 33 Ricker, R. W. 1987. Taxonomy and biogeography of Macquarie Island Seaweeds. British Museum (Nat. Hist.) London, 344p., 126 figs Sar, E. 1985. Contribución al conocimiento de Chaetomorpha aerea (Dillwyn) Kützing (Cladophorales, Chlorophyta) Darwiniana 26 (1-4): 71-77. Sar, E. 1985. Contribución al conocimiento de Ulothrix flacca (Dillw.) Thuret (Ulotrichales, Chlorophyta). Lilloana 36: 215-219. 57 Stevenson, R. N.; South, G. R. 1974. Coccomyxa parasitica sp. nov. (Coccomyxaceae, Chlorococcales), a parasite of giant scallops in Newfoundland. British Phycological Journal 9: 319-329, 4 figs, 3 tables. Svedelius, N. 1900. Algen aus den Ländern der Magellanstrasse und Westpatagonien. I. chlorophyceae. En O. Nordenskjöld, Wiss. Ergeb. schwed. Exped. nach den Magellansländern (1895-1897). 3 (8): 283-316, 16 pl. Stockholm. Taylor, W. M. 1939. Algae collected by the "Hassler", "Albatross" and "Schmitt" expeditions. II. Algae from Uruguay, Argentina, The Falklands and the Strait of Magellan. Mich. Acad. Sci. Arts Letters 24 (1): 127-164. Womersley, H. B. S. 1984. The Marine benthic flora of Southern Australia, Part I. South Australian, D. J. Woolman, Government Printing, Adelaide, South Australia, 329 p. Zechman, F. W.; Theriot, E. C.; Zimmer, E. A.; Chapman, R. L. 1990. Phylogeny of the Ulvophyceae (Chlorophyta): Cladistic analysis of nuclear-encoded rRNA sequence data. Journal of Phycology 26 (4): 700-710. 58 59 60 61 Capítulo 4: ALGAS PARDAS Características Generales Las algas pardas bentónicas pertenecen a las Clase Phaeophyceae (División Heterokontophyta, Cromophyta o Chromista) la que se caracteriza por la presencia de clorofilas a, c1 y c2 y de fucoxantina como pigmentos fotosintéticos y de laminarina y manitol como substancias de reserva. Los tipos de cloroplastos se caracterizan por: su forma y número, por su posición parietal o axial en la célula, por el grado y tipo de agregación y por la presencia y tipo de pirenoide. La pared se encuentra formada por material fibrilar, celulosa y una matriz amorfa de ácido algÍnico. Compuestos polifenólicos se pueden acumular, en vesículas dentro de los cloroplastos estas vesículas son expulsadas del feoplasto y coalescen en el citoplasma para formar los cuerpos fisodes, muy visibles en algunos géneros. Los tipos de células flageladas en Phaeophyceae comprenden zoosporas asexuales, isogametas, anisogametas y espermatozoides. Usualmente poseen dos flagelos heterocontas, uno anterior con pelos y uno posterior liso. La mayoría lleva una mancha ocular y un engrosamiento asociado a la base del flagelo posterior. El cuerpo basal flagelar está conectado con el núcleo y asociado espacialmente al feoplasto. Cuando las gametas poseen varios feoplastos, el estigma y la conexión a la base del flagelo se observan en uno solo o ninguno de ellos. La taxonomía de las algas pardas ha contado con importantes y numerosos estudios sobre ciclos de vida y ultraestructurales como los de Wynne (1969,1982); Delépine et al (1976); Silberfeld et al. (2011). Igualmente se ha avanzado mucho en las filogenias de diferentes grupos en algas pardas en estudios moleculares, como Stache-Crain et al. (1997) en Ectocarpaceae, Tan & Druehl (1995, 1996) en Sporochnales, Desmarestiales y Laminariales y Yoon, et al. (2001) en Laminariales. Clase Phaeophyceae: órdenes, familias y géneros: Orden Ectocarpales Familia Acinetosporaceae: Acinetospora; Bornet , Feldmannia Feldmannia Hamel; Geminocarpus Skottsberg; Hincksia Silva, Meñez & Moe Familia Ectocarpaceae: Ectocarpus Lyngbye; Kuckuckia G. Hamel Familia Pylaiellaceae : Pylaiella Bory Familia Chordariaceae: Asperococcus ; Lamouroux; Botrytella Bory; Cladochroa Skottsberg ; Cladothele Hooker & Harvey ; Corycus Kjellman , Chordaria J. Agardh ; Elachista Duby; Eudesme J. Agardh; Gononema Kuckuck & Skottsberg ;Laminarionema Kawai & Tokuyama; Laminariocolax Kylin, Leathesia Gray ;, Leptonematella Silva, Mikrosyphar Kuckuck, Myriogloea Kuckuck ; Myrionema Greville ; Punctaria Greville; Streblonema Derbès et Solier .Familia Adenocystaceae: Adenocystis Hooker et Harvey ; Caepidium J. Agardh ; Utriculidium ; Skottsberg Orden Scytosiphonales Familia Scytosiphonaceae: Colpomenia Derbès et Solier ; Petalonia Derbès et Solier ; Scytosiphon C. Agardh Orden Ralfsiales Familia Ralfsiaceae: Lithoderma Areschoug ; Petroderma Kuckuck , Ralfsia Berkeley, Pseudolithoderma Svedelius Orden Scytothamnales Familia: Scytothamnaceae: Scytothamnus Hooker & Harvey ; Stereocladon Hooker & Harvey Familia Asteronemataceae: Asteronema Delépine & Asensi Familia Bachelotiaceae: Bachelotia Kuckuk ex Hamel 62 Orden Cutleriales Familia Cutleriaceae: Cutleria Greville , Microzonia J. Agardh . Orden Dictyotales Familia: Dictyotaceae: Dictyota . Orden Fucales Familia Durvillaeacea: Durvillaea Familia Cytosphaeraceae: Cystosphaera Skottsberg Orden Ascoseirales Familia Ascoseiraceae: Ascoseira Orden Sphacelariales Familia Sphacelariaceae: Sphacelaria Lyngbye, Herpodiscus South Familia Stypocaulaceae: Halopteris Kützing ; Stypocaulon Kützing Familia Cladostephaceae: Cladostephus C. Agardh Orden Sporochnales Familia Sporochnaceae: Sporochnus Orden Laminariales Familia Lessoniaceae: Lessonia Bory . Macrocystis L. Familia Alariaceae: Undaria Suringar. Orden Ectocarpales Las pruebas a partir de los análisis de secuencias de bases apoyan cada vez más la idea de un gran grupo emparentado de géneros que abarcan a varias familias y sugieren la existencia del orden Ectocarpales en sentido amplio que abarca numerosas especies de estructura haplóstica. . Familia Acinestosporaceae Son filamentos haplósticos que crecen por meristemas localizados y poseen células con feoplastos discoides. Referencias: Guiry & Guiry (2012). Acinetospora Bornet Este género lleva ramas laterales cortas insertas en ángulos abiertos Suelen observase zonas de crecimiento en la base y también en la zona basal de las ramas largas de último orden. Las ramas terminan frecuentemente en una porción hialina o pseudopelo. Los feoplastos son discoides, o en forma de cuerpo de violín, con un pirenoide bien visible. Los esporocistos pluriloculares, se encuentran ubicados debajo de las regiones de crecimiento. Los esporocistos uniloculares se ubican en igual posición que los pluriloculares. Referencias: Asensi & Garrone (1973); Boraso & Zaixso (2007); Asensi & Küpper (2012). Acinetospora crinita Carmichael) Kornman Lam 4-1-figs. 2-4 Los talos son epífitos, erectos, pequeños, delicados, en mechones enmarañados. Los ejes y ramas primarias muestran una o más zonas de crecimiento intercalar, terminan en pseudopelos y llevan ramas cortas laterales espaciadas, insertas en ángulos de hasta 90 grados. Las células alcanzan hasta 30 µm de ancho por 80 µm de largo y llevan varios feoplastos desde discoides a alargados y con un pirenoide lateral. El número de feoplastos por célula es muy variable, pudiéndose observar desde pocos y relativamente grandes hasta numerosos y pequeños en diferentes zonas de un mismo talo. Las ramas pueden presentarse alternando con los esporocistos pluriloculares o llevarlos insertos lateralmente en la base. Los esporocistos están ubicados por debajo de las zonas meristemáticas, los uniloculares son poco frecuentes, esféricos u ovoides, los pluriloculares de hasta 110 µm de largo por 45- 50 µm de ancho, apenas recurvados, con lóculos grandes, insertos lateralmente en las ramas, sésiles o con un pedicelo unicelular. Referencias: Asensi & Garrone (1973); Boraso & Zaixso (2007). 63 Feldmannia Hamel En Feldmannia los meristemas son basales y no se observarían las ramas laterales cortas ni los esporocistos de grandes lóbulos característicos de Acinetospora. Feldmannia simplex (Crouan & Crouan) G. Hamel Talos epífitos, pequeños, formando penachos pardo claro, tenues, lacios, suaves, con una porción postrada, estolonífera y rizoidal, sólidamente adherida al huésped, y una porción erecta de filamentos simples, o escasamente ramificados, de 30 - 40 µm de diámetro, terminados en pseudopelos. Esporocistos pluriloculares frecuentes, cónicos a ovales, de 70-120 µm de largo por 40-70 µm de ancho, pedicelados en su base, ubicados por encima del meristema de la base de los filamentos erectos, saliendo de una célula cuadrangular en vista lateral. Esporocistos uniloculares esféricos a ovoides de 50 por 70 µm sobre los mismos individuos y en igual posición que los pluriloculares, aunque poco frecuentes. Referencias: Asensi (1972); Asensi & Küpper (2012). Geminocarpus Skottsberg Talos en mechones, formados por filamentos adheridos por rizoides, al principio haplósticos, luego levemente polísticos. Ramificados en forma opuesta, dística. Organos pluriloculares y uniloculares, laterales, sésiles o pedicelados, opuestos, formados a partir de rámulas transformadas, frecuentemente en series. Geminocarpus geminatus (H. & H.) Skottsberg Lam 4-2-fig. 1 Mechones pardos, de hasta 15 cm de alto, oliváceos, fláccidos, muy ramificados hacia la base, con ramas divergentes, opuestas, bilaterales arriba. Diámetro de los ejes de 40-70 µm y de las ramas de 25-50 µm, afinándose hasta 10-25 µm en los ápices de las rámulas. En porciones pequeñas del talo se pueden producir tabiques longitudinales. En las porciones uniseriadas las células son algo más cortas que anchas. Rámulas de último orden en series, ubicadas cada 3-7 células del eje. Parte basal del eje con rizoides. Esporocistos uniloculares y pluriloculares, más frecuentemente sobre individuos separados. Los esporocistos se ubican típicamente en forma opuesta, a veces con un esporocisto opuesto a una rama. Esporocistos uniloculares globosos de 45- 50 µm por 3040 µm, los pluriloculares desde cortos y cónicos hasta cilíndricos, rectos o ligeramente curvos, de 30-260 µm de largo y 20-50 µm de ancho. Referencias: Skottsberg (1907); Boraso & Zaixso (2007); Asensi & Küpper (2012). También se ha citado para la zona antártica: Geminocarpus austro-georgiae Skottsberg. Referencias: Guiry & Guiry (2007); Skottsberg (1907); Hincksia Silva, Meñez & Moe Este género abarca talos ectocarpoides, epilíticos o epífitos, muy ramificados, con ramas terminadas en pseudopelos. El crecimiento es intercalar, difuso o localizado en la base del pseudopelo terminal. Los feoplastos son numerosos, discoides, parietales y con un pirenoide. Los esporocistos pluriloculares son sésiles, desde cilíndricos hasta globosos. La reproducción sexual es por planogametas anisógamas. Las especies de la costa de Argentina actualmente asignadas a este género fueron estudiadas como especies de Giffordia por Asensi (1973b). Hincksia mitchellae (Harvey) P. Silva Talos epífitos de hasta 4 cm de alto, con rizoides basales abundantes, formados a partir de las células basales de los filamentos erectos. Ramas laterales muy abundantes, alternas o parcialmente unilaterales, terminadas en pseudopelo hialino aguzado. Células de alrededor de 20 µm de diámetro y hasta más de 60 µm de longitud. Varios feoplastos por célula, en forma de cuerpo de violín o discoides con pirenoide. Esporocistos 64 pluriloculares, cilíndricos, sésiles, de 30 µm de diámetro por hasta 100 µm de longitud. Esporocistos uniloculares de perfil oblongo. Referencias: Cabrera (1970); Asensi (1973b). Hincksia granulosa (J. E. Smith) P. Silva in P. Silva et al. Lam 4-1-figs. 12-13 Talos de hasta 4-5 (-10) cm de alto, epífitos, con rizoides corticantes cerca de la base, provistos de ramas opuestas o unilaterales. El crecimiento es intercalar y cada rama termina en un pseudopelo aguzado. El diámetro de los filamentos principales alcanza los 50-60 µm. Cada célula lleva varios feoplastos con forma de violín o discoidales, con pirenoides. Los esporocistos pluriloculares son frecuentes y abundantes, cónicos a ovoides, de 80-90 µm de largo por 50-60 µm de diámetro máximo, algo recurvados, sésiles, dispuestos sobre las ramas en posición adaxial, alternando con ramas cortas. Referencias: Asensi (1973b); Boraso & Zaixso (2007); Asensi & Küpper (2012). Hincksia hincksiae (Harvey) P. Silva in Silva, Meñez & Moe; Talos de hasta 5 cm de alto, epífitos. Ramas unilaterales con sectores en que se disponen alternadas, terminadas en un pseudopelo. Diámetro de los ejes de entre 40 y 60 µm. Varios feoplastos por célula, discoides, o con forma de cuerpo de violín o irregulares, con pirenoide. Esporocistos pluriloculares cónicos, levemente curvos, sésiles, en series, contiguos, adaxiales y en un plano, en ejes y ramas, con maduración centrífuga. Diámetro máximo de unos 35 µm y longitud de entre 60 y 70 µm. Esporocistos uniloculares poco frecuentes, con disposición similar a los pluriloculares. Referencias: Asensi (1973b); Parodi & Müller (1994); Boraso & Zaixso (2007); Asensi & Küpper (2012). Hincksia ovata (Kjelman) Silva Talos de hasta 6 mm, epilíticos, formando un césped muy corto. Con estrato filamentoso postrado, ejes erectos poco ramificado en forma irregular. Meristemas en la base de los pseudopelos terminales o también en otras posiciones. Diámetro de 20-30 µm, células hasta el doble de largas que anchas, cada una con feoplastos en forma de cuerpo de violín, o discoides, con pirenoide, relativamente poco densos. Esporocistos pluriloculares, cónicos a ovoides, algo aguzados y levemente recurvados,dispuestos irregularmente sobre los ejes y bases de las ramas laterales, sésiles o con una célula basal corta, de 30-40 µm de ancho y 60-70 µm de longitud. Referencias: Asensi (1973b); (como Giffordia intermedia) y por Boraso & Zaixso (2007) y Asensi & Küpper (2012) (como Hincksia intermedia). Hincksia sandriana (Zanard.) P. Silva Talos de hasta 5 cm de alto, con ramificaciones abundantes, ramas divaricadas, en tramos unilaterales, suavemente recurvadas y levemente aguzadas. Diámetro celular en los ejes hasta de 50 µm y hasta 40 µm de longitud. Varios feoplastos por célula, en forma de cuerpo de violín o discoidales, con pirenoide. Esporocistos pluriloculares en series, no contiguos, en un mismo plano, adaxiales sobre las ramas, ovoides hasta alargados, algo recurvados y sésiles, de 20 µm de diámetro y hasta de 60 µm de longitud. Referencias: Asensi (1973b), Boraso & Zaixso (2007) Asensi & Küpper (2012). 65 Lam 4-1: fig. 1: Kuckuckia spinosa: ramificaciones y feoplastos; figs. 2-4: Acinetospora crinita: 2-3: esporocistos pluriloculares, .4: feoplasto; 5-11: Pylaiella littoralis 5: ramificación, 6-8: feoplastos,9-10 esporocistos uniloculares, 11: esporocistos pluriloculares; figs. 12-13: Hincksia granulosa, 12: esporocisto plurilocular, 13: esporocisto unilocular; figs. 14- 15: Gononema ramosum: 14: ramas, 15: detalle de esporocistos; figs. 16-18: Ectocarpus fasciculatus: 16- 17: ramas y esporocistos o gametocistos pluriloculares, 18: feoplasto; fig. 19: Ectocarpus falklandicus: feoplastos acintados. 66 Familia Ectocarpaceae Ectocarpus Lyngbye El género Ectocarpus, que abarcaba anteriormente numerosas especies, ha sido circunscripto a un concepto menos amplio a medida que se delimitaron los géneros vecinos. En la actualidad Ectocarpus incluye especies de talo filamentoso, uniseriado, microscópico o macroscópico, con grado variable de ramificación, adherido basalmente por una porción postrada rizoidal o discoidal diminuta, con filamentos erectos ramificados opuesta, dística o unilateralmente, a veces corticados basalmente. El crecimiento de los filamentos erectos es predominantemente intercalar y el de las porciones postradas apical. Poseen pocos feoplastos por célula, parietales, en forma de bandas longitudinales o helicoidales o irregulares, con uno a varios pirenoides cada uno. Las estructuras reproductivas son usualmente pediceladas, laterales o terminales. Muestran alternancia isomórfica de generaciones, con esporofitos diploides con esporocistos meióticos uniloculares, globosos, frecuentemente acompañados de esporocistos mitóticos pluriloculares. Los gametofitos haploides llevan gametocistos pluriloculares que producen isogametas o anisogametas, frecuentemente partenogenéticas. Ectocarpus falklandicus Skottsberg Lam 4-1-fig. 19 Talos relativamente robustos, de hasta unos 5 (-8) cm de alto, ramificación abundante desde alterna hasta pectinada, con filamentos erectos de 50-60 (-80) µm de diámetro y ramas distalmente afinadas. Células desde más cortas que anchas hasta cuadrangulares en vista lateral, algo constrictas a nivel de los septos, con varios feoplastos alargados, angostos, a veces ramificados o helicoidales. No hemos observado porciones basales muy desarrolladas. Los órganos pluriloculares son cónicos cuando maduros, de hasta 120-190 µm de largo por 24-36 µm de ancho, sésiles o pedicelados, a veces apicales sobre una rama corta, frecuentemente se disponen unilateralmente. Referencias: Boraso & Zaixso (2007); Asensi & Küpper (2012). Ectocarpus siliculosus (Dillwyn) Lyngbye Talos delicados, muy ramificados en forma pseudodicotómica hacia la base y en forma alterna o unilateral en la región apical. Ramas algo atenuadas, sin zonas de crecimiento visibles. Grosor de las células en las porciones centrales del talo entre 20 y 50 µm, células de 0,9 a 2,5 veces tan largas como anchas. Feoplastos irregulares, en forma de banda y frecuentemente helicoidales, con varios pirenoides visibles. Esporocistos uniloculares desde ovoides a elipsoidales, sésiles o sobre cortos pedicelos, de 30-65 µm de largo por 20-45 µm de ancho. Órganos pluriloculares angostos, ligeramente cónicos o fusiformes, de 90-200 µm o más de longitud y 10-30 µm de ancho, con un pedicelo de una a varias células, ocasionalmente terminados en un pelo hialino. Referencias: Boraso & Zaixso (2007); Asensi & Küpper (2012). Ectocarpus fasciculatus. Harvey Lam 4-1-figs. 16-19: Talos epífitos formando mechones cortos partiendo de un diminuto disco basal, ejes erectos, de 20-40 µm de grosor, abundantes ramas laterales de menor diámetro, cortas, generalmente simples, de unos 10 m de diámetro, insertas en ángulos abiertos y terminadas en forma afinada con una célula apical pequeña, ramas frecuentemente ubicadas en la porción distal. Células de los ejes cilíndricas, apenas constrictas en las paredes transversales, desde una a dos veces tan largas como anchas. Ejes y ramas terminados en pseudopelos alargados incoloros. A veces con rizoides corticales descendentes en el tercio inferior del talo. 67 Esporocistos pluriloculares ovoides de aproximadamente 50-55 µm de longitud por 15- 20 (-55) m de ancho, también cónicos o cilíndricos, sésiles o pedicelados, laterales o terminales, solitarios o en series o intercalares y en este último caso de hasta 280 m de longitud y 55 µm de ancho. En las células más pequeñas los feoplastos aparentan ser uno o dos y cubren toda la pared celular, en las células más grandes se observan varios feoplastos irregulares o longitudinales con varios pirenoides cada uno. En nuestras muestras se encuentran mezclados ejemplares que responden a E. constanciae en el sentido restringido de Hariot (1889) con otros que corresponden a la descripción usual de E. fasciculatus. Womersley (1987) menciona la presencia de rizoides descendentes en el tercio inferior del talo en E. fasciculatus del sur de Australia y señala una mayor densidad de ramificación hacia el extremo distal y presencia de pseudopelos, que son caracteres coincidentes con E. constanciae tanto de nuestra zona como de Islas Macquarie (Ricker, 1987). Hariot (1889) señala que los esporocistos pluriloculares de E. constanciae pueden ubicarse terminales sobre ramas laterales o ser sésiles y los ilustra solitarios. Ricker (1987) por su lado amplía el rango de posibilidades e incluye en E. constanciae de las Islas Macquarie a formas con esporocistos en fascículos, presencia de ramitas retroflexas y rizoides basales corticando el talo, asimilables a E. fasciculatus Harvey. Los esporocistos pluriloculares de E. fasciculatus de Australia alcanzan mayores longitudes que los observables en los talos más típicos de E. constanciae, pero ocasionalmente hemos observado esporocistos pluriloculares de mayor tamaño y aún intercalares o con pelos terminales en algunos ejemplares que por lo demás responden al concepto original de E. constanciae. En algunas de las células más voluminosas de este material se observa claramente la disposición longitudinal de los feoplastos, característica que según Ricker (1987) diferencia a E. constanciae y E. fasciculatus del complejo E. confervoides.- E. siliculosus. Teniendo en cuenta la variabilidad observada en nuestro material dentro de un misma muestra, la descripción de E. fasciculatus de Australia de acuerdo a Womersley (1987) y la sugerencia de Ricker (1987) consideramos a E. constanciae Hariot como sinónimo de. E. fasciculatus. Referencias: Hariot (1889); Skottsberg (1907, 1921); Parodi & Müller (1994); Boraso & Zaixso (2007)(como E. constanciae); Asensi & Küpper (2012). Ectocarpus dimorphus Silva Esta forma parece corresponder al resultado de infecciones virósicas de algunas de las especies de la zona. Referencias: Asensi (1974b). Ectocarpus exiguus Skottsberg Talos epífitos, diminutos, con una porción postrada y una erecta de hasta 5 mm de alto, con filamentos de 15 - 30 µm de diámetro, algo ramificados hacia la base y simples hacia los ápices. Células cilíndricas, de 1,5 - 3 veces tan largas como anchas; de menor longitud relativa en la región basal. Esporocistos pluriloculares fusiformes de 60128 µm de largo y 18-39 µm de ancho ubicados sobre el estrato basal o en los filamentos erectos. Referencias: Skottsberg (1907, 1921). Kuckuckia G. Hamel Talo heterotrico, formado por filamentos erectos muy ramificados, a veces simpodialmente. Adheridos al sustrato por rizoides. Crecimiento intercalar con meristemas o difuso. Con pelos feofíceos laterales y terminales, los más jóvenes con vaina basal. Esporocistos pluriloculares sésiles o pedicelados, formados frecuentemente por transformación del ápice de laterales cortos. Feoplastos acintados con pirenoides. 68 Lam 4-2: fig. 1: Geminocarpus geminatus con esporocistos pluriloculares; fig. 2-3: Streblonema cokeri: 2 porciones rastrera y erecta, 3: células en centro y ápice de filamento erecto; figs. 4-9: Cladothele decaisnei: 4: corte del eje joven, 5: ramitas laterales, 6-7: aspecto superficial y en corte de talo con esporocistos y pelos feofíceos, 8: corte de talo maduro, 9: aspecto general; figs. 10- 12: Botrytella parva: ramas y esporocistos; figs. 13-14: Leathesia difformis, cortes en zona vegetativa y con corte en zona con esporocistos, parafisas y pelos; figs. 15-17: Caepidium antarcticum, 15: talo con predominancia de porción postrada, 16: talo leathesioide, 17: talo con predominancia de porción erecta; fig. 18: Lithoderma antarcticum: varios cortes transversales; figs. 19- 23 Chordaria linearis: 19: corte longitudinal, 20: corte transversal con esporocistos unilocular, 21: detalle de feoplasto, 22: parafisas, 23: aspecto general. 69 Kuckuckia spinosa (Kützing) Kornmann Lam 4-1-fig. 1 En la zona esta especie corresponde a ejemplares epífitos pequeños, muy ramificados, de alrededor de 30 µm de diámetro en las ramas de los últimos órdenes y de entre 30-80 µm en las principales, con largo de las células de 1 a 1,5 el ancho en todo el talo. Con meristemas poco definidos en la base de los pelos afinados. Los feoplastos son alargados y finos, con pirenoides. Las células muestran un conjunto central conspícuo de cuerpos fisodes. Los esporocistos pluriloculares son relativamente pequeños y se ubican lateralmente sobre un pedicelo corto. Referencias Hamel (1939); Womersley (1987); Guiry & Guiry (2012). No ha sido citada anteriormente para la zona. Familia Pylaiellaceae Se caracteriza por los órganos de reproducción intercalares. Pylaiella Bory Talo epífito o epilítico, filamentoso, heterotrico, simple hasta profusamente ramificado, en forma opuesta o alterna. Crecimiento intercalar, usualmente difuso, sin pelos verdaderos, con pseudopelos. Ocasionalmente se observa una célula vegetativa dividida longitudinalmente. Varios feoplastos discoides con un pirenoide por célula. Esporocistos uniloculares y pluriloculares intercalares, formados por transformación directa de células fotosintética del filamento erecto, catenados, en series, abiertos lateralmente; los uniloculares en forma de barril o subesféricos, los pluriloculares son cilíndricos, ambos tipos pueden encontrarse sobre el mismo individuo. Pylaiella littoralis (L.) Kjellman Lam 4-1-figs. 5-11: Talos de hasta 10 cm de longitud, generalmente en mechones de 1-2 cm de alto, a veces en grandes masas, laxos, delicados, de color pardo oscuro a verde amarillento, caracterizadas por ramas opuestas, o unilaterales no en series. Células de la parte basal entre 20 y 40 µm de ancho. Crecimiento intercalar. Se observan cadenas de hasta 30 esporocistos uniloculares de entre 10 y 45 µm de ancho y 45 µm de largo. Los órganos pluriloculares son menos frecuentes, generalmente intercalares; ambos tipos de esporocistos en igual o diferente individuo. Referencias: Skottsberg (1921) (como Bachelotia antillarum); Asensi (1966 a); Boraso & Zaixso (2007); Asensi & Küpper (2012). Familia Chordariaceae Talos haplósticos desde filamentosos a pseudoparenquimatosos, diminutos, laminares, macizos o huecos. Ciclo de vida con alternancia heteromórfica de generaciones, o con ciclos asexuales directos. Los esporofitos pseudoparenquimatosos muestran crecimiento apical e intercalar y pueden ser uniaxiales o multiaxiales. Las células pueden llevar desde uno hasta numerosos feoplastos, en forma de placa, de banda, lobados o discoides, normalmente con pirenoides. Los esporofitos llevan esporocistos uniloculares o pluriloculares. Los gametofitos dioicos filamentosos llevan gametocistos uniloculares solitarios los que producen gametas isógamas y también esporocistos pluriloculares, uniseriados o multiseriados. Esta familia abarca muchos géneros relacionadas filogenéticamente entre sí pero muy diferentes en su morfología, los cuales estaban anteriormente agrupados en familias que no son reconocidas en los sistemas taxonómicos actualmente en uso. Esto trae algunas dificultades desde el punto de vista didáctico, por lo que hemos organizado a los géneros de Chordariaceae por la complejidad y tipo de talo, haciendo referencia cuando lo consideramos útil a las antiguas familias en las que estaban agrupados hasta hace algunos años. 70 Chordariaceae de talos elachistoides. Elachista Duby Talos epífitos diminutos en mechón o pulvinados, con filamentos incoloros que pueden penetrar al huésped, filamentos ramificados solamente en la región medular. Los talos devienen pulvinados por el desarrollo de filamentos surgidos de la actividad de un meristema basal intercalar originado del disco basal inicial. Las parafisas o asimiladores cortos mezclados con filamentos asimiladores largos. Los esporocistos uniloculares claviformes y los pluriloculares piriformes, cilíndricos, filiformes o intercalares surgen generalmente en la base de los filamentos asimiladores, formando una banda concéntrica. Elachista meridionalis Skottsberg. Talos cespitosos, epítos sobre rodofíceas, hasta de 5 mm de alto, con estrato basal bien desarrollado de células hialinas redondeadas. Filamentos asimiladores de hasta 30 µm de diámetro, levemente atenuados hacia la base y constrictos en los septos. Feoplastos numerosos. Parafisas multicelulares, con células basales cilíndricas, angostas, hialinas y células apicales elipsoides hasta esféricas, con pocos feoplastos. Esporocistos uniliculares claviformes, sésiles de 60 - 150 µm de largo por 30-60 µm de diámetro. Referencias: Skottsberg (1907). Elachista antarctica Skottsberg es un alga antártica epífita sobre Palmaria decipiens. Referencias: Skottsberg (1953); Ricker (1987); Wiencke & Clayton (2002). Gononema Kuckuck & Skottsberg Posee una parte basal semejante a la del género Elachista, aunque menos desarrollada, con filamentos erectos ectocarpoideos, algo ramificados abajo, simples arriba. Esporocistos unicelulares en la base de los filamentos erectos, los gametocistos, muy numerosos, se ubican a lo largo de los filamentos erectos, desde solitarios hasta en series. Presenta pelos laterales y basales, pero no terminales. Crecimiento basal e intercalar. Gononema ramosum (Skottsberg) Kuckuck & Skottsberg Lam 4-1-figs. 14- 15 Frondes formando céspedes cortos de consistencia gelatinosa, de hasta 2 mm de alto, con un estrato celular basal de células cilíndricas hialinas, de 12-15 µm de diámetro y filamentos erectos de 9-12 µm de diámetro, no constrictos en los septos, algo ramificadas abajo. Feoplastos discoides numerosos. Esporocistos pluriloculares de 45 a 180 µm de largo y 12-13 µm de ancho, terminales o laterales, con una o pocas series de lóculos. Esporocistos uniloculares obovados a piriformes, ubicados sobre la porción basal, sésiles o sobre una célula pequeña de hasta 54 µm de largo por 20-27 µm de ancho. Referencias: Skottsberg (1907) (como Elachista ramosa); Boraso & Zaixso (2007); Asensi & Küpper (2012). Gononema pectinatum (Skottsberg) Kuckuck & Skottsb. Estrato horizontal de filamentos pseudoparenquimatosos incoloros. Filamentos verticales cespitosos densos, libres, de hasta 5 mm de longitud y 12 µm de diámetro. Células de la porción basal con el doble de largo que de ancho, células de la región apical con igual largo que ancho. El filamento es simple en la porción basal y lleva más arriba muchas ramitas cortas unilaterales, saliendo en ángulo recto. Algunas de las ramas devinien en esporocistos pluriloculares con pocas series de lóculos, desde lineares hasta ligeramente ovales, sésiles, de 21-54 µm de largo por 9-12 µm de ancho. Referencias: Skottsberg (1907) (como Ectocarpus pectinatus). 71 Lam 4-3: figs. 1-3: Myrionema, (especie no identificada) .1: porción postrada y filamentos erectos, 2: esporocisto plurilocular maduro, detalle de feoplastos en placa; figs. 4-6: Utriculidium durvillaei: 4: corte transversal del talo fértil, 5--6: empalizada de esporocistos pluriloculares; fig. 7: Petroderma maculiforme en corte. figs.8- 9:Ralfsia australis, 8: aspecto general, 9: esquema de esporocistos uniloculares y filamentos pigmentados de la corteza; fig. 10: Adenocystis utricularis; figs. 11- 12: Myriactula rosarioides, 11: mechón con parte de zona basal y esporocistos, 12: empalizada con parafisas; figs. 13 16: Corycus lanceolatus: 13-15: talos en diferentes estadios de desarrollo, 16: detalle de feoplasto; figs. 17-18: Myriogloea major: 17: aspecto general, 18: corteza con esporocistos uniloculares y filamentos fotosintetizadores. 72 Myriactula O. Kuntze Talos de perqueño tamaño, filamentos ramificados, pulvinados, epífitos hasta parcialmente endófitos. Carece de las paráfisis típicas de Elachista. Esporocistos uniloculares y pluriloculares en la base de los filamentos asimiladores. Myriactula pusilla (Skottsberg) Skottsberg Talos formando cojines hemisféricos diminutos, de hasta 0,7 mm de diámetro, células interiores basales pequeñas, subhialinas. En la corteza se encuentran filamentos asimiladores jóvenes y cortos mezclados con otros más largos de hasta 600 µm de alto y 15-21 µm de ancho, los que se atenúan más o menos rápidamente hacia la base, donde se observan meristemas basales de células cortas y constricciones en los tabiques. Células maduras de la zona ápical de largo igual al ancho. Feoplastos discoides, numerosos. Pelos numerosos, de 15 - 20 µm de diámetro. Gametocistos plurioculares uniseriados en racimos sobre la porción basal del talo. Esporocistos uniloculares de 75-114 µm de largo por 21- 42 µm de ancho Referencias: Skottsberg (1921, 1953). Myriactula rosarioides (Skottsberg) Skottsberg. Lam 4-3-figs. 11- 12: Talos en céspedes densos, poco gelatinosos, con la parte basal endófita, de células basales grandes, hialinas, con filamentos erectos asimiladores, moniliformes, de dos tipos, los más cortos de 350- 500 µm de largo y 10-12 µm de ancho, con células basales alargadas de solo 5-7 µm de ancho y muy largas, los más largos de hasta 1600 µm de largo y 16 µm de ancho. Pelos basales de 12- 18 µm de ancho. Esporocistos basales, en forma de clava, 90- 130 por 36-42 µm. Los gametocistos son raros, uniseriados, de 30-60 µm de largo por 6-7 µm de ancho. En algunos especímenes se observaron solo filamentos de 400 µm de largo y 15 µm de ancho, más angostos en la base, de 6-8 µm de ancho, con estructuras pluriloculares uniseriadas, fasciculadas, naciendo sobre la superficie de los estratos basales, de 45- 50 µm de largo por 7-9 µm de ancho. Epífitos sobre la porción postrada de Caepidium. Referencias: Skottsberg (1921, 1953). Chordariaceae de talos ectocarpoides Streblonema Derbès et Solier Talos total o parcialmente endófitos; los filamentos vegetativos, irregularmente ramificados, crecen entre las células del huésped y las ramas fértiles se extienden sobre la superficie del mismo. El crecimiento es intercalar, observándose filamentos con meristema basal y pelos incoloros simples. Cada célula lleva uno a varios feoplastos, sin pirenoide. Los esporocistos pluriloculares son en su mayoría uniseriados, los esporocistos uniloculares son infrecuentes. Streblonema cokeriHowe Lam 4-2-fig. 2-3 Los talos poseen una porción postrada y una erecta formada por un conjunto denso de filamentos erectos hasta 25 µm de grosor y 800 µm de alto. Células desde tan largas como anchas hasta el doble de largas que de anchas. Las células apicales llevan 1-2 feoplastos parietales y en las regiones centrales hasta 6-7 feoplastos irregulares. Esporocistos pluriloculares desde uni hasta pluriseriados, a veces desarrollados dentro de las paredes de otros ya vacíos. Referencias: Howe (1914); Boraso & Zaixso (2007). Streblonema patagonicum Skottsberg Filamentos endófitos en el huésped irregularmente ramificados, células entre 9 y 12 µm, hasta el doble de largas que anchas, a veces divididas longitudinalmente. Filamentos erectos cortos, de unos 300-400 µm. 73 Esporocistos pluriloculares terminales o laterales sobre un pedicelo unicelular, de 40-125 µm de largo por 18-32 µm de ancho. Los esporocistos suelen conservar parte de la pared original, y Skottssberg (1921) ilustra esporocistos nuevos desarrollándose dentro de las paredes de otros ya vacíos. Los feoplastos son varias placas parietales discoides. Referencias: Skottsberg (1921). Botrytella Bory Talos ectocarpoideos heterotricos, los ejes erectos filamentosos, con pelos verdaderos incoloros y repetida ramificación simpodial. La primera célula debajo del pelo terminal da un lateral que asume el crecimiento, el pelo terminal queda en posición lateral; en el nuevo ápice se forma un nuevo pelo terminal y el proceso se repite. Las células en forma de barril poseen feoplastos discoides o en cuerpo de violín, con 1-2 pirenoides o sin pirenoides. Esporocistos pluriloculares en grupos densos ubicados lateralmente sobre las ramas, formados por transformación de verticilos de ramas cortas ubicados en las zonas apicales de los laterales largos. Referencias Guiry & Guiry (2012). Botrytella parva (Takamatsu) H. S. Kim Lam 4-2-figs. 10- 12 Talos de alrededor de 1 cm de alto, muy ramificados, con ramas de los primeros órdenes irregularmente dispuestas. Ramas de los últimos órdenes marcadamente unilaterales y algo recurvadas hacia fuera, con el ápice afinándose gradualmente. Células con forma de barril, de 30- 90 µm de longitud y 40-75 µm de ancho y relación largo ancho 0,6 a 1,3. Pelos terminales frecuentes, frágiles, con bases persistentes en los ápices de la fronde adulta. Feoplastos numerosos, en forma de cuerpo de violín, con uno, ocasionalmente dos pirenoides. Esporocistos pluriloculares sobre cortas ramas terminales, con disposición unilateral, que alcanzan unos 50 µm de largo y hasta 20-25 µm de ancho, al principio son ovoides o cónicos pero luego devienen irregulares y se disponen formando grupos masivos. El desarrollo de los zooides es directo. Epífito sobre Chaetomorpha. Referencias: Asensi (1973a) (como Sorocarpus okamurae Takamatsu var. piliferus Asensi). Leptonematella Silva Talos con una porción postrada de filamentos uniseriados, ramificados, de aspecto rizoidal, formando un solo estrato y filamentos erectos en mechones que salen preferentemente del centro de la región postrada. Estos últimos son simples al principio, pero pueden llegar a formar alguna rama simple y corta, insertada en forma divaricada cerca de los ápices; los filamentos muestran un estrechamiento en la base y el ápice afinado, sin pelos verdaderos. La región meristemática no es muy marcada, se encuentra en la base de los filamentos. El número de feoplastos es de 3-4 por célula, en forma de placa parietal y con un pirenoide pequeño y no muy conspícuo. Los esporocistos pluriloculares se forman por transformación de células vegetativas de los filamentos erectos, con frecuentes tabiques longitudinales oblicuos, los esporocistos se observan como largas cadenas algo engrosadas respecto a las células vegetativas. Referencias: Skottsberg (1907) (como Leptonema). Leptonematella falklandica (Skottsberg) Wynne Talos penicilados, cespitosos, de hasta 2 mm de alto, de filamentos erectos de hasta 12-15 µm de diámetro, atenuados hacia la base, con varios feoplastos Esporocistos pluriloculares cilídricos, de hasta 18 µm de diámetro, con escasas células vegetativas entremezcladas, ubicados en largas cadenas en las regiones terminales. Esporocistos uniloculares obovados, sésiles o brevemente pedunculados, 74 ubicados hacia la base de los filamentos, de unos 40 µm de largo y 18 µm de diámetro. Referencias: Skottsberg (1907); Wiencke & Clayton (2002). Leptonematella fasciculata (Reinke) Silva Talos heterotricos con una parte basal postrada discoide formada por filamentos irregulares, sinuosos, ramificados, y filamentos erectos en mechones de unos pocos milímetros de alto y hasta 8 µm de grosor. Los filamentos erectos son simples o con unas pocas ramificaciones cortas de primer orden, insertas en ángulos abiertos, los ejes erectos son algo más angostos en su inserción basal y se aguzan apicalmente en un pseudopelo. La región meristemática de los filamentos erectos es proximal, no muy localizada. Las células muestran 3-4 feoplastos parietales con un pirenoide pequeño. Los esporocistos pluriloculares se forman por una división de las células vegetativas por un tabique longitudinal u oblicuo. Los esporocistos pluriloculares forman largas cadenas algo más gruesas que el resto del filamento, con contenido celular más denso y con las dehiscencias laterales conspicuas. Los zooides tienen unos 5 µm de diámetro y un feoplasto con estigma. Epífita sobre Microzonia velutina, Leathesia difformis, y Adenocystis utricularis. Referencias: Asensi (1976a); Asensi & Küpper (2012). Chordariaceae de talos mirionematoides. Mikrosyphar Kuckuck Talos diminutos, endófitos o epífitos, formados íntegramente por filamentos irregulares, reptantes, a veces constituyendo un disco pseudoparenquimatoso. Células vegetativas de 1 a 3 veces tan largas como anchas, con 1 a 3 feoplastos parietales en forma de placa. Pelos no siempre presentes. Esporocistos uniloculares esféricos, apicales en ramas de 2-3 células. Esporocistos pluriloculares uniseriados, cilíndricos, truncados, laterales, sésiles, con solo 2 a 4 células, a veces la primera célula es una intercalar en el filamento que lo lleva. Referencias: Waern (1952); Lindauer et al. (1961). Mikrosyphar aff. M. porphyrae Kuckuck Filamentos endófitos en Porphyra, entremezclados con las células del huésped, con pelos, produciendo órganos uniloculares terminales, esféricos. Referencias: Asensi (1966) (como Microsyphar sp). Mikrosyphar aff. M polysiphoniae Kuckuck Lam 4-4-fig. 5 Talos microscópicos, formando pequeños discos pseudo-parenquimatosos, irregulares, de hasta 1 mm de diámetro. Células poligonales frecuentemente cuadrangulares en el centro del talo, en la periferia las paredes externas son curvas. Células de 3 a 10 µm de diámetro, con un feoplasto grande, parietal, con un pirenoide. En el borde del disco se desarrollan filamentos rastreros, cortos. En la zona pseudoparenquimatosa y también en los filamentos cortos se observan células diferenciadas en esporocistos uniloculares, con pocos zooides (2-4), con una mancha ocular pequeña Epífito sobre Griffithsia antarctica y Codium fragile. Referencias: Waern (1952). Laminariocolax Kylin, Laminariocolax aecidioides (Rosenvinge) A. F. Peters Se presenta como manchas oscuras sobre Undaria pinnatifida cerca de los ductos de mucílago principalmente sobre el talo y en la zona cortical, donde comprimen a las células de Undaria lateralmente, el sistema postrado llega hasta la médula pero no entra en las células. Los filamentos tienen 5–15 μm en diámetro y las células muestran hasta 10–40 μm de largo con uno a varios feoplastos discoides o en banda. 75 Las perforaciones del talo de Undaria son ocupadas por las estructuras reproductivas del epi-endobionte.Los esporocistos pluriloculares son solitarias, ovoides y uniseriados, de 15–20 μm de diámetro, los esporocistos uniloculares, también solitarios y ovoides, alcanzan los 7–12 μm de diámetro y 20–40 μm de largo, con dehiscencia apical, lateral o basal. Referencias: Gauna et al. (2008) Es interesante remarcar la cita de Laminariocolax macrocystis (Peters) Peters (como Streblonema macrocystis Peters), endófita en Macrocystis pyrifera, para Chile Central (Peters, 1991) También se ha citado al género Laminarionema Kaway & Tokuyama con la especie L. elsbetiae Kaway & Tokuyama viviendo sobre Rhodymenia Referencias: Gauna et al. (2009.) Myrionema Greville Discos epífitos pequeños, monostromáticos, de borde regular o irregular, creciendo desde el centro por filamentos ramificados pseudodicotómicamente, adherentes entre sí, sin rizoides. En el centro del disco desarrolla filamentos erectos de altura uniforme, sin parafisas ni pelos feofíceos. Esporocistos uniloculares sobre la parte basal o laterales sobre los filamentos erectos. Esporocistos pluriloculares cilíndricos, usualmente total o parcialmente uniseriados y erectos sobre la porción basal, o, menos frecuentemente, laterales sobre los filamentos erectos. Crecimiento preponderamente apical. Células con uno a tres feoplastos parietales, laminares. Myrionema densum Skottsberg (Lam 4-3-figs.1-3). Máculas de 0,5 a 1 mm de diámetro, oscuras, orbiculares, discos basales monostromáticos, células de 6- 9 µm de largo por 2-4 µm de ancho con filamentos asimiladores erectos de 4-6 µm de diámetro. Esporocistos pluriloculares angostos, uniseriados o con pocas series de lóculos, cilíndricos a ovales de hasta 30- 60 µm de largo por 2-6 µm de ancho, sésiles o sobre una o dos células basales. Esporocistos uniloculares claviformes sésiles, o pedicelados, de hasta 36 µm de largo por 12 µm de ancho. Células con un feoplasto parietal. Referencias: Skottsberg (1907). Myrionema fuegianum Skottsberg Disco basal formado por células de alrededor de 6 µm de diámetro, Un feoplasto por célula, filamentos erectos numerosos de 9 µm de diámetro. Pelos de 6-7 µm de diámetro. Gametocistos numerosos con un estipe corto, 30-75 µm por 7-10 µm, normalmente biseriados. Referencias: Skottsberg (1921). Myrionema incommodum Skottsberg Disco basal orbicular monostromático de hasta 1 mm de diámetro. Filamentos diminutos anclados en el huésped por células alargadas. Filamentos erectos cortos, simples o irregularmente ramificados, de entre 7 y 9 µm de ancho, con longitud celular 2-3 veces el ancho celular. Feoplasto laminar, uno por célula. Esporocistos pluriloculares uniseriados de 4- 11 µm de ancho por 18-35-48 de largo, con pedicelo unicelular, a veces laterales. Esporocistos uniloculares claviformes, sésiles, de 7 µm de largo, laterales sobre los filamentos. Epífito en Adenocystis utricularis. Referencias: Ricker (1987); Wiencke & Clayton (2002). 76 Myrionema macrocarpum Skottsberg Máculas monostromáticas, de 1-2 mm de diámetro, oscuras, orbiculares y confluentes, células de 7-12 µm de ancho por 15- 20 µm de largo; con filamentos asimiladores erectos de 12 µm en el ápice, con varios feoplastos y pelos con células cortas en la base, terminados en células hialinas. Esporocistos pluriloculares multiseriados, cilíndricos a ovales de hasta 75 µm o más de largo por 15-24 µm de ancho, sésiles o sobre una o dos células basales. Esporocistos uniloculares obovados de ápices redondeados de 25- 45 µm de largo por 8- 20 µm de ancho. Epífito sobre Macrocystis pyrifera y Lessonia. Referencias: Skottsberg (1907). Myrionema patagonicum Skottsberg Disco basal de células de 15-20 µm por 6-9 µm, con 1-3 feoplastos. Sin filamentos erectos, con numerosos pelos, de 8-9 µm de diámetro, algo más angostos en la base. Gametocistos numerosos, uniseriados, de 30-60 µm de longitud y 8-9 µm de diámetro, sésiles, o con un pedicelo corto. Referencias: Skottsberg (1921). Myrionema strangulans Carmichael ex Greville Talo epífito sobre Ulvaceae, con una porción basal pseudo-parenquimatosa discoide formada por filamentos de 5 a 8,5 µm de ancho, con células apicales obtusas y por filamentos erectos no ramificados o con ocasionales bifurcaciones proximales, de hasta 60 µm de largo, formados por 4-7 células que nacen en la región central del disco, de unos 6-8 µm de ancho. Feoplastos discoides, pequeños. Esporocistos uniloculares sobre el disco, usualmente sésiles, esféricos a piriformes, de 30-65 µm de alto por 20-40 µm de ancho. Esporocistos pluriloculares sobre el disco, sésiles o con pedicelo de 1-2 células, uniseriados o biseriados, de 7-11 µm de ancho y 15 a 50 µm de largo. Referencias: Lindauer et al. (1961); Asensi & Küpper (2012). También se citaron para la zona a Myrionema paradoxum Reinsch y para las islas Georgias del Sur a Myrionema inconspicuum Reinsch. (Reinsch, 1890). Chordariaceae de talos macroscópicos Leathesia Gray Talo globoso y carnoso, gelatinoso, macizo o hueco cuando adulto, formado por filamentos ramificados, anticlinales, con la parte proximal formada por células globosas incoloras, y la distal organizada en forma de empalizada de filamentos de 3-6 células pequeñas pigmentadas componiendo la corteza. Parafisas de pocas células pigmentadas, usualmente con células terminales engrosadas. Fascículos de pelos feofíceos incoloros proyectándose de la superficie. Esporocistos uniloculares piriformes y pluriloculares filiformes, uniseriados, rectos, ubicados en la base de los filamentos corticales. Gametofitos microscópicos, filamentosos, con gametocistos pluriloculares. Leathesia difformis(L.) Areschoug Lam 4-2-figs. 13-14; Lam 4-4-fig. 15 Talos desde semi - esféricos cuando jóvenes hasta expandidos en la senescencia, intermareales y submareales, de hasta unos 12 cm de diámetro. Células medulares grandes, anastomosadas, laxamente entremezcladas. Esporocistos uniloculares terminales sobre los filamentos corticales. Con esporocistos pluriloculares en el talo erecto. Ciclo de vida heteromórfico. Referencias: Quartino & Boraso de Zaixso (1996); Boraso & Zaixso (2007); Asensi & Küpper (2012). 77 Lam 4-4: fig. 1: Punctaria sp. ; fig. 2: Punctaria plantaginea; figs. 3-4: Punctaria latifolia. Aspecto general y detalle de células con feoplastos discoides.; fig. 5: Mikrosyphar aff. M. polysiphoniae ; figs. 6-7: Asperococcus ensiformis: 6: aspecto general, .7: soros con pelos.; Figs. 8-10 y 12-13: Scytosiphon lomentaria: 8: vista superficial de soros de esporocistos con parafisas, 9: corte en empalizada con esporocistos pluriloculares maduros, 10:corte mostrando corteza y médula, 12-13: aspectos generales: fig. 11: Petalonia fascia; fig. 14: Colpomenia sinuosa; fig. 15: Leathesia: difformis. 78 Myriogloea Kuckuck Talo erecto simple o un poco ramificado en la base, multiaxial con numerosos filamentos medulares monopodiales. Entre la médula y los filamentos de la corteza hay una masa de filamentos repetidamente ramificados en dirección radial. La superficie del talo está completamente tapizada de filamentos asimiladores, no incluídos en mucílago y no ramificados por sobre la región meristemática. Las células apicales de los filamentos asimiladores son 1-2 veces tan largas como anchas y fuertemente pigmentadas. Sin pelos feofíceos. Esporocistos uniloculares, sésiles o pedunculados, en la base de los filamentos asimiladores; esporocistos pluriloculares, cuando presentes, formados apicalmente sobre los filamentos asimiladores. Myriogloea major Asensi Lam 4-3- figs. 17-18 Talos cilíndricos, macizos, muy gelatinosas, entre 20 cm hasta más de un metro de longitud, con diámetro entre 0,5 y 1,0 cm. Frondes simples o con algunas ramificaciones laterales irregulares, rara vez hasta de segundo orden. Fijación por un disco pequeño. Superficie cubierta de filamentos asimiladores libres de mucílago de hasta casi 2 mm de largo, rectos, flexibles. Filamentos asimiladores muy pigmentados, con varios feoplastos con pirenoides. Los filamentos asimiladores tienen una región meristemática basal. Células más cortas y en forma de barril en las porciones más jóvenes y más alargadas en las más maduras, de hasta unos 18-20 µm de diámetro.La subcorteza de células hialinas forman filamentos radiales de hasta 30 µm de diámetro muy ramificados formando ramilletes. Médula de filamentos longitudinales monopodiales independientes entre sí, entremezclados con hifas y mucílago que dan al conjunto una consistencia esponjosa pero consistente. Esporocistos uniloculares obovados a claviformes, de 80 a 100 µm de largo por 20-40 µm de ancho, sésiles sobre los filamentos o sobre una pequeña prominencia. Microtalos con esporocistos pluriloculares biseriados. Referencias: Asensi (1973d); Pérez (2002); Pérez & Boraso de Zaixso (2003); Boraso & Zaixso (2007); Asensi & Küpper (2012). Chordaria J. Agardh Talos erectos cilíndricos, ramificados, gelatinosos, con un disco basal pequeño, eje sólido o tubular, médula compacta, pseudoparenquimatosa, firme, células más internas alargadas, mezcladas con hifas secundarias, delgadas, células medulares más externas más cortas y delgadas. Superficie recubierta de filamentos asimilatorios y membrana gelatinosa, saliendo directamente de la zona medular externa, células terminales frecuentemente engrosadas, pelos verdaderos entremezclados ocasionalmente con los asimiladores. Esporocistos uniloculares elipsoides hasta oblongos y esporocistos pluriloculares en el mismo talo. La fase macroscópica da lugar a una microscópica con esporocistos pluriloculares. Chordaria linearis (Hook. & Harv.) Cotton Lam 4-2-figs. 19- 23 Talos solitarios o cespitosos, grandes, ramificados, mucilaginosos, pardo verdosos cuando secos. Ejes principales frágiles, de hasta 20-25 cm de largo, 1-1,5 mm de diámetro, densamente cubiertos de ramas delicadas, similares al eje, con rámulas a su vez. Centro del eje laxamente pseudoparenquimatoso, con células de 15-20 µm de diámetro, mezclados con filamentos laxos de 7-9 µm de diámetro, densamente dispuestos. Filamentos asimiladores de 50-70 µm de largo y 10-12 µm en los ápices, en forma de clava, formados por 5-6 células. Esporocistos uniloculares obovados, de 45-70 por 22-25 µm. Referencias: Asensi (1978); Wiencke & Clayton (2002); Boraso & Zaixso (2007). 79 Chordaria magellanica Kylin. Talos cilíndricos de hasta 10 cm de largo y 1-2 mm de diámetro. Las ramas laterales alternas se insertan en ángulos abiertos alcanzando los 2 mm. Las paredes son gruesas. El talo y partes jóvenes del mismo son al principio macizos y luego huecos. Los filamentos asimiladores, de entre 60 y 120 μm de longitud, consisten de una sola célula en forma de clava, a veces con una pequeña basal. Los esporocistos son obovados de 30 a 90 μm de longitud. Los asimiladores en forma de clava forman una empalizada y cubren a los esporocistos. Referencias: Cotton (1915); Skottsberg (1907, 1921) (como Ch. capensis, Ch. flagelliformis); Papenfuss (1964). Dictyosiphon Greville Talos epífitos o epilíticos, solitarios o cespitosos, cilíndricos, ramificados en foma opuesta o alterna, sólidos cuando jóvenes, huecos en la madurez. Atenuados hacia el ápice, Médula de dos a tres capas de células y corteza pigmentada. Cada célula con varios feoplastos con un pirenoide. Pelos feofíceos presentes. Con esporocistos uniloculares dispersos por el talo algo inmersos entre las células corticales.Referencias: Guiry & Guiry (2012). Dictyosiphon hirsutus (Skottsberg) Pedersen Fronde epífita, de hasta 5 cm de alta y 1 mm de diámetro, con diminuto disco basal, pardo-olivacea. Pilosa, hueca, ramas abundantes, atenuadas hacia la base y el ápice. Pelos largos, de 10-12 µm de diámetro. La estructura anatómica es como en Scytothamnus fasciculatus pero más delicada, con menos estratos celulares. Esporocistos inmersos en la corteza, de 35-45 µm de diámetro. Epífito sobre Adenocystis y Cladochroa. Referencias: Skottsberg (1921); Peters (1992). Eudesme J. Agardh Talos erectos ramificados una o dos veces, gelatinosos, con disco adhesivo rizoidal, a veces con rámulas distales. Médula multiaxial laxa de células grandes incoloras y corteza de filamentos finos de 15 a 20 células, cada célula con varios feoplastos con pirenoide. Con pelos feofíceos. Esporocistos uniloculares desde la parte basal de los filamentos corticales, irregulares, sésiles. Referencias: Guiry & Guiry (2013). Eudesme virescens (Carmichael ex Berkeley) J. Agardh. Referencias: Asensi & Küpper (2012). Corycus Kjellman Corycus lanceolatus (Kützing) Skottsberg Talos erectos gregarios, huecos, que no contienen agua, en forma de raqueta alargada, o de tubo aplastado, con un pedúnculo sólido en la base, desarrollándose sobre un estolón postrado o una fronde vieja o directamente sobre las rocas, adheridos en todos los casos por rizoides. En sección transversal el talo muestra dos o tres capas de células, las superficiales son isodiamétricas y pigmentadas, las interiores hialinas e irregulares. Con o sin pelos en criptas. Al principio del desarrollo se produce un pelo apical con crecimiento basal, pero hacia la base el crecimiento deviene polístico, formándose finalmente el hueco interno al apartarse las paredes por crecimiento polístico. La porción estolonífera es sólida, con una corteza pigmentada y una médula incolora. En el estado adulto se adhieren al sustrato por rizoides y alcanzan varios centímetros de largo; las frondes erectas se desarrollan sobre ellos frecuentemente en verticilos. Las células corticales llevan de 10 a 15 feoplastos parietales en forma de violín con un pirenoide. En las células grandes más internas los feoplastos se encuentran menos densamente dispuestos pero en igual número. 80 Lam 4-5: figs. 1-2: fig. 1: Scytothamnus fasciculatus: .1: aspecto general, 2: aspecto superficial del talo con pelos y parafisas; figs. 3-6: Asteronema ferruginea: 3: esporocisto plurilocular, 4: esporocisto unilocular, . 5: feoplastos, 6: aspecto general; figs. 7-9: Aglaozonia: 7-8: borde distal, 9: células en centro, figs. 10-11: Cutleria multifida: borde distal con crecimiento tricotálico y detalle del mismo; figs. 12- 14: Microzonia velutina: 12: aspecto general, 13: borde distal, 14; células en centro de talo. 81 En la naturaleza se encuentran esporocistos pluriloculares y uniloculares, en el mismo talo o en talos separados. Los pluriloculares se forman por transformación de las células superficiales, primero en zonas discretas, luego cubriendo todo el talo. Los esporocistos uniloculares ovoides se forman a partir de células corticales, no sobresalen de la superficie del talo y tienen dehiscencia apical. Epífitos sobre Corallina, Ahnfeltia, Codium, Cladostephus y Ulva, sobre valvas de moluscos y saxícolas. Referencias: Skottsberg (1907, 1921); Asensi, (1975a); Boraso & Zaixso (2007); Asensi & Küpper (2012). Cladothele Hooker & Harvey Talos gregarios, simples, filiformes, adheridos por rizoides, o ramificados, desde uniseriados hasta parenquimatosos, sólidos, con tejido central de células alargadas o redondeadas, con una corteza de células pequeñas con un estrato superficial de células asimilatorias. Los esporocistos uniloculares están parcialmente sumergidos en la corteza diseminados o en grupos, con o sin parafisis; los gametocistos pluriloculares intercalares en células superficiales, generalmente en grupos dispersos. Este género se caracteriza por la presencia de papilas, que en una primera observación pueden confundirse con esporocistos uniloculares, pero que nunca presentan esporas en su interior. Estas papilas son capaces de cumplir función de propágulos vegetativos. Los esporocistos pluriloculares son superficiales. En la fase postrada se observaron estructuras laterales multinucleadas, con apariencia de esporocistos uniloculares pero de función incierta. Referencias: Asensi (1971b, 1976b); Ricker (1986). Cladothele decaisnei Hooker & Harvey Lam 4-2-figs. 4-9: Eje principal cilíndrico, aguzado en el ápice, con un pequeño disco basal, que puede llevar varios ejes erectos. Cada eje con ramas cilíndricas insertas casi perpendicularmente sobre el mismo, hasta el cuarto orden o más, todas con ápices aguzados. En los ápices de los talos jóvenes se forma un pelo endógeno hialino, prematuramente caduco. El crecimiento procede de una zona meristemática subapical. La estructura polística se adquiere ya en la fase microscópica. El talo está formado por una zona cortical de células pequeñas, con varios feoplastos y una medular de células más grandes, menos pigmentadas. Con el tiempo las células superficiales pierden su coalescencia formando las papilas que caracterizan al género. Los esporocistos pluriloculares se desarrollan entre las mismas. Las esporas que provienen de los esporocistos pluriloculares tienen una feoplasto parietal, un pirenoide y un estigma visible. Al germinar dan un filamento que puede desarrollarse en un protonema vegetativo y permanecer como tal, o pueden dar esporocistos pluriloculares ectocarpoides, en cadenas, constreñidos a trechos, o dar nacimiento a talos erectos haplósticos al principio, luego polísticos, que a su vez producen esporocistos pluriloculares cónicos; en las condiciones más favorables coexisten los esporocistos sobre la parte basal con los talos erectos fértiles. Referencias: Skottsberg (1907, 1921); Asensi (1971b, 1976b) Boraso & Zaixso (2007); Asensi & Küpper (2012). Cladothele striarioides (Skottsberg) Zinova Talos epilíticos, intermareales, de 5(-6) cm de alto, casi negros cuando secos, filiformes, adheridos por rizoides, con un eje principal irregular y escasamente ramificado en forma opuesta, alternada o fasciculada. Las ramas cilíndricas son sólidas y flexuosas, de largo irregular, terminadas en un pelo largo. Las porciones más jóvenes son uniseriadas. Ejes y ramas consistentes en una región central de células grandes alargadas con un estrato periférico de células asimiladoras con forma de papila. Esporocistos uniloculares, 82 globosos, solitarios. Referencias: Skottsberg (1921); Asensi (1971b); Ricker (1986); Boraso & Zaixso (2007). Cladochroa Skottsberg Talos adheridos laxamente al sustrato por un disco basal, filiformes, blandos, tubulosos, desde irregularmente hasta subdicotómicamente ramificados con ramas cortas o largas. Las ramas más finas con criptostomas apicales. Estructura pseudoparenquimatosa con dos a tres estratos internos de células alargadas longitudinalmente y dos estratos externos de células subcúbicas. Esporocistos uniloculares ovoides. Filamentos asimiladores en forma de clava. Criptostomas esparcidos por el talo con numerosos pelos muy largos. Referencias: Skottsberg (1921). Cladochroa chnoosporiformis Skottsberg Talos ramificados de hasta 25 cm de largo y solo 2 mm de diámetro, fláccidos, de color marrón oscuro. Esporocistos uniloculares de 30 µm de largo por 12 µm de ancho, filamentos asimiladores de 50 por 12 µm . Pelos de 6-9 µm de diámetro. Órganos reproductivos uniloculares asociados con parafisas en forma de clava. Referencias: Skottsberg (1921). Chordariaceae anteriormente en familia Punctariaceae. Punctaria Greville Esporofitos anuales, con una o más láminas desde lineales hasta elípticas, con un estipe que se afina hacia la base, creciendo desde un disco basal. Generalmente con pelos superficiales multicelulares solitarios o en mechones. Láminas compuestas de células cúbicas, de entre 3 y 7 estratos celulares de grosor, las interiores apenas algo más grandes que las superficiales. Feoplastos discoides con pirenoide, desde pocos hasta numerosos por célula. Esporocistos uniloculares subcúbicos, dispersos, solitarios, parcialmente emergentes en el talo, formados en células superficiales. Esporocistos pluriloculares multiseriados, agrupados usualmente en soros pequeños y sin parafisas, frecuentemente con ápice proyectándose. Gametofitos filamentosos, microscópicos, ramificados; gametas isógamas. Punctaria plantaginea (Roth) Greville Lam 4-4-fig. 2: Talos laminares, gregarios, afinándose hacia la base, de hasta unos 12 cm de largo y hasta 3 cm de ancho, pardo claro hasta oscuro. Lámina formada por 5-8 estratos de células, las internas más hialinas y grandes que las ubicadas en los 1-2 estratos externos, las que son pigmentadas y llevan varios feoplastos discoides por célula. Con pelos abundantes sobre el talo, con esporocistos uniloculares algo inmersos. Referencias: Boraso & Zaixso (2007); Asensi & Küpper (2012). Punctaria latifolia Greville Lam 4-4-figs. 3-4 Talos laminares orbiculares con corto pedicelo cilíndrico, de unos 10 cm de diámetro, borde algo rizado, color pardo claro a mediano. Láminas usualmente con 1-4 estratos celulares, aún en ejemplares grandes. Pueden alcanzar hasta 6 estratos en el centro del talo cuando maduros, conservando dos estratos en los bordes del talo. Sin diferencia marcada en el tamaño celular, entre los estratos celulares centrales y los superficiales. Células con varios feoplastos discoides Con esporocistos pluriloculares y uniloculares, estos últimos sobresaliendo apenas del talo. Hábitat: submareal. Referencias: Boraso & Zaixso (2007); Gauna. & Parodi (2010); Asensi & Küpper (2012). Ocasionalmente se encuentran talos muy angostos asignables al género (Lam 4-4fig. 1) las que podrían pertenecer a otra especie que las mencionadas o ser una forma de P.plantaginea. 83 Asperococcus Lamouroux Talos membranáceos huecos, cilíndricos a hinflados. Células con varios feoplastos con pirenoide. Esporocistos con pelos y parafisas. Referencias: Guiry & Guiry (2013). Asperococcus ensiformis (Delle Chiaje)Wynne Lam 4-4-figs. 6-7 Talos erectos, huecos, complanados, ocasionalmente constreñidos, de hasta 40 cm de alto y 6 cm de ancho, pardo amarillentos los más jóvenes, más oscuros los maduros. En sección vertical se observa una zona cortical de células pequeñas (15-20 µm de diámetro) y pigmentadas; las células internas son más hialinas y con restos de hifas medulares en el hueco central. En cada célula superficial se encuentran alrededor de ocho feoplastos discoides o en forma de violín, con pirenoides conspicuos. Esporocistos uniloculares, sésiles, ovoides o esféricos, en soros, sobre ambas superficies del talo, asociados a pelos y parafisis. Las parafisis compuestas por unas pocas células, la apical redondeada, los pelos feofíceos son hialinos. En cultivo los zooides provenientes de los esporocistos uniloculares dan protonemas de los cuales se elevan talos erectos en un ciclo directo que se repite. Referencias: Asensi (1972); Boraso & Zaixso (2007) (como Haloglossum compressum); Asensi & Küpper (2012) (como Asperococcus compressus (Griff.) Hooke. Caepidium J. Agardh Talo epilítico, pequeño pero visible a simple vista, pardo amarillento, consistente en una porción postrada, conspicua, foliosa, aplanada, dividida, lobada, con los lóbulos imbricados y una porción erecta cilíndrica, delgada. El talo erecto emerge de un disco de bordes levantados semejante a un apotecio, ubicado en los bordes del talo postrado. Los órganos reproductivos pluriloculares se desarrollan sobre estructuras en forma de vejiga o verruga sobre la porción postrada. Caepidium antarcticum J. Agardh Lam 4-2-figs. 15-17 Talo epilítico, color pardo amarillento, pseudoparenquimatoso. La porción postrada crece por un meristema apical y pueden confluir mostrando costras coraloides con las ramas adheridas. El talo erecto es cilíndrico, delgado, blando, macizo al principio y luego hueco. El mismo emerge de discos de bordes levantados semejando apotecios ubicados en los bordes del talo postrado y está compuesto de un conjunto de filamentos erectos tapizados lateralmente de filamentos asimiladores de unas tres células y unos 75 µm de largo, con una célula apical inflada de 15-18 µm de diámetro y esporocistos uniloculares. Meristemas en la base de los filamentos corticales. Los ejes erectos son simples o presentan una sola división, pequeños al principio, pero se desarrollan en primavera alcanzando hasta 16 cm de largo y 1-1,5 mm de diámetro, estos ejes llevan algunas ramas laterales simples, a veces fasciculadas, que aparecen al principio basipetamente y luego intercalares entre las ya existentes. Los ejes erectos desaparecen en invierno. Los pelos son escasos pero están presentes. Sobre la porción postrada se desarrollan también estructuras en forma de vejiga o verruga, desde macizas hasta huecas, semejantes a pequeñas Colpomenia, sobre la superficie de las mismas se desarrollan empalizadas de órganos reproductivos pluriloculares y células estériles grandes, observándose pelos feofíceos solitarios saliendo de la subcorteza. Esporocistos uniloculares obovados de 30-45 µm de longitud por 15-18 de ancho, con numerosas esporas. Referencias: Nelson (1882); Boraso & Zaixso (2007). 84 Lam 4-6: figs. 1-2: Sporochnus pedunculatus 1: aspecto general, 2: receptáculos; figs. 3-6: Sphacelaria fusca: 3: aspecto general, 4: feoplastos, 5- 6: propágulos; figs. 7-10: Cladostephus spongiosus: 7- 8: aspecto general, 9- 10: esporocistos uniloculares; figs. 11-14: Stypocaulon funiculare: 11: aspecto general, 12: detalle de ramificación, 13: ramas llevando esporocistos y parafisas en axilas de inserciones de rámulas, 14: detalle de fig. 13.; fig. 15: Dictyota dichotoma. 85 Familia Adenocystaceae Los géneros Adenocystis y Utriculidium poseen ambos talos huecos con forma de vejiga con una corteza sólida y rellenos de líquido, con meristema apical tricotálico y criptostomas, pero difieren en los detalles reproductivos, habiéndose determinado que no son partes del mismo ciclo de vida. Ambos muestran dos fases somáticas en el ciclo de vida, un macrotalo haplóstico y un microtalo polístico. Estos dos géneros quedan agrupados en los análisis filogenéticos basados en ADNy segregados de Chordaria, Dictyosiphon, Punctaria o Scytosiphon, por lo que se propuso la familia Adenocystaceae. Adenocystis Hooker et Harvey. Se caracteriza por tener esporocistos uniloculares en soros en el talo macroscópico. Adenocystis utricularis (Bory) Skottsberg Lam 4-3-fig. 10: Esporofito piriforme, macizo al principio,hueco cuando adulto, lleno de agua, de hasta unos 9-10 cm de alto, con una región interna de 3-5 células de grosor, éstas hialinas y engrosadas. Con un corto estipe y un disco adhesivo pequeño. Externamente una corteza de filamentos asimiladores, de una célula de largo en los individuos jóvenes, aumentando luego hasta 8 células de grosor con la edad. La superficie con muchas criptas microscópicas con pelos uniseriados largos. Células con varios feoplastos piriformes con pirenoide. Esporocistos uniloculares en soros, entremezclados con parafisas, en criptas o fuera de ellas. Zooides piriformes, no fototácticos, sin tendencia a agruparse ni fusionarse, que germinan dando un filamento o un disco; a partir del mismo nace el talo erecto, primero como un filamento erecto con un pelo apical y luego como un talo multiseriado con un pelo terminal. Referencias: Skottsberg (1907); Delépine & Asensi (1978); Ricker (1987); Wiencke & Clayton (2002); Ponce et al. (2007); Boraso & Zaixso (2007); Asensi & Küpper (2012). Adenocystis longissima (Skottsberg) Asensi, Delépine, Rousseau, de Reviers Los talos son largos, cilíndricos y con constricciones conspícuas e irregulares, miden de 1 a 3 cm de diámetro arriba y son afinados en la base donde se adhieren al sustrato rocoso por un disco pequeño. La mayoría de los individuos adultos alcanzan entre 20–50 cm de longitud, siendo frecuentes los que alcanzan hasta un metro, especialmente en la Bahía de Ushuaia en verano. La pared del talo está compuesta de varios estratos celulares de una o dos capas externas de células pigmentadas pequeñas y cinco a siete estratos corticales de células más grandes y menos pigmentadas. Las células epidérmicas son cuadrangulares en vista superficial y miden unos 8 um. Llevan usualmente de 1 a 3 plástidos parietales en forma de placa, con un pirenoide piriforme. El interior del tubo está cubierto por un retículo de células filifomes anastomosadas. Sobre toda la superficie se encuentran mechones de pelos feofíceos hialinos de crecimiento basal ubicados en criptostomas diminutos.Los talos jóvenes obtenidos en cultivo muestran cuando aún son macizos, meristemas apicales asociados a un mechón de pelos apical. Los talos fértiles muestran una capa externa desarrollada a partir de las células epidérmicas conformada por parafisas unicelulares claviformes de 50–60 µm de largo mezcladas con esporocistos uniloculares de 30–40 µm de largo y 20 µm de ancho. Referencias: Skottsberg (1921); Asensi et al. (2004); Asensi & Küpper (2012). 86 Utriculidium Skottsberg Con las características de U. durvillaei Utriculidium durvillaei (Bory) Skottsberg, Lam 4-3-figs. 4-6 Talos gregarios, piriformes, huecos, creciendo de un disco basal, crecimiento multialxial, con un mechón de pelos apicales formados por las células terminales de la médula. Esporocistos pluriloculares en un estrato continuo sin parafisas ni pelos entre medio. Varios feoplastos por célula, con pirenoide. Intermareales, sobre roca y Corallinaceae. Referencias: Skottsberg (1907); Delépine & Asensi (1978); Asensi & Küpper (2012). Ricker (1987) señala que este género posee un solo feoplasto por célula, probablemente siguiendo el criterio de algunos autores que lo habían ubicado en las Scytosiphonales, pero Asensi et al. (1977) y Delépine & Asensi (1978) afirman que el género posee varios cromatóforos por célula, criterio al que adherimos. Orden Scytosiphonales Talo erecto, laminar o globular simple. Crecimiento al principio tricotálico, luego difuso o intercalar subapical. Feoplasto parietal, uno por célula con un pirenoide. Pelos frecuentes. Cistos pluriloculares numerosos uniseriados, usualmente en soros bien definidos. Esporocistos uniloculares en algunos géneros en talos costrosos. Familia Scytosiphonaceae Abarca las Scytosiphonales de crecimiento a través de meristas difusos. Scytosiphon C. Agardh Talos erectos usualmente en mechones surgiendo de una base común, Porciones erectas simples, tubulares, a veces sólidas, cilíndricas o aplanadas. Crecimiento intercalar cerca de la base. Células interiores del talo alargadas, de paredes gruesas, estratos corticales con células progresivamente más pequeñas hacia la superficie. Pelos verdaderos usualmente presentes. Ciclo de vida muy dependiente de las condiciones ambientales. Esporocistos uniloculares en estados costrosos semejantes a Ralfsia. Esporocistos pluriloculares ubicados en áreas extensas del talo erecto. Referencias: Asensi (1980). Scytosiphon lomentaria (Lyngb.) J. Ag. Lam 4-4-figs. 8-10 y 12-13: Talos tubulares, color pardo claro a mediano, de hasta 40 cm de largo, cilíndricos, usualmente constrictos a intervalos, creciendo en grupos en el intermareal. Pared del talo con varios estratos celulares, el cortical formado por células con un feoplasto parietal. Presuntos gametocistos pluriloculares uniseriados, en soros irregulares densos. Referencias: Boraso & Zaixso (2007); Asensi & Küpper (2012). Scytosiphon crispus Skottsberg Frondes cespitosas, sin ramificar, filiformes, tubulares, contortas en espiral, ondulados, hasta de 1 cm de largo, con pelo hialino apical en los talos juveniles. Presuntos gametocistos pluricelulares uniseriados en estrato continuo, sin parafisas ni pelos. Referencias: Skottsberg (1907). Scytosiphon dotyi M. J. Wynne Referencias: Doty (1947); Wynne (1969); Asensi & Küpper (2012) (como Scytosiphon complanatus) (Rosenvinge) Doty 87 Petalonia Derbès et Solier Talos anuales laminares desde lineales hasta laminares, surgiendo solitarios o en grupos de un disco basal pequeño. Células superficiales pequeñas, subcúbicas, médula con células incoloras, mucho más grandes, a veces entremezcladas con hifas. Pequeños mechones de pelos multicelulares sobre la superficie del talo. Parafisas unicelulares presentes o ausentes. Esporocistos pluriloculares uniseriados llegando a cubrir ambas superficies del talo, progresando la maduración desde el ápice hacia la base de la fronde. Las esporas de los mismos dan al germinar estadíos postrados tipo Ralfsia, sobre los cuales se desarrollan esporocistos uniloculares, ubicados en la base de parafisas pigmentadas, erectas. En otras especies las esporas dan lugar a microtalos que llevan esporocistos uniloculares. Las posibilidades en cuanto a ciclos de vida en base a estos elementos son variadas, siendo bastante común el desarrollo directo de la parte erecta a partir de la postrada. Petalonia fascia (O. F. Müller) O. Kuntze Lam 4-4-fig. 11 Talos en grupos, de hasta 6-7 cm, foliosos, delgados, pardo amarillentos, algo laciniados cuando seniles. La médula formada por uno o dos estratos de células. Gametocistos pluriloculares uniseriados sobre la corteza. Referencias: Ricker (1987); Wiencke & Clayton (2002); Boraso & Zaixso (2007); Asensi & Küpper (2012). Colpomenia Derbès et Solier Talos globosos o en forma de saco, amarillentos a marrón verdoso claro, con porción basal de adhesión amplia, al principio el talo es globular, sólido y glabro, luego irregular, hueco, con las paredes de varios estratos celulares, de células progresivamente más pigmentadas y pequeñas hacia la superficie. Sexos separados, gametas anisógamas. Gametocistos pluriloculares limitados en una primera etapa a las áreas alrededor de los mechones de pelos, extendiéndose luego. Parafisas incoloras unicelulares se hallan frecuentemente entre los esporocistos pluriloculares. Se han observado ciclos de vida directos asexuales y otros sexuales en los que la cigota produce esporofitos microscópicos con esporocistos uniloculares cuyas zoosporas (unisporas) dan origen a macrotalos; los microtalos producen también plurisporocistos que dan nuevos microtalos. Referencias: Clayton (1975); Kogame & Yamagishi (1997). Colpomenia sinuosa (Mertens ex Roth) Derbés et Solier Lam 4-4-fig. 14 Talos esféricos marrón claro, tempranamente huecos, desde esféricos hasta irregularmente aplastados y algo sinuosos, con base extendida, de 3 cm hasta 10 cm de diámetro cuando maduros. Epífitos sobre Corallina en niveles bajos del intermareal. Referencias: Boraso & Zaixso (2007); Asensi & Küpper (2012). Orden Ralfsiales Familia Ralfsiaceae Talo perenne, costroso, saxícola, pseudoparenquimatoso, con un estrato basal extendido, mayormente sin rizoides, usualmente de varias células de grosor, y una capa de filamentos erectos adheridos lateralmente entre sí, más o menos firmemente. Crecimiento marginal o intercalar. Feoplastos laminares, uno o varios por célula, sin pirenoide. Estructuras reproductivas en soros poco definidos, esporocistos uniloculares y pluriloculares generalmente en individuos separados. Gametas isógamas. Con alternancia isomórfica de generaciones o con un ciclo directo. Ralfsia Berkeley Ralfsia posee las características vegetativas de la familia mostrando filamentos erectos ramificados muy cohesionados entre sí y un feoplasto parietal por célula. Los esporocistos uniloculares son terminales sobre los filamentos erectos, asociados a 88 parafisas multicelulares. Los esporocistos pluriloculares, menos frecuentes, son desde uni a pluriseriados y se forman igualmente en posición terminal (o subterminal según Anderson et al. (1988), con una o más células terminales estériles y no se encuentran asociados a parafisas. Los límites del género son algo difusos, ya que algunas de sus especies se reconocen actualmente como fases del ciclo de vida de otros géneros con talos erectos. Referencias: Lindauer et al. (1961); Ricker (1987). Ralfsia australis Skottsberg Lam 4-3-Figs. 8- 9 Talos costrosos de color marrón adheridos al sustrato, de poco grosor, desde orbiculares a irregularmente expandidos en manchones, cuyo diámetro depende del sustrato disponible e interacción con otros organismos, sin líneas de crecimiento conspicuas. Con soros de esporocistos uniloculares sobre la superficie del talo. Referencias: Skottsberg (1921); Pérez (2001); Boraso & Zaixso (2007). Ralfsia verrucosa (Aresch.) J. Agardh Talos costrosos de color marrón oscuro, desde correosos hasta quebradizos, orbiculares a irregularmente expandidos en manchones, cuyo diámetro depende del sustrato disponible e interacción con otros organismos y con un grosor de hasta 1-2 mm, ocasionalmente zonados concéntricamente en la zona periférica y abullonados o verrucosos en el centro. Estrato basal dando lugar en el borde del talo a filamentos erectos, arqueados. En el corte del talo postrado se observan superpuestas las sucesivas series de filamentos en crecimiento. Se observan pelos en mechones creciendo desde el fondo de criptas profundas del talo. Se forman soros de esporocistos uniloculares sobre la superficie del talo. Referencias: Boraso & Zaixso (2007). Lithoderma Areschoug Talo saxícola, costroso, delgado, marrón oliv.aceo, formado por una porción basal monostromática y filamentos erectos bien consolidados en una empalizada, con pelos. Esporocistos uniloculares terminales en los filamentos erectos. Esporocistos pluriloculares poco frecuentes, laterales, uniseriados o biseriados. Referencias: Ricker (1987). Lithoderma antarcticum Skottsberg Lam 4-2- fig. 18 Talo costroso, delgado, epilítico, de 1-2 cm de diámetro, de color marrón oscuro, consistente en una base monostromática de filamentos simples, coalescentes de la que surge una empalizada compacta de hasta 170 µm de grosor de filamentos erectos firmemente unidos entre sí. Sin pelos. Las células tienen varios feoplastos pequeños. Referencias: Skottsberg (1953); Ricker (1987); Wiencke & Clayton (2002). Lithoderma piliferum Skottsberg Talos formando pequeños discos de hasta 3 mm de diámetro y de hasta 90 µm de grosor en el centro, constituídos por filamentos erectos de 6-7 células, simples o con alguna dicotomía. Skottsberg (1921) describe para esta especie dos tipos de talo. El primero con las células en el centro del estrato basal de forma poligonal, de 9-12 µm de diámetro y en los bordes de forma cuadrangular, de 15 a 30 µm de diámetro, con filamentos erectos adheridos en forma compacta de 12-14 µm de ancho y pelos de 8-9 µm de ancho. El segundo tipo de talo con células centrales del disco de solo 6-9 µm y las del borde de 6-12 µm, con filamentos erectos de 8-10 µm de ancho y pelos de 6-7 µm de ancho. Las células poseen varios feoplastos discoides. Esporocistos uniloculares poco frecuentes, solo observados en los talos de células grandes, terminales sobre los filamentos, subglobosos y de hasta 15 µm de diámetro. No se observaron gametocistos ni esporocistos pluriloculares. Referencias: Skottsberg (1921); Boraso & Zaixso (2007). 89 Pseudolithoderma Svedelius Se diferencia de Lithoderma por llevar los esporocistos pluriloculares en posición terminal. Se ha citado a Pseudolithoderma extensum (P .L. Crouan & H. M. Crouan).Lund. Referencias: Asensi & Küpper (2012) (como Lithoderma extensum (P. L. Crouan & H. M. Crouan) G.Hamel). Petroderma Kuckuck Talos consistentes en costras delgadas, de color pardo, formadas por una porción basal monostromática y filamentos erectos libres de 6-17 células de largo. Células con un solo feoplasto sin pirenoide visible. Los esporocistos uniloculares son terminales sobre los filamentos erectos. Petroderma maculiforme (Wollny) Kuckuck Lam 4-3-fig. 7: Costras pseudoparenquimatosas consistentes en una base monostromática y filamentos erectos de altura homogénea no consolidados o unidos solamente con mucílago, sin pelos. Células con un solo feoplasto y con contenido refractivo. Referencias: Skottsberg (1921); Wiencke & Clayton (2002); Boraso & Zaixso (2007); Asensi & Küpper (2012). Orden Scytothamnales Esporofito erecto con base costrosa y frondes erectas cilíndricas con médula filamentosa y corteza firme. Crecimiento por célula apical o por meristema apical. Pelos feofíceos en grupos, en criptostomas o en conceptáculos. Células con uno a varios feoplastos estrellados con un pirenoide central. Esporocistos uniloculares transformados a partir de células corticales y distribuidos en la corteza o formados sobre células corticales dentro de conceptáculos. Ciclo digenético con alternacia de un gametofito microscópico con gametocistos pluriloculares, iso o anisogamia y la generación esporofítica macroscópica. Referencias: Peters & Clayton (1998). Familia Scytothamnaceae Scytothamnus Hooker & Harvey Talos sólidos o huecos, frágiles o robustos, blandos o coriáceos, con las porciones centrales aplanadas o cilíndricas; si son aplanados son profusa e irregularmente ramificados y tienen proliferaciones marginales y superficiales; cuando son cilíndricos muestran ramificaciones más regulares. Las ramas, de varios órdenes, son de longitud heterogénea, las últimas cortas y acuminadas. La estructura en sección longitudinal muestra típicamente un tejido central de filamentos largos, anastomosados, que divergen paulatinamente hacia la periferia, dividiéndose en ramas cada vez más cortas y formando la corteza pigmentada de filamentos anticlinales. El crecimiento del talo muestra en una etapa temprana una estructura polística, con divisiones celulares longitudinales, pero luego adquiere modalidad haplóstica y el talo crece a través de filamentos, en las zonas apicales de los mismos. Los pelos son más o menos numerosos, en mechones dentro de puntuaciones estériles sobre la superficie del talo, creciendo de meristemas subapicales algo difusos. Los feoplastos se presentan en formas y posiciones variadas, desde discoides hasta alargados y desde parietales hasta centrales, en algunas células internas del talo adulto se observa una disposición axial del conjunto de los feoplastos alargados, semejando una figura estrellada. Los esporocistos uniloculares son grandes y se encuentran dispersos sobre la superfici e inmersos dentro del tejido cortical externo. Las esporas pueden producir gametofitos dioicos con isogametas o pueden germinar en un protonema que o regenera el talo erecto o da esporocistos pluriloculares. Referencias: Clayton (1986). 90 Scytothamnus fasciculatus (Hooker & Harvey) Cotton. Lam 4-5-figs. 1-2: fig. 1 Talos erectos huecos, con hifas centrales y corteza de células radiales medianamente compactadas. Ramas terminadas en una célula apical. Esporocistos uniloculares inmersos en la corteza. Con pelos en criptostomas, no asociados a estructuras reproductivas. Referencias: Cotton (1915); Asensi 1975b; Wiencke & Clayton (2002); Boraso & Zaixso (2007); Asensi & Küpper (2012). Stereocladon Hooker & Harvey Género monotípico con las características de la única especie. Stereocladon rugulosus (Bory) Hariot Costras perennes firmes y expandidas, de naturaleza haplóstica y de crecimiento marginal anual, con restos de ejes erectos viejos, en el centro del disco basal de superficie. Los talos más jóvenes se ubican hacia el borde, que es de superficie lisa y color más claro con numerosos ejes erectos, con ejes ramificados repetidas veces y con ramas laterales. Ejes sólidos, multiaxiales, con una médula pseudoparenquimatosa firme y filamentos asimiladores cortos. Apíces con un domo de células pequeñas, sugiriendo una región meristemática. Feoplastos estrellados, con un pirenoide central y varios lóbulos radiando. Esporocistos uniloculares inmersos en la corteza. Referencias: Skottsberg (1921); Peters & Clayton (1998). Familia Asteronemataceae Asteronema Delépine & Asensi Talos epífitos o epilíticos de hábito heterotrico. Estrato basal denso, del que se elevan filamentos erectos, poco ramificados, los cuales crecen intercalar y apicalmente, varios feoplastos con un arreglamiento en estrella y un cuerpo pirenoidal complejo, producto de la unión de los pirenoides correspondiente a cada feoplasto, en el centro de la célula. Esporocistos uniloculares y pluriloculares o solo pluriloculares, sésiles o con un pedicelo unicelular. Referencias: Delépine. & Asensi (1975); Müller & Parodi (1994); Boraso & Zaixso (2007). En Guiry & Guiry (2012) se señala que Womersley (1987) considera que no existen mayores diferencias entre Asteronema australe Delépine & Asensi y A ferruginea. Asteronema ferruginea (Harvey) Delépine & Asensi Lam 4-5-figs. 3-6 Con las características del género, de unos pocos milímetros de alto, células de 10-20 µm de ancho por 15-40 µm de largo. Esporocistos uniloculares subesféricos de 30-40 µm de ancho por 60-100 µm y pluriloculares elípticos 30-40 µm de ancho por 70100 µm de largo. Con monosporas. Epilítico o sobre Durvillaea. Referencias: Delépine & Asensi (1975); Asensi & Küpper (2012). Familia Bachelotiaceae Referencias: Silberfeld et al. (2011); Guiry & Guiry (2012). Bachelotia Kuckuk ex Hamel Talos menores de 5 cm, con una porción erecta irregularmente ramificada, con rizoides hacia la base. Crecimiento apical, con divisiones intercalares frecuentes en zonas localizadas de crecimiento. Ocasionales divisiones longitudinales solo en las zonas fértiles. Reproducción por esporas producidas en esporocistos uniloculares intercalares, en cadenas. Este género tiene una configuración estrellada del cromatoforo, formada por feoplastos en V, similar a la de Asteronema (Delépine et al., 1976). Referencias: Lindauer et al. (1961). Bachelotia antillarum (Grunow) Gerloff Talos filamentosos, en mechones, de hasta 2,5 cm de alto, con porción basal estolonífera y sistema erecto. Filamentos erectos normalmente uniseriados, de células 91 cilíndricas entre 26 y 65 µm de ancho 21-125 µm de largo. Feoplastos axiales estrellados, generalmente 1-2 por célula. Esporocistos uniloculares intercalares, en series simples o en pares. Referencias: Cabrera (1968); Sar et al. (1984). Papenfuss (1964) considera que la cita para Tierra del Fuego de Bachelotia en Skottsberg (1921) corresponde a P. littoralis, con lo que coincidimos porque en función de los diferentes muestreos realizados parece dudoso que Bachelotia se encuentre en latitudes tan altas. Orden Desmarestiales Esporocistos macroscópicos de naturaleza uniaxial pseudo-parenquimatosa, frondes enteras o pinnadamente ramificadas en un plano. Ejes y ramas cilíndricos o aplanados. El crecimiento es primariamente tricotálico, en un tejido meristemático en la base de pelos marginales o apicales, cuyas células cortan más células hacia el talo que hacia los pelos, estos últimos finalmente caducos. Las células corticales se dividen activamente formando un meristoderma. La meiosis ocurre en esporocistos uniloculares. Los gametofitosson diminutos, usualmente dioicos, con oogonios y con espermatozoides biflagelados, a veces monoicos y oógamos. Familia Desmarestiaceae Abarca los géneros de Desmarestiales en los que los esporocistos se encuentran dispersos sobre la superficie del talo. Desmarestia Lamouroux Esporofitos erectos pseudoparenquimatosos simple o ramificados, de pocos decímetros hasta varios metros, anuales o perennes. Grampón basal con un solo eje erecto muy ramificado o entero. Ejes y ramas terminados en una porción filamentosa delicada que puede perderse en el talo adulto, sin pelos feofíceos. Filamento central del eje rodeado por médula de células incoloras de paredes gruesas con hifas descendentes. Estrato superficial formado por células pigmentadas con numerosos feoplastos lenticulares sin pirenoides. Esporocistos uniloculares esparcidos en la superficie del talo, aparentemente como producto de la transformación de una sola célula cortical, subglobulares o a veces alargados y sobre un pedicelo junto con 1-2 parafisas. Los gametofitos microscópicos son filamentosos, monoicos o dioicos, a veces dimórficos. Los espermatozoides son móviles formados en racimos de anteridios en forma de clava; oocitos femeninos formados en oogonios alargados. Desmarestia confervoides (Bory) Ramirez & Peters. Lam 4-7-figs. 1-5: Talos marrón claro, de aspecto lanoso, de hasta de 1 m de alto. Grampón pequeño formado por hapterios más o menos aplanados. Ejes cilíndricos, algo aplastados hacia la base. Ramificación opuesta, regular, hasta de quinto orden. Extremos de ramas jóvenes persistentes, emergiendo de la porción pseudoparenquimatosa, frecuentemente terminando en un célula flamígera. Eje rodeado de una vaina de hifas fuertemente adheridas entre sí. Médula con células grandes y pequeñas entremezcladas, zona cortical pigmentada. Esporocistos uniloculares corticales globosos a ovales 9-13 µm de largo por 15-22 µm de ancho. Referencias: Gain (1912) (como Desmarestia willii Reinsch); Ramírez et al. (1986); Wiencke & Clayton (2002); Boraso & Zaixso (2007); Asensi & Küpper (2012). Desmarestia ligulata (Stackhouse) Lamouroux Lam 4-7-figs. 6-11: Talos aplanados y muy ramificados, sin nervaduras visibles, de 30-180 cm de largo, color verde oliva a pardo oliva. Con un corto tallo cartilaginoso, que se aplana arriba, formando láminas irregularmente insertas, pinnadas, con rámulas cortas lineal-lanceoladas, 92 con un pequeño tallo en la base, con dientes numerosos, espiniformes en los márgenes. Con un disco basal simple de 1-1,5 cm de diámetro (que alcanzaría hasta 4 cm si se incluye D. firma Skottsberg en esta especie). Los talos jóvenes muestran mechones de pelos uniseriados pigmentados saliendo de las espinas marginales, pero estos son usualmente caducos. En corte se ve el filamento axial, rodeado de células pequeñas, y luego sucesivamente por células pseudoparenquimatosas y corticales. Esporocistos uniloculares en soros, 24-30 µm de alto y 9-12 µm de ancho. Referencias: Gain (1912); Scrosati (1992); Boraso & Zaixso (2007); Asensi & Küpper (2012). Desmarestia patagonica Asensi Talos enteros de hasta 40 cm de alto y 16 de ancho, está constituidos por una sola fronde color pardo oscuro, obovada, algo asimétrica, de borde entero y liso, cuneiforme hacia la base, con un pedúnculo cilídrico de 1-2 mm de diámetro y de hasta 0,5 cm de longitud continuado en una nervadura central que alcanza el ápice, con nervaduras secundarias repetidamente ramificadas. Disco de adhesión carnoso, de hasta un cm de diámetro. El ápice del talo es bilobulado. La epidermis es uniestratificada con células pequeñas, con feoplastos lenticulares. La corteza está formada por células muy grandes con pocos feoplastos. La zona medular está formada por hifas sinuosas. Los esporocistos uniloculares superficiales formados a partir de las células epidérmicas no son muy diferenciados y se han observado hasta 16 esporas pequeñas en cada uno, las que son emitidas a través de un poro apical. Referencias: Asensi & Gonçalves Carralves (1972); Boraso & Zaixso (2007); Asensi & Küpper (2012). Asensi & Küpper (2012) citan Desmarestia muelleri Ramirez & Peters. Referencias: Ramirez y Peters (1993); Guiry & Guiry (2013). Para Antártida han sido descriptas las siguientes Desmarestiales: Desmarestia antarctica Moe et Silva; Desmarestia anceps Montagne; Desmarestia menziesii J. Agardh; Himantothallus grandifolius (Gepp & Gepp) Zinova.; Phaeurus antarcticus Skottsberg. Referencias: Wiencke & Clayton (2002). Orden Cutleriales Orden caracterizado por talos acintados o flabeliformes con alternacia isomórfica o heteromórfica de una generación gametofítica erecta y un esporofito de igual o menor tamaño que aquella. El crecimiento es total o parcialmente tricotálico. La reproducción sexual, monoica o dioica, es oógama. Familia Cutleriaceae Talo erecto o postrado, acintado, en abanico o discoide, membranoso o correoso, con el margen entero o lobado. Gametocistos pluriseriados terminales o laterales sobre filamentos (paranemata) simples o ramificados, ubicados sobre las células superficiales, entremezclados con parafisas estériles, en racimos, sobre ambas caras del talo o solo sobre la superior. Los oogonios y anteridios producen oosporas y anteridios móviles. El oogonio es fecundado solo luego de asentarse. Los órganos asexuales parecidos a esporocistos uniloculares, en soros superficiales, producen zoosporas biciliadas. 93 Lam 4-7: figs. 1-5: Desmarestia confervoides: 1: aspecto general. 2: ramificación, 3: células y feoplastos, 4: ápices de ramas, 5: detalle de ramificación, figs. 6-11: Desmarestia ligulata: 6: rama, 7: formación de `seudoparénquima, 8: base de rama, 9: detalle con ramas de varios órdenes, 10: feoplastos, 11: aspecto general. 94 Microzonia J. Agardh Género con las características de M. velutina. Microzonia velutina (Harvey) J. Agardh Lam 4-5- figs. 12- 14 Talo pequeño, complanado, en forma de abanico, de unos 3 cm de alto, más o menos multifido, estipitado y decumbente abajo, y erecto arriba. Se puede reconocer una cara ventral y una dorsal, la ventral es pubescente, cubierta por pelos de aspecto rizoidal, con pocos feoplastos pálidos, especialmente hacia la región basal, las células apicales de estos filamentos son voluminosas y fuertemente pigmentadas. La cara dorsal es glabra, con estriación radial debida a diferencias entre los haces de filamentos y también concéntrica debida a diferentes grados de pigmentación como respuesta al grado de crecimiento. Crece apicalmente y los márgenes laterales son lisos o lacerados. Estructura polistromática, con una o dos capas medulares y dos capas corticales, de células algo más pequeñas. Crecimiento por una fila de células marginales derivadas de pelos, fuertemente pigmentadas. Ocasionalmente los pelos marginales pueden crecer en forma independiente, formando filamentos libres. Células con varios feoplastos parietales discoides en forma de cuerpo de violín, presencia de pirenoides dudosa, abundantes fisodes. Areas fértiles extendidas por toda la superficie inferior, consistente en filamentos, tortuosos, ramificados, uniseriados con esporocistos uniloculares ovoides sobre pedúnculos, en grupos o solitarios, generalmente laterales. Se desconocen el ciclo de vida y la reproducción sexual. Referencias: Asensi (1971a); Escobar (1997); Boraso & Zaixso (2007); Asensi & Küpper (2012). Cutleria Greville Gametofito, de fronde plana, en abanico, subdicotómica o irregularmente ramificada en un plano, membranoso de hasta unos 20 cm de alto. Ancho de las ramas no superando los 0,5 cm. Adhesión al sustrato por una masa de rizoides. Crecimiento tricotálico a partir de pelos apicales simples o ramificados que se fusionan dando un tejido compacto. La ramificación se produce por fallas periódicas en la adhesión lateral de los filamentos. Esporofitos postrados, algo más pequeños. Cutleria multifida (Smith) Greville Lam 4-5-figs. 7-9(Aglaozonia); Lam 4-5-figs. 10-11(gametofito) Porción basal orbicular y porción erecta formada por cintas dilasceradas creciendo suabapicalmente a través de filamentos libres entre sí en los ápices. Pueden formarse ramas adventicias a partir de pelos superficiales coalescentes. Los talos comprenden una zona medular de 3-4 estratos de células grandes incoloras y una cortical formada de filas cortas (1-3 células) de pequeñas células pigmentadas. Especie dioica, oogonios y anteridios con o sin parafisas acompañantes. Oocistos oscuros, en soros sobre ambas superficies del talo, sobre pedúnculos simples o poco ramificados, con 4 a 7 filas de 4 lóculos grandes, cada lóculo llevando una oosfera piriforme con mancha ocular en el punto de inserción de los dos flagelos. Anteridios amarillo brillante sobre filamentos libres, con 20-22 filas de 8 lóculos pequeños, cada uno liberando un anterozoide biflagelado diminuto, piriforme. El talo esporofítico postrado, en forma de abanico coriáceo, de unos pocos centímetros de largo, conocido como estado aglaozonia, posee simetría dorsiventral, es perenne y está adherido al suelo por rizoides, sobre la superficie dorsal llevan mechones de pelos algo hundidos. Crecimiento del talo postrado por divisiones periclinales y anticlinales en el margen. Cada célula con varios feoplastos discoides. En sección transversal se observan dos estratos corticales, de células chicas y pigmentadas y 3-4 estratos de células grandes prismáticas, incoloras. Los esporocistos son alargados, cilíndricos u ovoides, formando soros extensos sobre la superficie del talo. Referencias: Asensi (1971a); Boraso & Zaixso (2007); Asensi & Küpper (2012). 95 Cutleria adspersa (Mertens ex Roth) De Notaris Talos en forma de abanicos regulares, delicados, de unos 2 cm de radio, con crecimiento tricotálico marginal, de color pardo. Referencias: Boraso & Zaixso (2007). Orden Dictyotales Talos erectos, saxícolas, con uno o varios ejes erectos aplanados, parenquimatosos, con un meristema apical y ramificación en un plano. Feoplastos discoides y numerosos, generalmente sin pirenoide. Especies dioicas con alternancia isomórfica de generaciones. Estructuras reproductivas parcial o totalmente emergentes del talo. Aplanosporas grandes, en grupos de 4 u 8 en esporocistos uniloculares. Reproducción oógama. Gametocistos en soros, produciendo un óvulo por oogonio y espermatozoides uniflagelados producidos en anteridios pluriloculares. Parafisas ausentes o presentes. Familia Dictyotaceae Dictyota Lamouroux Talos erectos o postrados, acintados, de hasta unos 40 cm de alto, con estolones ramificados basales, tipicamente divididos en forma dicotómica, a veces proliferados lateralmente o desde la superficie del talo, flabelados, con ramas en un plano o en espiral. Ramas con una célula grande apical inicial. Médula de un solo estrato de células grandes e incoloras. Corteza de células más pequeñas, pigmentadas, con numerosos feoplastos discoides, ordenadas en filas periclinales. Pelos comunes en los talos estériles. Gametofitos dioicos, oógamos, con las estructuras reproductivas emergentes, cubiertas por una cutícula. Los oogonios se encuentran en soros, cada uno produce un huevo relativamente grande, los anteridios son pluriloculares con márgenes estériles. Esporocistos uniloculares, distribuidos sobre la superficie del talo, produciendo 4 aplanosporas. En las colecciones de Dictyota que realizamos en la costa de Argentina aparecen una gran variedad de formas, las cuales no permiten diferenciar más que una especie muy polimórfica, coincidente en gran medida con la descripción de D. dichotoma de Womersley (1987). Dictyota dichotoma (Hudson) Lamouroux Lam 4-6- fig. 15 Talos de entre 3-4 cm hasta 20 cm de longitud, espiralados o planos, de color amarillento, pardo verdoso o pardo rojizo; con ramificaciones dicotómicas o subdicotómicas o irregulares, con ramas de de algo más de un centímetro hasta solo unos pocos milímetros de ancho, con o sin rizoides sobre el talo, con o sin ramas prolíferas, las ramificaciones pueden terminar apicalmente en forma redondeada o afinada, siendo frecuentemente encontrar pelos en mechones inconspicuos sobre el talo. Aún sobre diferentes porciones de un mismo talo se observan frecuentemente características morfológicas correspondientes a las diferentes especies descriptas para el hemisferio sur. Solo hemos observado la reproducción asexual por tetrasporocistos solitarios. Referencias: Boraso & Zaixso (2007); Asensi & Küpper (2012). Orden Fucales Talos saxícolas, limícolas o libres, de tamaño mediano a grande, a veces con estructuras de flotación, de muy variada ontogenia y anatomía. Las estructuras reproductivas se ubican en conceptáculos ostiolados del talo. El ciclo de vida es haplobionte diploide con reproducción oógama con oogonios y anteridios, los que producen anterozoides biciliados. Familia Durvillaeaceae Las Durvillaeaceae se diferencian de las Fucaceae por carecer de una célula apical, creciendo en cambio en forma difusa y también por la forma de desarrollo del 96 conceptáculo. Poseen talos grandes y gruesos. Forman hifas horizontales y verticales a partir de células medulares y corticales. Se pueden observar tubos cribosos entre las células medulares. El macrotalo diploide lleva meioesporocistos en conceptáculos dioicos dispersos por el talo. Durvillaea Bory Talos grandes, consistentes en un grampón cónico, discoide o fibroso, sólido, un estipe cilíndrico y una lámina plana, en forma de cinta ancha, gruesa y correosa, en algunas especies con cámaras de aire internas al talo, desde entera hasta más o menos laciniada según las especies. Tejido interno de hifas entretejidas, estratos corticales intermedios de células oblongas, con su eje mayor perpendicular a la superficie. Crecimiento difuso, sin meristemas apicales ni intercalares. Conceptáculos dioicos ostiolados, dispersos sobre la lámina, dentro de la corteza, con oogonios con cuatro óvulos, parietales o sobre pelos ramificados, con parafisis entre los oogonios y anteridios sobre pelos ramificados. Durvillaea antarctica (Chamisso) Hariot Talos de hasta 10 m de largo, con un estipe de menos de 50 cm de largo y cilíndrico, a veces algo aplanado, frecuentemente algo inmerso en el grampón. con estrías alrededor de la base, el cual se divide distalmente y lleva a las láminas, las cuales pueden estar escindidas en varias divisiones mayores, esta a su vez pueden estar divididas en cintas alargadas, infladas, correosas, con tejido en forma de celdas de panal. Las células corticales muy alargadas radialmente, con paredes gelatinosas gruesas. Las células de la médula también son engrosadas pero no alargadas radialmente. En el centro de la médula se hallan hifas laxamente entretejidas, perpendiculares a la superficie del talo, con espacios entre las hifas. Referencias: Skottsberg (1907); Delépine & Asensi (1976); Boraso & Zaixso (2007). Para Antártida se ha descripto también la fucal Cystosphaera jacquinotii (Mont.) Skottsberg de la familia Cystosphaeraceae Referencias: Skottsberg (1907); Lamb & Zimmerman (1977) Wiencke & Clayton (2002); Guiry & Guiry (2012.) Orden Ascoseirales Es un orden monotípico presente solo en Antártida con la especie Ascoseira mirabilis Skottsberg. Referencias: Skottsberg (1907); Lamb & Zimmerman (1977); Clayton (1987); Müller et al. (1990); Wiencke & Clayton (2002). Orden Sporochnales Esporofitos parenquimatosos, erectos, raificados con ramas cilíndricas o planas, sólidos o huecos. Meristema subterminal formando una placa, las células del mismo cortan células distalmente formando un mechón apical de filamentos pigmentados. Feoplastos desde discoides hasta irregulares, muchos por célula, sin pirenoides. Esporocistos pluriloculares nunca observados, esporocistos uniloculares agrupados en ramas laterales con porciones engrosadas típicas o receptáculos. Gametofitos microscópicos, monoicos o dioicos, ectocarpoides, con oogonios terminales y anteridios aislados o en grupos. Familia Sporochnaceae Sporochnus C. Agardh Talo delicado, ramificado en forma alterna, cilíndrico hasta ligeramente achatado, con estrato interno de grandes células incoloras y externo de células pigmentadas. Meristema subterminal sobre rámulas engrosadas, con mechón terminal de filamentos. Esporocistos uniloculares en la base de los filamentos terminales de las ramas laterales sobre receptáculos terminales, globosos. 97 Sporochnus pedunculatus (Huds) C. Agardh Lam 4-6-figs. 1-2 Talo erecto con eje de hasta 50 cm, flexible, marrón amarillento cuando vivo, oscuro al secarse, con ramas en espiral irregular, que parecen alternas en el material prensado de herbario. Ramas cilíndricas, de 0,5-1,2 mm de diámetro, llevando numerosas ramas determinadas cortas terminadas en mechones de filamentos pigmentados monosifónicos. Rámulas fértiles al principio sub sésiles, llegando a tener hasta 25 mm de largo y unos 0.2 mm de diámetro en los especímenes viejos. Los receptáculos pueden llegar a unos 0,5 mm de diámetro y hasta 2 mm de largo, y están compuestas de parafisas ramificadas de hasta 58 µm de largo con ápices globosos y esporocistos uniloculares. Referencias: Boraso y Negri (1997); Boraso & Zaixso (2007). Orden Sphacelariales Talos desde diminutos hasta 15 cm de alto en las formas más robustas, usualmente epilíticos o epífitos; a veces perennes, con filamentos erectos usualmente en mechones relativamente rígidos. Los talos están compuestos por ejes y ramas de crecimiento indefinido, las que llevan ramas de crecimiento definido opuestas, alternas, en verticilos o unilaterales. Porción basal persistente en forma de rizoides, a veces coalescentes en un disco. Cada eje y cada rama tienen una célula apical conspicua, denominada esfacelo. Los ejes y las ramas son cilíndricos, las ramas son uniseridas cerca de los ápices, haplósticas o polísticas más abajo, por formación de paredes longitudinales, a veces con una corteza rizoidal. Pelos con meristema basal presentes o ausentes. Feoplastos discoides, numerosos, sin pirenoides en las células vegetativas, aunque éstos han sido señalados en las zoosporas. Ciclo con alternancia isomórfica de generaciones. Esporocistos uniloculares y gametocistos pluriloculares raros, en individuos separados. Propagación vegetativa por propágulos más o menos diferenciados. Familia Sphacelariaceae Comprende talos generalmente erectos, o al menos con una porción erecta importante, creciendo a través de un esfacelo, el cual da lugar por división transversal a dos células, se forma así una articulación con dos segmentos que se denominan superior e inferior, éstos posteriormente pueden o no seguir dividiendose longitudinalmente en forma repetida. Las ramas, similares al eje principal, de crecimiento limitado o no, se forman a partir de los segmentos superiores y a cierta distancia de los ápices de los ejes. El talo crece estrictamente de manera leptocaule y formación hemiblástica de los laterales. Las ramas de crecimiento definidos no forman verticilos. Organos uniloculares y pluriloculares formados por diferenciación de una parte de una rama. No se ha observado oogamia. Propágulos vegetativos frecuentes. Referencias: Prud´Homme Van Reine (1982, 1993). Herpodiscus South Talos formando pequeños mechones epífitos o epilíticos. Crecimiento apical de los filamentos haplóstico o levemente polístico, con o sin paredes transversales secundarias. Esporocistos uniloculares solitarios o en series en posición adaxial, sobre ramas laterales simpodiales. Esporocistos pluriloculares sobre ramas laterales pequeñas y ramificadas. El ciclo de vida en la especie tipo es heteromomórfico, lo que diferenciaría a este género del resto de las Sphacelariales tal como se las concibe hoy en día, sin embargo la evidencia molecular confirma su pertenencia a este orden. Referencias: Guiry & Guiry (2012). Herpodiscus bornetii (Hariot) Draisma, Prud'homme & H. Kawai Talos de unos 2 mm de alto, rígidos, los ejes primarios rastreros,de hasta 30 µm de diámetro, no corticados, con ramificación hemiblástica, células de hasta 17 µm de longitud y 13,5 a 20,5 µm de ancho. Ápices con pocas filas de células (4-5). Ápices obtusos. Esporocistos uniloculares sésiles, ovoides, en series unilaterales sobre ramas 98 laterales, levemente en zigzag. No se observan propágulos pero las ramas cortas que se desprenden actúan como tales emitiendo rizoides. Referencias: Hariot (1889); Boraso & Zaixso (2007) (como Sphacelaria bornetii). Sphacelaria Lyngbye Talos verde oliva hasta pardo claro, filamentosos, pequeños a diminutos, generalmente epífitos, con una porción basal rizoidal, de filamentos más o menos coalescentes Filamentos erectos desde subsimples hasta muy ramificados. Ramificación hemiblástica. Ramas regularmente dísticas, alternas, o unilaterales, producidas de una célula superficial del eje, con la que generalmente se corresponde. Pelos ramificados con zona de crecimiento intercalar a veces presentes. Propágulos formados por una o más ramas apenas diferenciadas. Feoplastos parietales, numerosos, discoidales. Esporocistos uniloculares desde esféricos a ovoides con poro apical. Esporocistos pluriloculares pluriseriados, desde ovoides a elipsoidales, nunca alargados, a veces en el mismo talo que los uniloculares. Gametocistos pluriloculares similares a los esporocistos. Sphacelaria fusca (Hudson) S. F. Gray Lam 4-6-figs. 3-6 Talos ramificados, de a lo sumo dos centímetros de alto, de color pardo amarillento a verdoso, pulvinados, hemisféricos, con un esfacelo típico en todas los ápices de las ramas, que son redondeados. Diámetro del eje de alrededor de 50-60 µm. Feoplastos numerosos, desde alargados, radiando desde el centro de la célula hasta redondeados ubicados sobre las paredes celulares. Zona basal pseudoparenquimatosa circular uniestratificada, no endofítica. Ramificaciones irregulares, opuestas o pectinadas. Los ejes muestran una serie de dos o tres células apicales sin divisiones longitudinales, produciéndose luego divisiones longitudinales en cada segmento del talo correspondiente a una célula original. Son muy frecuentes los propágulos solitarios o en series sobre un lado de las ramas, formados por un pedicelo y tres ramitas, sin pelo apical, con una célula lenticular apical. Referencias: Womersley (1987); Keum et al. (2005); Boraso & Zaixso (2007); Asensi & Küpper (2012). Sphacelaria cirrosa (Roth) C. Agardh Por lo menos una vez hemos colectado ejemplares de Sphacelaria que responden a la descripción de esta especie, caracterizada por la presencia de pelos feofíceos apicales en los propágulos. Referencias: Asensi & Küpper (2012). También han sido mencionadas para la costa de Argentina Sphacelaria rigidula Kützing (como S. furcigera Kützing) para Tierra del Fuego e Islas Malvina, para una discusión acerca de estas especies ver Keum et al. (2005). Familia Stypocaulaceae Talos erectos, de tamaños medianos, repetidamente ramificados. Ramas formadas por la división acroblástica de la célula apical. Con una porción polística muy desarrollada, a veces con corticación rizoidal más o menos desarrollada. Esporocistos y gametocistos u oogonios y anteridios solitarios o en grupos en axilas de ramas y rámulas normales o especializadas Halopteris Kützing Talos oscuros verde oliva a pardo amarillentos. Polísticos, corticados, repetidamente ramificados hasta el quinto o más órdenes. Formando mechones rígidos, conspicuos, más irregulares a medida que el talo crece. Los segmentos no crecen en volumen respecto al del esfacelo. Las bases de las ramas cubren el segmento inferior de una articulación y el superior de la siguiente. En las axilas de ramas y rámulas se observan células que darán lugar a pelos, esporocistos o rámulas. El corte transversal de los ejes muestra en el centro una médula de 16-32 células subcúbicas, incluyendo cuatro 99 pericistos. No se observa corteza secundaria. Los esporocistos uniloculares pueden ubicarse solitarios o agrupados en las axilas de ramas comunes, o en grupos en las axilas de rámulas adventicias, la reproducción sexual es por planogametas formadas en gametocistos pluriloculares. Halopteris obovata (Hooker & Harvey) Sauvageau Talos marrones, de hasta 15 cm de alto, muy ramificado en forma dística, ramas con célula apical voluminosa. Médula rodeada por corteza uniestratificada de células pequeñas, base sin rizoides corticales. Se desconocen los órganos pluriloculares. Referencias: Wiencke & Clayton (2002); Quartino et al. (2005); Asensi & Küpper (2012). Para Antártida se ha citado Halopteris corymbosa (Dickie) Draisma, Prud'homme & H. Kawai como Alethocladus corymbosus(Wiencke & Clayton, 2002). Stypocaulon Kützing Este género fue inmerso en Halopteris Kützing por poseer características generales morfológicas semejantes, pero posteriormente fue reinstalado por la ausencia de pericistos y la reproduccción oógama. Stypocaulon funiculare (Mont.) Kützing Lam 4-6-figs. 11-14 Talo de unos 10-15 cm de alto, pardo a verde oliváceo; el eje central está cubierto de rizoides descendentes. Ramificación dística con ramitas fastigiadas. Especie dioica, con el área fértil generalmente proximal en el talo. Esporocistos en grupos sobre pedicelos ramificados, con parafisas clavadas axilares sobre ramas normales de segundo orden. Referencias: Boraso & Zaixso (2007); Asensi & Küpper (2012). Familia Cladostephaceae Cladostephus C. Agardh Este género se considera frecuentemente monotípico y con las características de C. spongiosus. Cladostephus spongiosus (Hudson) C. Agardh. Lam 4-6-figs. 7-10 Talos desde verde oliva oscuro hasta negros, muy rígidos, cuya porción proximal está desprovista de pinas; el crecimiento es auxocaule. Las ramas subdicotómicas están formadas por crecimiento hipacroblástico. Con ramas de crecimiento determinado cortas, de 1-3 mm, en verticilos, con algunos laterales acroblásticos, fácilmente caducas en las porciones viejas del talo, dejando el eje desnudo. Los ejes y ramas llevan un espeso crecimiento secundario parenquimatoso, que rodea a las base de los laterales determinados. Esporocistos uniloculares y gametocistos pluriloculares en individuos separados, estipitados y sobre ramas especiales diminutas, en las zonas más viejas del talo. En Argentina esta especie ha sido citada como C. setaceus Suhr, C. hariotii Sauvageau; C spongiosus (Lightf.) C. Agardh; C. antarcticus Cab. y C. australis Kützing. Referencias: Papenfuss (1964); Boraso & Zaixso (2007); Asensi & Küpper (2012). Orden Laminariales Esporofitos parenquimatosos, típicamente de gran tamaño, diferenciados en láminas, estipes y grampón. Internamente se pueden diferenciar una médula, una corteza y una epidermis. La epidermis se encuentra pigmentada, con numerosos feoplastos discoides sin pirenoides. La corteza incolora está formada por numerosos estratos celulares y la médula consta de filamentos alargados periclinalmente, observándose células en forma de trompeta, terminadas en placas cribosas simples, asociadas a la traslocación de sustancias. En algunas especies se observan en la corteza conductos con mucílago, tanto en las láminas como los estipes. El crecimiento procede por meristemas 100 intercalares. Los soros de esporocistos uniloculares, con abundantes parafisas, se desarrollan, ya sea en hojas especiales, los esporofilos, o en porciones determinadas de las láminas. Los gametofitos producidos a partir de las zoosporas biflageladas, son microscópicos, dioicos y oógamos; los gametocistos son uniloculares, produciendo espermatozoides piriformes, biflagelados lateralmente y óvulos inmóviles, los que germinan en el ápice del oogonio. Recientemente se han realizado una serie de trabajos sobre las afinidades filogenéticas de las Laminariales descubriéndose la naturaleza polifilética de Laminaria y la relativa lejanía de Macrocystis y Lessonia. Estos géneros fueron tradicionalmente ubicados en la familia Lessoniaceae, la que se caracterizaba por los clivajes más o menos elaborados en la zona de transición entre la lámina y el estipe.Hasta donde sabemos no se ha propuesto a la fecha una familia para Macrocystis y demás géneros del clado al que pertenece. Macrocystis C. Agardh Esporofito constituído por varias frondes de gran longitud, cada una con varias láminas lanceoladas provistas de flotadores basales, ubicadas unilateralmente a lo largo de un estipe cilíndrico flexuoso. El talo está adherido al sustrato por un grampón grande, formado por fuertes hapterios ramificados, la forma externa del grampón varía desde extendido hasta cónico. El talo tiene su origen en un sola lámina con un corto estipe y un pequeño grampón, la fronde crece luego a través de un meristema en la base de la láminas, el cual provee tejido al estipe que se alarga y a la lámina, ésta crece basalmente y comienza a dar nuevas láminas por escisión en su porción basal. A medida que la fronde crece va quedando definida su morfología adulta, con una hoja apical en forma de cimitarra que lleva en su base la zona de mayor actividad meristemática y forma en rápida sucesión nuevas láminas, éstas se van separando de la lámina en cimitarra, mostrando el comienzo del flotador aún antes de separarse de la lámina en cimitarra. Las láminas terminan su crecimiento y formación del flotador a través de meristemas residuales en su base. El estipe, que puede estar dividido varias veces en la base, crece en longitud a medida que se añaden nuevas láminas y también en grosor. Algunas de las láminas originadas cerca de la base se dividen sin formar flotadores ni alargar el estipe entre ellas, estás láminas, los esporofilos, darán lugar sobre su superficie a la formación de soros extensos de esporocistos uniloculares entre abundantes parafisas uniloculares, las esporas son piriformes, con una mancha ocular. Los gametofitos microscópicos son filamentosos, ramificados, dioicos, con oogonios inmóviles y espermatozoides flagelados. Macrocystis pyrifera (L.) C. Agardh Lam 4-8-figs. 9-13 Tiene las características del género, caracterizándose por un grampón cónico, más o menos chato y los filoides con superficie rugosa y bordes frecuentemente denticulados. Referencias: Boraso & Zaixso (2007); Asensi & Küpper (2012). Lessonia Bory Esporofito erecto de 60- 80 cm hasta 4 m de longitud en las especies más grandes, formado por láminas sin nervaduras, de superficie lisa, uno a varios estipes y grampón de hapterios ramificados o macizo. El talo comienza como una sola lámina con un breve estipe subcilíndrico abajo y se ramifica luego por escisión sucesiva de las ramas en la franja basal cerca del estipe. Los bordes pueden ser lisos o algo denticulados. Esporocistos en soros extendidos, sobre láminas no diferenciadas morfológicamente. 101 Lam 4-8: fig. 1: Lessonia flavicans: base del talo con grampón; figs. 2-8: Undaria pinnatifida: 2- 3: células en vista superficial, 4: comienzo de cripta, 5: corte en la corteza, 6: células gladulares, 7: esporofilo y lámina con nervadura central ancha, 8: aspecto general de talo joven; figs. 9-13: Macrocystis pyrifera: 9-10: talos jóvenes, 11: hoja apical en cimitarra, 12: grampón de talo joven, 13: talo adulto arrojado por el mar: g: grampón visto desde abajo, e: esporofilos, fi: filoides, flo: flotadores, ca: cauloides. 102 Aunque en las últimas décadas se ha reconocido en la costa de Patagonia la presencia de dos especies (L. vadosa Searles y L flavicans Bory sensu Searles) persistían algunas dudas sobre la denominación de las mismas, lo que llevó a Asensi y de Riviers (2012) a una revisión de los tipos. De acuerdo a la misma se vio la necesidad de definir una nueva especie: Lessonia searlesiana Asensi y de Reviers (sinónimo: Lessonia flavicans sensu Searles), la que corresponde a los ejemplares de profundidad que no presentan lagunas en sus tejidos y de reservar el nombre Lessonia flavicans Bory (sinónimos Lessonia fuscescens Bory y Lessonia vadosa Searles) para las algas de poca profundidad que presentan lagunas en su tejido. Referencias: Asensi (1973c); Scrosati (1991); Boraso & Zaixso (2007); Asensi & de Reviers (2009); Asensi & Küpper (2012). Lessonia flavicans Bory Lam 4-8-fig. 1 Sinónimos: Lessonia fuscescens Bory, Lessonia vadosa Searles) Talos con fuerte grampón ramificado y varias láminas correosas, muy flexibles, producidas por sucesivas divisiones dicotómicas a partir de un estipe primario que deviene grueso. Los talos creciendo a menos profundidad tienen estipes más cortos y robustos que los que se desarrollan a mayor profundidad. Las dicotomías son frecuentemente desiguales, prevaleciendo una de las ramificaciones en tamaño y grado de subdivisión. Borde de la lámina con dientes pequeños separados varios centímetros entre sí. En corte se observa una médula de hifas longitudinales de 100-120 µm de espesor, una zona subcortical de 8- 11 células grandes isodiamétricas de espesor de unos 700 µm de espesor con canales mucilaginosos bien desarrollados y la corteza de dos capas de células pequeñas, la más externa pigmentada. Las células medulares tienen paredes muy gruesas. Es una especie sublitoral, de poca profundidad. Referencias: Searles (1978) (como L. vadosa); Scrosati (1991); Boraso & Zaixso (2007) (como L. vadosa); Asensi & de Reviers, (2009.); Asensi & Küpper (2012 Hasta donde hemos podido verificarlo Lessonia flavicans Bory (según el concepto de Asensi y de Reviers, no el de Searles) es la especie de Lessonia más frecuente en la costa continental de Argentina, no encontrándose en cambio L. nigrescens Bory, que sería típica de la costa de Chile. Lessonia searlesiana Asensi y de Reviers Talos de gran tamaño, arborescentes, submareales. Con varios estipes, saliendo de un grampón ramificado. El talo puede mostrar finalmente un aspecto arborescente por pérdida de los estipes menos desarrollados. Láminas formadas por sucesivas escisiones de la fronde, Las frondes muestran en corte una médula de unos 50 µm de grosor, formada por hifas de paredes gruesas, una subcorteza parenquimatosa sin conductos de mucílago de ningún tipo, formada por células rectangulares y una corteza o epidermis de dos capas de células, la externa más pigmentada. Las citas de Chubut para esta especie deberían ser revisadas. Sinónimos: Lessonia flavicans sensu Searles; Lessonia ovata Hooker & Harvey.. Referencias: Asensi (1973 c); Asensi & de Reviers, (2009); Asensi & Küpper (2012). Familia Alariaceae Undaria Suringar Fronde compuesta por un estipe no ramificado de longitud variable y una lámina expandida, con una nervadura central más o menos marcada, de borde entero o con lóbulos. Anatomía Se adhiere al sustrato con un grampón formado por varios hapterios. En la porción basal de la lámina se producen los esporocistos en empalizada. Gametofitos microscópicos, dioicos. Undaria pinnatifida (Harvey) Suringar 103 Lam 4-8-figs. 2-8 Fronde correosa, más blanda apicalmente, color pardo oscuro, de hasta 60- 70 cm de alto y 40-50 cm de ancho compuesta por un estipe corto y una lámina expandida, con una nervadura central ancha engrosada y lóbulos marginales alargados. Se adhiere al sustrato con un grampón ramificado. En la porción basal engrosada y plegada de la lámina se producen los esporocistos en empalizada. Referencias: Boraso & Zaixso (2007); Casas et al (2008). Referencias bibliográficas del capítulo 4. Asensi, A. O. 1966 a. Sobre la presencia de Pylaiella littoralis (L.) Kjellman en la Antártida. Contrib. Inst. Antártico Argentino 101: 14 p. Asensi, A. O. 1971 a. Un orden de algas pardas nuevo para la Argentina (Cutleriales). Darwiniana 16 (3-4): 435-442. Asensi, A. O. 1971 b. La función de las papilas de Cladothele Hook et Harv. (Phaeophyta). Physis 30 (81): 539-542. Asensi, A. O. 1972. Dos géneros de algas pardas nuevos para Patagonia y el resultado de su cultivo "in vitro". (Feldmannia y Haloglossum, Phaeophyta). Darwiniana 17: 358-377. Asensi, A. O. 1973 a. Sorocarpus, un nuevo género de alga parda para la Argentina (Phaeophyta, Ectocarpales). Physis sec. A 32 (85): 311-316. Asensi, A. O. 1973 b. Representantes de género Giffordia (Batters) Hamel en Argentina (Phaeophyta, Ectocarpales). Bol. Soc. Arg. Bot. 15 (1) : 77-84. Asensi, A. O. 1973 c. El ciclo de vida del alga marina Lessonia fuscescens Bory (Phaeophyta, Laminariales). Darwiniana 18 (1-2) : 162-172. Asensi, A. O. 1973 d. Una especie de alga phaeophyta nueva para Argentina: Myriogloia major spec. nov. y el resultado de su cultivo "in vitro". Darwiniana 18: 153-161. Asensi, A. O. 1974 a. Observaciones sobre la propagación vegetativa de dos algas pardas (Phaeophyta). Physis sec. A. 33 (86): 17-21 Asensi, A. O. 1974b. Observaciones sobre la citología y morfogénesis de los esporocistos anormales de Ectocarpus dimorphus Silva (Phaeophyta, Ectocarpales). Physis sec. A 33 (86) : 139-147. Asensi, A. O. 1975a. Observations sur la phéophycée australe: Corycus lanceolatus Skottsb. Botaniste 42: 153-166. Asensi, A. O. 1975b. La estructura, la distribución y el cultivo de Scytothamnus fasciculatus (Hook. et Harv.) Cotton (Phaeophyta). Physis sec. A 34 (89): 269282. Asensi, A. O. 1976 a. Dos algas marinas nuevas para Argentina. Bol. Soc. Arg. Bot. 17 (12): 51-62. Asensi, A. O. 1976 b. Observaciones sobre Cladothele decaisnei Hooker et Harvey (Phaeophyta). Physis sec.A 35 (90): 1-14. Asensi, A. O. 1978. Observaciones sobre Chordaria linearis (Hook. et Harv.) Cotton (Phaeophyta) y su desarrollo en cultivo. Darwiniana 21 (2-4): 331-342. Asensi, A. O. 1980. Observaciones sobre la alternancia de generaciones de dos algas pardas (Scytosiphon, Phaeophyta) de la región patagónica. Darwiniana 22 (4): 399-425. Asensi A., R. Delépine, F. Rousseau, B. de Reviers. 2004. Morphology and taxonomy of Adenocystis longissima (Skottsberg) stat. nov. (Phaeophyceae) from subantarctic South America. Polar Biol (2004) 28: 82–91 Asensi, A. O., Garrone, D. 1973. Una nueva especie de alga parda para Argentina (Acinetospora, Phaeophyta). Bol. Soc. Arg. Bot. 15 (2-3): 277-280. Asensi, A. O., Gonçalves Carralves, M. 1972. Una nueva especie de alga parda: Desmarestia patagonica Asensi sp. nov. (Phaeophyta, Desmarestiales). Darwiniana 17: 378-383. 104 Asensi, A. O.; Küpper, F. C. 2012. Seasonal periodicity and reproduction of brown algae (Phaeophyceae) at Puerto Deseado (Patagonia). Botanica Marina 55(3): 217-228. Asensi, A. O.; de Reviers, B. 2009. Illustrated catalogue of types of species historically assigned to Lessonia (Laminariales, Phaeophyceae) preserved at PC, including a taxonomic study of three South American species with a description of L. searlesiana sp. nov. and a new lectotypification of L. flavicans. Cryptogamie, Algol. 30 (3):209-249.Boraso, A. L.; Negri, R. 1997. Presencia de Sporochnus pedunculatus (Sporochnales, Phaeophycophyta) en la costa argentina. Physis secc.A, 54: 126-127 Cabrera, S. M. 1968. Bachelotia antillarum (Grun.) Gerloff en Argentina (Phaeophyta, Ectocarpaceae). Rev. Mus. La Plata (n.s.) Bot. 11: 17-22. Cabrera, S. M. 1970 a. Sobre el ciclo biológico de Giffordia mitchellae (Harvey) Hamel (Phaeophyta, Ectocarpales). Bol. Soc. Arg. Bot. 13 (1): 31-41. Casas, G. N.; Piriz, M. L.; Parodi, E. R. 2008. Population features of the invasive kelp Undaria pinnatifida (Phaeophyceae, Laminariales) in Nuevo Gulf (Patagonia, Argentina). Journal of the Marine Biological Association of the United Kingdom 88(1):21–28. Clayton M. N. 1975. A study of variation in Australian species of Colpomenia (Phaeophyta, Scytosiphonales) Phycologia 14:187-195. Clayton, M. N.1986. Culture studies on the life history of Scytothamnus australis and Scytothamnus fasciculatus (Phaeophyta) with electron microscope observations on sporogenesis and gametogenesis. BR.-PHYCOL.-J. 1986. 21 ( 4) : 371-386. Delépine, R.; Asensi A. O. 1975. Asteronema nov. gen. nouveau genre de Phéophycée australe. Bull. Soc. Bot. France 122 (7-8): 295-304. Delépine, R., Asensi, A. O. 1976. Quelques données espérimentales su l écophysiologie de Durvillea antarctica (Cham.) Hariot (Phéophycées). Bull. Phycol. France, 21:65-80 Delépine, R.; Asensi, A. O.; G. Guglielmi. 1976. Nouveaux types d' ultrastructure plastidiale chez les Phéophycées. Phycologia 15: 425-434. Doty, M. S. 1947. The marine algae of Oregon. Part I. Chlorophyta and Phaeophyta. Farlowia 3: 1-65, Plates 1-10. Escobar, J. 1997 Presencia de Microzonia velutina (Harvey) J. Agardh en las costas del Chubut, Argentina. Naturalia patagónica, Serie Ciencias Biológicas 5(1-2): 117-120 Gauna, M. C.; Parodi, E. R.; Cáceres, E. J. 2008. Epi-endophytic symbiosis between Laminariocolaxaecidioides (Ectocarpales, Phaeophyceae) and Undaria pinnatifida (Laminariales, Phaeophyceae) growing on argentinian coasts. Journal of Applied Phycology 21:11-18. Gauna, M. C., Parodi, E. R.; Cáceres, E. J. 2009. The occurrence of Laminarionema elsbetiae (Phaeophyceae) on Rhodymenia pseudopalmata (Rhodophyta) from the patagonian coasts of Argentina: Characteristics of the relationship in natural and experimental infections, and morphology of the epi-endophyte in unialgal free cultures, Algae (Corea) 24(4): 249-256 Gauna, M. C.; Parodi, E. R. 2010. Life cycle of Punctaria latifolia (Punctariaceae, Phaeophyceae) from Buenos Aires, South America. Algological Studies 134:55-66. Guiry, M. D.; Guiry, G. M. 2003- 2012. AlgaeBase. World-wide electronic publication, National University of Ireland, Galway. http://www.algaebase.org. Hamel, G. 1939. Phéophycées de France. Fasc. V. pp. i-xlvii + 337-432, Figs. 56-60, 10 plates Paris. Hariot, P. 1889. Algues. En Mission Scientifique du Cap Horn (1882-83). Bot. 5: 1-109, 9 pl. Howe, M. A. 1914. Marine Algae of Perú. Mem Torrey Bot. Club. 15: 1-180. Keum, Y. S; J. H. Oak, S. G.A. Draisma; W. F. Prud’homme van Reine & I. K. Lee, 2005. Taxonomic Reappraisal of Sphacelaria rigidula and S. fusca (Sphacelariales, Phaeophyceae) Based on Morphology and Molecular Data with Special Reference to S. didichotoma. Algae 20(1): 1-13. Kogame, K & Y. Yamagishi 1997 The life history and phenology of Colpomenia peregrina (Scytosiphonales, Phaeophyceae) from Japan. Phycologia 36 (5): 337-344. 105 Kuckuk, P. 1986. Bemerkungen zur marinen Algenvegetation von Helgoland (ii). Aus der Biologischen Anstalt auf Helgoland: 374- 400, 21 pl. Lamb, I.; Zimmermann, M.H. 1977. Benthic marine algae of the Antarctic Peninsula. A preliminary guide to the commoner benthic marine algae of the antarctic Peninsula and adjacent Islands. Biology of the Antarctic Seas 5. Antartic Res. Ser. 23: 129-229. Lindauer, V. W.; Chapman, V. J.; Aiken, M. 1961. The marine algae of New Zealand. II. Phaeophyceae. Nova Hedwigia 3 (2/3): 350 p + 41 pl. Müller, D. G.; Parodi, E. 1994 Asteronema rhodochortonoides nov. comb. (Ectocarpales, Phaeophyceae) A newly recognized taxon with stellate chloroplast arrangement. Phycologia 1994 vol. 33, no. 6, pp. 471-474 Nelson, W. A. (1982). Morphology, anatomy and systematic position of Caepidium antarcticum J. Ag. (Phaeophyta). Botanica Marina 25: 371-379 Papenfuss, G. F. 1964. Catalogue and bibliography of antarctic and subantarctic benthic marine algae. Antarctic. Res. Ser. American Geophys. Union 1: 1-76. Peters, A.F. (1992). Culture studies on the life history of Dictyosiphon hirsutus (Dictyosiphonales, Phaeophycee) from South America. British Phycological Journal 27: 177-183. Parodi, E. R.; Müller, D. G. 1994. Field and culture studies on virus infections in Hincksia hincksiae and Ectocarpus fasciculatus (Ectocarpales, Phaeophyceae). European Journal of Phycology. 29:113-117 Pérez, L. 2001. Chordariales en Punta Maqueda. Tesis de Maestría en Ecología Marina Bentónica (FCN-UNPSJB). Pérez, L. B.; Boraso de Zaixso, A. L. 2003. Ciclo de vida in vitro de Myriogloia major (Phaeophyta, Chordariales). Boletín de la Sociedad Argentina de Botánica. 38 (34): 233-240. Peters, A. F. 1991. Field and culture species of Streblonema macrocystis sp. nov. (Ectocarpales, Phaeophyceae) from Chile, a sexual endophyte of giant kelp. Phycologia 30 (4): 365-377. Peters, A. F.; Clayton, M. N. 1998. Molecular and morphological investigations of three brown algal genera with stellate plastids. evidence for Scytothamnales ord. nov. (Phaeophyceae) Phycologia 37 (2):106 Ponce, N. M. A.; Leonardi, P. I.; Flores, M. L.; Stortz, C. A.; Rodriguez M. A. C. (2007) Polysaccharide localization in the sporophyte cell wall of Adenocystis utricularis (Ectocarpales s.l., Phaeophyceae) Phycologia 46 (6): 675–679 Quartino, M. L.; Boraso de Zaixso,A. L. 1996. Leathesia difformis en Pta. Este, Chubut, Argentina. Rev. Bras. Biol. 56 (1): 139-14. Quartino, M .L.; Zaixso, H. E.; Boraso de Zaixso, A. L. 2005. Biological and environmental characterization of marine macroalgal assemblages in Potter Cove, South Shetland Islands, Antarctica. Botanica Marina 48: 187-197. Ramírez, M.E. Müller, D & & Peters, A. 1986.Llife history and taxonomy of two populations of ligulate Desmarestia (Phaeophyceae) from Chile. Canad. J. Bot. 64: 2948-2954. Ramírez, M. E.; Peters, A. F. 1993. The South American species of Desmarestia (Phaeophyceae). Canadian Journal of Botany 70: 2430-2445. Reinsch, P. F. 1890. Zur Meeresalgenflora von Süd-Georgia. En G. Neumayer, Die Internat. Polarforschung 1882-1883. Die deutsch. Exped. 2 (15): 366-454. Ricker, R.W. 1987. Taxonomy and biogeography of Macquarie Island Seaweeds. British Museum (Nat..Hist.) London, 344p., 126 figs. Sar, E., Pascual, M., Parma, A. 1984. Consideraciones ecológicas sobre las algas del litoral rocoso bonaerense. Rev. Mus. de La Plata (n.s.) Botánica 13 (75): 143-147. Scrosati, R. A. 1991. Estudios anatómicos en Lessonia vadosa (Phaeophyta, Laminariales) de la Argentina. Bol. Soc. Arg. Bot. 27 (3-4): 165-171. Scrosati, R. A. 1992. Morfología y anatomía de Desmarestia ligulata de Argentina y D. menziesiii de Antártida (Phaeophyta). Physis 47: 89-98. Searles, R. B. 1978. The genus Lessonia Bory (Phaeophyta, Laminariales) in southern Chile and Argentina. Br. Phycol. J. 13: 361-381. Silberfeld, T.; Racault, M. F. L. P.; Fletcher, R. .L.; Couloux, A.; Rousseau, F.; De Reviers, B. 2011.Systematics and evolutionary history of pyrenoid-bearing taxa in brown algae (Phaeophyceae). European Journal of Phycology 46(4): 361-377. 106 Skottsberg, C. 1907. Zur Kenntnis der subantarktischen und antarktischen Meeresalgen. I. Phaeophyceen. En O. Nordenskjöld, Wiss. Ergeb. schwed. südp. Exped. 19011903. Stockholm. 4: 1 (6): 172 p., 187 figs., 10 pls., 1 map. Skottsberg, C. 1921. Marine Algae. I. Phaeophyceae. En Botan. Ergebn. der schwed. Expedition nach Patagonien und dem Feuerlande 1907-1909. VIII. K. Svenska. Vetenkapasakad. Handlingar. Stockholm. 61 (11): 56 p., 20 fig. Skottsberg, C.; Neushul, M. 1960. Phyllogigas and Himantothallus. Antarctic Phaeophyceae. Botanica Marina 2 (1-2): 164-173. Stache-Crain, B., Müller, D. G.; Goff, L. J. (1997). Molecular systematics of Ectocarpus and Kuckuckia (Ectocarpales, Phaeophyceae) inferred from phylogenetic analysis of nuclear- and plastid-encoded DNA sequences. Journal of Phycology 33: 152-168. Tan, I. H.; Druehl, L. D. 1995. Phylogenetic relationships among the brown algal (Phaeophycean) orders: Analysis of 18S ribosomal DNA sequence data. Journal of Phycology. 31, no. Suppl. 3 Tan, I. H.; Druehl, L. D. 1996 A ribosomal DNA phylogeny supports the close evolutionary relationships among the Sporochnales, Desmarestiales, and Laminariales (Phaeophyceae) Journal of Phycology 32 (1):112-118 Waern, M. 1952. Rocky shore algae of the Öregrund Archipelago. Acta Phytogeographyca Suecica 10: 228 p. Womersley, H. B. S. 1987. The Marine benthic flora of Southern Australia, Part II. South Australian. D. J. Woolman, Government Printing Division, Adelaide, South Australia, 484 p. Wiencke, C.; Clayton, M. N. 2002. Antarctic seaweeds. In J.W. Wägele. Synopses of the antarctic benthos. vol. 9. 237 p. A.R.G. Gantner Verlag KG Ruggell/Lichtenstein. Wynne, M. J. 1969. Life history and systematic studies of some Pacific North American Phaeophyceae (brown algae).University of California Publications in Botany 50:188. Wynne, M. J. 1982. Phaeophyceae. In Synopsis and Classification of Living organisms. E.S. Parker Ed: 115-125. Mc.Graw Hill. Yoon, H. S.; Lee, J. Y; Boo, S. M.; Bhattacharya, D. 2001. Phylogeny of Alariaceae, Laminariaceae, and Lessoniaceae (Phaeophyceae) Based on plastid-encoded RuBisCo Spacer and nuclear-encoded ITS sequence comparisons. Molecular Phylogenetics and Evolution 21: 231-243. 107 108 109 Capítulo 5 ALGAS ROJAS (I) Las antiguas Bangiaceae En el ordenamiento de los taxa de Rhodophycophyta se ha seguido a la base de datos de Guiry& Guiry (2006- ); Freshwater et al. (1994) y Saunders & Hommersand (2004). De acuerdo a estos estudios, las Porphyridiales, Compsopogonales y Bangiales, órdenes usualmente agrupados en la clase Bangiaceae aparecen como una línea polifilética, y han sido re- ordenados en las clases: Rhodellophyceae, que abarca los órdenes Porphyridiales y Stylonematales, la clase Compsopogonophyceae, abarcando a Erythropeltidales y Composopogonales y la clase Bangiophyceae, correspondiente al orden Bangiales en sentido restringido. En estos grupos encontramos arqueotalos y ptototalos relativamente sencillos: unicelulares, agregados celulares pseudofilamentosos, filamentos simples o ramificados y talos laminares de naturaleza polística. El crecimiento de los talos multicelulares puede ser apical o intercalar. Suelen llevar en cada célula un rodoplasto axial, estrellado, provisto de un pirenoide central prominente. En estos grupos encontramos varios tipos de elementos de reproducción: En Porphyropsis y Erythrotrichia se forman esporas a partir de una célula que se divide en dos partes desiguales por una pared curva; la porción más pequeña es el esporocisto, el cual libera su contenido, la célula grande puede agrandarse y repetir el proceso de división. En Asterocystis, Bangia, Erythrotrichia, Goniotrichum y Porphyra se forman monosporas a partir de células indiferenciadas, sin una división previa diferente a las vegetativas normales Y finalmente en Bangiaceae se encuentran las tradicionalmente denominadas “carposporas”, o más recientemente “zigosporas”, las que se forman por divisiones sucesivas de una célula madre. Las divisiones se dan en ángulo recto, en dos o tres planos para dar alrededor de 32 esporas. La célula madre de las esporas ha sido considerada como una gameta. Las esporas, denominadas alfa esporas por Conway son pigmentadas, al germinar producen un estado filamentoso, denominado conchocelis. En los mismos talos o en otros en las especies dioicas, se forman esporocistos que producen esporas incoloras, o menos coloreadas, cuya naturaleza sexual no ha sido probada, y que han sido interpretadas como espermacios. Órdenes, familias y géneros Clase Rhodellophyceae Orden Porphyridiales, Familia Porphyridiaceae: Porphyridium Nägeli Orden Stylonematales Familia Stylonemataceae: Stylonema Reinsch ; Chroodactylon Hansgirg (=Asterocytis Gobi) Clase Compsogonophyceae Orden Erythropeltidales Familia Erythrotrichiaceae: Sahlingia Kornmann; Erythrotrichia Areschoug Clase Bangiophyceae Orden Bangiales Familia Bangiaceae: Bangia Lyngbye; Pyropia J. Agardh ; Porphyra C. Agardh 110 Clase Rhodellophyceae Orden Porphyridiales, Familia Porphyridiaceae Porphyridium Nägeli Talo unicelular, Células solitarias o colonias irregulares dentro de una matriz mucilaginosa. Células desde esféricas antes de dividirse, hasta ligeramente elipsoidales. Rodoplasto axial estrellado con pirenoide central. El color de los rodoplastos varía con las especies. Porphyridium purpureum (Bory) Drew & Ross Lam 5-1-fig. 23: Forma agregaciones sobre otras algas. Las células son de subesféricas hasta ovoides, de unos 5-7 µm de diámetro. Presenta un rodoplasto de color rojo muy vivo con un pirenoide central. Es una especie tanto de agua dulce como marina. Referencias: Pujals (1963); Womersley (1994). Orden Stylonematales Familia Stylonemataceae Stylonema Reinsch Comprende talos microscópicos, formando pseudofilamentos simples o ramificados o láminas monostromáticas. Las células son esféricas o cilíndricas y están separadas por una mátrix gelatinosa. Poseen un rodoplasto estrellado axial con un pirenoide central. Posee ficoeritrina BII. No presenta sinapsis intercelulares y crece inicialmente por divisiones apicales y luego por divisiones intercalares, se adhiere por células poco modificadas. Se reproduce a través de arqueosporas sin pared celular, formadas a partir de células individuales vegetativas, sin división celular especial. Reproducción sexual desconocida. Crece usualmente epífita o epizoica desde el submareal superior hasta a 40 m de profundidad. Este género cosmopolita fue conocido por varias décadas como Goniotrichum. Stylonema alsidii (Zanardini) Drew Lam 5-1-fig. 1 Filamentos uniseriados, rojo - violáceos, delgados, ramificados pseudodicotómicamente, células desde esféricas a cilíndricas en una fila regular, de 12-20 µm de diámetro. Rodoplasto estrellado, axial, con un pirenoide. Referencias: Boraso & Zaixso (2007). Stylonema cornu cervi Reinsch Talos de hasta 200 µm de longitud, simples o con pocas dicotomías, formados por una o varias filas irregulares de células esféricas separadas, de unos 10 µm de diámetro y con paredes gruesas, con rodoplasto verde azulado y un pirenoide. Epífita sobre Aphanocladia robusta en Chubut, Golfo San José. Referencias: Womersley (1994). Chroodactylon Hansgirg Talo formado por filamentos simples o con muy escasas ramificaciones. Células con un rodoplasto verde azulado, con un pirenoide central. Su reproducción es por monosporas. Especies marinas y de agua dulce. Referencias: Pujals (1961). Chroodactylon ornatum (C. Agardh) Bason Talos diminutos epífitos de pocos milímetros de alto sin célula basal. Filamentos de 5 a 8 micras de diámetro. Referencias: Pujals (1961) (como Asterocystis ornata (C. Agardh) Hamel; Womersley (1994). 111 Clase Compsogonophyceae Orden Erythropeltidales Familia Erythrotrichiaceae Abarca talos desde uniseriados hasta laminares. La reproducción es asexual, por monosporas formadas por división no equitativa de células vegetativas. La presencia de zigosporas es desconocida o dudosa. Sahlingia Kornmann Talos microscópicos, usualmente epífitos, formado por discos monostromáticos compuestos por filamentos uniseriados ramificados reptantes que crecen radialmente. Los discos pueden llegar a elevarse en el centro. Células con un rodoplasto laminar parietal, o varios en otras descripciones,con un pirenoide. Reproducción asexual por monosporas producidas en las porciones más viejas del talo por división en dos de una célula vegetativa; reproducción sexual desconocida. Referencias: Guiry & Guiry (2012). Sahlingia subintegra (Rosenvinge) Kornman Lam 5-1-figs. 6-8 Talo discoide, de hasta 125 µm de diámetro, con los bordes enteros, formado por filamentos reptantes de células alargadas, de 3 -5 µm de diámetro y con células marginales usualmente bifurcadas. Se encuentra frecuentemente sobre Ulva. Referencias: Boraso & Zaixso (2007). Erythrotrichia Areschoug Talos erectos, de hasta unos pocos milímetros, uniseriados por lo menos en la base, arriba uniseriados, multiseriados o ligeramente foliosos, adheridos al sustrato por una célula basal, o por un disco, o por filamentos rizoidales descendentes cortos. Porción erecta usualmente no ramificada y con ápice cilíndrico o aplanado. Cada célula lleva un rodoplasto estrellado con un pirenoide central. Las monosporas se separan de la célula vegetativa por una pared curva. La posibilidad de la reproducción sexual ha sido señalada a partir de la observación de estructuras que serían carpogonios poco modificados, con corto tricogino, de células que se cortan externamente a los filamentos, las que podrían ser espermacios y la formación de esporas que se interpretaron como carposporas. Erythrotrichia carnea (Dillwyn) J. Agardh Lam 5-1-figs. 2-5 Filamentos epífitos desde uniseriados erectos, de 10-25 µm de diámetro, hasta formas más robustas uniseriadas o multiseriada y con células encimadas entre sí hacia el ápice. Con una célula basal con rizoides cortos. Las células presentan un rodoplasto estrellado y con un pirenoide central, mostrando en las formas más robustas largos brazos finos que llegan a las paredes celulares. Referencias:; Boraso & Zaixso (2007). Clase Bangiophyceae Orden Bangiales Familia Bangiaceae Talos cilíndricos, filamentosos o laminares, adheridos por un disco basal rizoidal. Células uninucleadas, con arqueoplastidio consistente en un rodoplasto estrellado central con un pirenoide. Sinapsis intercelulares faltantes en los talos macroscópicos, a veces presentes en las fases microscópicas. Crecimiento intercalar. Reproducción asexual por monosporas, las que pueden presentar una fase ameboide y luego se fijan dando rizoides y un filamento erecto o láminitas. Reproducción sexual dudosa a partir de presuntos espermacios y zigosporas. Estas últimas dando lugar a una fase microscópica filamentosa postrada y reptante, (estado conchocelis) que vive endofita en sustratos calcáreos y se reproduce por monosporas (conchosporas) que nacen en ramas fértiles engrosadas, las cuales pueden dar el talo erecto o repetir el filamentoso. 112 Bangia Lyngbye Talos filamentosos formando mechones o céspedes color rojo ladrillo, filamentos uniseriados al principio, multiseriados y cilíndricos luego con divisiones celulares en uno o varios planos, no ramificados. Células cilíndricas, cúbicas o poliédricas embebidas en una matriz gelatinosa. Se adhiere por rizoides descendientes originados en las células cercanas a la base. Capuchas de las sinapsis intercelulares uniestratificadas. Rodoplastos axiales estrellados y con un pirenoide prominente. Reproducción asexual y presuntamente sexual en las porciones apicales. Por división de las células vegetativas en dos a cuatro células se forman células que funcionan como esporas. Presuntos espermacios incoloros en número de 32 a 128 y zigosporas de color rojo brillante, en número de 8 a 16, son formados por divisiones de las células vegetativas en tres planos. Las zigosporas producen estados conchocelis, los que dan conchosporas que germinan en los talos gametofíticos. Bangia atropurpurea (Roth) C. Agardh Filamentos simples, desde haplósticos hasta polísticos y cilíndricos color pardo violáceo, adheridos al sustrato por uno a varios rizoides basales. Monosporas (1-4 por célula); espermacios (hasta 128 por célula) y zigosporas (hasta 16 por célula). Referencias: Mendoza (1970c). Pyropia J Agardh y Porphyra C. Agardh Estos dos géneros han sido diferenciados en base a estudios moleculares preliminares (Sutherland et al., 2011). Ambos comprenden talos macroscópicos laminares, monostromáticos o distromáticos, con un disco de adhesión basal rizoidal. Células incluídas en una mátrix gelatinosa firme. Rodoplastos 1- 2, axiales, estrellados, con un pirenoide central. Talos monoicos o dioicos. Espermacios y zigosporas en paquetes, en áreas marginales o submarginales. El número de espermacios y de zigosporas se indica como a x b x c, donde a y b es el número de esporas del paquete observables en vista superficial y c es el número de capas de zigosporas, observable en corte transversal del talo, este criterio se conoce como fórmula de Hus. Fase microscópica diploide Conchocelis perenne, creciendo comunmente en conchilla de moluscos. Reproducción asexual de ambas fases por arqueosporas y aplanosporas. Referencias: Guiry & Guiry (2013). En Argentina solo se han citado especies monostromáticas y con un solo rodoplasto por célula. La especie más abundante de este grupo es Pyropia columbina. (Basónimo: Porphyra columbina Montagne). Pyropia columbina (Montagne) W. A. Nelson in Sutherland et al. Lam 5-1-figs. 10-21 Talos monostromáticos de color pardo amarillento a púrpura, más rojizos al secarse. Desde lanceolados, de bordes lisos u ondulados cuando jóvenes hasta arrepollados en la senectud, los que en general no superan los 15 cm de alto, aunque pueden encontrarse ocasionalmente talos hasta de 40 cm. Grosor del talo muy variable, entre 55 y 150 µm, generalmente entre 60 y 100 µm, el cual depende de la edad y del grado de desecación al que están expuestas los talos. Los talos jóvenes son más delgados, con alto celular menor y paredes más delgadas y en las zonas fértiles el talo es más grueso, en promedio entre 80 - 100 µm. En las zonas basales se desarrollan rizoides abundantes. Las células vegetativas miden de 8-19 µm de diámetro y 10-35 µm de alto, mostrando tendencia a arreglarse circularmente en zonas no muy extensas. Los talos son monoicos; los espermacios se forman primero, formando en el borde una franja color blanco - amarillento, agrupados en paquetes de hasta 64 - 128 (a/2 b/4-8 c/8), estos de 2-8 µm de diámetro, sin células vegetativas intercaladas entre los paquetes de espermacios. Las zigosporas se ubican por dentro de la franja continua de espermacios; a medida que los elementos de reproducción son liberados comenzando desde el borde, las zigosporas quedan en manchas intercaladas con zonas de espermacios, con células vegetativas entre los paquetes de zigosporas. Paquetes de zigosporas, apretados, de color rojo vivo, de unos 113 15-25 µm de diámetro en vista superficial y 40-50 µm de alto en corte, formados por hasta 32- 64 zigosporas, éstas de 5-14 µm de diámetro (a/2 b/2-4 c/8), las zigosporas se observan normalmente en corte como dos paquetes superpuestos. Referencias: Boraso de Zaixso & Zaixso (1998); Boraso & Zaixso (2007). Porphyra linearis Greville Lam 5-1-fig. 22: Talo delgado, de unos 40 µm de grosor, acintado, de hasta 25 cm de largo por 2 cm de ancho, borde poco ondulado, con la zona de hapterio bien definida, algo umbilicada. Color rojo violáceo a púrpura. Células vegetativas de paredes no engrosadas, poligonales, con rodoplasto axial, de 8-10 µm de diámetro por 22-24 µm de alto. Presentaría talos monoicos y dioicos, con zigosporas por todo el talo, o solo en la mitad derecha o izquierda del mismo, en zonas algo más rojizas que la vegetativa. Zigosporas de 3-4 µm de diámetro, hasta 16 en paquetes de 20-25 µm de diámetro (a/2 b/2 c/4). Espermacios de alrededor de 2 µm de diámetro, hasta 64 en paquetes de 15-20 µm de diámetro (2/2 2-4/b 8/c), en el borde de color amarillento blanquecino del talo. Referencias: Kylin (1944); Piriz (1988); Boraso & Zaixso (2007). Porphyra pujalsiae (pujalsii) Coll & Oliveira Filho Talos saxícolas, delicados, orbiculares hasta cordiformes, de hasta 5 cm de ancho y 8 cm de largo, adhieren al papel. Color pardo purpúreo. Monostromáticas, talo de hasta 30-45 µm de grosor. Margen del talo con abundantes dientes microscópicos. Células vegetativas redondeadas en vista superficial con rodoplasto estrellado, de 5-10 µm de diámetro. Talosos monoicos con zigosporas y espermacios en una franja marginal delgada; 32 zigosporas (a/4; b/2; c/4) de alrededor de 8 µm cuando maduras y hasta 128 espermacios (a/4; b/4; c/4) en cada célula madre. Primera división para producir las zigosporas paralela a la superficie del talo, segunda división perpendicular, con lo que las zigosporas quedan en pares cruzados en ambas caras del talo. Monosporas presentes. Referencias: Coll & Oliveira filho (1976); Piriz (1981); Boraso & Zaixso (2007). Porphyra argentinensis Piriz, Talos saxícolas, lineales a lanceolados, frecuentemente furcados, varias láminas surgiendo juntas, 5-25 (30) cm de largo y 2-8 (-15) cm de ancho, umbilicadas, de borde liso. Pardo verdosas a amarillentos cuando vivas, púrpuras al ser fijadas en formol. Textura firme, adhieren bien al papel. Monostromáticas, de 35 - 70 µm de grosor, células de entre 10 y 20 µm de diámetro; dos veces tan altas como anchas en sección transversal. Un solo rodoplasto central con un pirenoide. Reproducción por aplanosporas producidas en el borde del talo (a/2-4; b/2-4; c/2), de unos 10 µm de diámetro al liberarse, con un rodoplasto con pirenoide central, dando lugar a una germinación bipolar que da directamente el talo erecto. Referencias: Piriz (1981). Porphyra woolhouseae (woolhousiae) Harvey; Fronde membranosa, monostromática, muy delicada, de unos (-12) 16- 20 (-25) µm de grosor, quebradiza cuando seca, rosado-brillante, lustrosa, lanceolada o falcada, cuneada en la base, simple o irregularmente hendida, de hasta 17 cm de largo y unos 4 cm de ancho. Con base rizoidal. Células vegetativas de 6-10 µm en el borde, 10-16 (-20) µm en las zonas más viejas, poligonales. Con zonas meristemáticas marginales en el talo con borde entero. Talos monoicos. Monosporas? solitarias, marginales de 12-17 µm ; espermacios de 2-4 µm en zonas delimitadas, delicuescentes en paquetes de (16) 32- 64. Epífita sobre Macrocystis u otras Phaeophyta y algunas Rhodophyta submareales. Referencias: Skottsberg (1923); Mendoza et al. (2005). 114 Lam. 5-1: fig. 1: Stylonema alsidii; figs. 2-5: Erythrotrichia carnea, 2: rodoplasto 3: filamento, 4: filamento uniseriado con inicio de ramita, 5: talo ramificado. Figs: 6-8: Sahlingia subintegra: 6 y 8: vista superficial, 7: en corte.; fig. 9: Bangia atropurpurea: figs. 10-21: Pyropia columbina: 10- 11: aspecto general, 12: monosporas en corte, 13-. 14: arqueosporas, 15: paquetes de carpospores entre células vegetativas y borde de espermatocistos.16: borde entre carpospores y espermacios, 17: detalle de zona con paquetes de espermatocistos, 18: rodoplastos 19-20: paquetes de carposporas en vista superficial y en corte, 21: aspecto de talos en el terreno, fig. 22: Porphyra linearis; fig. 23: Porphyridium purpureum 115 Para la zona antártica se ha citado Porphyra plocamiestris Ricker epífita sobre algas rojas. Referencias: Ricker (1987) y Porphyra endiviifolia (A. & E. S. Gepp) Chamberlain. Referencias: Ricker (1987); Lamb & Zimmerman (1977). Referencias bibliográficas del capítulo 5. Boraso de Zaixso, A. L.; Zaixso, J. M. 2007. Algas marinas bentónicas. En. Atlas de Sensibilidad ambiental del mar y de la costa. Demetrio Boltovskoy (Ed.) (PNUD). http://atlas.ambiente.gov.ar/tematicas/mt_02/macroalgas.htm Coll, J.; de Oliveira Filho, E. C. (1976). The genus Porphyra C. Ag. (Rhodophyta-Bangiales) in the American South Atlantic. II. Uruguayan species. Botanica Marina 19: 191196 Cormaci, M.; Furnari, G.; Scammacca, B. 1992. The benthic Algal flora of Terra Nova Bay (Ross Sea, Antarctica). Botanica Marina 35: 541- 552. Freshwater, D. W.; Fredericq, S.; Butler, B. S.; Hommersand, M. H.; Chase, M. W. 1994. A gene phylogeny of the red algae (Rhodophyta) based on plastid rbcL. Proc. Natl. Acad. Sci. USA 91 (15): 7281-7285 Guiry, M. D; Guiry, G. M. 2003-2013. AlgaeBase. World-wide electronic publication, National University of Ireland, Galway. http://www.algaebase.org; Kylin, H. 1944. Die Rhodophyceen der Schwedischen Westkuste. Lunds Univ. Arsskr. N.F. Avd. 2, 40(2), 104 p. 53 figs. 32 pls. Lamb, I.; Zimmermann, M.H. 1977. Benthic marine algae of the Antarctic Peninsula. A preliminary guide to the commoner benthic marine algae of the antarctic Peninsula and adjacent Islands. Biology of the Antarctic Seas 5. Antarctic Res. Ser. 23: 129229. Mendoza, M. L. 1970 c. Algunas observaciones y nuevas localidades de Bangia fuscopurpurea (Rhodophyta). Physis 30 (80): 283-290. Piriz, M. L. 1981. A new species and a new record of Porphyra (Bangiales, Rhodophyta) from Argentina. Botanica Marina 24: 599-602. Piriz, M. L. 1988. Porphyra linearis Grev. (Bangiales, Rhodophyta) a new record for Argentina. Physis sec. A 46 (110): 6. Pujals, C. 1961. Algunas observaciones sobre Asterocystis ramosa (C. Agardh) Hamel. Rodoficea nueva para Argentina. Darwiniana 12: 365-377. Pujals, C. 1963. Catálogo de Rhodophyta citadas para Argentina. Rev. Museo Argentino de Ciencias naturales Bernardino Rivadavia. ser. Cs. Bot. 3 (1): 1-139. Saunders, G. W., Hommersand, M. H. 2004. Assessing red algal supraordinal diversity and taxonomy in the context of contemporary systematic data. Am. J. Bot. 91: 14941507 Skottsberg, C. 1923. Marine Algae. 2. Rhodophyceae. En Botan. Ergebn. der Schwed. Expedition nach Patagonien und dem Feuerlande 1907-1909. IX. K. Svenska. Vetenkapasakad. Handlingar. Stockholm. 63 (8): 70 p., 29 figs. Sutherland, J. E.; Lindstrom, S. C.; Nelson, W. A.; Brodie, J.; Lynch, M . D.; Hwang, M. S.; Choi, H. G., Miyata, M.; Kikuchi, N.; Oliveira, M. C.; Farr, T.; Neefus, C.; MolsMortensen, A.; Milstein, D.; Müller, K. M. 2011. A new look at an ancient order: generic revision of the Bangiales (Rhodophyta). Journal of Phycology 47(5): 11311151. Womerley, H. B. S. 1994. The Marine benthic flora of Southern Australia, Part III A. Flora of Australia Supplementary series N° 1. Australian biological resources study. Canberra, 508 p. 116 Capítulo 6: Algas Rojas (II) Características generales de las Florídeas Las Florideophyta fueron consideradas durante mucho tiempo como monofiléticas a nivel de clase, pero actualmente se ha comprobado que abarcan varias líneas evolutivas que ameritan ser tratadas como sub clases separadas, por eso rescatamos para este apartado el antiguo nombre de Florídeas, sin valor taxonómico actual, pero presente en toda la literatura del grupo. Las algas rojas han ameritado esfuerzos especiales para abarcar su complejidad, pudiéndose destacar la obra de Kylin (1956) y Dixon (1970, 1973, 1982, 1992) y las contribuciones de Magne (1982); Peyriere (1981) y Pueschel (1985). En esta introducción sobre generalidades de algas rojas hemos extractado varios conceptos de Dixon (1973) y de Murray & Dixon (1992), adecuándolos en base a la nueva información disponible (Saunders & Hommersand, 2004). Las algas rojas difieren de los otros grupos de algas eucariotas en varios aspectos, uno de los más importantes es la presencia de los pigmentos solubles en agua, ficobilinas, con predominancia de la ficoeritrina. El almidón florideo que constituye la principal reserva está compuesto por un alfa 1:4 glicano similar a la fracción ramificada o amilopectina de los almidones de plantas vasculares. Un galactósido de glicerol, denominado floridósido, es muy frecuente en las Rhodophyta. En algunas Rhodomelaceae se encuentra ácido manoglicérico, laminitol, volemitol, sorbitol y dulcitol. La mayor parte de la pared está constituida de carbohidratos, con pequeñas cantidades de proteínas y lípidos. La porción externa de la pared es fácilmente soluble en agua, y está formadas por mucílagos, agares y carragenanos. En las porciones internas prevalecen los polisacáridos cristalinos. En las Corallinaceae y algunas Nemaliales, las paredes se encuentran total o parcialmente calcificadas. La forma cristalina del carbonato de calcio anhidro en Corallinaceae es la calcita, mientras que en Nemaliales, Batrachospermales y Peyssonnelia (Gigartinales) es la aragonita. En las células jóvenes el citoplasma es denso y viscoso, a medida que la célula aumenta en volumen el contenido se vuelve vacuolado, quedando el citoplasma y las organelas ubicados en la célula madura en una película delgada entre el tonoplasto y la membrana celular. En algunas Florídeas (Rhodymeniophycidae, Nemaliophycidae) las células permanecen uninucleadas en tanto que en otras, a medida que el talo madura aumenta el número de núcleos por célula, debido a las repetidas cariocinesis no acompañadas de citocinesis. Los rizoides de fijación pueden formar un disco o zona basal de adhesión. a veces una célula puede modificarse formando un hapterio dendroide con amplia superficie de fijación Las estructuras de adhesión laterales pueden ser también multicelulares y masivas, formadas por muchos rizoides y asociadas a un hábito estolonífero y a cierta capacidad de propagación vegetativa. En las Nemaliales los rodoplastos de las células jóvenes suelen verse axiales, a medida que éstas maduran, los brazos o proyecciones del rodoplasto estrellado se alargan y se distribuyen sobre las paredes celulares, parietalizando el contenido y modificando así su aspecto. Los pirenoides parecen estar confinados a los órdenes de Bangiofíceas y a las Nemaliales, en tanto que los rodoplastos tipo neoplastidio (Polysiphonia) se encuentran en la mayor parte de los órdenes de Florídeas. En las células jóvenes suele en general existir un solo rodoplasto, el cual a medida que la célula crece pueden eventualmente dar lugar a varios plastos discoides o en 117 forma de banda. A través de la microscopía óptica es posible observar en las Florídeas, la presencia en los septos entre células adyacentes de puntos conspicuos, aparentemente ocupados por citoplasma, a los que se denominó "pit connections" en la literatura sajona y “synapses” en la escuela francesa. La microscopía electrónica ha mostrado que su ultraestructura es de naturaleza compleja, asimilable a un tapón intercelular (pit plug) (bouchon synaptique) (Peyriere ,1981; Pueschel, 1985). De todas las traducciones posibles al idioma español de estos términos hemos adoptado para este texto la propuesta de Mendoza (2003) quien utiliza “sinapsis intercelular primaria” y “sinapsis intercelular secundaria” y, en donde se requiere dar detalle de la ultraestructura se propone el uso en castellano de “tapon sináptico”. En las Bangioficeas solo se han observado estructuras asimilables a las sinapsis intercelulares en las fases conchocelis de Bangia y Porphyra. Las sinapsis intercelulares de algunas Florídeas pueden tener además capuchas externas, con forma de domo o de placa, pudiéndose diferenciar dos linajes de acuerdo a la estructura del tapón intercelular: 1. Con sinapsis intercelulares en las que el tapón sináptico intercelular está provisto externamente con un domo o con una placa (outer cap layers: OCLs), incluyendo a los órdenes: Acrochaetiales, Palmariales, Nemaliales y Corallinales con placa, y Rhodogorgonales y Batrachospermales con domo. 2. Con sinapsis intercelulares en las que en el tapón sináptico intercelular, las capas internas (ICLs) se pierden secundariamente, incluyendo a Ahnfeltiales, Ceramiales, Bonnemaisoniales, Gigartinales, Gracilariales, Rhodymeniales, y quizás a las Gelidiales. Las sinapsis intercelulares primarias son los que se forman al dar una célula lugar a otra por división. Las sinapsis intercelulares secundarias aparecen entre células de diferente linaje, estando este proceso frecuentemente asociado a transferencia de núcleos. También se producen sinapsis secundarias entre células de parásitos y sus huéspedes. No se han observado sinapsis secundarias en Nemaliales, ni en Ceramiaceae, ni en los conchocelis de Bangiales. Anatomía de los talos En las Florídeas se encuentran talos con varios niveles de organización, pero siempre de naturaleza haplóstica, encontrándose filamentos uniseriados simples, filamentos uniseriados ramificados, talos con heterotrichia primaria o cladomas uniaxiales o multiaxiales. La adhesión lateral de los filamentos produce talos pseudo-parenquimatosos erectos o postrados, o con porciones erectas y postradas (heterotrichia secundaria). Variaciones sobre estos tipos básicos pueden darse por reducción de alguna de las porciones, ahuecamiento de los talos o crecimiento intercalar. Los ejemplos más claros de crecimiento intercalar se dan en Corallinales y Delesseriaceae. Las células meristemáticas, a través de cuya división crece el talo suelen ser apicales, aunque la capacidad de dividirse para dar nuevas ramificaciones o alargar las existentes puede encontrarse tambien en células no apicales, dependiendo la morfología final del talo del equilibrio entre ambos tipos de crecimiento. Es muy frecuente en la literatura encontrar descripciones de talos masivos de las Rhodophyta con referencias a una corteza y una médula, si bien esta diferenciación puede resultar útil para diferenciar entidades usando una clave de identificación se debe recordar que en realidad no existe en Rhodophyta tal diferenciación desde el punto de vista de las etapas de formación del talo, ya que lo que se observa como corteza cerca de los ápices, puede pasar con el tiempo a ser, parte de la médula en las partes inferiores del talo. Reproducción y ciclo de vida La reproducción sexual en Rhodophyta es una oogamia, donde la gameta 118 femenina inmóvil, el carpogonio, presenta una base algo inflada y está provista de un proceso alargado, el tricogino. El carpogonio es fecundado por un espermacio no flagelado que se adhiere al extremo del tricogino, el cual, en los talos masivos, sale al exterior por entre el tejido del gametofito femenino Los carpogonios suelen formarse en las zonas de crecimiento activo del talo, sobre ramas especiales. Las ramas carpogoniales son reconocibles usualmente desde el comienzo de su formación por el contenido celular homogéneo y sin rodoplastos de sus células y por su rápida tinción. En las Nemaliales las diferencias con las células vegetativas son mínimas y los carpogonios son considerados sésiles sobre ramas vegetativas. El número de células de cada rama, la presencia o no de células o ramas accesorias y el número de carpogonios por rama carpogonial son más o menos característicos de cada grupo taxonómico. El producto diploide de la fecundación es un tejido que queda retenido dentro del tejido del gametofito femenino denominado "gonimoblasto". El que puede formarse directamente de la cigota o luego de que el núcleo diploide de la misma haya sido transferido a una célula auxiliar. Células auxiliares se encuentran en líneas evolutivas alejadas entre sí, en las Corallinales, Ceramiales, Gigartinales, Rhodymeniales, Plocamiales, Gracilariales y Halymeniales, lo que sugiere que han surgido independientemente varias veces en las Florídeas Mientras en los grupos presuntamente menos evolucionados. el desarrollo de tejido diploide procede directamente a partir del carpogonio fecundado, en los más evolucionados existen transferencias del núcleo diploide a otras células del gametofito según varios esquemas diferentes. El origen de la célula auxiliar es característico para cada grupo; en algunos casos existe el denominado procarpo, formado por ramas asociadas a la rama carpogonial, sobre las cuales se encuentran las células auxiliares. Existe procarpo en muchas Gigartinales y Criptonemiales, en Corallinales y en todas las Rhodymeniales y Ceramiales. El gonimoblasto, junto con los carposporocistos que luego diferencian, se interpretan como una generación asexual parásita; las esporas mitóticas que produce se denominan carposporas. En Rhodophysema elegans y en las Palmariales esta generación está ausente y en Audouinella simplex está reducido a una sola célula, la esporocigota. El tetrasporofito es normalmente un talo macroscópico independiente, erecto o postrado, pero también puede en algunos casos quedar retenidos en el tejido gametofítico con la consiguiente reducción en tamaño y complejidad. En cualquiera de estos casos se produce en los tetrasporofitos la meiosis en esporocistos denominados tetrasporocistos, con la consiguiente formación de tetrasporas, las cuales al germinar dan lugar al gametofito. Estrucuras homólogas a los tetrasporocistos son los bisporocistos y los polisporocistos. Los primordios para la formación de los tetrasporocistos son siempre uninucleados. Los tetrasporocistos pueden ser zonados, tetraédricos o cruciados Hay que tener en cuenta que el simple desconocimiento de la existencia de las fases gametofíticas en una Rhodophyta no implica su inexistencia, porque son varios los casos en que han sido encontradas como talos costrosos o microscópicos. Se ha señalado que existe en las algas rojas una tendencia a la amplificación de la cigota, probablemente como forma de compensación de la falta de elementos reproductivos flagelados. Esta amplificación procede en dos etapas, primeramente la formación de una generación mitospórica o carposporofito, parásito del gametofito femenino, y luego la formación, a partir de las carposporas de un tetrasporofito en un talo independiente (ciclo trifásico o tipo Polysiphonia) o más o menos dependiente del gametofito según los ciclos de vida (ciclos difásicos). El ciclo trigenético típico es el ciclo exclusivo de Ceramiales, Corallinales, Gelidiales y Gracilariales y está también presente en muchas Gigartinales y Rhodymeniales 119 La alternancia de gametofitos-carposporofitos y tetrasporofitos con gametofitos de menor tamaño se encuentra en Acrochaetiales. La alternancia de gametofitos-carposporofitos con tetrasporofitos más pequeños, crustosos o filamentosos está ejemplificada por Bonnemaisonia hamifera. La alternancia de gametofitos-carposporofitos con una sola fase independiente se encuentra en Liagora tetrasporifera - Palmaria, Rhodophysema elegans, etc. Reciclado de tetrasporofitos o de-carposporofitos: se encuentra en diversas especies, especialmente en las zonas marginales de la distribución de las especies. En el ordenamiento de los taxa de Florídeas se ha seguido el esquema utilizado en la base de datos de Guiry & Guiry (2012), relacionado con las propuestas de Saunders & Hommersand (2004). Freshwater et al. (1994), utilizando la secuencia del gen rbcl plastídico, el cual codifica para la subunidad mayor de la 1-5 bifosfato carboxilasa/oxigenasa (RubisCO) pudieron proponer una primera filogenia de las algas rojas, que fue luego completándose con estudios más detallados sobre Gigartinales (Hommersand et al., 1993), Halymeniales (Saunders & Kraft. 1996); Rhodymeniales (Saunders et al., 1999) y Balliales (Choi et al., 2000). Harper & Saunders (1998, 2001) discuten en base a taxonomía molecular la ubicación de los órdenes de algas rojas, tradicionalmente conocidos como la clase Florideophyceae, afirmándose la posición separada de Hildenbrandia, como Hildenbrandiophycidae, la relativa cercanía de Balliales por un lado y Corallinales por otro, a las Palmariales, Nemaliales y Acrochaetiales, agrupados actualmente en Nemaliophycidae y la existencia de un conjunto de órdenes abarcando Gelidiales, Gracilariales, Gigartinales, Plocamiales, Cryptonemiales, Ceramiales y Bonnmaissoniales, actualmente agrupados en Rhodymeniophycidae con las Ahnfeltiophycidae separadas de las mismas como un grupo hermano. Zuccarello & West, (2006) han trabajado en Rhodomelaceae. Saunders & Hommersand (2004) elaboraron una nueva versión general en, que sigue completándose hasta la actualidad. Subclases, órdenes y familias Subclase Ahnfeltiophycidae: Ahnfeltia Fries Subclase Hildenbrandiophycidae: Hildenbrandia Nardo Subclase Nemaliophycidae Orden Acrochaetiales Familia Acrochaetiaceae: Acrochaetium Nägeli; Rhodochorton Nägeli; Camontagnea Pujals. Orden Colaconematales Familia Colaconemataceae Colaconema Batters. Orden Palmariales Familia Palmariaceae : Palmaria Stackhouse Familia Rhodothamniellaceae: Rhodothamniella Feldman. Familia Meiodiscaceae: Rubrointrusa S.L. Clayden & G.W. Saunders. Orden Nemalionales Familia Helminthocladiaceae: Nemalion Duby Familia Galaxauraceae (=Chaetangiaceae): Nothogenia Montagne Orden Balliales: Ballia Harvey Subclase Corallinophycidae Orden Corallinales Familia Corallinaceae: Corallina L.; Bossiella; Jania Lamouroux. Hydrolithon Foslie; Spongites Kützing ; Pneophyllum Kützing ; Neogoniolithon Setchell & Mason; Phymatholithon Foslie. Titanoderma Nägeli.; Pseudolytophyllum (Lemoine) emend Mendoza y Cabioch. 120 Familia Hapalidiaceae:Clathromorphum Foslie.; Lithothamnion Heydrich Mesophyllum Lemoine emend Woelkerling & Irving; Synarthrophyton Townsend amend May & Woelkerling. Subclase Rhodymeniophycidae Orden Gelidiales Familia Gelidiellaceae: Gelidiella Feldmann & Hamel. Familia Gelidiaceae: Gelidium Lam.; Pterocladiella Santelices & Hommersand Orden Bonnemaisoniales Familia Bonnemaisoniaceae: Ptilonia J. Agardh; Delisea Lamouroux; Trailliella Batters. Orden Rhodymeniales Familia Rhodymeniaceae: Rhodymenia Greville (abarcando Epymenia Kützing) Familia Lomentariaceae: Lomentaria Lyngbye Familia Champiaceae: Gastroclonium Kützing Orden Cryptonemiales Familia Cryptonemiaceae (=Grateloupiaceae= Halymeniaceae): Grateloupia C. Agardh; Cryptonemia J. Agardh; Nereoginkgo Kylin. Orden Gracilariales Familia Gracilariaceae: Gracilaria Greville; Curdiea Harvey. Orden Plocamiales. Familia Plocamiaceae: Plocamium Lamouroux. Orden Peyssonneliales Familia Peyssonneliaceae: Peyssonnelia Decaisne Orden Gigartinales Familia Areschougiaceae (incluyendo Solieriaceae y Rhabdoniaceae): Rhabdonia Hooker & Harvey ; Notophycus Moe Familia Cystocloniaceae (=Rhodophyllidaceae): Acanthococcus Hooker & Harvey Familia Caulacanthaceae: Catenella Greville Familia Phyllophoraceae: Gymnogongrus Martius; Anhfeltiopsis Silva & De Cew; Phyllophora Greville Familia Gigartinaceae; Gigartina Stackhouse Iridaea Bory; Sarcothalia Kützing; Mazzaella De Toni Familia Sarcodiaceae: Sarcodia J. Agardh Familia Faucheaeceae: Hymenocladiopsis Moe Familia Gainiaceae; Gainia Moe Familia Kallymeniaceae: Kallymenia J. Agardh; Callophyllis Kützing Orden Ceramiales Familia Ceramiaceae: Antithamnion Nägeli; Pterothamnion Nägeli; Antithamnionella Lyle; Georgiella Kylin; Plumariopsis De Toni; Falklandiella Kylin; Antarcticothamnion Moe & Silva; ; Ceramium Roth; Callithamnion Lyngbye; Aglaothamnion Feldmann Mazoyer; Medeiothamnion Pujals; Griffithsia C. Agardh; Anotrichium Nägeli Familia Delesseriaceae: Botryoglossum Kützing; Cladodonta Skottsberg; Delesseria Lamouroux; Gonimophyllum Batters; Hymenena Greville; Microrhinus Skottsberg; Myriogramme Kylin; Odontolaingia Mendoza; Phycodrys Kützing; Pseudolaingia Levring; Pseudonitophylla Mendoza; Pseudophycodrys Skottsberg; Schizoseris Kylin Familia Rhodomelaceae: Polysiphonia Greville; Neosiphonia M.S.Kim & I.K.Lee; Rhodomela C. Agardh; Lophurella Schmitz; Chondria C. Agardh; Herposiphonia Nägeli; Pterosiphonia Falkenberg; Aphanocladia Falkenberg; Picconiella De Toni ; Bostrychia Montagne in De la Sagra; Streblocladia Schmitz; Sporoglossum Kylin; Sporoglossum Kylin; Colacopsis De Toni; Antarctocolax Skottsberg, Familia Dasyaceae: Heterosiphonia Montagne; Colacodasya Schmitz Subclase Ahnfeltiophycidae 121 Maggs & Pueschel (1989) mostraron la existencia en Anhfeltia plicata de carposporofitos externos y propusieron el orden Ahnfeltiales. Esta subclase, hermana a las Rhodymeniophycidae se diferencia sobre bases moleculares y muestran sinapsis intercelulares desnudas. Orden Ahnfeltiales Familia Ahnfeltiaceae Ahnfeltia Fries Los gametofitos erectos crecen sobre una base discoide. Las frondes son multiaxiales y las células vegetativas forman conexiones secundarias a través de células conjuntoras o por fusión directa. Los tapones sinápticos intercelulares carecen de estratos de cobertura (layers) pero muestran membranas en las capuchas (caps). La pared contiene sustancias coloidales tipo agar. Los espermatocistos se cortan transversalmente de las células madres, superficiales en el talo. Los talos masculinos pueden regenerarse a través de monosporas formadas en su superficie.Los tetrasporofitos costrosos muestran fusiones celulares directas, sin sinapsis intercelulares secundarias. Los tetrasporocistos son irregularmente zonados y se ubican en soros y en posición apical. Carpogonios en soros dentro de nematecios engrosados, los que pueden fusionarse luego de la fertilización con células corticales vecinas, no existiendo células auxiliares diferenciadas. Los filamentos de los gonimoblastos se dispersan desde el carpogonio sobre el soro, fusionándose con otras células vegetativas y de otros gonimoblastos, radiando hacia el exterior y terminando en carposporocistos, formándose una estructura compuesta. En la zona se encuentra Ahnfeltia plicata (Hudson) Fries (Lam 6-1-fig. 2, Lam 6-12fig. 1), con las caracteristicas del género Referencias: Boraso & Zaixso (2007). Subclase Hildenbrandiophycidae Actualmente se acepta la separación de esta subclase sobre la base de la taxonomía molecular y la presencia de sinapsis intercelulares con un solo estrato en las capuchas y con membrana. Referencias: Sherwood & Sheath (2000). Orden Hildenbrandiales. Familia Hildenbrandiaceae Hildenbrandia Nardo Talo costroso, correoso, no calcificado, adherido al sustrato sin rizoides, compuesto de filamentos erectos de células cilíndricas muy adheridos lateralmente, emergiendo de estratos postrados mal definidos. Células uninucleadas con un solo rodoplasto. Sinapsis intercelulares con una membrana (cap membrane) y sin capa externa. Células adyacentes con sinapsis intercelulares entre ellas, sin células conjuntoras. Peritalo a veces estratificado horizontalmente. Tetrasporocistos en el fondo y las paredes de conceptáculos esféricos o cilíndricos que se abren al exterior. Tetrasporas irregularmente cruciadas o zonadas, con o sin parafisas. Reproducción sexual desconocida. Hildenbrandia lecannellieri Hariot. Lam 6-1-fig. 1 En la zona se encuentra Hildenbrandia lecannellieri Hariot con las caracteristicas del género Referencias: Hariot (1887); Boraso & Zaixso (2007). Subclase Nemaliophycidae 122 La característica de los tapones sinápticos intercelulares en esta subclase es que poseen dos capas en la capucha (cap layers). Las Corallinales, aunque relacionadas, han sido separadas en una subclase aparte. Orden Acrochaetiales Las Acrochaetiales abarcan especies con talos microscópicos, filamentosos y ramificados, los que pueden desarrollarse postrados o en mechones filamentosos erectos. . 123 Lam 6-1: fig. 1: Hildenbrandia lecannellieri; fig. 2: Ahnfeltia plicata; fig. 3: Colaconema daviesii; fig. 4 a y b: Rhodothamniella floridula: aspecto de filamentos y detalle de rodoplasto con pirenoides; fig. 5: Acrochaetium macropus: figs. 6-9: Camontagnea oxyclada, 6: esquema del aspecto general, 7: rodoplastos, 8: célula de ápice en crecimiento, 9: ápice de rama lateral. fig. 10: Nothogenia fastigiata; figs. 11-13: Ballia callitricha: 11: aspecto general, 12- 13: detalles de la ramificación; figs. 14-15: Ballia sertularioides: 14: detalle de rama, 15: rama con esporas. Pueden vivir epibiónticos, epilíticos, epipsámicos, o parcial o totalmente endobiónticos. Rodoplastos de formas variadas, con o sin pirenoides. En algunas especies se encuentran monosporocistos, terminales o laterales, sésiles o con pedicelo. Los tetrasporocistos, si están presentes, están divididos en forma cruciada o irregular y son usualmente sésiles. Los espermatocistos observados en algunas especies se presentan como grupos de pequeñas células incoloras. La rama carpogonial es unicelular y puede o no dividirse luego de la fertilización, formando un carposporofito desnudo con pocas esporas terminales, sin filamentos estériles. Referencias: Harper & Saunders (1998). Familia Acrochaetiaceae Las Acrochaetiaceae son una de las familias de Rhodophyta más difíciles de ordenar en géneros. En la denominación de las especies encontradas en nuestras costas hemos seguido los criterios según los cuales Acrochaetium abarca especies con rodoplastos parietales con pirenoide, en tanto Chromastrum abarca aquellas con rodoplastos axiales estrellados y Aoudinella a las especies con un solo rodoplasto parietal sin pirenoides. De acuerdo a este esquema Rhodochorton posee varios rodoplastos parietales, desde discoides hasta irregularmente alargados y sin pirenoides. Sería característica de Acrochaetium un ciclo compuesto por un gametofito con base unicelular y un tetrasporofito con base multicelular (Stegenga & Mulder, 1979). Varias especies originalmente en Rhodochorton, están actualmente reubicadas en Meiodiscus y Rhodothamniella del orden Palmariales. Acrochaetium Nägeli Talos diminutos epífitos, filamentos cortos erectos, con rodoplastos axiales estrellados. Sería también características de este género el ciclo con gametofitos con base unicelular y tetrasporofito con base multicelular. Acrochaetium catenulatum Howe Porción postrada comenzando en una división transversal de la monospora y posteriores divisiones de una de las hemicélulas. Porción erecta, con monosporas terminales sobre los filamentos cortos, erectos. Referencias: Kylin & Skottsberg (1919). También conocido como: Chromastrum catenulatum (Howe) Stegenga & Mulder. Acrochaetium fuegiense Kylin Talos epífitos, de hasta 400 µ de alto, con un disco basal monostromático, parenquimatoso al principio a través de una división oblicua de la monospora. Filamentos erectos numerosos, ramificados en forma desde alterna hasta vagamente pectinada. Células de 8-11 µm de diámetro, largo de 1-3 veces el ancho, pelos hialinos raros. Referencias: Kylin & Skottsberg (1919). Acrochaetium macropus Kylin Lam 6-1-fig. 5 Talos epífitos de hasta 200 µm de alto, con una célula basal globosa de 15-25 µm de diámetro, emitiendo 1-4 filamentos erectos, ramificaciones alternas hasta opuestas, simples, células inferiores de 9-11 µm de diámetro, superiores de 7-9 µm de 124 diámetro, 1-3 veces tan largas como anchas. Rodoplasto estrellado axial, ubicado distalmente. Pelos hialinos raros, monosporocistos laterales, usualmente sésiles, alternos hasta opuestos, ovoides de 12-14 µm. Se encuentra epífito en los niveles intermareal y submareal. Referencias: Kylin & Skottsberg (1919). Acrochaetium virgatulum Harvey) Batters Porción basal y filamentos erectos, ramificados mayores de 0,5 mm de alto. Rodoplasto axial con pirenoide central, con abundantes pelos unicelulares. Células de 10-15 µm de grosor, 3-5 veces tan largas como anchas. Referencias: Kylin (1944) (como Kylinia virgatula (Harvey) Papenfuss). Chromastrum virgatulum (Harvey) Stegenga También se ha citado Acrochaetium levringii Papenfuss. Referencias: Papenfuss (1964). Orden Colaconematales Familia Colaconemataceae Referencias: Harper & Saunders (2002) Colaconema Batters Talos uniseriados, no corticados, de hasta un centímetro de alto. Con un solo cromatóforo parietal, con un pirenoide. Ciclos de vida, si se conoce con dos generaciones desde isomórficas hasta heteromórficas. Gametofitos monoicos o dioicos, con base unicelular o más frecuentemente multicellular Tetrasporofitos con base multicellular. Ramificación desde irregular hasta pectinada u opuesta. Espermatocistos agrupados. Carpogonios sésiles o con pedicelo, sin rama carpogonial. El carpogonio fertilizado da gonimoblastos pequeños con carposporocistos terminales, sin involucros externos. Tetrasporocistos cruciados, terminales o laterales, solitarios o en grupos. Referencia: Guiry & Guiry (2003-2013). Colaconema daviesii (Dillwyn) Stegenga Lam 6-1-fig. 3 Filamentos erectos de más de 0,5 mm de alto, de hasta 3 mm, ramificados, con rodoplasto parietal, con pirenoide, células de 10-12 µm de grosor, 2-3 veces tan largas como anchas. Referencias: Ricker (1987); Boraso & Zaixso (2007) (como Acrochaetium daviesii (Dillwyn) Nägeli). Rhodochorton Nägeli En Rhodochorton los rodoplastos serían varios parietales sin pirenoide, desde discoides hasta irregularmente alargados. Rhodochorton purpureum (Lightfoot) Rosenvinge Talos formando matas rojo- purpúreas de filamentos erectos espaciadamente ramificados, de hasta 5- 10 mm de alto. Células de 3-4 veces tan largo como anchos. Células al principio con un solo rodoplasto reticulado sin pirenoides, luego fragmentado. Reproducción por tetrasporas, mayormente invernal, monosporocistos ausentes. Referencias: Kylin (1944) (como Rodochorton rothii); Ricker (1987). Camontagnea Pujals Este género fue creado por Pujals (1981) sobre la base de Ballia scoparia, y se lo ha ubicado provisionalmente en el orden Acrochetiales. Camontagnea oxyclada (Montagne) Pujals Lam 6-1-figs. 6-9 Talo heterotrico, filamentoso y muy ramificado, de hasta unos 12 cm de alto, con rámulas de crecimiento definido, tiesas, de ápices con células pequeñas y terminadas en 125 punta. Las células apicales del eje dividen su contenido a través de formaciones angulares desde la pared lateral que separan el contenido de la célula en una región distal y una proximal. A partir de la brotación lateral de la célula subapical se originan nuevos ejes de crecimiento en forma irregular y repetida. También pueden producirse ramificaciones a partir de células laterales lenticulares que se forman en cualquier célula del talo y pueden dar filamentos dirigidos al ápice o hacia la base con aspecto rizoidal. El conjunto produce una densa trama superficial que dan al talo un aspecto de cordel de hasta 1,5 mm de diámetro. Cada célula lleva varios rodoplastos parietales estrellados, con un pirenoide, que pueden ser alargados en las células subapicales. Los tetrasporocistos se forman en ramitas laterales cortas ubicadas sobre ramas de crecimiento determinado o indeterminado. Las tetrasporas germinan luego de dividirse en dos células. Referencias: Pujals (1981); Womersley (1994); Boraso & Zaixso (2007). Orden Palmariales Este orden se fue conformando a partir de observar que tetrasporas de Palmaria palmata en cultivo se generaron gametofitos que en una ocasión al menos produjeron tetrasporocistos. Posteriormente se observó que en en esta especie no existe rama carpogonial ni célula auxiliar y que el carpogonio fecundado da una fase tetrasporangial por mitosis, con lo cual faltaría el carposporofito. Para incorporar a este orden algunas especies ubicadas antes en Acrochaetiales se ha tenido en cuenta la presencia de Rficoeritrina tipo I, o de B- ficoeritrina; el tipo de germinación de las esporas en un disco; la presencia de fusiones celulares en la base y el ciclo de vida. Referencias: Saunders (2004). Familia Palmariaceae Palmaria Stackhouse Para la zona antártica se han descripto: Palmaria decipiens (Reinsch) Ricker. Referencias: Gain (1912) (como Gracilaria simplex). Kylin & Skottsberg (1919); Lamb & Zimmermann (1977); Ricker (1987). Palmaria georgica (Reinsch) R. W. Ricker. Referencias: Kylin & Skottsberg (1919); Ricker (1987). Familia Rhodothamniellaceae A pesar de mostrar afinidades en cuanto al ciclo de vida las algas acroquetioides Rhodochorton purpureum (Lightfoot) Rosenvinge y Rhodothamniella floridula (Dillwyn) J. Feldmann in Christensen no se afiliaron entre sí sobre bases moleculares, reproductivas y anatómicas. Rhodothamniella floridula fue entonces postulada como una línea primitiva dentro de las Palmariales, en una familia nueva, Rhodothamniellaceae. Referencias: Saunders et al. (1995). Rhodothamniella Feldman Talos uniseriados, filamentosos, ecorticados, de pequeño tamaño. Células con varios rodoplastos parietales estrellados, con un pirenoide. Gametofito minúsculo con base unicelular, tetrasporofito algo más grande, heterotrico. Talos masculinos produciendo filamentos muy ramificados o en corimbo con espermacios terminales. Carpogonios pedicelados, sobre filamentos no especializados. Sin carposporofitos ni carposporocistos, el carpogonio fertilizado da lugar directamente al tetrasporofito. Tetrasporocistos en pequeños racimos, tetrasporas cruciadas. Especie epilítica, cespitosa, en intermareal bajo y sublitoral superior, o en niveles más altos en ambientes sombreados. Referencia Guiry & Guiry (2009). Rhodothamniella floridula (Dillwyn) J. Feldman Lam 6-1-fig. 4 a y b 126 Talos formando céspedes densos color ladrillo, de filamentos poco ramificados con células, 3-4 veces tan largas como anchas. Varios rodoplastos parietales con pirenoide. Reprodución por tetrasporas. Referencias: Boraso & Zaixso (2007). Familia Meiodiscaceae Rubrointrusa S.L. Clayden & G.W. Saunders Rubrointrusa membranacea (Magnus) S.L. Clayden & G.W. Saunders Endozoico en hidroides y briozoos, de talo postrado irregular, células de 4-8 µ de diámetro y de 1-10 veces tan largas como anchas. Filamentos erectos cortos, poco ramificados. Tetrasporas cruciadas. West (1979) constató un ciclo con una sola fase productora de tetrasporas que se repetía sin producir la fase gametofítica. La germinación de las esporas es por 1-4 tubos de germinación que dan un sistema basal extendido. Referencias: Kylin (1944); Wiencke & Clayton 2002 (como Audouinella membranacea (Magnus) Papenfuss). Conocida también anteriormente como Rhodochorton membranaceum Magnus. Orden Nemaliales Familia Helminthocladiaceae Talos gametofíticos multiaxiales con filamentos erectos a partir de la porción basal. Talos tetrasporofiticos microscópicos llevando tetrasporas cruciadas. Los filamentos gonimoblásticos salen directamente del carpogonio. Nemalion Duby Talos cilíndricos multiaxiales, más o menos ramificados. Con una médula de filamentos incoloros filiformes periclinales y una corteza de filamentos pigmentados anticlinales. Gametofitos femeninos. Fase tetrasporangial tipo Acrochaetium, desconocida en la naturaleza. Nemalion helminthoides (Velley) Batters Lam 6-12- fig. 2 Talos usualmente en grupos conspicuos, con individuos de hasta 1m de largo y hasta 3,5 mm de diámetro, afinados hacia los ápices, simples o con alguna ramificación dicotómica . De color pardo dorado, blandos, cilíndricos, multiaxiales. Rodoplasto estrellado, rojo violado con un pirenoide. Las células terminales de los filamentos a veces llevan un pelo hialino. Talos homotálicos. Ramas carpogoniales laterales, comúnmente incoloras, células hipóginas contiguas al carpogonio. Ramas anteridiales de 2-5 células, sobre las células terminales de los filamentos laterales. Referencias: Pujals (1960); Boraso & Zaixso (2007). Familia Galaxauraceae (=Chaetangiaceae) Los géneros de esta familia poseen un tetrasporofito costroso y filamentos gonimoblásticos que salen directamente del carpogonio. Nothogenia Montagne Talos erectos, desde dicotómica hasta irregularmente ramificados, con carposporas en posición terminal sobre los gonimoblastos. Se ha observado repetidamente un tetrasporofito costroso. Huisman & Womersley (1992) observaron la formación de 127 gonimoblastos directamente a partir del carpogonio y la emisión de ramas estériles, las que eventualmente formarán un pericarpio. Nothogenia fastigiata (Bory) Parkinson. Lam 6-1-fig. 10 Gametofitos de color pardo claro a rojizo, de consistencia desde cartilaginosa a blanda, con base cuneiforme, desde cilíndricos a comprimidos, ramificados en forma dicotómica hasta cuatro veces, dando al talo forma de abanico o de corimbo. En Patagonia y Tierra del Fuego aparece típicamente como céspedes que no superan los 5 cm de alto, pero ha sido descripto como de mayor tamaño. Estructura interna multiaxial, semi-hueca o mucilaginosa en las partes más anchas, con una médula formada por numerosos filamentos incoloros, con una corteza externa de filamentos de células con varios rodoplastos discoides sin pirenoide. Crecimiento en zonas apicales levemente invaginadas. Cistocarpios internos formados por condensación de los filamentos medulares. Carpogonio terminal sobre una rama. La generación tetrasporofítica es un disco formado por filamentos erectos sobre los que se forman lateralmente los tetrasporocistos ovoides, solitarios, cruciados. Referencias: Delépine et al. (1979); Huisman & Womersley (1992); Boraso & Zaixso (2007). celular. Orden Balliales Sinapsis intercelulares con estructuras en domo de ambos lados de la pared Todas las menciones a reproducción sexual en el orden están referidas a especies que pertenecen a otros órdenes. La característica de talo dístico del orden tampoco se sostiene ya que es conocida la existencia de talos con porciones trísticas y tetrásticas en B. callitricha. Referencias: Adams (1994); Cho et al. (2000). Familia Balliaceae Es una familia monotípica con las características del género Ballia. Ballia Harvey Talos erectos, medianos, flabelados, ramificados repetidamente bilateralmente, plumosos, corticados o no, con algunos ejes de crecimiento indeterminado. Crecimiento por una célula apical grande. Sin células glandulares. Tetrasporocistos divididos cruciada o tetraédricamente, nacidos sobre grupos de filamentos curvos nacidos en las bases de las ramas de último orden. Ballia callitricha (C. Agardh) Kützing Lam 6-1-figs. 11-13 Varios ejes partiendo del mismo disco basal, 5-15 (-30) cm de alto, cartilaginosos. Ejes corticados por filamentos descendentes. Pinas densas, opuestas, no corticadas, con pínulas de último orden espiniformes. Células apicales de las ramas algo infladas. Tetrasporocistos pedicelados, subglobosos a elipsoidales 40-55 µm de diámetro, ubicados cerca de la base de rámulas simples. Carposporofito y espermatocistos desconocidos. Referencias: Mendoza (1969); Boraso de Zaixso (2003); Boraso & Zaixso (2007). Ballia sertularioides (Suhr) Papenfuss Lam 6-1-figs. 14-15 Talos cespitosos, dendroides, de hasta 5 cm de alto, color púrpura. Porción basal pulvinosa, con filamentos rastreros marginales formando nuevas almohadillas y filamentos erectos. Filamentos erectos uniseriados, ecorticados, simples basalmente, ramificados en forma pinnada desde 1 cm de la base, Ramas de primer orden rígidas, de hasta 5 mm de longitud y de 50 µm de ancho en la base, atenuadas distalmente, simples o con ramas de 128 segundo orden de unos 20 µm de ancho en la base y 230 µm de largo, las que no cubren la región distal de las ramas de primer orden. Célula apical de los ejes de crecimiento indeterminado grande, de ápice redondeado, produciendo alternadamente células laterales en el ángulo superior. Reproducción no observada. En Antártida se ha observado como epífita en el submareal. Referencias. Mendoza (1969); Boraso de Zaixso (2003); Boraso & Zaixso (2007) Subclase Corallinophycidae Orden Corallinales Abarca especies con el talo impregnado de carbonato de calcio, erectas y con talos costrosos o arborescentes. En los talos erectos suelen encontrarse zonas no calcificadas (genículas) entre zonas calcificadas (intergenículas), a este tipo de talo se los denomina “geniculados” y los encontramos en la familia Corallinaceae, subfamilia Corallioidae. Los géneros de talo postrado encontrados hasta ahora en Argentina pertenecen a las familias Corallinaceae (subfamilias Mastophoroideae; y Lithophylloideae) y Hapalidiaceae. (Subfamilia Melobesioideae) Los talos costrosos y las partes costrosas de especies con talos erectos se hallan diferenciados en un hipotalo de filamentos paralelos al sustrato, un peritalo de filamentos perpendiculares al sustrato, que da el crecimiento en grosor y un epitalo de cobertura superior de uno o dos estratos de células. El peritalo está formado en algunas especies por células grandes, glandulares denominadas megacélulas o heterocistos. Entre los criterios que se deben tener en cuenta a la hora de abordar el estudio de estos grupos está la construcción dímera o monómera del talo postrado. Los talos dímeros crecen en dos direcciones, constando de un estrato postrado, generalmente de una sola capa de células, del que nacen filamentos verticales que crecen por células meristemáticas intercalares (células subepitaliales) que se dividen dando el epitalo hacia arriba y el epitalo hacia abajo. El crecimiento en superficie procede a través del desarrollo del estrato postrado o hipotalo. Si el hipotalo verdadero detiene su crecimiento y el peritalo comienza a crecer por los bordes puede producirse un falso hipotalo. En los talos monómeros un mismo sistema de filamentos medulares postrados permite el crecimiento en superficie a través de las células apìcales y en grosor, emitiendo ramas hacia abajo que constituyen la zona de adhesión del talo, y hacia arriba, donde produce el peritalo y el epitalo. Un carácter taxonómico importante que separa la subfamilia Mastophoroideae de las Lithophylloideae es la prepoderancia en las primeras de fusiones celulares y en las segundas de sinapsis secundarias. De acuerdo a Mendoza (2003) las fusiones celulares implican la formación de verdaderos cenocitos, con la unión entre células mucho más extendida que en la formación de las sinapsis. Los tricocitos o pelos conforman filas cortas de células hialinas que se forman a partir de las células meristemáticas del peritalo y pueden ser persistentes o desaparecer por la posterior cicatrización del talo, dejando a veces un megacisto Para el esquema taxonómico de este grupo hemos seguido la base de datos Algabase y a Womersley (1996), así como la página mantenida por el Dr. Derek Keats, actualmente en reconstrucción. En el detalle de la flora local se han seguido en lo posible los criterios de los trabajos de la Dra. Ma Laura Mendoza. Para los detalles de las técnicas necesarias para los estudios morfológicos se puede consultar a Mendoza (1995). Para las especies de talos no geniculados se lista para cada género las especies citadas, pero no hemos transcripto descripciones específicas, ya que no contamos con 129 experiencia suficiente y muchas de las descripciones con las que se cuenta para la zona no están completas según criterios recientes. Las características utilizadas actualmente para separar los géneros son: el tipo de crecimiento somático del hipotalo, epitalo y peritalo, la morfología espermatangial y la estructura del conceptáculo tetrasporangial (Mendoza, 2003) Familia Corallinaceae Subfamilia Corallioidae Talos erectos con zonas no calcificadas (genículas) y calcificadas (intergenículas). Corallina Linneo Talos articulados, ramificación pennada, ramas principales con artículos desde cilíndricos hasta algoachatados. Ramas secundarias con alas laterales. Artículos con zona medular de células largas y angostas en hileras regulares, con fusiones laterales. Zona cortical delgada. Articulaciones entre los artículos formadas por un solo estrato de células muy largas. Conceptáculos axiales, terminales, con o sin cornículos. Conceptáculo espermatangial con zona fértil en su base. Conceptáculos tetrasporangiales con numerosos tetrasporocistos. Corallina officinalis Linneo Lam 6-2-fig. 6 Talos de aspecto muy variable que alcanzan entre 5 y 12 cm de alto. Ramas laterales con artículos cilíndricos. Conceptáculos terminales, piriformes, pedicelados, sin cornículos, ubicados en el extremo de ramas cortas o en cadenas de 2-3. Talos monoicos. Referencias: Mendoza (1974); Scrosati (1993); Boraso & Zaixso (2007). Corallina elongata Ellis & Solander. Lam 6-2-figs. 7-8 Talos de hasta 5-12 cm. Ramificados pennadamente. Conceptáculos terminales piriformes con cornículos. Artículos con alas. También citada como Corallina mediterranea. Referencias: Mendoza (1974a). Bossiella Silva Talos con una porción postrada y varias frondes erectas, articuladas, con fusiones intercelulares sin sinapsis intercelulares laterales. Genículas comprimidas (subgénero Bossiella) o cilíndricas (subgénero Pachyarthron). Filamentos de las genículas no ramificados, no calcificados, Conceptáculos en la corteza de las intergenículas,los conceptáculos tetrasporangiales llevando bisporas o tetrasporas. Talos gametofíticos dioicos. Los conceptáculos femeninos con células de fusión extensas con gonimoblastos delgados en su superficie. Poros de los conceptáculos espermatangiales con un pico corto. Referencias: Mendoza (1974a). Bossiella. orbigniana (Decaisne) Silva. Lam 6-2-figs. 1-3 Talos articulados con ramificación dicotómica o tricotómica. Artículos en forma de escudo o corazón. Conceptáculos sobre la superficie de los artículos. Referencias Mendoza (1974). Scrosati (1993); Boraso de Zaixso, (2003). Jania Lamouroux Base costrosa al principio, frondes cilíndricas con intergenículas calcificadas, con varias filas de células medulares con corteza fotosintética y un estrato de células epitaliales, divididas pseudodicotómicamente. Células de las genículas más largas en el centro que en la periferia, con fusiones laterales y sin sinapsis intercelulares; tricocitos presentes, conceptáculos inflados en la madurez, apicales en las ramas, axiales en la 130 médula. Poros de los conceptáculos centrales. Conceptáculos tetrasporangiales con pocos tetraporocistos. Conceptáculos espermatangiales sin un pico bien definido, con el área fértil en la base y en las paredes. Cistocarpio en el centro de la dicotomía. Referencias: Womersley (1996). En la costa de Buenos Aires está presente: Jania rubens (L.) Lamour. (Lam 6-2figs. 4-5). Referencia: Kühnemann (1972). Subfamilia Mastophoroidea Los tetrasporofitos presentan conceptáculos uniporados. Los talos carecen de sinapsis intercelulares pero presentan fusiones laterales entre células contiguas. Los géneros de Mastophoroideae con representantes en la zona son: Hydrolithon; Pneophyllum; Neogoniolithon y Spongites. Hydrolithon Foslie Talo de variadas formas, no geniculado, no endofítico, sin ahustorios; sin capa basal de células en empalizada. Hipotalo siempre uniestratificado. Peritalo desarrollado con fusiones laterales conspicuas, sin sinapsis secundarias. Marcado meristema intercalar marginal. Epitalo formado por 1-2 o más células. Tetrasporocistos con un tapón. Conceptáculos tetrasporangiales con un poro, este último recubierto por un anillo de células alargadas conspicuas, las que emergen de filamentos mezclados con las iniciales de los tetrasporocistos, estas células no protruyen hacia el canal del poro y están orientadas más o menos perpendicularmente al techo. Los conceptáculos masculinos contienen sistemas espermatangiales restringidos al piso del conceptáculo. Filamentos del gonimoblasto naciendo de los márgenes de la célula de fusión. Los límites de este género han quedado difusos desde que se comenzó a utilizar nuevamente el género Spongites Kützing. La diferencia más notable entre Spongites e Hydrolithon está en la naturaleza de las células del poro del conceptáculo tetrasporangial, paralela al techo del mismo en Spongites y perpendicular en Hydrolithon. Referencias: Mendoza (1979); Mendoza & Cabioch (1986 a). Se han citado para la zona: Hydrolithon farinosum (Lam.) Penrose & Chamberlain; Hydrolithon falklandicum (Foslie) Mendoza; Hydrolithon consociatum (Foslie) Mendoza. Referencia: Ricker (1987) (como Pseudolithophyllum consociatum). Spongites Kützing Talos costrosos, compuestos por numerosas capas e células, usualmente de más de 200 µm de grosor, sin austorios, no endofítico, sin células en empalizada, con fusiones laterales, sin sinapsis intercelulares secundarias, conceptáculos tetrasporangiales uniporados, tetrasporocistos sin tapón apical. Regiones basales no coaxiales, multiestratosas. Canales del poro de los conceptáculos tetrasporangiales cubiertos de células nacidas en filamentos periféricos del techo que protruyen en el canal y están orientados más o menos paralelos al techo. Con tricocitos solitarios o en series. Sistemas espermatangiales simples, restringidos al piso del conceptáculo, simples y carposporofitos con gonimoblastos saliendo solo del margen de la célula de fusión. En la zona se ha citado: Spongites discoideum (Foslie) Penrose & Woelkerling. Referencias: Mendoza &, Cabioch (1984)(como Hydrolithon discoideum); Ricker (1987) (como Pseudolythophyllum discoideum). Pneophyllum Kützing Talo no geniculado, sin ahustorios, sin estrato basal de células en empalizada, células de filamentos adyacentes unidas por fusiones. Techo del conceptáculo tetrasporangial desarrollado de filamentos formados a pertir de filamentos entremezclados con los tetrasporocistosy alrededor de los mismos. Canal del poro de los conceptáculos tetrasporangiales tapizados de células más o menos 131 paralelas al techo del mismo, las que pueden protruir en el canal. Conceptáculos masculinos con sistemas espermatangiales simples restringidos al piso de los mismos. Gonimoblastos formados a partir de los bordes de la célula de fusión. En la zona se ha citado: Pneophyllum amplexifrons(Harvey) Chamberlain & Norris. Referencias: Guiry & Guiry (2005). 132 Lam 6-2: figs. 1-3: Bossiella. orbigniana: 1: aspecto general, 2-3: detalles de intergenículas con conceptáculos; figs. 4-5: Jania rubens: 4: detalle de rama: 5: aspecto general; fig. 6: Corallina officinalis; figs. 7-8: Corallina elongata. 7: ramas, 8: detalle de intergenículas con laterales. 133 Phymatholithon Foslie Sin ahustorios, con célula de fusión, sin conexiones intracelulares secundarias. Paredes de las células epiteliales terminales, redondeadas o aplastadas, pero no en forma de bote. Las células vegetativas iniciales en división, tanto o más cortas que sus derivadas inmediatas inferiores. Los iniciales de los conceptáculos tetraspóricos o bispóricos profundos, adventicios. Techos de los conceptáculos masculinos formados centrípetamente por grupos de filamentos periféricos Iniciales de los espermacios no cubiertos por células protectoras. Sistemas espermatangiales dendroides sobre el piso del conceptáculo. Referencias: Womersley (1996). Especies citadas para la zona: Phymatholithon lenormandii (Aresch.) Adey. Referencias: Guiry & Guiry (2013). Subfamilia Lithophylloideae Talos costrosos, calcificados, usualmente con protuberancios coraloides. Hipotalo multiestratificado, formado usualmente por series de células curvadas hacia arriba (epitalo) y hacia abajo. Conceptáculos con un solo poro apical. Bisporocistos y tetrasporocistos sin poro apical. Presencia de sinapsis intercelulares secundarias. Fusiones celulares raras. De acuerdo a esta concepción los géneros incluídos en esta subfamilia representados en la zona son: Lithophyllum, Titanoderma y Pseudolithophyllum sensu Lemoine emend Cabioch y Mendoza. Titanoderma Nägeli. Organización dorsiventral. Presencia de conexiones intercelulares secundarias y ausencia de fusiones entre células de filamentos adyacentes. Conceptáculos tetrasporangiales uniporados. Hipotalo de un estrato de células en empalizada. Incluye varias especies epifíticas. Se han citado para la zona: Titanoderma pustulatum (Lam.) Näg ex Näg & Cramer; Titanoderma conspectum (Foslie & Howe) Woerkerling et al. Y Titanoderma pustulatum var. macrocarpum (Rosanoff) Chamberlain. Pseudolytophyllum (Lemoine) emend Mendoza y Cabioch. Género de hipotalo siempre uniestratificado, peritalo bien desarrollado con abundantes sinapsis secundarios, marcado meristema intercalar marginal y epitalo pluriestratificado fotosintético. Conceptáculos asexuales uniporados. Referencias: Mendoza (1976c); Mendoza & Cabioch (1984). Familia Hapalidiaceae Referencias: Harvey et al. (2003); Woelkerling & Irvine (2007) (de acuerdo a Guiry & Guiry (2013). Subfamilia Melobesiodeae. Los géneros de Melobesioideae con representantes conocidos en la zona son: Clathromorphum; Lithothamnion; Mesophyllum y Synarthrophyton. Los mismos se caracterizan por los conceptáculos tetraspóricos multiporados. Clathromorphum Foslie. Talo postrado o epífito, de organización mono ómera, sin ahustorios. Pared externa de células epiteliales externas redondeadas o planas, no en forma de bote. Iniciales subepiteliales tanto o más largas que las inmediatas inferiores. Médula de filamentos no coaxiales. Conceptáculos tetra o biesporangiales desarrollándose de grupos de iniciales subepitaliales, multiporados. Iniciales espermatangiales formados directamente de células meristemáticas. El techo del conceptáculo espermatangial formado a partir de filamentos horizontales 134 originados entre los iniciales de los espermatocistos y las células iniciales subepitaliales. Los sistemas espermatangiales son simples, no dendroides, y se desarrollan sobre el piso, paredes y techo del conceptáculo masculino. La mayoría de las especies del género tienen filamentos epitaliales multicelulares. Para la zona se ha citado: Clathromorphum obteculum (Foslie) Adey. Referencias: Mendoza & Cabioch, (1985) (como Clathromorphum lemoinenum); Wiencke & Clayton (2002). Lithothamnion Heydrich Talos postrados no arborescentes, excepto L. heterocladum. Austorios ausentes. Organización monómera. Hipotalo pluriestratificado, de estructura simple, peritalo bien desarrollado con fusiones laterales. Sinapsis secundarias ausentes. Marcado meristema intercalar marginal, epitalo uniestratificado con células en forma de bote características, Conceptáculos multiporados. Iniciales vegetativas en división activa tanto o más largas que sus derivadas inmediatas inferiores. Paredes del conceptáculo masculino formadas centrípetamente de grupos de filamentos periféricos. Iniciales de los espermatocistos no cubiertas por una capa de células protectoras. Espermatocistos sobre el piso, paredes y techo del conceptáculo espermatangial. Sistemas espermatangiales del piso, dendroides. Gran célula de fusión, gonimoblasto muy desarrollado, carposporocistos terminales, en cadenas. Filamentos del gonimoblasto sobre el piso del conceptáculo. Referencias: Mendoza (1988b); Womersley (1996). Para la zona se han citado: Lithothamnionn philippi Foslie; Lithothamnion mülleri Lenormand ex Rossanoff (epífito sobre Ahnfeltia plicata); Lithothamnion rugosum Foslie.); Lithothamnion granuliferum Foslie; Lithothamnion heterocladum Foslie. Mesophyllum Lemoine emend Woelkerling & Irving Talos postrados de construcción monómera, sin ahustorios. Talos costrosos a fruticosos no taeniformes. Pared externa de células epiteliales externas redondeadas o planas, no en forma de bote. Holofíticas, los tejidos vegetativos saliendo de células meristemáticas que producen células epitaliales redondeadas hacia afuera y otras hacia adentro, células de los meristemas marginales tanto o más largas que las derivadas hacia el interior, tejido del hipotalo coaxial en su vista en sección radial longitudinal. Algunas células laterales formando fusiones; sinapsis secundarias ausentes. Bi o tetrasporocistos con tapón apical dentro de conceptáculos multiporados. Iniciales de los espermatocistos fomadas directamente de células meristemáticas y cubiertas por una capa de células protectoras. Techo de los conceptáculos espermatangiales formados centrípetamente a partir de filamentos periféricos. Sistemas espermatangiales, simples, sobre el piso, paredes y techo del conceptáculo. Muchas de las especies presentan algún grado de coaxialidad en los filamentos medulares. En la zona se ha citado: M.. lichenoides. Referencias: Mendoza (1977 a). Synarthrophyton Townsend amend May & Woelkerling Talo costroso, no taeniforme, con fusiones laterales que toman solo una parte de la pared lateral de las células de los filamentos. Sin sinapsis secundarias, sin haustorios. Talo monómero, de centro plumoso de filamentos no coaxiales. Células epiteliales externas redondeadas o achatadas. Las células en división activa son tanto o más largas que sus derivadas hacia el interior del talo. Tetrasporocistos con sinapsis intercelulares apicales en los conceptáculos multiporados. Conceptáculos tetra o bisporangiales desarrollados de las iniciales subepitaliales. Iniciales de los espermatocistos cubiertas por una capa de células protectoras. Sistemas espermatangiales dendroides o dendroides y simples. 135 En la zona se han citado: Synarthrophyton patena (Hooker& Harvey) Townsend.Referencias: Ricker (1987) (como Mesophyllum patena); May & Woelkerling (1988) Synarthrophyton neglectum Foslie. Referencia: Mendoza et al. (2005). Subclase Rhodymeniophycidae Esta subclase definida en base a estudios moleculares abarca a numerosos órdenes, considerados tradicionalmente como los más evolucionados de las algas rojas los que en general poseen membrana y no capuchas en sus sinapsis intercelulares, las Gelidiales son la excepción ya que sus sinapsis intercelulares poseen capuchas internas. Orden Gelidiales Este orden tiene un ciclo de vida tipo Polysiphonia con tetrasporofitos y gametofitos isomórficos, aunque en varias especies se conoce solo el tetrasporofito. Tipicamente los talos erectos son desde cilíndricos hasta aplanados y tienen ejes postrados cilíndricos; con una célula apical conspicua. El talo está organizado en una médula de células grandes incoloras y una corteza con varias capas de células pigmentadas, con arqueoplastidios consistente en un solo rodoplasto, parietal y sin pirenoide. Las tetrasporas son cruciadas o tetraédricas, ubicadas usualmente en soros terminales. Los talos sexuales son usualmente dioicos. Los masculinos con los soros espermatangiales en ramas de último orden, con división transversal de los espermatocistos en vez de oblicua, que es lo común en el resto de las algas rojas. Talos femeninos con cistocarpios que se desarrollan apicalmente; aunque la estructura madura puede tener una posición más proximal, protruyendo sobre la superficie de la rama. Las carposporas son liberadas por un poro, rara vez más de uno, a través de una o de las dos superficies del talo. A nivel ultraestructural se considera que tienen una sola cap layer en las sinapsis intercelulares. Referencia: Rico & Guiry (1997). Familia Gelidiaceae Gelidium Lamouroux Talos cartilaginosos, desde rojos hasta casi negros, de hasta 40 cm de alto, con porciones rastreras adheridas por hapterios y ejes erectos cilíndricos o comprimidos con ramificaciones laterales regulares o irregulares. Corteza pigmentada y medulla incolora, con rizoides o hifas de paredes gruesas en la medula y la corteza. Tetrasporocistos cruciados en soros centrales, sobre zonas apicales redondeadas y aplanadas de las rámulas. o ejes. Rama carpogonial unicelular, formando fusiones con células adyacentes luego de la fertilización. El cistocarpio protruye sobre ambas superficies del talo y usualmente tiene una abertura sobre cada lado del talo. Se han citado varias especies del género en la costa de Argentina entre ellas: Gelidium crinale (Turner) Lamouroux. Referencias: Pujals (1963); Parma et al. (1987); Croce & Parodi (2013). Gelidium maggsiae Rico & Guiry. Referencias: Rico & Guiry (1997); Croce & Parodi (2012). Pterocladiella Santelices & Hommersand Abarca especies ubicadas anteriormente en Pterocladia, posee carpogonios intercalares dirigidos hacia ambos lados del talo, filamentos nutritivos creciendo centrípetamente y formando un cilindro casi sólido alrededor del eje central, y carposporofitos usualmente adheridos al piso del cistocarpio con cadenas de carposporocistos en los otros lados En la Provincia de Buenos Aires se han observado talos tetraspóricos asignables tentativamente a Pterocladiella capillacea (Gmelin) Santelices & Hommersand, especie presente en las costas de Uruguay. En la medida que se encuentren gametofitos se podrá 136 avanzar más en la determinación específica de estas poblaciones. Referencias: Santelices & Hommersand. (1997). Familia Gellidiellaceae Las características vegetativas propuestas por diferentes autores no terminan de delimitar bien los géneros Gelidium, Pterocladia y Gelidiella. Freshwater et al. (1995) encontraron evidencia en las secuencias de nucleótidos del rbcL que permite ubicar en una familia separada de las Gelidiaceae a Gelidiella. Gelidiella Feldmann & Hamel. Talos de hasta 7-10 cm de alto entremezclados con ejes postrados a veces arqueados, adheridos por rizoides. Con ejes erectos cilíndricos algo comprimidos, afinándose apicalmente y con rámulas dispersas, dísticas opuestas o subapuestas. Células corticales en filas más o menos regulares. Pigmentadas y medulares incoloras y grandes. Sin hifas longitudinales dentro de la médula o corteza. Soros tetrasporangiales apicales en las pinas modificadas en ramas infladas cónicas. Tetrasporocistos ovoides con división cruciada o tetraédricos o irregulares Guiry y Womersley (1992) postulan la importancia de los cistocarpios como criterio de separación de este género. La falta de rizoides entre las células medulares permite separar a los talos vegetativos del mismo de los de otros géneros. Gelidiella nigrescens (Feldmann) Feldmann & Hamel, se ha citado para Buenos Aires (López Gappa et al., 1993) y también se han observado individuos estériles en Golfo Nuevo que podrían pertenecer a esta especie. Croce & Parodi (2012) citan a Gelidiella calcicola Maggs & Guiry. Orden Bonnemaisoniales Familia Bonnemaisoniaceae Talo cilíndrico o comprimido, ramificados e forma radial o bilateral, a veces con rámulas en formas de cilias o dientes de crecimiento determinado. Estructura pseudoparenquimatosa alrededor de un filamento central con una corteza externa de células más pequeñas. Crecimiento por una sola célula apical. Células glandulares frecuentes. Ciclos de vida variados. Ramas carpogoniales de tres células, con tricogino recto o espiralizado, en ramas especiales laterales, con gran célula de fusión y carposporas terminales grandes. Cistocarpios sésiles o pedicelados Espermatocistos superficiales sobre rámulas especiales. Tetrasporocistos, cuando presentes, en soros corticales, divididos en forma cruciada o irregular. Ptilonia J. Agardh Talo color rojo púrpura, o, con nervadura poco visible en las partes más viejas, ramificado en forma lateral alterna a irregular. Borde con denticulaciones y proliferaciones espinosas. Crece a través de una célula apical. Estructura uniaxial con un filamento axial rodeado de rizoides en las partes más viejas, presenta una médula de células grandes incoloras y una corteza de células pigmentadas pequeñas con numerosos rodoplastos discoides parietales sin pirenoide. Algunas células corticales secretoras. Ramas carpogoniales a partir de células pericentrales de las ramas determinadas mayores. Cistocarpios pedunculados, con ostiolos dirigidos hacia fuera del plano de ramificación, muy abundantes; con carposporas claviformes. Espermatocistos en soros. Tetrasporofitos desconocidos. Ptilonia magellanica (Mont.) J. Agardh Lam 6-3-figs. 1-2 Talos aplanados, ramificados repetidamente, sin una diferenciación de rámulas laterales. Con estructura uniaxial mostrando un filamento central rodeado de un estrato de 137 células pequeñas Son frecuentes los gametofitos femeninos con cistocarpios prominentes en los extremos de las ramificaciones. Referencias: Boraso & Zaixso (2007). Delisea Lamouroux Delisea fimbriata (Lam.) Montagne Lam 6-3-figs. 3-4 Talos de 20-40 cm de largo, oscuros, pardo rojizos, cartilaginosos, con un disco basal pequeño, ramificados en forma densa e irregular. Ramas lineales, comprimidas. de 1-3 mm de ancho, dístico pinadas en forma irregular, con rámulas espinosas, pectinadas sobre los bordes, caducas en la senectud. Sin nervadura. Filamento central de las ramas principales rodeados de un tejido reticulado filamentoso formando un cilindro conspicuo de hasta 200 µ de diámetro; células medulares grandes, incoloras, de paredes finas. Ramas dentadas no corticadas, cuando jóvenes con el eje central visible externamente. Cistocarpios ovoides o subglobosos, dehiscente apicalmente por un poro, sésiles sobre la superficie de las ramas, justo por debajo de los ápices. Carposporas claviformes. Espermatocistos formados en saliencias pequeñas entre las rámulas dentadas. Tetrasporocistos más o menos irregularmente divididos. Submareales 15-40 m de profundidad, sobre roca y piedras. Se la había citado para la zona antártica pero se la encuentra también en la ría de Puerto Deseado (provincia de Santa Cruz). Lamb & Zimmermann (1977) indican que Delisea pulchra (Greville), citada para las Islas Georgias es sinónimo de D. fimbriata, que es la especie tipo. Referencias: Wiencke & Clayton (2002); Peters et al. (2005); Hommersand et al. (2009) (como Delisea pulchra) (Greville) Montagne. Trailliella Batters Trailliella intricata (C. Agardh.) Batters. Lam 6-3-fig. 8 Esta especie se encuentra epífita sobre mitílidos y Corallina y se supone que representa el estado tetrasporofítico de alguna Bonnemaisoniaceae. Talo heterotrico de color púrpura, adherido al sustrato por hapterios discoidales pluricelulares; forman penachos de hasta 1- 2 cm irregularmente ramificados. Células de 30-32 µm de largo por 23-24 µm de ancho, con numerosos rodoplastos discoides. Células glandulares sobre el lado superior de los filamentos rastreros y de distribución irregular en los erectos, ubicadas en el extremo superior de las células del filamento. No se observó fértil. Referencias: Quartino (1990); Boraso & Zaixso (2007). Orden Rhodymeniales Talos multiaxiales, ejes formados a partir de grupos de células apicales. Talos erectos o decumbentes o reptantes, cilíndricos o foliosos, simples o ramificados, con ramas sólidas o huecas. Corteza de dos hasta varios estratos celulares, a veces formando diafragmas en los huecos centrales, y con células glandulares internas. Médula pseudoparenquimática, filamentosa o hueca. Procarpios con filamentos de las células auxiliares naciendo sobre la célula soporte de la rama carpogonial o sobre una célula cortical distal a la soporte y adyacente a la célula basal de la rama carpogonial. Célula auxiliar presente antes de la fecundación, ubicada lateralmente sobre un filamento uni o bicelular Filamentos del gonimoblasto creciendo hacia la superficie; cistocarpio maduro prominente, pericarpio con o sin ostiolo. Espermatocistos dispersos o en soros. Tetrasporocistos inmersos justo bajo la superficie, dispersos o en soros, divididos cruciadamente o tetraédricamente. Referencias: Saunders et al. (1999). 138 Familia Rhodymeniaceae Talos desde cilíndricos hasta foliosos, usualmente ramificados. Médula continua, compuesta de células angulares grandes o hueca por gelatinización de los estratos medulares iniciales. Corteza formada por filas anticlinales de tres a cuatro células. Células glandulares de función secretora aisladas o agrupadas. Tetrasporocistos usualmente intercalares, en cadenas, divididos cruciadamente. Ramas carpogoniales de cuatro (rara vez de dos o tres) células. Célula auxiliar sobre rama bicelular, no fusionándose con otras luego de la fertilización. La mayoría de las células del gonimoblasto, agrupadas en gonimolobos, producen carposporocistos. Rhodymenia Greville (abarcando a Epymenia Kützing) Talo multiaxial, generalmente plano, erecto o postrado, con disco basal, con o sin estolones cilíndricos, ramas firmes, usualmente dicotómica, irregularmente o a veces simpodialmente divididas. En las especies previamente asignadas a Epymenia Kützing se observan folíolos sobre la fronde. Médula de células grandes isodiamétricas, de dos a 20 estratos, disminuyendo de tamaño gradualmente hacia afuera hasta la corteza de dos a cinco estratos de células pequeñas. Células con cuerpos parietales iridiscentes. Ramas carpogoniales de 3 - 4 células, base del carposporofito con una pequeña célula de fusión. El núcleo fecundado es pasado a la célula auxiliar, a veces a través de una pequeña célula de conexión. Cistocarpos prominentes, dispersos por el talo o restringidos a las zonas apicales, con un pericarpio grueso y ostiolo. Espermatocistos en soros pequeños, superficiales. Tetrasporocistos divididos cruciadamente, dispersos por toda la superficie o en soros subterminales, o en rámulas especiales, inmersos bajo la corteza o en nematecios. Rhodymenia coccocarpa (Montagne) Wynne Lam 6-3-fig. 5 Talos de estipe cilíndrico y láminas planas, divididos de forma dicotómica hasta irregular, segmentos desde triangulares hasta ligulados, generalmente en forma de cuña, proliferando distalmente, ocasionalmente con alguna rama sobre la superficie de la lámina. Corte transversal al centro del talo mostrando tejido parenquimatoso, de 168 a 210 µm de grosor, de una a tres capas de células medulares grandes y dos a tres de células pequeñas, cubiertas por células corticales de 5,5 - 8,5 µm. Todas las paredes celulares gruesas. Especie submareal Referencias: Ricker (1986); Boraso & Zaixso (2007). (como Rhodymenia subantártica. Ricker); Wynne (2007). Rhodymenia schmittii Taylor Talos de aspecto subpalmado, de hasta 17 cm de alto y 20 cm de ancho, formados por una ancha lámina plana dividida dicotómicamente, de cuatro a seis veces, con una base cuneiforme y subcilíndrica cerca de la base. El grosor del talo varía desde 330 µm en la base hasta 95 µm cerca de los ápices. La médula consta de dos a tres estratos de células grandes incoloras y varios estratos de células de tamaño decreciente hasta la corteza formada por células pigmentadas de 4,5 - 7,5 µm de diámetro. Tetrasporocistos ovales, de 20 - 25 µm de diámetro y hasta 45 µm de largo, en soros terminales sobre láminas angostas. Referencias: Taylor (1939). 139 Lam 6-3: figs. 1-2: Ptilonia magellanica: 1. Aspecto de ramificación, 2: detalle de ramas con cistocarpios.; figs. 3-4: Delisea fimbriata: 3: aspecto de ramificación, 4: detalle de rámulas; fig. 5: Rhodymenia coccocarpa; figs. 6-7: Lomentaria clavellosa 6: ápice, 7: detalle de ramificación cerca del ápice; fig. 8: Trailliella intricata; figs. 9-11: Grateloupia cutleriae: 9: corte en el borde, 10: corte en centro del talo, 11: aspecto general; fig. 12: Notophycus fimbriatus 140 Rhodymenia falklandica (Taylor) comb. nov. Talos de hasta más de 25 cm de alto, con base disciforme y fronde erecta con un pequeño estipe cilíndrico. El talo es acintado, alrededor de 1 cm de ancho abajo y algo más ancho arriba, alcanzando en las bifurcaciones hasta 1,5 cm. La ramificación abajo es irregularmente dicótoma y alterna distalmente. Los ápices de las ramas son redondeados, algo ensanchados antes de dividirse pero no espatulados. El grosor de la lámina alcanza hasta 175 µm hasta 300 µm en la base, con médula de hasta 110 µm distalmente y 200 µm en la base, de dos a cuatro capas de células grandes incoloras. La corteza es arriba de dos a tres capas de células de 3,5 a 5,5 µm de diámetro y paredes de 2,5 - 3,5 µm. Hacia la base las células corticales alcanzan los 4,0 - 4,5 µm de diámetro, isodiamétricas, con paredes de 2,0 - 3,5 µm y el talo se engrosa por proliferación de las células superficiales que forman hasta cinco a ocho capas. Los tetrasporocistos se forman en pequeños folíolos ovados hasta reniformes, estipitados, de posición usualmente marginal, de 2 - 4 mm de diámetro en la madurez, con el margen estéril y el centro de 210 - 250 µm de grosor, donde se forman tetrasporocistos ovales, 35 - 45 µm de alto y 24 - 28 µm de diámetro, en un estrato fértil sobre cada cara del folíolo, mezclados con filamentos estériles. Referencias: Taylor (1939) Boraso & Zaixso (2007) (como Epymenia falklandica). Familia Lomentariaceae Ramas cilíndricas o foliosas angostas. A veces con médula de células angulares, pero usualmente hueca e interrumpida transversalmente a intervalos por septos o diafragmas multiestratificados. Tetrasporocistos en su mayor parte divididos tetraédricamente, a veces formando polisporas, normalmente terminales, excepto en Lomentaria, distribuidos por la corteza externa. Espermatocistos en parches superficiales incoloros. Ramas carpogoniales usualmente de tres células, con la célula auxiliar fusionándose con otras luego de la fertilización. Gonimoblasto globular con la mayoría de las células formando carposporocistos. La célula de fusión masiva con señales oscurecidas de las células constitutivas o lineales, con señales discernibles de las células constitutivas. Lomentaria Lyngbye Talo erecto, cilíndrico o comprimido, ramificado, sin septa pero obliterado en la base de las ramas. Con grupos de células apicales, células glandulares internas a los filamentos medulares longitudinales. Esporocistos dispersos o a veces agrupados. Espermatocistos en áreas extendidas. Rama carpogonial de tres células. Célula de fusión en pedestal. La mayor parte de las células de los gonimoblastos formando carposporocistos. Cistocarpio protuberante, ostiolado. Lomentaria clavellosa (Turner) Gaillon Lam 6-3-figs. 6-7 Talos muy ramificadas, con ramas primarias largas y las de último orden cortas y ligeramente fusiformes, de aspecto sedoso, color rojo a rosado, de hasta unos 15 cm de largo. Submareal, frecuentemente epífita sobre Gracilaria gracilis. Referencias: Boraso & Zaixso (2007). Gastroclonium Kützing Talo con grampón ramificado o discoide y fronde erecta sólida o hueca,con o sin septos, cilíndrica o comprimida. Ramas cortas o largas, persistentes o caducas. Vesículas vacías o con mucílagos. Células medulares alargadas longitudinalmente, llevando a veces céulas secretoras. Especies dioicas, espermatocistos en soros superficiales. Procárpicas, ramas carpogoniales de 4 células y con 3 auxiliares, gonimoblasto dirigido hacia afuera, carposporocistos naciendo de una célula de fusión grande. Pericarpio grueso, sin poro. 141 Tetrasporocistos tetraédricos o polisporocistos intercaleres en la corteza, en porciones jóvenes del talo. Referencias: Guiry & Guiry (2013). Gastroclonium trichodes (Pujals) Santelices, Abbott, & Ramírez Talos epífitos, cespitosos, de hasta 2,5 cm de alto, con uno a varios ejes parenquimatosos macizos, cilíndricos, simples, bifurcados una o dos veces, hasta de 1 mm de diámetro en el eje y de hasta 1,5 mm de diámetro en las ramas recurvadas, articuladas, septadas, estoloníferas; ramificadas unilateralmente a la altura de los septos, con ramas de segundo y tercer orden. Corteza de 2 - 4 estratos celulares. Células externas con pelos de hasta más de 100 µm de largo. Polisporocistos con cuatro a ocho polisporas dispersos en los segmentos distales de las ramas, esféricos de hasta 87 µm de diámetro o algo alargados de hasta 106 µm. Propagación por fragmentos estoloníferos. Se encuentra en el intermareal, epífito sobre Corallina. Referencias: Pujals, 1967.(como Coeloseira trichodes, Pujals (1967); Boraso & Zaixso (2007). Orden Peyssonneliales Familia Peyssonneliaceae Peyssonnelia Decaisne Talos postrados desde adheridos firmemente al sustrato por rizoides ventrales hasta mayormente libres en su parte distal. Bordes enteros, o lobados, o lacerados. Sin células peritaliales por debajo del hipotalo. Tretrasporocistos inmersos en el talo, no nemateciales. La especie Peyssonnelia. harveyana Crouan ex J. Agardh: ha sido citada para Tierra del Fuego y Antártida. Referencias: Papenfuss (1964); Wienke y Clayton (2002). Orden Cryptonemiales Familia Cryptonemiaceae (=Grateloupiaceae= Halymeniaceae) Talos erectos, multiaxiales, filamentosos, comprimidos o cilíndricos, foliosos o muy divididos. Médula formada por filamentos periclinales y a veces anticlinales, desde filamentosa hasta parenquimatosa. Corteza filamentosa, compactada externamente. Tetrasporocistos divididos cruciadamente usualmente aislados bajo la superficie del talo o laxamente agregados en soros. Espermatocistos en parches superficiales incoloros. Sistemas reproductivos no procárpicos. Carpogonios en ramas carpogoniales bicelulares asociadas a grupos de ramas accesorias, llamadas ámpulas carpogoniales generalmente monocarpogoniales. Las células auxiliares se ubican en grupos de ramas accesorias (ámpulas), algo más desarrolladas que las de la rama carpogonial, formadas a partir de células internas de la corteza y región de transición a la médula. Los filamentos de conexión producidos luego de la fecundación transportan el material nuclear a las células auxiliares ubicadas en otras ámpulas. Los gonimoblastos son pequeños y embebidos, con escaso o ningún tejido estéril alrededor de la masa de esporas. Womersley (1994). Grateloupia C. Agardh Talo solitario o en grupos, erecto, folioso, simple o dividido en forma pinnada, dicotómica o irregular, o con proliferaciones en uno o más planos. Lámina usualmente estipitada, con un disco basal, superficie lisa, algo gelatinosa, márgenes a veces con laminitas prolíferas o crecimientos espinosos. Médula de filamentos periclinales incoloros y uno o dos estratos de células estrelladas incoloras. Los estratos interiores de la corteza también estrellados, corteza exterior formada por filas de células divididas dicotómicamete de 4 a 8 veces. Filamentos rizoidales frecuentes en talos viejos. Tetrasporocistos dispersos en la corteza externa, a veces laxamente reunidos en soros. Talos monoicos o dioicos, con espermatocistos en soros superficiales. Solo las células externas del gonimoblasto forman carposporas, ubicadas bajo el carpostoma. Las 142 ampollas suelen ser relativamente cerradas en los ápices. Referencias: Womersley (1994); Boraso & Zaixso (2007). Grateloupia cutleriae Kützing Lam 6-3-figs. 9-11 Alga carnosa, púrpura a violada, membranosa, linear. Talo simple o con pocas a numerosas con proliferaciones marginales cortas. Con pequeño disco basal. Médula laxa y corteza de 8-9 estratos celulares. Tetrasporas cruciadas. Referencias: Etcheverry (1986). De acuerdo a Pujals (1963) corresponden a esta especie también las citas en la zona de G. schiyzophylla Kützing. También fue citada Grateloupia filicina (Wulfen) C. Agardh por Hariot (1889). Por otro lado la especie invasiva G doryophora Montagne está presente en la costa atlántica desde Florida hasta Uruguay (Villalard-Bohnsanck & Harlin, 1997), por lo cual se la debe debe tener en cuenta al analizar el material del género que se encuentre en la zona. Cryptonemia J. Agardh Talos foliosos, o con láminas aplanadas, crispas, con un estipe cartilaginoso, perenne, frecuentemente derivado de la nervadura central, Estructura multiaxial,con una corteza delgada y una médula de filamentos entremezclados, células glandulares presentes.Ciclo de vida trifásico, gametofitos usualmente dioicos, ampulas de rama carpogonial relativamente simple, con pocos filamentos secundarios. Ampulas de célula auxiliar, más grandes, con más filamentos secundarios, convergiendo por arriba. Carposporofito con craposporocistos muy densamente agregados, con la célula auxiliar en la base, involucro leve y ostiolo pequeño. Espermatocistos cortados sobre la corteza externa. Tetrasporocistos cruciados, sobre filamentos de dos o tres células que proliferan en la corteza externa. Referencias: Womersley (1994). Cryptonemia. obovata J. Agardh ha sido citada para la región magallánica por Skottsberg (1941) y estaría presente en Chile (Santelices, 1989). Para la zona antártica se han citado también los géneros: Nereoginkgo Kylin con la especie Nereoginkgo. adiantifolia Kylin: Referencias: Kylin & Skottsberg (1919). Choreocolax Reinsch Con las especies: Choreocolax delesseriae Reinsch. Choreocolax macronema Reinsch y Choreocolax rhodymeniae Reinsch Referencias Reinsch (1890). Orden Gracilariales Algas filiformes y cilíndricas o aplanadas, arbustivas, cartilaginosas. Médula compacta de células isodiamétricas grandes y corteza de células pequeñas. Tetrasporas tetraédricas. Espermacios derivados de las células corticales, superficiales o en conceptáculos más o menos inmersos en el talo Ramas carpogoniales de dos células, formadas luego de la fecundación. Gonimoblasto formado a partir de célula de fusión. Cistocarpios con placenta basal y carposporofito dirigido hacia fuera, con pericarpio rígido, abierto por un poro. Familia Gracilariaceae. Gracilaria Greville Talo erecto, desde cilíndrico a veces aplanado, generalmente ramificado. Médula de células grandes desde isodiamétricas hasta ligeramente alargadas. Células progresivamente más pequeñas hacia afuera. Tetrasporocistos divididos cruciadamente, o distribuidos en la corteza externa o ubicados en nematecios. Espermatocistos en áreas superficiales o en receptáculos puntiformes superficiales. Ramas carpogoniales de dos células, célula soporte con filamentos estériles. No presentan una célula auxiliar 143 diferenciada sino que funciona como tal una célula vegetativa intercalar de los filamentos estériles formados a partir de la célula basal, la cual no recibe al núcleo sino que establece conexión con el carpogonio fecundado, el cual no degenera. Célula de fusión más o menos extendida, a partir de la auxiliar y la basal. Los gonimoblastos se desarrollan hacia afuera; la mayoría de sus células producen carposporocistos. El cistocarpio maduro es muy protuberante, con pericarpio y carpostoma. Se observan células tubulares entre el tejido fértil y el pericarpio. Womersley (1996). Gracilaria gracilis (Stackhouse) Steentoft, Irvine & Farnham. Lam 6-4-figs. 1-9 Talos desde casi simples hasta profusa e irregularmente ramificadas, ejes cilíndricos delgados en todo el talo. Cistocarpios dispersos por todo el talo, protruyendo de la superficie del mismo. Células nutritivas uniendo tejido de los gonimoblastos y porción externa del pericarpio. Célula de fusión expandida, abarcando también células de la médula. Espermatocistos en receptáculos en forma de ánfora, cercanos a la superficie del talo y con un poro. Las tetrasporocistos son cruciados, dispersos en la corteza. Existen varios estudios que avalan la pertenencia de la población de Gracilaria de Argentina al grupo europeo de poblaciones (Rice & Bird, 1990), las que deben asignarse según Steentoft et al. (1995) a G. gracilis. Referencias: Boraso & Zaixso (2007); Garcia et al. (2007). Gracilaria pulvinata Skottsberg Talos cespitosos, intermareales, de 2-3 cm de alto, flabelados a corimbosos, ramificados irregularmente y repetidamente, con un disco basal. Ramas cuneadas, algo comprimidas, de hasta 1,5 mm de ancho. Corteza monostromática, subcorteza de 1 - 3 estratos, médula de células grandes, incoloras. Esporocistos con tetrasporas cruciadas en la subcorteza. No se conocen los gametofitos, por lo que la ubicación taxonómica de esta especie es provisoria. Referencias: Skottsberg (1923). Para la zona antártica se ha citado el género Curdiea Harvey, con la especie: Curdiae racovitzae Hariot.( Lam 6-4- fig. 10). Referencias: Gain (1912). Orden Plocamiales Familia Plocamiaceae Plocamium Lamouroux Talo erecto, a partir de un disco basal o de ramas estoloníferas con pequeños discos de adhesión. Ramas erectas desde comprimidas hasta muy aplanadas. Ramificación simpodial, o alterna dística o pectinada en varios órdenes. Estructura pseudoparenquimatosa con ejes uniaxiales. Cada célula de un filamento axial lleva dos filamentos laterales, de los mismos se cortan progresivamente células cada vez más pequeñas hasta formar la corteza compacta. Tetrasporocistos zonados, en grupos en rámulas especiales. Espermatocistos cubriendo rámulas de último orden. Referencias: Saunders & Lehmkuhl (2005). Plocamium secundatum (Kützing) Kützing Lam 6-5-figs. 3-4 Talos de color rojo profundo, gelatinosos al tacto, delicados y repetidamente ramificados en un plano. Ramas de alrededor de 1,0- 2,0 mm de ancho con organización simpodial, dejando ramas con ramificación pectinada en varios órdenes. Ramas de último orden ligeramente incurvadas hacia adentro, en series de usualmente tres o cuatro hasta seis rámulas, excepcionalmente hasta trece ramas. Eje central del talo visible en corte transversal, rodeado de un estrato de células incoloras; corteza interna de un estrato de células de tamaño intermedio y corteza externa de un estrato de células con un rodoplasto parietal externo. 144 Lam 6-4: figs. 1-9 Gracilaria gracilis: 1: aspecto general, 2: bases sobre conchilla, 3-4: conceptáculos masculinos, 5: pared del cistocarpio, 6: cistocarpios maduros, 7:tetrasporocistos en vista superficial (ci: cicatriz de tetraspora liberada); 8: corteza con tetraspora en liberación, 9: conceptáculos masculinos en vista superficial; fig. 10: Curdiae racovitzae: corte transversal 145 Cistocarpios adaxiales o abaxiales y sésiles sobre las ramas. Tetrasporocistos en estiquidios formados en ramas planas ensanchadas y en su mayoría en forma de estrella de forma compactas o desarrolladas como ramas cortas, opuestas. Submareal y en piletas de marea en niveles bajos del intermareal. Referencias: Hooker & Harvey (1845); Ricker (1987); Boraso & Zaixso (2007). Para la zona antártica se ha citado: Plocamium hookeri Harvey Referencias: Hooker & Harvey (1845); Ricker (1987). Plocamium cartilagineum (L.) Dixon (Lam 6-5-fig. 1) fue citada para Antártida, pero según Saunders & Lehmkuhl (2005) no se encontraría en esa zona. Orden Gigartinales Fredericq et al. (1995) definieron al orden Gigartinales sensu lato abarcando alrededor de 40 familias, incluyendo a aquellas tradicionalmente ubicadas en el orden Cryptonemiales y a algunas de otros órdenes como Rhodymeniales. El carácter unificador del orden así concebido es la presencia de células auxiliares que interaccionan con el carpogonio fertilizado a través de filamentos de conexión. Usando a las Ahnfeltiales como grupo externo, el complejo de las Gigartinaceae (Gigartinaceae, Phyllophoraceae incluyendo Petrocelidaceae) es en dicho estudio, hermano al complejo de las Solieriaceae (Solieriaceae, Cystocloniaceae, Caulacanthaceae, Hypneaceae y Furcellariaceae , incluyendo Tichocarpaceae, Turnerella y Opuntiella); las Rhizophyllidaceae quedan estrechamente relacionadas a las Dumontiaceae; las Endocladiaceae y Gloiosiphoniaceae con las Sphaerococcaceae y Phacelocarpaceae; y las Sarcodiaceae con las Plocamiaceae, que algunos autores proponen separar como orden; las Halymeniaceae pertenecen a un grupo importante junto con las Schizymeniaceae, Sebdeniaceae, y algunas familias de Rhodymeniales. Familia Areschougiaceae (incluyendo a Solieriaceae y Rhabdoniaceae) La familia Areschougiaceae abarca gran variedad de morfologías y anatomías vegetativas, usualmente pseudoparenquimatosas y con células multinucleadas en la corteza interna y también variadas anatomías reproductivas, con especies procárpicas y no procárpicas. Las ramas carpogoniales tricelulares se dirigen hacia adentro y el tricogino es retroflexo. La célula auxiliar es una célula, diferenciada o no, de la corteza interna y el carposporofito está orientado inicialmente hacia adentro, pudiendo devenir luego radial. Los carposporofitos tienen una célula de fusión central grande abarcando tejidos del gonimoblasto primario y del gametofito femenino, la cual produce filamentos del carposporofito radiantes, con carposporocistos en cadenas o racimos. Los cistocarpios, ostiolados, están inmersos en el talo o protruyen del mismo. Las tetrasporas son zonadas, adheridas basal o lateralmente y se encuentran dispersas en la corteza externa. Los espermatocistos son corticales y se disponen dispersos o en soros. Referencias: Womersley (1994). Rhabdonia Hooker & Harvey Talos de hasta 25 cm. con disco basal y ejes cilíndricos o con segments ovoides. Talo uniaxial con un eje dando periaxiales en tres planos visible solo en el ápice. Corteza delgada. Gametofitos monoicos, Ramas carpogoniales de 3-4 células El carpogonio fertilizado emite un filamento de conexión, las células auxiliares son intercalares en filamentos corticales de células grandes y que se tiñen intensamente. Cistocarpios con pocos filamentos alrededor, inmersos, con célula de fusión y cadenas cortas de carposporas. Células espermatangiales superficiales en parches. Tetrasporocisdos superficiales y en parches. Referencia: Womersley (1994). 146 Rhabdonia coccinea (Harvey) Harvey Lam 6-5-figs. 7-12 Los talos son filamentos cilíndricos, delgados, ramificados y con ramas laterales cortas, con ápices afinados. Poseen una clara estructura uniaxial visible solo en la zona apical Cada célula del eje da una sola célula periaxial alargada en sentido anticlinal. Las pericentrales se dividen varias veces y producen apicalmente las células de la corteza interna y la corteza externa, de células más pequeñas, con numerosos rodoplastos discoides o acintados. Las pericentrales producen lateralmente células que se alargan en el sentido del eje, por eso en las partes más basales del talo se hace menos evidente la estructura uniaxial, observándose numerosos filamentos y rizoides medulares laxos. Las tetrasporas son zonadas y se originan en la corteza interna Los gametofitos son monoicos, los espermatocistos se producen 1-3 por célula cortical. Los complejos de células auxiliares están asociados a la corteza interna y separados de las ramas carpogoniales, Los carposporofitos se forman a partir de una célula grande de fusión. Las cadenas de carposporocistos radian desde el centro y están rodeadas de filamento laxos. Las carposporas pueden empezar a dividirse dentro del talo produciendo estructuras de 4, 8 o más células. R. coccinea es el lectotipo de su género y se considera una especie endémica de Australia, Tasmania y Nueva Zelandia por lo que su presencia en la costa patagónica desde hace al menos 30 años es de interés biogeográfico. Referencias: Boraso & Arratia (2012). Para la zona antártica se ha citado el género Notophycus Moe con la única especies: Notophycus fimbriatus Moe (Lam 6-3-fig.12). Referencias: Moe (1986). Familia Cystocloniaceae Los gametofitos y tetrasporofitos son isomórficos, con talo uniaxial. Las células axiales están típicamente acompañadas de pocas periaxiales; la corteza es compacta, de células grandes internas y más pequeñas hacia afuera. El gametofito femenino produce procarpios; las ramas carpogoniales están dirigidas hacia adentro del talo y son típicamente tricelulares; la célula auxiliar es una célula cortical no diferenciada, nacida directamente de la célula soporte, ésta produce por división un solo filamento gonimoblástico hacia el interior del talo. El carposporofito no presenta vaina envolvente ni ostiolo y todas las células del gonimoblasto producen los carposporocistos que forman carposporas en cadenas. Los tetrasporocistos son zonados. Referencias: Womersley (1994). Acanthococcus Hooker & Harvey Posee una fronde linear, dicotómica, cartilaginosa, de color rosado a rojo oscuro. La estructura uniaxial está algo oscurecida lejos del ápice, cada célula axial lleva una célula periaxial. Médula filamentosa rodeada de células de paredes gruesas, con rizoides ascendentes y descendentes Corteza interna de células discontinuas y externa de uno o dos estratos de células pequeñas, pigmentadas, de paredes delgadas. Los tetrasporofitos poseen ápices espinosos y tetrasporocistos en las porciones inferiores de las ramificaciones terminales formando tetrasporas zonadas subcorticales.Los talos masculinos son pequeños y llevan muchas ramitas apicales no espinosas, con espermacios en soros superficiales sobre las últimas ramificaciones. Los talos femeninos llevan cistocarpios con espinas y presentan médula central rodeando un eje formado por un racimo de rizoides. La rama carpogonial es de tres células, con la hipógina más ancha que la basal. Se forma una célula de fusión a partir de la célula auxiliar que se une a la basal a través de sinapsis intercelulares secundarias, con varios brazos con grupos de carposporas. Referencias: Womersley (1994). 147 Acanthococcus antarcticus Hooker & Harvey Lam 6-5-fig. 6 Talo de hasta 25 cm de alto, erecto, con un grampón fibroso y ramificado. Ejes principales desde comprimidos hasta subcilíndricos, de hasta 3 mm de diámetro. Ramificación hasta del sexto orden, alterna dística, irregular, subdicotómica o pectinada. Las ramas de último orden son cortas y abruptamente afinadas, o largas y gradualmente afinadas, pueden llevar rámulas de crecimiento determinado de hasta 2 mm de longitud. Corteza con 1-3 estratos de células progresivamente más pequeñas, siendo las células superficiales rectangulares o irregularmente poligonales, de 6 x 10 µm de diámetro. Cistocarpios intercalares o subterminales en las ramas laterales, con hasta seis espinas. Los carposporocistos de unos 50 µm de diámetro se ordenan en cadenas ramificadas. Las cavidades de los espermatocistos son de hasta 50 µm de diámetro. Los talos masculinos llevan los espermatocistos en soros superficiales ubicados en las ramas de orden superior. Los talos tetraspóricas son menos espinosos que los carpospóricos; los tetrasporocistos, de 20 - 50 x 50 - 1000 µm de diámetro se encuentran inmersos en la corteza modificada. Referencias: Joly et al. (1964); Fredericq et al. (1992); Boraso & Zaixso (2007). Familia Caulacanthaceae Especies con talos erectos, o de ramas entremezcladas, o pulvinados o parasíticos. Con ramas cilíndricas o comprimidas de estructura uniaxial o con un pequeño grupo de células apicales iniciales. Las células axiales con una a dos periaxiales que producen filamentos laxos, sin rizoides o pseudoparénquimas y una corteza pseudoparenquimática. El ciclo de vida es trifásico, con talos sexuales monoicos o doicos, no procárpicos. Las ramas carpogoniales están formadas por 2 a 5 células, producidas en la médula o en la corteza interna y están dirigidas hacia afuera. Los filamentos de conexión son cortos, no septados ni ramificados. La célula auxiliar es cercana a la rama carpogonial, y produce un solo primordio de gonimoblasto dirigido hacia adentro o varios hacia fuera, no se forma tejido nutritivo sino una célula de fusión extendida con filamentos del gonimoblasto radiales que forman uno o pocos carposporocistos. Los cistocarpios son ostiolados sin tejidos filamentosos externos de envoltura. Los espermacios se forman en rosetas sobre la corteza externa. Los tetrasporocistos son solitarios o en nematecios, adheridos basalmente a las células de la corteza interna y divididos en forma zonada. Referencias: Womersley (1994). Catenella Greville Frondes rojizas, lineares, rastreras, desde cilíndricas a compresas, constreñidas a intervalos en los nodos, algo más anchas en los internodos donde se ubican las ramificaciones; forma numerosos hapterios. La estructura es uniaxial o con pocos filamentos multiaxiales a partir de un pequeño número de células apicales. La médula está compuesta por filamentos anastomosados y la corteza por filamentos de células moniliformes. El gonimoblasto está dirigido hacia adentro y los cistocarpios son ligeramente estipitados. Los tetrasporocistos son zonados. Referencias: Womersley (1994). Catenella fusiformis (J. Agardh) Skottsberg Lam 6-6-figs. 4-7 Talos predominantemente reptantes, intermareal, frecuentemente asociado a Stictosiphonia intricata (S. hookeri) formados por ramas de aspecto fusiforme, en las que se destaca una célula apical y el arreglo celular en ángulo respecto al eje de crecimiento. En corte longitudinal se observa una zona central de filamentos de células algo alargadas y una corteza de células pequeñas. En los tetrasporofitos se encuentran los tetrasporocistos zonados, formados a partir de los filamentos internos, y desarrollándose en la superficie del talo, entre las células corticales. En la zona no hemos observado carposporofitos. Referencias: Skottsberg (1923); Boraso & Zaixso (2007). 148 Lam 6-5: fig. 1: Plocamium cartilagineum(?); fig. 2: Kallymenia antarctica; figs. 3-4 : Plocamium secundatum: 3: ramas, 4: detalle de ápices; fig. 5: Ahnfeltiopsis furcellata; fig. 6: Acanthococcus antarcticus; figs. 7-12: Rhabdonia coccinea 7: rama, 8: rámula con tetrasporas, 9: tetraspora zonada; 10: rodoplastos, 11: cistocarpio con carposporofito joven, 12: masa de carposporas maduras. 149 Familia Phyllophoraceae Esta familia abarca especies con ciclos de vida trifásicos o bifásicos, en este último caso los tetrasporocistos se forman sobre el gametofito femenino. El gametofito es erecto, el tetrasporofito a veces es postrado, los talos erectos son más o menos cartilaginosos, usualmente ramificados en forma desde dicotómica hasta irregular, a veces prolíferos, las ramas son desde cilíndricas hasta aplanadas. La estructura es multiaxial, con una médula compacta de células grandes y paredes engrosadas. La corteza es firme, de células pequeñas ubicadas en filas anticlinales. Los tetrasporofitos son postrados o desconocidos en algunas especies, los tetrasporocistos se dividen cruciadamente y se encuentran en cadenas anticlinales en nematecios superficiales. Los espermatocistos son usualmente superficiales y agrupados. Los gametofitos son procárpicos, con células soporte de la rama carpogonialactuando como células auxiliares. Los cistocarpios se desarrollan típicamente en grupos separados por filamentos estériles, formando a veces carposporocistos o tetracarposporocistos. Se observaron monospoocistos en unas pocas especies. Referencias: Womersley (1994). Para la zona antártica se han citado: para el género Gymnogongrus Martius las especies G. antarcticus Skottsberg (Skottsberg, 1953) y G. turquetii. Hariot (= Phyllophora appendiculata) (Hariot, 1907), (Lam 6-6-fig. 9). Estévez y Cáceres (2003) reportan la colección en Provincia de Buenos Aires de Gymnogongrus torulosus (Hooker & Harvey) Schmitz. Anhfeltiopsis Silva & De Cew El gametofito erecto es dicotómico, con ramas desde cilíndricas hasta aplanadas. La médula es pseudoparenquimatosa con corteza de series anticlinales de células pequeñas. Los cistocarpios son internos . La rama carpogonial está formada por tres células y la célula soporte actúa como auxiliar generativa. A partir de la primer célula o de las dos primeras células de la rama carpogonial se forman células estériles. La corteza del cistocarpio se engrosa en la madurez, formándose un poro especializado o carpostoma formado por filamentos periclinales, originados en las células ordenadas en filas anticlinales de la corteza. Los espermatocistos se ubican en soros, de a pares, y son 4 - 5 veces tan largo como anchos. El tetrasporofito es costroso, con tetrasporocistos cruciados formando cadenas intercalares, ubicados en nematecios superficiales. Referencias: Womersley (1994). Ahnfeltiopsis furcellata (C. Agardh) Silva & De Cew Los gametofitos tienen ramificación básicamente dicotómica, con ramas desde sub - cilídricas hasta ligeramente aplanadas; de 5 - 12 cm de alto. Luego el talo produce proliferaciones laterales en varias direcciones. Los cistocarpios son de paredes rígidas, se encuentran inmersos, y relativamente voluminosos, sobresaliendo marcadamente del talo. Las carposporas son pequeñas y se encuentran en grupos dispersos en la médula, dejando un espacio hueco al ser emitidas a través de un ostiolo. El ciclo de vida de esta especie abarca una alternancia de un esporofito costroso y un gametofito dioico erecto. Isabel Paternoster (com. pers.) estudió el ciclo de un alga proveniente del norte de Chubut, con las características vegetativas de esta especie, la que posee una importante zona basal perenne, en tanto la parte erecta es anual. Intermareal, sobre piedras. Referencias: (Pujals, 1963) (como Gymnogongrus furcellatus (C. Agardh) J. Agardh; Silva & De Cew (1992); Boraso & Zaixso (2007). Poblaciones de una especie de Ahnfeltiopsis, provisoriamente asignadas a A. devoniensis (Greville) P. C. Silva & De Cew han sido reportadas para la provincia de Buenos Aires, las mismas están caracterizadas por ciclos directos, donde las carposporas 150 producidas en carposporofitos desarrollados sobre gametofitos erectos producen por apomixis, nuevamente gametofitos.(Becherucci et. al., 2012). Para la zona antártica se ha citado: Phyllophora Greville con las especies: Phyllophora ahnfeltioides Skottsberg: y Phyllophora antarctica A. Gepp & S. Gepp. Familia Gigartinaceae Comprende talos multiaxiales, erectos, saxícolas, carnosos, foliáceos o comprimidos, frecuentemente de tamaño. La médula está formada por un retículo de filamentos anastomosados, o por filamentos irregulares no formando retículo. La corteza consiste típicamente de filamentos ramificados en dirección anticlinal. Los tetrasporocistos están divididos cruciadamente y se disponen o en filas dentro de la corteza, o en masas globosas, adyacentes la médula a o inmersas en ella. El origen de los tetrasporocistos puede estar en filamentos de la subcorteza, o de la corteza, o en filamentos especiales de la médula. Los espermatocistos se disponen en parches extensos, superficiales. Los gametofitos femeninos son procárpicos, con rama carpogonial de tres células. La célula soporte es grande, suele engrosarse luego de la fecundación, actuando como célula auxiliar. Los filamentos del gonimoblasto se proyectan hacia la médula y prácticamente todas sus células forman carposporocistos; alrededor del gonimoblasto puede o no formarse una envoltura de filamentos estériles. Referencias: Hommersand et al. (1993). Los géneros de Gigartinaceae actualmente reconocidos son: Chondrus Stackhouse, Gigartina Stackhouse, Iridaea Bory, nom. cons., Rhodoglossum J. Agardh; Chondracanthus Kützing, Sarcothalia Kützing y Mazzaella G. de Toni . Gigartina Stackhouse Talos con estructura multiaxial, desde cilíndricos hasta foliáceos, adheridos con discos o procesos basales. El tetrasporofito es similar al gametofito, provistos con crecimientos verrucosos sobre la superficie, algunos los cuales son vegetativos y otros están asociados a estructuras reproductivas femeninas. La médula está formada por filamentos anastomosados o por células de varias formas y tamaños. La corteza es de células pequeñas, ovales o esféricas, en filas anticlinales de 4 a 16 células de longitud. Los tetrasporocistos se desarrollan en la corteza interna, en el límite con la médula, se dividen en forma cruciada y se agrupan en soros globosos o achatados. Los espermatocistos se hallan en papilas o en soros superficiales irregulares. Los cistocarpios, los que se ubican sobre las papilas, son prominentes y muestran un estrato interno firme de filamentos estériles que rodean al gonimoblasto. Los filamentos del gonimoblasto penetran los tejidos de la envoltura externa del mismo, relacionándose por uniones celulares secundarias y células tubulares formando una placenta. Referencias: Hommersand et al. (1993). Gigartina skottsbergii Setchell & Gardner Los talos son orbiculares, gruesos y cartilaginosos, de hasta 60 cm de diámetro y de color rojo oscuro. Su posición en el terreno es paralela al sustrato, ya que se fijan al sustrato por medio de varios procesos rizoidales ubicados en un área sobre la cara abaxial. La superficie de gametofitos muestra abundantes papilas pediceladas, esféricas o irregulares, vegetativas o con uno a varios cistocarpios. Los gonimoblastos se encuentran rodeados de un tejido poco definido. Los tetrasporofitos presentan la superficie del talo lisa. La médula está formada por filamentos longitudinales entremezclados, con paredes muy gruesas y la corteza por filamentos anticlinales muy apretados, de células pequeñas con varios rodoplastos parietales sin pirenoide. Los tetrasporofitos forman tetrasporas cruciadas en los estratos corticales internos. Los talos masculinos son también de superficie lisa, con espermatocistos 151 superficiales. Crece sobre sustratos duros en el infralitoral. Referencias: Setchell & Gardner (1937); Piriz (1996); Boraso & Zaixso (2007). Iridaea Bory Los talos de este género se encuentran frecuentemente en grupos, presentan láminas cordadas o en forma de hoja, a veces con estípites cortos, cilíndricos o aplanados o con un disco basal perenne. Algunas especies son iridiscentes bajo el agua. La médula es incolora, de filamentos entremezclados, con mucho espacio intercelular, lacorteza es de filamentos anticlinales cortos. Los tetrasporocistos se dividen en forma cruciada y se encuentran en soros superficiales formados a partir de filamentos primarios de la corteza. Los espermatocistos forman soros extendidos. Los cistocarpios están total o parcialmente inmersos en el talo, son prominentes, usualmente sin ostiolo bien definido. Los talos son procárpicos, con rama carpogonial de tres células, ubicada sobre una célula soporte que funciona como auxiliar. Los filamentos del gonimoblasto crecen hacia el interior del talo, y prácticamente todas sus células forman carposporocistos; el gonimoblasto no forma una red intrincada y se encuentra rodeado por una cubierta masiva Referencias: Hommersand et al. (1993) Iridaea cordata (Turner) Bory Talos desde verdosos hasta rojos, con frondes cartilaginosas, elásticas, satinadas al secarse. Las frondes erectas son desde lanceoladas u ovales hasta anchas y foliosas, alcanzan hasta 35 cm de alto y son usualmente perforadas en la senectud. La base es cordada, con estipe aplanado, de 1-4 cm de largo. La adhesión es por un disco basal. Las láminas alcanzan hasta 500 µm de grosor, con una médula de 400 µm compuesta por una masa de filamentos pericilinales poco densos y corteza de 50 µm de filamentos anticlinales., ramificados dicotómicamente, formados por células de 3.-6 µm de diámetro Los carposporofitos están rodeados por abundante tejido filamentoso y se ubican dispersos sobre ambas superficies de toda la lámina. Los tetrasporocistos en cadenas se originan en la corteza interna de los tetrasporofitos y forman esporas cruciadas en soros subcorticales.Habita piletas del intermareal y sublitoral. Durante un período, hace unas décadas atrás, se consideró que I. cordata era una especie boreal y que los ejemplares de Antártida referidos a la misma debían denominarse I. micans Bory, actualmente en cambio se aplica el nombre I. cordata a la especie de Antártida y zona subantártica, considerándose I. micans un sinónimo de la misma. La especie boreal denominada I. cordata es conocida actualmente como Mazzaella splendens. Referencias: Ricker (1987); Cormaci et al. (1992); Weykam et al. (1997); Boraso & Zaixso (2007). Sarcothalia Kützing El género estaría caracterizado por dimorfismo, con gametofitos muy ramificados o espinosos y los tetrasporofitos lisos, aunque esta característica no es evidente en algunas especies como S crispata. Los talos se encuentran frecuentemente en grupos, presentan láminas cordadas o en forma de hoja, a veces con estípites cortos, cilíndricos o aplanados o con un disco basal perenne. La médula es incolora, de filamentos entremezclados, con mucho espacio intercelular y la corteza es de filamentos anticlinales cortos. Las células internas del gonimoblasto son multinucleadas e interconectadas, otras desplazan al tejido externo compacto y se conectan al mismo por células externas tubulares.Los tetrasporocistos nacen en filamentos secundarios en la médula que radian de un centro y forman un soro circular. Referencias: Hommersand et al. (1993). 152 Lam 6-6: figs. 1-2: Callophyllis. variegata: 1: aspecto general, 2: corte en corteza; fig. 3: Callophyllis atrosanguinea; figs.4-7: Catenella fusiformis: 4: césped sobre mejillín, 5: aspecto del talo, 6: talo rastrero, 7: corte en corteza; fig. 8: Nereoginkgo. adiantifolia; fig. 9: Gymnogongrus turquetii. 153 Sarcothalia crispata (Bory) Leister in Hommersand et al. Lam 6-7-figs. 5- 10 Talos desde medianos hasta grandes, desde rojo púrpura hasta dorados, a veces tornasolados. Generalmente con un pequeño pie, ápices generalmente afinados, a veces bífidos. Bordes dentados hasta ciliados, comenzando a formarse desde la base del talo, extendiéndose luego apicalmente con densidad variable. Los carposporofitos muestran las características del género. Los tetrasporofitos se forman a partir de las células de la médula y son cruciados, formando en la madurez soros internos lenticulares. Los soros de tetrasporas y los cistocarpios protruyen solo levemente del talo. Las esporas se liberan por rotura del talo. Se encuentra en el: submareal y en piletas de marea del intermareal inferior. expuestas a veces a fuerte oleaje. Referencias: Scrosati (1991) (como Iridaea crispata); Boraso & Zaixso (2007). Sarcothalia dichotoma (Hooker & Harvey) Leister Lam 6-7-fig. 11 Comprende talos con ramificaciones subdicotómicas de uno a varios órdenes, de base plana, en foma de "v", de bordes sin denticulación. Las formas con la fronde menos dividida suelen mostrar las láminas más anchas, ovales hasta reniformes y las formas con más divisiones dicotómicas muestran láminas en forma de hoja angosta. A medida que el talo pierde tejido en el extremo distal debido a la emisión de esporas adopta la forma de un triángulo invertido; en la medida que el tejido remanente no se desprende el talo senescente puede devenir reticulado. En corte transversal se observa una médula con el centro filamentoso de hifas paralelas, un tejido intermedio de células alargadas dirigidas en todas direcciones y una corteza de filamentos anticlinales de células pequeñas. Las estructuras reproductivas son muy semejantes a las de S. crispata Referencias: Hooker & Harvey (1845); Skottsberg (1923) (como Iridaea dichotoma); Boraso & Zaixso (2007). Mazzaella De Toni Este género, se caracterizaría por sus meristemas difusos y procarpios dispersos; células auxiliares subesféricas con numerosas protrusiones; filamentos del gonimoblasto conectados por células tubulares a las células medulares primarias y células secundarias del tejido involucral y cistocarpios con filamentos absorbentes radiando desde la porción basal del gonimoblasto hacia la periferia del mismo, con un anillo de filamentos medulares circundando la masa de carposporas.El tejido involucral sería poco diferenciado en las especies australes, siendo rápidamente consumido, y más diferenciado en cambio en las boreales; las células que son contactadas son consumidas y no incorporadas al gonimoblasto. Las cadenas de carposporocistos se forman directamente del gonimoblasto. Referencias: Womersley (1994). Mazzaella laminarioides (Bory) Fredericq. Lam 6-7-figs. 1-4 Talos desde pequeños con una parte basal importante con numerosas proyecciones erectas, canaliculadas hasta formas más grandes de lámina ensanchada y de base canaliculada. No he encontrado en la zona patagónica continental ejemplares que puedan asignarse a esta especie, la que se encuentra en Tierra del Fuego. Referencias: Pujals (1963); Hoffmann y Santelices (1997) (como Iridaea laminarioides). Familia Kallymeniaceae Talos erectos foliosos, sólidos o perforados, hasta ramificados y comprimidos en un plano,o parasíticos y pulvinados. Estructura multiaxial, con médula de células ovoides pseudoparenquimatosas o filamentosa y frecuentemente con células estrelladas o con contenidos refractantes, usualmente acompañadas de filamentos rizoidales delgados; corteza de filamentos anticlinales. Varios rodoplastos discoides por célula. Los gametofitos son dioicos, con o sin procarpios. Las ramas carpogoniales están formadas de tres células 154 y son mono o policarpogoniales, se presentan frecuentemente acompañadas de células acompañantes grandes y lobuladas. Luego de la fertilización se forma una célula de fusión que en los géneros no procárpicos genera filamentos de conexión hacia los sistemas de células auxiliares, en los que la célula auxiliar está acompañada de filamentos cortos. Los gonimoblastos se forman a partir de la célula auxiliar o de los filamentos de conexión adyacentes a la misma y dan carposporocistos inmersos entre los filamentos. Cistocarpios con o sin ostiolo protruyendo en el talo. Espermatocistos formados a partir de las células corticales superficiales. Tetrasporocistos cruciados, superficiales en la zona cortical. Referencia: Norris (1964); Womersley (1994). Kallymenia J. Agardh Talo laminar, expandido, usualmente lobado, de superficies firmes y algo resbalosas. Corteza de 3 ó 4 estratos celulares. Filamentos medulares dirigidos periclinalmente, no densos, asociados con células estrelladas grandes de contenido muy refractario. Ramas carpogoniales y células auxiliares en diferentes células soporte. Las células de la rama carpogonial se fusionan luego de la fecundación para dar uno o más filamentos de conexión, los cuales se conectan con la célula auxiliar. Carposporocistos en grupos desarrollados a partir de un gran gonimoblasto, mezclado con filamentos estériles, la mayoría de las células del gonimoblasto desarrollándose en carposporocistos. Tetrasporocistos divididos en forma cruciada. Espermatocistos superficiales, dispersos por todo el talo. Referencias: Lindstrom en Guiry & Guiry (2003-2013). Kallymenia antarctica Hariot: Lam 6-5- fig. 2 Talo erecto, de hasta unos 15 cm de alto, folioso, dicotómico, sin nervaduras ni venas. Crecimiento por meristemas apicales o laterales. Tetrasporocistos cruciados, en toda la superficie, sobre la corteza externa, cistocarpios inmersos pero protruyendo sobre una superficie, angostamente ostiolados en el ápice. Esta especie aparece esporádicamente en la costa patagónica de Argentina. Referencias Lamb & Zimmermann (1977). Boraso de Zaixso (1993). Callophyllis Kützing Talos laminares, muy divididos dicotómicamente, palmadamente o pinnadamente, sin engrosamientos ni venas. Márgenes desde lisos hasta dentados o laciniados. Médula de células grandes pseudoparenquimatosas mezcladas con filamentos ramificados pigmentados. Corteza de 4 ó 5 estratos progresivamente más pequeños hacia el exterior. Tetrasporocistos embebidos justo debajo de la corteza, divididos en forma cruciada, pudiendo germinar in situ. Espermatocistos en parches superficiales, formados a partir de las células más externas de la corteza. Gametofitos femeninos procárpicos, policarpogoniales o monocarpogoniales, con la célula soporte funcionando como auxiliar. Gonimoblasto desarrollándose hacia adentro, rodeado de tejido estéril, masas de carposporocistos separadas entre sí por filamentos estériles. Cistocarpio protruyendo unilateralmente con uno o varios ostiolos. Referencias: Arakaki et al. (2011). Callophyllis. variegata (Bory) Kützing Lam 6-6-figs. 1-2 Talo de color rojo a rojo oscuro, membranáceo hasta cartilaginoso, ramificado en un plano, muy variable en aspecto, base de fijación reducida. Talo en sección transversal mostrando una médula de células grandes, poco pigmentadas, con almidón, con rizoides entre ellas y una corteza de filas anticlinales de células. Las células presentan algunos rodoplastos discoides, parietales (neoplastidio) sin pirenoide. Los gametofitos femeninos llevan cistocarpios no pedunculados en las partes distales de la fronde. Los 155 tetrasporofitos cruciados se ubican en la zona cortical; los espermatocistos son cortados de la corteza externa. Es una especie frecuente en el submareal, sobre rocas, asociado a bosques de Macrocystis. Referencias: Boraso & Zaixso (2007). Callophyllis atrosanguinea (Hook. & Harv.) Hariot: Lam 6-6-fig. 3 Fronde plana, con corto estipe, que se ensancha gradualmente en una lámina palmatilobada, los lóbulos son alargados, hasta de 1 cm, con lóbulos cuneiformes, dilatados, de axilas redondeadas, con el margen escasa y toscamente dentado. Color rojo sanguíneo oscuro. Las tetrasporas están dispersas por la superficie del talo. Referencias: Hariot (1887); Norris (1964); Ricker (1987); Adams (1994); Peters et al. (2005). Para la zona antártica se han citado además:Callophyllis tenera J. Agardh (Hommersand et al., 2009); Sarcodia. montagneana (Hook. & Harv.) J. Agardh. de la familia Sarcodiaceae (Kylin & Skottsberg, 1919); Hymenocladiopsis crustigena Moe de la familia Faucheaeceae (Moe, 1985) y Gainia mollis Moe de la familia Familia Gainiaceae (Moe. 1986). Orden Ceramiales Los talos de las Ceramiales poseen una organización básicamente haplóstica, y son desde filamentosos ramificados hasta pseudoparenquimatosos, laminares o cilíndricos. Abarcan desde arqueotalos hasta cladomas, frecuentemente asimilables a la llamada estructura polisifónica. El crecimiento en número de células es generalmente apical, aunque también puede ser intercalar en algunas Delesseriaceae. En todo el orden suele observarse un gran aumento en el volumen celular, muchas veces acompañado de aumento en el número de núcleos por célula. Las células pueden ser uninucleadas o multinucleadas, siempre con neoplastidio, sin pirenoides. Los tetrasporocistos se encuentran divididos cruciada o tetraédricamente, pueden ser externos o inmersos en el talo, pueden encontrarse dispersos o localizados en soros y a veces son reemplazados por polisporocistos o parasporocistos. Los espermatocistos se forman en estructuras corimbosas o en masas compactas, sobre tricoblastos o en soros. Los gametofitos femeninos forman procarpios sobre una célula soporte, con o sin células estériles. La rama carpogonial consta de cuatro células, fusionándose luego de la fecundación con una o más células auxiliares producidas luego de la fertilización. Los carposporofitos pueden estar desnudos, o rodeados de un involucro laxo de filamentos estériles, o dentro de un pericarpio denso. Los carposporocistos son producidos a partir de todas las células del gonimoblasto o solo de las células terminales de los filamentos gonimoblásticos. Referencias: Womersley (1998). Familia Ceramiaceae Esta familia comprende especies caracterizadas o por arqueotalos o por cladomas de naturaleza haplóstica, de medianos a pequeños, frecuentemente epífitos, uniaxiales, con o sin corticación. Las células poseen uno o varios núcleos. Los tetrasporocistos se presentan divididos cruciada o tetraédricamente, solitarios o en racimos; en algunas especies se encuentran polisporocistos presentes. Los espermatocistos se forman en parches marginales o en cabezuelas esféricas o alargadas, o agrupados. En el gametofito femenino pueden desarrollarse cortas ramas especializadas de crecimiento determinado, de 1-3 células, denominadas a veces pericentrales, las cuales sirven de sostén a las ramas carpogoniales de 1-4 células. Luego de la fertilización se forman una o dos células de conexión entre el carpogonio y las células auxiliares, las que se forman de las células soporte o de las pericentrales adyacentes. 156 Lam 6-7: figs. 1-4: Mazzaella laminarioides: 1-3: aspectos generales, 4: base canaliculada; figs. 510: Sarcothalia crispata: 5 y 10: aspectos generales, 7: borde denticulado, 8 corte con médula y carposporofitos inmersos, 9: corte en corteza, fig. 11: Sarcothalia dichotoma. 157 Los carposporocistos se forman de todas las células o sólo de las terminales del gonimoblasto. El carposporofito puede llevar un involucro de células estériles o ser desnudo. Referencias: Mendoza (1969); Womersley (1998). Antithamnion Nägeli El talo es un cladoma filamentoso, que puede ser erecto o parcialmente postrado en la zona basal, no corticado, el cual suele estar adherido por un pequeño disco o zona filamentosa. Las ramas laterales de crecimiento definido se ubican sobre cada una de las células del eje, generalmente opuestas, a veces una o ambas son reemplazadas por una de crecimiento indefinido. La ramificación comienza desde el ápice en secuencia regular y, hacia la base puede ser algo alterna. La célula basal de las rámulas es tan larga como ancha, algo más pequeña que las adyacentes y no porta rámulas del siguiente orden. Las células son uninucleadas. Muestra células glandulares, las que se originan a partir de células vegetativas, las que siguen dividiéndose luego de formarlas por lo que queda cada célula glandular ubicada sobre varias células del filamento. Los tetrasporocistos son ovoides, divididos en forma cruciada, sésiles o pedicelados, y se ubican en posición adaxial sobre las células proximales de ramas opuestas. Los espermatocistos se encuentran agrupados sobre ramas especializadas nacidas sobre el lado adaxial de las células proximales de las rámulas. Las ramas carpogoniales se producen en número de dos ó más y nacen en las células basales de rámulas sucesivas ubicadas en los ápices de las ramas. Luego de la fertilización el ápice de la rama cesa su crecimiento en largo y se deflecta hacia un lado a medida que el gonimoblasto madura. La mayoría de las células del gonimoblasto forman gonimolobos redondeados protejidos por rámulas envolventes. Referencias: Mendoza (1969). Antithamnion densum (Suhr) Howe Lam 6-8-fig. 7 Ramas de crecimiento determinado ubicadas sobre el eje en forma dística, opuestas; simples o llevando adaxialmente rámulas preferentemente distales, éstas simples o a veces con una ramita del siguiente orden; las ramas más largas de segundo orden están ubicadas en el centro de la rama primaria de crecimiento determinado y a veces ligeramente curvadas hacia atrás, dándole a la misma un aspecto algo flabelado. Cuando se desarrolla sobre el eje una rama lateral de crecimiento indeterminado se suprime la opuesta de crecimiento determinado. Las células glandulares son adaxiales y se apoyan sobre dos células de rámulas cortas del último orden, las que pueden mostrar hasta cuatro células distales luego de la célula glandular. Los carposporofitos son expuestos y los tetrasporofitos ovales, con un pedicelo formado por una célula pequeña, ubicados sobre las ramas de primer orden y reemplazando a la correspondiente de segundo orden, o sobre rámulas cortas y con una pequeña rama lateral sobre la célula del pie. Referencias: Mendoza (1969) (como A. simile); Boraso & Zaixso (2007) Esta especie es la más común del género en la costa patagónica Según Wollaston (1979) la especie A. simile (Hooker & Harvey) J. Agardh se debe denominar Pterothamnion simile (Hooker & Harvey) Nägeli. Las ilustraciones de A. simile en Mendoza (1969) son aplicables a un Antithamnion en sentido estricto que por sus características corresponde a A. densum. Antithamnion cruciatum (C. Agardh) Nägeli Esta es la especie tipo del género. Puede presentar una porción basal decumbente bastante desarrollada, con células de paredes algo engrosadas, y ramas cortas de células apicales redondeadas. Las porciones erectas se caracterizan por la disposición decusada sobre los ejes de las ramas de crecimiento determinado, éstas con 158 una célula basal pequeña. Las ramas de crecimiento determinado presentan rámulas que terminan en porciones suavemente afinadas. Las células glandulares se apoyan sobre dos o más células de las ramas de último orden. Referencias: Kühnemann (1969). Pterothamnion Nägeli Este género muestra células terminales de los pleuridios afinadas, típicamente presenta pares de pleuridios opuestos y pares adicionales perpediculares a los primeros en algunos verticilos. Así como disposición unilateral de los pleuridios secundarios y terciarios; sobre algunas ramas viejas éstos pueden, en forma poco frecuente, ubicarse en forma opuesta. Ramas de los verticilos en pares opuestos, los dos miembros de cada par iguales o subiguales. Con producción facultativa de un par adicional, transversal al primero, más reducido. Ramas indeterminadas usualmente reemplazando a las determinadas en forma regular. Las ramas indeterminadas laterales son muy desarrolladas, lo que da al talo un aspecto dicotómico. Los ápices indeterminados son sinusoidales, cortando grupos pectiniformes de laterales en forma alterna. Células glandulares adaxiales sobre células comunes de las rámulas, cada una ubicada sola sobre la célula que le dió origen. Tetrasporocistos solitarios o en grupos, sésiles o pedicelados, reemplazando rámulas. Procarpos sobre la célula basal de un pleuridio no reducido de un verticilo, ubicados 5-10 células por debajo del ápice de crecimiento indeterminado, 1 ó 2 por eje. Carpoporofitos desnudos o cubiertos por un involucro laxo. Moe & Silva (1980). Pterothamnion plumula (Ellis) Moe & Silva Cuando los ejes secundarios de crecimiento indeterminado reemplazan a los pleuridios, su desarrollo suele estar acompañado de la aparición de nuevos pleuridios sobre el mismo verticilo. Las células glandulares se ubican sobre la célula que les dan origen. Los tetrasporocistos son de división cruzada, solitarios o en grupos de 2-3 sobre una misma célula, la que actúa como pedicelo. Referencias: Laing (1905). Moe & Silva (1980). Notas: Mendoza (1969) cita e ilustra un talo con ramificaciones alternas dísticas que asigna a Callithamnion plumula (Ellis) Thur. var. plumula, y en su sinonimia a Antithamnion plumula (Ellis) Thur., dicha especie no cabe en la descripción usual de A. plumula, o de Pterothamnion plumula, que típicamente presenta pares de pleuridios opuestos y pares adicionales perpediculares a los primeros en algunos verticilos. Dichas ilustraciones podrían corresponder a un aspecto vegetativo de Antarcticothamnion polysporum (Kylin) Moe & Silva. Para la zona antártica se han citado: Pterothamnion antarcticum (Kylin) Moe & Silva Referencias: Moe & Silva (1980) y Antarcticothamnion polysporum (Kylin) Moe & Silva. Referencias: Moe & Silva (1979). Antithamnionella Lyle Talos erectos o con porción erecta y postrada, no corticados, con ápices ligeramente curvos o rectos. Los ejes con verticilos de 1- 6 ramas de crecimiento determinado, generalmente de igual largo; simples o con rámulas. Las células basales de las ramas de crecimiento determinado son de igual o similar tamaño que las células adyacentes y pueden producir una ramita vegetativa. Una rama de crecimiento indeterminado puede reemplazar a un pleuridio del verticilo. Células uninucleadas. Las células glandulares, cuando existen, son cortadas adaxialmente de las células intercalares centrales o proximales de las rámulas, correspondiéndose con una sola célula del pleuridio. Los tetrasporocistos son ovoides o subesféricos, divididos en forma cruciada o tetraédrica, sésiles o pedicelados, sobre células proximales de las rámulas. Los espermatocistos se forman sobre ramas espermatangiales ramificadas ubicadas adaxialmente sobre las rámulas. Ramas carpogoniales de cuatro células, de uno a tres procarpos en el ápice de ramas, ubicados sobre las células basales de rámulas que solo se alargan una o dos células más allá de la célula soporte. 159 Luego de la fertilización, el ápice de la rama se detiene en su crecimiento en largo y se deflecta hacia un lado mientras el gonimoblasto madura. La mayor parte de las células del gonimoblasto producen carposporocistos, en grupos lobados o alargados. Referencia: Mendoza (1969). Antithamnionella ternifolia (Hooker & Harvey) Lyle Lam 6-8-figs. 1-4 Talos erectos, usualmente epífitos sobre otras Ceramiales del submareal y niveles inferiores de intermareal, de hasta 2-4 cm de longitud. Eje central de 50-75 µm de ancho con células de 6-8 veces tan largas como anchas. Ramas de crecimiento determinado simples, en verticilos de 3-4 ramas en el extremo superior de cada célula del eje. Ápice envuelto en las rámulas. Células glandulares solitarias o en series adaxiales sobre las rámulas, correspondiéndose una a una con las células que le dan origen. Tetrasporocistos ovales (50 x 110 µm), adaxiales o menos frecuentemente abaxiales sobre las rámulas, en posición proximal. Gonimoblastos globosos, desnudos, usualmente agrupados, rodeados por 4-5 ramas. Referencias: Mendoza (1969); Boraso & Zaixso (2007). Plumariopsis De Toni Género monotípico. Plumariopsis eatoni (Dickie) De Toni Esta especie es idéntica en su estructura vegetativa con Georgiella confluens pero tendría tetrasporocistos cruciados, las ramas de crecimiento indeterminado se forman de primordios formados especialmente y los ápices son rectos. Referencias: Moe & Silva (1983). Falklandiella Kylin Talos erectos de aspecto filamentoso, ramificados en varios órdenes, en un plano.Ejes creciendo por células apicales con división oblicua superadas por los pleuridios apicales. Corticación del eje y de las ramas casi total, a partir de tres células iniciales, formado por células rizoidales cortas dirigidas inicialmente hacia el centro del eje indeterminado. Ramas laterales de crecimiento limitado sobre todas las células del eje, formadas sobre primordios secundarios, simples o con ramificaciones de primer grado, no corticadas. Reemplazadas más o menos regularmente por ramas de crecimiento ilimitado de desarrollo semejante al eje y corticadas. Tetrasporocistos, divididos tetraédricamente, usualmente terminales sobre rámulas cortas, a veces laterales El procarpio se forma a partir de una célula pericentral especial cortada a partir de los ejes, perpendicular a las ramas laterales. Referencias: Mendoza (1969). Falklandiella harveyi (Hooker) Kylin Lam 6-9-figs. 15-16 Talos erectos, ramificados, de hasta 30 cm de alto, de color rojo vivo. Eje central de células grandes rectangulares, más cortas en el ápice, hasta 3-5 veces tan largas como anchas al centro y en la base. Corticación del eje casi total. Ramas laterales de crecimiento limitado sobre todas las células del eje, simples o con ramificaciones de primer grado, no corticadas. Reemplazadas ocasionalmente por ramas de crecimiento ilimitado similares al eje. Ápices de ramas simples encorvadas hacia adentro. Tetrasporocistos sésiles, ovales (75-80 por 140-150 µm), tetraédricamente divididos, terminales sobre las rámulas y el ápice de una rama determinada. Carposporofitos globosos protegidos totalmente por ramas encorvadas, en la porción subterminal de las ramas laterales. La mayoría de las células del gonimoblasto transformadas en carposporas. Referencias: Hooker & Harvey (1847); Mendoza (1969); Boraso & Zaixso (2007). 160 Lam 6-8: figs. 1-4: Antithamnionella ternifolia: 1: carposporofito sobre gametofito, 2: ramificación y célula glandular, 3: ramas con tetrasporas, 4: ápices; fig. 5: Callithamnion montagnei; fig. 6: Callithamnion gaudichaudii; fig. 7: Antithamnion densum; figs. 8- 11: Anotrichium furcellatum, 8: rodoplasto, 9- 10: ramificación, 11: eje con tetrasporas. 161 Ceramium Roth Talo usualmente erecto, a veces parcialmente postrado, saxícola o epífito, ejes uniseriados, cilíndricos, ramificados en varios órdenes, formados por un eje de células grandes, corticadas en su porción distal por células pequeñas, esta corticación puede extenderse sobre el resto de la célula en grado variable, ya sea circunscribiéndose la corticación a los nodos, es decir sobre las paredes transversales de los ejes, o cubriendo todo el talo; pudiendo variar en grado desde la zona apical de las ramas, donde suele ser parcial hata las zonas basales donde es continua. Ápices de las ramas a veces en forma de pinzas dobladas hacia el interior y a veces rectos. Células uninucleadas con neoplastidio, rodoplastos discoides hasta fusiformes, más densos en las células más pequeñas, Tetrasporocistos inmersos en las bandas corticales o proyectándose fuera sobre las mismas, con o sin céluas estériles protegiéndolos. Procarpos con una o dos ramas carpogoniales formadas por cuatro células, naciendo de una pericentral que forma la célula auxiliar luego de la fertilización. Filamentos de conexión presentes o ausentes. Gonimoblastos naciendo sobre los nudos, normalmente impidiendo mayor crecimiento vegetativo en ese punto pero iniciándos varias rámulas estériles desde abajo, las cuales actúan como involucro. El gonimoblasto es redondeado, con uno a tres gonimolobos, están rodeados de una cobertura gelatinosa y todas sus células forman carposporocistos. Especies de Ceramium corticadas en los nudos Ceramium diaphanum (Lightf.) Roth Talos erectas de color rojo vivo, de hasta 4-6 cm de alto, talo subdicotómico. Ápices muy encorvados hacia adentro. Ejes de células grandes corticados en los nudos por células grandes internamente y pequeñas externamente, irregularmente dispuestas externamente. Largo de las células del eje, 1-3 el alto de los nudos (4-6 en la forma moficata Petersen). Ramas laterales a partir de los nudos, corticadas, de ápices no encorvados. Tetrasporocistos ovales de 50 x 70 µm en región superior abultada de los nudos. Gonimoblastos globosos, con 4-5 ramas involucrales, sobre ramas laterales y prolíferas. Referencias: Mendoza (1969). Ceramium strictum Greville ex Harvey Lam 6-9-figs. 13-14 Talos erectos, rojo vivo, de 4-6 cm de alto, pseudodicotómicos. Ápices rectos. Células del eje incoloras de longitud hasta 8-9 veces el alto de los nudos. Nudos corticados por células pequeñas en el borde y más grandes al medio. Ramas laterales divididas pseudodicotómicamente y con ramas laterales más cortas. Con rizoides latrales de 2-3 células de largo sobre los nudos. Tetrasporocistos desde esféricos a ovales de 50 por 60 µm, solitarios o en verticilos incluídos o protruyendo de los nudos. Carposporofitos protegidos por 3-4 ramas involucrales largas, ubicados apicalmente sobre las ramas laterales. Referencias: Mendoza (1969); Boraso & Zaixso (2007). Especies de Ceramium totalmente corticadas Ceramium rubrum (Hudson) C. Agardh Lam 6-9-figs. 11- 12 Talos rojo-parduzco, pseudodicotómicos, proliferaciones laterales cortas variando en grado de abundancia. Talo con varias ramas primarias más desarrolladas que las proliferaciones laterales. Ramas apicales apenas encorvadas hacia adentro, con los ápices de crecimiento jóvenes encorvados hacia adentro y enderezándose a medida que la rama envejece. Con nudos algo marcados por corticación más pequeña e internudos con células corticales algo más largas que anchas, esta característica más notable hacia las zonas medias en inferiores del talo. Gonimoblastos globosos, cubiertos por 2-4 rámulas involucrales de tamaño variable, las que generalmente no alcanzan a recubrirlo cuando 162 está completamente desarrollado. Tetrasporas en verticilo asociados a las zonas de los nudos. Mendoza (1969) señala varias variedades de C rubrum que diferencia por el tipo de proliferaciones laterales, tamaño de las tetrasporas y el grado de abultamiento de las zonas internodales. Al momento resulta difícil separar a las mismas de la variedad principal ya que es posible encontrar en el mismo individuo características propias de varias de ellas. Sin embargo es claro que los ejemplares de un mismo ambiente y localidad tienden a parecerse entre sí en forma bastante característica, pudiéndose por ejemplo diferenciar poblaciones de talos muy robustos epilíticos, en piletas de marea que podrían ser asignadas a la var. proliferum en tanto que otras formas algo más delicadas podrían ser ubicadas en la var pedicellatum. Sobre Aphanocladia robusta se observaron ejemplares asignables a la var barbatum. Referencias: Mendoza (1969); Boraso & Zaixso (2007). Ceramium dozei Hariot Talos de tamaño mediano, rojo obscuro, con corticación completa y continua por un estrato de células internas, más grandes y uno externo de células pequeñas, ápices rectos, no recurvados, en forma de pequeña horquilla. Proliferaciones abundantes. Rizoides unicelulares y tetrasporocistos dispuestos alrededor de la base de las ramas terminales y proliferaciones. Gonimoblastos protegidos por ramas involucrales en la región subterminal de las ramas prolíferas. Referencias: Hariot (1887); Kylin & Skotttsberg (1919); Mendoza (1969). Ceramium involutum Kützing Talos erectos color rojo vivo, de hasta 8 cm de alto, con ramas laterales poco divididas. Eje central corticado totalmente por un estrato de células internas, más grandes y uno externo de células pequeñas, con nudos visibles. Ápices en forma de tenazas con porciones terminales encorvadas hacia adentro formado un círculo. Tetrasporocistos ovales 80x 90 µm, incluidos en la corticación, en verticilo al medio de los nudos de las ramas laterales. Referencia: Mendoza (1969). Ceramium irregulare Kützing Talos erectos, rojo vivo, de 4-7 cm de alto. Crecimiento por varios ejes con ramas más cortas. Células del eje grandes hacia la base, corticación por un estrato de células internas, más grandes y uno externo de células pequeñas, nudos bien delimitados con zona internodal con células alargadas. Ápices rectos. Ramas prolíferas cortas sobre los nudos, abundantes, frecuentemente en pares o verticilos con ápice simple o en horquilla. Tetrasporocistos sobre ramas laterales y prolíferas, de 60 x 80 µm, agrupados, incluídos en los nudos. Referencia: Mendoza (1969). Ceramium lessonii Del. ex Kützing Talos erectos, rojo vivo, de 5-10 cm de alto, marcadamente expandido y repetidamente pseudodicotómico, formando matas. Ramas terminadas aproximadamente todas a la misma altura. Ejes de células grandes de tamaño homogéneo en todo el talo, corticados totalmente por un estrato de células internas, más grandes y uno externo de células pequeñas; nudos poco marcados. Ápices encorvados hacia adentro, a veces doblemente encorvados. Tetrasporocistos ovales 80-90 µm de diámetro, en verticilos incluídos en los nudos de las ramas laterales. Carposporofitos globosos, con 4-5 ramas involucrales no muy grandes, en la región terminal de las ramas. Referencia: Mendoza (1969). Callithamnion Lyngbye Talo filamentoso erecto, delicado, saxícola o epífito. Ejes y ramas laterales mayores ramificados en forma alterna, helicoidal o dística, ramas laterales secundarias alternadas o unilaterales, a veces dísticas sobre tramos cortos. 163 Células multinucleadas. A veces con rizoides descendiendo de la base de las ramas. Tetrasporocistos divididos tetraédricamente solitarios o en series, en posición adaxial, usualmente sésiles. Espermatocistos en grupos, adaxiales sobre las ramas laterales. Procarpos con dos células pericentrales sirviendo de soporte, opuestas sobre los ejes principales, cerca de los ápices. Una de cada par llevando una rama carpogonial de cuatro células. Cada célula soporte forma, luego de la fertilización, una célula auxiliar, la que se fusiona con el carpogonio a través de una célula de conexión. Excepto las células basales del gonimoblasto, el resto forma carposporocistos. Gonimoblasto globular o irregular, con 2 a 4 gonimolobos formados de las dos células auxiliares. Normalmente falta el involucro. Referencias: Mendoza (1969); Womersley (1998). Callithamnion gaudichaudii C. Agardh Lam 6-8-fig. 6 Talos epífitos de color rojo oscuro, piramidales, muy ramificados, con ramas primarias en espiral sobre los ejes, más cortas que los mismos. Ramas de los ápices de crecimiento con los ápices ligeramente curvados hacia adentro, abriéndose luego a medida que las ramas se desarrollan o devienen fértiles. Ejes primarios y secundarios corticados por rizoides delicados, descendentes desde las células basales de las ramas del siguiente orden. Diámetro celular disminuyendo en forma paulatina hacia las ramas de orden mayor. Carposporofitos desnudos, globosos. Tetrasporocistos madurando desde la base de las ramas de los últimos órdenes hacia los ápices, de forma que en talos menos maduros suele verse uno solo por rámula y en las más maduras se aprecian varios tetrasporocistos maduros por rámula. Espermatocistos incoloros, en rámulas pequeñas apretadas ubicadas en zonas apicales. Referencias: Mendoza (1969); Boraso & Zaixso (2007). Callithamnion montagnei Hooker & Harvey. Lam 6-8-fig. 5 Talos de color rojo claro, ejes primarios con ramas primarias ubicadas en forma dística, corticadas por rizoides descendentes delicados. Ramas laterales de último orden cortas, con células algo más engrosadas en el centro que en la base y células apicales disminuyendo de tamaño y algo en punta. Tetrasporocistos en series. Carposporofitos desnudos. Frecuentemente epifita sobre Codium fragile. Referencias: Mendoza (1969); Boraso & Zaixso (2007). Aglaothamnion Feldmann Mazoyer. Comprende a las especies originalmente ubicadas en Callithamnion que poseen células uninucleadas, abarcando algunas especies con gonimolobos globosos y otras con gonimolobos lobados o cordados, o en punta. En algunas especies la rama carpogonial es en zig-zag, en otras en U o en L. Aglaothamnion uruguayense (Taylor) Aponte, Ballantine & Norris. Talo arbustivo, rígido de 2,5 a 3,5(-7) cm. Eje principal visible abajo, mezclado con laterales, ecorticado salvo unos pocos rizoides basipetos basales. Ramulas laterales dísticas, simples o subsimples en todo el talo, rámulas afinándose hacia los ápices, algo arqueadas. Células de los ejes al medio del talo cilíndricas, con constricciones medianas, de 50-115 µ de diámetro; largo celular hasta 4 veces el diámetro, en las rámulas de hasta 60 µ de diámetro, más pequeñas distalmente. Tetrasporocistos en series o solitarios, sobre el lado superior de las rámulas, sésiles ovales, de hasta 45 µm de diámetro y 55 µm de largo. Talos cistocárpicos de forma más irregular, cistocarpios ovales, apareados, de hasta 210 µm de largo y hasta 100 µm de ancho. Rama carpogonial en foma de "L". Gonimolobos esféricos a ovoides, sostenidos por filamentos involucrales. 1-2 ramas espermatangiales por célula, espermatocistos hemisféricos, pulvinados, agregados en un solo estrato adaxial. Tetrasporocistos seriados, 164 individuales, ovales, 50-55 µm por 42-45 µm. Referencias: Taylor (1939): Aponte et al. (1994). Papenfuss (1964) cita Aglaothamnion polyspermum (C. Agardh) Parke con dudas, la misma cita es repetida por Pujals (1977). Medeiothamnion Pujals. Talos ecorticados, mayormente erectos, rosados, delicados, de hasta 12 cm de largo, formados por filamentos ramificados hasta de cuarto orden, en forma opuesta en cada verticilo cerca de los ápices, pero opuesta, alterna dística o pectinada y más irregular hacia la base. Ramas ligeramente curvadas hacia arriba desde la base. Mayormente sin corticar excepto hacia la base. Adhesión por rizoides de 1-2 células. Células del eje principal muy largas, de 150-310 µm de diámetro. Eje excurrente con células de 35-50 µm de diámetro. Procarpos sobre células subapicales de ramas de crecimiento limitado sobre ramas de último y penúltimo orden. Rama carpogonial de 4 células formada a partir de la porción basal de la célula soporte, curvándose de forma que el carpogonio queda a la altura de la parte superior de la célula soporte. La célula soporte funciona como auxiliar. El carpogonio se fusiona con lacélula auxiliar, . ya sea directamente o a través de un puente citoplasmático. Los primordios de los gonimoblastos dan varios gonimolobos y estos producen unas 15 ramas carposporangiales que dan dos carposporocistos terminales cada una. El conjunto se rodea de ramas involucrales en uno o dos ciclos a partir de células estériles del procarpio. Espermatocistos sobre rámulas cortas. Tetraesporocistos ovales,tetraédricos en la mitad distal de células de ramas del último o penúltimo orden, sésiles o sobre pedicelos cortos, generalmente adaxiales. Referencias: Pujals (1970). Medeiothamnion flaccidum (Hooker & Harvey) Brauner. Lam 6-9-figs. 3-9 Laterales determinados pigmentados, racimos de esporocistos en diversas posiciones y cabezas espermatangiales en ramas verticiladas, ejes postrados, ramificación subdicotómica de los ejes indeterminados, procarpos tricelulares y una sola rama involucral sobre la célula hipógina. Referencias: Mendoza (1969); Pujals (1970); Brauner (1979); Boraso & Zaixso (2007). Griffithsia C. Agardh. Talo erecto ramificado subdicotómicamente. Células usualmente grandes, multinucleadas. Tetrasporocistos y espermatocistos en verticilos densos, a veces tetrasporocistos solitarios, con o sin células involucrales, ubicados en constricciones entre las células de los ejes. Tricoblastos caducos asociados a las estructuras reproductivas. Célula hipógina achatada, en forma de disco y ramas involucrales bicelulares. Involucro abaxial de ramas bicelulares formados por la célula basal, que funciona como auxiliar, luego de la fertilización y de una gran célula de fusión. La mayoría de las células del gonimoblasto forman carposporocistos envueltos en una mátrix gelatinosa. Mendoza (1969). Griffithsia antarctica Hooker & Harvey. Lam 6-9-figs. 1-2 Talos erectos, filamentosos, de hasta 20 cm de alto, de color rojo vivo. Ejes de células largas, cilíndricas, de hasta 400 µm de ancho por 3000 µm de largo. La pseudodicotomía original deviene en una aparente dicotomía del talo. Crecimiento apical por células cortas. Rizoides basales incoloros. Tetrasporocistos de 75-100 µm y espermatocistos en verticilos densos apicales de ramas unicelulares cortas protectoras. Referencias: Skottsberg (1923); Mendoza (1969); Boraso & Zaixso (2007). 165 Anotrichium Nägeli. Difiere de Griffithsia por varias características: una célula hipógina grande e inflada y ramas involucrales unicelulares numerosas, los tetrasporocistos y cabezas espermatangiales se ubican sobre pedicelos unicelulares ubicadas sobre las ramas de los verticilos o son sésiles; las ramas de los verticilos pueden a veces ser pilosas. La célula soporte suele funcionar como auxiliar. Boraso de Zaixso & Akselman (2005). Anotrichium furcellatum (J. Agardh) Baldock. Lam 6-8-figs. 8- 11 Los talos son filamentosos, delicados, ecorticados, de color rosado - rojizo, están ramificados lateralmente en los ápices y se muestra pseudodicotómico en el resto del talo; alcanzan hasta 14 cm de longitud y se encuentran usualmente en grupos numerosos en los que las ramas de diferentes talos individuales se encuentran enredadas entre ellas La primera ramificación lateral de cada rama se forma cerca del ápice de la misma y a una distancia de hasta 8 células del mismo, aunque usualmente es solo de dos o tres células. Las ramas se forman inicialmente formando ángulos agudos entre sí y son más abiertas en las zonas media y basal En la zona central del talo se observan sub-dicotomías cada 1-4 (5) células de la rama o eje . En la región proximal del talo pueden formarse filamentos rizoidales. El rango en la longitud de las células apicales fue de 28 - 80 (hasta 120) µm y en diámetro de 15 - 25 (hasta 30) µm; las células del centro del talo variaron en longitud entre 250 y 1200 µm y en diámetro entre 25 y 150 µm y las de la base del talo entre 1200 y 1970 µm en longitud y entre 260 y 290 µm en diámetro. La razón del largo al diámetro celular es 2-3 en la zona apical por encima de la primera dicotomía, hasta 4-10 en el centro del talo y de 3-4 en la base. Las células desarrolladas muestran un neoplastidio formado por numerosos rodoplastos parietales de pequeño tamaño Un solo tetrasporocisto por célula del filamento, con un pedicelo unicelular. La posición de la inserción de los tetrasporocistos sobre la célula es, desde distal cuando se los encuentra cerca del ápice del talo a subterminal o lateral a medida que se los encuentra más lejos de la zona apical del talo. Generalmente el pedicelo está inserto sobre células sin dicotomías en su ápice pero se pudo observar también la inserción de tetrasporocistoos sobre células inmediatamente por debajo de una dicotomía, los que presentaban una posición subterminal sobre la célula y no se encontraban en la dirección del eje, sino que estaban dirigidos lateralmente, en este caso el tetrasporocisto no está reemplazando a una de las ramas de la pseudodicotomía sino que sería una tercera rama. En un caso se observaron dos tetrasporocistos por sobre una tricotomía, uno de ellos asociado a una rama pequeña lateral. Referencias: Boraso de Zaixso & Akselman (2005); Boraso & Zaixso (2007). Para la zonas antártica se ha citado además los siguientes géneros monotípicos: Georgiella Kylin con la especie Georgiella confluens (Reinsch) Kylin (Lam 6-9-fig. 10). Referencias: Moe, & Silva, (1983). Antarcticothamnion Moe & Silva con la especie Antarcticothamniom polysporum (Kylin) Moe & Silva. Referencias: Moe & Silva (1979). Familia Delesseriaceae Talos foliosos, de naturaleza haplóstica, normalmente delicados, formados por la aposición lateral de filamentos de células poliédricas, a veces con venas macroscópicas centrales o laterales o ambas, con o sin vénulas microscópicas.El crecimiento puede proceder ya sea por una célula apical, cuyas derivadas pueden mostrar crecimiento por divisiones intercalares y producir a su vez todas ellas laterales, o también por células marginales apicales. En todos los casos las células se fusionan lateralmente produciendo una lámina de uno o varios estratos celulares. Las células son mayoritamente uninucleadas. 166 Lam 6-9: figs. 1-2: Griffithsia antárctica: 1: ramificaciones en el ápice, 2: ramificación pseudodicotómica y verticilos de células llevando tetrasporocistos; figs. 3-9: Medeiothamnion flaccidum: 3: ramificación en ápice, 4: ramificación por debajo del ápice, 5: rodoplastos, 6-7: tetrasporas, 8: ramificación en centro del talo, 9: comparación de células y ramificaciones del centro y del ápice del talo; fig. 10: Georgiella confluens; fig. 11- 12: Ceramium rubrum: 11: tetrasporas en nudos, 12: ramas con cistocarpio; fig. 13-14: Ceramium strictum, 13: ápices, 14: células en centro del talo; figs.15-16: Falklandiella harveyi: 15: en el terreno, 16: detalle de ramificación. 167 Los tetrasporocistos están divididos tetraédricamente y reunidos en soros en diferentes ubicaciones.Los espermatocistos se encuentran en soros dispersos sobre el talo o cerca de los márgenes. Los procarpos se forman sobre una célula pericentral con uno o dos grupos de células estériles asociados, con una rama carpogonial de cuatro células. Luego de la fecundación se corta una célula auxiliar a partir de la pericentral y se fusiona con el carpogonio, fusionándose luego varias células basales para formar una placenta incluída en el cistocarpio. Los carposporocistos pueden formarse en unas pocas células terminales del gonimoblasto o en todas. Alrededor de la masa de esporas se forma un pericarpio pseudoparenquimatoso con ostiolo.Referencias: Womersley (2003). Dada la complejidad de la familia se suele hacer referencia a dos subfamilias. Subfamilia Delesserioideae Abarca aquellos géneros con los procarpos restringidos a la filas primarias de células de las hojas fértiles, sin divisiones intercalares en dichas filas; con rizoides descendentes en la nerviación media y crecimiento por una sola célula apical que se divide transversalmente. Delesseria Lamouroux Talo erecto en forma de hoja, fronde monostromática, simple, lasciniada o ramificada, con una nervadura central de la que se nacen hojitas. Las nervaduras muestran en sección transversal una médula de células grandes entremezcladas con rizoides provenientes de las células corticales y una zona cortical de células más pequeñas. Los ápices muestran un nítida célula apical primaria; el crecimiento intercalar se observa solo a partir de células de las hileras de segundo orden. Células apicales de tercer orden sin llegar hasta el borde del talo. Procarpios sobre la nervadura central. Carposporas originadas de la mayor parte de las células del gonimoblasto. Tetrasporocistos y espermatocistos en soros. Delesseria lancifolia (Hooker) J. Agardh Lam 6-10--fig. 1 Frondes alargadas, delicadas, de hasta 30 cm de largo, con nervadura media y algunos nervios laterales opuestos. Ocasionalmente con ramificaciones desde la nervadura central. Cistocarpios globosos, sésiles sobre hojuelas sobre las nervaduras. Tetrasporocistos en soros a lo largo de la nervadura central o en hojuelas sobre la misma. Referencias: Skottsberg (1923); Mackenzie Lamb & Zimmermann; Peters et al. (2005); Hommersand et al., 2009); Boraso & Zaixso (2007). Delesseria fuegiensis Skottsberg Con un hapterio voluminoso hemisférico y estipe corto, hasta 30 cm de largo y 3 cm de ancho, nervadura central muy notable y persistente aún luego de desgastarse la lámina, con nervaduras laterales opuestas. Talos grandes con pinas dísticas marginales, similares a la fronde primaria, hasta de 12 cm de largo. Numerosas hojuelas sobre la nervadura media. Las hojas no tienen nervaduras secundarias. Hojuelas con carposporofitos sobre la base de la nervadura, primarias o secundarias. Esporocistos en soros normalmente sobre las hojas primarias, pero también sobre hojuelas secundarias. Referencias: Skottsberg (1923); Mendoza (1974). Delesseria epiglossum J. Agardh Frondes obtusas o agudas, de hasta 15 cm de largo y de hasta 1 cm de ancho, con hojas pequeñas y agudas proliferando sobre las nervaduras. Espermatocistos y tetrasporocistos en líneas siguiendo las nervaduras en hojas de cualquier tamaño y orden. Carposporofitos solitarios sobre las nervaduras medias de las hojuelas prolíferas. Referencias: Skottsberg (1923). 168 Delesseria macloviana Skottsberg Lam 6-10--fig. 6 Talos de hasta 15 cm de alto, rojo suave, con un pequeño disco basal y un estipe de hasta 4 cm. Con ramas laterales alternas saliendo de la nervadura central. Estipes cilíndricos en las proliferaciones, hojas angostas, con vénulas microscópicas y escasas hifas en las nervaduras. Sin pequeñas hojas opuestas sobre las nervaduras de las ramificaciones. Tetrasporocistos originados en células superficiales en un único soro longitudinal a lo largo de la nervadura central o varios soros triangulares a los lados. Carposporas en cadenas. Espermatocistos formados de las células superficiales, entre los nervios microscópicos de las ramificaciones que cubren la fronde. Referencias: Kylin & Skottsberg (1919) como Delesseria. hypoglossum,: Skottsberg (1923); Mendoza (1974); Boraso & Zaixso (2007). Delesseria salicifolia Reinsch Talos de hasta 11 cm de largo y hasta 18 mm de ancho de las láminas individuales. Márgenes enteros, ligeramente ondulados. Nervadura central bien desarrollada. Venas laterales simples desarrollándose hasta los márgenes. Láminas ramificadas desde la nervadura central. Las alas son monostromáticas excepto en las venas, las que tienen rizoides mezclados con las células grandes. Tetrasporocistos y procarpios en hojitas especiales de la nervadura central. Los tetrasporofilos tienen alrededor de 1 mm de largo y 600-700 µ de ancho y márgenes serrados. Las hojuelas cistocárpicas son un poco más pequeñas y serradas en los bordes. El pericarpio se caracteriza por los abundantes apéndices espinosos. Células grandes. Referencias: Kylin & Skottsberg (1919, 1923). Para la zona antártica se ha ctado: Delesseria antarctica Skottsberg. Referencias: Kylin & Skottsberg (1919) Odontolaingia Mendoza Género con los caracteres de la única especie, O. fuegiensis Mendoza (1976). Odontolaingia fuegiensis Mendoza Talo erecto con un estipe corto, fornde laminar,monostromática, en forma de hoja con una nervadura central prominente. Con pocas ramificaciones en forma de hoja y abundantes proliferaciones y dientes marginales. Los gametofitos femeninos muestran hojitas prolíferas a ambos lados de la nervadura central, nervios laterales y venas microscópicas. Crecimiento apical por una célula primaria, con crecimiento intercalar a partir de las hileras de segundo orden. Con células apicales terciales no desarrolladas hasta el borde de la fronde. Procarpio sobre la nervadura central y laterales de las hojuelas prolíferas. Tetrasporocistos sobre toda la superficie de la fronde. Referencias: Mendoza (1976d); Boraso & Zaixso (2007). Pseudolaingia Levring Género con las características de su única especie, P. larsenii (Skottsberg) Levring. Pseudolaingia larsenii (Skottsberg) Levring Lam 6-10-- fig. 2 Fronde foliacea, monostromática, con nervadura media con proliferaciones y un retículo de nervaduras secundarias. Crecimiento por célula apical, divisiones intercalares en series de células de orden segundo o superior. Soros de tetrasporocistos y cistocarpios dispersos por todo el talo. Referencias: Kylin & Skottsberg (1919); Levring (1944); Mendoza (1973); Boraso & Zaixso (2007). 169 Microrhinus Skottsberg Microrhinus carnosus (Reinsch) Skottsberg. Referencias: Reinsch (1888) (como Delesseria carnosa); Kylin & Skottsberg (1919); Skottsberg (1923); Mendoza (1973); Wynne (1982). Subfamilia Nitophylloideae Abarca los géneros en que los procarpos están distribuidos por toda la fronde fértil, con divisiones intercalares en las filas primarias de células. Excepto en el grupo Pseudophycodrys carecen de rizoides en la nervadura. Cistocarpio no cubierto por células rizoidales. Crecimiento por una célula apical o por muchas marginales. Pseudonitophylla Mendoza Con las características de la única especie, P. deseadensis Mendoza Pseudonitophylla deseadensis Mendoza Fronde monostromática, con nervadura central prominente, de hasta 30 cm dividida en varias hojas, con estipe desde corto hasta largo con hojuelas de hasta 2 cm de longitud a los lados de la misma y con nervaduras secundarias. Talo con una célula apical, con crecimiento intercalar ya en las filas de primer orden y ápices de las filas de tercer orden llegando al borde del talo. Procarpos sobre nervaduras laterales de hojuelas naciendo de las nervadura media y venas de las frondes primarias. Espermatocistos y tetrasporocistos en soros distribuidos por la fronde y las hojuelas. Referencias: Mendoza (1975). Pseudophycodrys Skottsberg Talos foliosos, generalmente repartidos en varias hojas lobadas, con nervaduras ramificadas, con rizoides en las nervaduras. Referencias: Skottsberg (1923). Pseudophycodrys phyllophora (J. Agarh) Skottsberg Lam 6-10--figs. 8-9 Los procarpios están distribuidos sobre la superficie de las frondes, generalmente cerca de las venas. Referencias: Boraso & Zaixso (2007). Phycodrys Kützing Talo monostromático excepto en nervaduras. Con nervadura central y venas laterales. Crecimiento apical. Tetrasporocistos usualmente sobre la superficie de la fronde primaria o extendiéndose a los segmentos marginales o procesos ciliares. Para la zona antártica se han citado Phycodrys antarctica (Skottsberg) Skottsberg y Phycodrys austrogeorgica Skottsberg. Referencias: Skottsberg (1923); Wynne (1982). Phycodrys quercifolia (Bory) Skottsberg Lam 6-10-- fig. 3: Ejes a veces denudados, con láminas laterales de hasta dos cm de ancho, con nervadura media y venas laterales opuestas, pinnadas. Cistocarpios dispersos entre las venas. Soros tetrasporangiales pequeños, de hasta 0,5 mm, a veces confluyendo, dispuestos submarginalmente entre las venas. Referencias: Kylin & Skottsberg (1919); Taylor (1939); Boraso & Zaixso (2007). Cladodonta Skottsberg Cladodonta lyallii (Hooker & Harvey) Skottsberg Lam 6-10--figs. 4-5 Talos de hasta unos 25 cm de alto, formadas por un eje denudado abajo y por frondas membranosas polistromáticas, consistentes, rojo vivo, con nervadura central y laterales apareadas, muy ramificadas marginalmente, a veces llegando a varios órdenes de ramificación con hojuelas de crecimiento limitado con borde serrado- dentado. 170 Lam 6-10: fig. 1:Delesseria lancifolia; fig. 2: Pseudolaingia larsenii; fig. 3: Phycodrys quercifolia; figs. 4-5: Cladodonta lyallii: 4: aspecto general, 5: detalle de hojuela; fig. 6: Delesseria macloviana; fig. 7: Myriogramme livida; figs. 8-9: Pseudophycodrys phyllophora; fig.10: Hymenena laciniata; fig. 11: Schizoseris condensata; figs. 12-13: Schizoseris dichotoma, 12: aspecto general, 13: detalle de base de talo joven. 171 Crecimiento por una célulla apical que se divide transversalmente. Tetrasporocistos en soros entre las nervaduras, en dos estratos, especialmente en las hojuelas de los bordes. Cistocarpios globosos con ostiolo prominente. Espermatocistos en soros por toda la superficie, entre las nervaduras. Referencias Skottsberg (1923). Mendoza 1969b; Boraso & Zaixso (2007). Para la zona antártica se ha citado el género Pantoneura Kylin con la especie tipo Pantoneura plocamioides Kylin. Referencias: Kylin & Skottsberg (1919); Mackenzie Lamb & Zimmerman (1977). Y entre los géneros parásitos a: Gonimocolax Kylin, con la especie Gonimocolax australis (Skottsberg) Kylin: Referencias: Kylin & Skottsberg (1919). Polycoryne Skottsberg Para la zona se ha citado Polycoryne radiata Skottsberg. Con talos parásitos en forma de ramas aciculares.Referencias; Kylin & Skottsberg (1919). Schizoseris Kylin Talos de hasta 45 cm de alto, de color rojo oscuro, adheridas al sustrato por un disco pequeño, la parte laminar de la fronde reducida o casi faltante, sobre todo en los ejemplares más viejos, quedando el talo reducido a la nervadura ramificada. Fronda constituída por una capa de células con gruesa nervadura central ramificada y con nervios laterales todos recubiertos por pequeñas hojas lanceoladas o con nervios paralelos y flanqueados por los restos de la fronde hendida. Tetrasporocistos agrupados en soros, a los lados de las nervaduras, en ambas superficies de la fronde principal y proliferaciones. Cistocarpios sobre la nervadura y a los lados de la misma. Schizoseris condensata (Reinsch)Ricker Lam 6-10--fig. 11 Presenta reducción de las frondes y nervaduras robustas. Es polistromática en la zona de los soros. El cistocarpio presenta un ostiolo prominente. Gran célula de fusión; gonimoblasto transformándose casi completamente en carposporocistos Referencias: Mendoza (1969 b) (como Schizoseris laciniata); Boraso & Zaixso (2007). Schizoseris dichotoma (H.& H.) Kylin Lam 6-10--figs. 12-13 Talo inicialmente formado por un sola fronde obovada, luego biloba, con una nervadura central que se ramifica repetidamente en forma dicotómica hasta hacerse evanescente hacia los bordes. Fronde adulta con eje desnudo por rotura de la lámina, la que queda limitada a las porciones remanentes apicales y a hojas proliferantes sobre la nervadura, similares a la original pero más angostas. Cistocarpos sobre las nervaduras, tetrasporocistos dispersos sobre la fronde. Referencias: Ricker (1987); Boraso & Zaixso (2007). Schizoseris griffithsiae (Suhr) Wynne Talos grandes de hasta 45 cm de alto, color rojo intenso. Adheridos al sustrato por un pequeño disco con un estipede 2-3 cm. Fronde con un gruesa nervadura ramificada repetidamente Fronde monostromática persistente, frecuentemente hendida en forma oblicua desde el borde hacia el centro. Crecimiento por células meristemáticas apicales que se dividen oblicuamente por sus dos caras, originando filas por divisiones intercalares. Borde de las frondes con papilas. Nervaduras con células internas grandes y externas progresivamente más pequeñas. Esporocistos originados en células corticales internas, agrupados en soros a los lados de las nervaduras laterales. Procarpios usualmente sobre las nervaduras laterales del último orden o sobre la superficie de la fronde. Referencias: Mendoza (1974) (como Schizoseris davisii (Hook. & Harv.) Kylin); Guiry & Guiry (2013). 172 Se ha citado además a Schizoseris polydactila (Reinsch) Skottsberg para las islas Georgias Referencia: Kylin & Skottsberg (1919). Myriogramme Kylin Talos de hasta 40 cm de alto, de color rosa, rojo o violáceo, con estipe corto. Fronda expandida con bordes desde enteros hasta lobulados. Crecimiento por zona marginal a partir de células que se dividen oblicuamente sobre dos de sus caras. Talo monostromático en el borde, polistromático hacia el centro del talo, con células de tamaño homogéneo, o totalmente polistromático. Con una nervadura ramificada hacia la base. Tetrasporocistos en soros, distribuidos irregularmente sobre ambas superficies de la fronde. Ramas carpogoniales sobre toda la fronde. Cistocarpios globosos con un poro apical. Carposporofito transformando la mayoría de sus células en carposporas. Referencia: Mendoza (1969 c). Myriogramme smithii (Hooker & Harvey) Kylin Frondes monostromáticas en los bordes, en abanico, formadas por varios lóbulos divididos a su vez en lóbulos menores, de color púrpura violáceo, estipitadas, cuneadas a flabeliformes, de ápices normalmente redondeados, con nervaduras dicotómicas bien desarrolladas divididas repetidamente en venas monostromáticas de varias células de ancho hasta desvanecerse en los bordes. Con proliferaciones en los bordes. Cistocarpios ostiolados sobre un lado y soros diminutos de tetrasporocistos dispersos por la superficie del talo. Referencias: Mendoza (1969c); Mackenzie Lamb & Zimmermann (1977). Myriogramme crozieri (Hooker & Harvey) Kylin Frondes enteras o algo laciniadas, con la nervadura basal no bifurcada, de hasta unos 20 cm de alto, de color rojo claro, adheridas por un pequeño disco basal, con un corto estipe. Fronde membranosa, expandida, con base estrecha, cuneiforme, margenes muy ondulados, con zona apical entera, lanceolada o dividida en segmentos angostos. Crecimiento marginal por división oblicua de células, por dos de sus caras, con abundantes divisiones intercalares. Fronde monoestratificada en el borde y con varios estratos de células de tamaño homogéneo al centro. Nervadura macroscópica basal. Tetrasporocistos en soros alargados por toda la superficie, carposporas en cadenas. Referencias: Mendoza (1969 c). Myriogramme livida (Hooker & Harvey) Kylin. Lam 6-10--fig. 7 Talo de hasta 15 cm de alto, con una única nervadura basal dividida dicotómicamente, elíptica en seccción transversal. Fronde dividida en anchos segmentos oblongos. En las porciones marginales el talo es monostromático. Tetrasporocistos en soros biestratificados, visibles sobre ambas caras de la fronda. Cistocarpios globosos con un poro apical distribuidos sobre todo el talo. Referencias: Mendoza (1969 c); Boraso & Zaixso (2007). Para Antártida se ha citado Myriogramme mangini (Gain) Skottsberg. Referencia: Gain (1912) como Nitophyllum mangini (Gain) Skottsberg. Gonimophyllum Batters Parásito sobre varias Delesseriaceae. Con venas microscópicas y carposporofitos terminales. Hemiparásitas de hasta 2 cm de alto. Filamentos endófitos basales y porción erecta formada por frondas arrepolladas, lobuladas, con crecimiento marginal por células que se dividen por dos caras. Número variable de estratos celulares. Nervaduras microscópicas anastomosadas por toda la fronde. Tetrasporocistos y espermatocistos en soros, cistocarpios por toda la fronde.hemiparásita sobre Hymenena falklandica. 173 Gonimophyllum insulare Warner Hemiparásitas de hasta 2 cm de alto. Filamentos endófitos basales y porción erecta formada por frondas arrepolladas, lobuladas, con crecimiento marginal por células que se dividen por dos caras. Número variable de estratos celulares. Nervaduras microscópicas anastomosadas por toda la fronde. Tetrasporocistos y espermatocistos en soros, cistocarpios por toda la fronde. Referencia Mendoza (1970 a). Hymenena Greville Talos desde unos pocos centímetros hasta unos 25 cm de alto, de color rojo a rojo parduzco. Fronde membranosa, delicada, muy ramificada subdicotómicamente. Crecimiento marginal por células marginales que se dividen por dos de sus caras. Venas macroscópicas y vénulas microscópicas, formadas éstas por células alargadas. Monostromática en el borde, polistromática en el centro y la base. Tetrasporocistos sobre ambas caras, en soros con tetrasporocistos en dos estratos. Cistocarpios globosos dispersos con carposporocistos terminales en los filamentos del gonimoblasto. Espermatocistos en soros. Referencias: Mendoza (1969b). Hymenena falklandica Kylin La fronde se encuentra dividida subdicotómicamente, formando segmentos angostos. La nervadura macroscópica es muy visible. Referencias: Mendoza (1969b); Boraso & Zaixso (2007). Hymenena laciniata (Hooker & Harvey) Kylin Lam 6-10--fig. 10 La fronde se encuentra dividida en segmentos anchos, muy lobulados, radiando desde el centro. La nervadura central no es conspicua. Referencias: Mendoza (1969b); Boraso & Zaixso (2007). Botryoglossum Kützing Botryoglossum platycarpum (Turner) Kützing: Organos reproductivos en proliferaciones especiales sobre la lámina o los bordes. Tetrasporocistos usualmente formados de células corticales. Referencias: Kylin (1924). Familia Rhodomelaceae Talos polisifónicos, con segmentos formados apicalmente, cada segmento se divide longitudinalmente en una célula axial central y cuatro o más células pericentrales, las que pueden o no dividirse transversalmente. Puede existir una corticación externa de filamentos predominantemente descendentes. Las ramas pueden ser de crecimiento indeterminado o determinado. Ramificación radial, a veces bilateral o dorsiventral, predominantemente de origen exógeno, a veces endógeno. Células uninucleadas o multinucleadas, con numerosos rodoplastos discoides. En algunos géneros pueden existir ramitas laterales monosifónicas, simples o ramificadas, denominadas tricoblastos. Tetrasporocistos en su mayoría con división tetraédrica, a veces cruciada, usualmente derivados de las células pericentrales primarias o secundarias. Espermatocistos usualmente sobre ramas especiales originadas en tricoblastos. Carpogonios originados usualmente en conexión con tricoblastos. Cistocarpios con un pericarpio ostiolado o no.Referencias: Choi et al. (2001); Womersley (2003); Kim et al. (2011). Polysiphonia Greville Talo principalmente erecto, monopodial, ramificado radialmente, con porción postrada usualmente limitada, adherido por numerosos rizoides. Tricoblastos generalmente presentes, insertos en espiral regular cerca de los ápices de las ramas, nunca más de uno por segmento, frecuentemente son caducos, dejando una cicatriz persistente. 174 Células pericentrales en un estrato de cuatro o más, relativamente constantes en número para cada especie. Las ramas endógenas, cuando existen, tienen dos pericentrales en el segmento basal. Los ejes pueden en algunas especies estar corticados por rizoides descendentes. Los tetrasporocistos están ubicados usualmente en series espirales, uno por segmento. Espermatocistos en estiquidios cilíndricos, originados en el primordio de un tricoblasto o de una rama primaria de un tricoblasto. Cistocarpios globulares, con un pedicelo corto. Polysiphonia abscissa Hooker & Harvey Lam 6-11-figs. 1-6 Talos de color rojo a pardo rojizo, los que,en su mayor expresión, forman largos mechones sedosos de hasta 14 cm de alto; pudiendo rebrotar luego de un período desfavorable. Suele mostrar fascículos laterales de ramas cortas y ahusadas. Ejes no corticados, con cuatro pericentrales y con numerosos tricoblastos en espiral, caducos, dejando una célula cicatricial prominente. Ramitas jóvenes con ápices en forma de corimbo. A medida que el talo envejece muestra más frecuentemente ramas adventicias en posiciones axiales sobre las ramas. Ramas espermatangiales con una o dos células basales, terminando en un largo filamento incoloro de hasta 8 células. Es una especie frecuente en el intermareal en toda la costa de Argentina. Referencias: Boraso & Zaixso (2007). Polysiphonia anisogona Hooker & Harvey Lam 6-12-fig. 10 Talos color rojo vivo, hasta de unos 4 cm de alto, repetidamente ramificados en forma pseudodicotómica. La zona basal algo decumbente, de hasta 300 µm de diámetro, con rizoides. Ejes sin corticación, con 10 - 14 pericentrales. Ramas de unos 300 µm de diámetro. Células muy largas en la porción inferior del talo, cada segmento mostrando una relación del largo y el ancho de entre 2 y 3. El origen de las ramas es axilar en los tricoblastos caducos.Referencias: Hooker & Harvey (1845); Taylor (1939). Polysiphonia brodiaei (Dillwyn) Greville Lam 6-11-figs. 9-11 Talos fláccidos y suaves, de hasta 23 cm de alto, de contorno piramidal, alargado en su máxima expresión, de aspecto muy variable con el estadío de crecimiento. Ejes bien diferenciados, corticados y cartilaginosos en la base, frágil, con ramitas en forma de pincel en las puntas. Ramas cicatrígenas sobre el eje. Organo de fijación rizomatoso o disciforme. Eje con cuatro a seis pericentrales cerca del ápice y ocho más abajo. Tricoblastos muy abundantes y relativamente cortos. Tiene una amplia distribución en el intermareal hasta submareal superior, creciendo epífita sobre talos robustos o en piedritas o en piletas pequeñas de marea. Referencias: Lazo (1982); Boraso & Zaixso (2007). Polysiphonia hassleri Taylor Lam 6-12-figs. 3-10 Talos pardo-rosados, de hasta unos 10 cm, con un eje de unos 300 µm de diámetro y un disco basal prominente. Ramas principales de unos 160 µm de diámetro, de aspecto subdicotómico y hacia el ápice con ramitas laterales largas de aspecto subcorimboso, de unos 42-50 µm de diámetro. Generalmente con cinco pericentrales. Numerosos tricoblastos apicales. Ejes corticados con varios estratos celulares, corticación más fuerte en la base. Ramas espermatangiales con una célula basal, cilíndricolanceoladas, sin células apicales diferenciadas y con tricoblastos asociados. Referencias: Taylor (1939) Otras especies citadas de Polysiphonia, para costa de Argentina o Tierra del Fuego son: Polysiphonia cancellata Harvey; Polysiphonia fuscorubens Hooker & Harvey:; Polysiphonia tenuistriata Hooker & Harvey. 175 Lam 6-11: figs. 1-6: Polysiphonia abscissa 1: aspecto general, 2: ramita adventicia axial, 3: ápices, 4-6: ramas con tetrasporas; figs. 7-8: Neosiphonia harveyi: 7: aspecto general, 8: ápice con tricoblastos; figs. 9-11: Polysiphonia brodiaei: 9: ápice, 10: pericentrales, 11: aspecto general; figs. 12-13: Streblocladia corymbifera 12: ramificación, 13: detalle del ápice; figs. 14-16: Herposiphonia sulivanae: 14 aspecto general, 15: detalle de ramas, 16: ramas con tetrasporocistos; fig. 17: Bostrychia intricata; figs. 18-19: Picconiella pectinata: 18: ápice en crecimiento, 19: ápice de tetrasporofito con tetrasporocistos; figs. 20-21: Lophurella hookeriana: 20: ramas apicales, 21: corte del talo; figs. 22-23: Aphanocladia robusta; fig. 24: Pterosiphonia pennata; figs. 25-29: Chondria macrocarpa: 25: aspecto general, 26: corte mostrando célula del eje y pericentrales alargadas, 27: ídem, más cerca del ápice, 28: ídem, con tetrasporas entre pericentrales. 176 Neosiphonia M.S.Kim & I.K.Lee Talos solitarios, epífitos o saxícolas, polisifónicos, con grampón rizoidal formado a partir de las células basales. Desde cuatro hasta nueve pericentrales. Corticado o no corticado. Ramas mayormente exógenas. Con laterales cicatrígenos. Tricoblastos en ápices de rámulas, uno por segment, simples o bifurcados, espiralmente dispuestos, caducos. Procarpios con rama carpogonial de tres células. Cistocarpios dispersos, ovales, con pedicelo corto. Ramas tetrasporangiales en una bifurcación de los tricoblastos, con ápice a veces estéril. Tetrasporangios tetraédricos en series espirales en las rámulas superiores. Referencias: Kim & Lee (1999); Guiry & Guiry (2013). Este género se ha separado de Polysiphonia sobre bases moleculares, la rama carpogonial tricelular parece ser una característica morfológica asociada. Neosiphonia harveyi (J. W. Bailey) M. S. Kim, H. G. Choi, M. Guiry & G. W. Saunders Lam 6-11-figs. 7-8 Talos oscuros, algo rígidos, de hasta unos 7 cm de alto, de contorno piramidal, ramas delicadas en el talo muy joven, pero más toscas con la edad, alcanzando 550 µm de diámetro. Ejes con cuatro pericentrales, no corticados distalmente, pero corticados desde el centro del talo hacia la base por rizoides descendentes. Tricoblastos caducos. Tetrasporocistos en vagas líneas espirales en ramas laterales no especializadas. Cistocarpios dispersos sobre las ramas de menor orden, con un estipe corto y grueso, ovales, sin poro visible. Es una especie generalmente submareal. Referencias: Taylor (1939) (como Polysiphonia argentinica Taylor); Boraso & Zaixso (2007). Rhodomela C. Agardh Talos cilíndricos, erectos, emergentes de una estructura discoide de fijación, formados por filamentos gruesos de naturaleza polisifónica, los que presentan divisiones transversales en las células pericentrales y varias capas de células externas. Los ejes pueden ramificarse repetidamente en forma espiral, dando progresivamente ramas más cortas. Forman ramas adventicias de la corteza externa y poseen tricoblastos. Rhodomela patagoniensis Taylor Talos arbustivos, blandos, marrón obscuro al secarse, hasta de 15 cm de alto, con eje de hasta 1,2 mm de diámetro, sin rámulas, divididos en varias ramas principales conspicuas en toda su longitud. Sección transversal mostrando un filamento axial y cuatro células grandes pericentrales adyacentes, con otras células grandes algo más alejadas rodeadas por células sucesivamente de menor tamaño hasta una corteza de células pigmentadas pequeñas. Ramas llevando numerosas ramas secundarias que se dividen repetidamente hasta las de último orden, de unos 2 cm de largo, las que llevan numerosas ramas laterales produciendo mechones peniciliformes. Tricoblastos numerosos en los ápices de las rámulas. Ramas estériles delicadas, agudas, subsimples, cuando fértiles se vuelven nodosas, de 70-105 µm de diámetro. Tetrasporocistos ovales a esféricos de 60-70 µm de diámetro, uno por nudo. Referencias: Taylor (1939). Lophurella Schmitz Talos formados por filamentos gruesos, firmes, de color oscuro, con un eje y cuatro pericentrales no segmentados transversalmente en cada segmento, con corteza externa pigmentada uniestratificada de células pequeñas y subcorteza de células incoloras. Lophurella comosa (Hook. & Harv.) Falkenberg Talo ramificado varias veces, con abundantes ramas laterales cortas en mechones sobre todo el talo y tricoblastos persistentes, de posición subterminal. Las células de la corteza presentan diversidad de formas en vista superficial. Existiría una 177 segunda forma con menos ramitas laterales. Tetrasporocistos en ramas laterales poco modificadas. Referencias: Hooker (1847); Skottsberg (1923). Lophurella hookeriana (J. Agardh) Falkenberg Lam 6-11-figs. 20-21 Talos pardo negruzcos, con ramificación de aspecto subdicotómico, ligeramente lúbricos, que adhieren medianamente al papel. Ramas laterales en varios órdenes, frecuentemente con rámulas laterales, ligeramente curvadas hacia el eje o hacia la rama del orden superior donde se inserta. A medida que envejece el eje va quedando desnudo y las rámulas quedan circunscriptas a mechones terminales o intercalares. Se observan tricoblastos laterales ramificados, algo pigmentados. La estructura polisifónica, con 4 células pericentrales, queda determinada en las primeras células apicales, la corticación también comienza muy cerca de los ápices. Las células corticales son isodiamétricas hacia los ápices y alargadas hacia la base. En las partes jóvenes se observan los segmentos por transparencia. Las células axiales y las pericentrales se alargan, éstas últimas engrosan su diámetro y suelen tener un contenido granuloso, especialmente en los ejes y ramas principales. Los tetrasporocistos se forman en ramas laterales cortas, engrosadas, sin tricoblastos, terminadas en una célula globosa o hemisférica, la que se divide transversalmente dando varias células achatadas. Tetrasporocistos ubicados en espiral, muy voluminosos cuando están maduros y sobresaliendo del talo, dándole a la rama fértil un aspecto en zig-zag. El material de Santa Cruz que pudimos analizar consta en su totalidad de esporofitos. Referencias: Skottsberg (1923); Boraso & Zaixso (2007). Chondria C. Agardh Talos polisifónicos, con un eje claramente visible. Eje central muy visible con varias células pericentrales alargadas periclinalmente, las que se dividen dando varios órdenes de células corticales sucesivamente más pequeñas e incoloras hasta producir las células pigmentadas de la corteza externa uniestratificada. Ápices con una porción apical uniseriada corta, inmersa en una depresión. Ramas espermatangiales en forma de hojuelas aplanadas ubicadas en los ápices. Comprende especies totalmente erectas hasta parcial o totalmente postradas, con ejes desde filamentos gruesos cilindricos hasta aplanados. Referencias; Millar and Wynne (1992). Chondria macrocarpa Harvey: Lam 6-11-figs. 25-29; Lam 6-12- figs. 14-15 Talos robustos de color castaño, hasta 15 cm de alto, profusamente ramificados, posee un olor característico y se decolora rápidamente fuera del agua. Vive en piletas de marea, zanjones intermareales y en el submareal. Referencias: Boraso & Zaixso (2007). También se han citado para la zona: Chondria dasyphylla (Woodward) C. Agardh y Chondria angustata (Hooker & Harvey) Kylin. Herposiphonia Nägeli Talos polisifónicos con ejes mayormente postrados, llevando en la mayoría de los segmentos rámulas erectas simples determinadas en series dísticas alternas, frecuentemente con ramas cortas indeterminadas de origen exógeno cada tres determinadas, también alternando a cada lado del talo. Segmentos con 6-18 pericentrales, en rangos algo variables en cada especie y entre ejes postrados y rámulas erectas. Ápices de los ejes desde curvos hasta circinados. Sin corticación, tricoblastos a veces presentes en rámulas determinadas, Rizoides a partir de las pericentrales ventrales, con ápices frecuentemente multicelulares. Estructuras reproductivas en rámulas determinadas, Tetrasporocistos, uno por segmento, en una serie abaxial. Espermatocistos en capítulos ovoides hasta cilíndricos, reemplazando a los tricoblastos. Cistocarpios globosos, ovoides, urceolados, laterales o semiterminales en rámulas determinadas. 178 En la zona se ha citado Herposiphonia sulivanae (Hooker & Harvey) Falkenberg (Lam 6-11-figs. 14- 16). Referencias: Hooker & Harvey (como Polysiphonia sulivanae); Boraso & Zaixso (2007). Pterosiphonia Falkenberg Talo con ramas postradas y ramas erectas, dísticas, alternas, con ramas subordinadas de uno a varios órdenes. Ramas desde cilíndricas hasta muy comprimidas, con (4-) 5 hasta 12 (-20) pericentrales, usualmente no corticadas. Ramas de último orden determinadas desprovistas de tricoblastos. Tetrasporocistos divididos tetraédricamente, uno por segmento, en series lineales, principalmente en ramas no modificadas de último orden. Espermatocistos en estiquidios agrupados cerca de los ápices de las ramas determinadas, arreglados dísticamente, con o sin ápices estériles, desarrollándose del primordio del tricoblasto. Cistocarpio ovoide a globular, con pedicelo corto. Referencias: Pujals (1967). Pterosiphonia dendroidea (Montagne) Falkenberg Talos de 3-7 cm con una porción trastrera y una erecta formada por vástagos achatados, ramificados varias veces en forma alterna dística cada dos segmentos. Existe una soldadura fuerte de varios segmentos de la porción basal de las ramas laterales con dos segmentos del eje. Diámetro de los vástagos 3-4 veces el largo de los segmentos Referencias: Pujals (1967). Pterosiphonia pennata (C. Agardh) Sauvageau Lam 6-11-fig. 24 Talos cespitosos de hasta unos 7 cm de alto, con una porción rastrera. Ecorticados, color rojo vivo hasta oscuro. Ejes erectos con con rámulas laterales cortas cada dos segmentos de crecimiento determinado, simples o, algunos de ellos con rámulas simples de segundo orden. Pericentrales desde 9 hasta 14. Segmento inferior de las ramas laterales soldado al eje. Diámetro del vástago el doble del largo de los segmentos. Tetrasporocistos hacia los ápices de ramas laterales con rámulas cortas que llevan un esporocisto por segmento. Referencias: Pujals (1967); Boraso & Zaixso (2007). Aphanocladia Falkenberg Talo formado por ejes erectos y postrados, con 4 pericentrales por segmento, sobre los ejes erectos se producen ramas en 1/4 de espiral sobre cada segmento. En los ejes postrados se suprimen las ramas dorsales y ventrales. Este esquema es regular sobre el eje principal, pero las ramas tienen algunas células basales antes de comenzar el esquema. Pueden presentar algún grado de corticación, no hay fusiones congénitas entre ramas de diferentes órdenes, las pericentrales no difieren de tamaño, ni poseen divisiones transversales. Referencias: Pujals (1967). Aphanocladia robusta Pujals. Lam 6-11- figs. 22-23 Talos generalmente pequeños, con una porción postrada y una erecta frecuentemente apoyada sobre el sustrato, de hasta 5 cm de alto, con ramas de hasta el cuarto orden. Con cuatro pericentrales. Corteza de células isodiamétricas bien desarrollada en las zonas media e inferior del talo, especialmente desarrollada en los cantos del talo. Con organización apical radial, espiralada, con un primordio por segmento. Dos de los primordios abortan, quedando finalmente una organización dística alterna Con agregados de rizoides a veces formando discos de adhesión pseudoparenquimatosos. Los tetrasporocistos se forman en las rámulas, uno por segmento, esféricos de hasta 80 µ de diámetro. Es una especie submareal aunque puede encontrarse en ambientes sombreados dentro de piletas de niveles bajos del intermareal. Frecuentemente epífita. Referencias: Pujals (1967); Boraso & Zaixso (2007). 179 Lam 6-12: fig. 1: Ahnfeltia, corte transversal del talo; fig. 2: Nemalion: corte de medulla y corteza; figs. 3-10: Polysiphonia hassleri, 3: aspecto general, .4: corte hacia la zona distal del talo, 5: corte hacia la zona basal del talo; 6: ápice, 7: ramificación, 8a-b: comienzo de rizoides al medio del talo y corticación rizoidal en la zona basal, 9: cistocarpio. fig.10: Polysiphonia anisogona, pericentrales; fig. 11-13: Bostrychia scorpioides: 11: ápices, 12: corte transversal con varias capas de pericentrales, 13: corte longitudinal del talo; figs. 14-15: Chondria macrocarpa: 14: ápice con hojuelas con espermacios, 15: cripta apical del talo, figs. 16-19: Bostrychia intricata: 16: vista superficial y del eje por transparencia, 17: ápices, 18: rama con tetrasporas, 19: corte transversal; figs. 20-22: Streblocladia camptoclada:, 20: aspecto general, 21: corte transversal, 22: rama con tetrasporas. 180 Picconiella De Toni Talos con ejes polisifónicos, de simetría bilateral, erectos, con crecimiento monopodial, con un eje muy marcado con cuatro pericentrales, cubierto de rizoides con ramas de crecimiento determinado. Alternan sobre los ejes rámulas uniseriadas de crecimiento determinado y algunas polisifónicas de crecimiento indeterminado. Ápices cubiertos lateralmente por ramas muy encorvadas. Tetrasporocistos tetraédricos, en la porción polisifónica de los ejes en crecimiento de los últimos órdenes, en dos de las cuatro pericentrales. Espermatocistos en estructuras elipsoidales formadas de ramas uniseriadas. Cistocarpio lateral, urceolado. Picconiella pectinata (Hook. & Harv. ) De Toni Lam 6-11-figs. 18-19 Talos de aspecto repetidamente plumoso, delicados Las ramas de crecimiento determinado son de color más oscuro que las más delicadas en crecimiento activo y presentan el eje polisifónico, mayormente no corticado y rámulas uniseriadas, algo rígidas, con la célula apical redondeada. Las ramas laterales de crecimiento indeterminado llevan rámulas simples uniseriadas desde el segmento proximal, vecino al eje, esa primera rámula suele ser más larga que las ubicadas más distalmente, dando el aspecto que la rama lateral está ubicada en la axila entre la misma y el eje. Esta especie es bastante frecuente en el submareal superior, epífito sobre otras algas rojas o sobre conchillas. Referencias: Skottsberg 1919; Boraso & Zaixso (2007). Para la zona antártica se ha citado: Picconiella plumosa (Kylin) De Toni fil. Referencia: Kylin & Skottsberg (1919); Mackenzie Lamb & Zimmermann (1977). Bostrychia Montagne in De la Sagra Célula apical que se divide basalmente, células de los segmentos que se dividen longitudinalmente dando varias, éstas se dividen a su vez transversalmente. Célula cortical que se dividirá dando células corticales primarias, cada una de ellas dará lateralmente una célula cortical secundaria. Algunos autores separan algunas especies en el género Stictosiphonia Harvey. Bostrychia intricata (Bory) Montagne Lam 6-11-fig. 17; Lam 6-12-16-19 Talos rojo oscuro a violáceos, decumbentes, en céspedes espesos, muy ramificados lateralmente, con hasta 10- 12 pericentrales, las que dan pericentrales de segundo orden , cada una de las cuales se divide transversalmente dando un filamento de hasta 6 o más células que crecen hacia la base. Los talos se adhieren por rizoides celulares formados a partir de las células pericentrales laterales e inferiores. Dos núcleos en la célula pericentral superior de cada segmento del talo. La propagación parece ser en gran medida vegetativa. Es una especie muy común en el intermareal medio, típicamente sobre superficies horizontales sombreadas, a veces sola, a veces mezclada con Catenella, sobre roca o epifita sobre mitílidos. Referencias: Kylin & Skottsberg (1919 y Boraso & Zaixso (2007) (como Stictosiphonia intricata) Bostrychia vaga Hooker & Harvey Talos con porciones postradas y erectas de hasta 2 cm de alto, púrpura verdoso a oscuro, con ramificaciones alternas o unilaterales. Con ramas apicales ampliamente arqueadas. Ejes con (4-) 6 (-8) pericentrales, cada una dividida transversalmente en 5-6 células, las cuales a su vez pueden producir una capa cortical de una célula de grosor. Tetrasporocistos en estiquidios, dos por segmento de acuerdo a Ricker (1987), aunque en la descripción original parecen más. Referencias: Ricker (1987). 181 Lam 6-13: figs. 1-10: Heterosiphonia berkeleyi: 1: zona apical, 2: talo viejo con ramificación más dispersa, 3: zona del talo con ramificación densa, 4: detalle de crecimiento simpodial en el ápice, 5: talo tetraspórico con estiquidios, 6: detalle de estiquidio, 7: rama espermatangial, 8: corte en zona vieja del talo, con base de rama, 9: cistocarpio sésil, 10: gametofito con cistocarpios numerosos. 182 Bostrychia scorpioides (Hudson) Montagne ex Kützing. Lam 6-12-fig. 11-13 Talos de hasta 5 (-10) cm de longitud, con ejes ramificados y profusamente provistos con laterales. Las pericentrales (5-7) por célula del eje, se dividen una vez transversalemnte y producen luego una corteza de dos capas de células. Los tetrasporocistos se forman en estiquidios, 1-4 por segmento. En la zona no son frecuentes los gametofitos fértiles, los cistocarpios descriptos para la especie son en forma de urna, subglobosos y los espermatocistos se ubican en ramas alargadas de color pálido. Referencias: Prud'Homme Van Reine & Sluiman (1980); Boraso & Zaixso (2007). Streblocladia Schmitz Talos de simetría dorsiventral, con una parte libre conspicua, ramificada simpodialmente en los extremos. Ramas en dos filas paralelas en las partes jóvenes, este esquema algo oscurecido en las más viejas. Segmentos con 4-12 células pericentrales. Un tetrasporocisto por segmento sobre una rama esporofítica. Procarpos solitarios, intercalares a partir del segundo segmento basal de un tricoblasto fértil de 4- 6 células o en forma terminal sobre ramas fértiles cortas. Ramas espermatangiales agrupadas, terminales, derivadas de tricoblastos fértiles, sin tricoblasto vegetativo. Ramas endógenas con dos pericentrales en el segmento basal. Referencias: Lazo (1982). Streblocladia camptoclada (Mont.) Falkenberg Lam 6-12-figs. 20-22 Talos atropurpúreos a purpúreos de hasta 4 cm de alto, formando céspedes de altura homogénea. Algunas ramas largas y otras abortivas. Cuatro células pericentrales. Pocos tricoblastos. Tetrasporocistos en ramas de último orden. Ramas espermatangiales adaxiales. Procarpos en la porción subapical del talo. Cistocarpios grandes, globulares. Epizoica sobre mitílidos en niveles inferiores del intermareal. Referencias: Lazo (1982); Boraso & Zaixso (2007). Streblocladia corymbifera (C. Ag.) Kylin Lam 6-11-figs. 12-13 Talos de hasta 12 cm de alto. Ramas largas y flexuosas bien desarrolladas, no espiralizados, sin ramas abortivas. Diez a doce células pericentrales. Pocos tricoblastos, escasa cortización. Tetrasporocistos en ramas de penúltimo orden, tetrasporocistos prominentes. Ramas espermatangiales adaxiales en grupos y con células apicales estériles. Procarpos en las ramas de cuarto a quinto orden, adaxiales. Cistocarpios medianos, globulares. Se encuentra en los niveles inferiores del intermareal sobre rocas y valvas. Referencias: Lazo (1982); Boraso & Zaixso (2007). Sporoglossum Kylin Género monotípico. Sporoglossum lophurellae Kylin Hemiparásitas sobre Aphanocladia robusta, de hasta 2 mm de largo. Con porción monosifónica basal endófita, una porción postrada y una de filamentos externos erectos. Sobre estos se disponen los tetrasporocistos en estiquidios foliosos, los espermatocistos en cabezuelas terminales sobre pedicelos cortos y cistocarpios gobosos sobre rámulas cortas polisifónicas, con carposporas terminales. Referencias: Kylin & Skottsberg (1919); Mendoza (1970). 183 Colacopsis De Toni Talos parasíticos con parte basal pulvinada y erectos algunos pocos polisifónicos, mayormente monosifónicos muy poco ramificados y terminando en estructuras reproductivas. Estiquidios de 5 a 8 pericentrales, con más de 3 tetrasporocictos por segmento. Cistocarpios esféricos a ovoides, sobre pedicelo al menos inicialmente monosifónico. Capítulos masculinos esféricos a ovoides sobre filamentos monosifónicos. Colacopsis lophurellae Kylin Referencias: Kylin & Skottsberg (1919, 1923). Para la zona antártica se ha citado al género Antarctocolax Skottsberg, con la única especie Antarctocolax lambii Skottsberg parásita sobre Picconiella plumosa. Referencias: Skottsberg (1953). Familia Dasyaceae Los talos de las Dasyaceae presentan ejes de estructura polisifónica y ramas laterales total o parcialmente monosifónicas. El crecimiento es claramente simpodial, siendo el eje de crecimiento desplazado lateralmente y reemplazado por un eje lateral que continúa el crecimiento en longitud. La ramificación es dística o radial, frecuentemente con organización dorsiventral. El eje puede o no estar corticado. Las células periaxiales se forman en secuencia en el sentido horario. Además de las ramas indeterminadas formadas a partir de las periaxiales pueden encontrarse en algunos géneros ramas denominadas pseudolaterales, formadas a partir de la célula axial, ubicadas entre la primera y la segunda periaxial. Varios tetrasporocistos, divididos tetraédricamente, se ubican en cada segmento de los estiquidios, los que pueden ser cilíndricos o comprimidos. Espermatocistos densamente agrupados sobre rámulas laterales. El procarpo puede formarse sobre cada tercera célula pericentral, o sobre cada última célula formada. Cada procarpo tiene una rama carpogonial de cuatro células y dos grupos de células estériles, estas últimas se fusionan con la conspícua célula auxiliar formada luego de la fecundación. El pericarpio suele ser voluminoso. Heterosiphonia Montagne Talo con ejes erectos o postrados, dísticos o ramificados subdicotómicamente. Talo cilíndrico o comprimido, con o sin corticación, con 4-12 células pericentrales cortadas en secuencia alterna. Ramas laterales determinadas, polisifónicas en la parte basal y monosifónicas en la distal, pigmentadas, ramificadas una o varias veces, ramas separadas por 2 a 9 internudos. De 4 a 9 tetrasporocistos se ubican en cada segmento de los estiquidios sésiles, terminales o laterales, con 5-9 pericentrales formadas en forma alterna. Los tetrasporocistos presentan una cubierta pre-esporangial de 2 a 4 células, las que los envuelven totalmente. Espermatocistos en estiquidios con cinco células periaxiales alternas, produciéndose entre 2 y 4 espermatocistos por célula parental. Los procarpos se ubican irregularmente en laterales monosifónicos. Rama carpogonial formada por 4 células, con 4-7 células en los grupos laterales estériles y 2-4 células estériles basales. Los gonimoblastos son producidos simpodialmente, con carposporocistos terminales. Cistocarpios iniciados antes de la fecundación, usualmente con un ostiolo en una prominencia apical. Referencias: Ricker (1987) Para la zona se han descrito Heterosiphonia berkeleyi Montagne y Heterosiphonia merenia Falkenberg, consideradas sinónimos según varios autores. La descripción que damos abajo abarca ambas especies, tanto los talos más robustos, asignables a H. merenia, como a los más laxos y subdicotómicos asignables a H. berkeleyi. 184 Heterosiphonia berkeleyi Montagne Lam 6-13-figs. 1-10 Especie tipo del género; de acuerdo al concepto de Skottsberg abarca ejemplares en los que predomina el hábito pseudodicotómico sobre el simpodial, esto podría ser cierto en las partes más viejas del talo pero en los ápices es claro el origen simpodial de las ramificaciones. Ocasionalmente, los talos más viejos pierden gran parte de las ramas laterales inferiores dejando solo los ejes pseudodicotómicos con mechones apicales, pero en la zona patagónica son comunes los talos muy frondosos en toda su extensión. Talos color rojo, de hasta 14 cm de alto. Ejes vegetativos simpódicos con 4 a 10 periaxiales, con rámulas laterales de menor porte, ramificadas a su vez simpodialmente en varios órdenes; las rámulas del último orden parcialmente monosifónicas, de entre 2 y 15 células. Tetrasporocistos en estiquidios desde cilíndricos a ahusados en las rámulas laterales, que se comienzan a esbozar en los glomérulos apicales, a veces en conjuntos pectinados discretos o continuos, con 5 o más pericentrales y hasta 5 tetrasporocistos por segmento. Espermatocistos en soros continuos dejando libres los extremos distales de las rámulas. Cistocarpios sésiles sobre las rámulas laterales. Talos con una corticación moderada entre los segmentos del eje simpodial. Refererencias: Kylin & Skottsberg (1919); Parsons (1975); de Jong (1997); Boraso & Zaixso (2007) (como H. merenia). Colacodasya Schmitz Colacodasya inconspicua (Reinsch) Schmitz Hemiparásitas sobre Heterosiphonia, de hasta 2 cm de alto. Porción basal endófita y filamentos erectos bifurcados en forma simpodial, con 4-6 células pericentrales. Tetrasporocistos en estiquidios y espermatocistos en ramitas, ambos en la última ramificación del eje erecto. Cistocarpios terminales, con carposporas en cadenas cortas. Referencias: Kylin & Skottsberg (1919); Mendoza (1970b). Referencias bibliográficas del capítulo 6. Adams, N.M. 1994. Seaweeds of New Zealand. An illustrated guide. Canterbury University Press. 360 p Aponte, N. E.; Ballantine, D. L.; Norris, J. N. 1994. Culture studies on the morphology and life history of Aglaothamnion herveyi (Howe) comb. nov., with notes on A. felipponei (Howe) comb. nov. (Ceramiaceae, Rhodophyta). Phycologia 33 (4): 231-238. Arakaki, N.; Alveal, K.; Ramírez; Ma. E.; Fredericq, S. 2011.The genus Callophyllis (Kallymeniaceae, Rhodophyta) from the central-south Chilean coast (33º to 41º S), with the description of two new species .Revista Chilena de Historia Natural 84: 481-499. Athanasiadis, A. 2002. Recent Additions to the Subfamily Ceramioideae (Rhodophyta) and the Nature of the Ceramialean Ancestor. Constancea 83. http://ucjeps.berkeley.edu/constancea/83/). Consultado Enero. 2003. Becherucci, M. E.; Benavidez, H.; Boraso, A. L. 2012. Estudios preliminares del desarrollo y morfogénesis de carposporas de Ahnfeltiopsis devoniensis (Phyllophoraceae, Gigartinales) cultivadas in vitro. VII Jornadas Nacionales de Cs. del Mar. Comodoro Rivadavia, 3-7 de Diciembre de 2012. Resúmenes: 46. Boraso de Zaixso, A. L. 1993 Observaciones sobre el tipo de Callymenia antarctica Hariot. Naturalia patagonica, Ser Cs. Biológicas 1(2); 77-83. ISSN 0327-8050 Boraso de Zaixso, A. L. 2003. Adiciones al conocimiento de Ballia Harvey (Balliales, Rhodophyta) Boletín de la Sociedad Argentina de Botánica. 38: (1-2): 139-147. Boraso de Zaixso, A. L; Akselman, R. 2005 Anotrichium furcellatum (Ceramiaceae, Rhodophyta) en Argentina Boletín de la Sociedad Argentina de Botánica. 40 (34):207-213. Boraso, A. L.; Arratia, P. 2012. Rhabdonia coccinea (Harvey) Harvey (Areschougiaceae, 185 Gigartinales, Rhodophyta,) en Patagonia. VII Jornadas Nacionales de Cs. del Mar. Comodoro Rivadavia, 3-7 de Diciembre de 2012. Resúmenes: 24. Boraso de Zaixso, A. L.; Zaixso, J. M. 2007. Algas marinas bentónicas. En. Atlas de Sensibilidad ambiental del mar y de la costa. Demetrio Boltovskoy (Ed.) (PNUD). http://atlas.ambiente.gov.ar/tematicas/mt_02/macroalgas.htm Brauner, J. F. 1979. Developmental morphology and taxonomy of Medeiothamnion flaccidum (Hooker Harvey) comb. nov. (Ceramiaceae, Rhodophyta) from Southern America. Phycologia 18 (4): 338-346. Cabioch, H, J. 1988 Morphogenesis and generic concepts in coralline algae, a reappraisal. Helgoländer Meeresuntersuchungen. 42: 493-509. Choi; H. G.; Kim, M. S.; Guiry, M. D; Saunders, G. W. 2001. Phylogenetic relationships of Polysiphonia (Rhodomelaceae, Rhodophyta) and its relatives based on anatomical and nuclear small-subunit rDNA sequence data. Can. J. Bot. 79: 1465-1476 Choi, H. G; Kraft, G. T.; Saunders, G. W. 2000. Nuclear small- subunit rDNA sequences from Ballia sp (Rhodophyta): proposal of the Balliales ord. nov., Balliaceae fam. nov., Ballia nana sp. Nov. and Inkyuleea gen. nov (Ceramiales). Phycologia 39 (4): 272-287. Croce, M.E.; Parodi, E.R. 2013. The turf forming alga Gelidium crinale (Florideophyceae, Rhodophyta) on Atlantic Patagonian coasts. Botanica Marina 55(2): 131-141. Delépine, R.; Delesalle, B; Lambert, C. 1979. Sur l' existence dún tetrasporophyte dans le cycle de la Rhodophycée Chaetangium fastigiatum (Bory) J. Agardh aux iles Kerguelen. CRAS, Paris, Sér III 289: 595-598. Dixon P. S. 1970. The Rhodophyta: some aspects of their biology II. Oceanogr. Mar. Biol. Ann. Rev. 8: 307-352. Dixon, P. S. 1973 Biology of the Rhodophyta. University of California at Irvine. 285 pp. Dixon, P. S. 1982 Life histories in the Florideophyceae with particular reference to the Nemaliales sensu lato. Bot. Mar. 25: 611-621. Dixon P. S. 1992. The Rhodophyta: some aspects of their biology III. Oceanogr. Mar. Biol. Ann. Rev. 30: 1-148. Estévez, J. M.; Cáceres; E. J.2003. Fine structural study of the red seaweed Gymnogongrus torulosus ( Phyllophoraceae, Rhodophyyta). Biocell 27 (2): 181-187. Fredericq, S.; Brodie, J.; Hommersand, M. H. 1992. Developmental morphology of Chondrus crispus (Gigartinaceae, Rhodophyta). Phycologia 31: 542-563. Fredericq, S.; Norris, J. N.; Zimmer, E. A.; Freshwater, D. W.; Hommersand, M. H. 1995. New insights into the systematics and biogeography of the red algal order Gigartinales derived from rbcL sequence analysis and developmental morphology. 1995 Meet. of the Phycological Society of America, Breckenridge, CO (USA), 610 Aug 31, Suppl. 3 p. 18. Freshwater, D. W.; Fredericq, S.; Butler, B. S.; Hommersand, M. H.; Chase, M. W. 1994 A gene phylogeny of the red algae (Rhodophyta) based on plastid rbcL. Proc. Natl. Acad. Sci. USA 91 (15): 7281-7285. Gain, M. L. 1912. La flore algologique des régions antarctiques et subantarctiques. En J. B. Charcot, Deuxieme expedition antarctique francaise 1908-1910. Sci. Nat. Doc. Sci. Paris: 1-218, 8 pl., 1 cart. Garcia M. D.; Miravalles A B.; Leonardi P. I. 2007. Formación de pelos en el alga agarofita Gracilaria chilensis (Gracilariales, Rhodophyta). Darwiniana 45(1): 7-12. Guiry, M. D.; Guiry, G. M. 2003 - 2013. AlgaeBase. World-wide electronic publication, Nat. Univ. of Ireland, Galway. http://www.algaebase.org. Guiry, M. D.; Womersley, H. B. 1992. Gelidiella minima sp. nov. (Rhodophyta) from Victoria, Australia: Implications for the generic classification of the Gelidiaceae. British Phycological Journal. 27 (2): 165-176 Hariot, P. 1887. Algues magellaniques nouvelles. J. Bot. París 1: 55-59, 72-74. Harper; J. T.;Saunders G.W.1998. A molecular systematic investigation of the Acrochaetiales (Florideophycidae, Rhodophyta) and related taxa based on nuclear small- 186 subunit ribosomal DNA sequence data. European Journal of Phycology, 33 (3): 221-229. Harper, J.T. & Saunders, G.W. 2002. A re-classification of the Acrochaetiales based on molecular and morphological data, and establishment of the Colaconematales, ord. nov. British Phycological Journal 37: 463-475. Harvey, A. S.; Broadwater; S. T.; Woelkerling, W. J.; Mitrovski, P. J. 2003. Choreonema (Corallinales, Rhodophyta): 18S rDNA phylogeny and resurrection of the Hapalidiaceae for the subfamilies Choreonematoideae, Austrolithoideae and Melobesioideae. Journal of Phycology 39: 988-998. Hommersand; M. H.; Guiry, M. D.; Fredericq, S.; Leister, G. L. 1993. New perspectives in the taxonomy of the Gigartinaceae (Gigartinales, Rhodophyta). 14th Intl Seaweed Symp. Hidrobiologia 260/ 261: 105-120. Hommersand, M. H.; Moe, R. L.; Amsler, C. D.; Fredericq, S. 2009. Notes on the systematics and biogeographical relationships of Antarctic and sub-Antarctic Rhodophyta with descriptions of four new genera and five new species. Botanica marina 52: 509-534. Hooker, J. D., Harvey, W. H. 1845. Algae antarctica.. discovered ... during the voyage of H.M. discovery Ships "Erebus" and "Terror". J. Bot. London 4: 249-276. Huisman, J.M.; Womersley, H.B.S. 1992. Cystocarp development in the red alga Nothogenia fastigiata (Galaxauraceae, Nemaliales). Phycologia 31 (3/4): 359364. Joly, A. B., Cordeiro, M., Yamagushi N. 1964. La estructura y reproducción de Acanthococcus antarcticus Hooker et Harvey. Boletín del Instituto de Biología Marina de Mar del Plata 5, 10 p. Kim, M. S.; Lee, I. K.1999. Neosiphonia flavimarina gen. et sp. nov. with a taxonomic reassessment of the genus Polysiphonia (Rhodomelaceae, Rhodophyta). Phycological Research 47: 271-281. Kim, M-S, Maggs, Ch.; McIvor, L.; Guiry, M . 2011. Reappraisal of the type species of Polysiphonia (Rhodomelaceae, Rhodophyta). European Journal of Phycology 35:1, 83-92 King, R. J.; Puttock, C. 1989. The morphology and taxonomy of Bostrychia Montagne and Stictosiphonia J. D. Hooker et Harvey (Rhodomelaceae). Australian Syst. Bot. 2:173. Kühnemann, O.1969. Vegetación marina de la ría de Puerto Deseado. Opera Lilloana 17: 1-169. 132 pl. Kühnemann, O. 1972. Bosquejo fitogeográfico de la vegetación marina del litoral argentino. Physis 31 (82): 117-142 y 31 (83): 295-325. Kylin, H. 1944. Die Rhodophyceen der Schwedischen Westkuste. Lunds Univ. Arsskr. N.F. Avd. 2, 40(2): 104 p. 53 figs. 32 pls. Kylin, H. 1956. Die Gattungen der Rhodophyceen. CWK Gleerup, Lund ,i-iv + 673 p, 458 figs. Kylin, H.; Skottsberg,C.1919. Zur Kenntnis der subantarktischen und antarktischen Meeresalgen. II. Rhodophyceen. En O. Nordensjöld, Wiss. Ergeb. Schwed. Südpolar Exped. 1901-1903, 4 (15): 1-88, 1pl. Lamb, I.; Zimmermann, M. H. 1977. Benthic marine algae of the Antarctic Peninsula. A preliminary guide to the commoner benthic marine algae of the antarctic Peninsula and adjacent Islands. Biology of the Antarctic Seas 5. Antarctic Research. Series. 23: 129-229. Lazo. M. L.1982. Novedades en Rhodophyta argentinas. Bol. Soc.Arg.Bot. 21 (1-4): 65-80. Maggs, C. A.; Guiry, M. D. (1988 '1987'). Gelidiella calcicola sp. nov. (Rhodophyta) from the British Isles and northern France. British Phycological Journal 22: 417-434. Maggs, C. A. C.; Pueschel, M. 1989. Morphology and development of Ahnfeltia plicata (Rhodophyta), proposal of Anhnfeltiales ord. nov. J. of Phycol. 25: 333-351. Magne, F. 1982. On two new types of life history in the Rhodophyta. Cryptogamie, Algologie 3(4): 25-272. 187 Marelli, C. 1912. Algas calcáreas del Golfo Nuevo (Patagonia). Physis 1: 186-192. Mendoza, M. L. 1969 a. Estudio sistemático y ecológico de las Ceramiaceae (AlgaeRhodophyta) de Puerto Deseado. Provincia de Santa Cruz. Darwiniana 15: 287362. Mendoza, M. L. 1969 b. Las Delesseriaceae (Rhodophyta) de Puerto Deseado, Provincia de Santa Cruz, Argentina. I. Estudio sistemático y ecológico de los géneros Schizoseris Kylin, Cladodonta Skottsberg e Hymenena Greville. Physis 28: 419441. Mendoza, M. L. 1969 c. Las Delesseriaceae (Rhodophyta) de Puerto Deseado, Provincia de Santa Cruz, Argentina. II. Estudio sistemático del género Myriogramme Kylin. Physis 29: 245-260. Mendoza, M. L. 1970 a. Las Delesseriaceae (Rhodophyta) de Puerto Deseado, Provincia de Santa Cruz, Argentina. III. Estudio sistemático del género Gonimophyllum Batters. Physis 29: 372-378. Mendoza, M. L. 1970 b. Dos especies de algas rojas hemiparásitas de Puerto Deseado, Prov. de Santa Cruz, Argentina. Physis 29: 363-371. Mendoza, M. L. 1973. El estado sexual masculino de Pseudolaingia larsenii (Skottsberg) Levring (Rhodophyta) y su presencia en Tierra del Fuego e Isla de los Estados. Physis sec.A 32: 211-217. Mendoza, M. L. 1974a. Distribution de quelques espèces de corallinacées articulées sur la cote d' Argentine. Bull Soc. Phycol France 19: 67-73. Mendoza, M. L. 1974 b. El estado sexual masculino de Delesseria fuegiensis Skottsberg y la presencia de los géneros Delesseria Lam. y Schizoseris Kylin (Rhodophyta) en Tierra del Fuego e Isla de los Estados. Physis sec. A 33: 483-504. Mendoza, M. L. 1975. Pseudonitophylla, nuevo género de la familia Delesseriaceae (Rhodophyta). Physis sec. A 34: 59-65. Mendoza, M. L. 1976 a. Estudio de las variaciones morfológicas externas, internas y citológicas de las Corallinaceae (Rhodophyta) de la Argentina. Physis sec. A 35 (90):15-25. Mendoza, M. L. 1976 b. Antarcticophyllum, nuevo género para las Corallinaceae . Bol. Soc. Arg. Bot. 17 (3-4): 252-261. Mendoza, M. L. 1976 c. Presencia del género Pseudolithophyllum (Corallinaceae) en Argentina. Contrib. Cient. CIBIMA 140, 9 p. Mendoza, M. L. 1976 d. Odontolaingia, nuevo género de la familia Delesseriaceae (Rhodophyta). Bol. Soc. Arg. Bot. 17: 190-198. Mendoza, M. L. 1977 a. Las Corallinaceae de Puerto Deseado, Provincia de Santa Cruz, Argentina. I. Géneros Dermatholithon y Mesophyllum. Physis sec.A 36 (92): 21-29. Mendoza, M. L. 1979. Presencia del género Hydrolithon (Corallinaceae) en Argentina. Bol. Soc. Arg. Bot. 18 (3-4): 5-16. Mendoza, M. L. 1988a. Consideraciones biológicas y biogeográficas de las Corallinaceae (Rhodophyta) de las costas de la Isla Grande de Tierra del Fuego . Gayana (Bot.) 45 (1-4): 163-171. Mendoza, M. L. 1988b. Estudio morfogenético, reproductivo, sistemático, biológico y biogeográfico de algunos Lithothamnion (Rhodophyta, Corallinaceae) de las costas de la Isla Grande de Tierra del Fuego. Gayana (Bot.) 45 (1-4): 173-191. Mendoza, M. L. 1995. Las Corallinales (Rhodophyta). Caracteres a considerar para su clasificación taxonómica y métodos para el análisis de su estructura. Naturalia Patagonica. Ser. Ciencias Biológicas. 3(1-2):175-189. Mendoza, M. L. 2003. Generalidades de las Corallinales (Rhodophyta) Subantárticas. Memorias del Curso Internacional de Posgrado y Especialización de Macroalgas Marinas en Ambientes Subantárticos. (Ediciones Univ. de Magallanes): 43-52. Mendoza, M. L., Cabioch, J. 1984. Redéfinition comparée de deux spèces de Corallinacées d'Argentine: Pseudolithophyllum fuegianum (Heydrich) nov. comb. et Hydrolithon discoideum (Foslie nov. comb. Cryptogamie, Algologie 5(4):141154. 188 Mendoza, M. L.; Cabioch, J. 1985. Critique et comparaison morphogénetique des genres Clathromorphum et Antarcticophyllum (Rhodophyta, Corallinaceae) consequences biogéographiques et sistématiques. Cah. Biol. Mar. 26: 251-266. Mendoza, M. L.; Cabioch, J. 1986 a. Le genre Hydrolithon (Rhodophyta, Corallinaceae) sur les côtes subantarctiques et antarctiques d' Argentine et des quelques regions voisines. Cah. Biol. Mar. 27: 163-191. Mendoza, M. L.; Cabioch, J. 1986 b. Affinités biologiques et biogéographiques des Corallinacées (Rhodophyta) subantartiques des côtes Argentines et des regions voisines. Bot. Mar. 29: 474-479. Mendoza, M. L.; Cabioch, J. (1998). Étude comparée de la reproduction de Phymatolithon calcareum (Pallas) Adey & McKibbin et Lithothamnion corallioides (P. & H. Crouan) P. & H. Crouan (Corallinales, Rhodophyta), et reconsidérations sur la définition des genres. Canadian Journal of Botany 76: 1433-1445 Millar, A. J. K.; Wynne, M. J. 1992. Chondria viticulosa sp. nov. (Rhodomelaceae, Rhodophyta) a distinctly flattened species from South- eastern Queensland, Australia. Aust. Syst. Bot. 5: 421-429. Moe, R. L. (1985). Gainia and the Gainiaceae, a new genus and family of crustose marine Rhodophyceae from Antarctica. Phycologia 24: 419-428. Moe, R. L. 1986. Hymenocladiopsis crustigena (Rhodymeniaceae) a new genus and species from the Antarctic Peninsula. Phycologia 25 (1): 1-9. Moe, R.L. 1986. Notophycus fimbriatus (Solieraceae), a new genus and species of marine Rhodophyceae from the Antarctic Peninsula. Phycologia 25(4): 544-550 Moe, R. L.; Silva, P. C. 1979. Morphological and taxonomic studies on antarctic Ceramiaceae (Rhodophyceae). I. Antarcticothamion polysporum gen. et sp. nov. British Phycological Journal. 14: 385-405. Moe, R. L.; Silva, P. C. 1980. Morphological and taxonomic studies on antarctic Ceramiaceae (Rhodophyceae). II. Pterothamnion antarcticum (Kylin) comb. nov. (Antithamnion antarcticum Kylin). British Phycological Journal 15: 1-17. Moe, R . L.; Silva, P. C. (1983). Morphological and taxonomic studies on Antarctic Ceramiaceae (Rhodophyceae). III. Georgiella and Plumariopsis (tribe Ptiloteae). British Phycological Journal 18: 275-298. Murray, S. N.; Dixon, P. S. 1992 The Rhodophyta: some aspects of their biology III. Oceanogr. Mar. Biol. Ann. Rev. 30: 1-148. Norris, R .E. 1964. The morphology and taxonomy of South African Kallymeniaceae. Botanica Marina 7(1-4):90-129. Papenfuss, G. F. 1964. Catalogue and bibliography of antarctic and subantarctic benthic marine algae. Antarctic. Res. Ser. American Geophys. Union 1: 1-76. Parma, A., Pascual, M.; Sar, E. 1987. Clave para el reconocimiento de los géneros de algas macrofitas del intermareal rocoso bonarense. Serie Técnica y Didáctica, Serie aperiódica de la Fac. de Cs. Nat. y Museo de La Plata, Argentina 15, 29 p. Parsons, M. J. 1975. Morphology and taxonomy of the Dasyaceae and Lophothaliae (Rhodomelaceae) of the Rhodophyta. Austr. J. Bot. 23 (4):549-713. Peters, K. J.; Amsler, C. D.; Amsler, M. O.; McClintock, J. B.; Dunbar, R. B.; Baker, B. J. (2005). A comparative analysis of the nutritional and elemental composition of macroalgae from the western Antarctic Peninsula. Phycologia 44: 453-463. Peyriere, M. 1981 Jonctions cellulaires et synapses des rhodophycées floridées. Étude de deux Chorecolacées parasites, Harveyella mirabilis et Holmsella pachyderma. Cryptogamie, Algologie 2(2):85-104. Piriz, M. L. 1996. Phenology of a Gigartina skottsbergii Setchell et Gardner population in Chubut Province (Argentina) Botanica Marina 39 (4): 311-316. Pueschel, C. M. 1985. A expanded survey of the ultrastructure of red algal pit plugs. J. of Phycol. 25: 265-636. Pujals, C. 1960. Nemalion (Rhodophycophyta) género nuevo para la flora argentina. Darwiniana 12: 75-80. 189 Pujals, C. 1961. Algunas observaciones sobre Asterocystis ramosa (C. Agardh) Hamel. Rodoficea nueva para Argentina. Darwiniana 12: 365-377. Pujals, C. 1967. Notas sobre Rhodophycophyta de la Argentina. Rev. del Museo Argentino de Cs. Naturales Bernardino Rivadavia, Hidrobiol. 2: 57-76. Pujals, C. 1968. Revalidación de algunas especies argentinas de Rhodophycophyta. Rev. Mus. Arg. Cs. Nat. B. Rivadavia, Extra, n.s. 54: 1-2. Pujals, C. 1970. Medeiothamnion nuevo género de Ceramiaceae. Rev. Mus. Arg. Ciencias Nat. Ser. Bot. 3 (10): 287-299. Pujals, C. 1981. Identidad de Ballia scoparia (Hook. & Harv) Harv. (Rhodophyra, Floridophyceae). Rev. Mus. Arg. Ciencias Nat. Ser. Bot. 6 (1): 1-22. Quartino, M. L. 1990. Trailiella intricata (Bonnemaisoniales, Rhodophyta) en la Argentina. Bol. Soc. Arg. Bot. 26 (3-4): 209-213. Reinsch, P. F. 1890. Zur Meeresalgenflora von Süd-Georgia. En G. Neumayer, Die Internat. Polarforschung 1882-1883. Die deutsch. Exped. 2 (15): 366-454. Rice, E. L.; Bird, J. 1990. Relationships among geographycally distant populations of Gracilaria verrucosa (Gracilariales, Rhodophyta) and related species. Phycologia 29 (4): 501-510. Ricker, R. W. 1987. Taxonomy and biogeography of Macquarie Island Seaweeds. British Museum (Nat. Hist.) London, 344p., 126 figs. Rico, J. M.; Guiry, M. D. 1997. Life history and reproduction of Gelidium maggsiae sp. nov. (Rhodophyta, Gelidiales) from Ireland. European Journal of Phycology 32: 267277, 31 figs. Santelices, B. 1989 Algas Marinas de Chile. Distribución, Ecología, Utilización, Diversidad. Ediciones Univ. Católica de Chile. 399 p. Santelices, B.; Hommersand, M. 1997. Pterocladiella, a new genus in the Gelidiaceae. (Gelidiales, Rhodophyta). Phycologia 36 (2): 114-119. Saunders, G. W. 2004. A chronicle of the convoluted systematics of the red algal orders Palmariales and Rhodymeniales (Florideophyceae, Rhodophyta) CEMAR Occasional Notes in Phycology. Department of Biology, University of New Brunswick, Fredericton, N.B., Canada, E3B 6E1. Published online 16.xi. http://www.unb.ca/cemar/links/Palmariales.pdf Saunders, G. W.; Bird, C. J.; Ragan, M. A.; Rice, E. L. 1995. Phylogenetic relationships of species of uncertain taxonomic position within the Acrochaetiales - Palmariales complex (Rhodophyta): Inferences from phenotypic and 18S rDNA sequence data. J. Phycol. 31 (4): 601-611. Saunders, G. W.; Hommersand, M. H. 2004. Assessing red algal supraordinal diversity and taxonomy in the context of contemporary systematic data. Am. J. Bot. 91: 14941507 Saunders, G. W.; Kraft, G. T. 1996. Small-subunit rRNA gene sequences from representatives of selected families of the Gigartinales and Rhodymeniales (Rhodophyta.2. Recognition of the Halymeniales ord. nov. Canad. J. Bot. 74: 694 707. Saunders, G. W.; Lehmkuhl, K. V.2005. Molecular divergence and morphological diversity among four cryptic species of Plocamium (Plocamiales, Florideophyceae) in northern Europe. European Journal of Phycology 40: 293-312. Saunders, G. W.; Strachan, I.; Kraft, G. T: 1999 The families of the order Rhodymeniales (Rhodophyta); a molecular-systematic investigation with a description of Faucheaceae fam. nov. Phycologia 38 (19): 23-40. Scrosati, R, A. 1991. Presencia de Iridaea crispata (Rhodophyta, Gigartinales) en Chubut y Santa Cruz, Argentina. Bol. Soc. Arg. Bot. 27 (3-4) : 129. Scrosati R. A. 1993. Scanning electron microscopy of Corallina officinalis and Bossiella orbigniana ssp orbigniana (Rhodophyta, Corallinales) from Argentina. Boletin Sociedad Argentino Botanica 29 (3-4): 179-182. Setchell, W.A. ; Gardner, N.L. 1937. Iridophycus, with special reference to the South American species. Univ. Calif. Pub. Bot. 19 (6) : 195-244. 190 Sherwood, A.; & Sheath, R. 2000. Biogeography and systematics of Hildenbrandia (Rhodophyta, Hildenbrandiales) in Europe: inferences from morphometrics and rbcL and 18S rRNA genensequence analyses. European Journal of Phycology 35:2, 143-152. http://www.tandfonline.com/loi/tejp20 Skottsberg, C. 1923. Marine Algae. 2. Rhodophyceae. En Botan. Ergebn. der Schwed. Expedition nach Patagonien und dem Feuerlande 1907-1909. IX. K. Svenska. Vetenkapasakad. Handlingar. Stockholm. 63 (8), 70 p., 29 figs. Silva, P. C.; De Cew, T. C. 1992. Ahnfeltiopsis, a new genus in the Phyllophoraceae (Gigartinales, Rhodophyta). Phycologia 31 (6):576-580 Steentoff, M.; Irvine, L. M.; Farnham, W. F. 1995. Two terete species of Gracilaria and Gracilariosis (Gracilariales, Rhodophyta) in Britain. Phycologia 34 (2) : 113-127. Sutherland, J. E.; Lindstrom, S. C.; Nelson, W. A.; Brodie, J; Lynch, M. D.; Hwang, M. S.; Choi, H. G.; Miyata; M.; Kikuchi, N.; Oliveira, M. C.; Farr, T.; Neefus, C.; MolsMortensen, A.; Milstein, D.; Müller, K. M. (2011). A new look at an ancient order: generic revision of the Bangiales (Rhodophyta). Journal of Phycology 47(5): 11311151. Taylor, W. M. 1939. Algae collected by the "Hassler", "Albatross" and "Schmitt" expeditions. II. Algae from Uruguay, Argentina, The Falklands and the Strait of Magellan. Mich. Acad. Sci. Arts Letters 24 (1): 127-164. Weykam, G.; Thomas, D.N.; Wiencke, C. 1997. Growth and photosynthesis of the antarctic red algae Palmaria decipiens (Palmariales) and Iridaea cordata (Gigartinales) during and following extended periods of darkness. Phycologia 36(5):395-405. Wiencke, C.; Clayton, M. N. 2002. Antarctic seaweeds. In J. W. Wägele. Synopses of the antarctic benthos. vol. 9. 237 p. A. R. G. Gantner Verlag KG Ruggell/Lichtenstein. Woelkerling, W. J.; Irvine, L. M. 2007. The genus Mesophyllum (Hapalidiaceae, Corallinales, Rhodophyta): typification update. Phycologia 46: 230-231. Wollaston, E.M. 1979. Recognition of Pterothamnion Nägeli with taxonomic notes on P. simile (Hooker and Harvey) Nägeli and Platythamnion nodiferum (J. Agardh) Wollaton (Rhodophyta, Ceramiaceae). Trans. R. Soc. S.Austr. 103: 191-196 Womersley, H. B. S. 1994. The Marine benthic flora of Southern Australia, Part III A. Flora of Australia Supplementary series N° 1. Australian biological resources study. Canberra, 508 p. Womersley, H. B. S. 1996. The marine benthic flora of Southern Australia. Rhodophyta. Part IIIB. Gracilariales, Rhodymeniales, Corallinales and Bonnemaisoniales. Flora of Australia Supplementary series, N° 5. Australian biological resources study. Canberra. 392 p. Womersley, H. B. S. 1998. The marine benthic flora of Southern Australia. Rhodophyta. Part IIIC. State Herbarium of South Australia. 535 p. Womersley, H. B. S. 2003 The marine benthic flora of Southern Australia. Rhodophyta. Part IIID. Ceramiales, Delesseriaceae, Sarcomeniaceae, Rhodomelaceae. Flora of Australia Supplementary series, N° 4. State Herbarium of South Australia. 533 p. Wynne, M. J. 1983. The currente status of Genera in the Delesseriaceae. (Rhodophyta) Botanica Marina 26: 437-450. Wynne, M. J. 1989. Taxonomic observations on some marine algae in Herbarium Hamburgense. Nova Hedwigia 48: 419-430. Wynne, M. J. 2007. Rhodymenia coccocarpa, A new combination based on Phyllophora coccocarpa Montagne. Contr. Univ Michiga Herb. 25: 241-247. Zuccarello, G.; West, J. A. 2006. Molecular phylogeny of the subfamily Bostrychioideae (Ceramiales, Rhodophyta):subsuming Stictosiphonia and highlightiong polyphyly in species of Bostrychia. Phycologia. 45 (1):24-36. 191 GLOSARIO A lo largo del taller intentamos utilizar un léxico sencillo y correcto desde el punto de vista tanto técnico como en el uso del idioma castellano, ya que muchas de uso diario son perfectamente aptas para describir estructuras botánicas. Sin embargo queda un número importante de términos botánicos latinos que no forman parte de la experiencia diaria y algunos neologismos propios del lenguaje técnico acerca de los cuales se ha tenido que tomar una decisión en cuanto a su utilización. En algunos casos en que nos ha parecido que será de utilidad en futuras lecturas damos los sinónimos utilizados por otros autores y los términos que se utilizan en la bibliografía anglosajona o francesa. No hemos incluído términos asociados a la taxonomomía molecular. -aAbaxial: ubicado en la cara o lado inferior de una rama o lámina, o del lado opuesto al que: célula vegetativa con acumulación de materias de reserva que puede funcionar como elemento de propagación. Acinetospora espora inmóvil a partir de esporocisto plurilocular (gro.Acinetospora) Acroblástico: (en Sphacelariales), cuando las ramas se originan en una célula lenticular a partir de la célula apical. Acroheteroblástico: (en Sphacelariales): crecimiento acroblástico en el que la célula lenticular da dos tipos de estructura. Acrohomoblástico: en Sphacelariales : crecimiento acroblástico en el que la célula lenticular da un solo tipo de estructura. Acroquetioide: talo filamentoso pequeño parecido al género Acrochaetium. Adaxial: ubicado en la cara o lado superior de una rama o lámina, hacia el lado que enfrenta al eje. Adventicio: órgano en posición diferente a la del esquema de crecimiento. Anisogamia unión sexual de dos gametas móviles de diferente tamaño. Anteridio: gametocisto donde se forman los anterozoides. Anterozoide: célula sexual masculina, flagelada, móvil. Anticlinal: se aplica a la división celular perpendicular a la superficie o eje de una estructura. Apical: en el ápice. Aplanospora: espora inmóvil. Apomeiosis: reproducción asexual de algas pardas y rojas, en el que esporocistos, similares morfológicamente a esporocistos meióticos, producen esporas o zooides que dan talos con el mismo complemento cromosómico de los progenitores (2n). Archeospore a monospore found in certain monoecious species of Arqueoplastidio: cromatóforo de algas, generalmente uno por célula, en posición axial o parietal, frecuentemente con pirenoides. Si son axiales frecuentemente poseen la forma de una estrella con brazos cortos o largo, a veces los brazos de la misma llegan hasta la pared celular y se parietalizan en los extremos. Cuando son parietales pueden mostrar forma de placa, de bordes lisos o algo ondulados. Articulación: (en coralináceas): zona no calcificada entre dos segmentos Axial: perteneciente o relativo al eje. Axila: ángulo entre eje y ramas. Axilar: perteneciente o relativo a las axilas. -bBasónimo: combinación de género y especie en la que por primera vez se describió a la especie validamente. Bentónico: relativo al bentos. Bentos: conjunto de organismos que viven en contacto con el fondo marino. Bífido: órgano hendido profundamente en el centro del ápice. Biflagelado: con dos flagelos. 192 Bilateral (simetría): tipo de simetría a ambos lados de un plano. Bipinado: con pinas de segundo orden. Biseriado: arreglado en dos series o filas. Bispora: (en rodofita) Tipo de espora homólogo a las tetrasporas donde solo se forman dos por esporocisto. -cCalcificado: impregnado en carbonato de calcio. Capítulo: forma de inflorescencia racimosa en la que el pedúnculo se ensancha en la extremidad Carpogonio: célula femenina de las Florideophyceae Carpospora: espora de las algas rojas originada en los gonimoblastos procedentes de los carpogonios fecundados. Carposporocisto: porción del carpoporofito, a veces protegida dentro de un cistocarpio, que produce las carposporas. Carposporofito (Florideophyceae): generación diploide, parásita en el gametofito femenino. Cenocito: estructura no tabicada, con numerosos núcleos y organelas, propia de algas sifonales. Cespitoso: en forma de césped. Célula auxiliar: En algas rojas, células que reciben el núcleo diploide formado por la fecundación del carpogonio, a partir de las cuales se forma el gonimoblasto. Célula conjuntora: (cellule de jonction)(conjuctor cell); célula pequeña formada por mitosis a partir de una célula normal que se fusiona con una célula vecina y le traspasa el núcleo hijo proveniente de la mitosis, proceso relacionado con la formación de sinapsis secundarias. Célula de cubierta: (coralináceas) célula externa que muchas veces se desprende Cigota: célula producto de la fecundación de dos gametas. Cilíndrico: talo con ejes filiformes, de sección circular (terete en la bibliografía anglosajona) Cimitarra: sable de hoja curva. Circinado: arrollado en espiral Cisto: quiste, saco, bolsa. Cistocarpo: estructura globosa formada por tejido del gametofito y los carposporofitos. Cladoma: Estructura formada por un eje de crecimiento indeterminado que lleva ramificaciones laterales (pleuridios) de crecimiento determinado y ejes secundarios de crecimiento indeterminado. Los ejes pueden ser uniaxiales o multiaxiales. Claviforme: en forma de clava. Cloroplasto: organela de vegetales que lleva los pimentos fotosintéticos. Coaxial: en una misma dirección de crecimiento, se aplica a los filamentos de la médula de las Corallinales de talo postrado, como opuesto a la estructura plumosa en corte longitudinal. Complanado: aplanado o ramificado en un plano. Compreso: comprimido, hueco y con las paredes acercadas. Conceptáculo: cripta o cavidad que se abre al exterior por un ostíolo. Conchocelis: estado microscópico de las Bagiophycidae. Conchosporas: esporas producidas por el el estado conchocelis de Bangiophyceae. Conexión (filamento de): En Florydeophycidae, filamentos a través de los cuales migran los núcleos diploides hacia las células auxiliares. Coraloide: en forma de coral. Cordado: en forma de corazón. Corteza: capas de célula de la parte externa del talo, alrededor de la médula. Costroso (crustoso): formando costras firmes Criptostoma: puntuación hundida propia de la superficie de las Phaeophyceae 193 Cromatóforo: organela que lleva los pigmentos fotosintéticos (cloroplasto, feoplasto, rodoplasto). Cruciado (tetrasporocisto) esporocisto donde las esporas se forman por divisiones perpendiculares entre sí -dDecumbente: talos que crecen inclinados o acostados con los extremos que se curvan hacia arriba. Decusado: posición de órganos o ramas laterales, de a pares enfrentados entre sí y a 90° respecto a los pares adyacentes. Dendroide: en forma de dendritas, Dentado: con dientes en el borde. Denticulado: con dientes pequeños en el borde. Determinado: se aplica al crecimiento relativamente fijo de las ramas laterales de los talos con organización cladomiana. Diafragma: membrana que establece divisiones interiores en un órgano o talo. Dicótoma: división apical en dos mitades equivalentes. Difásico: que presenta dos fases con número cromosómico diferente en su ciclo de vida. Difuso: crecimiento no localizado en una zona del talo. Digitado: en forma de dedos. Dimórfico: que presenta dos formas de diferente aspecto en su ciclo de vida. Dioico: talo de la especie en la que los sexos están separados en diferentes individuos. Diplobiontico: ciclo de vida con dos fases cariológicas diferentes. Diplohaplontico: diplobióntico. Diplonte: individuo con complemento cromosómico diploide. Diplóntico: ciclo de vida donde prevalece el talo diploide, con solo las gametas haploides. Disectado: cortado Distal: zona que se encuentra en el extremo más alejado del origen del talo. (opuesto a proximal) Dístico: órganos ubicados en un mismo plano que miran a uno y otro lado de un eje. Distromático: formado por dos capas o estratos. Divaricada: rama que forma un eje muy abierto con el eje. División celular segregativa: división de porciones de protoplasma dentro de una célula (en Siphonocladales). Dorsal: ubicado sobre el dorso de un talo Dorsiventral: con superficies superior e inferior discernibles, semejantes o disímiles. -e Ecorticado: sin corteza. Endobionte: organismo que vive dentro de otro. Endofito: especie vegetal que vive en el interior de otro organismo. Endógeno: rama u órgano producido internamente al talo a partir del eje, en oposición a los que se producen en los meristemas apicalmente. Endospora: espora que se produce dentro de las paredes del esporocisto. Epifito: especie vegetal que vive sobre otro organismo. Epitalo: tejidos de la parte superior del talo en Corallinaceae, Espermacio: célula reproductiva masculina no flagelada en caso de oogamia en Rhodophyceae Espermatozoide: células reproductivas masculinas. Espermatocisto: célula en la cual se forman los espermacios. Espora: célula reproductiva, producida dentro de esporocistos y que sirve a la reproducción. Esporangio: estructura unicelular o multicelular donde se forman esporas. Esporocisto: célula modificada dentro de la cual se forman esporas. 194 Esporofilo: fronde especializada que lleva esporocistos. Esporofito: individuo que lleva esporocistos. Estiquidio: rama más o menos especializada, que lleva tetrasporocistos Estípite: pedúnculo basal o estructura cilíndrica de gran longitud, que lleva las láminas. Estolón: porción postrada del talo, de la que pueden rebrotar ejes o láminas erectas. Estrato (celular): conjunto de células aproximadamente en un mismo plano respecto a la superficie del talo. Estrellado: en forma de estrella, con brazos partiendo de un centro. -fFlagelo: estructura fibrilar inserta en las porciones anteriores o laterales de zooides. Fascículo: ramas erectas, paralelas y juntas Fasciculado: formado por fascículos. Fastigiado: de forma general cónica, con ramas surgiendo desde la base que crecen en forma sub- paralela y se van raleando hacia el ápice. Fenestrado: con aberturas Feoplasto: cromatóforo de algas pardas. Filamento: estructura alargada formada por una fila de células o por un cenocito alargado o por varias filas de células. Filamento absorbente: Filamentos que penetran en los tejidos, presuntamente para absorber y transportar substancias. Filiforme: estructura en forma de filamento formada por varias filas de células. Fimbriado: dividido en finas lascinias. Fistuloso: cilíndrico y hueco Flabelado: en forma de abanico. Flagelo: extensiones muy largas y finas de algunas células reproductivas que confieren movilidad a las mismas. Flexuoso: ejes en suave zigzag. Folioso: en forma de hoja. Fotófilas: algas que viven en ambientes con altos niveles lumínicos. Fotófobas: algas que viven en la sombra. Fronde: porción principal del talo por encima del grampón. Furcado: dividido en dos o como tenedor. Fusiforme: en forma de huso. Fusión (célula de) (en Florídeas) estructura de la fusión del carpogonio fecundado y células de la rama carpogonial y vecinas. -gGameta: célula haploide de función sexual. Gametangio: estructura unicelular o pluricelular donde se diferencian gametas, Gametocisto: célula dentro de la que se diferencian las gametas. Gametofito: individuo que forma gametocistos. Geniculado: talo de las coralinaceas organizado en su porción erecta en genículas e intergenículas. Genícula: porción no calcificada entre dos calcificadas o intergenículas. Glandular (célula): célula refringente, presuntamente excretora que se observan en los tejidos de algunas Ceramiales, Cryptonemiales y Laminariales. Gonimoblasto: filamento del carposporofito que dará lugar a las carposporas. Gonimolobo: cada una de las partes que a veces son diferenciables en la base de una masa de carposporas Grampón: estructura maciza, desde platiforme hasta formado por hapterios muy ramificados, a través de la cual se adhieren al sustrato las algas de mayor porte, como las Laminariales. -hHábitat: ambiente donde vive una especie. Hábito: aspecto morfológico de un talo. 195 Haplobióntico: ciclo de vida formado por una sola fase cariológica, ya sea ésta haploide o diploide. Haplonte: individuo con complemento cromosómico haploide. Haplóntico: ciclo de vida donde prevalece el talo haploide, con un período diploide solo en la cigota. Haplóstico: Tejido filamentoso, laxo o consolidado como pseudoparénquima, formado por células en series, provenientes de divisiones en un plano transversal al filamento ,es decir por filamentos monosifónicos o uniseriados. Hapterio: rama modificada para la adhesión al sustrato, simple o ramificada. Hemiblástica. (en Sphacelariales) Se refiere a la ramificación lateral que se produce de las células correspondientes a la sección superior del segmento del eje. Heterocisto.(en coralináceas) célula vegetativa con contenido refringente diferente del resto de las células. Ver también megacélula y tricocisto. Heteroconta: elemento flagelado de reproducción cuyos flagelos son de diferente tipo o tamaño. Heteromorfico: ciclo de vida en el que los talos de las diferentes fases muestran diferente morfología, generalmente un a fase es erecta y macroscópica y la otra postrada, costrosa o miscroscópica. Heterotrico: talo filamentoso con una porción postrada y una erecta Hipacroblástico:(en Sphacelariales) origen de ramas laterales a partir de células por debajo de la apical, ya sea a partir de todo su largo (holobástica) o a partir de una subdivisión de la misma (meroblástica) Hifa: célula alargada e incolora, típica de la médula de muchas algas. Hipotalo (corallinaceas): zona basal del talo de coralináceas incrustantes. Hipógina (célula): la que está ubicada bajo el carpogonio. (especialmente en Ceramiaceae). Holobástica: ver hipacroblástica. Holotipo: ejemplar en el que el autor basa la descripción de una especie. Huésped: organismo sobre o dentro del cual vive otro como epífito, endófito o parásito. -iImbricados: elementos encimados como en un tejado. Indeterminado: crecimiento en largo de un cladoma, o de un arqueotalo ya sea del eje central , o de una rama de crecimiento no limitado morfogenéticamente. Intercalar: órgano o proceso (división celular por ejemplo) con localización no apical ni basal. Intermareal: entre las bajamres y pleamares comunes. Isoconta: zooide con flagelos de igual longitud. Isodiamétrico: aproximadamente igual en sus diferentes dimensiones. Isogamia: unión sexual de gametas móviles iguales. Isomórfico: ciclo de vida que consta de dos generaciones de igual morfología, que difieren por su complemento cromosómico o tipo de reproducción. Isotipo: especimen duplicado del holotipo. -lLacerado: partido irregularmente. Laciniado: partido en franjas longitudinales. Lámina: parte aplanada de la fronde. Leptocaule (en Sphacelariales), con segmentos secundarios de las ramas que no crecen en tamaño. Lectotipo: especimen de la colección escogido como tipo en ausencia del holotipo. Lanceolado: en forma de hoja de lanza. Lenticular convexo. Ligulado: en forma de lengua Linear: alargado y no ensanchado 196 Lobado: con lóbulos. Lóculo: celda de un órgano reproductivo plurilocular, conteniendo generalmente un solo zooide. Lúbrico: resbaladizo. -mMastigonema: pelos finos que participan en la estructura de un flagelo. Médula: parte central del talo, frecuentemente formada por células incoloras o por hifas. Megacélula (heterocisto= tricocisto): célula interna al talo de coralináceas crustosas, que se diferencia por su mayor tamaño. Meiogametas: gametas meióticas, producidas en un talo diploide. Meiosis: división celular donde se reduce el número de cromosomas de diploide a haploide. Meiosporas: esporas haploides meióticas producidas en un talo diploide. Meristema: tejido embrionario en el que proceden abundantes divisiones celulares. Meristodrma: región meristemática de la superficie de un talo, que crece principalmentepor divisiones periclinales de la capa basal y anticlinales de las capas superficiales. Meroblástica: ver hipacroblástica. Mesoplastidio: cromatóforos parietalizados, consistentes en un retículo, generalmente con pirenoides dispersos. Mitospora: espora originada por división mitótica. Moniliforme: filamento de células pequeñas globosas como un collar de cuentas. Monocarpogonial: rama carpogonial con un solo carpogonio. Monoespecífico: género con una sola especie. Monofásico: ciclo de vida con una sola fase cariológica. Monoico: talo de la especie en que ambos sexos se encuentran sobre el mismo individuo. Monopodial: crecimiento del talo siempre desde un punto apical. Tipo de ramificación en el que de un eje central parten ramas originadas en el ápice del mismo. Monosifónico (=uniseriado) (= haplóstico) : talo o porción del mismo formado por filamentos uniseriados, simples o ramificados, sin divisiones longitudinales de las células otras que las destinadas a formar ramas. Monospora: espora formada individualmente en un esporocisto. Mucrón: excrecencia puntiaguda en la pared apical de un órgano. Multiaxial: talo de naturaleza mayormente haplóstica formado por el crecimiento paralelo de varios ejes, todos ellos de crecimiento apical o subapical cuyas ramificaciones laterales hacia el exterior forman la corteza del talo., Multifido: partido apicalmente en varias partes. -nNematecio: estructura algo elevada sobre la superficie del talo , asociada a la reproducción producida por proliferación de células superficiales en algunas algas rojas. Neoplastidio: conjunto de cromatóforos, ubicados en el citoplasma generalmente entre la vacuola central y la membrana celular, circulares, ovales, alargados, acintados, en forma de cuerpo de violín estrellados, etc. A veces ubicados formando en conjunto una estructura estrellada axial en la célula. Neotipo: especimen designado como tipo en ausencia de la colección original. Nervadura central (midrib): Zona central del talo con más capas de células que las zonas adyacentes, la que se visualiza como una nervadura, simple o ramificada. Neutro: (esporocisto) que produce mitosporas que reproducen la misma fase del ciclo de vida. 197 Nutritivo: (tejido) aquellas células, filamentos o tejidos asociados a estructuras reproductivas que están supuestamente relacionados con el rol de reserva de substancias. -oOb: prefijo indicando inversión, se refiere normalmente a la forma ( obovoide, oblanceolado). Ooblasto: tubo de conexión entre un carpogonio y una célula auxiliar. Oogamia: unión sexual de una gameta inmóvil (oosfera) y una móvil (anterozoide) Oogonio: gametocisto conteniendo una o más células sexuales femeninas. Orbicular: de contorno circular. Ostiolo: orificio de conceptáculos, esporangios y esporocistos. Ovado: ovoide algo afinado distalmente Ovoide: en forma de huevo. Ovulo oosfera: célula sexual femenina. -pPantonemático: (flagelo) con mastigonemas laterales. Paráfisis: parafisa, filamento corto, pigmentado o incoloro, estéril, entre esporocistos o gametocistos. Paraspora: esporas triploides no análogas a tetrasporas. Parásito: organismo que toma toda o parte de las substancias que requiere para subsistir de un huésped en el que e desarrolla. Parénquima: conjunto de células formado por repetida división celular en más de un plano. Parietal: ubicado sobre la pared Partenogénesis: formación de nuevos talos a partir de gametas no fecundadas. Pectinado: en forma de peine. Pedicelado: con pedicelo. Pedicelo: estructura delgada que lleva un órgano. Pelos feofíceos (= pelos verdaderos): filamentos hialinos, filamentosos, terminales o laterales, que llevan en la base un meristema. Peltado: en forma de escudo. Penicilado: en forma de pincel. Percurrente: que escapa en la punta, puede referirse a una nervadura que sobresale apicalmente de la hoja. Perenne: que persiste varios años. Pericarpio: (en rodofitas) : estructura pseudoparenquimatosa originada en el gametofito femenino que contribuye a proteger el carposporofito, el conjunto de pericarpio y carposporofito forma el cistocarpio. Pericentral:(célula): célula basal del pleuridio en Ceramiales. Pericisto:(en Sphacelariales), una célula lateral periférica que difiere en tamaño, color y contenido, la que funciona como una inicial dormida. Periclinal: plano en dirección paralela e interior a la superficie de un cuerpo. Peritalo: (en corallinaceas incrustantes) estrato de filamentos erectos perpendiculares al hipotalo. Pinna: rama sobre el eje, de crecimiento determinado, equivalente a pleuridio (=whorl branch). Pinnado: talo con pinnas. Pinnula: última ramificación de una pinna. Pirenoide: organela asociada a los cromatóforos, asociada a la síntesis de carbohidratos. Piriforme: en forma de pera. Pit connection (pit plug, tapón intercelular): estructura intercelular compleja, típica de Rhodophyta Florídeas, sinapsis intercelular. Plástido: cromatóforo Plasticidad: capacidad de un organsimo de cambiar en respuesta al ambiente. 198 Pletismotalo: talo asexual microscópico de feofíceas (N ó 2n) que puede producir zoosporas. Pleuridio: rama lateral de crecimiento determinado, usualmente en pares o en verticilos, pueden a su vez llevar ramificaciones de mayor orden Plurangio: esporocisto plurilocular. Plurilocular: formado por varios lóculos o cámaras. Polisifónico : talo formado por segmentos, cada uno de los cuales consta de una célula central y varias , que lo rodean, las que pueden o no dividirse a su vez. Polisporocisto: esporocisto homólogo a un tetrasporocisto que produce más de cuatro esporas. Polistromático: talo formado por varios estratos celulares. Polístico: Opuesto a haplóstico crecimiento del talo, o porción del mismo por divisiones celulares transversales y longitudinales o en varios planos respecto al eje de crecimiento., produce estructuras laminares o parenquimatosas. Postrado: con el eje principal horizontal, generalmente en contacto con el sustrato. Procarpo: estructura en Rhodophyta en la que una o más células auxiliares forman parte del sistema de la rama carpogonial. Proliferación: porciones nuevas del talo que se forman a partir del borde , la superficie o la base de uno más viejo, generalmente en forma de hojuelas. Propágulo: porción vegetativa del talo, modificada para la propagación. Protonema: talo microscópico vegetativo. Proximal: cercano al origen, o al eje (opuesto a distal) Pseudoparénquima: tejido del talo de naturaleza haplóstica, el que, debido al engrosamiento y compresión lateral de las células muestra una apariencia de parénquima. Pulvinado: en forma de cojín. -rRama carpogonial: filamento corto del gametofito sobre el que se diferencia el carpogonio. Rámula: rama de último orden, generalmente de crecimiento determinado. Receptáculo: rama modificada que lleva conceptáculos u órganos de reproducción en general. Reniforme: en forma de riñón. Retículo: red Rizoide: célula alargada adaptada a la adhesión o a la formación de cortezas. Rizomatoso: con aspecto de eje postrado grueso semejante a un rizoma de planta vascular. Rodoplasto: cromatóforo de algas rojas. -sSaxícola: que vive sobre piedras. Secund (término usado en bibliografía anglosajona): ramificación unilateral. pectinado Septo: tabique entre dos secciones abiertas de un talo o cenocito. Seriado: en series. Serrado: en forma de sierra. Seta: pelo de naturaleza no celular? Sésil: órgano asentado directamente sobre el eje, sin pedúnculo. Sifonal: talos constituído por un cenocito. Simple (eje o filamento): sin ramificar. Simpodial: crecimiento del talo en el cual el ápice de crecimiento apical es reemplazado por el ápice de ramificaciones laterales que asumen sucesivamente la posición apical. Sinapsis: estructuras intercelulares en Rhodophyta, pit plug, pit connection. . 199 Soporte (célula): célula vegetativa que en Rhodophyta origina y sostiene a la rama carpogonial; en algunos grupos funciona como célula auxiliar. Soro: grupo delimitado de órganos de reproducción. Sub: prefijo indicando "bajo" o "menor". Submareal: ubicado en el litoral por debajo del nivel de las bajamares ordinarias. -tTaeniforme: en forma de láminas acintadas ramificadas (término que se ha aplicado a algunas algas rojas y a algunas coralináceas costrosas. Talo: cuerpo vegetativo de especies no vasculares. Tetraédrico:(tetrasporocisto) que divide su contenido oblicuamente, de forma que solo tres esporas están normalmente visibles. Tetraspora: esporas meióticas producidas en tetradas dentro de esporocistos. Tetrasporocisto: célula del gametofito donde se forman las tetrasporas Tetrasporofito: talo que lleva tetrasporocistos. Tomento: cubierta de pelos o filamentos. Tricoblasto: pelo incoloro, generalmente distal de Rhodomelaceae. Tricocisto: ver heterocisto Tricotálico (crecimiento). Se aplica al crecimiento subapical que deja como producto secundario un pelo apical. -uUniaxial: eje de naturaleza haplóstica con crecimiento a través de un solo filamento central. Unilocular (esporocisto): con un solo lóculo. Uniporado: con un solo poro. Uniseriado: se aplica a un filamento monosifónico, haplóstico. o a un esporocisto plurilocular con una sola serie de lóculos. Utrículo: ramas hinfladas de los sifones algunos talos sifonales que constituyen su corteza. -vVerticilo. estructura con elementos alargados radiando desde un eje. Vesícula: bolsa llena de líquido o aire. -zZonado (tetrasporocisto) donde las tetrasporas están en fila. Zoogameta: gameta móvil con flagelos. Zooide: elemento reproductivo con flagelos. Zoospora: espora móvil con flagelos 200 INDICE TAXONÓMICO Acanthococcus, 123, 148 Acanthococcus antarcticus, 149 Acinestosporaceae, 65 Acinetospora, 64, 65 Acinetospora crinita, 65 Acinetosporaceae, 64 Acrochaetiaceae, 122, 126 Acrochaetiales, 122, 124 Acrochaetium, 122, 126 Acrochaetium daviesii, 127 Acrochaetium fuegiense, 126 Acrochaetium virgatulum, 126 Acrosiphonia, 29, 34 Acrosiphonia arcta, 34 Adenocystaceae, 64 Adenocystis, 64, 88 Adenocystis utricularis, 88 Aglaothamnion, 123, 165 Aglaothamnion uruguayense, 165 Aglaothamnion polyspermum, 166 Ahnfeltia, 122, 124 Ahnfeltia plicata, 124 Ahnfeltiopsis devoniensis, 151 Ahnfeltiopsis furcellata, 151 Alariaceae, 65, 105 Alethocladus corymbosus, 102 Anhfeltiopsis, 123, 151 Anotrichium, 123, 167 Anotrichium furcellatum, 167 Antarcticothamniom polysporum, 167 Antarcticothamnion, 123, 167 Antarcticothamnion polysporum, 160 Antarctocolax, 123, 185 Antarctocolax lambii, 185 Antithamnion, 123, 159 Antithamnion cruciatum, 159 Antithamnion simile, 159 Antithamnion densum, 159 Antithamnion plumula, 160 Antithamnionella, 123, 160 Antithamnionella ternifolia, 161 Aoudinella, 126 Aphanocladia, 123, 180 Aphanocladia robusta, 180 Areschougiaceae, 123, 147 Ascoseira, 65 Ascoseira mirabilis, 99 Ascoseiraceae, 65 Ascoseirales, 65, 99 Asperococcus, 64, 86 Asperococcus compressus, 86 Asperococcus ensiformis, 86 Asterocystis ornata, 113 Asteronema, 64, 93 Asteronema australe, 93 Asteronema ferruginea, 93 Asteronemataceae, 64, 93 Audouinella membranacea, 129 Bachelotia, 64, 93 Bachelotia antillarum, 93 Bachelotiaceae, 64, 93 Ballia, 122, 130 Ballia callitricha, 130 Ballia sertularioides, 130 Balliaceae, 130 Balliales, 122, 130 Bangia, 112, 115 Bangia atropurpurea, 115 Bangiaceae, 112, 114 Bangiales, 112, 114 Bangiophyceae, 112, 114 Blidingia, 29, 40 Blidingia chadefaudii, 40 Blidingia marginata subsp. marginata, 40 Blidingia minima, 40 Bonnemaisoniaceae, 123, 138 Bonnemaisoniales, 138 Bossiella, 122, 132 Bossiella. orbigniana, 132 Bostrychia, 123, 182 Bostrychia scorpioides, 184 Bostrychia intricata, 182 Bostrychia vaga, 182 Botryoglossum, 123, 175 Botryoglossum platycarpum, 175 Botrytella, 64, 76 Botrytella parva, 76 Bryopsidaceae, 30, 53 Bryopsidales, 30, 53 Bryopsidophyceae, 30, 53 Bryopsis, 30, 53 Bryopsis plumosa, 54 Bryopsis australis, 53 Bryopsis magellanica, 54 Bryopsis rhizophora, 53 Bryopsis rosae, 54 Caepidium, 64, 86 Caepidium antarcticum, 86 Callithamnion, 123, 164 Callithamnion montagnei, 165 Callithamnion gaudichaudii, 165 Callithamnion plumula, 160 Callophyllis, 123, 156 Callophyllis atrosanguinea, 157 Callophyllis tenera, 157 Callophyllis. variegata, 156 Camontagnea, 122, 127 Camontagnea oxyclada, 127 Capsosiphon, 29, 33 Capsosiphon fulvescens, 34 Catenella, 123, 149 Catenella fusiformis, 149 Caulacanthaceae, 123 Ceramiaceae, 123, 157 Ceramiales, 123, 157 Ceramium, 123, 163 Ceramium irregulare, 164 Ceramium . strictum, 163 Ceramium diaphanum, 163 Ceramium dozei, 164 201 Ceramium involutum, 164 Ceramium lessonii, 164 Ceramium rubrum, 163 Chaetangiaceae, 129 Chaetomorpha, 30, 48 Chaetomorpha aerea, 49 Chaetomorpha linum, 49 Champiaceae, 123 Chlorococcales, 29, 30 Chlorophyceae, 29 Chondria, 123, 179 Chondria angustata, 179 Chondria dasyphylla, 179 Chondria macrocarpa, 179 Chondrus, 152 Chordaria, 64, 81 Chordaria linearis, 81 Chordaria magellanica, 82 Chordariaceae, 64, 72 Choreocolax, 144 Choreocolax delesseriae, 144 Choreocolax macronema, 144 Choreocolax rhodymeniae, 144 Chromastrum, 126 Chromastrum catenulatum, 126 Chromastrum macropus, 126 Chromastrum virgatulum, 127 Cladochroa, 64, 85 Cladochroa chnoosporiformis, 85 Cladodonta, 123, 171 Cladophora, 30, 49 Cladophora albida var. refracta., 49 Cladophora coelothrix, 51 Cladophora falklandica, 51 Cladophora lehmanniana, 52 Cladophora subsimplex, 52 Cladophora utriculosa, 52 Cladophoraceae, 47 Cladophorales, 30, 47 Cladophoropsis, 30, 53 Cladophoropsis voluticola, 53 Cladostephaceae, 65, 102 Cladostephus, 65, 102 Cladostephus antarcticus, 102 Cladostephus australis, 102 Cladostephus hariotii, 102 Cladostephus setaceus, 102 Cladostephus spongiosus, 102 Cladothele, 64, 84 Cladothele decaisnei, 84 Cladothele striarioides, 84 Clathromorphum, 122, 135 Clathromorphum lemoinenum, 136 Clathromorphum obteculum, 136 Coccomyxa, 29, 30 Coccomyxa parasitica, 30 Codiaceae, 55 Codiaceae:, 30 Codium, 30, 55 Codium decorticatum, 55 Codium effusum, 57 Codium fragile, 57 Codium subantarcticum, 57 Codium vermilara, 57 Codiun difforme, 57 Coeloseira trichodes, 143 Colacodasya, 123, 186 202 Colacodasya. inconspicua, 186 Colaconema, 122, 127 Colaconema daviesii, 127 Colaconemataceae, 122, 127 Colaconematales, 122, 127 Colacopsis, 123, 185 Colacopsis lophurellae, 185 Colpomenia, 64, 90 Colpomenia sinuosa, 90 Compsogonophyceae, 112, 114 Corallina, 122, 132 Corallina elongata, 132 Corallina mediterránea., 132 Corallina officinalis, 132 Corallinaceae, 122, 131 Corallinales, 122, 131 Corallinophycidae, 122, 131 Corycus, 64, 82 Corycus lanceolatus, 82 Cryptonemia, 123, 144 Cryptonemia. obovata, 144 Cryptonemiaceae, 123, 143 Cryptonemiales, 143 Curdiae racovitzae, 145 Curdiea, 123, 145 Cutleria, 65, 97 Cutleria multifida, 97 Cutleria. adspersa, 98 Cutleriaceae, 65, 95 Cutleriales, 65, 95 Cystocloniaceae, 123, 148 Cystosphaera, 65 Cystosphaera jacquinotii, 99 Cystosphaeraceae, 65, 99 Dasyaceae, 123, 185 Delesseria, 123, 169 Delesseria antarctica, 170 Delesseria fuegiensis, 169 Delesseria macloviana, 170 Delesseria . salicifolia, 170 Delesseria epiglossum, 169 Delesseria lancifolia, 169 Delesseria. hypoglossum, 170 Delesseriaceae, 123, 167 Delesserioideae, 169 Delisea, 123, 139 Delisea fimbriata, 139 Delisea pulchra, 139 Derbesia, 30, 54 Derbesia antarctica, 55 Derbesia furcata, 55 Derbesia marina, 55 Derbesiaceae, 30, 54 Desmarestia, 94 Desmarestia confervoides, 94 Desmarestia ligulata, 94 Desmarestia patagonica, 95 Desmarestia willii, 94 Desmarestiaceae, 94 Desmarestiales, 94 Dictyosiphon, 82 Dictyosiphon hirsutum, 82 Dictyota, 65, 98 Dictyota dichotoma, 98 Dictyotaceae, 98 Dictyotaceae, 65 Dictyotales, 98 Dictyotales, 65 Durvillaea, 65, 99 Durvillaea antarctica, 99 Durvillaeacea, 65 Durvillaeaceae, 98 Ectocarpaceae, 64, 69 Ectocarpales, 64, 65 Ectocarpus, 64, 69 Ectocarpus falklandicus, 69 Ectocarpus dimorphus, 70 Ectocarpus exiguus, 70 Ectocarpus fasciculatus, 69 Ectocarpus pectinatus, 73 Ectocarpus. siliculosus, 69 Elachista, 64, 73 Elachista antarctica, 73 Elachista meridionalis, 73 Elachista ramosa, 73 Enteromorpha ahlneriana, 44 Enteromorpha bulbosa., 41 Enteromorpha lingulata, 43 Entocladia, 29, 35 Entocladia maculans, 38 Epicladia maculans, 38 Epymenia, 123, 140 Erythropeltidales, 112, 114 Erythrotrichia, 112, 114 Erythrotrichia carnea, 114 Erythrotrichiaceae, 112, 114 Eudesme, 64, 82 Eudesmes virescens, 82 Falklandiella, 123, 161 Falklandiella harveyi, 161 Faucheaeceae, 123 Feldmannia, 66 Feldmannia simplex, 66 Florideas, 119 Florideophyta, 119 Fucales, 65, 98 Gainia, 123 Gainia mollis, 157 Gainiaceae, 123, 157 Galaxauraceae, 122, 129 Gastroclonium, 123, 142 Gelidiaceae, 123, 137 Gelidiales, 123, 137 Gelidiella, 123, 138 Gelidiella calcicola, 138 Gelidiella nigrescens, 138 Gelidium, 137 Gelidium crinale, 137 Gelidium maggsiae, 137 Gellidiellaceae, 123, 138 Geminocarpus, 64, 66 Geminocarpus austro-georgiae, 66 Geminocarpus geminatus, 66 Georgiella, 123, 167 Georgiella confluens, 167 Giffordia, 66 Gigartina, 123, 152 Gigartina skottsbergii, 152 Gigartinaceae, 123, 152 Gigartinales, 123 Gonimocolax, 173 Gonimocolax australis, 173 Gonimophyllum, 123, 174 Gonimophyllum insulare, 175 Goniotrichum, 113 Gononema, 64, 73 Gononema pectinatum, 73 Gononema ramosum, 73 Gracilaria, 123, 144 Gracilaria gracilis, 145 Gracilaria. pulvinata, 145 Gracilariaceae., 144 Gracilariales, 144 Grateloupia, 123, 143 Grateloupia cutleriae, 144 Grateloupia doryophora, 144 Grateloupia filicina, 144 Griffithsia, 123, 166 Griffithsia antarctica, 166 Gymnogongrus, 123, 151 Gymnogongrus antarcticus, 151 Gymnogongrus furcellatus, 151 Gymnogongrus torulosus, 151 Haloglossum compressum, 86 Halopteris, 65, 101 Halopteris corymbosa, 102 Hapalidiaceae, 122, 135 Helminthocladiaceae, 129 Helminthocladiaceae, 122 Herpodiscus, 65, 100 Herpodiscus bornetii, 100 Herposiphonia, 123, 179 Herposiphonia sulivanae, 180 Heterosiphonia, 123, 185 Heterosiphonia merenia, 185 Heterosiphonia berkeleyi, 185, 186 Hildenbrandia, 122, 124 Hildenbrandia lecannellieri, 124 Hildenbrandiaceae, 124 Hildenbrandiales., 124 Hildenbrandiophycidae, 122, 124 Himantothallus grandifolius, 95 Hincksia, 64, 66 Hincksia ovata, 67 Hincksia granulosa, 67 Hincksia hincksiae, 67 Hincksia mitchellae, 66 Hincksia sandriana, 67 Hydrolithon, 122, 133 Hydrolithon consociatum, 133 Hydrolithon . falklandicum, 133 Hydrolithon farinosum, 133 Hymenena, 123, 175 Hymenena falklandica, 175 Hymenena laciniata, 175 Hymenocladiopsis, 123 Iridaea, 123, 153 Iridaea cordata, 153 Iridaea dichotoma, 155 Iridaea laminarioides, 155 Jania, 122, 132 Jania. rubens, 132 Kallymenia, 123, 156 Kallymenia . antarctica, 156 Kallymeniaceae, 123, 155 Kornmaniaceae, 29 Kornmanniaceae, 40 Kuckuckia, 64, 70 Kuckuckia spinosa, 72 Kuckuckia;, 64 Lambia antarctica, 55 203 Laminariales, 65, 102 Laminariocolax, 77 Laminariocolax aecidioides, 77 Laminarionema, 64, 78 Laminarionema elsbetiae, 78 Leathesia, 64, 79 Leathesia difformis, 79 Leptonamatella fasciculata, 77 Leptonema, 76 Leptonematella, 64, 76 Leptonematella falklandica, 76 Lessonia, 65, 103 Lessonia flavicans, 105 Lessonia fuscescens, 105 Lessonia ovata, 105 Lessonia searlesiana, 105 Lessonia vadosa, 105 Lessoniaceae, 65 Lithoderma, 64, 91 Lithoderma antarcticum, 91 Lithoderma piliferum, 91 Lithophylloideae, 135 Lithothamnion, 122, 136 Lithothamnion granuliferum, 136 Lithothamnion heterocladum, 136 Lithothamnion. mülleri, 136 Lithothamnion. rugosum, 136 Lithothamnionn philippi, 136 Lola, 30, 48 Lola implexa, 48 Lola irregularis, 48 Lomentaria, 123, 142 Lomentaria clavellosa, 142 Lomentariaceae, 123, 142 Lophurella, 123, 178 Lophurella comosa, 178 Lophurella hookeriana, 179 Macrocystis, 65, 103 Macrocystis pyrifera, 78, 103 Mastophoroidea, 132 Mazzaella, 123, 155 Mazzaella laminarioides, 155 Medeiothamnion, 123, 166 Medeiothamnion flaccidum, 166 Melobesiodeae, 135 Mesophyllum, 122, 136 Mesophyllum patena, 137 Mesophyllum. lichenoides, 136 Microrhinus carnosus, 171 Microzonia, 65, 97 Microzonia. velutina, 97 Mikrosyphar, 77 Mikrosyphar aff. M polysiphoniae, 77 Mikrosyphar aff. M. porphyrae, 77 Monostroma, 29, 33 Monostroma hariotii, 33 Myriactula, 75 Myriactula pusilla, 75 Myriactula. rosarioides, 75 Myriogloea, 64, 81 Myriogloea major, 81 Myriogramme, 123, 174 Myriogramme crozieri, 174 Myriogramme livida, 174 Myriogramme mangini, 174 Myriogramme smithii, 174 Myrionema, 64, 78 204 Myrionema patagonicum, 79 Myrionema densum, 78 Myrionema fuegianum, 78 Myrionema incommodum, 78 Myrionema inconspicuum., 79 Myrionema macrocarpum, 79 Myrionema paradoxus, 79 Myrionema strangulans, 79 Nemaliales, 129 Nemalion, 122, 129 Nemalion helminthoides, 129 Nemalionales, 122 Nemaliophycidae, 122, 124 Neogoniolithon, 122 Neosiphonia harveyi, 178 Nereoginkgo, 123, 144 Nereoginkgo. adiantifolia, 144 Nitophylloideae, 171 Nothogenia, 122, 129 Nothogenia fastigiata, 129 Notophycus, 123, 148 Notophycus fimbriatus, 148 Odontolaingia, 123, 170 Odontolaingia fuegiensis, 170 Pachyarthron, 132 Palmaria, 122, 128 Palmaria georgica, 128 Palmaria decipiens, 128 Palmariaceae, 122, 128 Palmariales, 122, 128 Pantoneura, 173 Pantoneura plocamioides, 173 Percursaria, 29, 46 Percursaria percursa, 46 Petalonia, 64, 90 Petalonia fascia, 90 Petroderma, 64, 92 Petroderma maculiforme, 92 Peyssonnela, 143 Peyssonnelia, 123 Peyssonnelia. harveyana, 143 Peyssonneliaceae, 123, 143 Peyssonneliales, 123, 143 Phaeurus antarcticus, 95 Phycodrys, 123, 171 Phycodrys antarctica, 171 Phycodrys austrogeorgica, 171 Phycodrys quercifolia, 171 Phyllophora, 123, 152 Phyllophora ahnfeltioides, 152 Phyllophora antarctica, 152 Phyllophora appendiculata, 151 Phyllophoraceae, 123, 151 Phymatholithon, 122, 135 Phymatholithon lenormandii, 135 Picconiella, 123, 182 Picconiella pectinata, 182 Plocamiaceae, 123, 145 Plocamiales, 123, 145 Plocamium, 123, 145 Plocamium hookeri, 147 Plocamium cartilagineum, 147 Plocamium. secundatum, 145 Plumariopsis, 123, 161 Plumariopsis eatoni, 161 Pneophyllum, 122, 133 Pneophyllum amplexifrons, 133 Polycoryne, 173 Polycoryne radiata, 173 Polysiphonia, 123, 175 Polysiphonia abscissa, 176 Polysiphonia anisogona, 176 Polysiphonia argentinica, 178 Polysiphonia brodiaei, 176 Polysiphonia hassleri, 176 Porphyra, 112, 115 Porphyra argentinensis, 116 Porphyra columbina, 115 Porphyra endiviifolia, 118 Porphyra linearis, 116 Porphyra plocamiestris, 118 Porphyra pujalsiae, 116 Porphyra woolhouseae, 116 Porphyridiaceae, 112, 113 Porphyridiales,, 112, 113 Porphyridium, 112, 113 Porphyridium. purpureum, 113 Prasinocladus marinus, 30 Prasinophyceae:, 29 Prasiola, 29, 31 Prasiola crispa, 31 Prasiolaceae., 31 Prasiolales, 31 Prasiolales:, 29 Protomonostroma, 29, 33 Protomonostroma undulatum, 33 Pseudolaingia, 123, 170 Pseudolaingia. larsenii, 170 Pseudolithoderma, 64, 92 Pseudolithoderma extensum, 92 Pseudolytophyllum, 122, 135 Pseudonitophylla, 123, 171 Pseudonitophylla deseadensis, 171 Pseudophycodrys, 123, 171 Pseudophycodrys phyllophora, 171 Pterocladiella, 123, 137 Pterocladiella . capillacea, 137 Pterosiphonia, 123, 180 Pterosiphonia dendroidea, 180 Pterosiphonia pennata, 180 Pterothamnion, 123, 160 Pterothamnion antarcticum, 160 Pterothamnion plumula, 160 Pterothamnion simile, 159 Ptilonia, 123, 138 Ptilonia magellanica, 138 Punctaria, 64, 85 Punctaria latifolia, 85 Punctaria plantaginea, 85 Pylaiella, 64 Pylaiella littoralis, 72 Pylaiellaceae, 64 Pyropia, 112, 115 Ralfsia, 64, 89, 90 Ralfsia australis, 91 Ralfsia verrucosa, 91 Ralfsiaceae, 64, 90 Ralfsiales, 64 Rama, 30, 47 Rama antarctica, 48 Rama novaezelandiae, 48 Rhabdonia, 123, 147 Rhabdonia coccinea, 148 Rhizoclonium, 30, 47 Rhizoclonium ambiguum, 47 Rhizoclonium riparium, 47 Rhizoclonium tortuosum, 47 Rhodellophyceae, 112, 113 Rhodochorton, 122, 126, 127 Rhodochorton membranaceum, 129 Rhodochorton purpureum, 127 Rhodoglossum, 152 Rhodomela, 123, 178 Rhodomela patagoniensis, 178 Rhodomelaceae, 175 Rhodophyllidaceae, 123 Rhodophysemataceae, 126 Rhodothamniella, 122, 128 Rhodothamniella floridula, 128 Rhodothamniellaceae, 122, 128 Rhodymenia, 123, 140 Rhodymenia coccocarpa, 140 Rhodymenia falklandica, 142 Rhodymenia subantártica, 140 Rhodymeniaceae, 123, 140 Rhodymeniales, 123, 139 Rhodymeniophycidae, 137 Rosenvingiella, 29, 31 Rosenvingiella polyrhiza, 31 Rubrointrusa, 122, 129 Rubrointrusa membranácea, 129 Sahlingia, 112, 114 Sahlingia subintegra, 114 Sarcodia, 123 Sarcodia. montagneana, 157 Sarcodiaceae, 123 Sarcothalia, 123, 153 Sarcothalia crispata, 155 Sarcothalia dichotoma, 155 Schizoseris, 123, 173 Schizoseris dichotoma, 173 Schizoseris . condensata, 173 Schizoseris davisii, 173 Schizoseris griffithsiae, 173 Schizoseris polydactila, 174 Scytosiphon, 64, 89 Scytosiphon crispus, 89 Scytosiphon complanatus, 89 Scytosiphon dotyi, 89 Scytosiphon lomentaria, 89 Scytosiphonaceae, 64, 89 Scytosiphonales, 64, 89 Scytothamnaceae, 64, 92 Scytothamnales, 64, 92 Scytothamnus, 64, 92 Scytothamnus fasciculatus, 93 Siphonocladales, 52 Siphonocladales:, 30 Siphonocladophyceae, 30 Sorocarpus okamurae var. piliferus, 76 Sphacelaria, 65, 101 Sphacelaria bornetii, 101 Sphacelaria cirrosa, 101 Sphacelaria fusca, 101 Sphacelaria rigidula, 101 Sphacelariaceae, 65, 100 Sphacelariales, 65, 100 Spongites, 122, 133 Spongites discoideum, 133 Spongomorpha, 29, 35 Spongomorpha pacifica, 35 205 Sporochnaceae, 65, 99 Sporochnales, 65, 99 Sporochnus, 65, 99 Sporochnus pedunculatus, 100 Sporocladopsis, 29 Sporocladopsis novaezelandiae, 38 Sporoglossum, 123, 184 Sporoglossum . lophurellae, 184 Stereocladon, 64, 93 Stereocladon rugulosus, 93 Stictosiphonia, 182 Stictosiphonia intricata, 182 Streblocladia, 123, 184 Streblocladia camptoclada, 184 Streblocladia corymbifera, 184 Streblonema, 64, 75 Streblonema macrocystis, 78 Streblonema patagonicum, 75 Streblonema cokeri, 75 Stylonema, 112, 113 Stylonema alsidii, 113 Stylonema cornu cervi, 113 Stylonemataceae, 112, 113 Stylonematales, 112, 113 Stypocaulaceae, 65, 101 Stypocaulon, 65, 102 Stypocaulon funiculare, 102 Synarthrophyton, 122, 136 Synarthrophyton neglectum, 137 Synarthrophyton patena, 137 Tetraselmidales, 29 Tetraselmis, 29, 30 Tetraselmis marina, 30 Titanoderma, 122, 135 Titanoderma conspectum, 135 Titanoderma pustulatum, 135 Titanoderma pustulatum var. macrocarpum, 135 206 Trailliella, 139 Trailliella, 123 Trailliella intricata, 139 Trebouxiophyceae, 29 Ulothrix, 29, 33 Ulothrix australis, 33 Ulothrix consociata, 33 Ulothrix flacca, 33 Ulotrichales, 29, 31 Ulva, 29, 40 Ulva californica, 45 Ulva clathrata, 41 Ulva compressa, 43 Ulva flexuosa, 43 Ulva flexuosa subsp. pilifera, 43 Ulva hookeriana, 41 Ulva intestinalis, 44 Ulva lactuca, 45 Ulva linza, 44 Ulva prolifera, 44 Ulva rigida, 46 Ulva torta, 45 Ulvaceae, 29, 40 Ulvales, 29, 35 Ulvaria, 29, 46 Ulvella, 29, 38 Ulvella lens, 38 Ulvellaceae, 29, 35 Ulvophyceae, 29 Undaria, 65, 105 Undaria pinnatifida, 105 Urospora, 29, 34 Urospora penicilliformis, 34 Utriculidium, 64, 89 Utriculidium durvillaei, 89 Wittrockiella, 30, 52 Wittrockiella lyallii, 52 EDITORIAL UNIVERSITARIA DE LA PATAGONIA (EDUPA) http://www.infoweb.unp.edu.ar edupa@unp.edu.ar Miembro de la Red de Editoriales de Universidades Nacionales de la República Argentina (REUN) 207