Document
Anuncio

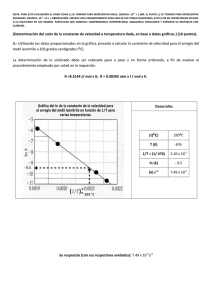
Unidad IV: Propiedades fundamentales de la materia. Facultad de Ingeniería 2012 UPV Unidad IV: Propiedades fundamentales de la materia: • • Masa y densidad – Concepto de masa – Relación entre masa y volumen – Concepto de densidad y peso especifico – Propiedades de los compuestos Temperatura y Dilatación – Concepto de temperatura – Escalas de temperatura y conversión – Propiedades térmicas de la materia • Propiedades térmica de los gases – Expansión y compresión de gases – Ley de los gases ideales • Propiedades térmicas de los sólidos – Dilatación lineal – Dilatación superficial y volumétrica La Materia • La materia esta formada por átomos y estos están constituidos por un núcleo y electrones que giran alrededor. • El núcleo esta compuesto por partículas positivas llamadas Protones y partículas neutras llamadas Neutrones Masa Atómica • La masa de un átomo esta concentrada en el núcleo. Debido a lo pequeño que son los átomos. • La masa atómica es la masa que tiene una sustancia elemental. • Un átomo de hierro tiene una masa atómica de 55,845 unidades de masa atómica (uma). Cantidad de sustancia: Mol • El mol (símbolo: mol) es la unidad con que se mide la cantidad de sustancia y es una de las siete magnitudes físicas fundamentales del SI. • Dada cualquier sustancia ya sea, elemento o compuesto químico y considerando a la vez un mol de entidades elementales, donde estas entidades elementales corresponde a 6,022·1023 unidades elementales. Mol y Masa Molar • Si tomamos 1 mol de átomos de hierro estos masan 55,845 gramos. Por tanto se dice que la Masa Molar de 55,845 g/mol. • Podemos decir que 6,022·1023 átomos de hierro masan 55,845 gramos Masa • La masa es la cantidad de materia de un cuerpo. • Es una propiedad intrínseca de los cuerpos que determina la medida de la masa inercial y de la masa gravitacional. Masa • La unidad utilizada para medir la masa en el Sistema Internacional de Unidades es el kilogramo (kg). • Es una cantidad escalar y no debe confundirse con el peso, que es una cantidad vectorial que representa una fuerza. Masa y Mol • La masa de los compuestos esta relacionada a través de la Masa molar por medio de la siguiente expresión: m n M • Donde n es el número de moles, m masa en gramos y M es la Masa molar. Ejemplo 1. Para 0,325 moles de MgO, determine: a) Masa molar b) Número de moléculas c) Masa del compuesto. Respuesta. a) M = 24.305 g/mol + 15.999 g/mol= 40.304 g/mol b) 0,325 moles ·6.022·1023=1.957·1023 c) n=m/M => m=n·M=0,325 mol· 40.304 g/mol m= 13,0988 g Masa • La cantidad de materia se mide con balanza. Densidad Madera masa Densidad ; volumen m ρ V Plomo: 11300 kg/m3 Madera: 500 kg/m3 2 kg, 4000 cm3 4000 cm3 177 cm3 Plomo Mismo volumen 45.2 kg Plomo Misma masa 2 kg Ejemplo 2: La densidad del acero es 7800 kg/m3. ¿Cuál es el volumen de un bloque de acero de 4 kg? m ; V m 4 kg V 7800 kg/m3 4 kg V = 5.13 x 10-4 m3 ¿Cuál es la masa si el volumen es 0.046 m3? m V (7800 kg/m3 )(0.046 m3 ); m = 359 kg Gravedad específica La gravedad específica r de un material es la razón de su densidad a la densidad del agua (1000 kg/m3). r x 1000 kg/m3 Ejemplos: Acero (7800 kg/m3) Latón (8700 kg/m3) Madera (500 kg/m3) r = 7.80 r = 8.70 r = 0.500 Peso Especifico El peso específico medio de un cuerpo, se define como el cociente entre su peso P y su volumen V. masa·gravedad Pe ; volumen Unidades SI: Newton/m3 m·g Pe V Temperatura La temperatura se relaciona con la actividad cinética de las moléculas, mientras que la dilatación y los cambios de fase de las sustancias se relacionan más con la energía potencial. Aunque no es cierto en todos los casos, un buen principio es definir la temperatura como la energía cinética promedio por molécula. 1 2 Ec m·v 2 Energía Cinética ½mv T N 2 Temperatura contra energía interna Misma temperatur a inicial El volumen más grande tiene mayor energía térmica hielo agua hielo Las jarras grande y pequeña tienen la misma temperatura, pero no tienen la misma energía térmica. Una mayor cantidad de agua caliente funde más hielo. Equilibrio de temperatura Equilibrio térmico Carbones calientes Agua fría Contenedor aislado Misma Temperatura El calor se define como la transferencia de energía térmica debido a una diferencia en temperatura. Dos objetos están en equilibrio térmico si y sólo si están a la misma temperatura. Termómetro Un termómetro es cualquier dispositivo que, mediante escalas marcadas, puede dar una indicación de su propia temperatura. T = kX X es propiedad termométrica: dilatación, resistencia eléctrica, longitud de onda de luz, etc. Escalas de temperatura El punto fijo inferior es el punto de congelación, la temperatura a la que el hielo y el agua coexisten a 1 atm de presión: 1000C 0 0C 2120F 320F 0 0C o 32 0F El punto fijo superior es el punto ebullición, la temperatura a la que vapor y agua coexisten a 1 atm de presión: 100 0C o 212 0F Comparación de intervalos de temperatura Intervalos de temperatura: 100 C0 = 180 F0 5 C0 = 9 F0 Si la temperatura cambia de 79 0F a 70 0F, significa una disminución de 5 C0. 1000C 2120F 100 C0 180 F0 tC 0 0C tF 320F Temperaturas específicas Mismas temperaturas tienen números 0F diferentes: 0C 1000C 2120F 100 C0 180 F0 tC 00 tF 320 100 div 180 div tC tF 0 0C 320F t tF 32 0 9 5 C tF t 32 9 5 C 0 tC 5 9 t 32 0 F Ejemplo 3: Un plato de comida se enfría de 1600F a 650F. ¿Cuál fue la temperatura inicial en grados Celsius? ¿Cuál es el cambio en temperatura en grados Celsius? Convierta 160 0F a 0C de la fórmula: tC 0 5 5(128 ) 0 0 tC (160 32 ) 9 9 0 0 5 C 0 t 95 F 0 9F t 32 0 F tC = 71.1 0C t 160 F 65 F 95 F 0 5 9 0 9 F0 = 5 C0 t = 52.8 C0 Limitaciones de las escalas relativas El problema más serio con las escalas Celsius y Fahrenheit es la existencia de temperaturas negativas. Claramente, ¡la energía cinética promedio por molécula NO es cero o en 0 0C o en 0 0F! T = kX = ¿0? ¿-25 0C? Termómetro a volumen constante Presión absoluta Válvula Volumen constante de un gas. (Aire, por ejemplo) La búsqueda para un cero verdadero de temperatura se puede hacer con un termómetro a volumen constante. Para volumen constante: T = kP La presión varía con la temperatura. Cero absoluto de temperatura P1 P2 T1 T2 Cero absoluto T -2730C 0 0C P 1000C 0 0C 1000C Grafique los puntos (P1, 00C) y (P2, 1000C); luego extrapole a cero. Cero absoluto = -2730C Comparación de cuatro escalas 1000C 2120F 373 K 672 R 1 C0 = 1 K 460 R 5 C0 = 9 F vapor 00C 320F 273 K hielo Celsius K Fahrenheit C Kelvin F R Rankine Cero absoluto -2730C 0K -4600F 0R tF t 32 9 5 C 0 tC 95 tF 320 TK = tC + 2730 Propiedades térmicas de los gases El comportamiento de los gases depende de la Presión, Volumen, Temperatura y número de moles. La ecuación de los Gases ideales corresponde a un modelo que predice las propiedades de los gases que cumplen con los siguientes requisitos: Las moléculas de gas ocupan un volumen casi nulo. La energía cinética es muy alta. Las moléculas de gas experimentan choques perfectos. Ecuación de los Gases Ideales PV · n·RT · atm·L R 0,082 K·mol J 8,3 K·mol P Presión V Volumen n = número de moles R = Constante de los gases T = Temperatura Absoluta Relación de Estados • Es posible relacionar distintos estados para un gas ideal por medio de la siguiente expresión: P1·V1 P2·V2 n1T1 n2T2 • Si el numero de moles de gas permanece constante, tenemos: P1·V1 P2·V2 n1 n2 T1 T2 Ejemplo 4: Un gas ideal ocupa un volumen de 100 cm3 a 20°C ya una presión de 100 Pa. Determine el número de moles de gas en el recipiente. n=P·V/(R·T) para este caso utilizaremos R=8,3 J/K·mol n=100 Pa·0,0001 m3/(8,3 J/K·mol ·293K) n=4,11·10-6 moles Ejemplo 5: Se mantiene un gas ideal en un recipiente a volumen constante. Inicialmente, su temperatura es 100 ºC y su presión es 2,5 atmósferas ¿Cuál será la presión cuando la temperatura sea de 80°C? P1·V1 P2·V2 T1 T2 V1 V2 P2 2,5atm 373K 353K P2 2,36atm Dilatación lineal L L0 t to L L0 t Cobre: = 1.7 x 10-5/C0 Hierro: = 1.2 x 10-5/C0 Lo L L t Concreto: = 0.9 x 10-5/C0 Aluminio: = 2.4 x 10-5/C0 Ejemplo 2: Una tubería de cobre mide 90 m de largo a 20 0C. ¿Cuál es nueva longitud cuando a través de la tubería pasa vapor a 1000C? Lo = 90 m, t0= 200C t = 1000C - 200C = 80 C0 L = Lot = (1.7 x 10-5/C0)(90 m)(80 C0) L = 0.122 m L = Lo + L L = 90 m + 0.122 m L = 90.12 m Aplicaciones de la dilatación Hierro Latón Latón Hierro Junta de dilatación Tira bimetálica Las juntas de dilatación son necesarias para permitir que el concreto se dilate, y las tiras bimetálicas se pueden usar como termostatos o para abrir y cerrar circuitos. Dilatación de área Dilatación al calentarse. A0 A La dilatación de área es análoga a la ampliación de una fotografía. El ejemplo muestra una tuerca caliente que se encoge para un firme ajuste después de enfriarse. Cálculo de dilatación de área A0 = L0W0 A = LW L = L0 + L0 t W = W0 + W0 t W W L = L0(1 + t ) W = W0(1 + t A = LW = L0W0(1 + t)2 Wo L Lo L A = A0(1 + 2 t) Dilatación de área: A = 2A0 t Dilatación de volumen La dilatación es la misma en todas direcciones (L, W y H), por tanto: V = bV0 t b 3 La constante b es el coeficiente de dilatación de volumen. V b V0 t Ejemplo 3. Un vaso de precipitados Pyrex de 200 cm3 se llena hasta el tope con glicerina. Luego el sistema se caliente de 20 0C a 80 0C. ¿Cuánta glicerina se desborda del contenedor? Glicerina: b 5.1 x 10-4/C0 200C Pyrex: b = 3 b 30.3 x 10-5/C0) b = 0.9 x 10-5/C0 Vdesb = VG - VP Vdesb= ¿? 800C V0 V 200 cm3 Vdesb = bGV0 t - bPV0 t = (bG - bP )V0 t Vdesb = (5.1 x 10-4/C0- 0.9 x 10-5/C0)(200 cm3)(800C - 200C) Ejemplo 3. (continuación) Glicerina: b 5.1 x 10-4/C0 Pyrex: b = 3 b 30.3 x 10-5/C0) b = 0.9 x 10-5/C0 Vdesb = VG - VP 200C Vdesb= ¿? 800C V0 V 200 cm3 Vdesb = bGV0 t - bPV0 t = (bG - bP )V0 t Vdesb = (5.1 x 10-4/C0- 0.9 x 10-5/C0)(200 cm3)(800C - 200C) Desbordamiento de volumen = 6.01 cm3