Modulación del sustrato de muerte súbita mediante la ablación
Anuncio

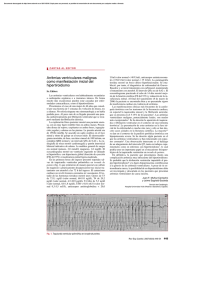
Rev Electro y Arritmias 2010; 4: 34-44 ARTÍCULO ORIGINAL Modulación del sustrato de muerte súbita mediante la ablación lineal para el control de arritmias ventriculares graves: simplificando la técnica para reducir los riesgos y complicaciones Tauber P., Mansilla V., Corbalan R., Maidana G., Ortopan C., Valero E., Pesce R. Técnico: Ruiz C. Departamento de Arritmias, Insuficiencia y Resincronización Cardíaca. Centro Modelo de Cardiología. Hospital Centro de Salud ”Zenón J. Santillán”. Tucumán. Trabajo presentado para optar al Premio SADEC 2010. Introducción Material y método La ablación por radiofrecuencia (RF) basada sobre la cartografía del sustrato todavía no está bien sistematizada y su implementación correcta puede mejorar los resultados, disminuyendo los riesgos y complicaciones, cuando se la compara con la técnica de exploración por “encarrilamiento”. Esta última puede realizarse de manera apropiada y con buena tolerancia sólo en el 10% de los pacientes y de las taquicardias ventriculares clínicas toleradas menos del 25% son tratadas con éxito por este medio1-5. Teniendo en cuenta esas limitaciones hemos desarrollado la presente investigación, cuyo propósito es definir con claridad los electrogramas ventriculares patológicos que son el objetivo de la modulación/ablación lineal para suprimir las arritmias ventriculares amenazantes para la vida, con una técnica simplificada que provea una relación riesgo beneficio apropiada, superior a la de la técnica de “encarrilamiento”. Población de pacientes Se realizó un estudio prospectivo, no aleatorizado, en pacientes con miocardiopatía isquémica y no isquémica y deterioro de la función del ventrículo izquierdo que presentaron arritmias ventriculares graves (fibrilación ventricular, taquicardia ventricular uniforme sostenida incesante, taquicardia ventricular no sostenida repetitiva, taquicardia ventricular pleomórfica o multiforme, “tormenta arrítmica”) y fueron sometidos a ablación lineal del sustrato miocárdico. Los pacientes incluidos se consideraron de alto riesgo para procedimientos de ablación con cartografía por inducción de taquicardia ventricular. Previo consentimiento informado por escrito y con autorización del Comité de Docencia e Investigación local, se incluyeron pacientes de ambos sexos, que presentaron arritmias ventriculares que requirieron cardioversión eléctrica, choques de cardiodesfibrilador implantable, taquicardia ventricular uniforme sostenida mal tolerada o incesante. Se realizó ecocardiograma Doppler y perfusión miocárdica con el objetivo de caracterizar el sustrato y obtener datos basales. Objetivos Se definió como “objetivo primario” a la ausencia de recurrencia de arritmia ventricular severa o síncope en un seguimiento a los 7 días, 1 y 3 meses mediante evaluación clínica, ECG de Holter de 24 horas e interrogatorio del cardiodesfibrilador automático implantable, en los pacientes portadores de este dispositivo. Se definió como “objetivo secundario” a la aplicación de un número considerado suficiente de lesiones lineales a través del sustrato guiados por los electrogramas considerados “malignos” y la caracterización de los componentes del sustrato mediante análisis de los electrogramas. Por el mismo período de tiempo se siguió a los pacientes con evaluación de la clase funcional de la NYHA y ecocardiograma Doppler a fin de establecer cambios eventuales en los síntomas de insuficiencia cardíaca y en la función ventricular izquierda. También se evaluó el tiempo del procedimiento y la correlación entre las características de los electrogramas locales y los parámetros de latencia y “encarrilamiento”. Con ésta técnica se trató de eliminar y/o modificar circuitos potenciales que pudiesen con el tiempo generar otras arritmias ventriculares. También se buscó caracterizar de modo retrospectivo a los electrogramas y establecer patrones de correlación con la nueva clasificación de las arritmias ventriculares propuesta por Garfinkel y col. Correspondencia: Pablo Tauber Email: pablotauber@gmail.com Recibido: 14/08/2010 Aceptado: 01/09/2010 34 Metodología técnica Mediante el análisis del ECG de la taquicardia ventricular clínica se determinó su sitio de origen para decidir la táctica de abordaje (endocárdica, epicárdica, ventrículo izquierdo o derecho ) y en caso de requerir la cartografía del ventrículo izquierdo se evaluó con ecocardiograma el estado de la válvula aórtica con el propósito de decidir la vía transeptal o aórtica retrógrada. Si la arritmia clínica fue una fibrilación ventricular se abordó en primera instancia el ventrículo izquierdo, siempre por vía aórtica retrógrada a menos que existiera contraindicación (estenosis o reemplazo valvular aórtico). En caso de identificarse una taquicardia ventricular de origen epicárdico, el abordaje se realizó por pericardiocentesis con la técnica de Sosa y col. y también simultáneamente por vía endocárdica. Una vez identificados los electrogramas, mediante exploración con filtro de 10-400 Hz , se procedió a realizar ablación lineal por RF con catéter convencional con punta de 4 mm u 8 mm, potencia de hasta 50 W y temperatura controlada hasta 60° C por períodos de 60 segundos, aplicando lesiones lineales con 5 mm de separación entre ellas, aproximadamente, para transitar por la escara desde una zona borde hasta otra, o hasta un istmo o canal atravesando zonas de múltiples parches de escaras y aplicando energía de RF sobre zonas donde se identificaran potenciales diastólicos, o uniendo zonas Electrofisiología y Arritmias, Vol 4, N° 2 / Abril - junio 2011 Modulación del sustrato de muerte súbita mediante la ablación lineal para el control de arritmias ventriculares graves: simplificando la técnica para reducir los riesgos y complicaciones Tabla 1. Características clínicas basales. Abreviaturas. CF NYHA: clase funcional New York Heart Association; AA: antiarrítmicas; FEy: fracción de eyección; AI: aurícula izquierda; DDVI: diámetro diastólico del ventrículo izquierdo; DSVI: diámetro sistólico del ventrículo izquierdo; IM: insuficiencia mitral; MCP: marcapasos; EV: extrasístole ventricular; BRD: bloqueo de rama derecha; BRI: bloqueo de rama izquierda; FV: fibrilación ventricular; FA: fibrilación auricular; TV: taquicardia ventricular; TVMS: taquicardia ventricular monomorfa sostenida; HTA: hipertensión arterial; DBT: diabetes; DLP: dislipemia; EPOC: enfermedad pulmonar obstructiva crónica; Amiod: amiodarona; BB: beta bloqueante; ACO: anticoagulación oral; Espiro: espironolactona; Furo: furosemida; AAS: acido acetilsalicílico; ARAII: antagonistas de los receptores de angiotensina II; Hpl: hipolipemiante; IECA: inhibidor de la enzima convertidora de angiotensina; Endoc: endocárdica; Epic: epicárdica. borde o canales con obstáculos anatómicos como el anillo AV. Se realizaron tantas líneas como el operador consideró necesario guiándose por imágenes anátomo-Rx y de electrogramas locales, pero evitando liberar la energía de RF en sitios con potenciales correspondientes a tejido sano. Se consideró que la aplicaciones lineales eran “seguras”, sin considerar su número, si se respetaron de manera estricta los parámetros de cartografía electrográfica y existía la certeza de liberar la energía de RF sobre tejido patológico para evitar lesionar miocardio sano y no empeorar la función ventricular. Valores de referencia para la exploración bipolar de los electrogramas Durante la cartografía epicárdica y/o endocárdica se utilizaron los criterios siguientes para definir los electrogramas (EGM) locales (25): 1.EGM endocárdicos normales: EGM bi o trifásico Amplitud > 1,5 mV Duración < 70 mseg Para ventrículo derecho: > 1,44 mV (especificidad: 95%) Para ventrículo izquierdo: > 1,55 mV (especificidad: 95%) 2.EGM epicárdicos normales para ambos ventrículos: EGM bi o trifásicos Amplitud > 1,0 mV Duración < 70 mseg EGM en zona de grasa epicárdica que rodea un vaso coronario o próximo a un anillo AV: EGM bi o trifásico, Amplitud < 1,0 mV, Duración < 70 mseg, sin criterios patológicos. 3.EGM anormales: Amplitud < 1,0 mV en el epicardio o < 1,5 mV en el endocardio, con una o más de las siguientes características: a. Duración > 80 mseg y fraccionados: corresponden a bandas de miocitos separados por fibrosis, con propiedades de conducción lenta. b. EGM “desdoblados” con 2 o más componentes con segmentos isoeléctricos entre los picos > 10 mseg: corresponden a zonas de bloqueo de conducción con activación alrededor del bloqueo o dos frentes de onda. c. Potenciales tardíos (PT) o potenciales diastólicos: EGM aislados en la diástole a más de 10 mseg después del complejo QRS o que preceden a éste. d. Potenciales de fibras de Purkinje precediendo al complejo QRS en 11mseg +/- 4 mseg. En caso de desencadenarse una taquicardia ventricular espontánea, fuese clínica o no, o inducidas por la movilización del catéter-electrodo se aprovechó para realizar el mapeo de la latencia mediante la evaluación de los intervalos EGM-QRS y buscar zonas de salida del circuito mediante criterios de “encarrilamiento” por determinación de EGMQRS = ( duración del EGM - duración del QRS) +/- 20 mseg y el porcentaje de la duración del intervalo EGM-QRS con respecto al intervalo del ciclo de la taquicardia ventricular (ICT) (valor considerado óptimo: < 70%) (5). Tabla 2. Seguimiento Post-ablación. Abreviaturas. CDI: cardiodesfibrilador implantable; RC: resincronizador; Atorv: atorvastatina; HGO: hipoglucemiante oral; resto de abreviaturas como en la tabla 1. Electrofisiología y Arritmias, Vol 4, N° 2 / Abril - junio 2011 35 Pablo Tauber y col. Tabla 3. Características del procedimiento. Abreviaturas. Ven: venoso; Ao: aórtico; Retróg: retrógrado; resto de abreviaturas como en tabla 1. Tabla 4. Características de los electrogramas considerados “objetivos” de ablación. Abreviaturas. EGM: electrograma; ms: milisegundos; Pot: potencial; Fragm: fragmentados; RS: ritmo sinusal; MP: marcapaseo. Resto de abreviaturas como en tabla 1. Tabla 4a. Abreviaturas. B: borde; C: canal; E: escara. Tabla 4b. No se admitió ninguna maniobra electrofisiológica ni farmacológica que pusiera en riesgo la estabilidad hemodinámica del paciente ni que intentara la inducción de taquicardia ventricular. Resultados Características clínicas basales (Tabla 1) El estudio incluyó a 5 pacientes: uno con miocardiopatía isquémica, dos con miocardiopatía de etiología chagásica, uno en quien se encontró una banda muscular calcificada en el ventrículo izquierdo y el restante que padecía de taquicardia primaria. La edad promedio fue de 61 años. Dos pacientes, uno isquémico y el otro chagásico, presentaron episodios de taquicardia ventricular de dos o más morfologías y uno, taquicardia/fibrilación ventricular con múltiples episodios sincopales de causa primaria. Los dos pacientes restantes tenían taquicardia ventriculares uniformes catalogadas como incesantes por el ECG de Holter. Tres pacientes (75%) recibían amiodarona y todos estaban medicados con bloqueantes β adrenérgicos. Cuatro pacientes tenían taquicardias ventriculares endocárdicas (80%) por criterios ECG y sólo el que padecía de cardiopatía isquémica (20%) tenía taquicardias ventriculares de origen epicárdico de hasta 3 morfologías. La fracción de eyección promedio fue de 42%. 36 Seguimiento posablación por RF (Tabla 2) De los 5 pacientes tratados con las técnicas descriptas, en el seguimiento hasta los tres meses, no se observaron recurrencias de arritmias ventriculares graves ni síncopes, ni requerimiento de nuevos procedimientos; tampoco hubo deterioro de la función ventricular ni de la clase funcional de la NYHA. Características del procedimiento (Tabla 3) En todos los pacientes se utilizaron sólo 2 catéteres-electrodo; en 4 de ellos (80%) se realizó cartografía y ablación endocárdica y sólo en uno (20%) el abordaje fue endocárdico y epicárdico. En todos los casos se empleó anestesia local y se agregó sedación profunda cuando se realizó la exploración epicárdica. La duración promedio del procedimiento fue de 83 minutos, con buena y tolerancia y sin complicaciones. El número promedio de lesiones lineales por radiofrecuencia fue 11,6. Características de los EGM bipolares considerados “objetivo” para la modulación/ablación del sustrato (Tabla 4). Potenciales de fibras de Purkinje se hallaron en un solo paciente, con diagnóstico de taquicardia ventricular/fibrilación ventricular; esos potenciales precedieron al electrograma del músculo ventricular en un valor promedio de 22 mseg. Los otros 4 pacientes presentaron una duración Electrofisiología y Arritmias, Vol 4, N° 2 / Abril - junio 2011 Modulación del sustrato de muerte súbita mediante la ablación lineal para el control de arritmias ventriculares graves: simplificando la técnica para reducir los riesgos y complicaciones Figura 1. Escara densa. promedio del electrograma para la zona borde de 158 mseg, para zona canal, de 148 mseg, y para cicatriz, de 148 mseg; todos estos electrogramas fueron “desdoblados” y/o fragmentados y coexistieron con potenciales diastólicos. En estos pacientes se pudieron aplicar de manera retrospectiva criterios para mapeo de latencia; se halló que la precocidad del electrograma local con respecto al complejo QRS midió, en promedio, 56,2 mseg para la zona borde, 36,8 mseg para la zona canal y 32 mseg para la zona de cicatriz. Cuando se utilizó la relación electrograma a QRS = (EGMQRS) x 100 se encontró que todos los electrogramas elegidos para ablación por los criterios morfológicos presentaron un porcentaje inferior al 70%, lo cual indica una buena co- rrelación y, por lo tanto, que la morfología de los electrogramas permitió ubicarse en las zonas críticas de los circuitos. Los 3 pacientes con antecedentes de fibrilación ventricular mostraron electrogramas continuos durante la diástole, con características de conducción fibrilatoria en algún lugar del sustrato. 4. Caracterización de los componentes del sustrato mediante análisis de los electrogramas Escara densa (Figura 1) Electrograma < 0,50 mV (fraccionado); sin “desdoblamiento evidente; sin latencia; duración > 130 mseg; sin potenciales diastólicos relacionados. Figura 2. Electrogramas en zona de escara potencialmente maligna. Electrofisiología y Arritmias, Vol 4, N° 2 / Abril - junio 2011 37 Pablo Tauber y col. Figura 3. Potenciales diastólicos. Interpretación: zona con escasas células viables con propiedades electrofisiológicas alteradas, rodeadas por una elevada cantidad de tejido fibroso con conducción lenta y sin sitio de entrada o salida identificable. Escara potencialmente maligna (Figura 2) Electrograma < 0,50 mV; con fragmentación y potenciales diastólicos relacionados; duración > 80 mseg; con latencia. Interpretación: zona con células viables con propiedades electrofisiológicas alteradas, rodeadas por menor cantidad de tejido fibroso con conducción lenta y con sitio de entrada y/o salida que probablemente no participan en el circuito de la taquicardia ventricular, ya que son consideradas “espectadores” y pueden constituir istmos críticos para otras taquicardias ventriculares no-clínicas. Uno o varios de esos istmos pueden generar taquicardias ventriculares de varias morfologías. Potenciales diastólicos4 (Figura 3) Como se mencionó, estos potenciales se registran durante la diástole, 10 mseg o más antes o después del complejo QRS en ritmo sinusal, en taquicardia ventricular o durante la estimulación artificial. Los potenciales diastólicos precoces preceden inmediatamente al complejo QRS y se registran en la zona de salida del circuito; los potenciales diastólicos tardíos corresponden a la porción proximal y media del circuito y se inscriben 10 mseg o más después del QRS o durante la diástole. Canal o istmo (“inner loops”) (Figura 4) Electrograma entre 0,5 mV y 1,0 mV para el epicardio y entre 0,5 y 1,5 mV para el endocardio; con “desdoblamientos” múltiples de alta frecuencia; duración > 80 mseg; con o sin potenciales tardíos relacionados; sin latencia; en relación con electrogramas de escaras durante la cartografía. Interpretación: corredor de tejido viable con propiedades de conducción lenta, con o sin sitios de entrada y/o salida iden38 tificables correspondientes a una actividad eléctrica durante la diástole. Su asociación con potenciales tardíos indica un circuito completo con entrada y salida (potencialmente maligno). Puede ser dividido en 3 segmentos funcionales: 1) entrada; 2) zona central; y 3) salida. Canal potencialmente maligno (Figura 5) Electrogramas entre 0,5 mV y 1,0 mV para el epicardio y entre 0,5 mV y 1,5 mV para el endocardio; con potenciales “desdoblados” múltiples de alta frecuencia; duración > 80 mseg y potenciales tardíos relacionados; con latencia; en relación con electrogramas de escaras durante la exploración cartográfica. Interpretación: corredor de tejido viable con propiedades de conducción lenta con sitio de entrada y salida. Zona borde (potencialmente maligna) (“outer loops”) (Figura 6) Electrogramas entre 0,5 mV y 1,5 mV para el endocardio y entre 0,5 mV y 1,0 mV para el epicardio; hemos encontrado zonas con electrogramas de mayor voltaje, de hasta 1,8 mV, pero con las características de zona borde y asociados a potenciales tardíos; con potenciales “desdoblados” de alta frecuencia y componentes múltiples sin separación por línea isoeléctrica; duración > 80 mseg; con o sin potenciales tardíos relacionados; con latencia; en relación con EGM correspondientes a tejido sano durante la exploración cartográfica. Interpretación: corredor de tejido viable con propiedades electrofisiológicas alteradas y posibilidad de múltiples sitios de salida. Canal espectador (“Bystander”): istmo de tejido no asociado con potenciales tardíos, pero que pueden ser parte de circuitos funcionales para otras TV no clínicas. Latencia EGM-QRS: corresponde a la porción del istmo que se despolariza antes del comienzo del QRS (presistólico). Electrofisiología y Arritmias, Vol 4, N° 2 / Abril - junio 2011 Modulación del sustrato de muerte súbita mediante la ablación lineal para el control de arritmias ventriculares graves: simplificando la técnica para reducir los riesgos y complicaciones Potenciales de Fibras de Purkinje: son electrogramas de alta frecuencia bi o multifásicos que en ritmo sinusal o durante la estimulación artificial preceden al electrograma ventricular en hasta 22 mseg. o que durante una taquicardia ventricular o extrasístoles ventriculares pueden hallarse detrás del electrograma ventricular en un lapso variable, lo que se interpreta como bloqueo de la conducción local entre el tejido de Purkinje y el músculo ventricular (Figura 7). EGM de actividad continua durante la diástole Corresponde a un electrograma que se prolonga durante toda la diástole con morfología que remeda una actividad fibrilatoria, y se presenta en algunas zonas del sustrato mientras se registra en el ECG de superficie ritmo sinusal o taquicardia ventricular. Este fenómeno se encontró en los pacientes con antecedentes de fibrilación ventricular (Figura 8). Potenciales “desdoblados”: son electrogramas multifragmentados con separación entre ellos > 10 mseg, duración > 80 mseg y amplitud entre 0,5 mV y 1,5 mV. Correlación de los resultados con la nueva clasificación de las arritmias ventriculares Intentamos correlacionar nuestros hallazgos clínicos y de la exploración cartográfica del sustrato con la clasificación de las arritmias ventriculares propuesta por Garfinkel y colaboradores14. Discusión El sustrato miocárdico propicia los circuitos relacionados con cicatrices por la presencia de regiones de conducción lenta, bloqueo unidireccional y bloqueo de la conducción que es probable que delimiten partes de la vía de reentrada. La reentrada ocurre a través de bandas musculares sobrevivientes que se localizan por lo general en el subendocardio, aunque también puede hallarse en el mesocardio y en el epicardio; esas fibras sobrevivientes pueden conectarse lado a lado generando una patente en zig-zag y permitir la propagación del impulso en dirección transversal. Así, “parches” de fibrosis entre fibras sobrevivientes producen demoras considerables en el avance de la onda excitatoria. El bloqueo unidireccional puede ocurrir después de una extrasístole ventricular y ser así probablemente más funcional que fijo. Muchos circuitos de reentrada contienen un istmo protegido o canales de longitud variable aislados por áreas con bloqueo de la conducción4. La despolarización de pequeñas masas de tejido miocárdico en estos canales no es detectable en el ECG pero puede ser registrada por la exploración de potenciales en la diástole eléctrica, como se observó en alguno de nuestros pacientes. Desde el sitio de salida del canal, el frente de la onda excitatoria se propaga generando un complejo QRS y circula a lo largo del borde de la escara (outer-loop) o a través de ella, para reingresar en el canal o istmo (inner-loop), de modo que en los pacientes con miocardiopatías o infarto de miocardio pueden observarse potenciales múltiples4. Dos o más circuitos reentrantes pueden tener una misma salida, con bloqueos funcionales que cambian la morfología del complejo QRS o bien puede existir un istmo común con diferentes salidas o dos istmos diferentes en áreas distintas de la misma escara o en diferentes escaras. La presencia de múltiples circuitos potenciales y la complejidad anatómica del sustrato explican la complejidad de la exploración cartográfica y la ablación por la técnica de “encarrilamiento”. También es difícil la identificación de zonas “espectadoras” (by-stander) de una taquicardia ventricular que pueden participar en otra taquicardia ventricular. Existen tres variedades de frente de onda: el planar, que transcurre por el borde de una lámina bidimensional; el circular, si la excitación Figura 4. Electrogramas de canal o istmo. Electrofisiología y Arritmias, Vol 4, N° 2 / Abril - junio 2011 39 Pablo Tauber y col. Figura 5. Cause potencialmente maligno. se inicia en el interior de una lámina biplanar y se produce un frente de onda circular o elíptico en el tejido anisotrópico; el espiralado o rotatorio, que puede autoperpetuarse ya que posee en su centro o punta una singularidad de fase y no necesita girar alrededor de un obstáculo fijo. Cuando coexisten dos o más de ellos, en un medio heterogéneo, si el grado de heterogeneidad supera un valor crítico es factible la coexistencia de múltiples ondas espiraladas con diferentes frecuencias, aisladas por una región caótica y así vagar por el medio excitable heterogéneo. Si pudiera controlarse la inestabilidad de estas ondas quizás podría evitarse la transición a la fibrilación ventricular37. Se ha demostrado que un istmo de tan sólo 150 nm permite la propagación de una onda excitatoria. Los obstáculos inexcitables con bordes agudos pueden originar ondas espiraladas a la salida del istmo por un mecanismo que depende de la curvatura del frente de onda. Así, una reentrada anatómica alrededor de un obstáculo se convierte en una reentrada funcional38. Las ondas espiraladas pueden girar alrededor de un eje inexcitable pero, en ocasiones, su punta o centro adquiere un movimiento serpenteante que se compone de una frecuencia de giro de la onda espiralada y de una frecuencia de serpenteo de la punta. Dado que el medio extracelular es más anisotrópico que el intracelular (cociente desigual) esto afecta al trayecto de la punta de la onda espiralada, que, en ciertas circunstancias, se vuelve inestable y se descompone en un estado caótico. Se ha establecido que cuando la duración del potencial de acción supera al intervalo diastólico (DPA/ID > 1) se genera alternancia y disgregación de las ondas espiraladas28,38. En las ondas espiraladas reentrantes generadas en el sustrato, la segunda frecuencia aparece como modulación periódica de la frecuencia y/o la amplitud de la oscilación primaria, con evolución desde un espiral estable a otro con 40 serpenteo cuasi-periódico, el cual presenta ya dos frecuencias como oscilaciones desestabilizantes que conducen al serpenteo caótico de las ondas espiraladas, cambio que indica la transición funcional de una dinámica simple hacia otra compleja, de la periodicidad al caos espacio-temporal que precede a la disgregación de las ondas espiraladas y a la fibrilación ventricular12. Durante la fibrilación ventricular se han demostrado múltiples ondas espiraladas que comienzan a partir de una; ellas tienen una duración limitada y se extinguen al chocar con la refractariedad del tejido o de las otras espirales, disgregándose y creándose en forma continua, con lo cual se mantiene un espectro de frecuencia “inestable” (estado inestable sostenido continuo) para perpetuar la fibrilación ventricular12, 13. Por otro lado, las células transicionales entre las fibras de Purkinje y los miocardiocitos se conectan con ambos a través de bandas finas, identificándose dos áreas de acoplamiento de alta resistencia, lo que explica los registros de componentes múltiples observados en la porción ascendente del potencial de las fibras transicionales, que provee un sistema de amplificación de corriente para conseguir la excitación de las células miocárdicas desde las fibras de Purkinje7. La duración del potencial de acción y la refractariedad de las fibras de Purkinje se prolonga de manera progresiva hasta alcanzar sus valores máximos 2 o 3 mm antes de su terminación en las fibras musculares. Estas áreas de máxima refractariedad actúan como “puertas” para la propagación del impulso y funcionan como múltiples bandas de Purkinje que en condiciones normales ofrecen un límite funcional uniforme para la conducción de estímulos ventriculares prematuros, evitando su propagación hacia el músculo. Una alteración local de estas “puertas” puede resultar en un circuito corto de transmisión a través de ellas que a su vez deriva en una transmisión no-uniforme por las bandas de Electrofisiología y Arritmias, Vol 4, N° 2 / Abril - junio 2011 Modulación del sustrato de muerte súbita mediante la ablación lineal para el control de arritmias ventriculares graves: simplificando la técnica para reducir los riesgos y complicaciones Purkinje y en la creación de circuitos de microreentrada8. Las fibras de Purkinje que sobreviven a una isquemia aguda pueden generar arritmias reentrantes y “gatilladas”. En este sentido, se publicaron taquicardias ventriculares mediadas por fibras de Purkinje en pacientes que padecieron de infartos de miocardio, en quienes el potencial de Purkinje precedía al complejo QRS; la ablación en esos sitios permitió impedir la reiteración de las arritmias9. Además, algo análogo sucedió en pacientes con miocardiopatía dilatada y taquicardia ventricular10. En la insuficiencia cardíaca se dan las condiciones para la dispersión de la repolarización, lo cual es el sustrato de la reentrada funcional11. Todo lo expuesto sustenta una nueva clasificación de las arritmias ventriculares graves propuesta por Garfinkel y colaboradores, que se basa sobre el concepto de las ondas espiraladas: 1) estables: taquicardias ventriculares uniformes; 2) serpenteo cuasi-periódico: torsades de pointes; 3) serpenteo caótico: taquicardias ventriculares multiformespleomórficas; y 4) disgregación caótica de las ondas espiraladas: fibrilación ventricular14. Nosotros encontramos una correlación clínica con esta clasificación. La taquicardia ventricular y la fibrilación ventricular pueden originarse en rotores múltiples tridimensionales que vagan en el interior de la pared ventricular generando múltiples frentes de onda. Las ondas espiraladas y los rotores tridimensionales pueden iniciarse por activación focal, bloqueo unidireccional o turbulencia por la ruptura de la onda excitatoria. La ablación puede quitar puntos de activación focal e interrumpir zonas de rotores y reentrada de ondas espiraladas. Nosotros encontramos turbulencia diastólica en los pacientes que sufrieron taquicardia/fibrilación ventri- cular y la aplicación de radiofrecuencia en esos sitios evitó la recurrencia de esas arritmias. La evidencia experimental indica que la reentrada epicárdica sostenida (rotor madre) puede ser el objetivo de las terapias desfibrilatorias de baja energía15 y de la terapia ablativa. Por otro lado, la fibrilación ventricular isquémica, a la luz de los conocimientos actuales, puede sobrevenir como consecuencia del estiramiento mecánico de las fibras y la estimulación simpática centralmente mediada, que se suma a las otras condiciones electrofisiológicas ya comentadas16. Los registros epicárdicos y endocárdicos desde sitios de taquicardia y fibrilación ventricular demuestran potenciales prolongados de baja amplitud y fragmentados, como los documentados en este trabajo. Los componentes individuales de estos electrogramas fragmentados se originan en islotes de miocitos sobrevivientes rodeados por tejido fibroso. La duración prolongada de estos electrogramas locales representa la conducción lenta y fraccionada en aquellos islotes, que en presencia de “disparadores” adecuados, como las extrasístoles ventriculares, la isquemia y la insuficiencia cardíaca, derivan en arritmias ventriculares potencialmente letales17. En nuestros pacientes, esos electrogramas fueron objetivos de la ablación por radiofrecuencia. En la taquicardia ventricular, el sitio de salida del circuito de reentrada se localiza en la zona borde de la escara y corresponde al comienzo del complejo QRS. La exploración cartográfica y la ablación de la taquicardia ventricular multiforme plantea dificultades inherentes a la localización del o de los circuitos involucrados, aunque la ablación de los “disparadores” puede ser eficaz. Esta dificultad parece superarse cuando se realiza la ablación lineal guiada por los electrogramas locales. Figura 6. Zona “borde” potencialmente maligna. Electrofisiología y Arritmias, Vol 4, N° 2 / Abril - junio 2011 41 Pablo Tauber y col. Figura 7. Potenciales de Purkinje (PP) Los pacientes con insuficiencia cardíaca avanzada pueden no tolerar los procedimientos de ablación prolongados, poseen accesos vasculares limitados, en ocasiones tienen prótesis valvulares mecánicas y el riesgo del procedimiento es elevado. Para minimizar la cantidad de energía de radiofrecuencia liberada en la ablación y las complicaciones inherentes al procedimiento se desarrollaron varias técnicas: 1) cartografía por “encarrilamiento” para las taquicardias ventriculares toleradas y estables; 2) cartografía del sustrato para las taquicardias ventriculares y 3) cartografía de “gatilladores” para la taquicardia ventricular multiforme. Sin embargo, una sesión prolongada y bien tolerada de la técnica de “encarrilamiento” sólo puede realizarse en el 10% de los pacientes19; por otra parte, más del 25% de los pacientes derivados para la ablación por RF de taquicardias ventriculares toleradas no pueden ser tratados con éxito mediante esta técnica20. El análisis y ulterior empleo de las características de los electrogramas bipolares que se propone en este trabajo permitió individualizar el sustrato miocárdico de las taquiarritmias potencialmente letales, por lo que consideramos que constituye una herramienta útil y eficaz para obtener la modulación/ablación del sustrato arritmogénico. A través de la cartografía electroanatómica se ha establecido que el istmo de un circuito presenta una longitud promedio de 31 mm+/- 7 mm y un ancho de 16 mm +/- 8 mm, que durante la taquicardia ventricular generan potenciales diastólicos que corresponden hasta el 81% del intervalo del ciclo de la taquicardia y que por lo general se orientan en dirección perpendicular al anillo mitral en localizaciones septal, antero-apical e ínfero-lateral. Los potenciales “dobles” indican líneas de bloqueo y la mayoría de las taquicardias ventriculares muestra una patente de “doble loop” reentrante21. Nosotros observamos patentes electrográficas distribuidas por el sustrato que indican varias asas de reentrada. La ablación por RF con lesiones “múltiples” y contiguas en la zona “borde” puede interrumpir y eliminar los circuitos de la taquicardia ventricular22. Otros autores han extendido 42 las líneas de ablación a través de islas dentro del infarto y aun de todos los electrogramas fraccionados. También se demostró la utilidad de identificar los electrogramas por cartografía de voltaje en ritmo sinusal, los canales preferenciales de conducción con alto voltaje, que de este modo podrían ser objetivos para la ablación lineal empírica23. Las extrasístoles ventriculares que se originan en fibras de Purkinje alrededor de un tejido infartado pueden iniciar taquicardias ventriculares multiformes o fibrilación ventricular. La ablación de estos sitios con señales compatibles con potenciales de Purkinje produjo la supresión de arritmias ventriculares recurrentes monitorizadas mediante el cardiodesfibrilador automático implantable24. La miocardiopatía dilatada presenta un sustrato heterogéneo y las cicatrices se distribuyen en placas endocárdicas (85%) con parches de fibrosis intersticial (57%), que conforman la base para las taquicardias ventriculares por reentrada o actividad “gatillada” y exhibe menos electrogramas anormales que la cardiopatía isquémica. La fragmentación es menor y se concentran en el endocardio basal del ventrículo izquierdo, aunque también pueden hallarse en el epicardio. Entre el 10% y el 40% de los pacientes con enfermedad de Chagas desarrollan una miocardiopatía dilatada, con arritmias ventriculares graves y muerte súbita. Suelen tener taquicardias ventriculares de varias morfologías y se observan electrogramas que preceden al complejo QRS. La mayoría de los circuitos reentrantes (70%) se identificaron en el endocardio y los restantes en el epicardio; su evolución a largo plazo se desconoce26,27. Las cicatrices se localizan en las paredes ínfero-lateral, septo-apical e ínfero-apical del ventrículo izquierdo y se asocian con denervación autonómica. Las taquicardias ventriculares inestables pueden responder a la modificación del sustrato y su tasa elevada de recurrencias puede deberse a circuitos epicárdicos o intramiocárdicos25,28. Hemos encontrado una incidencia considerable de electrogramas anormales en pacientes chagásicos. El infarto agudo de miocardio provoca denervación simpática regional por degeneración walleriana seguida por Electrofisiología y Arritmias, Vol 4, N° 2 / Abril - junio 2011 Modulación del sustrato de muerte súbita mediante la ablación lineal para el control de arritmias ventriculares graves: simplificando la técnica para reducir los riesgos y complicaciones un proceso regenerativo que conduce a una hiperinervación simpática regional; existe una relación estrecha entre ésta y la aparición de arritmias ventriculares. Los nervios simpáticos, que son posganglionares, se distribuyen fundamentalmente sobre el epicardio y penetran en el miocardio siguiendo los vasos coronarios paralelos al eje mayor de los miocitos. Casi no existen terminaciones nerviosas parasimpáticas en el epicardio pero éstas son predominantes (70%) en el sistema de conducción y corresponden a fibras preganglionares33,34. La hiperinervación simpática posinfarto de miocardio (remodelado neuronal) ocurre entre los 3 y los 12 meses del cuadro agudo35. Se ha demostrado que la distribución de las fibras simpáticas en el miocardio ventricular humano con cardiopatía isquémica e idiopática es heterogénea en la periferia de zona de necrosis o perivasculares y no lo es en el centro de las zonas necróticas34. La hiperinervación ocurre en el miocardio superviviente que rodea a las zonas necróticas, donde se originan las taquicardias ventriculares y donde estos miocitos se entremezclan con abundantes fibras (hiperinervación) simpáticas34, con mayor actividad adrenérgica regional y abreviación de los períodos refractarios locales (heterogeneidad electrofisiológica). El miocardio con remodelado “electrofisiológico” constituiría el sustrato de la taquicardia ventricular y la muerte súbita, pero el remodelado neuronal por hiperinervación regional simpática sería el factor modulador. Ello explicaría la eficacia de los bloqueantes β adrenérgicos en la prevención de la muerte súbita. El borde que separa las células supervivientes se conoce como “zona limítrofe epicárdica” y se demostró que allí tienen lugar con frecuencia la taquicardia ventricular y la fibrilación ventricular, probablemente por reducción de las corrientes de entrada de calcio-L y de sodio rápida (INa)36. Se ha demostrado que la sección del ganglio estrellado izquierdo es eficaz para la prevención de la muerte súbita luego del infarto agudo de miocardio y en pacientes con anomalías adquiridas de los canales de K+33. Es probable que la técnica de modulación/ablación lineal descripta en este artículo actúe sobre las fibras simpáticas y que no sólo modifique el remodelado “eléctrico” sino también el remodelado autonómico. Conclusiones 1. La modulación/ablación del sustrato guiada por una correcta caracterización de los electrogramas es una técnica rápida, segura y con una tasa de éxito en apariencia considerable. 2. La exploración cartográfica del sustrato reveló que los electrogramas están distribuidos en tres dimensiones, lo cual corresponde a un comportamiento de dinámica no lineal bi y tridimensional. 3. Se observaron electrogramas de actividad continua durante el ritmo sinusal en pacientes con más de una taquicardia ventricular y fibrilación ventricular. 4. El buen resultado clínico sin desaparición de los electrogramas puede deberse a aislamiento del sustrato y a modulación/ablación de terminaciones simpáticas. Es menester tener en cuenta el siguiente axioma general: “Ningún componente del sustrato debe considerarse benigno porque corresponde a una patología maligna (arritmia ventricular grave) o potencialmente maligna (componentes dinámicos o funcionales de futuros circuitos para TV o FV) y, por lo tanto, son objetivos para la ablación”. Bibliografía 1. Hsia H, Marchlinski FE. Characterization of the electroanatomic substrate for monomorphic tachycardia in patients with non-ischemic cardiomyopathy. Pacing Clin Electrophysiol 2002; 25: 1114-27 2. Soefima K, Stevenson WG, Sapp JL et al. Endocardial an epicardial radiofrecuency ablation of ventricular tachycardia associated with dilated cardiomyopathy: the importance of low-voltage scars. J Am Coll Cardiol 2004;43:1834-42 3. Bausch D, Oyang F, Antz M et al. Successful catheter ablation of electrical storm after myocardial infarction. Circulation 2003;108:3011-3016 4. Aliot E, Stevenson WG, Almendral-Garrote J et al.: EHRA/HRS Expert Consensus on Catheter Ablation of Ventricular Arrhytmias. Heart Rhythm, vol 6, N°6, June 2009 5. Stevenson WG, Khan H, Sager P et al: Identification of reentry circuit sites during catheter mapping and radiofrequency ablation of ventricular Figura 8. Actividad eléctrica diastólica continua. Electrofisiología y Arritmias, Vol 4, N° 2 / Abril - junio 2011 43 Pablo Tauber y col. Figura 9. tachycardia late after myocardial infarction. Circulation 1993;88(Pt 1): 1647-70. 6. Kleber AG, Rudy Y. Basic mechanisms of cardiac impulse propagation and associated arrhythmias. Physiol Rev 2004;84:431-88 7. Tranum-Jensen J, Wilde AAM, Vermeulen JT et al: Morphology of electrophysiologically identified functions between Purkinje fibers and ventricular muscle in rabbit and pig hearts. Circ Res 1991;69:429-437 8. Myerburg RJ, Stewart JW, Hoffman BF. Electrophysiological properties of the canine peripheral A-V conducting system. Circ Res 1970;26:361378 9. Bogun F, Good E, Reich S et al: Role of Purkinje fibers in post-infarction ventricular tachycardia. J Am Coll Cardiol 2006; 48:2500-2507 10. Sinha A M, Schmidt M, Marschang H et al: Role of left ventricular scar and Purkinje-Like potentials during mapping and ablation of ventricular fibrillation in dilated cardiomyopathy. Pacing Clin Electrophysiol 2009;32:286-290 11. Laurita K R, Rosenbaum D S. Interdependence of modulated dispersion and tissue structure in the mechanism of unidirectional block. Circ Res 2000;87:922-928 12. Choi B R, Nho W, Liu T, Salama G. Life span of ventricular fibrillation frecuencies.Circ Res 2002;91:339-345 13. Valderrabano M, Yang J Z, Omidi C et al: Frecuency análisis of ventricular fibrillation in swine ventricles. Circ Res 2002;90:213-222 14. Garfinkel A, Chen P S, Walter D O et al : Quasi-periodicity and chaos in cardiac fibrillation. J Clin Invest 1997; 99:305-314 15. Rogers J M, Huang J, Melnick S B et al: sustained reentry in the left ventricle of fibrillating pig hearts. Cir Res 2003; 292:539-545 16. Zaitsev AV, Sarmast F, Kolli A et al: Wave break formation during ventricular fibrillation in the isolated regionally ischemic pig heart. Circ Res 2003; 92:546-553 17. Wyse DG, Friedman PL, Brodsky MA et al: Life threatening ventricular arrhythmias due to transient or correctable caused. High risk for death in follow-up. J Am Coll Cardiol 2001; 38:1718-1724 18. Szumowski L, Prashanthan S, Franciszek W et al: Mapping and ablation of polymorphic ventricular tachycardia after myocardial infarction. J Am Coll Cardiol 2004; 44:1700-1706 19. Morady F, Harvey M, Kalbfleisch S et al: Radiofrequency catheter ablation of ventricular tachycardia in patients with coronary artery disease. Circulation 1993; 87: 363. 20. Callans D J, Zado E, Sarter B H et al: Efficacy of radiofrecuency catheter ablation for ventricular tachycardia in healed myocardial infarction. Am J Cardiol 1998; 82: 429 21. de Chillon C, Lacroix D, Klug D et al: Isthmus characteristic of reentrant ventricular tachycardia after myocardial infarction. Circulation 2002; 105:726 22. Callans D J Ablation of ventricular tachycardia in coronary artery disease. In Catheter Ablation of Cardiac Arrythmias. SAUNDERS. Textbook.2006 Cap.27 23. Arenal A, del Castillo S, Gonzalez-Torrecilla E et al: Tachycardiarelated channel in the scar tissue in patients with sustained monomorphic ventricular tachycardias: Influence of the voltage scar definition.. Circulation 2005;106:962 24. Haissaguerre M, Shoda M, Jais P et al: Mapping and ablation of idio- 44 pathic ventricular fibrillation. Circulation 2005;106: 962 25. Marchlinski FE, Callans DJ, Gottleb CD et al: Linear lesions for control of unmappable ventricular tachycardia in patients with ischemic and no-ischemic cardiomyopathy. Circulation 2000;101:1288-1296 26. Tavora MZ, Mehta N, Silva RM et al: Characteristic and identification of site chagasic ventricular tachycardia by endocardial mapping. Arq Bras Cardiol 1999; 72:451-474 27. Sosa E, Scanavacca M, D’Avila A et al: Endocardial and epicardial ablation guided by nonsurgical transthoracic epicardial mapping to treat recurrent ventricular tachycardia. J Cardiovascular Electrophysiol. 1998; 9:229-239 28. Qu Z, Weiss JN, Garfinkel A: Origins of spiral wave meander and breakup in a two-dimensional cardiac tissue model. Ann Biome.Eng.2000; 28: 755-771 29. Garfinkel A, Chen PS, Walter DO et al: Quasi periodicity and chaos in cardiac fibrillation. J Clin. Invest.. 1997; 99:305-314 30. Kirn YH, Garfinkel A, Ikeda T et al: Spatiotemporal complexity of ventricular fibrillation revealed by tissue mass reduction in isolated swine right ventricle. Further evidence for the quasi periodic route to chaos hypothesis. J Clin. Invest. 1997;100: 2486-2500 31. Zaitsev AV, Berenfeld O, Mironov SF et al: Distribution of excitation frecuencies on the epicardial and andocadrdial surface of fibrillating ventricular wall of the sheep heart. Circ. Res. 2000; 86:408-417 32. Weiss J, Qu Z, Chen P S et al: The dynamics of the cardiac fibrillation. Circulation 2005;112:1232-1240 33. Chen P S, Chen L S, Cao JM et al : Sympathetic nerve sprouting electrical remodeling and the mechanisms of sudden death. Cardiovasc. Res. 2001; 50:409-416 34. Cao JM, Fishbein MC, Han JB et al : Realtionship betwen regional cardiac hyperinnervation and ventricular arrhytmia. Circulation 2000; 101:1960-1969 35. Hartikainen J, Mustonen J, Kuikka J et al: Cardiac sympathetic denervation in patients with coronary artery disease without previous myocardial infarction. Am J Cardiol.1997;80:273-277 36. Pu J, Boyden PA: Alterations of NA+ currents in myocytes from epicardial border zone of the infarcted heart. A possible ionic mechanism for reduced excitability and postrepolarization refractoriness. Circ. Res. 1997; 81:110-119 37. Xie F, Qu Z, Weiss JN, Garfinkel A: Coexistence of multiple spiral waves with indepedent frequencies in a heterogeneous excitable medium. Phys Rev E 2001; 63:031905. 38. Starbin JM, Starmer CE: common mechanism links spiral wavefront-obstacle separation. Phys Rev E 1997; 55: 1193-1196. 39. Buxton A E, Lee K, Fisher J et al: Multicenter Unsustained Tachycardia Trial (MUSTT). N Engl J Med. 1999; 341: 1882-90. Electrofisiología y Arritmias, Vol 4, N° 2 / Abril - junio 2011