Boletín Analítica nº1
Anuncio

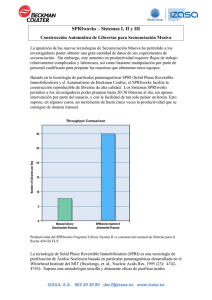
Izasa Analítica Nº1 marzo 2014 EN 3 ( )*+,)./0!$" 12 Dr. Xavier Llovet. Responsable de la Unidad de Microsonda de CCiTUB Los CCiTUB son un conjunto de infraes !"#$ %& f ' 6 5 %& & sistemas automatizados de muestreo 3 4 3 ( 5 & 6 f ' 5 7 3 3 3 4 K 4 3 3 3 * 9 4 ' 4 3MN '3 ' f ' !" #$%&' (% ) * % + ,,% %)-, ./ 0 -1 %% % 23( 4(&56% 6 78.)9 ':%0) % ;"< >5%!?""*@'A ' , 9 9 dad humana desde hace D5 34 / 9 #""""##""" D 9 5'9 9 ?"""D f ' E+9 4 F 3 3 2// 4 :93 9 G:G5 58%/H1 G5IJ!"#"1,=/(% f ' =85! 89 3 : ;"< 43 f ' ESTE NÚMERO ( & D H(2O+ * (2O+ 2O9 % & D & &' : f ' Si desea información sobre algunos de estos productos, rellene el FORMULARIO ADJUNTO Para más información contacte con Atención al Cliente Tel.: 902 20 30 80 dac2@izasa.es izasa.es @izasaGIC COLABORACIÓN Nueva microsonda electrónica JEOL JXA-8230 en los Centros Científico y Tecnológicos de la Universidad de Barcelona Dr. Xavier Llovet Responsable de la Unidad Microsonda Electrónica Centros Científicos y Tecnológicos Universidad de Barcelona La microsonda electrónica es un instrumento que permite realizar análisis químico cuantitativo de volúmenes microscópicos de materiales sólidos. Para ello utiliza un haz de electrones monoenergético, con una energía bien definida, que se focaliza en un punto de la superficie de la muestra, y como resultado de la interacción de los electrones incidentes con los átomos del material se produce la emisión de rayos X. El espectro de rayos X emitido por el material se registra mediante uno o varios espectrómetros dispersivos en longitud de onda (wavelength-dispersive spectrometer, WDS). A partir del análisis de los rayos X característicos de cada elemento se puede determinar la composición química de la región de la muestra en donde ha impactado el haz de electrones. La resolución lateral de la técnica es del orden de 1 micra. La microsonda electrónica es un instrumento semejante al microscopio electrónico de barrido, si bien éste último está diseñado especialmente para la obtención de imágenes electrónicas y, en cambio, la microsonda electrónica está optimizada para la obtención de análisis químicos precisos. Así, mediante el análisis de las longitudes de onda de los rayos X característicos emitidos por la muestra podemos identificar cuáles son los elementos que componen la muestra (análisis cualitativo). Una vez identificados estos elementos, las intensidades de los rayos X (alturas de las líneas en el espectro) nos permiten obtener las concentraciones relativas de dichos elementos (análisis cuantitativo). En general, los métodos de cuantificación requieren el uso de patrones de referencia de composición conocida. La microsonda electrónica y las bases del análisis cuantitativo fueron desarrollados a principios de los años 50 por el científico francés Raimon Castaing y el primer equipo comercial fue puesto al mercado en 1958. Desde entonces hasta la actualidad, se han producido numerosos avances y mejoras tanto por lo que refiere a instrumentación (columna electrónica, espectrómetros, cristales analizadores) como a métodos de cuantificación. Estos avances han logrado mejorar significativamente las microsondas electrónicas en términos de reproducibilidad, resolución espacial y límites de detección. En la actualidad diversos fabricantes ofrecen equipos de microsonda electrónica entre los que destaca la firma japonesa JEOL. Los Centros Científicos y Tecnológicos de la Universidad de Barcelona (CCiTUB) son un conjunto de infraestructuras marzo-14 científico-técnicas cuya principal misión es dar soporte a la investigación, desarrollo y innovación en diversos campos entre los que destaca la Ciencia y Tecnología de Materiales. Para realizar esta tarea, los CCiTUB ponen a disposición de la comunidad científica e industrial, instrumentación científica de última generación y ofrecen asesoramiento en las diversas tecnologías instrumentales. Desde mediados de 2013, los CCiTUB disponen de un nuevo equipo de microsonda electrónica. Se trata de un modelo JEOL JXA-8230 (ver Figura 1) equipado con cinco espectrómetros WDS y una amplia variedad de cristales monocromadores que permiten analizar todos los elementos químicos desde el Boro (B) hasta el Uranio (U), estando especialmente diseñada para la detección de elementos ligeros (B, C, N, O y F). La composición del material se determina con una precisión relativa del 1-3% y con unos límites de detección del orden de 20 ppm. El equipo dispone también de un espectrómetro dispersivo en energía con tecnología SSD (silicon-drift detector) y varios accesorios de última generación como un sistema de “plasma cleaner” (EVACTRON) incorporado en la precámara que permite limpiar la superficie de la muestra a analizar. El instrumento está completamente controlado por ordenador lo que permite realizar todos los análisis en modo automatizado. Figura 1. Microsonda electrónica JEOL JXA-8230 de los Centros Científicos y Tecnológicos de la Universidad de Barcelona Boletín IZASA Analítica La microsonda electrónica se utiliza habitualmente para el análisis de materiales de interés tecnológico y industrial como metales, aleaciones, aceros, cerámicos, vidrios, materiales compuestos, materiales avanzados, minerales y rocas, semiconductores, etc. Así, uno de los usos más habituales de la técnica es la caracterización de las diferentes fases presentes en éste tipo de materiales. Como ejemplo ilustrativo, podemos citar la caracterización de precipitados y fases secundarias que se forman en aceros inoxidables y otros aceros especiales como consecuencia de tratamientos térmicos específicos y que pueden producir fuertes modificaciones de las propiedades del material en servicio. Ligeras correcciones de composición química pueden dar lugar a la formación de nuevas fases, o a la modificación de los intervalos de estabilidad de las ya existentes. Otro de los usos importantes de la microsonda electrónica es para el estudio de fenómenos de zonación, intercrecimiento y difusión, por ejemplo, para el análisis de superfícies carburizadas o nitruradas, o fenómenos de corrosión u oxidación. En estos casos, es habitual realizar perfiles en línea para determinar la variación de la concentración de un determinado elemento a lo largo de una dirección. La microsonda electrónica nos permite también realizar mapas bidimensionales de composición en los que podemos estudiar como varía la concentración de un cierto elemento en la zona de interés. Como ejemplo la Figura 2 nos muestra los mapas de distribución de Al, Ca, Na, Si y Zr en un material refractario (magmalox) utilizado para la fabricación de hornos de laminación en acerías. Estos mapas nos ayudan a entender cómo se distribuyen las diversas fases que forman este material: corindón (Al2O3), mullita (Al6Si2O13), vidrio y zirconia (ZrO2). Finalmente, mediante el análisis a diferentes voltajes de aceleración es posible determinar el grosor y la composición de capas delgadas depositadas en sustratos y multicapas con grosores que van desde pocos nanómetros hasta centenares de nanómetros. Como ejemplos concretos de aplicaciones de la microsonda electrónica de interés tecnológico y industrial podemos citar los siguientes: Caracterización de fases microestructurales y precipitados (a escala micro) presentes en aleaciones, metales, aceros, cerámicas, vidrios, materiales avanzados, etc.. para aplicaciones de control de calidad o desarrollo de nuevos materiales. Caracterización de fases metálicas y carburos presentes en recubrimientos obtenidos por proyección térmica. Análisis de composición y grosor de capas delgadas y multicapas. Caracterización de materiales cristalinos láser y y no-lineales para aplicaciones fotónicas.Análisis de materiales para aplicaciones fotovoltaicas y baterías recargables (Li, Na,etc..)Estudio de envejecimiento de aleaciones metálicas y análisis de fallos (cambios anticipados de la microestructura de un material).Control de calidad de vidrios y soldaduras. Análisis de cementos para entender su comportamiento a largo plazo. Estudios de difusión elemental en profundidad en recubrimientos metálicos Estudio de minerales indicadores para exploración minera (kimberlitas, oro, etc..) Estudio de la distribución de las fases sulfuradas en carbones, su aplicación en su eliminación en los productos combustibles de centrales térmicas, control de calidad en los filtros de las turbinas de estas centrales. Estudio de la distribución metálica en aerosoles naturales, materia particulada, suelos y sedimentos contaminados, áreas contaminadas por actividad industrial y minera. Conclusión En conclusión, los CCiTUB disponen de una nueva microsonda electrónica JEOL JXA-8230, un instrumento versátil que permite el microanálisis químico y preciso de un gran variedad de materiales de interés tecnológico y industrial, con aplicaciones que van desde el control de calidad hasta el desarrollo y caracterización de nuevos materiales. Figura 2. Mapas de rayos X que muestra la distribución de Al, Ca, Na, Si y Zr, así como la imagen de electrones retrodispersados, en un material refractario (magmalox) utilizado para la fabricación de hornos de laminación en acerías. Para más información contacte con Atención al Cliente Tel.: 902 20 30 80 dac2@izasa.es www.izasa.es @izasaGIC Boletín IZASA Analítica marzo-14 Para más información de estos productos enviar un e-mail a dac2@izasa.es o visitar nuestra web izasa.es Freeslate, nueva representada de Izasa especializada en sistemas automatizados de muestreo de altas prestaciones para soluciones fáciles y prácticas en la Industria ExxonMobil: "Hemos encontrado en la experimentación de alto rendimiento un poderoso método para descubrir y desarrollar nuevos catalizadores para aplicaciones químicas en un plazo de tiempo mucho más corto. Nuestra expectativa es que vamos a seguir cosechando un gran valor en nuestra colaboración con Freeslate". Dentro de sus gama de productos nos vamos a centrar en la línea CM Protegeque es una familia de soluciones de automatización de Freeslate diseñadas para hacer que procesos específicos de laboratorio o aplicaciones (por ejemplo, dispensadores de muestras en polvo) sean más sencillos, más rápidos y más fiables. Hay tres modelos cuyas configuraciones se adaptan perfectamente a funciones concretas: Izasa acaba de firmar un acuerdo de colaboración comercial con Freeslate empresa norteamericana ubicada en Sunnyvale, EEUU. Freeslate ofrece productos y servicios relacionados con la investigación de alto rendimiento (High Throughput Research, HTR). Desde 1994, han automatizado la investigación en la industria farmacéutica. Sus plataformas de automatización de laboratorio, las mejores en su clase y un potente software permiten a los usuarios de Freeslate aumentos espectaculares en la productividad del desarrollo y la innovación. Su misión es "permitir y ayudar a las organizaciones de I+D de las empresas para lograr mejoras notables en la productividad y la innovación ofreciendo flujos de trabajo automatizados integrados a la investigación de alto rendimiento." Sistema CM Protege Powder Dispense Para muestras en polvo, es un sistema robusto y automatizado que proporciona un nivel inigualable de rendimiento y elimina los errores asociados al pesaje y dispensación manuales que son el cuello de botella en el laboratorio. El sistema se diseñó para un pesaje y dispensación preciso, trazable y exacto en cantidades de submiligramos a gramos en una amplia gama de materiales. Así tenemos testimonios de usuarios suyos que comentan sus experiencias con Freeslate: Dow Chemical: "Mientras que los métodos convencionales por ensayo y error son costosos y requieren mucho, un margen de cinco a diez años desde la idea hasta la comercialización, la metodología de alto rendimiento completamente integrado de Freeslate puede identificar los sistemas catalíticamente activos más prometedores ... en cuestión de horas". Eli Lilly: "Una de las fortalezas que Freeslate trae a la mesa para la colaboración es su capacidad para ayudar a pensar a través de su flujo de trabajo y diseñar un sistema que satisfaga realmente sus necesidades. Eso no es una cosa trivial que hacer". marzo-14 Para más información contacte con Atención al Cliente Tel.: 902 20 30 80 dac2@izasa.es www.izasa.es @izasaGIC Boletín IZASA Analítica Para más información de estos productos enviar un e-mail a dac2@izasa.es o visitar nuestra web izasa.es Es capaz de: Sistema CM Protege para Bio-formulación. Dispensar de forma precisa y exacta muestras en polvo con la probada tecnología propia Powdernium™. La dosificación de muestras en polvo de hasta 34 orígenes diferentes en una variedad de contenedores. Seguimiento dinámico y optimización de los parámetros de dosificación para compensar la variabilidad en las propiedades de las muestras en polvo durante el proceso de llenado. Almacenar las condiciones de dispensación optimizadas para una dosificación reproducible día tras día. Sistema CM Protege PharmD. A medida que el número de candidatos de fármacos poco solubles en agua se ha incrementado, el screening en forma sólida se ha convertido en una parte esencial del desarrollo de fármacos. Debido al gran número de parámetros que se deben estudiar para identificar la forma sólida con las mejores características físicas, químicas y biofarmacéuticas, la experimentación manual es demasiado laboriosa y consume demasiado tiempo y materiales. Este sistema de Freeslate es una plataforma automatizada para el screening enforma sólida de alto rendimiento. El sistema lleva a cabo seguimiento HTP en polimorfos, sales, y cocristales de ingredientes farmacéuticos activos (API). Los estudios de formulación y estrés acelerado son un paso esencial en el desarrollo de formulación de productos biológicos. Ambos implican la preparación de bibliotecas y el análisis de muchas muestras para evaluar la estructura de las proteínas y la estabilidad de su formulación. Tradicionalmente el contaje de partículas visibles, la turbidez, el color, la viscosidad y el pH se miden manualmente con instrumentos individuales. Este sistema de Freeslate automatiza estos ensayos y está disponible en tres configuraciones diferentes que podemos ver en la siguiente tabla: Producto Contaje de partículas visibles Evaluación del Color Sistema CM Protégé Bioformulation Assessment 200 Sistema CM Protégé Bioformulation Assessment 300 Sistema CM Protégé Bioformulation Assessment 400 Turbidez pH Viscosidad Para más información contacte con Atención al Cliente Tel.: 902 20 30 80 dac2@izasa.es www.izasa.es @izasaGIC Boletín IZASA Analítica marzo-14 Para más información de estos productos enviar un e-mail a dac2@izasa.es o visitar nuestra web izasa.es Preparacion de nanotubos de carbono para ultracentrifugación analítica mediante automatización y centrifugación de alta eficacia Única técnica efectiva para la evaluación cuantitativa de nanotubos de carbono de pared simple y doble Resumen En este artículo se hace énfasis en dos áreas que representan un desafío en el trabajo con nanopartículas: el aumento rápido y fiable de la escala de purificación de nanopartículas y el análisis cuantitativo de la concentración de especies presentes. La Estación de Trabajo Automatizada Biomek 4000 ayuda a superar la variabilidad humana y proporciona un método para la preparación de gradientes de alta productividad, consistente y reproducible que representa una ruptura con los problemas de incremento de escala. La Ultracentrifugación preparativa contribuye a mantener la consistencia entre carreras al hacerlas altamente reproducibles. La Ultracentrifugación Analítica es ideal para el estudio de nanoparticulas como nanotubos, quantum dots y grafeno ya que el volumen requerido es pequeño y la concentración precisa baja mientras que proporciona detalles estadísticamente significativos sobre la composición de las nanopartículas en solución. Introducción Se ha producido un creciente interés en los Nanotubos de Carbono de Pared Simple (Single Walled Carbon Nanotubes (SWCNT)) en los últimos 15 años para semiconductores1, pilas de combustible2 y aplicaciones biomédicas3. Todas esas áreas, se enfrentan a dos cuellos de botella principales: En primer lugar la síntesis de SWCNT genera numerosas impurezas de carbono así como la posible presencia de nanotubos de paredes múltiples (MWCNT). Adicionalmente no hay método fiable para la cuantificación del porcentaje de material distinto de los SWCNT presente4. En segundo lugar, los SWCNT son sintetizados en una heterogénea variedad de esquemas de envoltura (conocidos como quiralidades (n, m)) (Figura 1)5: quiralidades diferentes tienen propiedades ópticas y electrónicas ampliamente diferentes6,7. Hay la necesidad de una separación a gran escala posterior a la síntesis de los SWCNT para obtener una quiralidad única y homogénea, especialmente para semiconductores (donde los SWCNT metálicos reducen grandemente el ratio on/off8 y en las aplicaciones in vivo de drug delivery e imaging9,11 . Los esfuerzos iniciales para determinar impurezas de SWCNT en solución se centraron en microscopía electrónica, que carece de significación estadística, puede ser influída por la apreciación humana y difícilmente puede distinguir entre nanotubos de doble marzo-14 Figura 1. Esquema de un Nanotubo de Carbono de pared simple. pared (DWNCT) de 3 nm de diámetro y SWCNT de 1 nm. Se han estudiado también la Absorción UV-Vis, la Fluorescencia en el Infrarrojo Cercano y la Espectroscopía Raman, como soluciones al problema de las impurezas; desafortunadamente estas técnicas contienen defectos inherentes que les impiden ser una solución aceptable para el análisis cuantitativo de impurezas de SWCNT 4. Hasta la fecha, para el enriquecimiento de especies de SWCNT de una única quiralidad una de las técnicas utilizadas con más éxito ha sido la Ultracentrifugación en gradiente de densidad (Density Gradient Ultracentrifugation, ( DGU)12,13. DGU es capaz de proporcionar (6,5) SWCNT del 99% de pureza lo que es altamente deseable. Sin embargo, hay aspectos a mejorar en la escalabilidad de la técnica, relacionados con el gradiente preparado manualmente que se usa habitualmente. En este artículo, se presenta un esquema de trabajo que separa de forma rápida y reproducible (6,5) SWCNT en bruto en quiralidades únicas, confirmadas por UV-Vis. Las características clave de este flujo de trabajo son un tratamiento rápido de dos minutos con ultracentrífuga (Optima MAX-XP, Beckman Coulter, Inc.) para una purificación inicial de SWCNT que elimina grandes agregados seguido de un gradiente de densidad preparado mediante un manipulador de líquidos automatizado (Biomek 4000, Beckman Coulter, Inc) y el uso de una Ultracentrífuga Preparativa Optima X para purificar SWCNT y DWCNT mediante el uso de gradientes de densidad. El uso de la automatización permite una mejor reproducibilidad y precisión en la preparación del gradiente que la que Boletín IZASA Analítica Para más información de estos productos enviar un e-mail a dac2@izasa.es o visitar nuestra web .izasa.es se puede conseguir haciéndolo a mano. Este nivel de precisión es muy relevante para la separación de SWCNT, donde los escalones de densidad difieren únicamente en +/- 1% g/ml. Una mano trémula puede perturbar con facilidad el gradiente mientras que la automatización no se ve afectada por esa variable. En la segunda parte de este artículo, resaltaremos como la Ultracentrifugación Analítica puede distinguir cuantitativamente entre SWCNT y DWCNT. La Ultracentrifugación Analítica (AUC) ha sido usada tradicionalmente en análisis de proteínas, pero AUC tiene capacidades muy adecuadas para caracterizar nanopartículas. AUC mediante la determinación de coeficientes de sedimentación y difusión y el ratio friccional de nanopartículas en solventes de distintas densidades, puede completar los huecos del análisis de nanomateriales que dejan otras técnicas tales como la microscopía electrónica y la espectroscopía óptica14,15. Procedimientos Experimentales Preparación del Gradiente El Gradiente de Densidad se preparó con la Estación de Trabajo Biomek 4000, mediante el uso de una herramienta de pipeteo de una punta P-1000SL y puntas P1000 de gran diámetro. El método tiene flexibilidad para cambiar volúmenes para cada gradiente así como el número de tubos que se han de preparar. Se usa una gradilla de 24 posiciones de 14 mm de diámetro para sostener los tubos de centrífuga (Beckman Coulter P/N 331372) que se incorporaron a la programación como nuevo labware. Para reducir el efecto de mezclado de los gradientes se usó una técnica de pipeteo lenta. El gradiente se depositó por capas tal como se muestra en la tabla 1. Capa en el Gradiente Densidad (g/mL) 1 1,160 30 900 0,75 0,175 2 1,147 27,5 756 0,75 0,175 3 1,133 25 972 0,75 0,175 % OP Volumen mL SC (%w/v) SDS (% w/v) Figura 2. Distribución del espacio de trabajo de la Estación de Trabajo Biomek 4000 donde se muestran las herramientas básicas que se requieren para la Preparación de Gradientes. (1) Una gradilla de tubos para colocar los nanotubos de 24 posiciones: los tubos de centrífuga encajan en la gradilla de tubos de 24 posiciones, pero se ha de crear un nuevo tipo de labware para ajustar la altura de los tubos; (2) Una caja de puntas P1000 para puntas P1000 Gran diámetro; (3) Una Herramienta de Pipeteo de Una Sola Punta para transferencia de líquido Biomek 4000 P1000SL (4) un Reservorio Modular para reactivos de gradientes. perturbación de los agregados precipitados, y se usaron para la carrera en gradiente de densidad. Se insertaron 1,8 mL de disolución de SWCNT igualada a una densidad de 1,13 g/mL (25% OP) usando 2% SC+OP entre capas de 27,5% y 25% de OptiPrep (Sigma Aldrich) en tubos previamente llenos de gradiente. Los tubos de centrífuga se llenaron y equilibraron hasta 2-3 mm del límite superior mediante el uso de agua desionizada con la misma relación de surfactante que Optiprep. Se centrifugaron en una Optima XPN usando un rotor SW 41, a 41000 rpm (288.000 xg) durante 32 horas a 22 ºC aplicando la aceleración y deceleración mínimas (Perfil 9). Después de la centrifugación, se extrajeron los 2 mL superiores usando una jeringa, con la precaución de no perturbar las bandas inferiores. Se tomaron alícuotas de #",6 &;5( Dispersión de Nanotubos de Carbono de Doble Pared Se sometieron a sonicación 20 mg en agua desionizada 4 1,120 22,5 1,188 0,75 0,175 con 2% de SC en un baño de ultrasonidos Branson M1800H 5 1,107 20 1,188 0,75 0,175 durante una hora en un vial de vidrio de 20 mL. La solución se centrifugó en un rotor TLA 120.2 en una ultracentrífuga 6 1,093 17,5 1,305 0,75 0,175 Optima MAX-XP a 22 ºC, 30000 xg durante 2 minutos SWCNT 1,133 25 1,800 2 0 y se usaron tubos abiertos de policarbonato (Beckman Coulter P/N 343778) para eliminar cualquier gran agregado Tabla 1. Arquitectura del Gradiente de Densidad en la presente. A fin de fraccionar la preparación de DWCNT por Separación de especies de una única quiralidad longitud se preparó manualmente un gradiente de densidad en tubos de polialómero (Beckman Coulter P/N 331372) 16 tal como se muestra en la Tabla2. Se depositaron 1,5 mL Preparación de Nanotubos de pared única (SWCNT) Se sometieron a sonicación 20 mg de una solución de de la solución de DWCNT sobre el gradiente. Se llenaron SWCNT en Colato de Sodio (SC) en agua desionizada (DI) y equilibraron hasta 2-3 mm de la parte superior del tubo en un baño de ultrasonidos Branson M1800H durante una usando agua desionizada con 2% SC. Se procesaron en un rotor SW 41Ti en una Optima XPN en un programa de dos hora en un vial de vidrio de 20 mL. La solución de SWCNT se centrifugó en un rotor TLA 120.2 etapas, primera carrera a 15000 rpm (38500 x g) durante en una ultracentrífuga Optima MAX-XP, se usaron tubos una hora, seguida por una segunda carrera a 30500 rpm abiertos de policarbonato (Beckman Coulter P/N343778) a (159,500 xg) durante una hora a 22 ºC con perfiles de 22 ºC, 55.000 rpm (131.000 xg) durante dos minutos para aceleración y deceleración máximos (Perfil 0). Después de hacer caer cualquier gran agregado presente. Se tomaron 4 4 ;"", ##"", 3 4 la parte superior a la base y se unieron las fracciones 4-6 (Figura 6). Boletín IZASA Analítica marzo-14 Para más información de estos productos enviar un e-mail a dac2@izasa.es o visitar nuestra web .izasa.es Capa en el Gradiente Densidad (g/ mL) % OP Volumen mL SC (%w/v) 1 1,320 60 1,500 2 2 1,160 30 1,500 2 3 1,133 25 1,500 2 4 1,107 20 1,500 2 5 1,080 15 1,500 2 6 1,053 10 1,500 2 DWCNT 1,000 0 1,500 2 Tabla 2. Arquitectura del Gradiente de Densidad en la Separación de especies de doble pared Análisis de Fracciones Se obtuvo la representación de la absorción UV-Vis-NIR (Paradigm, Molecular Devices) entre 400 y 1000 nm de cada fracción de SWCNT. Se juntaron las fracciones con los mayores picos de absorción a 570 y 990 nm y mínimos de absorción a otras longitudes de onda. Diálisis Después del fraccionamiento, las quiralidades de SWCNT separadas individualmente (6,5) se dializaron con membranas de celulosa de 3,5 kDa MWCO contra 1%SC para eliminar iodixanol y SDS de la solución SWCNT y para reestablecer el envoltorio de surfactante de los SWCNT. Se hicieron ocho cambios de agua con al menos cuatro horas entre cambios. Después de la diélisis, el resultado de la dispersión se concentró usando un Ultra Centrifuge Filter Amicon (Millipore) en una microcentrífuga Microfuge 20 (Beckman Coulter Inc). Se usó el mismo procedimiento con las fracciones reunidas de la solución de DWCNT fraccionada por longitud. Se compararon los coeficientes de sedimentación de SWCNT y DWCNT; también se comprobó la capacidad de la ultracentrifugación analítica para distinguir ambas especies en solución. Análisis de la Distribución de Tamaños vía Dynamic Ligth Scattering Se analizó una pequeña muestra de la muestra de DWCNT fraccionada por longitud y de SWCNT de quiralidad enriquecida (6,5) en un instrumento DelsaMax CORE Dynamic Light Scattering/ Static Ligth Scattering (Beckman Coulter, Inc). Se colocaron 10 mL en la cubeta de cuarzo y procesada a 25 ºC con 10 adquisiciones, con cinco segundos/ adquisición. Las curvas representativas se generaron por análisis de las carreras en modo de Regularización (Multimodal). PASO 1 Se compran SWCNT y DWCNT en polvo (Sigma), se disuelve en el surfactante adecuado y se somete a sonicación para obtener una solución bien dispersada. PASO 2 Ultracentrifugación (Optima MAX-XP) para eliminar agregados de las soluciones de SWCNT y DWCNT. PASO 3 Estación de Trabajo para Biomek 4000 para preparar gradientes de iodixanol para carreras en gradiente de densidad de SWCNT. PASO 4 Determinación del Rango de Sedimentación Se procesaron soluciones de SWCNT y DWCNT en una Ultracentrífuga Analítica ProteomeLab XLA (Beckman Coulter, Inc.). (Se cargaron SWNCT de quiralidad enriquecida (6,5), con una absorción de D.O. 0,85 a 570 nm en una cubeta EPON rellena de carbón activo con ventanas de cuarzo. Se usó como referencia agua desionizada con 1% SC (tomada del último cambio de ' * 4 $" , 4 4 $0" , + 3 con las mismas especificaciones se cargó con DWCNT fraccionados por longitud con una D.O. de 0,85 a 570 nm. Una tercera cubeta se cargó con una dispersión 50%/50% SWCNT/DWCNT por absorción a 570 nm. Las condiciones iniciales de carrera fueron 4 h a 27000 rpm@22ºC. (17). Se repitió el experimento con D.O. de 0.6 a 570 nm para comprobar efectos dependientes de la concentración. Análisis de Sedimentación Se hizo el análisis en SEDFIT, ajustando los modelos de acuerdo a la ecuación de Lamm considerando que la difusión debería proporcionar el mejor ajuste para los datos. (17). marzo-14 Ultracentrífuga (Optima XPN) para carrera en gradiente de densidad para aislar quiralidades específicas de SWCNT. PASO 5 Espectro de Absorción para identificar la pureza de cada fracción de SWCNT (Paradigm Molecular Devices). PASO 6 Microcentrífuga (Microfuge20) y filtro centrífugo 10kDa MWCO (Millipore) para concentrar las soluciones de SWCNT y DWCNT. PASO 7 DelsaMax PRO para determinación del tamaño de SWCNT y DWCNT. PASO 8 Para más información Atención al Cliente AUC para diferenciar contacte especies decon SWCNT y DWCNT Tel.: 902 20 30 80 dac2@izasa.es www.izasa.es @izasaGIC Boletín IZASA Analítica Para más información de estos productos enviar un e-mail a dac2@izasa.es o visitar nuestra web izasa.es Manual Figura 3. Método para Gradiente de Nanotubos. Una nueva técnica de transferencia se creó para reducir al mínimo la mezcla durante la preparación del gradiente B4K Figura 4. Preparación de un gradiente de prueba de iodixanol con colorantes alimentarios para mostrar las diferencias en la formación de capas en cada gradiente y comparación del manual frente al generado con la Estación de trabajo Biomek 4000. Resultados El éxito de la separación de SWCNT por DGU se visualiza fácilmente en la Figura 5. Antes de la ultracentrifugación (Figura 5a), los SWCNT se perciben como una solución negra debido a la mezcla de quiralidades que tienen picos de absorción a lo largo de todo el intervalo Visible. Después de la ultracentrifugación, las quiralidades individuales emerge como bandas coloreadas (Figura 5b); las parte superior, la banda púrpura contiene (6,5) los SWCNT que se recogen para análisis en AUC. Los SWCNT presentan picos de absorción con la singularidad de Van Hoff en el espectro infrarrojo cercano y Visible; para (6,5) SWCNT recubiertos con SC, los picos aparecen, en teoría a 570 nm-580 nm y 980- 990 nm (16). La representación de la absorción de la Figura 7 se tomó después de diálisis y concentración de la (6,5) SWCNT en solución de SC al 1%. Los intensos picos intensos a 571 nm y 990 nm así como la falta de picos intensos de absorción a otras longitudes de onda, señalan la pureza de las quiralidades enriquecidas (6,5) SWCNT. DWCNT se fraccionan por longitud siguiendo un procedimiento similar a los SWCNT. (18). Before After Figura 5. Separación de (6,5) SWCNT basada en la quiralidad. Fotos de tubo de centrífuga con SWCNT antes (5a) y después (5b) de la Ultracentrifugación en Gradiente de Densidad. Se recogieron fracciones de 0,2 mL de la región de color púrpura (indicada con la flecha) y se sometieron a a análisis de absorción y mezcladas basándose en el pico de absorbancia a 575 nm. La fracción superior que se indica en la Figura 6b, debería contener mayormente DWCNT desagregados; los datos de dispersión de luz dinámica (Figura 8) confirman que los DWCNT tienen una longitud promedio próximo a 200 nm 3' 4 4 !##"-8 cm2/s. Los datos de dispersión de luz dinámica tomados en el DelsaMax CORE, también resalta la dificultad de discernir entre los nanotubos de pared simple y doble (Figura 8). Mientras DWCNT y SWCNT tienen propiedades ópticas diferentes, incluyendo absorción (figura7) y fluorescencia (19), los parámetros físicos y la densidad son muy similares: ambos tienen longitudes entre 100 y 1000 nm y diámetros muy próximos (alrededor de 1 nm para SWCNT, entre 2 y 3,5 nm para DWCNT(19)). Esto dificulta que técnicas que evalúan el conjunto como la dispersión de luz sean capaces de diferenciar las dos especies. Igualmente, incluso la microscopía electrónica tiene dificultades para Boletín IZASA Analítica Figura 6. Separación por longitud de DWCNT. Imagen óptica de tubo de centrífuga con DWCNT, antes de la Ultracentrifugación en Gradiente de Densidad (6a) y después (6b). Se obtuvieron alícuotas de 0,6 mL y se tomaron las fracciones 4-6 para análisis ulterior. La posición aproximada de las fracciones 4-6 se muestra con un corchete }. marzo-14 Para más información de estos productos enviar un e-mail a dac2@izasa.es o visitar nuestra web izasa.es distinguir entre SWCNT Y DWCNT de forma fiable cuando la diferencia de alturas de la sensibilidad es pequeña, a la vez que el contaje de unos centenares de nanotubos no es representativo de una solución que puede llegar a contener 1018 partículas. La Ultracentrifugación Analítica es capaz de distinguir fácilmente entre SWCNT y DWCNT (Figura 9c). Los DWCNT sedimentan con mucha rapidez durante la ultracentrifugación en tampón SC, debido a un pobre revestimiento con el surfactante, con un coeficiente de sedimentación promedio de 80.4 +/-25.6S (Figuras 9b, 10b). En cambio, los SWCNT sedimentan lentamente, como se había reportado anteriormente en la literatura, (17,20) con un coeficiente de sedimentación promedio de 11.3 S (Figuras 9a, 10a). Para demostrar verdaderamente la potencia de la AUC, se preparó una mezcla de SWCNT y DWCNT. Ambas soluciones presentan absorciones "0? + " & # , solución y se procesaron en la AUC (Figura 9c). Si observamos (6,5) SWCNT puros, se muestra que hay muy pocas partículas que tengan coeficientes de sedimentación mayores de 30S (Figura 10a), mientras que los DWCNT fraccionados por longitud contienen muy pocas partículas que tengan coeficientes de sedimentación menores de 30S. Si usamos el valor 30S como valor de corte e integración de las representaciones de distribución del coeficiente de sedimentación (Figura 10c), considerándolo cuantitativamente, se muestra por absorción que la solución contiene el 50,4% de SWCNT y un 49,6% DWCNT. Esta evaluación cuantitativa de SWCNT y DWCNT no se puede conseguir mediante ninguna otra técnica analítica. Se analizaron otras dos mezclas de SWCNT/ DWCNT para confirmar la capacidad cuantitativa de la AUC. Una muestra que por Absorción contenía 29% de SWCNT y 71% de DWCNT resultó tener midiéndolo por distribución del coeficiente de sedimentación un 28,3%de SWCNT y un 71,7% de DWCNT (Figura 10d). De forma similar, una solución que por absorción contiene 71,4% de SWCNT y 28,6 de DWCNT resulta tener una relación de 64,7% SWCNT /35,3% por distribución del coeficiente de sedimentación (datos no mostrados). Ambos análisis usaron 30S como cut-off entre los (6,5) SWCNT y DWCNT. Figura 7. Gráfica de Absorción de soluciones concentradas de Nanotubos de Carbono de pared doble separados por longitud (DWCNT, Curva Roja) y de (6,5) Nanotubos de carbono de pared simple (SWCNT, Curva Negra) en el recuadro se muestran imágenes de las cubetas de AUC con tampón de referencia en la cámara libre y muestra en la cámara derecha, (a) contiene solo DWCNT, (b) contiene primariamente (6,5) SWCNT indicado por los intensos picos a 570 nm y 980 nm. Diameter (nm) Figura 8 .Datos representativos de Dynamic Light Scattering en el DelsaMax CORE. Las especies de nanotubos de carbono generan los picos por encima de 1000 nm en diámetro mientras que las micelas de surfactante aparecen representadas por picos alrededor de 10 nm de diámetro. Señalar que sería imposible distinguir entre SWCNT y DWCNT basándose en dispersión de luz dinámica. Figura 9. Curvas AUC de SEDFIT (9a). Los datos primarios de absorbancia con ajuste de una solución que contiene solo (6,5) SWCNT. (9b) Datos primarios de absorbancia con ajuste a una solución que contiene solo DWCNT fraccionados por longitud. (9c) Datos primarios de absorbancia con ajuste a una solución que contiene las dos especies (6,5) SWCNT y DWCNT. marzo-14 Boletín IZASA Analítica Para más información de estos productos enviar un e-mail a dac2@izasa.es o visitar nuestra web izasa.es (a) (b) DWCNT c(S) c(S) (6,5) SWCNT Sedimentation Coefficient (S) Sedimentation Coefficient (S) (c) (d) 71/29 DWCNT+(6,5) SWCNT c(S) c(S) 50/50 DWCNT+(6,5) SWCNT Sedimentation Coefficient (S) Sedimentation Coefficient (S) Figura 10. Gráfica de la Distribución de Coeficientes de Sedimentación (10a) (6,5) SWCNT de quiralidad enriquecida. El promedio de coeficiente de sedimentación de (6,5) SWCNT es 11,3S que concuerda bien con la literatura. Subrayar que todas las partículas presentes en la solución (6,5) SWCNT tienen esencialmente un coeficiente de sedimentación inferior a 30S. (10b) DWCNT fraccionados por longitud. El coeficiente de sedimentación promedio para DWCNT fraccionados por longitud es 80.4 +/-25.6S; la gran propagación indica que algunos DWCNT pueden estar presentes como pares de inclusión. Señalar que prácticamente todas las partículas presentes en la solución de DWCNT tiene (6,5) SWCNT, ambas soluciones tienen una absorción idéntica a 570 nm y se mezclaron en cantidades equimolares, integrando la distribución de la sedimentación, el 50,4% de la señal total tiene coeficiente de sedimentación entre 5 y 30S con un valor promedio de 11.2 +/- 5,2S, mientras el 49,6% del total de la señal tiene un coeficiente de sedimentación entre 30 y 140, con un valor promedio de 70.2 +/- 21.3S. (10d) mezcla de soluciones de DWCNT y (6,5) SWCNT 71/29, ambas soluciones tienen una absorción idéntica a 570 nm y se mezclaron en una relación 71:29 DWCNT/ (6,5) SWCNT. Integrando la distribución de la sedimentación, el 28,3% del total de la señal tiene un coeficiente de sedimentación entre 2 y 30 S, con un valor promedio de 12,5 +/-3,9 S, mientras que el 71,7% de la señal total tiene un coeficiente de sedimentación entre 30 y 120 con un valor promedio de 80.0 +/- 21.0 S. Boletín IZASA Analítica marzo-14 Para más información de estos productos enviar un e-mail a dac2@izasa.es o visitar nuestra web izasa.es Referencias 1. Baughman R H, Zakhidov A A, and de Heer W A. Carbon nanotubes—the route toward applications. Science. 297.5582; 787–792: (2002). 2. Che G et al. Carbon nanotubule membranes for electrochemical energy storage and production. Nature. 393.6683; 346–349: (1998). 3. Liu Z et al. Carbon nanotubes in biology and medicine: in vitro and in vivo detection, imaging and drug delivery. Nano research. 2.2; 85–120: (2009). 4. Lopez-Lorente A I, Simonet B M and Valcárcel M. Qualitative detection and quantitative determination of single-walled carbon nanotubes in mixtures of carbon nanotubes with a portable Raman spectrometer. Analyst. 138.8; 2378–2385: (2013). 5. Saito R. Physical properties of carbon nanotubes: (1998). 6. O’Connell M J et al. Band gap fluorescence from individual single-walled carbon nanotubes. Science. 297.5581; 593–596: (2002). 7. Liu H et al. Large-scale single-chirality separation of singlewall carbon nano-tubes by simple gel chromatography. Nature Communications. 2; 309: (2011). 8. Zhang L et al. Assessment of chemically separated carbon nanotubes for nanoelectronics. Journal of the American Chemical Society. 130.8; 2686–2691: (2008). 9. Welsher K et al. A route to brightly fluorescent carbon nanotubes for near-infra-red imaging in mice. Nature nanotechnology. 4.11; 773–780: (2009). 10. Liu Z et al. Supramolecular stacking of doxorubicin on carbon nanotubes for in vivo cancer therapy. Angewandte Chemie International Edition. 48.41; 7668–7672: (2009). 11. Bhirde A A et al. Targeted killing of cancer cells in vivo and in vitro with EGF- directed carbon nanotube-based drug delivery. ACS nano. 3.2; 307–316: (2009). 12. Green A A, Duch M C and Hersam M C. Isolation of single¤ 3 3 3 ¥ Nano Research. 2.1; 69–77: (2009). 13. Komatsu N and Wang F. A comprehensive review on separation methods and techniques for single-walled carbon nanotubes. Materials. 3.7; 3818–3844: (2010). 14. Carney R P et al. Determination of nanoparticle size distribution together with density or molecular weight by 2D analytical ultracentrifugation. Nature Communications. 2; 335: (2011). 15. Falabella J B et al. Characterization of gold nanoparticles ¦ ¤9 (/ ultracentrifugation and dynamic light scattering. Langmuir. 26.15; 12740–12747: (2010). 16. Antaris A L et al. Ultra-Low Doses of Chirality Sorted (6, 5) Carbon Nano-tubes for Simultaneous Tumor Imaging and Photothermal Therapy. ACS nano. 7.4; 3644–3652: (2013). 17. Arnold M S et al. Hydrodynamic characterization of surfactant encapsulated carbon nanotubes using an analytical ultracentrifuge. ACS nano. 2.11; 2291–2300: (2008). 18. Tabakman S M et al. Optical properties of single-walled carbon nanotubes separated in a density gradient: length, bundling, and O ¥ 9 )4J99 114.46; 19569–19575: (2010). 19. Hertel T et al. Spectroscopy of single-and double-wall carbon 3 ¥ ( $##§#N (2005). 20. Fagan J A et al. Analyzing Surfactant Structures on Length and Chirality Resolved (6, 5) Single-Wall Carbon Nanotubes by Analytical Ultracentrifugation. ACS nano. 7.4; 3373–3387: (2013). Para más información contacte con Atención al Cliente Tel.: 902 20 30 80 dac2@izasa.es www.izasa.es @izasaGIC marzo-14 Boletín IZASA Analítica Para más información de estos productos enviar un e-mail a dac2@izasa.es o visitar nuestra web izasa.es Medida de plomo en placas de circuito impreso El siguiente artículo describe la medida del nivel de plomo en placas de circuito impreso de acuerdo a las nuevas directrices RoHS 2 Hasta ahora, el plomo se encontraba en niveles de aproximadamente el 60% en peso en las soldaduras empleadas en la fabricación de placas de circuito impreso para equipos eléctricos y electrónicos. Bajo la directiva RoHS (Restriction of Hazardous Substances), el uso de estos materiales de soldadura está permitido ahora solo en casos excepcionales, de modo que se está incrementando el número de productos alternativos. En esta ocasión, se llevó a cabo un ensayo para determinar la presencia de plomo en soldaduras en varias placas de circuito impreso (Figura 1) de equipos eléctricos y electrónicos empleando el espectrómetro de emisión por plasma de acoplamiento inductivo Shimadzu ICPE-9000 (Figura 2). Además de plomo, es posible determinar otros elementos de manera simultánea en una sola medida empleando el ICPE-9000, que proporciona gran cantidad de información sobre la muestra en un tiempo muy corto. La emisión de los átomos en la muestra, en el rango de longitudes de onda entre 167 nm y 800 nm, se separa en un espectrómetro a vacío y se detecta empleando un chip CCD de gran tamaño y alta resolución. Gracias al funcionamiento a vacío, no es necesario purgar el espectrómetro con gas inerte. El empleo de una mini antorcha reduce considerablemente los costes de operación debido a su bajo consumo de argón. Para un funcionamiento estable del plasma analítico es suficiente un caudal de 10 L/min. Preparación de muestra Figura 1: Placas de circuito impreso analizadas. Resultados Cabría esperar que un alto contenido en plomo se debiera a varias fuentes de contaminación, como las soldaduras. Dado que los resultados se basan en la masa total, incluyendo materiales plásticos, las fuentes de contaminación sin diluir podrían exhibir una concentración de plomo incluso mayor, haciendo el uso de estos productos más problemático en términos de RoHS 2. Esto ilustra la importancia de la clarificación de definiciones vagas, como por ejemplo “material homogéneo” para referirse a la fuente del material a analizar. La directiva define un material homogéneo de la siguiente manera: “un material de composición completamente uniforme o un material, compuesto por una combinación de Previo a la medida, es necesario realizar una preparación de muestra adecuada para convertir una muestra heterogénea como las placas de circuito impreso, en muestras líquidas homogéneas. Para conseguirlo, cada placa se muele empleando diferentes molinos, de modo que se obtiene un polvo fino. Este polvo se somete a un proceso de digestión ácida en un digestor por microondas. La muestra así preparada puede medirse directamente. Para asegurar la exactitud de los resultados, se examinaron en detalle las líneas analíticas de emisión empleadas para la evaluación, con especial atención a las posibles interferencias. Como ejemplo, los perfiles de emisión de la calibración del plomo se muestran en la figura 3. Figura 2: Espectrómetro de emisión ICPE-9000 de Shimadzu. Boletín IZASA Analítica marzo-14 Para más información de estos productos enviar un e-mail a dac2@izasa.es o visitar nuestra web izasa.es Sample Pb (g/kg) A 30.3 B 41.1 C 8.47 D 11.9 E 0.616 F 34.9 G 46.4 Tabla 1: Contenido en plomo de diferentes placas de circuito impreso. materiales, que no pueda dividirse o separarse en materiales diferentes, mediante acciones mecánicas consistentes en destornillar, cortar, aplastar, pulverizar y procedimientos abrasivos” [1]. De acuerdo con esto, ni una sola soldadura puede exceder el valor límite si se quiere mantener la distribución de un equipo eléctrico o electrónico dentro de la Unión Europea. Substancias peligrosas restringidas para equipos eléctricos y electrónicos RoHS significa Restriction of Hazardous Substances y regula el uso de ciertas substancias peligrosas en equipos eléctricos y electrónicos, concretamente plomo, mercurio, cadmio, cromo VI y dos retardantes del fuego especiales. Mientras que la primera directiva RoHS (2002/95/ EG) ha estado vigente desde el 1 de junio de 2006, su sucesora RoHS 2 (2011/65/EU)[1] se aplica desde enero de 2013. A pesar de las discusiones sobre el cambio de los límites o la inclusión de elementos adicionales, los valores originales permanecen vigentes. Por ejemplo, el valor límite para plomo permanece en 0,1% en peso. Sin embargo, se han introducido cambios en el alcance de la directiva en cuanto a los tipos de instrumentos afectados. De esta forma, los dispositivos médicos o equipos de monitorización y control quedan ahora cubiertos por la directiva. Referencias [1] DIRECTIVA 2011/65/UE DEL PARLAMENTO EUROPEO Y DEL CONSEJO de 8 de junio de 2011 sobre restricciones a la utilización de determinadas sustancias peligrosas en aparatos eléctricos y electrónicos (refundición). http://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:201 1:174:0088:0110:ES:PDF Figura 3: Perfiles de emisión de la calibración para plomo a 220,353 nm (izquierda) y una posible fuente del plomo: la soldadura empleada para la fijación de los distintos componentes electrónicos a la placa (derecha). Para más información contacte con Atención al Cliente Tel.: 902 20 30 80 dac2@izasa.es www.izasa.es @izasaGIC marzo-14 Boletín IZASA Analítica Para más información de estos productos enviar un e-mail a dac2@izasa.es o visitar nuestra web izasa.es YSI 2900. El “ no va más” en aplicaciones de lácteos La producción de leche ha sido una importante actividad humana desde hace miles de años. Se cree que las cabras fueron domesticados en Asia occidental entre hace 10.000 y 11.000 años y la evidencia de la domesticación del ganado se ha encontrado en el Sáhara oriental hace unos 9.000 años. YSI2900 da resultados precisos en menos de un minuto y puede ser configurado para medidas de hasta 6 químicas Obviamente los animales se crían para carne y leche, pero también existe considerable evidencia, a través de la asociación de la cerámica, lo que indica un origen temprano para la producción lechera, la producción de productos lácteos secundarios, tales como la mantequilla, el queso y el yogur. La evidencia se remonta ya en el sexto milenio antes de Cristo para Europa oriental y se extiende hacia el norte de Europa en el cuarto milenio antes de Cristo. Parece muy apropiado entonces que una habilidad humana tan antigua ahora se beneficie de algunas de nuestras últimas tecnologías. Tecnología de sensor de enzima inmovilizada, desarrollado por YSI y aplicado en su gama YSI 2900 de analizadores de bioquímicos, está ayudando con éxito en la industria láctea. Este método rápido (resultados en menos de 1 minuto!) y preciso para analizar productos químicos, como los constituyentes lácteos clave, está demostrando ser valiosa en muchos procedimientos derivados de lácteos diferentes. La leche condensada, por ejemplo, contiene los ingredientes cruciales sacarosa y dextrosa. La leche condensada se hace mediante la eliminación de 60 % de agua de la leche, seguida por la adición de 40-45 % de sacarosa. Este producto puede ser analizado en el analizador bioquímico YSI 2900 simplemente equilibrando una muestra con tampón, seguida por análisis simultáneo de sacarosa y dextrosa en el instrumento precalibrado y fácil de operar. intolerantes a la lactosa. Aquí la automatización ahorra tiempo, permite realizar pruebas de muestras de forma rápida, ahorrando costes de corrección del proceso. La pantalla táctil integrada en el sistema con vídeos de formación incluidos en el YSI2900 lo hace increíblemente fácil de utilizar La serie YSI 2900 de los analizadores Life Science puede configurarse para medir hasta seis químicas diferentes, con características como un muestreador automático integrado, el muestreo flexible (incluyendo una opción de placa de 96 pocillos), conectividad y un mecanismo antiobstrucción, lo que hace que cumpla lo que promete. En la producción de queso los niveles de lactato y la lactosa son cruciales, así la dureza queso está relacionada con la concentración de lactosa, porque durante el proceso de acidificación la lactosa se convierte en ácido láctico. Estos dos componentes importantes pueden ser analizados fácilmente en el YSI 2900, sin la necesidad de especialistas ni personal altamente capacitado. Del mismo modo, los niveles de lactosa pueden ser controlados fácilmente en la leche con baja lactosa fabricado para las personas Para más información contacte con Atención al Cliente Tel.: 902 20 30 80 dac2@izasa.es www.izasa.es @izasaGIC Boletín IZASA Analítica marzo-14 Para más información de estos productos enviar un e-mail a dac2@izasa.es o visitar nuestra web izasa.es Nuevo analizador de tamaño de partícula y potencial Z NanoBrook Omni El analizador de tamaño de partícula y potencial zeta incorpora todo lo necesario para una caracterización rápida y exacta de partículas en el rango nanométrico El instrumento se basa en los principios de la dispersión de luz dinámica (DLS – Dynamic Light Scattering) para la determinación de la distribución de tamaño de partícula, velocimetría Doppler o dispersión de luz electroforética (ELS – Electrophoretic Light Scattering) para medidas de potencial Z y análisis de fase de luz dispersada (PALS – Phase Analysis Light Scattering) para medidas de potencial Z en muestras con baja movilidad, bien en disolventes orgánicos o en soluciones de alta concentración salina, así como en muestras delicadas como proteínas, péptidos, anticuerpos o DNA/RNA. Tres ángulos de medida Las medidas de tamaño de partícula en coloides suelen hacerse a un ángulo de dispersión de 90º, debido a los excelentes resultados obtenidos, sin desviaciones. Para nanopartículas de muy pequeño tamaño, por debajo de 50 nm, proteínas, IgG y péptidos es posible emplear el ángulo de retrodispersión de 173º, para obtener la mejor reproducibilidad y relación señal / ruido. Finalmente, el ángulo de medida de 15º se puede seleccionar para obtener una mayor sensibilidad en la medida de tamaño de agregados. Asimismo, las medidas de potencial Z se realizan empleando el ángulo de 15º. Determinación de tamaño de partícula Se preparan suspensiones diluidas, en el rango desde 0,0001% hasta 1,0%, empleando agentes humectantes y dispersantes adecuados si es necesario. Un pequeño baño de ultrasonidos es a veces útil para la eliminación de aglomerados. Empleando el ángulo de 173º, el volumen de muestra se puede reducir hasta 50 μL, siendo posible su recuperación. Para la medida a 90º se emplean cubetas estándar de 1 cm de lado, de poliestireno o vidrio, que requieren 2 o 3 mL de muestra. También es posible emplear cubetas de vidrio de 10 μL. En el caso de tener que emplear disolventes agresivos, es posible emplear celdas cilíndricas de vidrio con tapón de Teflon. En todos los casos, solo se requieren unos minutos para alcanzar el equilibrio térmico de la cubeta con la celda de medida termostatizada en el NanoBrook Omni. Reproducibilidad Una de las ventajas más importantes de esta técnica para el usuario es la reproducibilidad de los resultados obtenidos para diferentes muestras, operadores e instrumentos. La tabla muestra los resultados obtenidos para una muestra de látex. El error estándar del diámetro efectivo es menor del 1% de la media de 10 repeticiones. Cada medida se realizó en tan solo 5 minutos, consiguiendo una excelente repetibilidad. marzo-14 Figura 1: NanoBrook Omni de Brookhaven Instruments. La tabla también muestra la reproducibilidad entre instrumentos típica en equipos Brookhaven de dispersión de luz dinámica. Con el fin de comprobar la fiabilidad de la información obtenida con el instrumento, un usuario realizó medidas de cuatro muestras diferentes en cinco laboratorios distintos con diferentes operadores. La tabla de resultados muestra una excelente reproducibilidad en el análisis de materiales de referencia reconocidos. Instrument Nom. 90 Nom. 273 Nom. 111 Nom. 400 A 91±1 276±1 110±1 404±4 B 90±1 279±1 108±1 391±3 C 90±1 276±1 109±1 399±3 D 90±1 277±1 110±1 397±3 E - - 112±1 394±3 Ave. 90.3 277.0 109.8 397.0 Std. Err ±0.3% ±0.3% ±0.6% ±0.6% Tabla 1: Resultados de medida de tamaño de partícula empleando el analizador NanoBrook 90Plus de Brookhaven Instruments (diámetros en nm). Presentación de resultados El NanoBrook Omni ofrece tres opciones de presentación de resultados. Para determinaciones de rutina, un valor medio del diámetro (diámetro efectivo) y una medida de la anchura de la distribución (polidispersidad) son suficientes para muchas aplicaciones. Esto puede verse en la ilustración para el látex con una distribución de tamaño estrecha. La segunda opción es ajustar estos valores a una distribución log-normal, permitiendo ver la distribución de tamaños, así como interpolar resultados diferenciales o acumulados en intervalos del 5 %. La figura 2 muestra la tercera opción de presentación de resultados, adecuada para distribuciones de tamaño multimodales, más complejas. Aquí se emplea un algoritmo numérico, incluyendo la teoría de Mie, para obtener la información sobre las diferentes poblaciones de partículas presentes en la muestra. El resultado de la figura corresponde a una mezcla de partículas de látex conocidas. Las posiciones de las poblaciones en la gráfica están en excelente acuerdo con los tamaños conocidos de 92 y 269 nm. Boletín IZASA Analítica Para más información de estos productos enviar un e-mail a dac2@izasa.es o visitar nuestra web izasa.es Al contrario que otros métodos de determinación de potencial Z, la técnica PALS no requiere la aplicación de grandes campos eléctricos, que pueden provocar problemas de calentamiento y desnaturalización de muestras biológicas delicadas, tales como proteínas, anticuerpos, péptidos o DNA/RNA. El NanoBrook Omni puede medir la movilidad de este tipo de muestras aplicando voltajes de tan solo 2 o 4 voltios, evitando así cualquier tipo de degradación de la muestra. Esto se debe al hecho de que, al realizar la medida mediante análisis de fase, es suficiente con que las partículas se muevan tan solo una fracción de su propio diámetro para proporcionar buenos resultados. Figura 2: Resultado de la medida de tamaño de partícula de una muestra bimodal en el NanoBrook Omni. Durante la medida, la pantalla puede cambiarse para mostrar bien la función de autocorrelación, la distribución log-normal o la distribución multimodal. Cada una de ellas se muestra “viva” a medida que los datos se van acumulando. La gráfica en tiempo real es particularmente útil para determinar el punto final de una medida, donde la forma de la distribución multimodal puede ser importante. Determinación de potencial Z por análisis de fase (PALS) Para la medida de movilidades electroforéticas muy pequeñas, el Brookhaven NanoBrook Omni es la solución, la única solución! Basado en conceptos desarrollados en la Universidad de Bristol y Brookhaven Instruments, el NanoBrook Omni determina el potencial zeta empleando análisis de fase de luz dispersada (PALS – Phase Analysis Light Scattering). Esta técnica es hasta 1.000 veces más sensible que los métodos tradicionales de medida de potencial zeta basados en el cambio de frecuencia de la luz dispersada. Figura 3: Medida de potencial Z mediante la técnica PALS (Phase Analysis Light Scattering). En muestras con alto contenido salino, de hasta 2 molar, y con campos eléctricos de solo 1 o 2 V/cm, se induce suficiente movimiento en las partículas como para conseguir excelentes resultados. Además, el diseño de los electrodos elimina cualquier interferencia debida al efecto del flujo electróosmótico, y por lo tanto elimina la necesidad de su corrección. La repulsión electrostática de partículas coloidales es a menudo la clave de la estabilidad de una dispersión. Una medida sencilla de la movilidad electroforética, incluso en líquidos no polares, proporciona información valiosa. Las medidas realizadas en agua y otros líquidos polares, cubren el rango típicamente de ± (6 a 100) mV, correspondientes a movilidades de ± 0,5 – 8,0 x 10-8 m2/Vs. El NanoBrook Omni no solo cubre este rango, sino que lo extiende en un factor x 1000 en sensibilidad hasta 10-11 m2/Vs. Figura 4: La medida de potencial Z se realiza empleando un electrodo no desechable dentro de una cubeta estándar de plástico. Para más información contacte con Atención al Cliente Tel.: 902 20 30 80 dac2@izasa.es www.izasa.es @izasaGIC Boletín IZASA Analítica marzo-14 Para más información de estos productos enviar un e-mail a dac2@izasa.es o visitar nuestra web izasa.es ¿Olor a moho en frutas y verduras? GCxGCqMS con SHIMADZU GCMS-QP2010 ULTRA NCI Determinación de tricloroanisol y tribromoanisol usando SPME acoplado a Comprehensive GCxGC y detección selectiva de masas (HS-SPME-GCxGC-qMS-NCI) El 2,4,6-tricloroanisol (TCA) es a menudo mencionado en la literatura, particularmente desde que H.R. Buser´s identificó el TCA en una publicación como un componente clave del "sabor del corcho" en vino. Muchos otros informes han sido publicados por los efectos sensoriales en los alimentos por TCA y también 2,4,6-tribromoanisol (TBA). En 1990, J. C. Spadone encontró que el 20% de café verde de Brasil fue contaminada con TCA. Más recientemente, TBA apareció en productos de las empresas farmacéuticas Pfizer y Johnson & Johnson, quien tuvo que retirar productos del mercado como resultado de envases contaminados. Ha sido desarrollado un método robusto y sensible para determinar TBA y TCA en una gama de frutas y verduras exhibiendo olores mohosos no deseados Propiedades y sensoriales Fuentes de TBA y TCA TCA y TBA tienen un desagradable mal olor mohoso que es detectado por los seres humanos - incluso a muy concentraciones bajas. Estos compuestos puede ser percibido a diferentes niveles por seres humanos en diferentes alimentos/matrices. La figura 1 muestra las estructuras químicas de los dos compuestos. Cabe señalar que ninguno de los estas sustancias se añadieron a los productos alimenticios intencionalmente, pero ambas sustancias se forman a partir de halofenoles que se utilizan como bactericidas (PCP). 2,4,6 -trichloroanisole 2,4,6 -tribromooanisole Water: Beer: Water: 0,02 ng/L (Whitfield) 0,03 ng/L 0,09 ng/L dentro como fuera del corcho como resultado del proceso de producción. La formación ocurre ya sea por metilación directa de triclorofenol y / o tribromofenol o una reacción de metilación después de una decloración de fenoles de halogenuros con más de tres cloro o átomos de bromo. Del gran número de los anisoles de halogenuros, el TCA y el TBA tienen, con mucho, el olor a menor nivel de concentración. Métodos analíticos Debido a la alta volatilidad de la sustancias, la cromatografía de gas de alta resolución (GC) es el método de elección para el análisis. Un detector de captura de electrones (ECD) o mejor un espectrómetro de masas para su uso en cualitativo y cuantitativo rn la detección de compuestos de haluro. Las mediciones iniciales sobre frutas y verduras con un cuadrupolo en modo SIM se muestran. Sin embargo, tal método no es útil en el análisis de muestras del mundo real debido a interferencias masivas ( ver figura 2) . Figura 1. Tricloroanisol y tribromoanisol. El mecanismo de formación pudo ser identificado en la producción de tapones de vino hecha de corcho natural. Un número de microorganismos podrían ser detectados tanto marzo-14 Figura 2. Iones extraídos (m/z 212) por GC-qMS-EI. Boletín IZASA Analítica Para más información de estos productos enviar un e-mail a dac2@izasa.es o visitar nuestra web izasa.es Para resolver este problema se utilizó la combinación de cromatografía multidimensional (GCxGC ) con ionización química negativa (NCI ). En Comprehensive (GCxGC) dos columnas de diferentes polaridades son acopladas en serie . La primera columna en este set-up por lo general tiene dimensiones convencionales, mientras que la segunda es sustancialmente más corta (0,5 - 3 m ). Todos los compuestos que eluyen de la primera se criofocalizan en cabeza de la segunda columna por un chorro de gas nitrógeno frío y posteriormente calentado en un intervalo constante tiempo (frecuencia de modulación, generalmente 2-8 s ) por un chorro de nitrógeno caliente. De esta manera, los picos de la primera dimensión se fraccionan y la separación adicional en la segunda columna se lleva a cabo. Para una mejor visión de la separación, los datos resultantes son representados en los llamados gráficos de contorno en lugar de en los cromatogramas. La Figura 3 muestra los gráficos de contorno de haluros de anisoles en una muestra real de mango. La preparación de la muestra se llevó a cabo de forma automatizada: HSSPME con una fibra de 2 cm 50/30 micras divinilbenceno / carboxene / polidimetilsiloxano a 80 ° C durante 60 min. Cantidad de muestra era 1 g de material homogeneizado. Rango de calibración fue 1-100 ng / kg. En un gráfico de contorno el tiempo de retención se representa en la primera columna contra el tiempo de retención en la segunda columna. Además, la modulación de los picos conduce a una mejor sensibilidad, como la anchura de un pico convencional suele ser de cinco a seis segundos de esta forma se reduce de 200 a 400 ms . Ionización química Negativa en GCMS La relación señal/ruido (S / N) para los 10 ng / kg de TCA se incrementó desde 18 : 1 por impacto electrónico ( EI) en Modo de SIM a 72 : 1 (NCI en modo SIM) . Si el NCI se utiliza en combinación con GCxGC, el aumento adicional es hasta S/N > 300 que resulta en un límite de cuantificación de 0,1 ng / kg. La siguiente figura muestra el contorno de una muestra patrón con una concentración de 10 ng / kg de cada uno de diferentes haloanisoles. 2,3,4,5 -tetrachloroanisole 2,3,4 -trichloroanisole Pentachloroanisole Figura 3: (a) Mango 1 / (b) Mango 2 Conclusión El uso de un sistema Comprehensive acoplado a SPME y en modo de Ionización química negativa, ha demostrado ser una técnica selectiva y sensible para la determinación de los compuestos activos de olor 2,4,6 - tricloroanisol y 2,4,6 - tribromoanisole . El método es también robusto y simple. La determinación de los compuestos diana sin ninguna interferencia de la matriz es posible con este método. Los primeros resultados de muestras del mundo real (mango, ajo y diferentes tipos de setas) obtenido a partir de una tienda de comestibles mostraron niveles alarmantes de contaminación. 2,3,6 -tribromoroanisole 2,3,5,6 -tetrachloroanisole 2,4,6 -trichloroanisole Referencias 1. H.R. Buser, J. Agric Food Chem. 30, 359-362(1982). 2. J.C. Spadone, J. Agric. Food Chem. 38(1), 226-233 (1990) Muestra patrón con concentración de 10/ng/kg de cada uno de los diferentes haloanisoles. Para más información contacte con Atención al Cliente Tel.: 902 20 30 80 dac2@izasa.es www.izasa.es @izasaGIC Boletín IZASA Analítica marzo-14 Siguenos en: Para más información contacte con Atención al Cliente Tel.: 902 20 30 80 dac2@izasa.es www.izasa.es @izasaGIC Boletín IZASA Analítica marzo-14