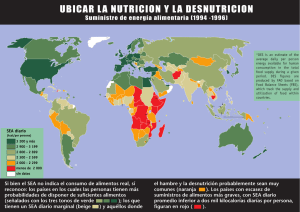
SEP.-DIC. Vol. 21,n.º 3
Anuncio

SEP.-DIC. Vol. 21, n.º 3 2 0 1 4 Grasa láctea: una fuente natural de compuestos bioactivos M.V. Calvo, M.P. Castro-Gómez, A. García-Serrano, L.M. Rodríguez-Alcalá, M. Juárez Iglesias, J. Fontecha Alonso Métodos alternativos al control químico de hongos toxígenos y micotoxinas en alimentos J. Gil-Serna, B. Patiño, C. Vázquez, M.T. González-Jáen Oligosacáridos derivados de la lactosa: síntesis, análisis y bioactividad A. Montilla Corredera, N. Corzo Sánchez, F.J. Moreno Andújar, A. Olano Villén, M. Villamiel Guerra Niveles de mercurio en pescado azul. Potenciales riesgos de su consumo y recomendaciones en mujeres embarazadas E. Conde Puertas, E Conde Puertas, I. Hernández Herrerías EQUIPO DE REDACCIÓN: Director: Prof. M. Serrano Ríos Jefe de Redacción: Dra. A. Sastre Comité Editorial: Presidente: Prof. M. Foz Sala Prof. R. Carmena Secretaria de Redacción: Prof. M. Juárez Prof. M. Bueno Prof. A. Mariné Font Comité Asesor: Sra. Dña. I. Ávila Prof. J. Cabo Soler Sra. Dña. P. Cervera Prof. F. Guarner Sra. Dña. C. López-Nomdedeu Prof. J. M. Ribera Casado Prof. L. Moreno Dr. J. A. Mateos Sr. D. M. Sarrias © Copyright 2014. Instituto Danone. C/. Buenos Aires, 21. 08029 Barcelona. Telf. 93 419 51 78. www.institutodanone.es Publicación trimestral. Reservados todos los derechos. Ninguna parte de esta publicación puede ser reproducida, transmitida en ninguna forma o medio alguno, electrónico o mecánico, incluyendo fotocopias, grabaciones o cualquier sistema de recuperación de almacenaje, información, sin el permiso por escrito del titular del Copyright. Publicación autorizada por el Ministerio de Sanidad como Soporte Válido, Ref. S.V. 94028 R. ISSN: 1136-4815 Depósito Legal: M-10938-1994 Edita: ARÁN Ediciones, S.L. C/ Castelló, 128, 1.º. Tel. 91 782 00 35 - Fax 91 561 57 87 - 28006 MADRID e-mail: revistas@grupoaran.com - http.//www.grupoaran.com S U VOL. 21 M A R I SEPTIEMBRE-DICIEMBRE 2014 O N.º 3 Revisiones Grasa láctea: una fuente natural de compuestos bioactivos M.V. Calvo, M.P. Castro-Gómez, A. García-Serrano, L.M. Rodríguez-Alcalá, M. Juárez Iglesias, J. Fontecha Alonso Departamento de Bioactividad y Análisis de Alimentos. Grupo Lípidos. Instituto de Investigación en Ciencias de la Alimentación (CIAL) CSIC-UAM. Campus de la Universidad Autónoma de Madrid 57 Métodos alternativos al control químico de hongos toxígenos y micotoxinas en alimentos J. Gil-Serna, B. Patiño, C. Vázquez, M.T. González-Jáen Departamentos de Microbiología III y Genética. Facultad de Biología. Universidad Complutense de Madrid64 Oligosacáridos derivados de la lactosa: síntesis, análisis y bioactividad A. Montilla Corredera, N. Corzo Sánchez, F.J. Moreno Andújar, A. Olano Villén, M. Villamiel Guerra Instituto de Investigación en Ciencias de la Alimentación (CIAL) (CSIC-UAM). CEI (UAM+CSIC). Madrid72 Niveles de mercurio en pescado azul. Potenciales riesgos de su consumo y recomendaciones en mujeres embarazadas E. Conde Puertas1, E Conde Puertas2, I. Hernández Herrerías2 1 Hospital Materno Infantil Virgen de las Nieves. Granada 2 Hospital La Inmaculada. Huércal-Overa. Almería82 1136-4815/14/57-63 Alimentacion, Nutricion y Salud Copyright © 2014 Instituto Danone Alim. Nutri. Salud Vol. 21, N.º 3, pp. 57-63, 2014 Grasa láctea: una fuente natural de compuestos bioactivos M.V. Calvo, M.P. Castro-Gómez, A. García-Serrano, L.M. Rodríguez-Alcalá, M. Juárez Iglesias, J. Fontecha Alonso Departamento de Bioactividad y Análisis de alimentos. Grupo Lípidos. Instituto de Investigación en Ciencias de la Alimentación (CIAL) CSIC-UAM. Campus de la Universidad Autónoma de Madrid RESUMEN L Abstract T a leche ha sido reconocida tradicionalmente como un alimento completo cuyo consumo implica elevar los niveles de múltiples nutrientes como minerales, vitaminas y proteínas de elevada calidad nutricional. No obstante, este consenso desaparece al referirse a la grasa láctea. Su elevado contenido en ácidos grasos saturados y colesterol ha sido indiscriminadamente utilizado como argumento para relacionar la ingesta de leche y sus derivados con una mayor incidencia de obesidad, diabetes tipo 2 y enfermedades cardiovasculares. De hecho, se insiste en recomendar el consumo preferente de productos lácteos con reducido contenido en grasa. Sin embargo, los estudios científicos más recientes sugieren que no existen evidencias contrastadas que justifiquen mantener tales recomendaciones en individuos sanos. Se ha demostrado que la grasa láctea constituye una fuente natural de compuestos bioactivos (ácido butírico, ácido linoleico conjugado (CLA), fosfolípidos y esfingolípidos) cuyo beneficio potencial sobre la salud humana permitiría su aplicación comercial en el desarrollo de alimentos funcionales orientados a la prevención de enfermedades crónicas. raditionally milk has been recognized as a very complete food because its consumption involves raising levels of variety of nutrients such as minerals, vitamins and high nutritional quality proteins. However, this consensus disappears when referring to milk fat. Its high content of saturated fatty acids and cholesterol has been indiscriminately employed as argument to link the milk and dairy products consumption with an increased incidence of obesity, type 2 diabetes and cardiovascular disease. In fact, it is strongly recommended the preferential intake of low fat dairy products. However, recent scientific studies suggest that there are no proven evidences to justify keeping these recommendations in healthy people. It has been shown that milk fat is a natural source of bioactive compounds (butyric acid, conjugated linoleic acid (CLA), phospholipids and sphingolipids) whose potential benefits to human health, would allow its commercial application in the development of functional foods, aimed to prevention of chronic diseases. Palabras clave: Lípidos bioactivos. Ácido linoleico conjugado (CLA). Ácido butírico. Fosfolípidos. Esfingolípidos. Key words: Bioactive lipids. Conjugated linoleic acid (CLA). Butyric acid. Phospholipids. Sphingolipids. Introducción A pesar de su enorme importancia nutricional y de jugar un papel esencial en el desarrollo de las propiedades físicas y organolépticas de los productos lácteos, la grasa láctea quizás sea el constituyente más infravalorado de los mismos. La grasa de leche se presenta en forma de glóbulos rodeados de una membrana de naturaleza lipoproteica compuesta principalmente por fosfolípidos y glicoproteínas y cuyo núcleo constituido mayoritariamente (95 %) por triglicéridos (TAG), posee carácter hidrofóbico. En su composición (Tabla I) figuran además otros lípidos simples (diglicéridos, monoglicéridos, ésteres de colesterol y ceras), lípidos complejos (mayoritariamente fosfolípidos), colesterol, antioxidantes (especialmente tocoferoles) y escualeno (1). Igualmente los lípidos de la leche constituyen el vehículo para las vitaminas liposolubles (A, D, E y K), de las que la leche es una buena fuente, así como carotenoides (2). Por lo que se refiere a su perfil lipídico, la grasa láctea contiene un elevado contenido de ácidos grasos saturados (AGS), del orden del 60-70 %, un 20-25 % corresponden a ácidos grasos monoinsaturados (AGMI)-con un 20-22 % de ácido oleico (cis-9 C18:1) y un 1-4 % a ácidos grasos trans (AGT)- y 3-5 % de ácidos poliinsaturados (AGPI), en cuya fracción está incluido el ácido linoleico (cis-9, cis-12 C18:2) y el ácido linoleico conjugado (CLA) (3) (Tabla II). En la leche de las especies más difundidas para consumo hay diferen- 57 M.V. Calvo, ET al. ALIM. NUTRI. SALUD cias notables en el contenido de algunos ácidos grasos, que influyen en el gusto de los productos elaborados (tal como el queso), sobre todo los ácidos caprílico (C8:0) y cáprico (C10:0) que pueden ser 2-3 veces mayores en las leches de oveja y cabra, que en leche de vaca. La grasa láctea es además una de las fuentes de colesterol de nuestra dieta, con un contenido medio de 260-270 mg/100 g de grasa. Durante las últimas décadas la posible contribución de la grasa láctea a una dieta saludable ha generado un intenso debate, ya que su elevado contenido en ácidos grasos saturados y colesterol se asocia a un riesgo potencial de enfermedades coronarias. Por otra parte, como consecuencia del concepto actual que se tiene de una alimentación saludable, se viene insistiendo desde distintos foros en recomendar el consumo preferente de productos lácteos desnatados, lo cual ha provocado una reducción drástica del consumo de grasa láctea. Sin embargo, los últimos avances científicos en este sentido han puesto de manifiesto que estos mensajes representan una visión excesivamente simplista del tema. De la información científica disponible, procedente de los estudios de meta-análisis y ensayos clínicos más recientes, se deduce que no hay razones para mantener la recomendación de excluir el consumo de grasa láctea de la dieta de forma generalizada a toda la población, por no existir evidencia positiva de la asociación entre el consumo moderado de productos lácteos y el riesgo de padecer enfermedades cardiovasculares (CVD), obesidad y diabetes tipo 2 y que por el contrario, los productos lácteos enteros parecen aportar efectos beneficiosos para la salud del consumidor sano (4-8). Los estudios clínicos recientes coinciden en señalar que la absorción del colesterol de la dieta (colesterol exógeno) es ineficiente en un individuo sano (6) y que en tal caso factores genéticos, tensión nerviosa, actividad física o el estado emocional jugarían el papel más relevante en la regulación de los niveles de colesterol en suero sanguíneo. Por otro lado, la disminución de la grasa de leche en la dieta puede dar lugar a una reducción en la ingesta de com- Tabla I Composición de los lípidos de la leche de vaca % mínimo % máximo puestos bioactivos de interés que poseen una significativa actividad biológica en relación con la salud humana. Tal es el caso del ácido butírico, el CLA y constituyentes de la membrana del glóbulo de grasa como fosfolípidos y esfingolípidos (9-14). Así, a la luz de los resultados científicos más actuales y tras varias décadas de controversia, la denostada imagen de la grasa láctea se está viendo revalorizada detectándose un Tabla II Composición media de los ácidos grasos mayoritarios en leches de vaca, oveja y cabra (% del total de ácidos grasos) Ácido graso Especie Vaca Oveja Cabra C4:0 3,13 3,51 2,18 C6:0 1,94 2,9 2,39 C8:0 1,17 2,64 2,73 C10:0 2,48 7,82 9,97 C12:0 2,99 4,38 4,99 C14:0 10,38 10,43 9,81 cis-9 C14:1 1,08 0,28 0,18 iso C15:0 0,29 0,34 0,13 anteiso C15:0 0,5 0,47 0,21 C15:0 1,05 0,99 0,71 iso C16:0 0,22 0,21 0,24 C16:0 28,51 25,93 28,23 cis-9 C16:1 1,73 1,03 1,59 iso C17:0 0,55 0,53 0,35 anteiso C17:0 0,52 0,3 0,42 C17:0 0,73 0,63 0,72 C18:0 10,51 9,57 8,88 cis-9 C18:1 20,5 18,2 19,29 trans C18:1 (total) 4,25 2,9 2,12 cis-9 cis-12 C18:2 3,13 2,33 3,19 Triglicéridos 97,0 98,0 Diglicéridos 0,3 0,6 otros C18:2 1,03 0,88 0,7 Monoglicéridos 0,2 0,4 cis-9 cis-12 cis-15 C18:3 0,59 0,63 0,42 Ácidos grasos libres 0,1 0,4 CLA 1,03 0,74 0,7 Fosfolípidos 0,2 1,01 Total saturados 64,97 70,65 71,96 Colesterol 0,3 0,4 Total insaturados 27,56 22,41 23,18 Total poliinsaturados 5,78 Hidrocarburos Trazas Incluye la esfingomielina (intervalo mínimo y máximo en % de grasa). Datos tomados de Jensen (1). 1 58 4,58 CLA: ácido linoleico conjugado. Datos tomados de Fontecha y Juárez 2012 (3). 5,01 Vol. 21, N.º 3, 2014 Grasa láctea: una fuente natural de compuestos bioactivos creciente interés en todos aquellos aspectos que se refieren a los lípidos lácteos como fuente de ingredientes bioactivos y funcionales, cuyo consumo aporta beneficios para el mantenimiento de la salud y la prevención de enfermedades crónicas en humanos (3). ÁCIDOS GRASOS SATURADOS Y SALUD CARDIOVASCULAR Como se ha mencionado anteriormente, la imagen de la leche y de los productos lácteos se ha visto dañada en gran medida por la elevada presencia de AGS, ~ 65 % en su fracción lipídica y por la creencia generalizada de que dichos ácidos resultan perjudiciales para la salud, por lo que su consumo se ha desaconsejado de forma indiscriminada. No obstante, la evidencia científica actual sobre los efectos específicos de los diferentes AGS no apoya las directrices que restringen su consumo con el fin de prevenir el riesgo de enfermedad coronaria y obligarían a una cuidadosa reevaluación del papel de grasas saturadas en relación con la salud (15). En esta línea, conviene indicar que únicamente la fracción correspondiente a los ácidos laúrico (C12:0), mirístico (C14:0) y palmítico (C16:0), podría considerarse no saludable, en el supuesto de que se produjera un consumo excesivo de forma aislada (12). Los estudios realizados para determinar el efecto de estos AGS de manera independiente frente al que se considera el mejor indicador de CVD colesterol total/HDL-colesterol, revelan que mientras el ácido C12:0 se comporta de manera significativamente positiva, disminuyendo dicho indicador, el C14:0 también muestra una tendencia hacia su disminución y sólo el C16:0 lo aumentaría (16). Las discrepancias encontradas entre los diferentes estudios, frente a los marcadores de CVD, podrían explicarse en parte a la utilización de fórmulas que incorporan grasas sintéticas, con ácidos grasos esterificados al azar. El ácido esteárico (C18:0) es otro AGS presente en grasa láctea con un contenido superior al 10 %. Dicho compuesto es considerado neutro desde la perspectiva de la salud humana (17), aunque sin duda es tan efectivo para reducir el colesterol plasmático como el ácido oleico (C18:1), también presente en grasa láctea en concentraciones altas. Otros compuestos que se encuentran en la grasa de leche, particularmente en la de cabra, son los ácidos metíl-ramificados. Su relevancia en relación con la salud reside en sus propiedades anticancerígenas descritas en cultivos de células tumorales y al no encontrarse en otras grasas animales, son utilizados como marcadores del consumo humano de grasa láctea en estudios clínicos (18). Igualmente, cabe destacar las actividades biológicas atribuidas a los ácidos grasos de cadena corta butírico (C4:0), caproico (C6:0) y de cadena media, caprílico y cáprico, cuya presencia es casi exclusiva de grasa láctea y representan del 10-12 % del total de AGS. Es bien conocido que el ácido butírico actúa como modulador génico y desempeña un papel importante como agente antitumoral inhibiendo el crecimiento en una amplia gama de líneas celulares de cáncer humanas (19). Se ha documentado que el butírico puede actuar tanto solo, como de forma sinérgica con otros componentes de la dieta, por lo que no serían necesarias concentraciones plasmáticas muy elevadas para proporcionar un efecto beneficioso (20). Además, tanto en ensayos in vitro como en animales de experimentación, se ha visto que los ácidos caproico, caprílico y cáprico ejercen actividades antivirales y antibacterianas (21). Por otra parte, la presencia de estos ácidos grasos da lugar a un elevado contenido en TAG de cadena corta y media, lo que confiere a la grasa láctea un menor punto de fusión frente a otras grasas animales saturadas, proporcionándole asimismo unas propiedades químicas y físicas diferentes que afectan de manera positiva su digestibilidad y favorecen su biodisponibilidad. Además, los TAG de estos ácidos grasos de la dieta se hidrolizan en nuestro organismo, absorbiéndose desde el intestino al sistema circulatorio sin re-síntesis de TAG y son empleados como fuente de energía rápida, por lo que tienen baja tendencia a acumularse en tejido adiposo (19). Por todo ello, parece demostrado que la grasa láctea tiene menos efectos negativos sobre los lípidos séricos que el que cabría esperar por su contenido en grasa saturada. ÁCIDOS GRASOS TRANS: ¿SON TODOS IGUALES? La presencia de ácidos grasos trans AGT de “origen natural” en grasa láctea y su relación con la salud cardiovascular es un tema que genera gran controversia. Si bien es cierto que se ha demostrado claramente que los AGT de “origen industrial” obtenidos a partir de procesos de hidrogenación parcial de aceites vegetales, provocan un aumento del riesgo de enfermedad coronaria y cerebral al originar un incremento en la relación colesterol LDL/HDL y de la lipoproteína A (22-24), la cuestión sobre si los AGT presentes en la leche producen tales efectos adversos no está clara (25). Actualmente se admite que las consecuencias negativas derivadas de la ingesta de AGT se inician mediante cambios en el perfil de las lipoproteínas séricas, aunque también se pueden afectar la respuesta inflamatoria y la función endotelial. El riesgo asociado al consumo de AGT parece depender de los alimentos que forman la dieta y de su contenido en AGT. Así, aunque los perfiles de AGT de la grasa láctea y de los aceites vegetales parcialmente hidrogenados guardan considerables similitudes, sin embargo difieren en las proporciones en las que se hallan presentes los distintos isómeros trans. La alimentación del ganado es el factor que más afecta al contenido de AGT en la grasa láctea (entre 2-6 % del total de ácidos grasos), siendo el trans-11, C18:1 o ácido vacénico (VA), el isómero cuantitativamente más importante constituyendo del 50 al 60 % del total de AGT. 59 M.V. Calvo, ET al. En relación con este tema, son numerosos los estudios publicados recientemente que sugieren que el consumo moderado de AGT por la ingesta de productos lácteos, podría no contribuir a aumentar los riesgos cardiovasculares (26-29), y que en particular el VA ejercería efectos beneficiosos en el metabolismo de lípidos y dislipemia (30) y de protección frente a aterosclerosis en modelos animales (31). Estas posibles contradicciones podrían ser debidas al doble papel que juega el VA en el metabolismo, ya que es a la vez un AGT y precursor del ácido ruménico (RA, cis-9, trans-11 C18:2), el isómero mayoritario del CLA. Actualmente se reconoce que aproximadamente el 90 % del RA de la leche se produce de forma endógena implicando la actividad de la enzima delta-9-desaturasa a partir del VA, pero también se ha confirmado esa bioconversión a CLA, metabólicamente activo, en tejidos animales y humanos (32). LÍPIDOS BIOACTIVOS DE LA MEMBRANA DEL GLÓBULO GRASO LÁCTEO Durante los últimos años, los fosfolípidos (FL) y esfingolípidos presentes en la leche han despertado un creciente interés tanto dentro de la comunidad científica como en la industria alimentaria. Ello es debido no sólo a las reconocidas cualidades tecnológicas de estos lípidos polares presentes en la membrana del glóbulo graso lácteo (MGGL), sino también a sus actividades biológicas potencialmente beneficiosas para la salud humana. Todo ello ha llevado a la idea de considerar a la membrana del glóbulo graso lácteo como un potencial nutracéutico (33-35). Los lípidos polares juegan un papel fundamental en la emulsión de la grasa láctea en el agua, ya que junto con las glicoproteínas presentes, son los principales constituyentes de la MGGL que rodea las gotas de lípidos secretados por las células de la glándula mamaria. La MGGL se halla constituida por una compleja mezcla de glicoproteínas, glicerofosfolípidos, esfingolípidos, glicolípidos (cerebrósidos y gangliósidos), colesterol, enzimas y otros componentes minoritarios. Debido a su carácter lipofílico e hidrofílico, los lípidos polares presentes en la MGGL se encuentran profundamente implicados en el metabolismo celular, juegan un papel en la señalización neuronal y se hallan vinculados a las enfermedades relacionadas con la edad (capacidad cognitiva, demencia), la inmunidad y las respuestas inflamatorias (35). Los FL suponen un porcentaje pequeño de los lípidos lácteos totales (0,3-1 % en leche de vaca y 0,3 % en leche humana). Sin embargo, pueden representar una parte importante de los lípidos totales del suero de mantequilla (mazada) y de la leche desnatada, debido a la presencia de cantidades significativas de componentes de la MGGL en dichos productos. Entre los FL presentes en el glóbulo graso (Fig. 1), destacan la fosfatidilcolina (FC) 35 %, fosfatidiletanolamina (FE) 30 %, esfingomielina (EM) 25 %, fosfatidilinositol (FI) 5 % y fosfatidilserina (FS) 3 % (36). La presencia de los fosfolípidos y glicoproteínas permite a la MGGL interactuar ampliamente, tanto a nivel 60 ALIM. NUTRI. SALUD físico como bioquímico, con el epitelio intestinal durante la digestión, por lo que destaca su papel en el transporte y la transferencia de nutrientes liposolubles a lo largo del tracto gastrointestinal. Entre las actividades biológicas descritas para los lípidos polares cabe mencionar además su carácter antioxidante, sus propiedades antimicrobianas y antivirales, así como su efecto protector frente a la úlcera gástrica y a patógenos gastrointestinales. Estudios recientes han demostrado que los FL parecen desarrollar importantes funciones como agentes activos frente al cáncer de colon (35,37). Se ha propuesto que estas funciones pueden hallarse relacionadas con la presencia de ácidos grasos poliinsaturados de cadena larga en su posición sn-2 (38). Las lisoformas originadas por la acción de la lipasa sobre los FL durante la digestión son también altamente bioactivas ya que inducen, mediante procesos surfactantes, la lisis de bacterias Gram-positivas. Estos efectos líticos han sido comprobados con FC, FE y sus lisoformas tanto en cultivos celulares como en ratas alimentadas con mazada en polvo. Además, se ha ensayado con éxito la inhibición del crecimiento de L. monocytogenes en ratas infectadas, mediante la aplicación de FC (39). A nivel individual, se ha visto que la FS ejerce efectos positivos frente a enfermedades como Alzheimer, depresión, estrés y ayuda a restaurar la memoria, tal como se ha comprobado al realizar diversos ejercicios de retentiva (35). Por su parte la FC parece tener un posible papel en la recuperación del hígado y protección de la mucosa gastrointestinal humana tras un ataque químico tóxico o daño viral (33) y es capaz de actuar como agente anti-inflamatorio reduciendo el desarrollo de artritis en ratas (40). También destaca por su importancia el grupo de los esfingolípidos, que incluye a esfingomielinas, cerebrósidos, globósidos y gangliósidos, así como a sus productos de Fig. 1. Fosfolípidos mayoritarios en membrana del glóbulo graso lácteo (FE: fosfatidil-etanolamina; FS: -serina; FI: -inositol; FC: -colina) y esfingolípidos (EM: esfingomielina). Vol. 21, N.º 3, 2014 GRASA LÁCTEA: UNA FUENTE NATURAL DE COMPUESTOS BIOACTIVOS digestión (ceramidas y esfingosinas). En leche, la mayoría de los esfingolípidos son glucosilceramidas, lactosilceramidas y esfingomielina (EM) (41). Todos ellos son moléculas de elevada actividad, con importantes efectos en la regulación celular y en los indicadores plasmáticos ya que reducen el nivel de LDL y elevan HDL-colesterol en suero (42,43). Contribuyen además al mantenimiento de la estructura de la membrana al generar “microdominios”, que modulan el comportamiento de los receptores de factores de crecimiento y proteínas de la matriz extracelular, y sirven como centros de unión para algunos microorganismos, toxinas microbianas y virus (44). Existe evidencia experimental de que el consumo de esfingolípidos inhibe los estadios tempranos de cáncer de colon en ratones (45). Se ha descrito que la esfingomielina ejerce un papel clave en el proceso de mielinización del sistema nervioso y en el desarrollo neurológico en bebés (46). También se ha comprobado que se comporta como un efectivo inhibidor de la absorción intestinal de colesterol (47). Las ceramidas han sido propuestas como importantes agentes mediadores de las señales en cascada en procesos de apoptosis, proliferación y respuestas de estrés celular (48). Los gangliósidos desarrollan su función biológica principalmente en los tejidos nerviosos, donde se ha demostrado que juegan un papel importante en el desarrollo cerebral neonatal, contra las alergias y como inhibidores de toxinas bacterianas (37). Estos resultados, sugieren que los alimentos o los suplementos ricos en esfingolípidos, podrían ser beneficiosos en la prevención de los cánceres de mama y colon y de enfermedades relacionadas con el sistema nervioso central. llas o aceites vegetales –ricos en ácidos poliinsaturados– la alternativa que ha dado lugar a incrementos más notables. En la actualidad, la información disponible sobre los efectos del CLA en el metabolismo de células cancerígenas en cultivos, así como su actividad anti-proliferativa y pro-apoptótica (51), le convierten en un potencial agente antitumoral. A este respecto, un estudio prospectivo sugiere que una ingesta elevada de CLA mediante el consumo de productos lácteos con alto contenido en grasa puede reducir el riesgo de cáncer colorrectal (52). Otros efectos potencialmente beneficiosos del CLA en el ámbito de la salud humana provendrían de sus propiedades antiarterioscleróticas y antidiabéticas, su capacidad para disminuir la grasa corporal, favorecer la absorción de calcio y mejorar la respuesta inmunitaria (53). Se ha demostrado que la incorporación a la dieta de personas sanas de una mezcla de isómeros de CLA (cis-9, trans-11 y trans-10, cis-12) afecta de forma positiva a la relación de los lípidos plasmáticos, especialmente es el isómero cis-9, trans-11, el que causa una reducción significativa en la concentración de colesterol total y de TAG (54). El papel del isómero trans-10, cis-12 en los ensayos realizados no parece ser tan positivo para los indicadores plasmáticos de enfermedades cardiovasculares, sobre todo si se utilizan suplementos a dosis elevadas de consumo (25). El isómero trans-10, cis-12 C18:2, presente en proporción similar al RA en los suplementos de origen industrial, ha alcanzado también una gran repercusión por su potencial capacidad para reducir la grasa corporal. Sin embargo, existe una gran controversia en torno a este isómero ya que podría ser también causante de las alteraciones en los niveles de glucosa e incrementos de resistencia a insulina plasmática en ciertas patologías (55-57). Los estudios realizados en humanos sobre efectos relacionados con actividad anticancerígena o sobre pérdida de peso LA GrASA LÁctEA ES LA PrIncIPAL FuEntE dE ÁcIdo LInoLEIco conJuGAdo dE nuEStrA dIEtA El CLA es sin duda el componente de la grasa láctea que ha adquirido mayor relevancia en las últimas décadas. Este hecho tiene fiel reflejo en el incremento exponencial que ha experimentado la investigación desarrollada en torno a este compuesto y que puede ser consultada en la página web http://fri.wisc.edu/clarefs.htm). Desde que en 1987 se demostró (49) su efecto inhibitorio de tumores epiteliales en animales de experimentación, el CLA y en particular su isómero mayoritario el cis-9 trans-11 C18:2 o ácido ruménico (RA) (Fig. 2) han sido objeto de multitud de estudios dirigidos a determinar sus propiedades bioquímicas y fisiológicas. Aunque gran parte de estos trabajos se ha llevado a cabo con mezclas sintéticas equimoleculares de dos isómeros de CLA (cis-9, trans-11 y trans-10, cis-12), los resultados sugieren que el RA sería el responsable en mayor medida de los efectos antiaterogénicos y anticancerígenos, así como de la mejora de las funciones inmunológicas (12,50). El contenido total de CLA en leche puede oscilar entre 0,7-1,2 % (Tabla II). Dichos niveles de CLA se pueden aumentar, siendo la modificación de la alimentación del ganado, y en particular la suplementación con semi- A trans-11 cis-9 cis-12 B trans-10 trans-11 C Fig. 2. Estructura química y geométrica de los principales isómeros de CLA: A. cis-9 trans-11 C18:2 (ácido ruménico, RA) y B. trans-10 cis-12 C18:2, así como de C. ácido vacénico trans-11 C18:1, precursor metabólico del RA. 61 M.V. Calvo, ET al. obtenida con suplementos con CLA evidencian en general la necesidad de realizar investigaciones adicionales (50,56,58). Resulta prioritario seguir profundizando en estos efectos biológicos atribuidos al CLA, puesto que los posibles mecanismos metabólicos implicados aún no han sido completamente definidos. Se ha sugerido que el CLA compite con el ácido araquidónico (C20:4) en la reacción de la ciclooxigenasa, lo que reduce la concentración de prostaglandinas y tromboxanos de la serie 2 (59). El CLA puede suprimir la expresión de genes de la ciclooxigenasa y reducir la liberación de citoquinas pro-inflamatorias tales como TNF-alfa e interleukina en animales. También parece activar los factores de transcripción PPARs, reducir el paso inicial en la activación del NF-kappa B y por tanto reducir las citoquinas, moléculas de adhesión, y de otros tipos de moléculas inducidas por estrés (60). Igualmente, en la actualidad hay un elevado número de estudios clínicos en marcha con el objetivo de aclarar otro aspecto esencial, como es el establecimiento de la dosis de CLA adecuada para lograr en humanos los efectos biológicos descritos en animales de experimentación. En definitiva, si todas las ventajas fisiológicas atribuidas al CLA fueran trasladables a humanos, aumentos de este compuesto en la ingesta podrían repercutir positivamente sobre el valor nutricional de los alimentos que los contengan, como es el caso de la leche y los productos lácteos. CONSIDERACIONES FINALES La imagen nutricional adversa de la grasa láctea es sobre todo atribuida a la posible implicación de ciertos ácidos saturados y el colesterol en el aumento del riesgo de enfermedades coronarias. Sin embargo, las conclusiones obtenidas después de más de 50 años de estudios epidemiológicos no aportan asociación entre consumo de lácteos y enfermedades cardiovasculares. Por otra parte, la disminución de la grasa de leche de la dieta puede dar lugar a una reducción en la ingesta de compuestos bioactivos de interés para la salud, presentes en la fracción lipídica de la leche● CORRESPONDENCIA: M.ª Visitación Calvo Departamento de Bioactividad y Análisis de Alimentos. Grupo Lípidos Instituto de Investigación en Ciencias de la Alimentación (CIAL) CSIC-UAM C/ Nicolás Cabrera, 9 Campus de la Universidad Autónoma de Madrid (UAM) 28049 Madrid e-mail: mv.calvo@csic.es BIBLIOGRAFÍA 1. Jensen RG. The composition of bovine milk lipids: January 1995 to December 2000. J Dairy Sci 2002;85:295-350. 62 ALIM. NUTRI. SALUD 2. Juárez M, Fontecha J. Componentes bioactivos de la grasa láctea. En: Fontecha J, Recio M, Pilosof MA, editores. Funcionalidad de Componentes Lácteos. Ed. Cyted-Iberofun. J; 2009. 3. Fontecha J, Juárez M. Avances científicos sobre el papel de la grasa láctea en la alimentación. En: Avances en Alimentación, Nutrición y Dietética. Madrid: Editorial Nemira 2012. p. 117-34. 4. Elwood FC, Pickering JE, Givens DI, Gallacher JE. The consumption of milk and dairy foods and the incidence of vascular disease and diabetes: an overview of the evidence. Lipids 2010;45:925-39. 5. de Oliveira Otto MC, Mozaffarian D, Kromhout D, Bertoni AG, Sibley CT, Jacobs DR Jr, et al. Dietary intake of saturated fat by food source and incident cardiovascular disease: The Multi-Ethnic Study of Atherosclerosis. Am J Clin Nutr 2012;96:397-404. 6. Lecerf JM, de Lorgeril M. Dietary cholesterol: from physiology to cardiovascular risk. Br J Nutr 2011;106:6-14. 7. Kratz M, Baars T, Guyenet S. The relationship between highfat dairy consumption and obesity, cardiovascular, and metabolic disease. Eur J Nutr 2013;52:1-24. 8. van Aerde MA, Soedamah-Muthu SS, Geleijnse JM, Snijder MB, Nijpels G, Stehouwer CDA, et al. Dairy intake in relation to cardiovascular disease mortality and all-cause mortality: The Hoorn Study. Eur J Nutr 2013;52:609-16. 9. Akaln S, Gönç S, Ünal G. Functional properties of bioactive components of milk fat in metabolism. Pakistan J Nutr 2006;5:194-7. 10. German JB, Dillard CJ. Composition, structure and absorption of milk lipids: A source of energy, fat-soluble nutrients and bioactive molecules. Crit Rev Food Sci Nutr 2006;46:57-92. 11. IDF-International Dairy Federation. The health benefits of milk and dairy products. Brussels. Belgium. Bull Inter Dairy Fed 2007: 417. 12. Parodi PW. Milk lipids: Their role as potential anti-cancer agents. Sci de Aliments 2009;28:44-52. 13. Legrand P. Nutritional Interest of Dairy Fat 2011. IDF World Dairy Summit; 2011. 14. Mills S, Ross RP, Hill C, Fitzgerald G, Stanton C. Milk intelligence: Mining milk for bioactive substances associated with human health. Int Dairy J 2011; 21:377-401. 15. Chowdhury R, Warnakula S, Kunutsor S, Crowe F, Ward HA, Johnson L, et al. Association of dietary, circulating, and supplement fatty acids with coronary risk: A systematic review and meta-analysis. Ann Intern Med 2014;160:398-406. 16. Steijns JM. Dairy products and health: Focus on their constituents or on the matrix? Inter Dairy J 2008;18:425-35. 17. Hunter JE, Zhang J, Kris-Etherton PM. Cardiovascular disease risk of dietary stearic acid compared with trans, other saturated, and unsaturated fatty acids: A systematic review. Am J Clin Nutr 2010;91:46-63. 18. Vlaeminck B, Fievez V, Cabrita ARJ, Fonseca AJM. Dewhurst RJ. Factors affecting odd- and branched-chain fatty acids in milk: A review. Anim Feed Sci Technol 2006;131:389-417. 19. Parodi PW. Nutritional significance of milk lipids. In: PF. Fox & PLH, editors. Advanced Dairy Chemistry. Lipids. 3ª ed. Vol. 2. Springer, EEUU: McSweeney; 2006. p. 601-39. 20. Wolte F. Stein J. Resveratrol enhances the differentation induced by butyrate in Caco-2 colon cancer cells. J Nutr 2002;132:2028-86. 21. Hilmarsson H, Larusson LV, Thormar H. Virucidal effect of lipids on visna virus, a lentivirus related to HIV. Archives of Virology 2006;151:1217-24. 22. Lichtenstein AH, Erkkila AT, Lamarche B, Schwab US, Jalbert SM, Ausman LM. Influence of hydrogenated fat and butter on CVD risk factors: Remnant-like particles, glucose and insulin, blood pressure and C-reactive protein. Atherosclerosis 2003;171:97-107. 23. Mozaffarian D, Aro A, Willett WC. Health effects of trans-fatty acids: experimental and observational evidence. Eur J Clin Nutr 2009;63:S5-21. Vol. 21, N.º 3, 2014 Grasa láctea: una fuente natural de compuestos bioactivos 24. Brouwer IA, Wanders AJ, Katan MB. Effect of animal and industrial trans fatty acids on HDL and LDL cholesterol levels in humans a quantitative review. PloS one 2010;5:e9434. 25. Wang Y, Jacome-Sosa M, Proctor SD. The role of ruminant trans fat as a potential nutraceutical in the prevention of cardiovascular disease. Food Res Int 2012;46:460-8. 26. Chardigny JM, Destaillats F, Malpuech-Brugere C, Moulin J, Bauman DE, Lock, et al. Do industrially-produced and natural trans fatty acid sources have the same impact on cardiovascular diseases risk factors in healthy subjects? Results of the TRANSFACT Study. Am J Clin Nutr 2008;87:558-66. 27. Gebauer SK, Destaillats F, Mouloungui Z, Candy L, Bezelgues JB, Dionisi F, et al. Effect of trans fatty acid isomers from ruminant sources on risk factors of cardiovascular disease: Study design and rationale. Cont Clin Trials 2011;32:569-76. 28. Bendsen NT, Christensen R, Bartels EM, Astrup A. Consumption of industrial and ruminant trans fatty acids and risk of coronary heart disease: A systematic review and meta-analysis of cohort studies. Eur J Clin Nutr 2011;5:773-83. 29. Sjogren P, Rosell M, Skoglund-Andersson C, Zdravkovic S, Vessby B, de Faire U, et al. Milk-derived fatty acids are associated with a more favorable LDL particle size distribution in healthy men. J Nutr 2004;34:1729-35. 30. Field CJ, Blewett HH, Proctor S, Vine D. Human health benefits of vaccenic acid. Appl Phys Nutr Metab 2009;34:979-91. 31. Gayet-Boyer C. Ruminant trans fatty acids intake and cardiovascular risk factors: A quantitative review of intervention studies. IDF World Dairy Summit; 2011. 32. Jutzeler van Wijlen RP, Colombani FC. Grass-based ruminant production methods and human bioconversion of vaccenic acid with estimations of maximal dietary intake of conjugated linoleic acids. Int Dairy J 2010;20:433-48. 33. Spitsberg VL. Bovine milk fat globule membrane as a potential nutraceutical. J Dairy Sci 2005;88:2289-94. 34. Hintze KJ, Snow D, Burtenshaw I, Ward RE. Capitule 16 Nutraceutical Properties of Milk Fat Globular Membrane. In: Biotechnology of Biopolymers. USA. 2011. p. 321-43. 35. Contarini G, Povolo M. Phospholipids in Milk Fat: Composition, Biological and Technological Significance, and Analytical Strategies. Int. J. Mol. Sci. 2013;14:2808-31. 36. Rodríguez-Alcalá LM, Fontecha J. Major lipid classes separation of buttermilk, and cows, goats and ewes milk by high performance liquid chromatography with an evaporative light scattering detector focused on the phospholipid fraction. J Chromat A 2010;1217:3063-6. 37. Castro-Gómez MP, Rodríguez-Alcalá LM, Calvo MV, Juárez M, Fontecha J. La membrana del glóbulo graso lácteo como fuente de lípidos polares bioactivos. En: Fontecha J. Ingredientes bioactivos y alimentos funcionales en Iberoamérica. Ed. Cyted-Iberofun. 38. Lee LHW, Shui G, Farooqui A, Wenk MR, Tan CH, and Ong WY. Lipidomic analyses of the mouse brain after antidepressant treatment: Evidence for endogenous release of long-chain fatty acids? Int J Neuropsychoph 2009;12:953-64. 39. Sprong RC, Hulstein MF, Van Der Meer R. High intake of milk fat inhibits intestinal colonization of Listeria but not of Salmonella in rats. J Nutr 1999;129:1382-9. 40. Hartmann P, Szabó A, Eró́s G, Gurabi D, Horváth G, Németh I, et al. Anti-inflammatory effects of phosphatidylcholine in neutrophil leukocyte-dependent acute arthritis in rats. Eur J Pharmacol 2009;622:58-64. 41. Rombaut R, Dewettinck K, Van Camp J. Phospho- and sphingolipid content of selected dairy products as determined by HPLC coupled to an evaporative light scattering detector (HPLC-ELSD). J Food Comp Anal 2007;20:308-12. 42. Kobayashi T, Shimizugawa T, Osakabe T, Watanabe S, Okuyama H. A long-term feeding of sphingolipids affected the level of plasma cholesterol and hepatic triacylglycerol but not tissue phospholipids and sphingolipids. Nutr Res 1997;17:111-4. 43. Vesper H, Schmelz EM, Nikolova-Karakashian MN, Dillehay DL, Lynch DV, Merrill AH. Sphingolipids in food and the emerging importance of sphingolipids to nutrition. J Nutr 1999;29:1239-50. 44. Küllenberg D, Taylor LA, Schneider M, Massing U. Health effects of dietary phospholipids. Lipids Health Dis 2012;5;11:3. doi: 10.1186/1476-511X-11-3 45. Lemonnier LA, Dillehay DL, Vespremi MJ, Abrams J, Brody E, Schmelz EM. Sphingomyelin in the suppression of colon tumors: prevention versus intervention. Arch Biochem Biophys 2003;419:129-38. 46. Tanaka K, Hosozawa M, Kudo N, Yoshikawa N, Hisata K, Shoji H, et al. The pilot study: Sphingomyelin-fortified milk has a positive association with the neurobehavioural development of very low birth weight infants during infancy, randomized control trial. Brain Dev 2012;35:45-52. 47. Noh SK, Koo SI. Milk sphingomyelin is more effective than egg sphingomyelin in inhibiting intestinal absorption of cholesterol and fat in rats. J Nutr 2004;34:2611-6. 48. Hannun YA, Obeid LM. The ceramide-centric universe of lipid-mediated cell regulation: Stress encounters of the lipid kind. J Biol Chem 2002;277:25487-850. 49. Ha YL, Grimm NK, Pariza MW. Anticarcinogens from fried ground beef: Heat altered derivatives of linoleic acid. Carcinogenesis 1987;8:1881-7. 50. McCrorie TA, Keaveney EM, Wallace JMW, Binns N, Livingstone MBE. Human health effects of conjugated linoleic acid from milk and supplements. Nutr Res Rev 2011; 24:206-27. 51. Ochoa JJ, Farquharson AJ, Grant I, Moffat LE, Heys, SD, Wahle KW. Conjugated linoleic acids (CLAs) decrease prostate cancer cell proliferation: Different molecular mechanisms for cis-9, trans-11 and trans-10, cis-12 isomers. Carcinogenesis 2004;25:1185-91. 52. Larsson SC, Bergkvist L, Wolk A. High-fat dairy food and conjugated linoleic acid intakes in relation to colorectal cancer incidence in the Swedish Mammography Cohort. Am J Clin Nutr 2005;82:894-900. 53. Battacharaya A, Banu J, Rahman M, Causey J, Fernandes G. Biological effects of conjugated linoleic acids in health and disease. J Nutr Biochem 2006;17:789-810. 54. Tricon S, Burdge GC, Kew S, Banerjee T, Russell JJ, Jones EL, et al. Opposing effects of cis-9, trans-11 and trans-10, cis12 conjugated linoleic acid on blood lipids in healthy humans. Am J Clin Nutr 2004;80:614-20. 55. Simón E, Macarulla MT, Churruca I, Fernández-Quintela A, Portillo MP. Trans-10, cis-12 conjugated linoleic acid prevents adiposity but not insulin resistance induced by an atherogenic diet in hamsters. J Nutr Biochem 2006;17:126-31. 56. Chen SC, Lin YH, Huang HP, Hsu WL, Houng JY, Huang CK. Effect of conjugated linoleic acid supplementation on weight loss and body fat composition in a Chinese population. Nutr 2012;28:559-65. 57. Riserus U, Brismar K, Arner P, Vessby B. Treatment with dietary trans-10 cis-12 conjugated linoleic acid causes isomer-specific insulin resistance in obese men with the metabolic syndrome. Diabetes Care 2002;25:1516-21. 58. Heinze VM, Actis AB. Dietary conjugated linoleic acid and long-chain n-3 fatty acids in mammary and prostate cancer protection: a review. Inter J Food Sci Nutr 2012;63:6678. 59. Akahoshi A, Koba K, Ichinose F, Kaneko M, Shimoda A, Nonaka K, et al. Dietary protein modulates the effect of CLA on lipid metabolism in rats. Lipids 2004;39:25-30. 60. Cheng WL, Lii CK, Chen HW, Lin TH, Liu KL. Contribution of conjugated linoleic acid to the suppression of inflammatory responses through the regulation of the NF-kappaB pathway. J Agric Food Chem 2004; 52:71-8. 63 1136-4815/14/64-71 Alimentacion, Nutricion y Salud Copyright © 2014 Instituto Danone Alim. Nutri. Salud Vol. 21, N.º 3, pp. 64-71, 2014 Métodos alternativos al control químico de hongos toxígenos y micotoxinas en alimentos J. Gil-Serna, B. Patiño, C. Vázquez, M.T. González-Jáen Departamentos de Microbiología III y Genética. Facultad de Biología. Universidad Complutense de Madrid RESUMEN L Abstract M as micotoxinas son un grave riesgo para la seguridad alimentaria y es imprescindible controlar su presencia en alimentos. Tradicionalmente, se han aplicado compuestos químicos para evitar el desarrollo de los hongos productores aunque, en los últimos años, se ha restringido mucho su uso debido a los problemas que ocasionan para la salud y el medio ambiente y a la restrictiva legislación Europea. En este trabajo, se ha evaluado la efectividad in vitro de métodos alternativos (antioxidantes, aceites esenciales y control biológico con microorganismos antagónicos) para controlar el crecimiento y la producción de micotoxinas de importantes especies del género Aspergillus. Los extractos de salvia española y espliego, así como el agente biológico Debaryomyces hansenii CYC 1244 han demostrado ser prometedores candidatos para la reducción de la contaminación por micotoxinas en alimentos al ser capaces de reducir significativamente el desarrollo y la producción de micotoxinas en varias de especies toxígenas. ycotoxins are a major hazard to food safety and it is essential to control their presence in food products. Traditionally, chemical fungicides have been applied to prevent fungal development although their use is now restricted due to the problems caused to health and environment as well as the restrictive European legislation. In this work, we have evaluated the in vitro effectiveness of several alternative methods (antioxidants, essential oils and biological control with antagonistic microorganisms) to control growth and mycotoxin production by important species included in the Aspergillus genus. The extracts of Spanish sage and lavender, as well as the biological agent Debaryomyces hansenii CYC 1244 are promising candidates to prevent mycotoxin contamination in foodstuffs since they are able to reduce fungal growth rate and mycotoxin production by several toxigenic species. Palabras clave: Micotoxinas. Aspergillus. Seguridad alimentaria. Antioxidantes. Aceites esenciales. Key words: Mycotoxins. Aspergillus. Food safety. Antioxidants. Essential oils. Introducción Las micotoxinas son metabolitos secundarios producidos por gran variedad de hongos filamentosos que presentan toxicidad tanto para los animales como para el ser humano. Estos hongos son capaces de proliferar en los alimentos produciendo dichas toxinas lo que acarrea gravísimas consecuencias para la seguridad alimentaria. Por ello, la Unión Europea ha establecido una estricta regulación sobre los niveles máximos de las micotoxinas más importantes en una gran variedad de productos (1-4). Dentro de las micotoxinas cuyos límites están legislados destacan, por su elevada toxicidad, las aflatoxinas y la ocratoxina A (OTA) y las principales especies productoras se encuentran clasificadas dentro del género Aspergillus. 64 El órgano diana primario de las aflatoxinas es el hígado aunque también se han comprobado sus efectos tóxicos en los riñones y las glándulas suprarrenales. La aflatoxina B1 (AFB1) está considerada el agente cancerígeno natural más potente que existe y ha sido clasificada por la Agencia Internacional de Investigación en el Cáncer (IARC) como un carcinógeno humano del tipo 1 (5). Las especies productoras de aflatoxinas más importantes son A. flavus y A. parasiticus debido a su frecuente presencia en alimentos y su elevada capacidad productora (6). Las aflatoxinas se han encontrado en numerosos productos alimentarios aunque los sustratos más frecuentemente contaminados son los cereales, los frutos secos y las especias. La OTA es una micotoxina de distribución mundial y se considera que su principal fuente en la dieta humana son Vol. 21, N.º 3, 2014 Métodos alternativos al control químico de hongos toxígenos y micotoxinas en alimentos El método más eficiente para controlar la contaminación de micotoxinas en los alimentos consiste en reducir al máximo la presencia de los hongos en los productos. Tradicionalmente, este control se ha llevado acabo con la aplicación de fungicidas químicos; sin embargo, en los últimos años su aplicación se ha restringido debido a los problemas que suponen para el medio ambiente y la salud humana y animal (11). Por otra parte, cada vez aparecen un mayor número de cepas de hongos resistentes a los tratamientos con fungicidas, principalmente a los denominados de amplio espectro que actúan simultáneamente sobre diferentes dianas en los hongos y que, hasta el momento, habían sido los más utilizados (12). Por todo ello, la Unión Europea ha establecido una estricta normativa con respecto a los residuos de fungicidas en los productos alimentarios (13,14). Asimismo, es importante destacar el auge de los productos orgánicos o ecológicos en la sociedad actual. Estos alimentos son cultivados sin el uso de fungicidas y la sociedad asume que son más saludables y naturales que los producidos de manera convencional. Sin embargo, diversos estudios han señalado que el manejo de estos cultivos sin la utilización de compuestos químicos fungicidas puede suponer el aumento de la contaminación por hongos y, por tanto, un incremento de los niveles de micotoxinas presentes en ellos o en sus productos derivados (15-18). Por tanto, la búsqueda y desarrollo de nuevos métodos de control de hongos toxígenos es imprescindible para garantizar que los alimentos lleguen al consumidor libres de micotoxinas. COMPUESTOS NATURALES En los últimos años se ha disparado el interés de la comunidad científica en la búsqueda de compuestos ambientalmente sostenibles como alternativa al uso de productos químicos para el control de hongos productores de micotoxinas (19). Distintos autores han comprobado que ciertas sustancias naturales como los compuestos antioxidantes y los extractos de plantas son capaces de controlar eficazmente el crecimiento de algunas especies de hongos toxígenos y, en algunos casos, también interfieren en su capacidad para producir micotoxinas (20-25). Asimismo, el uso de estos compuestos naturales estaría aceptado por las directrices de la agricultura ecológica ya que permite la aplicación de sustancias naturales obtenidas de plantas para inhibir el crecimiento de microorganismos. En este trabajo se planteó la evaluación de seis compuestos antioxidantes y cuatro extractos de plantas aromáticas sobre el crecimiento y la capacidad de producir micotoxinas en las especies más relevantes productoras de OTA de la sección Circumdati (A. westerdijkiae y A. steynii) así como de aflatoxinas (A. parasiticus). Los experimentos se realizaron in vitro utilizando medio CYA (Czapek Yeast Agar) suplementado con diferentes concentraciones del correspondiente compuesto ensayado. Asimismo, se incluyó un control no suplementado y todos los ensayos se realizaron por triplicado. Una suspensión de esporas de los hongos se sembró en el centro de la placa y se incubaron a 28 °C durante 6 días en A. parasiticus y 8 días en el caso de A. westerdijkiae y A. steynii. El diámetro de la colonia se evaluó diariamente para proceder al cálculo de la tasa de crecimiento en cada una de las condiciones. Al final del experimento se evaluó cuantitativamente la concentración de aflatoxinas u OTA en el medio por cromatografía líquida de alta eficacia (HPLC) siguiendo el protocolo descrito previamente (26). Todos los datos obtenidos se evaluaron mediante los correspondientes test estadísticos. Antioxidantes Se seleccionaron cuatro compuestos antioxidantes liposolubles (curcumina, quercetina, vitamina A y ß-caroteno) y dos hidrosolubes (N-acetil-cisteína [NAC] y vitamina C) y su efecto in vitro se evaluó a 6 concentraciones: 10, 50, 100, 150 y 250 ppm. El único compuesto que reducía significativamente el crecimiento de manera similar en las tres especies fue la curcumina (Fig. 1). La mayor disminución en la tasa de crecimiento con respecto al control en ausencia de curcumina se obtuvo a una concentración de Tasa de crecimiento (mm/día) los cereales, seguidos de las uvas y sus derivados (fundamentalmente vino y mosto) (7). Este compuesto tiene elevada toxicidad renal y ha sido clasificado por la IARC como un posible carcinógeno humano del grupo 2B (8). Las principales especies productoras de OTA se encuentran incluidas dentro de las secciones Nigri y Circumdati del género Aspergillus. En el primer grupo destaca A. carbonarius ya que todas las cepas de esta especie son capaces de producir la toxina (9), mientras que en la sección Circumdati las más importantes son A. westerdijkiae y A. steynii por su gran capacidad de producción (10). 16 14 12 10 8 6 4 2 0 0 10 50 100 150 250 Concentración de curcumina (ppm) A. parasiticus A. westerdijkiae A. steynii Fig.1. Efecto de la presencia de curcumina sobre el crecimiento de hongos toxígenos. Se representa la tasa de crecimiento de A. parasiticus (naranja), A. westerdijkiae (morado) y A. steynii (azul) en presencia de distintas concentraciones de curcumina entre 10 y 250 ppm. Los resultados son la media de las tres réplicas de cada condición y las barras finas representan el error estándar. Asimismo, se representan los resultados del análisis estadístico indicándose las diferencias con respecto al control: p < 0,05 (+), p < 0,01 (*), p < 0,001 (°). 65 J. Gil-Serna, et al. ALIM. NUTRI. SALUD 150 ppm y fue del 27 % en A. parasiticus y del 22 y 24 % en A. westerdijkiae y A. steynii, respectivamente. A modo de ejemplo, en la figura 2 (A), se muestra el crecimiento de A. steynii en placas de medio CYA suplementadas con curcumina. El resto de antioxidantes probados no redujeron el crecimiento de los hongos e incluso algunos de ellos, a determinadas concentraciones, suponían un incremento de la tasa de crecimiento como es el caso de la NAC que estimuló significativamente el crecimiento de A. steynii en más de un 12 % a una concentración de 250 ppm. En cuanto al efecto de los antioxidantes sobre la producción de micotoxinas, la capacidad de los hongos para producir aflatoxinas u OTA se vio afectada por algún compuesto en las tres especies. Únicamente la curcumina fue Control Control 10 ppm 10 ppm 50 ppm 100 ppm capaz de reducir la producción de aflatoxinas en A. parasiticus y la disminución máxima se obtuvo a una concentración de 150 ppm (40 % de reducción) (Tabla I). Por otro lado, la presencia de 100 ppm de NAC supuso una inducción de más del 40 % en la producción de aflatoxina G2 en A. parasiticus. El resto de los antioxidantes no modificaron de manera significativa la capacidad aflatoxígena en esta especie. Resultados similares se obtuvieron en el caso de las especies productoras de OTA, A. westerdijkiae y A. steynii. Únicamente la presencia de curcumina fue capaz de afectar significativamente la producción de OTA en estas dos especies y la reducción máxima se obtuvo a una concentración de 150 ppm (90 % en A. westerdijkiae y 67 % en A. steynii) (Tabla I). 100 ppm 500 ppm 150 ppm 1000 ppm 250 ppm Control + D. hansenii CYC1244 Fig. 2. Efecto de los tratamientos más efectivos sobre el crecimiento de A. steynii. Se muestra como ejemplo una de las réplicas de A. steynii creciendo en presencia de curcumina (A), aceite esencial de salvia española (B) y D. hansenii CYC 1244 (C). Se observa claramente una disminución en el diámetro de la colonia con respecto al control en los tres casos. TABLA I Efecto de la presencia de curcumina sobre la capacidad de producir micotoxinas. Se muestra la concentración total de aflatoxinas (B1, B2, G1 y G2) producidas por A. parasiticus y de OTA producida por A. westerdijkiae y A. steynii en medio CYA en presencia de concentraciones crecientes de curcumina (10-250 ppm) determinadas por HPLC Concentración de AFs (μg/g agar) Concentración de OTA (μg/g agar) A. parasiticus A. steynii A. westerdijkiae 106,88 ± 13,14 Control 192,89 ± 12,73 76,58 ± 8,42 91,66 ± 12,10 10 ppm 194,87 ± 10,19 101,64 ± 10,06 89,54 ± 8,05 50 ppm 162,29 ± 8,49 58,55 ± 9,68 85,93 ± 10,22+ 100 ppm 103,63 ± 45,92 9,78 ± 1,98+ 63,05 ± 5,98* 150 ppm 64,09 ± 17,52* 6,80 ± 0,39+ 75,38 ± 9,19* 250 ppm 152,56 ± 15,73 11,17 ± 0,19+ Los resultados son la media de las tres réplicas en cada concentración ± error estándar. Asimismo, se representan los resultados del análisis estadístico indicándose las diferencias con respecto al control: p < 0,05 (+), p < 0,01 (∗). 66 Vol. 21, N.º 3, 2014 Métodos alternativos al control químico de hongos toxígenos y micotoxinas en alimentos Por tanto, los resultados obtenidos indican que de todos los compuestos antioxidantes probados, el único que sería efectivo para prevenir la contaminación por micotoxinas sería la curcumina ya que es capaz de reducir tanto el crecimiento como la capacidad de producción de estos hongos. Otros autores ya habían descrito este efecto en otras especies toxígenas (22,27,28); sin embargo, a pesar de los buenos resultados obtenidos, su aplicación directa en alimentos es poco probable. Un requisito indispensable de cualquier compuesto utilizado en el procesado de alimentos es que mantenga las propiedades organolépticas del mismo (29) y la curcumina presenta unas características (color naranja, olor intenso, etc.) que harían difícil su aplicación en productos alimentarios en la dosis necesaria sin modificar sensiblemente sus propiedades. (Salvia officinalis), lavandín (Lavandula hybrida), espliego (Lavandula latifolia) y salvia española (Salvia lavandulifolia) y su efecto in vitro se evaluó a 4 concentraciones: 10, 100, 500 y 1000 ppm. Todos ellos fueron amablemente suministrados y caracterizados por HPLC por el Dr. Jaime Usano del Centro de Investigación Agraria de Albaladejito, dependiente de la Junta de Castilla-La Mancha. Los resultados obtenidos mostraron efectos muy diferentes entre la especie productora de aflatoxinas y las productoras de OTA. Ninguno de los extractos ensayados afectó de manera consistente al crecimiento de A. parasiticus, así como a su capacidad para producir ninguno de los cuatro tipos de aflatoxinas (B1, B2, G1, G2). Sin embargo, el efecto fue muy significativo en las especies productoras de OTA principalmente en presencia de extractos de salvia española y espliego (Tablas II y III). El extracto de salvia española redujo el crecimiento de A. steynii a las concentraciones más elevadas ensayadas obteniendo porcentajes de reducción del 8 y el 23 % a 500 y 1000 ppm, respectivamente. En la figura 2 (B) se muestra el crecimiento de A. steynii en placas suplementadas con aceite esencial de salvia española. Asimismo, se observó una disminución en la concentración de OTA en el medio en presencia de este aceite esencial con una media de reducción del 75 % entre 100 y 1000 ppm (Tabla II). La presencia de extracto de Salvia lavandulifolia sólo afectó significativamente al crecimiento de A. westerdijkiae a una concentración de 250 ppm (disminución del 14 %) y redujo su capacidad para producir OTA a partir de 100 ppm, observándose valores de reducción de más del 90 % con respecto al control a la concentración más alta ensayada (Tabla II). Como se ha comentado anteriormente, distintos autores habían descrito el efecto antifúngico y antimicotoxígeno de distintos antioxidantes. Sin embargo, en dichos trabajos las concentraciones ensayadas eran extremadamente altas y los efectos se observaban a concentraciones mayores de 250 ppm y, en algunos casos, de hasta 5000 ppm (22,23,25). Se ha comprobado que los antioxidantes utilizados como aditivos alimentarios a concentraciones elevadas son muy tóxicos (30) y, según la normativa vigente no se pueden utilizar en cantidades superiores a 200 ppm (29). Por tanto, las concentraciones necesarias para poder prevenir la contaminación por micotoxinas en los productos alimentarios sería tan elevada que hace que estos compuestos no sean efectivos para su uso como aditivos en la industria alimentaria para este propósito. De igual manera, el aceite esencial de espliego también afectó de manera significativa el crecimiento de A. steynii (11 % de reducción a 500 y 1000 ppm con respecto al control), así como a su capacidad para producir OTA (60 % de reducción a 100 ppm y más del 75 % a una concentración de 500 o 1000 ppm) (Tabla III). Asimismo, la tasa de crecimiento de A. westerdijkiae se redujo en un 10 % en las Extractos naturales de plantas aromáticas Los aceites esenciales de plantas aromáticas seleccionados en este estudio fueron extraídos de salvia oficinal TABLA II Efecto del extracto de salvia española sobre el crecimiento y la producción de OTA de A. westerdijkiae y A. steynii Extracto de salvia española A. steynii A. westerdijkiae Crecimiento OTA Crecimiento OTA Control 7,19 ± 0,09 91,09 ± 14,68 8,42 ± 0,08 55,19 ± 5,49 10 ppm 7,25 ± 0,16 79,45 ± 15,04 8,49 ± 0,02 47,14 ± 6,68 100 ppm 7,13 ± 0,06 19,20 ± 9,65* 8,56 ± 0,03 18,45 ± 7,76 () 500 ppm 6,65 ± 0,06+ 28,26 ± 15,28* 7,37 ± 0,47 6,81 ± 3,79 () 1000 ppm 5,53 ± 0,28 () 30,31 ± 2,99* 7,28 ± 0,26+ 5,19 ± 3,39 () Se muestran los valores de la tasa de crecimiento de los hongos (mm/día) y la concentración de OTA determinada por HPLC (μg/g agar) en presencia de las distintas concentraciones de extracto (0-1000 ppm). Los resultados se corresponden a la media de las tres réplicas ± error estándar. Asimismo, se representan los resultados del análisis estadístico indicándose las diferencias con respecto al control: p < 0,05 (+), p < 0,01 (∗), p < 0,001 (). 67 J. Gil-Serna, et al. ALIM. NUTRI. SALUD TABLA III Efecto del extracto de espliego sobre el crecimiento y la producción de OTA de A. westerdijkiae y A. steynii Extracto de espliego A. steynii A. westerdijkiae Crecimiento OTA Crecimiento OTA Control 7,38 ± 0,24 89,14 ± 13,99 8,65 ± 0,05 49,24 ± 11,62 10 ppm 7,43 ± 0,08 105,13 ± 8,03 8,40 ± 0,10 38,63 ± 8,51 100 ppm 7,29 ± 0,16 32,85 ± 21,03+ 8,11 ± 0,05* 14,35 ± 4,32* 500 ppm 6,55 ± 0,07* 18,26 ± 1,62* 7,56 ± 0,15+ 5,73 ± 1,32* 1000 ppm 6,56 ± 0,16* 20,79 ± 1,61* 7,92 ± 0,50 5,66 ± 5,92* Se muestran los valores de la tasa de crecimiento de los hongos (mm/día) y la concentración de OTA determinada por HPLC (μg/g agar) en presencia de las distintas concentraciones de extracto (0-1000 ppm). Los resultados se corresponden a la media de las tres réplicas ± error estándar. Asimismo, se representan los resultados del análisis estadístico indicándose las diferencias con respecto al control: p < 0,05 (+), p < 0,01 (∗). concentraciones intermedias ensayadas (100 y 500 ppm) aunque fue la producción de OTA el parámetro más afectado por la presencia de este extracto con una reducción del 70 % a 100 ppm y de un 88 % tanto a una concentración de 500 como de 1000 ppm (Tabla III). Los aceites esenciales de salvia oficinal y lavandín no afectaron de manera consistente ni al crecimiento ni a la producción de OTA de A. steynii y A. westerdijkiae y únicamente se obtuvo una pequeña reducción en presencia de algunas concentraciones de extracto de lavandín. Desde hace tiempo se conoce que los aceites esenciales de plantas son inocuos para el medio ambiente y para los consumidores. Muchos de ellos tienen un potente efecto antimicrobiano por lo que podrían ser efectivos para el control de patógenos cuando se usan directamente sobre los alimentos y se han descrito distintos posibles métodos de aplicación (31). Asimismo, otros autores también han demostrado la efectividad de distintos aceites esenciales para controlar el crecimiento fúngico y la capacidad productora de micotoxinas (20,22,24). Los resultados obtenidos en este trabajo señalan a los extractos de salvia española y espliego como potentes antifúngicos y antiocratoxígenos al ser capaces de reducir muy significativamente el crecimiento y la producción de OTA en los dos hongos ensayados, A. steynii y A. westerdijkiae. De esta manera, estos dos extractos podrían ser buenos candidatos para su uso en el control de estos hongos directamente aplicados sobre matrices alimentarias. Sin embargo, el hecho de que ninguno de los aceites esenciales testados tuviera un espectro de actuación capaz de afectar también a especies productoras de aflatoxinas, nos hace planear más estudios en los que se compruebe la aplicación combinada con otros extractos, ya que se ha descrito que la toxicidad de los aceites esenciales frente a hongos se potencia cuando se combinan varios de ellos debido a la acción sinérgica de todos sus componentes (32). Los resultados obtenidos en este estudio son prometedores 68 y podrían indicar que los extractos de plantas podrían ser una buena alternativa a los productos químicos de síntesis para el control de hongos productores de micotoxinas. En este contexto, serán necesarios más estudios para comprobar cuáles serían los métodos de aplicación más adecuados sobre los productos alimentarios para la reducción de la contaminación por micotoxinas. CONTROL BIOLÓGICO El control biológico utilizando microorganismos antagónicos frente a patógenos de plantas se ha estudiado desde hace mucho tiempo y actualmente se considera una aproximación muy prometedora como alternativa al uso de fungicidas para prevenir la formación de micotoxinas (33). Se han propuesto distintos microorganismos que podrían ser aplicados como agentes de biocontrol frente a varias especies de hongos micotoxígenos. Dentro de ellos, las levaduras son los que han dado resultados más interesantes ya que son fáciles de producir y aplicar, son seguras para el medio ambiente y la salud humana, su biología se conoce perfectamente y presentan gran especificidad frente a los patógenos de los que son antagonistas (34). En estudios previos realizados en nuestro grupo, se han ensayado una gran cantidad de especies de levaduras y se han seleccionado distintas cepas con respecto a su capacidad para inhibir el crecimiento de hongos toxígenos lo que las convierte en agentes potenciales para el control biológico (35,36). Dentro de los agentes candidatos, Debaryomyces hansenii CYC 1244 es la que ha ofrecido resultados más prometedores. Se ha comprobado que esta levadura no sólo es capaz de reducir el crecimiento sino también es capaz de interferir en la regulación de la expresión de los genes de la ruta biosintética de OTA y, en consecuencia, Vol. 21, N.º 3, 2014 Métodos alternativos al control químico de hongos toxígenos y micotoxinas en alimentos reducir su producción en A. westerdijkiae (36). Como ya se ha comentado anteriormente, el desarrollo de estrategias de control integrado que, utilizando el mismo agente, permitan reducir la contaminación de varias especies fúngicas a la vez es uno de los principales objetivos de la comunidad científica en los últimos años. Por tanto, los ensayos realizados se han centrado en comprobar el espectro de hongos sobre el cual esta levadura podría tener efecto y comprobar si su presencia modifica la capacidad para crecer y producir micotoxinas de los hongos. En este estudio se realizaron ensayos in vitro para comprobar la respuesta de distintas especies del género Aspergillus a la presencia de D. hansenii CYC 1244. A 25 ml de medio CYA fundido se le añadió 1 ml de una suspensión celular de la levadura seleccionada a una concentración de 105 células/ml y, tras la solidificación, se sembró en el centro de cada placa una suspensión de esporas (106 esporas/ ml) de una cepa de dos especies productoras de OTA: A. steynii y A. westerdijkiae y de dos productoras de aflatoxinas: A. parasiticus y A. flavus. Asimismo, se incluyeron en el ensayo placas control de medio CYA sin levadura. Las placas se incubaron a 28 °C durante 5 días en el caso de A. flavus, 6 días en A. parasiticus y 8 días en A. westerdijkiae y A. steynii. El diámetro alcanzado por la colonia fúngica se midió diariamente para proceder al cálculo de la tasa de crecimiento. Todos los experimentos se llevaron a cabo por triplicado. El último día de incubación se llevó a cabo la extracción de la correspondiente micotoxina del medio y se evaluó su concentración de manera semicuantitativa mediante cromatografía en capa fina (TLC). Todos los datos recogidos se analizaron con los correspondientes test estadísticos. Los resultados en relación a la tasa de crecimiento de las especies seleccionados en presencia de D. hansenii CYC 1244 se muestran en la figura 3. Todos los hongos ensayados redujeron su tasa de crecimiento cuando la levadura estaba incluida en el medio. La disminución con respecto al control en el caso de las especies ocratoxígenas fue de un 20 y 24 % en A. steynii y A. westerdijkiae, respectivamente. En la figura 2 (C), a modo de ejemplo, se detalla el crecimiento de A. steynii en presencia de la levadura. El efecto fue similar en el caso de las especies productoras de aflatoxinas observándose una reducción del 35 % en la tasa de crecimiento en A. flavus y un 32 % en el caso de A. parasiticus. El efecto de la presencia de D. hansenii CYC 1244 sobre la producción de micotoxinas se evaluó de manera semicuantitativa por TLC. Los resultados se muestran en la figura 4. En el caso de las dos especies productoras de OTA, la levadura supuso una reducción casi total de la toxina presente en el medio lo que se deduce por la reducción tan significativa que se produce en el grosor e intensidad de la banda específica de OTA en la cromatografía. Asimismo, la presencia de aflatoxina B1 en los co-cultivos de A. flavus y A. parasiticus con D. hansenii CYC 1244 también supuso una disminución muy considerable con respecto al control. Como se ha comentado anteriormente, las levaduras presentan unas características que las hacen estar considerados como uno de los mejores agentes para el control biológico de hongos patógenos (34). D. hansenii es una levadura usada comúnmente en procesos biotecnológicos y, actualmente, está considerada un microorganismo no patógeno (37). La actividad antagonista de algunas cepas de D. hansenii frente a patógenos fúngicos ha sido estudiada desde hace tiempo y se ha demostrado su eficacia como agentes de biocontrol eficaces en frutas, lácteos y productos cárnicos (38-42). Control + D.h Tasa de crecimiento (mm/día) A. parasiticus 20 16 A. flavus 14 12 10 8 A. steynii 6 4 2 0 Control A. parasiticus +CYC 1244 A. flavus A. westerdijkiae A. westerdijkiae A. steynii Fig. 3. Efecto de la presencia de D. hansenii CYC 1244 sobre el crecimiento de hongos toxígenos. Se representa la tasa de crecimiento de A. parasiticus (naranja), A. flavus (verde), A. westerdijkiae (morado) y A. steynii (azul) en presencia de esta levadura (105 células/mL). Los resultados son la media de las tres réplicas de cada condición y las barras finas representan el error estándar. Asimismo, se representan los resultados del análisis estadístico indicándose las diferencias con respecto al control: p < 0.05 (+), p < 0.01 (∗), p < 0.001 (°). Fig. 4. Efecto de la presencia de D. hansenii CYC 1244 sobre la producción de micotoxinas evaluado mediante cromatografía en capa fina (TLC). Se muestra la detección de aflatoxinas en el caso de A. parasiticus y A. flavus y de OTA en A. steynii y A. westerdijkiae tanto en placas control como suplementadas con D. hansenii CYC 1244 (+D.h.). La reducción en la intensidad y grosor de la banda fluorescente se relaciona con una menor concentración de toxina en el medio. 69 J. Gil-Serna, et al. ALIM. NUTRI. SALUD TABLA IV Resumen de la efectividad de los tratamientos ensayados para reducir el crecimiento y la producción de micotoxinas de A. parasiticus, A. westerdijkiae y A. steynii Efectividad del tratamiento Crecimiento Micotoxinas Observaciones ß-caroteno - - Aumenta crecimiento de A. westerdijkiae Curcumina +++ +++ NAC - - Aumenta crecimiento de A. steynii Quercetina - - Aumenta crecimiento de A. westerdijkiae Vitamina A - - Vitamina C - - Espliego ++ ++ Lavandín - ++ Salvia española ++ ++ Reduce AFG1 en A. parasiticus Salvia oficinal - - Aumenta AFs en A. parasiticus D. hansenii +++ +++ También afecta a A. flavus Antioxidantes Aceites esenciales Biocontrol Aumenta crecimiento de A. steynii Los símbolos indican una reducción estadísticamente significativa en las tres especies (+++), en dos de ellas (++) o ningún efecto (-). En este trabajo se ha comprobado cómo D. hansenii CYC 1244 es un agente de control biológico efectivo in vitro frente a las principales especies toxígenas del género Aspergillus tanto productores de OTA como de aflatoxinas. El hecho de que el mismo agente sea capaz de inhibir el crecimiento fúngico y reducir la concentración de micotoxinas en varias especies la hace una muy buena candidata para su aplicación para el control integrado de hongos toxígenos in vivo. CORRESPONDENCIA: Jéssica Gil-Serna Departamento de Microbiología III Facultad de Biología. Universidad Complutense de Madrid Avda. José Antonio Nováis, n.º 12 28040 Madrid e-mail: jgilsern@ucm.es Bibliografía CONCLUSIÓN La aplicación de métodos de control adecuados es imprescindible para evitar la contaminación por micotoxinas en los alimentos. Los resultados obtenidos en este trabajo indican que algunos aceites esenciales o el control biológico utilizando Debaryomyces hansenii CYC 1244 serían buenos candidatos para el control integrado de hongos toxígenos ya que son capaces de reducir el crecimiento y la producción de micotoxinas en los principales especies del género Aspergillus. Sin embargo, los compuestos antioxidantes no tendrían ningún efecto a las concentraciones adecuadas a las que tendrían que ser aplicados en los alimentos. En la tabla IV, se recoge un resumen de todos los resultados presentados en este artículo● 70 1. Comisión Europea. Reglamento (CE) Nº 1881/2006 de 19 de diciembre de 2006 por el que se fija el contenido máximo de determinados contaminantes en los productos alimenticios. Diario Oficial de la Unión Europea 2006;364:5-24. 2. Comisión Europea. Reglamento (CE) Nº 1126/2007 de 28 de septiembre de 2007 que modifica el Reglamento (CE) Nº 1881/2006 por el que se fija el contenido máximo de determinados contaminantes en los productos alimenticios por lo que se refiere a las toxinas de Fusarium en maíz y los productos del maíz. Diario Oficial de la Unión Europea 2007;255:14-7. 3. Comisión Europea. Reglamento (UE) Nº 105/2010 de 5 de febrero de 2010 que modifica el Reglamento (CE) Nº 1881/2006 por el que se fija el contenido máximo de determinados contaminantes en los productos alimenticios por lo que se refiere a la ocratoxina A. Diario Oficial de la Unión Europea 2010;35:7-8. 4. Comisión Europea. Reglamento (UE) Nº 165/2010 de 26 de febrero de 2010 que modifica, en lo que respecta a las aflatoxinas, el Reglamento (CE) Nº 1881/2006 por el que se Vol. 21, N.º 3, 2014 Métodos alternativos al control químico de hongos toxígenos y micotoxinas en alimentos 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 21. 22. fija el contenido máximo de determinados contaminantes en los productos alimenticios. Diario Oficial de la Unión Europea 2010;50:8-12. Wild CP, Turner PC. The toxicology of aflatoxins as a basis for public health decisions. Mutagenesis 2002;17:471-81. Wilson DM, Mubatanhema W, Jurjevic Z. Biology and ecology of mycotoxigenic Aspergillus species as related to economic and health concerns. Advances in Experimental Medicine and Biology 2002;504:3-17. Miraglia M, Brera C. Assessment of dietary intake of ochratoxin A by the population of EU Member States. Reports on tasks for scientific cooperation 2002; task 3.2.7. Pfohl-Leszkowicz A, Manderville RA. Ochratoxin A: An overview on toxicity and carcinogenicity in animals and humans. Molecular Nutrition and Food Research 2007;51:61-99. Samson RA, Noonim P, Meijer M, Houbraken J, Frisvad JC, Varga J. Diagnostic tools to identify black Aspergilli. Studies in Mycology 2007;59:129-45. Gil-Serna J, Vázquez C, Sardiñas N, González-Jaen MT, Patiño B. Revision of ochratoxin A production capacity by the main species of Aspergillus section Circumdati. Aspergillus steynii revealed as the main risk of OTA contamination. Food Control 2011;22:343-5. De Costa P, Bezerra P, editors. Fungicides: Chemistry, Environmental Impact and Health Effects. EEUU: Nova Biomedical; 2009. McGrath MT. Fungicides and other chemical approaches for use in plant disease control. In: Schaechter M, editor. Encyclopedia of Microbiology. UK: Academic Press; 2009. p. 412-21. Comisión Europea. Reglamento (CE) Nº 396/2005 de 23 de febrero de 2005 relativo a los límites máximos de residuos de plaguicidas en alimentos y piensos de origen vegetal y animal y que modifica la Directiva 91/414/CEE del Consejo. Diario Oficial de la Unión Europea 2005;70:1-16. Comisión Europea. Reglamento (CE) Nº 299/2008 de 11 de marzo de 2008 por el que se modifica el Reglamento (CE) Nº 396/2005, relativo a los límites máximos de residuos de plaguicidas en alimentos y piensos de origen vegetal y animal, por lo que se refiere a las competencias de ejecución atribuidas a la Comisión. Diario Oficial de la Unión Europea 2008;97:67-71. Piqué E, Vargas-Murga L, Gómez-Catalán J, de Lapuente J, Llobet JM. Occurrence of patulin in organic and conventional apple-based food marketed in Catalonia and exposure assessment. Food and Chemical Toxicology 2013 60:199-204. Rubert J, Soriano JM, Mañes J, Soler C. Occurrence of fumonisins in organic and conventional cereal-based products commercialized in France, Germany and Spain. Food and Chemical Toxicology 2013;56:387-391. Serrano AB, Font G, Mañes J, Ferrer E. Emerging Fusarium mycotoxins in organic and conventional pasta collected in Spain. Food and Chemical Toxicology 2013;51:259-66. Vidal A, Marín S, Ramos AJ, Cano-Sancho G, Sanchis V, 2013. Determination of aflatoxins, deoxynivalenol, ochratoxin A and zearalenone in wheat and oat based bran supplements sold in the Spanish market. Food and Chemical toxicology 2013;53:133-8. Prieto JA, Patiño OJ, Plazas EA, Pabón LC, Ávila MC, Guzmán JD, Delgado WA, Cuca LE. Natural products from plants as potential source agents for controlling fusarium. In: Nita M, editor. Fungicides - Showcases of Integrated Plant Disease Management from Around the World. Croacia: Intech; 2013. p. 233-78. Alpsoy L. Inhibitory effect of essential oil on aflatoxins activities. African Journal of Biotechnology 2010;9:2474-81. Da Cruz-Cabral L, Fernández-Pinto V, Patriarca A. Application of plant derived compounds to control fungal spoilage and mycotoxin production in foods. International Journal of Food Microbiology 2013;166:1-14. Dias-Ferreira F, Kemmelmeier C, Arrotéia CC, da Costa CL, Mallmann CA, Janeiro V, et al. Inhibitory effect of the essential oil of Curcuma longa L. and curcumin on aflatoxin produciton by Aspergillus flavus Link. Food Chemistry 2013;136:789-93. 23. Palumbo JD, O’Keeffe TL, Mahoney NE. Inhibition of ochratoxin A production and growth of Aspergillus species by phenolic antioxidant compounds. Mycopathologia 2007;164:241-8. 24. Passone MA, Girardi NS, Etcheverry M. Evaluation of the control ability of five essential oils against Aspergillus section Nigri growth and ochratoxin A accumulation in peanut meal extract agar conditioned at different water activities levels. International Journal of Food Microbiology 2012;159:198-206. 25. Romero SM, Alberto MR, Manca de Nadra MC, Vaamonde G. Inhibition of growth and ochratoxin A biosynthesis in Aspergillus carbonarius by flavonoid and nonflavonoid compounds. Mycotoxin Research 2009;25:165-70. 26. Bragulat MR, Abarca ML, Cabañes FJ. An easy screening method for fungi producing ochratoxin A in pure culture. International Journal of Food Microbiology 2001;71:139-44. 27. Jayashree T, Subramanyam C. Oxidative stress as a prerequisite for aflatoxin production by Aspergillus parasiticus. Free Radical Biology & Medicine 2000;29:981-5. 28. Lee SE, Park BS, Bayman P, Baker JL, Choi WS, Campbell BC. Suppression of ochratoxin biosynthesis by naturally occurring alkaloids. Food Additives and Contaminants 2007;24:391-7. 29. Shahidi F, Zhong Y. Antioxidants: regulatory status. In: Shahidi F, editor. Bailey’s Industrial Oil and Fat Products. UK: John Wiley & Sons; 2005. p. 491-512. 30. Ndhlala AR, Moyo M, Van Staden J. Natural antioxidants: Fascinating or mythical biomolecules? Molecules 2010;15:6905-30. 31. Burt S. Essential oils: Their antibacterial properties and potential applications in foods - a review. International Journal of Food Microbiology 2004;94:223-53. 32. Tripathi P, Dubey NK. Exploitation of natural products as an alternative strategy to control postharvest fungal rotting of fruit and vegetables. Postharvest Biology and Technology 2004;32:235-45. 33. Pal KK, Gardener BM. Biological control of plant pathogens. In: The Plant Health Instructor; 2006. DOI: 10.1094/PHIA2006-1117-02. 34. Pimenta RS, Morais PB, Rosa CA, Correa A. Utilization of yeast in biological control programs. In: Satyanarayana T, Kun G, editors. Yeast biotechnology: Diversity and applications. Germany: Springer; 2009. p. 199-214. 35. Gil-Serna J, Patiño B, González-Jaén MT, Vázquez C. Biocontrol of Aspergillus ochraceus by yeast. In: Mendez-Vilas A, editor. Current Research Topics in Applied Microbiology and Microbial Biotechnology. Singapur: World Scientific; 2009. p. 368-72. 36. Gil-Serna J, Patiño B, Cortés L, González-Jaén MT, Vázquez C. Mechanisms involved in reduction of ochratoxin A produced by Aspergillus westerdijkiae using Debaryomyces hansenii CYC 1244. International Journal of Food Microbiology 2011;151:113-8. 37. Breuer U, Harms H. Debaryomyces hansenii – an extremophilic yeast with biotechnological potential. Yeast 2006;23:415-37. 38. Andrade MJ, Thorsen L, Rodríguez A, Córdoba JJ, Jespersen L. Inhibition of ochratoxigenic moulds by Debaryomyces hansenii strains for biopreservation of dry-cured meat products. International Journal of Food Microbiology 2014;170:70-7. 39. Chalutz E, Wilson CL. Postharvest Biocontrol of Green and Blue Mold and Sour Rot of Citrus Fruit by Debaryomyces hansenii. Plant Disease 1990;74:134-7. 40. Domenech M, Vázquez C, González-Jaén MT, Patiño B. Biocontrol of Penicillium expansum with yeasts. In: Mendez-Vilas, editor. Microorganisms in Industry and Environment. From scientific and industrial research to consumer products. Singapur: World Scientific Publishing; 2010. p. 366-71. 41. Hernández-Montiel LG, Ochoa JL, Troyo-Diéguez E, Larralde-Corona CP. Biocontrol of postharvest blue mold (Penicillium italicum Wehmer) on Mexican lime by marine and citrus Debaryomyces hansenii isolates. Postharvest Biology and Technology 2010;56:181-7. 42. Liu SQ, Tsao M. Biocontrol of dairy moulds by antagonistic dairy yeast Debaryomyces hansenii in yoghurt and cheese at elevated temperatures. Food Control 2009;20:852-5. 71 1136-4815/14/72-81 Alimentacion, Nutricion y Salud Copyright © 2014 Instituto Danone Alim. Nutri. Salud Vol. 21, N.º 3, pp. 72-81, 2014 Oligosacáridos derivados de la lactosa: síntesis, análisis y bioactividad A. Montilla Corredera, N. Corzo Sánchez, F.J. Moreno Andújar, A. Olano Villén, M. Villamiel Guerra Instituto de Investigación en Ciencias de la Alimentación (CIAL) (CSIC-UAM). CEI (UAM+CSIC). Madrid RESUMEN E Abstract T ste artículo de revisión aborda en primer lugar la obtención, análisis y caracterización de una serie de oligosacáridos derivados de la lactosa como los galacto-oligosacáridos (GOS) y los derivados de la lactulosa (OsLu). Igualmente, se describen los efectos beneficiosos más relevantes que pueden ejercer sobre la salud estos oligosacáridos no digeribles, haciendo especial hincapié en aquellos relacionados con el sistema gastrointestinal. Teniendo en cuenta las propiedades físico-químicas y bioactivas que presentan, los oligosacáridos derivados de la lactosa son ingredientes que pueden fácilmente incorporarse a un amplio número de alimentos y/o bebidas funcionales, evidenciando su indudable interés comercial. No obstante, es necesario realizar más estudios que confirmen la estabilidad de estos carbohidratos durante el procesado y conservación, así como las modificaciones organolépticas que puedan producirse una vez añadidos a la matriz alimentaria. his review firstly addresses the production, analysis and characterization of a range of lactose-derived oligosaccharides such as galacto-oligosaccharides (GOS) and oligosaccharides derived from lactulose (OsLu). Secondly, the most relevant beneficial effects exerted by this type of non-digestible oligosaccharides on human health, especially in regard to the gastrointestinal system, are also described. Taking into account their physico-chemical and bioactive properties, lactose-derived oligosaccharides can be easily incorporated as a high-value ingredient into a wide number of functional foods and/or beverages, highlighting their commercial importance. However, it is necessary to carry out further studies on the stability of these oligosaccharides under the processing conditions and applied storage, as well as on the potential organoleptic modifications produced by their addition to real food products. Palabras clave: Transgalactosilación. Análisis de carbohidratos. Galactooligosacáridos. Oligosacáridos derivados de la lactulosa. Bioactividad. Efecto prebiótico. Key words: Transgalactosylation. Carbohydrate analysis. Galactooligosaccharides. Oligosaccharides derived from lactulose. Bioactivity. Prebiotic effect. INTRODUCCIÓN La mayor parte de los alimentos que tomamos habitualmente se digieren en el estómago y en el intestino delgado mediante la intervención de diversas enzimas. Algunos ingredientes no se digieren o lo hacen parcialmente y pasan al colon, donde son sometidos a la acción de la microbiota intestinal. Los denominados carbohidratos prebióticos son oligosacáridos que llegan inalterados al colon y estimulan selectivamente el crecimiento de un número limitado de microorganismos considerados beneficiosos para la salud, fundamentalmente lactobacilos y bifidobacterias. Desde que en 1995 Gibson y Roberfroid (1) introdujeron el concepto de prebiótico, han sido numerosos los 72 estudios realizados en los que se demuestran los beneficios que aportan para la salud (2) y, por ello, han adquirido gran popularidad entre los consumidores, aumentando de modo constante su producción mundial (3). De la gran variedad de carbohidratos que se están considerando como potenciales prebióticos, la inulina, los fructooligosacáridos (FOS), la lactulosa y los galactooligosacáridos (GOS) son los primeros reconocidos como tales debido al gran número y solidez de los trabajos cientifícos que existen sobre ellos (4-7). Los GOS son oligosacáridos derivados de la lactosa que se encuentran presentes de forma natural en la leche materna a muy bajas concentraciones (del orden de ppm). Los GOS, al igual que los FOS, son reconocidos legalmente en la Unión Europea como ingredientes alimentarios y no como aditivos, como GRAS en EE. UU. y como FOSHU en Vol. 21, N.º 3, 2014 Oligosacáridos derivados de la lactosa: síntesis, análisis y bioactividad Japón (8). Su incorporación en fórmulas maternizadas, de larga tradición en Japón y más reciente y menos frecuente en Europa, ha permitido imitar los efectos de la leche humana en la microbiota de los lactantes. Los GOS pueden obtenerse por transgalactosilación enzimática a partir de la lactosa presente, por ejemplo, en el permeado procedente del suero, subproducto muy abundante de la industria quesera. Por ello, la obtención de oligosacáridos prebióticos semejantes a los presentes en la leche humana constituye un método atractivo y eficaz de aprovechamiento del suero, muy estudiado en los últimos años. Además, recientemente se ha propuesto que los GOS así obtenidos pueden posteriormente isomerizarse originándose oligosacáridos derivados de la lactulosa (OsLu), con propiedades bioactivas mejoradas respecto a los GOS y a la propia lactulosa (9,10). El presente artículo pretende revisar los principales métodos de obtención y análisis de GOS, OsLu y otros oligosacáridos derivados de la lactosa, así como los principales efectos beneficiosos que, para la salud del consumidor, pueden tener estos ingredientes con el fin de disponer de información actualizada que contribuya a ampliar y diversificar sus aplicaciones en la industria alimentaria. SÍNTESIS DE OLIGOSACÁRIDOS DERIVADOS DE La LACTOSA Y la LACTULOSA Los GOS son derivados galactosilados de la lactosa que pueden obtenerse mediante reacciones de transgalactosilación catalizadas por b-galactosidasas (EC 3.2.1.23) de diversos orígenes (levaduras, hongos y bacterias) durante la hidrólisis de la lactosa. Un esquema del mecanismo general se muestra en la figura 1. Los oligosacáridos formados se convierten, a su vez, en sustratos para la enzima y son lentamente hidrolizados o actúan como aceptores de nuevas moléculas de galactosa. La importancia de ambas reacciones va a depender, en gran medida, de la concentración de sustrato, a mayor concentración, mayor formación de GOS y a menor concentración, mayor porcentaje de hidrólisis. Los productos así obtenidos son mezclas complejas de GOS con enlaces b(1→3), b(1→4) y b(1→6) y un grado de polimerización entre 2 y 8, dependiendo de las condiciones de reacción (concentración de sustrato y enzima, temperatura, tiempo, pH) y de la fuente de la enzima. En estas mezclas los trisacáridos son los principales productos de reacción, siendo la 6’-galactosil lactosa y la 4’-galactosil lactosa los compuestos mayoritarios (11,12). Además, también pueden originarse cantidades importantes de disacáridos, siendo la alolactosa (6-O-b-D-galactopiranosil-D-glucosa) el que se forma en mayores concentraciones (13). Aunque la lactulosa es un conocido derivado de la lactosa con múltiples beneficios para la salud (14), su utilización como sustrato para la síntesis de oligosacáridos no ha sido abordada hasta hace pocos años (15). La b-galactosidasa tiene la capacidad de hidrolizar la lactulosa y transferir el residuo galactosil a la galactosa de otra molécula de lactulosa. Como ocurre en el caso de la transgalactosilación de la lactosa, la galactosa liberada se une por enlaces b(1→6), b(1→3) o b(1→4) originándose los correspondientes OsLu. Los estudios de Martínez-Villaluenga y cols. (15) y Cardelle-Cobas y cols. (16) han puesto de manifiesto que los principales OsLu que se originan utilizando enzimas de Aspergillus aculeatus, A. oryzae y Kluyveromyces lactis son la 6’-galactosil lactulosa y la 1-galactosil lactulosa. Dado que los GOS son carbohidratos reductores, los OsLu pueden también formarse por isomerización química de aquellos, utilizando aluminato sódico como catalizador, al convertirse las aldosas en los correspondientes ceto-azúcares (17). Otros oligosacáridos derivados de la lactosa también pueden obtenerse vía transglicosilación catalizada por glicosiltransferasas empleando diferentes glicosil o fructosil donadores, como la sacarosa, y la lactosa como aceptor. Este método ha permitido la obtención de lactosacarosa, trisacárido producido de la transferencia de un residuo fructosilo de la sacarosa a la lactosa, reacción catalizada por b-fructofuranosidasas (EC 3.2.1.26) o levansacarasas (EC 2.4.1.10) (18,19). De modo similar, la 2-a-D-glucopiranosil-lactosa se produce utilizando dextransacarasa (EC 2.4.1.5) que transfiere la glucosa de la sacarosa a la lactosa mediante un enlace a(1→2) (20). ANÁLISIS Y CARACTERIZACIÓN DE OLIGOSACÁRIDOS Fig. 1. Esquema del mecanismo general de hidrólisis y transgalactosilación enzimática de carbohidratos. Tal y como se ha indicado anteriormente, los productos obtenidos tras las reacciones de transglicosilación suelen comprender una mezcla compleja de carbohidratos que hay que analizar y caracterizar de forma exhaustiva, dada la necesidad de información detallada sobre la composición de los ingre- 73 A. Montilla Corredera, et al. dientes alimentarios que exige la Autoridad Europea de Seguridad Alimentaria o European Food Safety Authority (EFSA) para el reconocimiento de las propiedades funcionales que se demandan. Por ello, en los últimos años ha habido numerosos estudios sobre este tema, en los que se han empleado tanto técnicas cromatográficas y espectrométricas clásicas como otras combinadas más avanzadas (9). Dado que las reacciones de transglicosilación de la lactosa pueden realizarse en diferentes condiciones, con distintos enzimas y distintos aceptores o donantes, nuevos derivados de la lactosa están continuamente aislándose y caracterizándose. Aunque los di- y trisacáridos han sido, en general, bien caracterizados, las estructuras químicas de oligosacáridos de mayor peso molecular presentan mayores dificultades analíticas y aún no han sido investigadas en detalle (9). Técnicas cromatográficas para el análisis de carbohidratos Debido a la gran variedad y similitud estructural de los carbohidratos, para su análisis es necesario el uso de técnicas de alto poder de resolución, tales como las cromatográficas. Entre las principales técnicas analíticas que se emplean actualmente, la cromatografía de gases (GC) y la cromatografía líquida de alta resolución (HPLC) son las ALIM. NUTRI. SALUD más utilizadas. También, aunque más raramente utilizada, la electroforesis capilar (CE) proporciona un análisis de alta resolución de mezclas heterogéneas de oligosacáridos, como los GOS. En este caso los carbohidratos se derivatizan previamente para detectarse, posteriormente, mediante radiación UV o fluorescencia inducida por láser (21,22). El análisis mediante GC de estos oligosacáridos implica también una derivatización previa convirtiéndolos en sus derivados volátiles, sin embargo la GC es ampliamente utilizada para el análisis de carbohidratos debido a su rapidez, simplicidad y su relativo bajo coste. Se trata de una técnica de alto poder resolutivo, sensibilidad y selectividad que, acoplada a un detector simple y casi universal como el de ionización de llama (FID), permite la cuantificación de oligosacáridos en alimentos presentes en baja concentración (23). Esta técnica se ha utilizado para el análisis de los GOS presentes en leches comerciales sin lactosa (24) (Fig. 2), los carbohidratos formados en permeado de suero isomerizado con cáscara de huevo y posteriormente transgalactosilado (12), así como para comprobar la pureza de la kojibiosa obtenida en un proceso biotecnológico eficaz y económico que utiliza sacarosa y lactosa como materias primas (25,26). En el caso de la determinación de carbohidratos mediante HPLC, las muestras pueden analizarse directamente sin derivatización previa. Además, el desarrollo durante las últimas décadas de un gran número de materiales y de fases estacio- Fig. 2. Perfil cromatográfico (GC-FID) de los trimetilsilil derivados de los carbohidratos presentes en una leche con lactosa hidrolizada. Cromatograma completo: galactosa (picos 1), glucosa (picos 2) y patrón interno (P.I., β-fenilglucósido). (A) Disacáridos: lactosa (picos 3), alolactosa (picos 4), 6-galactobiosa (pico 5). (B) Trisacáridos: 4’-galactosil-lactosa (pico 6), 6’-galactosil-lactosa (picos 7).*Disacáridos y **trisacáridos no identificados. 74 Vol. 21, N.º 3, 2014 Oligosacáridos derivados de la lactosa: síntesis, análisis y bioactividad narias para trabajar en diferentes modos de separación ha permitido que esta técnica sea la más extendida para el análisis de oligosacáridos prebióticos (9). La técnica de HPLC con detección por índice de refracción (RID) ha sido muy utilizada para la determinación de derivados de la lactosa por ser sencilla, rápida y económica (27), sin embargo presenta una baja sensibilidad, selectividad y resolución, siendo especialmente adecuada para el análisis de mezclas no muy complejas. La cromatografía de alta eficacia de intercambio aniónico con detección amperométrica de pulsos (HPAEC-PAD) es una de las técnicas más empleadas en el análisis de carbohidratos prebióticos por su alta resolución y sensibilidad, tal y como se ha puesto de manifiesto recientemente en el análisis de las mezclas obtenidas en la síntesis de 2-a-D-glucopiranosil-lactosa (28). Existe, por tanto, en la bibliografía un número elevado de trabajos en los que se ha empleado HPAEC-PAD en el análisis de GOS y OsLu (13,15,16,29,30). Recientemente, también se ha utilizado la cromatografía de interacción hidrofílica (HILIC), que utiliza fases estacionarias hidrofílicas y fases móviles hidrofóbicas, para el análisis de oligosacáridos de leche humana (31) y de diferentes GOS comerciales (32). Fraccionamiento de carbohidratos Debido a que en las reacciones enzimáticas se obtienen mezclas muy complejas de carbohidratos, con una elevada concentración de mono- y disacáridos sin propiedades prebióticas y con alto poder calórico, en muchas ocasiones es necesario un paso adicional para su fraccionamiento. La finalidad de esta etapa puede ser la obtención de productos comerciales enriquecidos en oligosacáridos prebióticos u obtener compuestos aislados para proceder a una posterior caracterización. En el primer caso, si se pretende obtener grandes cantidades de oligosacáridos para una aplicación industrial, la filtración por membrana y más concretamente la nanofiltración puede ser la técnica de elección (33,34), o tratamientos microbiológicos, con levaduras, como en el nuevo proceso de obtención de kojibiosa que posibilita su uso como ingrediente alimentario (25,26). Aunque también se han estudiado tecnologías emergentes tales como la extracción con fluidos presurizados (35) o con fluidos supercríticos (36). Sin embargo, si el fraccionamiento es previo a la caracterización se pueden utilizar distintos métodos de separación (carbón activo, HILIC, RP-HPLC, SEC) que permiten obtener compuestos casi puros, lo que posibilita en gran medida la caracterización de los mismos (34). elucidar de forma exacta dicha estructura. Para dicho fin se han utilizado diferentes técnicas como cristalografía por rayos X, espectroscopía infrarroja y Raman o microscopía electrónica; sin embargo, la espectroscopía de masas (MS) y la resonancia magnética nuclear (NMR) son las más empleadas. Los métodos basados en el análisis por MS proporcionan una mayor sensibilidad que los de NMR y son preferidos cuando existe limitación en la cantidad de muestra, aunque la NMR es más adecuada para nuevos compuestos y para el estudio de procesos dinámicos, ya que se puede determinar la estructura a nivel atómico (9). Ambas técnicas espectroscópicas pueden acoplarse a las de separación cromatográfica antes referidas, pudiéndose desarrollar métodos muy potentes para el análisis estructural de los carbohidratos. Espectromería de masas (MS). Hay una gran variedad de técnicas aplicables al análisis de carbohidratos dependiendo de la técnica de separación, los modos de ionización y el/los analizadores de masas acoplados. La fuente de ionización normalmente acoplada a GC es la de impacto electrónico (EI) con un analizador cuadrupolo (Q). Esta técnica proporciona información cualitativa de gran interés, aunque al ser moléculas muy semejantes los perfiles de fragmentación son muy similares, encontrándose las mayores diferencias en la intensidad de algunos fragmentos (m/z); estos datos facilitan información acerca del tamaño del anillo y los enlaces glicosídicos (37). Hernández y cols. (38) utilizaron GC-MS para el análisis de los carbohidratos presentes en el Vivinal®GOS. Más recientemente se han analizado de forma exhaustiva los OsLu formados mediante la transgalactosilación de la lactulosa con 3 β-galactosidasas comerciales (39). También se ha utilizado GC-MS para confirmar la identidad y pureza de la kojibiosa obtenida por un nuevo proceso biotecnológico (26). La fuente de ionización más ampliamente utilizada con cromatografía líquida es la ionización por electronebulización (ESI), acoplada a distintos analizadores de masa, cuadrupolo (Q), de tiempo de vuelo (TOF), de trampa de iones (IT), entre otros, y sistemas múltiples con combinación de estos y otros analizadores (MSn). Mediante la técnica HPLC-ESI-Q se determinó la presencia hasta de hexasacáridos en OsLu obtenidos utilizando una β-galactosidasa de A. oryzae (39). Pero para obtener mayor información estructural se necesita fragmentaciones adicionales, como en el análisis de distintos GOS comerciales por HILIC-ESI(+)-MSn, con una IT como analizador de masas, que permitió determinar los enlaces glicosídicos según los distintos fragmentos característicos formados y su abundancia (32). Caracterización estructural de carbohidratos Otra fuente de ionización muy utilizada es la de desorción/ ionización por láser asistida por una matriz (MALDI). Mediante MALDI-TOF se pudo determinar, en una fracción enriquecida en oligosacáridos de los OsLu obtenidos a partir de Duphalac® y una β-galactosidasa de A. oryzae, la presencia de compuestos con grado de polimerización de hasta 8 (40). Dada la estrecha relación que existe entre las características estructurales de los carbohidratos (composición monomérica, enlace glicosídico, grado de polimerización) y sus propiedades funcionales resulta de gran importancia En los últimos años, estas técnicas multidimensionales acopladas están posibilitando la caracterización de un gran número de compuestos presentes en distintas mezclas de GOS (41), así como de oligosacáridos de leche humana, que presentan estructuras mucho más complejas (42). 75 A. Montilla Corredera, et al. Espectroscopía de resonancia magnética nuclear (NMR). Esta técnica se utiliza habitualmente para la caracterización completa de los nuevos oligosacáridos obtenidos en los distintos procesos biotecnológicos, pero es necesario aislarlos con un alto grado de pureza. Para la caracterización se obtienen normalmente los espectros mononucleares 1D de carbono (13C) y de protón (1H) y los heteronucleares 2D (COSY, TOCSY, NOESY, HSQC). Esta técnica ha posibilitado en los últimos años la elucidación completa de la estructura de diversos derivados de la lactosa (28-30) y de la lactulosa (15,27). BIOACTIVIDAD DE LOS OLIGOSACÁRIDOS DERIVADOS DE la LACTOSA Y la LACTULOSA Como se ha comentado en la introducción, durante los últimos años se ha prestado especial atención a los ingredientes prebióticos debido al efecto beneficioso que ejercen sobre la microbiota intestinal. Entre los diferentes prebióticos reconocidos, los GOS constituyen una adecuada elección para ser incorporados a diferentes tipos de alimentos siendo las fórmulas infantiles unos de los más destacados (43). Existe un gran número de estudios científicos que avalan los beneficios de los GOS sobre la salud humana (44). Los dos mecanismos más importantes relacionados con el efecto de los GOS en el hospedador son los siguientes (45,46): 1. Estimulación del crecimiento de bacterias beneficiosas en el colon tales como lactobacilos y bifidobacterias. 2. Producción de ácidos grasos de cadena corta (AGCC; acetato, propionato, butirato) durante la fermentación de los carbohidratos. Estos productos del metabolismo de las bacterias pueden ejercer su efecto beneficioso en el intestino y se pueden absorber produciendo otros efectos deseables. Los efectos positivos de los GOS se han revisado extensamente en la literatura en los últimos años, pero se conoce mucho menos sobre los beneficios de oligosacáridos recientemente descritos tales como los OsLu. Dada su similitud desde el punto de vista estructural, es presumible que ambos tipos de compuestos presenten propiedades bioactivas similares, que podrían ser mejoradas en los OsLu al tener como núcleo estructural a la lactulosa, de reconocido carácter prebiótico, en vez de la lactosa. A continuación se describen los principales efectos de ambos tipos de oligosacáridos sobre la salud humana. ALIM. NUTRI. SALUD requisitos primordiales para que un compuesto sea considerado como prebiótico (47,48). Respecto a la digestibilidad de los OsLu, Hernández-Hernández y cols. (49) pusieron de manifiesto en ratas una mayor resistencia a la digestión gastrointestinal y a la absorción en el intestino delgado de los OsLu en comparación con los GOS, debido probablemente al enlace b(1→4) entre la galactosa y la fructosa en los primeros. Efecto prebiótico Como ya se ha dicho, un prebiótico es un ingrediente que es selectivamente fermentado y origina cambios en la composición y/o en la actividad de la microbiota intestinal, lo cual beneficia a la salud y al bienestar del individuo (4,45). Existe un gran número de estudios, incluyendo los de intervención con humanos, que demuestran el efecto prebiótico de los GOS, tal y como han revisado muy recientemente Moreno y cols. (9). Aunque de forma menos extensa, también se ha estudiado el efecto prebiótico de los OsLu, tanto en ensayos in vitro con cultivos puros (50), con muestras fecales humanas (51,52), como in vivo con animales (53). Estos estudios han puesto de manifiesto que los nuevos OsLu pueden constituir una alternativa como prebióticos al disacárido de origen, la lactulosa, y también a los GOS. Actualmente, se encuentran en curso ensayos de intervención en humanos para establecer definitivamente las propiedades prebióticas de los OsLu. Absorción de minerales Varias investigaciones en animales y en humanos han puesto de manifiesto la capacidad de los GOS para mejorar la absorción de minerales, principalmente Ca, tras su fermentación en el colon. Una de las explicaciones plausibles es la bajada del pH que se origina, por la mayor formación de AGCC, mejorando la solubilidad de los minerales y su absorción a través de las células epiteliales del intestino grueso. Otro de los posibles mecanismos está relacionado con el incremento de la superficie disponible para la absorción, debido a la proliferación de las células epiteliales (9). Recientemente, Takasugi y cols. (54) han encontrado que la combinación de leche fermentada y GOS mejora en ratas la absorción de Ca, Fe y Zn y disminuye la excreción urinaria del P. También en humanos, concretamente en mujeres adolescentes sanas, se ha visto una mayor absorción de Ca tras la ingestión diaria durante tres semanas de 5 g de GOS incorporados a bebidas refrescantes (55). Digestibilidad Diferentes ensayos in vitro e in vivo, tanto con animales como con humanos, han demostrado que los GOS son estables a la digestión enzimática y llegan mayoritariamente al colon donde son fermentados, cumpliendo así uno de los 76 Efecto frente a patógenos Los prebióticos pueden interferir en la unión de patógenos a la superficie de las células epiteliales del intestino Vol. 21, N.º 3, 2014 Oligosacáridos derivados de la lactosa: síntesis, análisis y bioactividad mediante diferentes mecanismos de acción (56), tal y como se muestra en la Figura 3. Tzortzis y cols. (57), en un ensayo in vitro con Bimuno® GOS, mostraron una fuerte inhibición de la adhesión de Escherichia coli y Salmonella enterica serotipo Typhimurium a células HT29. Shoaf y cols. (58), en células Hep-2 y Caco-2, encontraron una mayor capacidad antiadherente frente a E. coli E2348/69 en el caso de los GOS, en comparación con FOS, inulina, lactulosa y rafinosa. En líneas celulares humanas Hep-2, también se ha visto la capacidad antiadherente de los GOS frente a Cronobacter sakazakii, un patógeno oportunista implicado en infecciones graves en neonatos (59). Drakoularakou y cols. (60), en un estudio con 159 voluntarios sanos, evaluaron la capacidad de Bimuno® GOS para reducir la diarrea del viajero, debido probablemente a la inhibición de la adhesión del patógeno a la mucosa intestinal. Estudios con ratas con pancreatitis demostraron un efecto positivo al administrar GOS por vía enteral, ya que se mantenía la función de la barrera intestinal debido a una estimulación de la IgA secretora de la mucosa (61). En un ensayo clínico con personas mayores sanas se evidenció que el consumo de Bimuno ® GOS provocaba una disminución en la secreción de citoquinas proinflamatorias, un incremento en la secreción de citoquinas anti-inflamatorias IL-10 y una mejora de la actividad en las células NK (62). La administración conjunta de GOS/ FOS/pectinoligosacáridos, POS (15-20 g/día) ha demostrado que mejora la actividad citolítica de las células NK y reduce la respuesta inmune en individuos adultos infectados con HIV-1 (63). En relación a los OsLu, sólo existe un estudio llevado a cabo in vitro con células Caco-2 y HT29-MTX en el que se comprobó un incremento de las citoquinas anti-inflamatorias IL-6 y IL-10 y una reducción de los factores TNF-a, IL-1b (64). Modulación del sistema inmune Los microorganismos intestinales y los AGCC que se producen durante el metabolismo sacarolítico pueden afectar positivamente al sistema inmune y proteger frente a enfermedades inflamatorias. Durante la fermentación de los GOS, el butirato y el propionato producidos pueden participar en varios mecanismos relacionados con la modulación de la respuesta inmune tales como la estimulación de apoptosis y la regulación de la producción de citoquinas, entre otros (46). Efecto sobre las alergias Durante los últimos años se ha observado en los países desarrollados un incremento en la incidencia de enfermedades alérgicas, atribuyéndose, entre otros factores, a un menor contacto con los microorganismos desde la infancia. Por los estudios realizados se ha comprobado que los niños alérgicos presentan menor número de bifidobacterias y lactobacilos, por tanto es de suponer que el consumo de Fig. 3. Esquema de los diferentes mecanismos de acción de los carbohidratos prebióticos frente a microorganismos patógenos. Figura modificada y basada en Steed y Macfarlane (56). 77 A. Montilla Corredera, et al. prebióticos puede mejorar el estado de su microbiota intestinal y, por lo tanto, de las enfermedades de tipo alérgico. Los efectos de los prebióticos sobre las alergias se han estudiado tanto en ensayos con animales como en humanos. La administración de fórmulas infantiles con una mezcla de GOS/FOS (8 g/L) durante los primeros 6 meses de vida provocó, no sólo un efecto bifidogénico, sino también una disminución de la incidencia de dermatitis atópica en bebés y de diversas infecciones, encontrándose una disminución en los niveles de IgG1, IgG2, IgG3 e IgE (65-66). En otro estudio, realizado también con niños, se observó que el consumo de fórmulas infantiles con una mezcla de GOS/FOS/POS (8 g/L) ejercía un efecto preventivo sobre el desarrollo de dermatitis atópica e infecciones del tracto respiratorio, disminuyendo el número de tratamientos con antibióticos (67). Efecto sobre el metabolismo lipídico y la obesidad El continuo aumento del número de personas obesas y los efectos negativos que pueden llegar a originarse en la salud humana como consecuencia de la obesidad es uno de los temas de mayor preocupación, tanto de las autoridades sanitarias como de los consumidores. Durante los últimos años, la obesidad se ha asociado con la alteración en la expresión de genes y de rutas metabólicas, así como con cambios en la microbiota intestinal tales como la reducción de la diversidad bacteriana. Dados los efectos positivos de los GOS sobre la microbiota intestinal, se ha planteado que la administración de estos oligosacáridos podría ejercer ciertos efectos que modificaran parámetros relacionados con la obesidad. Aunque este efecto no está totalmente clarificado y ha sido uno de los menos estudiados, se ha visto recientemente que la administración de Vivinal® GOS durante tres semanas a ratas jóvenes macho mostró una reducción de grasa e incrementó la expresión génica de péptidos relacionados con la saciedad (68). También, en individuos con sobrepeso y con síndrome metabólico, el consumo de GOS disminuyó los niveles de colesterol total y triglicéridos, mientras que los niveles de colesterol LDL y HDL no se vieron afectados (69). Aplicaciones Las aplicaciones de los GOS han sido ampliamente revisadas en los últimos años (46,70) y vienen determinadas por sus propiedades físico-químicas que, a la vez, dependen de su estructura química. Como se ha indicado anteriormente la estructura variará según las condiciones en las que tiene lugar la reacción de transgalactosilación (origen de la enzima, concentración de sustrato y enzima, pH, temperatura, tiempo). Los GOS poseen las mismas propiedades físico-químicas que el resto de oligosacáridos por lo que 78 ALIM. NUTRI. SALUD pueden incorporarse a numerosas matrices alimentarias. En general, la solubilidad, osmolalidad, capacidad de formar cristales, poder edulcorante y reactividad disminuyen al aumentar el tamaño de la cadena. Son menos solubles en agua, menos dulces y tienen menor poder calórico que la sacarosa (71). Comparándolos con los mono- y disacáridos el mayor peso molecular da lugar a un incremento en la viscosidad mejorando el cuerpo y la palatabilidad del producto (72). Otra característica muy importante para su aplicación es que son estables a las condiciones de temperatura y pH utilizados en el procesado de alimentos (tratamientos térmicos, horneado, deshidratación, etc.) (73). Los GOS y, teóricamente los OsLu, pueden incorporarse a leches fermentadas, yogur, zumos y otras bebidas ácidas, barras de cereales, productos de panadería y repostería, derivados cárnicos, sopas, salsas, complementos nutricionales, fórmulas infantiles y alimentos para mascotas. Además, en otros sectores como los relacionados con farmacia y cosmética también pueden emplearse, por ejemplo, en formulaciones para la piel. Conclusiones/Tendencias futuras A pesar de los numerosos trabajos existentes relacionados con la síntesis de carbohidratos bioactivos derivados de la lactosa, es preciso seguir avanzando en el conocimiento de nuevas estrategias que permitan la obtención a gran escala de nuevos oligosacáridos que sean utilizados como ingredientes funcionales en los alimentos. El constante avance de técnicas analíticas robustas contribuirá a la elucidación de las nuevas estructuras sintetizadas para poder establecer en cada caso el binomio estructura-función. En este sentido, es preciso servirse de ensayos no sólo in vitro o con animales, sino también realizar estudios de intervención en humanos para esclarecer, con suficiente evidencia científica, las propiedades bioactivas que se les atribuyen, de forma que puedan ser reconocidas por las autoridades alimentarias. En el desarrollo de nuevos oligosacáridos bioactivos no debe olvidarse tampoco su aplicación directa a alimentos, que va a venir determinada por las propiedades físico-químicas de los mismos. Se requiere de más estudios que confirmen la estabilidad de estos carbohidratos durante el procesado y la conservación, así como sobre las modificaciones organolépticas que pueden producirse cuando estos ingredientes funcionales sean incorporados a los alimentos. Agradecimientos Este trabajo ha sido financiado por los proyectos de investigación AGL2011-27884 del Ministerio de Economía y Competitividad, y ALIBIRD 2009/AGR-1469 de la Comunidad de Madrid● Vol. 21, N.º 3, 2014 Oligosacáridos derivados de la lactosa: síntesis, análisis y bioactividad CORRESPONDENCIA: F. Javier Moreno Andújar Instituto de Investigación en Ciencias de la Alimentación, CIAL (CSIC-UAM) C/ Nicolás Cabrera, 9 Campus de la Universidad Autónoma de Madrid 28049 Madrid e-mail: javier.moreno@csic.es 17. 18. 19. 20. BIBLIOGRAFÍA 1. Gibson GR, Roberfroid MB. Dietary modulation of the human colonic microbiota: introducing the concept of prebiotics. J Nutr 1995;125:1401–12. 2. Di Bartolomeo F, Startek JB, Van den Ende W. Prebiotics to fight Diseases: Reality or fiction. Phytother Res 2013;27:1457–73. 3. Saad N, Delattre C, Urdaci, M, Schmitter M, Bressollier P. An overview of the last advances in probiotic and prebiotic field. LWT - Food Sci Technol 2013;50:1-16. 4. Gibson G R, Probert HM, Loo JV, Rastall RA, Roberfroid MB. Dietary modulation of the human colonic microbiota: updating the concept of prebiotics. Nutr Res Rev 2004;17:259-75. 5. Macfarlane GT, Steed H, Macfarlane S. Bacterial metabolism and health-related effects of galacto-oligosaccharides and other prebiotics. J Appl Microbiol 2008;104:305-44. 6. Rastall R A. Functional Oligosaccharides: Application and manufacture Annu Rev Food Sci Technol 2010;1:305-39. 7. Watson D, Motherway MO, Schoterman MHC, van Neerven RJJ, Nauta A, van Sinderen D. Selective carbohydrate utilization by lactobacilli and bifidobacteria. J Appl Microb 2013;114:1132-46. 8. Tzortzis G, Vulevic J. Galacto-oligosaccharide prebiotics. En Prebiotics and Probiotics. Science and Technology. Charabampopoulos D, Rastall RA (Eds.) Springer (New York). XXIV, 1265p, 2009. 9. Moreno FJ, Montilla A, Villamiel M, Corzo N, Olano A. Analysis, structural characterization and bioactivity of oligosaccharides derived from lactose. Electrophoresis 2014;1519-34. 10. Villamiel M, Montilla A, Olano A, Corzo N. Production and bioactivity of oligosaccharides derived from lactose. En Food Oligosaccharides: Production, Analysis and Bioactivity. Moreno FJ, Sanz ML (Eds.). Wiley-Blackwell (Chichester, Reino Unido), 2014. p. 137-67. 11. Cardelle-Cobas A, Villamiel M, Olano A, Corzo N. Study of galacto-oligosaccharide formation from lactose using Pectinex-Ultra SP-L. J Sci Food Agric 2008;88:954-61. 12. Corzo-Martínez M, Copoví P, Olano A, Moreno FJ, Montilla A. Synthesis of prebiotic carbohydrates derived from cheese whey permeate by a combined process of isomerisation and transgalactosylation. J Sci Food Agric 2013;93:1591-97. 13. Martínez-Villaluenga C, Cardelle-Cobas A, Corzo N, Olano A, Villamiel M. Optimization of conditions for galactooligosaccharide synthesis during lactose hydrolysis by b-galactosidase from Kluyveromyces lactis (Lactozym 3000 L HP G). Food Chem 2008;107:258-64. 14. Olano A, Corzo N. Lactulose as a Food ingredient. J Sci Food Agric 2009;89:1987-90. 15. Martínez-Villaluenga C, Cardelle-Cobas A, Olano A, Corzo N, Villamiel M, Jimeno ML. Enzymatic synthesis and identification of two trisaccharides produced from lactulose by transgalactosylation. J Agric Food Chem 2008;56:557-63. 16. Cardelle-Cobas A, Martínez-Villaluenga C, Villamiel M, Olano A, Corzo N. Synthesis of oligosaccharides derived 21. 22. 23. 24. 25. 26. 27. 28. 29. 30. 31. 32. 33. 34. from lactulose and Pectinex Ultra SP-L. J Agric Food Chem 2008;56:3328-33. Cardelle-Cobas A, Corzo N, Villamiel M, Olano A. Isomerization of lactose-derived oligosaccharides: A case study using sodium aluminate. J Agric Food Chem 2008;56:10954-59. Fujita K, Hara K, Hashimoto H, Kitahata S. Transfructosylation catalyzed by β-fructofuranosidase I from Arthrobacter sp. K-l. Agric Biol Chem 1990;54:2655-61. Park NH, Choi HJ, Oh DK. Lactosucrose production by various microorganisms harbouring levansucrase activity. Biotechnol Lett 2005;27:495-97. Bailey RW, Barker SA, Bourne EJ, Stacey M. Enzymic synthesis of a branched trisaccharide. Nature, 1955;176:1164-65. Splechtna B, Nguyen TH, Steinbock M, Kulbe KD, Lorenz W, Haltrich D. Production of prebiotic galacto-oligosaccharides from lactose using beta-galactosidases from Lactobacillus reuteri. J Agric Food Chem 2006;54:4999-06. Albrecht S, Schols HA, Klarenbeek B, Voragen AGJ, Gruppen H. Introducing Capillary Electrophoresis with Laser-Induced Fluorescence (CE-LIF) as a Potential Analysis and Quantification Tool for Galactooligosaccharides Extracted from Complex Food Matrices. J Agric Food Chem 2010;58:2787-94. Montilla A, van de Lagemaat J, Olano A, del Castillo MD. Determination of oligosaccharides by conventional high-resolution gas chromatography. Chromatographia 2006;63:453-8. Ruiz-Matute AI, Corzo-Martínez M, Montilla A, Olano A, Copoví P, Corzo N. Presence of mono-, di- and galactooligosaccharides in commercial lactose-free UHT dairy products. J Food Comp Anal 2012;28:164-9. Díez-Municio M, Moreno FJ, Herrero M, Montilla A. Procedimiento de síntesis de kojibiosa y su aplicación en la elaboración de composiciones alimentarias y farmaceúticas. 2013; Patente Española P201331333. Díez-Municio M, Montilla A, Moreno FJ, Herrero M. A sustainable biotechnological process for the efficient synthesis of kojibiose. Green Chem 2014;16:2219-26. Díez-Municio M, Herrero M, Jimeno ML, Olano A, Moreno FJ. Efficient synthesis and characterization of lactulosucrose by Leuconostoc mesenteroides B-512F Dextransucrase. J Agric Food Chem 2012;60:10564-71. Díez-Municio M, Montilla A, Jimeno ML, Corzo N, Olano A, Moreno FJ. Synthesis and characterization of a potential prebiotic trisaccharide from cheese whey permeate and sucrose by Leuconostoc mesenteroides dextransucrase. J Agric Food Chem 2012;60:1945–53. Rodríguez-Colinas B, Abreu MA, Fernández-Arrojo L, Beer R, Poveda A, Jiménez-Barbero J, Haltrich D, Ballesteros AO, Fernández-Lobato M, Plou FJ. Production of Galacto-oligosaccharides by the beta-galactosidase from Kluyveromyces lactis: Comparative analysis of permeabilized cells versus soluble enzyme. J Agric Food Chem 2011;59:10477-84. Rodríguez-Colinas B, Poveda A, Jiménez-Barbero J, Ballesteros AO, Plou F J. Galacto-oligosaccharide synthesis from lactose solution or skim milk using the beta-galactosidase from Bacillus circulans. J Agric Food Chem 2012;60:6391-8. Ruhaak LR, Lebrilla CB. Advances in analysis of human milk oligosaccharides. Advan Nutr 2012;3:406-14. Hernández-Hernández O, Calvillo I, Lebrón-Aguilar R, Moreno FJ, Sanz ML. Hydrophilic interaction liquid chromatography coupled to mass spectrometry for the characterization of prebiotic galactooligosaccharides. J Chromatogr A. 2012;1220:57-67. Sanz ML, Ruiz-Matute AI, Corzo N, Martínez-Castro I. Analysis of prebiotic oligosaccharides. En Prebiotics and Probiotics. Science and Technology. Charabampopoulos D, Rastall RA (Eds.) Springer (New York), 2009. p. 465-534. Moreno FJ, Carrero-Carralero C, Hernández-Hernández O, Sanz ML. Fractionation of food bioactive oligosaccharides. En 79 A. Montilla Corredera, et al. 35. 36. 37. 38. 39. 40. 41. 42. 43. 44. 45. 46. 47. 48. 49. 50. 51. 80 Food Oligosaccharides: Production, Analysis and Bioactivity. Moreno FJ, Sanz ML (Eds.), Wiley-Blackwell (Chichester, Reino Unido), 2014. p. 255-83. Ruiz-Matute AI, Sanz ML, Corzo N, Martin-Alvarez PJ, Ibanez E, Martinez-Castro I, Olano A. Purification of lactulose from mixtures with lactose using pressurized liquid extraction with ethanol-water at different temperatures. J Agric Food Chem 2007;55:3346–50. Montañes F, Fornari T, Olano A, Ibanez E. Isolation of prebiotic carbohydrates by supercritical fluid extraction. Scaling-up and economical feasibility. J Chromatogr A 2012;1250:92–8. Sanz ML, Sanz J, Martinez-Castro I. Characterization of O-trimethylsilyl oximes of disaccharides by gas chromatography-mass spectrometry. Chromatographia 2002;56:617–22. Hernandez O, Ruiz-Matute AI, Olano A, Moreno FJ, Sanz ML. Comparison of fractionation techniques to obtain prebiotic galactooligosaccharides. Int Dairy J 2009;19:531-6. Hernandez O, Montañes F, Clemente A, Moreno, FJ, Sanz ML. Characterization of galactooligosaccharides derived from lactulose. J Chromatogr A 2011;1218:7691–6. Anadón A, Martínez MA, Ares I, Castellano V, Martínez-Larrañaga MR, Corzo N, Olano A, Montilla A, Recio I, Martínez-Maqueda D, Miralles B, Fornari T, García-Risco MR, Gonzalez M, Reglero G. Acute and repeated dose (28 days) oral safety studies of ALIBIRD in rats. J Food Protect 2013;76:1226-39. Barboza M, Sela DA, Pirim C, Locascio RG, Freeman SL, German JB, Mills DA, Lebrilla CB. Glycoprofiling bifidobacterial consumption of galacto-oligosaccharides by mass spectrometry reveals strain-specific, preferential consumption of glycans. App Environ Microbiol 2009;75:7319-25. Bao Y, Chen C, Newburg DS. Quantification of neutral human milk oligosaccharides by graphitic carbon high-performance liquid chromatography with tandem mass spectrometry. Anal Biochem 2013;433:28-35. Cilla A, Lacomba R, García-Llatas G, Alegría A. Prebiotics and nucleotides in infant nutrition; review of the evidence. Nutrición Hospitalaria 2012;27:1037-48. Roberfroid M, Gibson GR, Hoyles L, McCartney AL, Rastall R, Rowland I, Wolvers D, Watzl B, Szajewska H, Stahl B, Guarner F, Respondek F, Whelan K, Coxam V, Davicco MJ, Léotoing L, Wittrant Y, Delzenne NM, Cani PD, Neyrinck AM, Meheust A. Prebiotic effects: metabolic and health benefits. Brit J Nutr 2010;104:S1-63. Sangwan V, Tomar SK, Singh RR, Singh AK, Ali B. Galactooligosaccharides: novel components of designer foods. J Food Sci 2011;76:R103-11. Barile D, Rastall RA. Human milk and related oligosaccharides as prebiotics. Curr Opin Biotech 2013;24:214-9. Ohtsuka K, Tsuji K, Nakagawa Y, Ueda H, Ozawa O, Uchida T, Ichikawa T. Availability of 4’galactosyllactose (O-β-D-galactopyranosyl-(1-4)- O-β-D-galactopyranosyl-(1-4)-D-glucopyranose) in rat. J Nutr Sci Vitaminol 1990;36:265-76. Torres DPM, Gonçalves MPF, Teixeira JA., Rodrigues LR. Galacto-oligosaccharides: production, properties, applications, and significance as prebiotics. Compr Rev Food Sci Food Saf 2010;9:438-54. Hernández-Hernández O, Marín-Manzano MC, Rubio LA, Moreno FJ, Sanz ML, Clemente A. Monomer and linkage type of galacto-oligosaccharides affect their resistance to ileal digestion and prebiotic properties in rats. J Nutr 2012;142:1232-9. Cardelle-Cobas A, Corzo N, Olano A, Peláez C, Requena T, Ávila M. Galactooligosaccharides derived from lactose and lactulose: influence of structure on Lactobacillus, Streptococcus and Bifidobacterium growth. Int J Food Microbiol 2011;149:81-7. Cardelle-Cobas A, Fernández M, Salazar N, Martínez-Villaluenga C, Villamiel M, Ruas-Madiedo P, de los Reyes-Ga- ALIM. NUTRI. SALUD 52. 53. 54. 55. 56. 57. 58. 59. 60. 61. 62. 63. 64. vilán CG. Bifidogenic effect and stimulation of short chain fatty acid production in human faecal slurry cultures by oligosaccharides derived from lactose and lactulose. J Dairy Res 2009;76:317-25. Cardelle-Cobas A, Olano A, Corzo N, Villamiel M, Collins M, Kolida S, Rastall RA. In vitro fermentation of lactulose-derived oligosaccharides by mixed fecal microbiota. J Agric Food Chem 2012;60:2024-32. Marín-Manzano MC, Abecia L, Hernández-Hernández O, Sanz ML, Montilla A, Olano A, Rubio LA, Moreno FJ, Clemente A. Galacto-oligosaccharides derived from lactulose exert a selective stimulation on the growth of Bifidobacterium animalis in the large intestine of growing rats. J Agric Food Chem 2013;61:7560−7. Takasugi S, Ashida K, Maruyama S, Matsukiyo Y, Kaneko T, Yamaji T. A combination of a dairy product fermented by lactobacilli and galactooligosaccharides shows additive effects on mineral balances in growing rats with hypochlorhydria induced by a proton pump inhibitor. Biol Trace Elem Res 2013;153:309-18. Whisner CM, Martin BR, Schoterman MH, Nakatsu CH, McCabe LD, McCabe GP, Wastney ME, van den Heuvel EG, Weaver CM. Galacto-oligosaccharides increase calcium absorption and gut bifidobacteria in young girls: a double-blind cross-over trial. Brit J Nutr 2013;110:1292-303. Steed H, Macfarlane S. Mechanisms of prebiotic impact on health. En Prebiotics and Probiotics. Science and Technology. Charabampopoulos D, Rastall RA (Eds.) Springer (New York), 2009. p. 135-61. Tzortzis G, Goulas AK, Gee JM, Gibson GR. A novel galactooligosaccharide mixture increases the bifidobacterial population numbers in a continuous in vitro fermentation system and in the proximal colonic contents of pigs in vivo. J Nutr 2005;135:1726-31. Shoaf K, Mulvey GL, Armstrong GD, Hutkins RW. Prebiotic galactooligosaccharides reduce adherence of enteropathogenic Escherichia coli to tissue culture cells. Infect Immun 2006;74:6920-8. Quintero M, Maldonado M, Pérez-Muñoz ME, Jiménez R, Fangman T, Wittke A, Rusell M, Hutkins R. Adherence Inhibition of Cronobacter sakazakii to Intestinal Epithelial Cells by Prebiotic Oligosaccharides. Curr Microbiol 2011;62:1448-54. Drakoularakou A, Tzortzis G, Rastall RA, Gibson GR. A double-blind, placebo-controlled, randomized human study assessing the capacity of a novel galacto-oligosaccharide mixture in reducing travellers’ diarrhoea. Eur J Clin Nutr 2010;64;14652. Zhong Y, Cai D, Cai W, Geng S, Chen L, Han T. Protective effect of galactooligosaccharide-supplemented enteral nutrition on intestinal barrier function in rats with severe acute pancreatitis. Clin Nutr 2009;28:575-80. Vulevic J, Drakoularakou A, Yaqoob P, Tzortzis G, Gibson GR, Modulation of the fecal microflora profile and immune function by a novel trans-galactooligosaccharide mixture (B-GOS) in healthy elderly volunteers. Am J Clin Nutr 2008;88:1438-46. Gori A, Rizzardini G, van’t Land B, Amor KB, van Schaik J, Torti C, Quirino T, Tincati C, Bandera A, Knol J, Benlhassan-Chahour K, Trabattoni D, Bray D, Vriesema A, Welling G, Garssen J, Clerici M. Specific prebiotics modulate gut microbiota and immune activation in HAART-naive HIV-infected adults: results of the “COPA” pilot randomized trial. Mucosal Immunol 2011;4-5:554-63. Clemente A, Hernández-Hernández O, Laparra M, Montilla A, Moreno FJ, Olano A, Ruiz L, Sanz ML, Sanz Y. Galacto-oligosacáridos derivados de lactulosa multifuncionales con actividad inmunomoduladora y prebiótica. 2011;Patente Española P201130784. Vol. 21, N.º 3, 2014 Oligosacáridos derivados de la lactosa: síntesis, análisis y bioactividad 65. Arslanoglu S, Moro GE, Boehm G. Early supplementation of prebiotic oligosaccharides protects formula-fed infants against infections during the first 6 months of life. J Nutr 2007;137:2420-4. 66. Arslanoglu S, Moro GE, Schmitt J, Tandoi L, Rizzardi S, Boehm G. Early dietary intervention with a mixture of prebiotic oligosaccharides reduces the incidence of allergic manifestations and infections during the first two years of life. J Nutr 2008;138:1091-5. 67. Grüber C, van Stuijvenberg M, Mosca F, Moro G, Chirico G, Braegger CP, Riedler J, Boehm G, Wahn U, Reduced occurrence of early atopic dermatitis because of immunoactive prebiotics among low-atopy-risk infants. J Allergy Clin Immunol 2010;126:791–7. 68. Overduin J, Schoterman MHC, Calame W, Schonewille AJ, Ten Bruggencate SJM. Dietary galacto-oligosaccharides and calcium: effects on energy intake, fat-pad weight and satiety-related, gastrointestinal hormones in rats. British J Nutr 2013;109:1338-48. 69. Vulevic J, Juric A, Tzorzis G, Gibson G. Mixture of trans-Galactooligosaccharides Reduces Markers of Metabolic Syndrome and Modulates the Fecal Microbiota and Immune Function of Overweight Adults. J Nutr 2013;143:324-31. 70. Lamsal BP. Production, health aspects and potential food uses of dairy prebiotic galactooligosaccharides. J Sci Food Agric 2012;92:2020-8. 71. Roberfroid M, Slavin J. Nondigestible oligosaccharides: Crit Rev Food Sci Nutr 2000;40:461-80. 72. Crittenden RG, Playne MJ. Production, properties and applications of food-grade oligosaccharides. Trends Food Sci Tech 1996;7;353-61. 73. Van Leusen E, Torringa E, Groenink P, Kortleve P, Geene R, Schoterman M, Klarenbeek B. Industrial applications of galactooligosaccharides. En Food Oligosaccharides: Production, Analysis and Bioactivity. Moreno FJ, Sanz ML (Eds.), Wiley-Blackwell (Chichester, Reino Unido), 2014. p. 470-91. 81 1136-4815/14/82-87 Alimentacion, Nutricion y Salud Copyright © 2014 Instituto Danone Alim. Nutri. Salud Vol. 21, N.º 3, pp. 82-87, 2014 Niveles de mercurio en pescado azul. Potenciales riesgos de su consumo y recomendaciones en mujeres embarazadas E. Conde Puertas1, E. Conde Puertas2, I. Hernández Herrerías2 Hospital Materno Infantil Virgen de las Nieves. Granada. Hospital La Inmaculada. Huércal-Overa, Almería 1 2 RESUMEN E Abstract I n los últimos años se ha creado cierto debate en relación a los beneficios y riesgos del consumo de algunos tipos de pescado azul debido a la presencia de metilmercurio como contaminante habitual en este, dando lugar a confusión en cuanto a la cantidad o las especies de pescado que pueden ser consumidas durante el embarazo y la infancia. Distintos organismos internacionales han establecido recomendaciones a este respecto, restringiendo especies predadoras como el atún y pez espada. Es fundamental una educación sanitaria adecuada para evitar la exposición al metilmercurio a través del consumo materno de pescado que podría poner en riesgo el óptimo desarrollo de los niños. n recent years there has been discussion in relation to the benefits and risks of fish consumption, due to the usual presence of methylmercury as contaminant in it, resulting in confusion about the amount or fish species that can be consumed in pregnancy and childhood. Different international organizations have established recommendations about fish intake, limiting the consumption of predatory species such as tuna and swordfish. A proper health education is essential to avoid exposure to methylmercury through maternal fish consumption, which could be harmful to the optimal development of the child. Palabras clave: Embarazo. Metilmercurio. Consumo de pescado. Neurodesarrollo. AGPI omega 3. Key words: Pregnancy. Methilmercury. Fish consumption. Neurodevelopment. Omega 3 PUFA. INTRODUCCIÓN La gestación y lactancia son periodos en los cuales una adecuada nutrición es excepcionalmente importante para la salud materna y el óptimo desarrollo del feto y neonato. El consumo de pescado, particularmente el pescado azul, es fundamental debido, entre otras razones, a que constituye el principal aporte en ácidos grasos poliinsaturados omega 3. Sin embargo hay que considerar la exposición al mercurio, contaminante habitual en algunos tipos de pescado azul, presente en su mayor parte en forma de metilmercurio (MeHg), un compuesto orgánico del mercurio que constituye la forma más tóxica, habiéndose demostrado su potencial perjuicio en el neurodesarrollo. Los beneficios y riesgos para la salud de la ingesta de pescado pueden variar en función de la especie, tamaño, así como la cantidad consumida. Las agencias 82 internacionales y nacionales de seguridad alimentaria han desarrollado recomendaciones de consumo de pescado dirigidas a mujeres embarazadas y población infantil para evitar una sobreexposición al mercurio que podría poner en riesgo el óptimo desarrollo de los niños. OBJETIVOS El objetivo de este trabajo es describir los posibles riesgos derivados del consumo de algunas especies de pescado azul con niveles elevados de mercurio durante el embarazo, así como exponer las recomendaciones de consumo de pescado de distintas agencias de seguridad alimentaria dirigidas a la población gestante. Vol. 21, N.º 3, 2014 niveles de mercurio en pescado azul. potenciales riesgos de su consumo y recomendaciones en mujeres embarazadas MATERIAL Y MÉTODO Se llevó a cabo una revisión bibliográfica de la literatura científica existente en las bases de datos PubMed, Tripdatabase y Scopus con las palabras clave: “pregnancy”, “fish consumption”, “methilmercury”, “neurodevelopment”, “omega 3 PUFA”. Así mismo se revisaron las recomendaciones de distintos organismos internacionales de alimentación y seguridad alimentaria. RESULTADOS Formas de mercurio en el medio ambiente y fuentes El mercurio es un metal pesado que se encuentra en el medio ambiente en diferentes formas, entre las que destaca el metilmercurio, un catión organometálico de fórmula química (CH3Hg)+, debido a sus características toxicocinéticas perjudiciales para el organismo humano. Aparece en el ambiente producto de la contaminación por fuentes naturales o antropogénicas, produciéndose también en el medio acuático por vía enzimática y mediante la acción microbiana (1), siendo particularmente preocupante por su capacidad de bioacumulación en peces y mamíferos marinos. Hoy, los niveles de mercurio en la atmósfera son entre 3 y 6 veces superiores a los niveles anteriores a la industrialización (2). El metilmercurio como contaminante del pescado La principal fuente de exposición al metilmercurio en el hombre es la ingesta de pescado y marisco contaminado, tanto de agua dulce como salada y algunos mamíferos marinos. La mayor parte de las concentraciones de mercurio total en los peces se encuentra en forma de metilmercurio (cerca de 100 % en los peces más viejos) (1,3). Los mayores niveles se encuentran en las especies más grandes, que viven más tiempo y las especies predadoras, como el tiburón, pez espada, tintorera o lucio. Algunas especies de atún pueden contener también altos niveles. En el atún en conserva, los niveles suelen ser más bajos que en atún fresco, debido principalmente a la especie o porque se utilizan peces de menor tamaño (4). Los límites máximos de contenido de mercurio en productos de pesca están regulados en la Unión Europea, fijándose el contenido máximo de mercurio en 1 mg/kg (o μg/g) de peso fresco para atún, bonito atlántico, pez espada y tiburón y 0,5 mg/kg (o μg/g) de peso fresco para el marisco (5). Sin embargo numerosos estudios han analizado el contenido de mercurio total y metilmercurio en distintas especies de consumo humano, demostrando concentraciones promedio en ocasiones, mayores a las permitidas (6-9). Toxicidad del metilmercurio Los efectos tóxicos del mercurio, inorgánico y orgánico, se deben a que se unen a los constituyentes orgánicos celulares ricos en grupos sulfhidrilo y afectan así a diversos sistemas metabólicos y enzimáticos de la célula, siendo el sistema nervioso el blanco fundamental de su toxicidad. Se acumula en mayor proporción en el hígado y cerebro. Por su liposolubilidad, los compuestos orgánicos atraviesan fácilmente la barrera hematoencefálica y la placenta. La eliminación se efectúa principalmente por heces y de forma secundaria por la orina, cabellos y leche materna (3). La principal vía de exposición humana es la gastrointestinal a través del consumo de pescados y mariscos. Las mujeres embarazadas, lactantes y niños tienen ciertas características que los transforman en grupos de población más vulnerables (4,10). La toxicidad del mercurio se conoce debido a la enfermedad de Minamata, ciudad japonesa donde tuvo lugar un brote de envenenamiento por metilmercurio en los años 50 debido a la ingesta de pescado y marisco contaminado por los vertidos de una empresa petroquímica, con numerosas víctimas y afectos de problemas neurológicos. Además, madres que no presentaban ningún síntoma dieron a luz niños gravemente afectados (11,12). Sin embargo, la exposición a grandes dosis es rara hoy en día, por lo que la principal preocupación consiste en los posibles efectos neurotóxicos de la exposición crónica al MeHg. Existe evidencia convincente de que la exposición al metilmercurio durante el desarrollo del feto, debido al consumo materno de pescado durante el embarazo, está asociada con consecuencias en el desarrollo neurológico en lactantes y niños de corta edad (10). Incluso se ha sugerido que la ingesta de una sola ración de pescado con gran contenido en mercurio durante un periodo crítico del embarazo, como el periodo embrionario, puede poner en riesgo al feto en desarrollo (13). Los estudios mencionados con mayor frecuencia respecto a la neurotoxicidad crónica asociada al MeHg, son los estudios realizados en las islas Feroe y Nueva Zelanda que confirmaron un efecto neurotóxico tras la exposición intrauterina al MeHg secundaria a la ingesta de pescado contaminado (14-16). Numerosos estudios adicionales de exposición dietética informaron de efectos adversos en el desarrollo neurológico de los niños tras la exposición crónica al MeHg (17-21). En los últimos años han aparecido nuevos estudios que han evaluado la relación de la exposición prenatal al mercurio y el desarrollo cognitivo durante la infancia, en poblaciones con un consumo variable de pescado. Sin embargo, los resultados obtenidos han sido motivo de controversia, encontrándose resultados dispares (10). En nuestro país, el proyecto INMA (Infancia y Medio Ambiente) ha proporcionado información sobre los niveles de exposición prenatal al mercurio de 1.800 recién nacidos, 83 E. conde puertas et al presentando un 24 % niveles superiores a los recomendados por la OMS y un 64 % por encima de la recomendación de la Agencia de Protección Ambiental de Estados. Sin embargo, no se encontró asociación entre la exposición prenatal al mercurio y efectos adversos en el desarrollo mental y psicomotor al segundo año de vida (22). Según el estudio Dermocophes, la presencia de mercurio en el organismo de las mujeres españolas es más de seis veces superior a la media de 17 países europeos (23). Varios gobiernos y organizaciones han estimado la ingesta semanal tolerable o niveles de referencia para la exposición al metilmercurio que no tiene efectos adversos para la salud. La relación entre las concentraciones del mercurio que se encuentra en el cabello de la madre, así como en la sangre del cordón umbilical, y las concentraciones de metilmercurio en la dieta están relativamente bien descritas, por lo que es posible estimar los niveles en la dieta humana considerados seguros. Basándose en las intoxicaciones por ingesta de mercurio, el Comité mixto de expertos en aditivos alimentarios (JECFA), concluyó que un nivel mínimo de riesgo estaría asociado con una exposición de 200 μg/l de mercurio en sangre o 50 μg/g en pelo, estimándose una ingesta semanal tolerable provisional (ISTP) de 3,3 μg/kg de peso corporal. El Comité JECFA en 2003 consideró que las mujeres embarazadas, las que tengan intención de estarlo y lactantes podrían presentar mayor riesgo, tomando en cuenta nuevos datos de los estudios epidemiológicos realizados, entre otros, en las islas Faroe. Por ello revisó la ISTP y la redujo a 1,6 μg/ kg peso corporal para poder proteger al feto en desarrollo. En 2012, la Autoridad Europea de Seguridad Alimentaria (EFSA) publicó una nueva opinión científica sobre los riesgos para la salud pública relacionados con la presencia de mercurio y metilmercurio en los alimentos y redujo la ISTP a 1,3 μg/kg de peso corporal (24). La regulación del contenido de mercurio en los productos pesqueros parece no ser una medida suficiente ya que, por ejemplo, el consumo de una vez a la semana de un depredador como el pez espada, con gran contenido en mercurio, bastaría para sobrepasar los límites tolerables por la Agencia de Alimentos y Medicamentos (FDA) y el Comité Mixto de Expertos en Aditivos Alimentarios (JECFA) (25). Consumo de pescado durante el embarazo: beneficios y riesgos España se sitúa en los primeros puestos en el consumo mundial de productos pesqueros. Este alimento posee indudables ventajas: es apto para todas las edades, su consumo contribuye a prevenir enfermedades y su aporte calórico es, en general, moderado. El consumo de pescado, particularmente el pescado azul, es fundamental debido entre otros, a que constituye el principal aporte en ácidos grasos poliinsaturados (AGPI) omega 3, entre los que destaca el ácido docosahexaenoico (DHA) por sus efectos demostrados en el desarrollo tempra- 84 ALIM. NUTRI. SALUD no. En este grupo se incluyen el salmón, sardinas, caballa, arenque, trucha, pez espada y atún, ya sea fresco, congelado o en conserva (4). El DHA es un ácido graso al que se le atribuyen múltiples funciones, siendo esencial durante la gestación y lactancia para el óptimo desarrollo y función del sistema nervioso central (26-28). Así estudios epidemiológicos han relacionado baja ingesta materna de DHA con incremento del riesgo de pobre desarrollo neuronal en niños (29). Los niños pretérmino alimentados con fórmulas con DHA presentan mayor agudeza visual comparada con un grupo control (30,31). Se ha demostrado que los niños alimentados con leche materna (rica en DHA) tienen un mejor desarrollo cognitivo comparados con los alimentados con fórmula (32). También la suplementación de las madres lactantes con DHA ha evidenciado tener resultados positivos a nivel cognitivo (33,34). En el estudio ALSPAC se encontró una asociación entre el consumo menor de 340 g/semana de pescado con un mayor riesgo de bajo percentil de coeficiente de inteligencia verbal en los niños. Asimismo, se encontró asociación entre baja ingesta de pescado y resultados subóptimos en comportamiento psicosocial, motricidad, comunicación y puntuaciones del desarrollo social (35). Sin embargo, en el balance entre beneficios y riesgos del consumo de pescado, encontramos los posibles riesgos derivados de la presencia de contaminantes en el pescado azul de gran tamaño como el metilmercurio (4,36). Algunos estudios han evaluado los riesgos y beneficios de la ingesta de pescado durante el embarazo y lactancia en relación al DHA y metilmercurio (37,38) de modo que se ha sugerido que el beneficio por el incremento materno en el consumo de pescado, puede ser mayor si la mujer escoge pescado azul bajo en metilmercurio (39). Por otro lado evitar un moderado consumo de pescado atendiendo a confusas alertas sobre los riesgos y beneficios, podría resultar en un exceso de muertes atribuibles a enfermedad coronaria y un subóptimo neurodesarrollo de los niños (40). Recomendaciones sobre ingesta de pescado Diferentes organismos y autoridades a nivel internacional han establecido recomendaciones sobre la ingesta de pescado como parte de una dieta equilibrada y para asegurar el aporte de AGPI omega 3 como el DHA, limitando aquellas especies con alto contenido en mercurio. En un informe conjunto publicado en 2004 por el Comité Asesor Científico de Alimentación (SACN) y el Comité de Toxicidad (COT) de Reino Unido se recomendó “tomar al menos 2 porciones de pescado semanalmente, una de las cuales debe ser azul” (4). La guía de alimentación saludable de la sociedad española de nutrición comunitaria (SECN) establece la recomendación general para la población adulta de consumo de 3-4 raciones de pescado por semana (41). Vol. 21, N.º 3, 2014 niveles de mercurio en pescado azul. potenciales riesgos de su consumo y recomendaciones en mujeres embarazadas Puesto que el consumo de pescado es la ruta de exposición al metilmercurio dominante en las poblaciones humanas, se aconseja un cambio en los hábitos alimenticios para limitar el consumo de pescado, donde los niveles de mercurio son altos. En la tabla I se resumen las recomendaciones de distintos organismos de Seguridad Alimentaria. Las recomendaciones se centran, además de en mujeres embarazadas, en aquellas que tienen intención de estarlo o las que están amamantando. También se incluyen los niños en las primeras etapas de la infancia. En términos generales se recomienda no consumir las especies que presentan contenidos altos de mercurio, como son el pez espada, el tiburón y el atún rojo, y en caso de hacerlo, restringir su consumo a una ración semanal/quincenal, evitando a su vez el consumo de otros tipos de pescado en ese periodo. El consumo de atún en lata no se desaconseja, pero se restringe en alguna de las recomendaciones (10). CONCLUSIONES El pescado es un alimento esencial en la dieta con beneficios demostrados en el neurodesarrollo gracias a su contenido en AGPI. Sin embargo el metilmercurio, contaminante habitual de algunos tipos de pescado azul, actúa en sentido contrario. Distintos organismos de seguridad alimentaria a nivel internacional han establecido recomendaciones de consumo de pescado, restringiendo el consumo de especies con altos niveles de mercurio, aunque con cierta variabilidad a la hora de definir tanto las especies restringidas, porciones de consumo o grupos de riesgo. Sería por tanto conveniente, además de unificarlas y reforzarlas, integrar en las misma estrategia los aspectos positivos de una dieta equilibrada y la necesidad de realizar un consumo adecuado de pescado azul y blanco y señalar las especies de pescado azul predador que deberían estar restringidas, fomentando el consumo de pescado azul de pequeño tamaño. Para que Tabla I Recomendaciones de organismos internacionales Entidad organismo AFSSA FDA Comisión Europea AESAN SACN/COT Recomendación Embarazadas, lactantes o con intención de procrear: consumo de pescado dos porciones por semana. Evitar el consumo de pescado contaminado (pez espada, tiburón y aguja, lamprea). Limitar el consumo de pescado salvaje depredador a 150 g por semana (rape, atún, bonito, emperador, fletán, aguja-marlín, anguila, pez espada, capellán, gallo, lucio y palometa, entre otros) Niños < 30 meses: evitar el consumo de pescado contaminado (pez espada, tiburón y aguja, lamprea). Limitar el consumo a 60 g por semana de rape, atún, bonito, emperador, fletán, marlín, anguila, pez espada, capellán, gallo, lucio y palometa, entre otros Embarazadas, lactantes o con intención de procrear: consumir dos porciones por semana de una variedad de pescados con niveles bajos de mercurio: gambas, atún claro en lata, salmón, pez gato y abadejo. Si se consume atún blanco (Albacora), limitar el consumo a una ración semanal de las dos señaladas. Tener cuidado con el consumo de pescado capturado en lagos o ríos del entorno. Reducir su consumo a una ración semanal Niños: las mismas recomendaciones, pero con raciones acordes a la edad Embarazadas, lactantes o en edad de procrear, niños/as: una porción (< 100 g) por semana de pescado grande predador: pez espada, tiburón, marlín y lucio. Si se consume dicha ración no deberá consumirse más pescado durante ese periodo. Tampoco deberá consumirse atún más de dos veces por semana Mujeres embarazadas o que puedan llegar a estarlo o en periodo de lactancia: evitar el consumo de pez espada, tiburón, atún rojo (Thunnus thynnus): especie grande, normalmente consumida en fresco o congelada y fileteada) y lucio Niños < 3 años: evitar el consumo de pez espada, tiburón, atún rojo (Thunnus thynnus): especie grande, normalmente consumida en fresco o congelada y fileteada) y lucio Niños 3-12 años: limitar a 50 g/semana o 100 g/ 2 semanas (no consumir ningún otro de los pescados de esta categoría en la misma semana) Evitar el consumo de pescados como tiburón, pez espada o aguja, límite cuatro raciones de atún enlatado o dos raciones de atún fresco (raciones de alrededor de 140 g). AFSSA: Agencia Francesa de Seguridad Alimentaria (42); FDA: Agencia de Alimentos y Medicamentos (43); Comision Europea para la Seguridad Alimentaria (44); AESAN: Agencia Española de Seguridad Alimentaria (45); SACN/COT: Comité Asesor Científico de Alimentación (SACN) y Comité de Toxicidad (COT) de Reino Unido (4). 85 E. conde puertas et al dicha información llegue de forma adecuada a la población diana sin crear confusión ni alarma es fundamental una adecuada educación sanitaria con una estrategia de comunicación clara y comprensible. Finalmente, es fundamental considerar la calidad de los peces de nuestro país y fomentar políticas para lograr disminuir las concentraciones de mercurio presentes en el pescado y medio ambiente● ALIM. NUTRI. SALUD 14. 15. 16. 17. CORRESPONDENCIA: Elena Conde Puertas Servicio de Pediatría Hospital Materno Infantil Virgen de las Nieves Calle Ribera del Beiro, s/n 18014 Granada e-mail: esthercpu@gmail.com 18. 19. 20. BIBLIOGRAFÍA 1. Programa de las Naciones Unidas para el Medio Ambiente, 2002. Evaluación mundial sobre el mercurio. Disponible en: www.unep.org/hazardoussubstances.com 2. Cooperación técnica entre Brasil, Bolivia y Colombia: teoría y práctica para el fortalecimiento de la vigilancia de salud de poblaciones expuestas a mercurio. OPS/OMS, 2011. 3. Environmental Protection Agency & Food and Drug Administration. Disponible en: http://www.fda.gov/food/foodsafety/ product-specificinformation 4. Scientific Advisory Committee on Nutrition (SACN) and Committee on Toxicity (COT). Advice on fish consumption: benefits and risks. TSO, London 2004. 5. Reglamento 629/2008 de la Comisión Europea del 2 de Julio de 2008. Disponible en: http://www.aesan.msc.es/AESAN/ web/legislacion/subdetalle/metales_pesados.shtml 6. Marcano V, Troconis A. Evaluación del contenido de mercurio en el pescado expendido en la ciudad de Mérida, Venezuela. Rev Ecol Lat Am 2001;8(2):15-24. 7. Gomes A, Vieira V, Veiga C, Teixeira R, Santana F. Total mercury in the night shark, Carcharhinus signatus in the western equatorial Atlantic ocean. Brazilian. Archives of Biology and Technology 2004;47(4):629-34. 8. Dewailly E, Rouja P. Balancing the risks and benefits of local fish consumption in Bermuda. Unité de recherché en santé publique du CHUL (CHUK)Québec, Canada/ Department of Conservation Services-Government of Bermuda; 2008. 9. Storelli MM, Stuffler RG, Marcotrigiano GO. Food Addit Contam. Total and methylmercury residues in tuna-fish from the Mediterranean sea. 2002;19(8):715-20. 10. Llop S, Ibarlucea J, Sunyer J, Ballester F. Estado actual sobre la exposición alimentaria al mercurio durante el embarazo y la infancia, y recomendaciones en salud pública. Gac Sanit. 2013. Disponible en: http://dx.doi.org/10.1016/j.gaceta.2012.09.002. 11. Karada M. Congenital minamata disease: intrauterine methylmercury poisoning. Teratology 1978;18:285-8. 12. ETO, K. Minamata disease. Neuropathology 2000;20:14-9. 13. Herreros MA, Iñigo-Núñez S, Sánchez-Pérez E, Encinas T, González-Bulnes A. Contribution of fish consumption to heavy metals 86 21. 22. 23. 24. 25. 26. 27. 28. 29. 30. 31. 32. 33. exposure in women of childbearing age from a Mediterranean country (Spain). Food Chem Toxicol 2008;46(5):1591-5. Grandjean P, Wheihe P, White RF, Debes F, Araki S, Yokoyama K, et al. Cognitive defeicit in 7-year-old children whit prenatal exposure to methylmercury. Neurotoxicol Teratol 1997;19:417-28. Grandjean P. Late insights into early origins of disease. Basic Clin Pharmacol Toxicol 2008;102:94-9. Frodi D, Budtz-Jørgensen E, Weihe P, White RF, Grandjean P. Impact of prenatal methylmercury exposure on neurobehavioral function at age 14 years. Neurotoxicol Teratol 2006;28(3):363-75. Bjornberg KA, Vahter M, Grawe KP, Berglund M. Methyl mercury exposure in Swedish women with high fish consumption. Sci Total Environ 2005;341:45-52. Innis SM, Palaty J, Vaghri Z, Lockith G, Canada J. Increased levels of mercury associated with high intakes among children from Vancouver. Pedriatr 2006;148:759-63. Murata K, Sakamoto M, Nakai K, Weihe P, Dakeishi, Iwata T, et al. Effects of methylmercury on neurodevelopment in Japanese children in relation to the Madeira Study Int Arch Occup Environ Health 2004;77:571-9. Tetsuro A, Kunito T, Iwata H, Monirith I, Seang Tana T, Subramanian A, et al. Mercury contamination in human Hair and fish from Cambodia: Levels, specific accumulation and risk assessment. Environmental Pollution 2005;134:79. Tetsuya E, Koichi H. Mercury Levels in hair samples from residents of Taiji, a Japanese whaling town Hair. Marine Pollution Bulletin 2009;60(5):743-7. Posicionamiento INMA (Proyecto multicéntrico investigación Infancia y Medio Ambiente) ante el consumo de pescado para mujeres embarazadas y niños. Disponible en: //www.proyectoinma.org/presentacioninma/noticieses/posicionamient Proyecto dermocophes. Disponible en: http://democophes. blogs.isciii.es/files/2013/11/Layman-report-final-CASTELLANO-3.pdf Scientific Opinion on the risk for public health related to the presence of mercury and methylmercury in food. EFSA Journal 2012;10(12):2985. Burger J, Gochfeld M. Mercury in canned tuna: White versus light and temporal variation. Environmental Research 2004;96:239-49. 26. Domingo JL, Bocio A, Falcó G, Llobet JM. Benefits and risks of fish consumption Part I. A quantitative analysis of the intake of omega-3 fatty acids and chemical contaminants. Toxicology 2007;230(2-3):219-26. Denomme J, Stark KD, Holub BJ. Directly Quantitated Dietary (n-3) Fatty acid intakes of pregnant Canadian women are lower than current dietary recommendations. J Nutr 2005;135:206-11. Gil Campos M, Dalmau J. Comité de Nutrición de la Sociedad Española de Pediatría. Importancia del Ácido Docosahexaenoico (DHA): Funciones y Recomendaciones para su ingesta en la infancia. Anales de Pediatría 2010;73(3):142e1-142e8. Innis S. Essential fatty acids in growth and development. Prog Lip Res 1991;30:39-103. Innis SM. Dietary omega 3 fatty acids and the developing brain. Brain Research 2008;5-43. Carlson SE. Docosahexaenoic acid supplementation in pregnancy and lactation. Am J Clin Nutr 2009;89:678S-84S. Lewin GA, Schachter HM, Yuen D, Merchant P, Mamaladze V, Tsertsvadze A. Effects of omega-3 fatty acids on child and maternal health. Evidence Report/Technology Assessment. Agency for Healthcare Research and Quality 2005;118:1-15. Jensen CL, Voigt RG, Prager TC, Zou YL, Fraley JK, Rozelle JC, et al. Effects of maternal docosahexaenoic acid intake on visual function and neurodevelopment in breastfed term infants. Am J Clin Nutr 2005;82:125-32. Vol. 21, N.º 3, 2014 niveles de mercurio en pescado azul. potenciales riesgos de su consumo y recomendaciones en mujeres embarazadas 34. Helland IB, Smith L, Blomen B, Saarem K, Saugstad OD, Drevon CA, et al. Effect of supplementating pregnant and lactating mothers with n-3 very-long-chain fatty acids on children´s IQ and body mass index at 7 years of age. Pediatrics 2008; 122(2):472-9. 35. Hibbeln JR, Davis JM, Steer C, Emmett P, Rogers I, Williams C, et al. Maternal seafood consumption in pregnancy and neurodevelopmental outcomes in childhood (ALSPAC study): An observational cohort study. Lancet 2007;369:578-85. 36. Costa LG. Contaminants in fish: risk-benefit considerations. Arh Hig Rada Toksikol 2007;58(3):367-74. 37. Mahaffey KR, Clickner RP, Jeffries RA. Adult women’s blood mercury concentrations vary regionally in the United States: Association with patterns of fish consumption (NHANES 1999-2004). Environ Health Perspect 2009;117(1):47-53. 38. Halldorsson TI, Meltzer HM, Thorsdottir I, Knudsen V, Olsen SF. Is high consumption of fatty fish during pregnancy a risk factor for fetal growth retardation? A study of 44,824 Danish pregnant women. Am J Epidemiol 2007;166(6):687-96. 39. Oken E, Bellinger D. Fish consumption, methylmercury and child neurodevelopment. Curr Opin Pediatr 2008;20(2):178-183. 40. Mozaffarian D, Rimm EB.Fish intake, contaminants, and human health: Evaluating the risks and the benefits. JAMA 2006;296(15):1885-99. 41. Guia de alimentacion saludable de la SECN. Disponible en: http://www.aesan.msc.es/AESAN/docs/docs/come_seguro_y_saludable/guia_alimentacion2.pdf 42. Recomendaciones de la Agencia Francesa de Seguridad Sanitaria de los Alimentos (AFSSA). Disponible en: http://www. anses.fr/fr/node/79555 43. FDA and EPA Announce the Revised Consumer Advisory on Methylmercury in Fish. Disponible en: http://www.fda. gov/NewsEvents/Newsroom/PressAnnouncements/2004/ ucm108267.htm 44. Dirección General de Salud y Consumo. Comisión Europea. Disponible en: http://ec.europa.eu/food/food/chemicalsafety/contaminants/information_note_mercury-fish_12-05-04. pdf. 45. Agencia Española de Seguridad Alimentaria (AESAN). Recomendaciones de consumo de pescado debido a la presencia de mercurio. Disponible en: http://www.aesan.msc.es/AESAN/ web/rinconconsumidor/subseccion/mercurio pescado.shtm 87