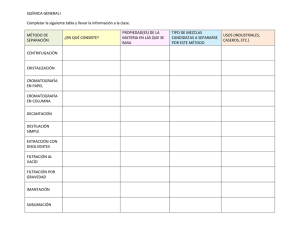
Hojas adicionales Química Orgánica I (1311) Manual de Prácticas
Anuncio

Hojas adicionales Química Orgánica I (1311) Manual de Prácticas DISOLVENTES MÁS USADOS EN ORDEN DE POLARIDAD DISOLVENTES FÓRMULA CONDENSADA FÓRMULA SEMI-DESARROLLADA Pe (ºC) Densidad (δ) Hexano C6H14 CH3-CH2-CH2-CH2-CH2-CH3 69° 0.659 Tolueno C7 H8 110° 0.865 Benceno C6 H6 80° 0.874 Éter C4H10O 35° 0.706 77° 1.604 61° 1.492 40° 1.325 77° 0.902 56° 0.791 CH3 P O L A CH3-CH2-O-CH2-CH3 Cl Tetracloruro de carbono CCl4 C Cl Cl Cl Cl R I D A Cloroformo CHCl3 C H Cl Cl Cloruro de metileno ó Diclorometano Cl CH2Cl2 H C Cl H O D Acetato de etilo Acetona C4H8O2 CH 3-C-O-CH 2-CH 3 O C3H6O CH3-C-CH3 Etanol C2H6O CH3-CH2-OH 78° 0.785 Metanol CH4O CH3-OH 65° 0.791 Agua H2O 100° 1.000 118° 1.049 Ácido acético O H H O C2H4O2 CH3 Página 1 C OH Hojas adicionales Química Orgánica I (1311) Manual de Prácticas PRÁCTICA NO. 1 DETERMINACIÓN DE PUNTO DE FUSIÓN INFORMACIÓN ADICIONAL 1. El punto de fusión de un compuesto sólido es la temperatura a la cual se encuentran en equilibrio la fase sólida y la fase líquida y generalmente es informado dando el intervalo entre dos temperaturas: la primera es cuando aparece una primera gotita de líquido y la segunda es cuando la masa cristalina termina de fundir. Por ejemplo, el pf del ácido benzoico se informa como: pf = 121 – 122ºC 2. El punto de fusión de un compuesto puro, en muchos casos se informa como una sola temperatura, ya que el intervalo de fusión puede ser muy pequeño (menor a 1º). En cambio, si hay impurezas, éstas provocan que el pf disminuya y el intervalo de fusión se amplíe. Por ejemplo, el pf del ácido benzoico impuro podría ser: pf = 117 – 120ºC 3. Aprovechando esta característica, se emplea el punto de fusión mixto (punto de fusión de una mezcla) para determinar la identidad de un compuesto: Si se mezclan dos muestras diferentes de la misma sustancia, el resultado sigue siendo la misma sustancia pura. Si se mezclan dos muestras de sustancias diferentes, éstas se impurifican entre sí, por lo cual la mezcla fundirá a una temperatura más baja y el intervalo de fusión será más amplio. EXPERIMENTO II – B (Optativo) PROBLEMA Y PUNTO DE FUSIÓN MIXTO a) PUNTO DE FUSIÓN DE UNA SUSTANCIA PROBLEMA Determine el pf de una sustancia problema y compárelo con los de la lista de sustancias posibles. Es probable que encuentre varios puntos de fusión parecidos. (No olvide controlar la velocidad de calentamiento). Anote aquí los puntos de fusión encontrados. (Anote los dos valores, el de inicio y el de término, para conocer el intervalo) Sustancia Problema pf= Sustancias posibles A.B.C.- Página 2 pf ºC Hojas adicionales Química Orgánica I (1311) Manual de Prácticas b) PUNTO DE FUSIÓN MIXTO Para confirmar o rechazar la identidad de su sustancia problema, lleve a cabo el punto de fusión mixto, para lo cual coloque unos cristales de la sustancia conocida a la izquierda del cubre-objetos (observe la Figura 2), unos cristales de su sustancia problema a la derecha y un poco de la mezcla de ambos, abajo. Para hacer la mezcla, puede poner unos cristales de cada uno en un vidrio de reloj y molerlos con el extremo de un agitador. Realice todos los pf mixtos que necesite, hasta identificar la sustancia problema, dibujando en su cuaderno los esquemas y anotando los tres puntos de fusión en cada uno, con su intervalo, ya que eso nos proporciona información. Sustancia conocida “A” Sustancia Problema pf = pf = Mezcla (A + Prob.) pf = (Figura 2) ______________________________________________________________ Sustancia conocida “B” Sustancia Problema pf = pf = Mezcla (B + Prob.) pf = (Figura 3) Página 3 Hojas adicionales PRÁCTICA No. 2 Química Orgánica I (1311) Manual de Prácticas CRISTALIZACIÓN SIMPLE INFORMACIÓN ADICIONAL A. El procedimiento general en una cristalización es el siguiente: a) Disolución del compuesto sólido en el disolvente ideal a ebullición. b) Eliminación de las impurezas coloridas (si las hay) por ebullición con carbón activado. c) Eliminación de las impurezas insolubles por filtración en caliente. (En el caso de haber usado carbón activado, se puede usar un ayuda-filtro). d) Inducción de la cristalización (formación de los cristales). Además de dejar enfriar a temperatura ambiente y luego en baño de hielo-agua, también se puede inducir la cristalización tallando las paredes del matraz con una varilla de vidrio, sembrando cristales, etc. e) Separación de los cristales de las aguas madres por filtración al vacío. f) Lavado de los cristales con un poco del disolvente frío. g) Secado de los cristales. B. Carbón activado El carbón activado es preparado a partir de diversos materiales, tales como carbón, madera, cáscara de nuez, turba y petróleo. Su poder adsorbente surge cuando es calentado a altas temperaturas (800 a 1000º) en la ausencia de oxígeno; de esta manera se crean millones de poros microscópicos en la superficie del carbón. El carbón activado tiene una fuerte atracción para moléculas orgánicas y es excelente en retener firmemente moléculas más pesadas tales como compuestos aromáticos o resinas. El proceso de adsorción trabaja como un imán para mantener las impurezas en la superficie del carbón activado, la adherencia se da por una atracción electrostática. Página 4 Hojas adicionales Química Orgánica I (1311) Manual de Prácticas PRÁCTICAS No. 4 y 5 DESTILACIÓN SIMPLE Y FRACCIONADA PUNTO DE EBULLICIÓN Y DESTILACIÓN A PRESIÓN REDUCIDA INFORMACIÓN ADICIONAL a) El punto de ebullición de un líquido es la temperatura a la cual su presión de vapor es igual a la presión externa. Para que una sustancia alcance su punto de ebullición, es necesario suministrar la energía necesaria para que pase del estado líquido al estado de vapor. b) Las destilaciones se pueden clasificar de la siguiente manera: Simple A Presión atmosférica Fraccionada Destilación Simple A Presión reducida Fraccionada c) El punto de ebullición de las sustancias varía en relación directa con la presión, pues la relación entre la presión aplicada y la temperatura de ebullición de un líquido está determinada por su comportamiento presión de vapor-temperatura. Muchos líquidos orgánicos no pueden ser destilados a presión atmosférica debido a que se descomponen al llegar a su punto de ebullición o aún antes, esto es frecuente en compuestos que ebullen por encima de los 200 ºC. Estas sustancias se purifican o separan por una destilación a presión reducida para evitar su descomposición. Dicha destilación puede hacerse simple o fraccionada, dependiendo de la mezcla de sustancias que se tenga: Figura 1. Equipo para destilación simple a presión reducida Figura 2. Equipo para destilación fraccionada a presión reducida Página 5 Hojas adicionales Química Orgánica I (1311) Manual de Prácticas d) Un nomograma es la representación gráfica de una ecuación de varias variables y consta de tantos elementos gráficos como variables tenga la ecuación. Estos elementos pueden ser puntos o líneas, ya sea rectas o curvas. Dados los valores de todas las variables menos una, el de esta última puede encontrarse por medio de algún recurso geométrico inmediato, que generalmente es el trazado de otra línea que pasa por ese punto. e) En general, los factores que determinan el punto de ebullición son: el peso molecular, la forma lineal o ramificada de las moléculas, su polaridad y la asociación intermolecular. Para PUNTO DE EBULLICIÓN y DESTILACIÓN SIMPLE, se tienen 2 juegos de disolventes: o o Serie de alcoholes lineales. Un alcohol lineal y uno ramificado, del mismo peso molecular (n-propanol e isopropanol). Serie de hidrocarburos. Aún cuando no los tenemos en el laboratorio, se pueden anotar los puntos de ebullición de esta serie y también dibujar esta gráfica, para comparar resultados, sobre todo porque este tema es parte de su curso de Teoría. o ALCOHOLES Metanol P.e. normal 64º P.e. en la Cd. de México HIDROCARBUROS n-Pentano P.e. normal 36º Etanol 78º n-Hexano 69º n-Propanol 97º n-Heptano 98º n-Butanol 118º n-Octano 125º ALCOHOLES LINEALES Y RAMIFICADOS n-Propanol No. de ramificaciones P.e. en la Cd. de México 97º iso-Propanol P.e. normal 82º Dibuje una gráfica para cada serie, anotando en las abscisas el número de átomos de carbono y en las ordenadas el punto de ebullición en °C. Temp. °C No.de átomos de carbono Página 6 Hojas adicionales PRÁCTICA No. 6 Química Orgánica I (1311) Manual de Prácticas CROMATOGRAFÍA EN CAPA FINA INFORMACIÓN ADICIONAL a) Concepto de cromatografía La cromatografía se define como la separación de una mezcla de dos o más compuestos por distribución entre dos fases inmiscibles: una fase móvil, llamada también activa, que transporta las sustancias que se separan y que progresa en relación con la otra, denominada fase estacionaria. La fase móvil puede ser un líquido o un gas y la estacionaria puede ser un sólido o un líquido. Todas las técnicas cromatográficas dependen de la distribución de los componentes de la mezcla entre esas dos fases. Según lo anterior, son posibles varios tipos de cromatografía, dependiendo de la naturaleza de las dos fases involucradas: pueden ser sólido-liquido (capa fina, papel o columna), o bien liquido-liquido o gases-liquido (fase vapor). Todos los sólidos finamente pulverizados tienen el poder de adsorber en mayor o menor grado otras sustancias sobre su superficie; y, similarmente, todas las sustancias pueden ser adsorbidas, unas con más facilidad que otras. Este fenómeno de adsorción selectiva es el principio fundamental de la cromatografía. b) Concepto de Rf El símbolo Rf significa “Relación de frentes”, es una relación de distancias, y se expresa como el cociente entre la distancia recorrida por la sustancia y la distancia recorrida por el disolvente hasta el frente del eluyente: Rf = (a) distancia que recorre la muestra desde el punto de aplicación (b) distancia que recorre el disolvente hasta el frente del eluyente Frente del eluyente Muestra Punto de aplicación (a) (b) El valor de Rf depende de las condiciones en las cuales se corre la muestra: tipo de adsorbente, eluyente, así como las condiciones de la placa, temperatura, vapor de saturación, etc. Tiene una reproducibilidad de 20%, por lo que es mejor correr duplicados de la misma placa. c) Cromatografía en capa fina En la cromatografía en capa fina (ccf), se utiliza una placa recubierta con el adsorbente (fase estacionaria) en forma de una capa delgada, de espesor constante, adherida sobre un soporte rígido, que puede ser una placa de vidrio, aluminio o poliéster. Hay adsorbentes que contienen un indicador de fluorescencia para facilitar la identificación de muestras. Si no se usa indicador y los componentes no son coloridos, se requerirán otras técnicas de revelado. Página 7 Hojas adicionales Química Orgánica I (1311) Manual de Prácticas El eluyente (fase móvil) ascenderá por capilaridad por la placa y arrastrará los componentes en forma diferenciada a lo largo de ésta, produciendo “manchas” de los componentes. El grado de elución de las sustancias dependerá tanto de su propia polaridad como de la polaridad del eluyente utilizado. h) Gel de sílice. Es una forma granular y porosa de dióxido de silicio, hecho a partir de silicato sódico. Es un gel sólido y duro, de aspecto cristalino, poroso, inerte, no tóxico e inodoro. Su fórmula molecular es SiO2.nH2O, casi insoluble en agua y en cualquier otro disolvente. Es químicamente estable, sólo reacciona con ácido fluorhídrico y con álcali. OH O Si OH O O O Si Si OH O O O Si Si OH O O O Si Si O O O Si O n El gel de sílice, también conocido como Silicagel, es un producto absorbente que puede diferenciar la adsorción de diferentes moléculas, actuando como un adsorbente selectivo en procesos de cromatografía, tanto en columna como en placa fina. El gel de sílice está catalogado como el de mayor capacidad de absorción de los que se conocen actualmente, y bajo diferentes métodos de fabricación, se pueden conseguir diferentes tipos de gel de sílice con diversas estructuras de poro, pudiendo llegar a absorber hasta un 40% de su propio peso en agua, por lo que es usado también para reducir la humedad en espacios cerrados. O O O O Para el Informe. Para mayor claridad de los resultados, incluya en su informe los dibujos de las cromatoplacas a tamaño natural de todos los experimentos. Conteste también las siguientes preguntas en cada experimento: I. Preparación de cromatoplacas y capilares. a) Explique cómo se preparan las cromatoplacas. b) Diga cómo se prepara la cámara de elución. II. Aplicación de la muestra y efecto de la concentración. a) ¿Cuál es la relación existente entre la intensidad y tamaño de las manchas con la concentración de la sustancia aplicada en cada caso? b) ¿Cuál es el Rf de la mancha intermedia? III. Polaridad de las sustancias y polaridad de los eluyentes. a) ¿Cuál es el eluyente adecuado? ¿Por qué? b) ¿Cuál de las dos sustancias problema es la más polar? ¿Por qué? c) ¿Cuál es la sustancia problema menos polar? ¿Por qué? IV. Pureza de las sustancias. a) ¿Cuál es la sustancia pura? ¿Por qué? b) ¿Cuál es la sustancia impura? ¿Cuántas impurezas se observan? c) ¿Cuál es el Rf de la sustancia principal? d) ¿Cuál es el Rf de la impureza? V. La cromatografía en capa fina como criterio parcial de identificación a) Diga cuál eluyente permite una mejor separación de los componentes. b) c) d) e) f) Tomando en cuenta solamente la cromatoplaca eluída en el eluyente que resultó ser el adecuado, conteste también las siguientes preguntas: ¿A qué analgésico corresponde el Prob. 1? ¿Por qué? ¿A qué analgésico corresponde el Prob. 2? ¿Por qué? ¿Cuál es el Rf del ácido acetil-salicílico? ¿Cuál es el Rf del paracetamol? ¿Cuál es el Rf de la cafeína? Página 8 Hojas adicionales PRÁCTICA No. 7 Química Orgánica I (1311) Manual de Prácticas CROMATOGRAFÍA EN COLUMNA INFORMACIÓN ADICIONAL a) Concepto de cromatografía a) La cromatografía se define como la separación de una mezcla de dos o más compuestos por distribución entre dos fases inmiscibles: una fase móvil, llamada también activa, que transporta las sustancias que se separan y que progresa en relación con la otra, denominada fase estacionaria. La fase móvil puede ser un líquido o un gas y la estacionaria puede ser un sólido o un líquido. Todas las técnicas cromatográficas dependen de la distribución de los componentes de la mezcla entre esas dos fases. b) Según lo anterior, son posibles varios tipos de cromatografía, dependiendo de la naturaleza de las dos fases involucradas: pueden ser sólido-liquido (capa fina, papel o columna), o bien liquido-liquido o gases-liquido (fase vapor). c) Todos los sólidos finamente pulverizados tienen el poder de adsorber en mayor o menor grado otras sustancias sobre su superficie; y, similarmente, todas las sustancias pueden ser adsorbidas, unas con más facilidad que otras. Este fenómeno de adsorción selectiva es el principio fundamental de la cromatografía. d) La cromatografía en columna se usa para separar mayores cantidades de material: más de100 mg. Recordemos que el proceso de cromatografía consta de una fase móvil (eluyente) y una fase estacionaria (adsorbente), los cuales dependen de las sustancias que se deseen separar. e) La cromatografía en capa fina es una técnica para determinar el número de componentes de una mezcla y se usa como una prueba preliminar para conocer los eluyentes adecuados para realizar una cromatografía en columna. f) El proceso de cromatografía en columna se puede controlar por cromatografía en capa fina, de tal manera que se pueda separar adecuadamente cada componente de la mezcla. Página 9 Hojas adicionales PRÁCTICA No. 9 Química Orgánica I (1311) AISLAMIENTO.- Manual de Prácticas ACEITES ESENCIALES Los aceites esenciales son mezclas complejas de hidrocarburos, terpenos, alcoholes, compuestos carbonílicos, aldehídos aromáticos y fenoles y se encuentran en hojas, cáscaras o semillas de algunas plantas. La obtención de los aceites esenciales se realiza comúnmente por destilación por arrastre con vapor, ya que, en general, esta técnica se utiliza cuando los compuestos cumplen con las condiciones siguientes: ser volátiles, inmiscibles en agua, tener presión de vapor baja y punto de ebullición alto, como lo son muchos de estos aceites. En el vegetal, los aceites esenciales están almacenados en glándulas, conductos, sacos, o simplemente acumulaciones dentro del vegetal, por lo que es conveniente desmenuzar el material para exponer dichos aceites a la acción del vapor de agua. Estos aceites esenciales son productos naturales que tienen aplicación en diferentes industrias, como son la farmacéutica, la alimentaria, o en perfumería, entre otros usos. Actualmente, son productos alternos para la elaboración de biopesticidas o bioherbicidas. O O α-Pineno Limoneno Neral Geranial (Citral) OH OH p-Cimeno Geraniol Nerol β-Pineno CH=O OH CH=CH-CH3 OMe OH CH3O Anetol Timol (p-Cimenol) Eugenol Cuminaldehido CH=CH-CH=O OH O O Mentol Cinamaldehido Mentona Página 10 Alcanfor Hojas adicionales Química Orgánica I (1311) Manual de Prácticas TABLA 2.- Algunos compuestos volátiles importantes en el aroma de los cítricos: TABLA 3.- Compuestos importantes en el aroma de hierbas culinarias usadas como aromatizantes: TABLA 4.- Compuestos importantes en el aroma de algunas especias usadas como aromatizantes: Página 11 Hojas adicionales Química Orgánica I (1311) PRÁCTICA No. 10 Manual de Prácticas ISOMERÍA GEOMÉTRICA O O O H H O H HCl H 2O H O H OH H 2O O Anhidrido maleico C H O Ácido maleico C H O PM = Pf = PM = Pf = MEC AN ISMO DET ALL ADO DE L A RE ACC IÓN. a) Hidrólisis del anhídrido maleico.- b). Transposición del isómero cis al trans.- + H+ Página 12 H + OH HO OH H O Ácido fumárico C H O PM = Pf =