Estabilidad operacional de β-glucosidasa inmovilizada por
Anuncio

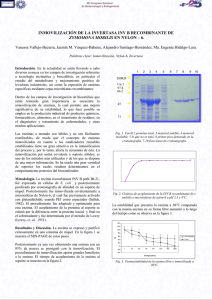
Scientific registration nº : 1353 Symposium nº : 41 Presentation : poster Estabilidad operacional de β -glucosidasa inmovilizada por asociación a humatos a través de glutaraldehído Stabilité d'une β -glucosidase immobilisée par le glutaraldehyde sur des acides humiques Operational stability of β -glucosidase immobilised in humates by cross-linking with glutaraldehyde ORTEGA Natividad, BUSTO Mª Dolores, PEREZ-MATEOS Manuel Dpto de Biotecnología y Ciencia de los Alimentos. Universidad de Burgos, Plaza Misael Bañuelos s/n, 09001 Burgos, Spain INTRODUCCIÓN Los enzimas presentes en el suelo (implicados en importantes reacciones de los ciclos nutricionales) se encuentran bien en estado extracelular o bien asociados a células vivas proliferantes o no, a células muertas o a restos celulares. Los enzimas de la fase acuosa del suelo tienen generalmente una vida corta, porque resultan inactivados por una serie de procesos de adsorción, desnaturalización o degradación. Sin embargo, estos enzimas pueden estabilizarse y permanecer activos durante largos periodos de tiempo si se asocian a coloides húmicos (Pérez-Mateos y González, 1985; Burns, 1987). Ciertos enzimas, entre los que se encuentra la β-glucosidasa, han sido extraídos del suelo en forma de complejos en los que se encontraban inmovilizados por asociación a coloides edáficos (Pérez-Mateos et al., 1987; Busto y Pérez-Mateos, 1995). No obstante, y aunque se han descrito las propiedades químicas de estos complejos húmico-enzimáticos (Nannipieri et al., 1988), la interacción entre los enzimas y sus soportes poliaromáticos, así como su formación y su posible función en el suelo y la rizosfera, resultan todavía desconocidos. La asociación de enzimas a humatos edáficos resultaba especialmente interesante por cuanto que podría suponer una copolimerización adicional de derivados fenólicos, procedentes de la degradación de la lignina, con las estructuras enzimáticas. Esta asociación podría conferir una estabilidad remarcada en comparación con sus contrapartidas solubles, que normalmente resultan rápidamente desnaturalizadas, degradadas o inactivadas. Por todo ello, se procedió en este trabajo a la extracción y posterior utilización de humatos como soporte de inmovilización de β-glucosidasa extracelular aislada de A. niger. 1 MÉTODOS Ensayo de la actividad β -glucosidasa La determinación de la actividad β-glucosidasa está basada en la determinación colorimétrica del p-nitrofenol (pNP) liberado por acción catalítica del enzima sobre un sustrato artificial, el p-nitrofenil-β-D-glucopiranósido (pNPG). El procedimiento suponía mezclar 0,5 ml de muestra enzimática, diluida previamente a un volumen de 4 ml con tampón fosfato de Sorensen (pH 5,4), con 1 ml de sustrato (pNPG) 10 mM. Las muestras, preparadas por triplicado, se sometían a incubación a 37ºC durante 1 h. Se incluían muestras control en las que el sustrato se adicionaba después de la incubación. Transcurrido el tiempo de agitación, se añadían 2,5 ml de CaCl2 0,5 M para eliminar la materia orgánica presente, 8 ml de tampón trishidroximetilaminometano (THAM) 0,1 M a pH 12, para extraer el pNP liberado y paralizar la acción del enzima, y se incluía 1 ml de sustrato en cada uno de los blancos. Finalmente se filtraban las muestras y, en los filtrados obtenidos, se evaluaba la absorbancia a una longitud de onda de 410 nm. Los resultados de actividad enzimática se expresaban en µg de pNP ml-1 h-1. Inmovilización de β -glucosidasa por humatos edáficos. Los humatos utilizados en este trabajo se aislaron de un suelo ocre humífero de montaña, según el método de extracción descrito por Pérez-Mateos et al. (1988). El protocolo de inmovilización consistía en mezclar en un bote de polietileno de 25 ml, 3 ml de solución de ácidos húmicos (1, 2, 4 ó 10 mg humatos ml-1) con 3 ml de solución enzimática (2 mg enzima ml-1) y 4 ml de tampón fosfato a pH 5,4. Las concentraciones de humatos en los complejos sintetizados fueron de 0,3; 0,6; 1,2 y 3,0 mg ml-1, mientras que la concentración de enzima era de 0,6 mg ml-1, siendo por tanto las proporciones humato/enzima de 0,5/1, 1/1, 2/1 y 5/1 (en p/p), respectivamente. Las mezclas se sometían a agitación orbital (150 rpm) a diferentes temperaturas (4, 30 y 45ºC) y tiempos de agitación (15, 60, 120 y 240 min). Paralelamente, y por separado se aplicaba el mismo tratamiento a muestras de enzima libre y de extracto húmico. Para ello, se mezclaban 3 ml de solución de humatos, o de enzima, con 7 ml de tampón fosfato a pH 5,4. Se ensayaba la actividad β-glucosidasa del enzima inmovilizado, del enzima libre y de las soluciones de humatos para cada temperatura y tiempo de inmovilización. Inmovilización de β -glucosidasa por humatos edáficos a través de glutaraldehído. La inmovilización se llevaba a cabo mezclando 4 ml de una solución de glutaraldehído al 2,5%, con 3 ml de extracto húmico y 3 ml de solución de enzima. De esta forma, se conseguía una concentración final de glutaraldehído durante el proceso de inmovilización del 1%. La mezcla se sometía a agitación orbital (150 rpm) a diferentes temperaturas (4, 30 y 45ºC) y tiempos de agitación (15, 60, 120 y 240 min). Estabilidad térmica En esta prueba se determinaba el comportamiento de los enzimas libre e inmovilizados, cuando se sometían a un tratamiento térmico de corta duración (1 h) con calor seco a diferentes temperaturas (30, 40, 50, 60, 70 y 90ºC). Finalizado el tratamiento se evaluaba en las muestras la actividad enzimática residual. Estabilidad operacional en medios edáficos A muestras de 50 g de suelo se les adicionaban 12,5 ml de una solución de enzima libre (0,6 mg ml-1) y 10 ml de enzima inmovilizado. Todas las muestras se realizaban por 2 triplicado, incluyendo además muestras control con suelo sin enzima. Tanto las muestras como los controles se incubaban en estufa con humedad controlada, a 25ºC. Se tomaban muestras a intervalos de tiempo fijos (0, 1, 3, 7, 10, 16, 20 y 30 días) y se determinaba la humedad y la actividad enzimática residual. RESULTADOS Y DISCUSIÓN Inmovilización de β -glucosidasa por humatos edáficos Los resultados de actividad del enzima inmovilizado, mostraban que la asociación del enzima a humatos edáficos provocaba un fuerte incremento en la actividad de los inmovilizados con respecto a sus contrapartidas solubles. Los porcentajes de inmovilización enzimática (Tabla 1) eran función directa de la temperatura de inmovilización: a medida que aumentaba la temperatura del tratamiento se incrementaban los rendimientos del inmovilizado. Mientras que a 4ºC los porcentajes oscilaban entre el 80% y el 100%, a 45ºC se producían activaciones que alcanzaban porcentajes de hasta un 180% cuando el tratamiento se prolongaba durante 4 h de agitación. Aunque el tiempo de inmovilización no influía prácticamente sobre el proceso a 4ºC, tenía una influencia decisiva a temperaturas de 30 y 45ºC. En concreto, la actividad de la mezcla humatos-enzima, se incrementaba sobre un 30% o incluso un 60% al aumentar el tiempo de agitación de 15 min a 4 h para 30 o 45ºC, respectivamente. Tabla 1. Porcentajes de inmovilización de β-glucosidasa por asociación a humatos a diferentes temperaturas, tiempos de tratamiento y proporciones humato/enzima. Temperatura (ºC) 4 30 45 Tiempo (min) 15 60 120 240 15 60 120 240 15 60 120 240 0,5/1 b 93,83 91,12 96,24 97,49 96,81 104,54 114,69 130,50 133,35 163,60 170,89 180,54 % de inmovilización a 1/1 c 2/1 d 88,98 84,68 81,98 81,69 87,73 84,01 87,17 80,79 87,25 88,00 92,78 89,90 105,31 98,64 107,44 99,07 104,53 99,37 138,28 133,47 139,09 145,33 154,79 145,50 5/1 e 101,35 98,48 102,54 103,21 101,99 110,52 117,70 124,97 120,07 158,68 160,88 163,58 a En % respecto a la actividad inicial 0,3 mg humatos ml-1 0,6 mg humatos ml-1 d 1,2 mg humatos ml-1 e 3,0 mg humatos ml-1 b c Por tanto, la asociación de los humatos a los extractos enzimáticos suponía una mayor o menor activación de la proteína enzimática que dependía de la temperatura y tiempo de inmovilización. El hecho de que apareciera una activación e inhibición sobre el mismo enzima implica que el efecto de los humatos se producía principalmente sobre el enzima y no sobre el sustrato (Ladd y Butler, 1969). Podría pensarse que la proteína enzimática se asociaba a la materia húmica a través de una serie de mecanismos de intercambio iónico, atrapamiento entre micelas tridimensionales, reacciones lipofílicas, enlaces de hidrógeno o covalentes de manera tal que producían una modificación del efecto catalítico del enzima (Pérez-Mateos y Rad, 1989; Pérez-Mateos et al., 1990). 3 Butler y Ladd (1975) supusieron que las uniones de humatos con distintos enzimas eran reversibles y seguían un mecanismo de intercambio catiónico a través de grupos carboxilato. También sugerían la intervención de los grupos amino de las proteínas enzimáticas en su asociación con los materiales húmicos del suelo (Ladd y Butler, 1975). Según estos autores, para tiempos de inmovilización cortos, la mayor parte de las uniones suelen ser de tipo iónico, mientras que en experiencias con tiempos de tratamiento prolongado probablemente empiecen a tener importancia las uniones covalentes. En base a estas consideraciones, podríamos pensar que la activación de los complejos sintetizados estaría directamente relacionada con el establecimiento de enlaces covalentes entre la materia húmica y el enzima, enlaces que se verían favorecidos a temperaturas elevadas (45ºC). Estas uniones podrían producir cambios en torno al centro activo del enzima provocando mayor facilidad para la acción catalítica. Adicionalmente, podría pensarse en una posible participación directa de la estructura fenólica en catálisis general del tipo ácido-base, covalente, etc. Por otra parte, la concentración de humatos en la mezcla afectaba también a la actividad enzimática del complejo formado. De forma general, cuando se incrementaba la concentración de humatos desde 0,3 hasta 1,2 mg ml-1, se producía una inactivación del complejo enzimático. No obstante, al aumentar la concentración de humatos hasta 3,0 mg ml-1, se observaba un comportamiento anómalo, ya que se incrementaba la actividad de los complejos. A esta concentración de ácidos húmicos (10 veces superior a la del enzima), la concentración del enzima se convertía en limitante del proceso, con lo que podría producirse una mayor reactividad de las estructuras fenólicas entre sí, dando como resultado complejos de mayor actividad enzimática a lo que era previsible. Inmovilización de β -glucosidasa en humatos a través de glutaraldehído Los reactivos multifuncionales pueden utilizarse para introducir grupos funcionales reactivos en el interior de los polímeros, facilitando la reacción covalente con el enzima. Un ejemplo de este método es la modificación de los humatos del suelo por acción del glutaraldehído (Busto et al., 1997). Los resultados de la inmovilización de β-glucosidasa por entrecruzamiento con glutaraldehído al 1% demostraban que la temperatura de tratamiento era un parámetro determinante en el proceso de inmovilización, observándose tanto inhibiciones como activaciones, dependiendo de las condiciones de inmovilización (Tabla 2). La inmovilización con glutaraldehído al 1% a una temperatura de 4ºC suponía una disminución en la actividad del enzima inmovilizado con respecto a la de su contrapartida soluble (~20%). Este descenso de la actividad de los complejos húmicoenzimáticos podría deberse a una acción específica del glutaraldehído sobre la proteína enzimática, ya que no dependía ni de la concentración de ácidos húmicos ni del tiempo de tratamiento. Sin embargo, procesos de inmovilización a 30ºC y tratamientos cortos de 15 o incluso 60 min producían una inactivación parcial (en menor grado que a 4ºC), mientras que tiempos de agitación superiores provocaban un incremento sustancial de la actividad del enzima inmovilizado. No obstante cuando la temperatura de inmovilización se incrementaba a 45ºC, los complejos húmico-enzimáticos entrecruzados con glutaraldehído presentaban la mayor activación respecto a la actividad del enzima añadido inicialmente (Tabla 2). A esta temperatura, el incremento de la concentración en humatos conducía a una disminución de la actividad del inmovilizado, mientras que un 4 incremento del tiempo de tratamiento provocaba un mayor rendimiento de inmovilización, alcanzándose un máximo a los 120 min de agitación, tiempo a partir del cual la actividad de los complejos permanecía prácticamente constante. Es probable que a partir de ese momento, todos los grupos aldehído del reactivo bifuncional estuvieran interaccionando bien con el enzima o bien con el soporte polifenólico, impidiéndose, por tanto, la posibilidad de un mayor acoplamiento. Tabla 2. Porcentajes de inmovilización de β-glucosidasa por entrecruzamiento con humatos a través de glutaraldehído al 1,0% a diferentes temperaturas, tiempos de tratamiento y proporciones humato/enzima. Temperatura (ºC) 4 30 45 Tiempo (min) 15 60 120 240 15 60 120 240 15 60 120 240 b 0,5/1 76,44 75,13 76,31 73,11 76,50 95,17 109,53 130,09 120,43 174,48 195,76 205,48 % de inmovilización a 1/1 c 2/1 d 81,39 80,35 83,68 78,43 84,98 82,72 78,13 77,99 84,77 81,78 98,64 98,18 117,36 111,23 135,15 114,86 128,67 112,55 178,02 172,72 200,27 181,29 212,02 185,86 5/1 e 77,42 75,33 75,72 74,65 74,21 84,51 101,80 107,04 107,72 134,29 146,96 145,41 a En % respecto a la actividad inicial 0,3 mg humatos ml-1 0,6 mg humatos ml-1 d 1,2 mg humatos ml-1 e 3,0 mg humatos ml-1 b c Estos resultados podrían explicarse si se piensa que las reacciones del glutaraldehído con los grupos ε-amino de las proteínas enzimáticas implican tanto reacciones intramoleculares como intermoleculares. Las condiciones que favorecen uno u otro mecanismo dependen, entre otros factores, de las características de cada enzima (Jansen et al., 1971). De hecho, en los resultados en los que la β-glucosidasa entrecruzada con glutaraldehído presentaba menor actividad que el enzima nativo podría pensarse en un mayor número de reacciones intramoleculares (Jansen et al., 1971), mientras que un entrecruzamiento intermolecular podría explicar los resultados en los que se producía una activación de la β-glucosidasa inmovilizada (Wong y Wong, 1992). Estabilidad térmica Debido al elevado incremento de la actividad β-glucosidasa de los inmovilizados observado cuando se entrecruzaba con humatos a través de glutaraldehído, (especialmente para la proporción humato/enzima de 1/1 y tiempo y temperatura de tratamiento de 2 h y 45ºC, respectivamente) resultaba de interés comprobar si dichos aumentos provocaban además una estabilidad adicional de la proteína enzimática. Para el estudio de la estabilidad térmica se sometió (i) al enzima inmovilizado, (ii) al enzima libre y (iii) a los ácidos húmicos, a un pretratamiento térmico de 1 h de duración a temperaturas comprendidas entre 30 y 90ºC. Los resultados obtenidos (representados en la Fig. 1) muestran que a temperaturas bajas tanto el enzima libre como el inmovilizado presentaban la misma estabilidad, mientras que, tras el tratamiento a 70ºC, el enzima inmovilizado permanecía 5 un 10% más activo que el libre, siendo también ligeramente más estable para temperaturas superiores de tratamiento. Libre 100 80 60 40 20 H-E-G 0 20 30 40 50 60 70 80 90 Temperatura (ºC) Fig. 1. Estabilidad térmica de β-glucosidasa entrecruzada con humatos a través de glutaraldehído al 1,0% (H-E-G). Estabilidad operacional En el suelo existe una amplia gama de organismos celulolíticos, de los cuales sólo unas pocas especies (principalmente hongos del género Trichoderma) producen todas las celulasas necesarias para la degradación completa de la celulosa. Es bien conocido el hecho de que muchas cepas de Trichoderma no producen cantidades suficientes de βglucosidasa para que se generen los efectos cooperativos y sinérgicos de los diferentes enzimas celulolíticos necesarios para una rápida sacarificación de la celulosa (Wood et al., 1980). Por consiguiente, la posibilidad de inoculación en el suelo de β-glucosidasa estabilizada podría resultar beneficioso tanto para la agricultura como para la descontaminación del medio ambiente. En este sentido, se determinó también la estabilidad operacional en muestras de suelo seleccionadas de la β-glucosidasa inmovilizada por humatos a través de glutaraldehído al 1,0% (H-E-G). Las muestras control presentaban oscilaciones de actividad β-glucosidasa mínimas durante todo el periodo de incubación (Fig. 2). Este comportamiento podría entenderse si se considera que una fracción relativamente importante de enzimas se encontraban en el suelo estabilizados mediante asociación a soportes coloidales (Busto y Pérez-Mateos, 1995). Las muestras de suelo suplementadas con una cantidad adicional de enzima libre, una vez superados los tres primeros días de incubación en los que se observaba una cierta pérdida de la actividad inicial, seguían un comportamiento análogo al descrito para las muestras control (Fig. 2). En esta figura también podemos observar que la adición del enzima inmovilizado (H-E-G) provocaba un aumento considerable de la actividad β-glucosidasa al cabo de 7 días de incubación (próximo al 70%). Esta activación podría entenderse si se tiene en cuenta la heterogeneidad y complejidad del medio al que se añadían las muestras: un sistema en el que coexisten gran diversidad de 6 elementos reactivos. El propio soporte de inmovilización y el reactivo bifuncional glutaraldehído podrían llegar a establecer nuevos enlaces con material coloidal edáfico existente lo que conllevaría a una modificación del microambiente del enzima y/o a una alteración de su estructura. H-E-G 500 400 300 200 Libre 100 Control 0 0 5 10 15 20 25 30 Tiempo de incubación (días) Fig. 2. Estabilidad operacional de β-glucosidasa libre e inmovilizada con humatos a través de glutaraldehído al 1,0% (H-E-G). REFERENCIAS Busto, M.D. y Pérez-Mateos, M. (1995). Extraction of humic-β-glucosidase fractions from soil. Biology Fertility Soils, 20, 77-82. Pérez-Mateos, M. y Gónzalez S. (1985). Effect of fractionation on location of enzyme activities in soil structural units. Biology Fertility of Soils, 1 (3), 153-159. Pérez-Mateos, M. y Rad, J.C. (1989). Immobilization of alkaline phosphatase by soil structural units. Biotechnology and Applied Biochemistry, 11, 371-378. Pérez-Mateos, M., Gónzalez, S. y Busto, M.D. (1988). Extraction of catalase from soil. Soil Science Society of American Journal, 52, 408-411. Pérez-Mateos, M., Rad, J.C. y Busto, M.D. (1990). Stability and properties of alkaline phosphatase immobilized by a Rendzine soil. Journal of Science Food Agricultural, 55 (2), 229-240. Burns, R.G. (1987). Relationship between microorganisms in the soil microenvironment. En: Trans. XIII International. Soil Science Congress, 5, 175-183. Nannipieri, P., Ceccanti, B. y Bianchi, D. (1988). Characterization of humus-phosphatase complexes extracted form soil. Soil Biology and Biochemistry, 20, 683-691. Ladd, J.N. y Butler, J.H.A. (1969). Inhibition and stimulation of proteolytic enzyme activities by soil humic acids. Australian Journal of Soil Research, 7, 253-261. Ladd, J.N. y Butler, J.H.A. (1975). Humics-enzyme systems and synthetic organic polymer-enzyme analogues. En: Soil. Biochemistry. (E.A. Paul and A.D. Mc Laren, eds.). pp. 149-194, Marcel Dekker, New York. Wong, S.S. y Wong, L.-J.C. (1992). Chemical crosslinking and the stabilization of proteins and enzymes. Enzyme and Microbial Technology, 14, 866-870. Jansen, E.F., Tomimatsu, Y. y Olson, A.C. (1971). Cross-linking of a chymotrypsin and other proteins by reaction with glutaraldehyde. Archives of Biochemistry and Biophysics, 144, 394-400. Wood, T.M., McCrae, S.I. y MacFarlane, C.C. (1980). The isolation, purification, and properties of the cellobiohydrolase component of Penicillium funiculosum cellulase. Biochemistry Journal, 189, 51-65. Palabras clave : β-glucosidasa, inmovilización enzimática, humatos edáficos, entrecruzamiento por glutaraldehído, estabilización enzimática 7 Mots clés : β-glucosidase, immobilisation des enzymes, acides humiques du sol, immobilisation par le glutaraldéhyde, stabilité enzygmatique Keywords : β-glucosidase, enzyme immobilization, soil humates, glutaraldehyde crosslinking, enzyme stability 8