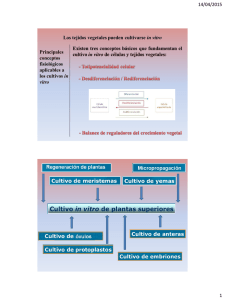
Propagación y Conservación de Lirio de Todos Santos Laelia
Anuncio

Propagación y Conservación de Lirio de Todos Santos Laelia anceps Lindl. subsp. anceps f. semialba (Orchidaceae) a través del cultivo de tejidos MIGUEL CASTAÑEDA ZÁRATE Existen diferentes tonalidades de Lirio de todos santos, las cuales van desde el rosa pálido hasta el morado intenso; sin embargo, sobresalen las de color blanco (semialbas) debido a que son raras en la naturaleza. Ilustración de S. Ramos Castro. UNIVERSIDAD VERACRUZANA FACULTAD DE BIOLOGÍA “Propagación Propagación y Conservación Conservación de Lirio de Todos Santos Laelia anceps ancep Lindl. subsp. anceps f. semialba (Orchidaceae) a través del Cultivo de Tejidos” Tejidos TESIS Trabajo de Experiencia Recepcional Presenta: Miguel Castañeda Zárate Directorr externo: Dr. Martín Mata Rosas Director interno: Dra. Blanca Lilia Náder García Xalapa, Ver. V 2008 El presente trabajo de investigación se realizó en el Laboratorio de Cultivo de Tejidos Vegetales de la Unidad de Recursos Forestales del Instituto de Ecología, A.C. bajo la dirección del Dr. Martín Mata Rosas. DEDICATORIA A mis padres Gerardo y Patricia por todo el amor, confianza y comprensión brindados, además de todo el esfuerzo que han realizado para darme la oportunidad de continuar con mis estudios. Gracias porque aún estando lejos siempre he contado con su apoyo. A mis hermanos Marilú y Gerardo con mucho cariño, por todos los momentos divertidos que hemos pasado juntos y por su amor brindado. Saben que los quiero en gran manera y deseo lo mejor para ustedes. Jairo, mi hermano pequeñín, desde que llegaste a mi vida has sido mi inspiración y un motivo más para salir adelante. A mis abuelitas Ernestina y Soledad, a mi tía Bety, mi prima Perla y el resto de familiares por los buenos deseos para que siguiera adelante, hoy éstos se ven recompensados. AGRADECIMIENTOS A Dios por bendecirme y acompañarme siempre, porque durante esta etapa me permitió salir adelante a pesar de los obstáculos que se presentaron. Al Instituto de Ecología A. C. por permitirme realizar el servicio social y trabajo de tesis en sus instalaciones. Al Dr. Martín Mata Rosas con respeto y admiración por compartir sus conocimientos conmigo, por su apoyo incondicional durante mi estancia en el laboratorio de cultivo de tejidos y por su dirección en la realización de este trabajo. Al Dr. Ernesto Aguirre León por brindarme asesoría incondicional e información útil para respaldar mi tesis. Al M. en C. Miguel Ángel Soto Arenas por ayudarme a comprender ciertos aspectos taxonómicos de mi taxón de estudio. A la Dra. Blanca Lilia Náder García, al Biol. Roberto V. Ortega Ortíz y M. en C. Tomás Carmona Valdovinos por las observaciones y sugerencias realizadas para mejorar esta tesis. A la Dra. María del Socorro Fernández por su orientación en la experiencia recepcional. A todos los profesores de la Facultad de Biología por sus enseñanzas, en especial a aquellos que me brindaron apoyo en algún momento. A mis amigos Sergio, José, Jonas, Alicia, Monse y Eyra porque con ustedes he vivido experiencias muy agradables. Además a Sergio, por la excelente ilustración de Laelia anceps Lindl. subsp. anceps que adorna este trabajo, también a Jonas por el arreglo hecho a algunas imágenes. A Lupita, Guada, Miriam, Yureli, Migue, Conchis, Saray, Ale, Givisay, Tania y demás compañeros de la facultad por los momentos alegres que compartimos. A Norma por su amistad y apoyo desinteresado. A mis colegas de la Asociación para la Conservación de Orquídeas Silvestres (ACoOS), por el esfuerzo y tiempo prestado para la realización de muchas actividades. Y a todas las personas que fueron amables y de alguna manera me ayudaron durante mi tránsitar por la Facultad de Biología. ÍNDICE ABREVIATURAS RESUMEN 1. INTRODUCCIÓN ......................................................................................................................... 1 2. ANTECEDENTES ......................................................................................................................... 3 2.1 Biodiversidad .................................................................................................................... 3 2.2 Diversidad biológica en México ......................................................................................... 3 2.3 Amenazas a la biodiversidad ............................................................................................. 4 2.4 Conservación de la biodiversidad ...................................................................................... 5 2.5 La familia Orchidaceae y su problemática ......................................................................... 6 2.6 El género Laelia ................................................................................................................ 8 2.7 Laelia anceps Lindl. subsp. anceps .................................................................................... 8 2.7.1 Clasificación taxonómica ...................................................................................... 10 2.7.2 Sinonimias ............................................................................................................ 10 2.7.3 Etimología ............................................................................................................ 10 2.7.4 Nombres comunes ............................................................................................... 11 2.7.5 Distribución .......................................................................................................... 11 2.7.6 Ecología ................................................................................................................ 12 2.7.7 Descripción botánica de Laelia anceps Lindl. subsp. anceps .................................. 14 2.8 Estrategias para la conservación de orquídeas ................................................................ 17 2.8.1 El cultivo de tejidos como alternativa de conservación ......................................... 18 2.8.1.1 Micropropagación ................................................................................... 19 2.8.2 Suplementos naturales ......................................................................................... 25 2.8.3 Retardantes del crecimiento ................................................................................. 26 2.8.4 Reguladores del crecimiento vegetal .................................................................... 29 2.8.4.1 Auxinas .................................................................................................... 30 2.8.4.2 Citocininas ............................................................................................... 31 2.8.4.3 Interacción en reguladores del crecimiento vegetal ................................. 32 2.9 Cultivo in vitro de orquídeas ........................................................................................... 33 2.10 Cultivo in vitro del género Laelia ................................................................................... 35 3. JUSTIFICACIÓN ........................................................................................................................ 37 4. HIPÓTESIS ................................................................................................................................ 38 5. OBJETIVOS ............................................................................................................................... 39 6. MATERIAL Y MÉTODO ............................................................................................................. 40 6.1 Material biológico ........................................................................................................... 40 6.2 Efecto de compuestos orgánicos ..................................................................................... 40 6.3 Ensayos para retardar el crecimiento .............................................................................. 41 6.4 Inducción de respuestas morfogenéticas ........................................................................ 42 6.5 Registro de datos ............................................................................................................ 42 6.6 Establecimiento ex vitro .................................................................................................. 43 6.7 Análisis estadístico .......................................................................................................... 44 7. RESULTADOS Y DISCUSIÓN ...................................................................................................... 45 7.1 Efecto de compuestos orgánicos ..................................................................................... 45 7.1.1 Porcentaje de supervivencia de las plantas de Laelia anceps subsp. anceps f. semialba durante el cultivo in vitro ............................................................................... 46 7.1.2 Altura promedio obtenida en las plántulas de Laelia anceps subsp. anceps f. semialba ....................................................................................................................... 46 7.1.3 Incremento de altura en las plántulas de Laelia anceps subsp. anceps f. semialba ..................................................................................................................................... 47 7.1.4 Organogénesis...................................................................................................... 47 7.1.5 Análisis por tratamiento ....................................................................................... 48 7.2 Ensayos para retardar el crecimiento .............................................................................. 50 7.2.1 Porcentaje de supervivencia de las plantas de Laelia anceps subsp. anceps f. semialba durante el cultivo in vitro ............................................................................... 51 7.2.2 Promedio de altura obtenida en las plántulas de Laelia anceps subsp. anceps f. semialba ....................................................................................................................... 52 7.2.3 Incremento de altura en las plántulas de Laelia anceps subsp. anceps f. semialba ..................................................................................................................................... 52 7.2.4 Organogénesis...................................................................................................... 53 7.2.5 Análisis por tratamiento ....................................................................................... 54 7.3 Inducción de respuestas morfogenéticas ........................................................................ 60 7.3.1 Efecto de BA y ANA sobre las plántulas de Laelia anceps subsp. anceps f. semialba ..................................................................................................................................... 61 7.3.2 Efecto de mT y ANA sobre las plántulas de Laelia anceps subsp. anceps f. semialba ..................................................................................................................................... 64 7.3.3 Efecto de TDZ y ANA sobre las plántulas de Laelia anceps subsp. anceps f. semialba ..................................................................................................................................... 67 7.3.4 Efecto de K y ANA sobre las plántulas de Laelia anceps subsp. anceps f. semialba ..................................................................................................................................... 70 7.3.5 Análisis de los reguladores del crecimiento........................................................... 73 7.4 Establecimiento ex vitro ......................................................................................................... 73 7.5 Consideraciones finales .......................................................................................................... 82 8. CONCLUSIONES ....................................................................................................................... 83 9. LITERATURA ............................................................................................................................ 84 10. APÉNDICE .............................................................................................................................. 98 10.1 Protocolo de propagación y conservación de Laelia anceps subsp. anceps f. semialba .......... 98 10.2 Componentes del medio MS (Murashige y Skoog, 1962) ...................................................... 99 10.3 Fórmula del fertilizante foliar Nitrofoska empleado para las pruebas de establecimiento ex vitro ........................................................................................................................................... 100 10.4 Fórmula de la lombricomposta líquida empleada para las pruebas de establecimiento ex vitro .................................................................................................................................................. 101 11. ÍNDICE DE FIGURAS Figura 1. Algunas formas de Laelia anceps subsp. anceps ............................................................... 9 Figura 2. Laelia anceps subsp. anceps f. semialba ......................................................................... 10 Figura 3. Distribución de Laelia anceps subsp. anceps .................................................................. 11 Figura 4. Ejemplares de Laelia anceps subsp. anceps f. semialba en estado silvestre .................... 13 Figura 5. Ilustración científica de Laelia anceps Lindl. subsp. anceps ............................................ 16 Figura 6. Ejemplares empleados en la formación de fruto ............................................................ 40 Figura 7. Tratamiento con compuestos orgánicos ........................................................................ 50 Figura 8. Tratamiento con manitol ............................................................................................... 57 Figura 9. Tratamiento con sacarosa .............................................................................................. 58 Figura 10. Tratamiento con ABA ................................................................................................... 59 Figura 11. Efecto de la incubación a 5°C sobre los explantes de Laelia anceps subsp. anceps f. semialba ...................................................................................................................................... 60 Figura 12. Respuesta morfogenética de las plántulas después de 2 meses de inducción............... 61 Figura 13. Plántulas sujetas a la interacción de BA y ANA ............................................................. 64 Figura 14. Respuestas morfogenéticas en plántulas sujetas a la interacción de mT y ANA ............ 66 Figura 15. Respuestas morfogenéticas en plántulas sujetas a la interacción de TDZ y ANA ........... 68 Figura 16. Respuestas morfogenéticas en plántulas sujetas a la interacción de K y ANA ............... 72 Figura 17. Apariencia de las plántulas cultivadas con compuestos orgánicos ................................ 75 Figura 18. Apariencia de las plántulas cultivadas con retardantes de crecimiento ........................ 76 Figura 19. Apariencia de las plántulas cultivadas con reguladores del crecimiento vegetal ........... 77 Figura 20. Aspecto general de las plántulas durante su establecimiento ex vitro .......................... 78 Figura 21. Plántulas aclimatadas tras dos meses bajo condiciones de invernadero ....................... 80 ABREVIATURAS ABA Ácido abscísico ANA Ácido α-naftalen acético ANOVA Análisis de varianza BA N6-benciladenina CTV Cultivo de Tejidos Vegetales EC Endospermo líquido de coco HC Hidrolizado de caseína HCl Ácido clorhídrico HP Homogeneizado de papa K Kinetina/N6-furfuriladenina MS Medio Murashige & Skoog (1962) mT Metatopolina/N6-(meta-hidroxibencil) adenina NaOH Hidróxido de sodio PLBs Protocorm like bodies (Cuerpos semejantes a protocormos) PGR Plant Growth Regulators (Reguladores del crecimiento vegetal) TDZ Tidiazuron/N-fenil-N1-1,2,3,-tidiazolil-5-urea RESUMEN Se exploró la capacidad regenerativa in vitro de Laelia anceps subsp. anceps f. semialba, comúnmente llamado lirio de todos santos (color blanco), para proponer un protocolo para su propagación masiva, así como su conservación. Como explantes se usaron plántulas de semillas previamente germinadas in vitro. Se exploró el efecto de diversos compuestos orgánicos (endospermo líquido de coco, homogeneizado de papa e hidrolizado de caseína) para acelerar el crecimiento de las plántulas. El homogeneizado de papa (50 g/l) fue el que indujo el mayor incremento en la talla de las plántulas en 3.75 cm, seguido por el hidrolizado de caseína en concentraciones de 50 mg/l y 100 mg/l, respectivamente mostrando un incremento de 2.23 y 1.93 cm. Por otro lado se evaluó el efecto del manitol, sorbitol, sacarosa y ácido abscísico, así como el empleo de baja temperatura para tratar de retardar o inhibir el crecimiento de las plántulas. Obteniéndose el mejor resultado con la adición de 60 g/l de manitol, ya que no sólo inhibió el desarrollo de las plántulas, sino provocó un decremento promedio en la talla de los explantes de 1.70 cm, esto debido a que las puntas de las hojas se secaron, sin afectar la supervivencia de las plántulas, a éste tratamiento le siguió el adicionado con sorbitol 60 g/l con una reducción en la talla de 0.88 cm. Para establecer un protocolo de propagación in vitro se adicionaron reguladores del crecimiento vegetal en una combinación factorial de N6-benciladenina (BA), metatopolina (mT), N-fenil-N1-1,2,3,tidiazolil-5-urea (TDZ), N6-furfuriladenina (K) (0, 2.2, 4.4, 8.9,17.8 µM) y ácido α-naftalen acético (ANA) (0, 2.7, 5.4 µM), el tratamiento que indujo la mayor formación de brotes por explante en promedio (42.1) fue el adicionado con 2.2 µM de TDZ en combinación con 2.7 µM de ANA. Finalmente, las plántulas de L. anceps subsp. anceps f. semialba obtenidas de la fase in vitro y con una talla de 2-5 cm fueron aclimatadas en condiciones de invernadero, en 2 diferentes sustratos: 1) mezcla de corteza de pino, carbón vegetal, tepecil (1:1:1) y 2) Tepecil, éstas se fertilizaron con Nitrofoska®Foliar PS (0.5 g/l), y Lombricomposta líquida (200 m/l). La supervivencia ex vitro de las plántulas, concluidos dos meses fue superior al 80% en ambos sustratos y el incremento en la talla de las mismas fue de casi 2 mm. El presente estudio es una contribución importante para la conservación de L. anceps subsp. anceps f. semialba, reconocida como rara, pues se logró establecer un protocolo de micropropagación fácil y seguro que puede ser aplicado con otras integrantes del género Laelia o especies de la familia Orchidaceae. Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba 1. INTRODUCCIÓN Las orquídeas constituyen una de las familias más diversas y ampliamente distribuidas de plantas con flores, con unas 25 000 especies conocidas a nivel mundial agrupadas dentro de 650 a 900 géneros (Dixon et al., 2003; Murguía y Lee, 2007). La mayoría de ellas se encuentra en las regiones tropicales, en México, que se localiza en el límite norte del trópico americano, se han registrado 1,254 especies y 21 taxa subespecíficos (SotoArenas et al., 2007a), con un endemismo de aproximadamente en 35% de especies y 8% de géneros (Soto-Arenas, 1988). La mayor parte de esta diversidad se concentra en los bosques húmedos y subhúmedos de las sierras y las tierras bajas del sur del país, pero aún las regiones áridas pueden albergar representantes de esta familia (Salazar-Chávez et al., 2006). México como la mayoría de los países megadiversos, enfrenta serios problemas ambientales que ponen en peligro gran parte de la biodiversidad que posee, donde las orquídeas representan un grupo altamente vulnerable (Hágsater et al., 2005). Se sabe que la mayoría de las orquídeas son muy específicas en cuanto a sus requerimientos ecológicos y son muy vulnerables a las alteraciones causadas por el hombre en los diferentes ecosistemas que habitan (Rivera, 1999; Dixon et al., 2003; Aguirre-Leon, 2005; Salazar-Casasa et al., 2007). Además, muchas de las poblaciones silvestres son objeto de la extracción ilegal de ejemplares reproductores para satisfacer la demanda comercial existente y es muy frecuente que estas extracciones se dirijan hacia los ejemplares con características sobresalientes, ya que son muy solicitados a pesar del alto costo que algunas individuos llegan a alcanzar (Flores-Palacios y Valencia-Díaz, 2007). Un claro ejemplo de lo anterior, es el lirio de todos santos Laelia anceps subsp. anceps, donde pueden encontrarse esporádicamente ejemplares con rasgos que destacan de entre el resto de los individuos que conforman la población, tal es el caso de aquellas que poseen pétalos y sépalos blancos y únicamente presentan una coloración, por lo general rosa-morada en el labelo, llamadas semialbas; ésta y otras formas (albas, lineatas, veitchianas, con coloración rosada más pálida o más oscura) que poseen nombres de interés hortícola y no taxonómico, no forman poblaciones silvestres debido a que no son entes biológicos separados, es decir, sólo son especímenes aislados entre muchos cientos con coloración típica, constituyendo parte de la variación de la misma (Soto-Arenas, 1993; Soto-Arenas, com. pers., 2008). Aunque esta 1 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba subespecie no presenta problemas de conservación, las diferentes formas, aunque no reconocidas de manera formal y no ameritan tal status (Soto-Arenas, com. pers., 2008) son muy escasas y por lo tanto es necesario desarrollar programas dedicados a su conservación y propagación. Una manera adecuada para propagar y conservar ex situ la forma semialba de esta especie, es la propagación a través de las técnicas del cultivo de tejidos vegetales, ya que han demostrado su gran utilidad para estudiar, propagar y conservar especies hortícolas, ornamentales y principalmente aquellas que presentan problemas en su conservación como orquídeas, agaves, cactáceas y árboles entre muchas más (Malabadi et al., 2004; Shatnawi et al., 2004; Osorio-Rosales y Mata-Rosas, 2005; Portillo et al., 2007; Ramírez-Malagon et al., 2007; Tinoco-Juárez, 2006). En el presente estudio, se explora el potencial regenerativo in vitro que poseen las plántulas de Laelia anceps subsp. anceps forma semialba, caracterizadas por poseer pétalos y sépalos blancos con labelo rosa-morado, a través del cultivo in vitro, mediante la adición de complejos orgánicos y reguladores del crecimiento vegetal para incrementar la talla de los explantes e incrementar el número de individuos y así proponer el más adecuado para la propagación masiva de esta especie. Además de determinar cuáles son las condiciones que permiten retardar su crecimiento y que sean la base para su conservación a corto-mediano plazo y que los explantes sean viables para su posterior utilización. Lo anterior permitirá establecer las bases para diseñar y transferir un paquete tecnológico para la conservación y propagación masiva en tiempos relativamente cortos de esta forma, lo cual podría ayudar a minimizar la extracción de plantas silvestres al poder satisfacer la demanda comercial de que son objeto y con la esperanza de que si todavía existen individuos silvestres en su hábitat natural, éstos puedan permanecer y continúen contribuyendo al enriquecimiento genético de sus poblaciones. Cabe mencionar que en el presente estudio se emplea el término “forma” únicamente con fines prácticos únicamente, pues como se mencionó anteriormente el taxón Laelia anceps subsp. anceps forma semialba no es correcto en sistemática debido a que no se ha efectuado tal clasificación, y también más adelante se usa este vocablo de manera abreviada, es decir, sólo se usa la letra f. 2 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba 2. ANTECEDENTES 2.1 Biodiversidad La biodiversidad se define como toda variación de la base hereditaria en todos los niveles de organización, desde los genes en una población local o especie, hasta las especies que componen toda o una parte de una comunidad local y finalmente en las mismas comunidades que componen la parte viviente de los múltiples ecosistemas del mundo (Wilson, 1997; Núñez et al., 2003). Es el resultado de procesos y patrones ecológicos y evolutivos irrepetibles que se manifiestan en la existencia de diferentes formas de vida (Jeffries, 1997). La diversidad biológica implica la medición de la riqueza biótica en un espacio y un tiempo determinados, también conlleva un componente geopolítico (Toledo, 1994) y abarca todos los tipos y niveles de variación biológica (Halffter y Ezcurra, 1992). Morrone et al. (1999) indican que para poder analizarla se identifican tres niveles: ecológico, específico y genético. 2.2 Diversidad biológica en México México presenta características ecológicas singulares que lo colocan como una de las naciones más importantes por la diversidad biológica con la que cuenta y por ello figura entre los diecisiete países considerados como de mayor diversidad biológica del planeta, junto con: Australia, Brasil, China, Colombia, Congo, Ecuador, Estados Unidos, Filipinas, India, Indonesia, Malasia, Madagascar, Perú, Papua-Nueva Guinea, Sudáfrica y Venezuela (Mittermeier et al., 1997; Magaña y Villaseñor, 2002). Con apenas el 1.4% de la superficie terrestre, la República Mexicana posee más del 12% del total de especies conocidas en el mundo (Toledo, 1994), y de acuerdo con la categorización de países megadiversos, ocupa el tercer lugar con mayor biodiversidad en el mundo por su alto grado de riqueza y por su alto índice de endemismos (Toledo y Ordóñez, 1993). Generalmente esta diversidad se asocia con los ecosistemas tropicales del mundo. Sin embargo, otros tipos de vegetación contribuyen también de manera importante, por ejemplo dentro de los bosques templados, los bosques de pino y encino de México son los más diversos del planeta (Mittermeier y Goettsch, 1992). 3 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba Las características geográficas que presenta nuestro país le otorgan ciertas particularidades respecto a la riqueza biológica que posee y éstas han contribuido a formar un mosaico de condiciones ambientales y microambientales que promueven una gran variedad de hábitats y de formas de vida (Sarukhán et al. 1996, citado en Conabio, 1998). En la República Mexicana convergen dos grandes regiones biogeográficas con características contrastantes: la neártica, constituida por especies de origen boreal, que comúnmente ocupan las zonas montañosas templadas y frías; y la neotropical, formada por especies que habitan las partes bajas o medias, con climas cálidos secos y húmedos (Toledo, 1988). Esta intersección biogeográfica se articula además con una compleja topografía, producto de una intrincada historia geológica. El país se encuentra, a su vez, en medio de dos grandes masas oceánicas: el océano Pacífico y el océano Atlántico, que le confieren una extraordinaria diversidad biológica y ecosistémica. Según Wilson (1993) se calcula que existen unas 250,000 especies de plantas vasculares en el mundo y México ocupa el cuarto lugar a nivel mundial en riqueza de flora vascular (Challenger, 1998), pues se han descrito alrededor de 22,800 especies de plantas vasculares (Rzedowski, 1998) y con un total que se espera sume entre 29,000 y 34,000 especies de plantas (Toledo y Ordóñez, 1993; Flores y Gerez, 1994). De este total de especies descritas para México, más del 40% son especies endémicas (Conabio, 2000). 2.3 Amenazas a la biodiversidad Hasta ahora el ser humano ha provocado o al menos favorecido, la extinción de entre el 8 y el 9% de las especies de plantas y se calcula que las tasas actuales de desaparición de especies han aumentado (Chapin III et al., 2000), lo cual representa grandes e importantes amenazas a la diversidad genética (ICBP, 1992). Este problema es particularmente grave en el cinturón intertropical del planeta en donde se concentra la mayor diversidad biológica. En México, algunas de las zonas más severamente afectadas por las diversas acciones antropocéntricas son las cubiertas por los bosques: tropical perennifolio, tropical subcaducifolio, tropical caducifolio y mesófilo de montaña, ecosistemas particularmente ricos en recursos y por lo mismo preferidos por el hombre para sus actividades agropecuarias (Espejo et al., 2005). Casi tres cuartas partes de la superficie del planeta y un 67.3% de la superficie de México están cubiertas por ecosistemas manejados o modificados 4 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba por seres humanos (SAGARPA, 2007), lo cual ha resultado en cambios fuertes en la estructura y el funcionamiento de los ecosistemas a nivel mundial (Vitousek et al., 1997). En todas partes se encuentra destrucción y severa degradación de hábitats naturales y sus implicaciones para la conservación de la diversidad biológica y la sostenibilidad de los recursos naturales tienen importancia global. La alteración extensiva del medio ambiente realizada por el hombre en las últimas décadas del siglo XX ha transformado para siempre el paisaje, cambiando los ciclos biogeoquímicos, alterando el equilibrio ecológico locale, modificando la estabilidad y la productividad de los ecosistemas primarios y propiciando la disminución de la biodiversidad (Chapin III et al., 2000; Hernández-Valencia y LópezHernández, 2002; Stern et al., 2002). El género humano es responsable por la disminución, amenaza y extinción de un gran número de especies, debido al deterioro generalizado en la calidad del aire, agua y suelos, que constituyen los recursos básicos de los que depende la vida (Bennet, 2004). Esta degradación del ambiente natural no es un fenómeno nuevo, lo que produce mucha alarma es la rapidez y la escala global con que se produce el cambio (Brown, 1981; Lunney, 1991). En la actualidad, por ejemplo, se presta mucha atención a la disminución masiva de bosques tropicales y a la pérdida de la biodiversidad; una estimación colocó la tasa de deforestación de bosques tropicales cerrados en 10.7 millones de hectáreas por año (Houghton, 1994). Sin embargo, no sólo los países tropicales experimentan deforestación y pérdida de hábitat; un cambio parecido ocurre en muchos países, incluyendo aquellos donde ya se ha producido un extenso clareo. 2.4 Conservación de la biodiversidad La conservación de la biodiversidad es ahora uno de los más importantes asuntos ambientales de organizaciones conservacionistas gubernamentales y no gubernamentales, particularmente como advertencia de la inminente extinción en masa de especies y en estrecha asociación con el problema de la amplia pérdida de hábitats naturales, está el desafío de mantener y conservar la biodiversidad en paisajes donde predomina la utilización de la tierra por parte de los humanos (Bennet, 2004; Manson et al., 2008). Como la biodiversidad no se encuentra distribuida de manera uniforme; una propuesta eficiente para su conservación es identificar áreas de conservación lo cual aseguraría la supervivencia y evolución de una alta proporción de la biota mundial (ICBP, 1992), aunque en todo el 5 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba mundo, son relativamente pocas en cuanto a número y dispersas en cuanto a ubicación las áreas reservadas a la conservación. El éxito en conservar la biodiversidad de la Tierra dependerá en gran manera de la capacidad de plantas y animales de sobrevivir en paisajes fragmentados con predominio de la presencia humana. Existen muchas familias de plantas que cuentan con un gran número de especies que están en peligro, por ejemplo Agavaceae, Araceae, Arecaceae, Bromeliaceae, Cactaceae, Crassulaceae, Cyatheaceae, Fabaceae, Magnoliaceae, Pinaceae, Zamiaceae, entre otras (SEMARNAT, 2002) y dentro de las cuales las orquídeas representan un porcentaje importante en esta amenaza a la biodiversidad (Hágsater et al., 2005; Pillon y Chase, 2007; Soto-Arenas et al., 2007b). 2.5 La familia Orchidaceae y su problemática Las orquídeas son plantas monocotiledóneas, herbáceas, perennes pertenecientes a la familia Orchidaceae, la cual probablemente es la familia más grande de plantas con flores, con aproximadamente 800 géneros y alrededor de 25,000 especies (Espejo et al., 2002; Dixon et al., 2003; Vázquez-Torres, 2006). Están ampliamente distribuidas en el mundo, se pueden encontrar en todos los ecosistemas a excepción de las regiones polares (Taylor et al., 2003). En México se distribuyen alrededor de 1,200 especies de orquídeas (Espejo y López Ferrari, 1998), con un endemismo de 40%; los estados con mayor diversidad de orquídeas son: Oaxaca, Chiapas y Veracruz (Soto-Arenas y Salazar, 2004). En éste último se han registrado aproximadamente 320 especies de orquídeas (Sosa-Ortega y Gómez-Pompa, 1994) y según diversos autores, esta cifra puede llegar alrededor de 380 especies debido al reporte de otras y a la descripción de nuevas especies. Desafortunadamente esta riqueza se encuentra amenazada, principalmente por la alteración del hábitat y la sobrecolecta de ejemplares para satisfacer la demanda comercial de que son objeto, esto ha originado que muchas especies se encuentren dentro de alguna categoría de riesgo. De acuerdo a la Norma Oficial Mexicana NOM-059-ECOL-2001 (SEMARNAT, 2002) 183 especies de orquídeas presentan problemas de conservación, ninguna está extinta, 106 se encuentran bajo protección especial, 61 están amenazadas, 16 en peligro de extinción, además de que existe en muchos casos un desconocimiento (falta de estudio) de muchas especies que posiblemente las llevaría a ser incluidas en dicha norma y 6 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba de acuerdo a Soto-Arenas et al., (2007b) muchos status han cambiado y algunos taxa se han extinguido. La disminución de las poblaciones es alta debido al disturbio del hábitat natural y si esta disminución no las lleva a su extinción, si ocasiona que parte de su variación genética pueda perderse (Aguirre-Leon, 2005; Trapnell y Hamrick, 2005; Soto-Arenas et al., 2007b). Aunado a esto, existe un comercio que no ha sido debidamente registrado, pero se presume que muchas poblaciones silvestres están seriamente afectadas por el volumen de individuos reproductores que se extraen, así como el deterioro del hábitat (fragmentación del hábitat), provocando como consecuencia el lento o nulo restablecimiento de las poblaciones llegando a ocasionar en algunos casos la extinción local (Sosa y Platas, 1998; Flores-Palacios y Valencia-Díaz, 2007). Actualmente, en nuestro país existe un gran número de especies que presentan problemas de conservación, tal es el caso de Laelia anceps subsp. dawsonii, especie casi extinta en la naturaleza, de la cual se tiene conocimiento sólo existen 11 clones silvestres (Soto-Arenas, 1993); Paphiopedilum xerophyticum de la cual sólo se conocen 7 clones y de Paphiopedilum exstaminodium con tan sólo 30 individuos conocidos (Hágsater y SotoArenas, 1998). Mexipedium xerophyticum y Phragmipedium exstaminodium subsp. exstaminodium ya no pueden sobrevivir en la naturaleza por si solas, pues son tan raras que sus poblaciones no son viables y su hábitat ha desaparecido o está seriamente amenazado (Hágsater et al., 2005). También se tiene conocimiento que Laelia anceps subsp. anceps f. chilapensis y Laelia gouldiana, endémicas de México, se encuentran extintas en la naturaleza; sin embargo es posible contemplarlas en los traspatios de algunas familias de los estados de Guerrero e Hidalgo, respectivamente, quienes aprendieron a cultivarla hace poco más de un siglo (Soto-Arenas, 1993; Hágsater et al., 2005). Los ejemplos mencionados anteriormente, entre muchos más, son muestra clara de la problemática que presenta la familia Orchidaceae y es por ello que este tipo de especies requieren de estudios para conocer su biología, su diversidad genética y los efectos de la fragmentación del hábitat para establecer lineamientos de conservación (Hágsater y Soto-Arenas, 1998). 7 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba 2.6 El género Laelia El género Laelia es uno de los más prominentes dentro de la familia de las orquídeas, gracias a sus flores, a su fácil cultivo y al gran número de disposiciones genéticas se han usado intensivamente para la producción de híbridos (Lindley, 1829; Aguirre-Leon, 2005; Ježek, 2005). Este género de orquídeas se distribuye principalmente en México y de acuerdo a Halbinger y Soto-Arenas (1997) y Salazar et al., (2006) en México se reportan 12 especies de Laelia: Laelia albida, Laelia anceps con 2 subespecies, la subsp. anceps que se distribuye en los estados de la vertiente del Golfo hasta algunos países de Centroamérica y la subsp. dawsonii que se encuentra únicamente en los estados de Oaxaca y Guerrero, Laelia aurea, Laelia autumnalis, Laelia crawshayana, Laelia eyermaniana, Laelia furfuracea, Laelia gouldiana, Laelia halbingeriana, Laelia rubescens, Laelia speciosa y Laelia superbiens. Además de Laelia anceps subsp. anceps también pueden hallarse Laelia rubescens y Laelia superbiens, en países de Centro y Sudamerica. 2.7 Laelia anceps Lindl. subsp. anceps Laelia anceps subsp. anceps es una orquídea importante desde el punto de vista cultural y religioso (Santos-Hernández et al., 2006). Es la especie del género, con distribución en México de mayor importancia hortícola, ha sido y probablemente seguirá siendo una de las grandes favoritas de los cultivadores ya que posee flores características de color rosapúrpura; sin embargo, existen variantes en el tamaño y coloración, es decir, se encuentran plantas con flores blancas o casi blancas llamadas semialbas (Soto-Arenas, 1993), además de otras formas cultivadas que han sido clasificadas y nombradas, pero cabe aclarar que no corresponden a variedades taxonómicas sino a cultivares, o sea son nombres de interés hortícola y no taxonómico (Figura 1). 8 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba A B C D (rosa (B) Figura 1.. Algunas formas de Laelia anceps subsp. anceps. (A) Forma típica (rosa-morado) Veitchiana (C) Semialba (D) Lineata. Li En su lista preliminar de plantas mexicanas raras o en peligro de extinción, Vovides (1981) cataloga como vulnerable a Laelia anceps;; sin embargo, actualmente la subespecie anceps no se encuentra en riesgo ya que existen grandes poblaciones en Veracruz, San Sa Luís Potosí y Tamaulipas (Halbinger y Soto-Arenas, Soto , 1997), además de que es una planta de fácil cultivo, lo que hace que esta especie sea una de las orquídeas mexicanas más utilizada para hibridización (Rose, 1987; Bechtel, 1990, citados por Soto-Arenas, Soto 1993). A pesar de esto, y de acuerdo a Vovides (1981) y Vovides et al., 1997, Laelia anceps Lindl. f. blanca habita en bosques de Quercus en los estados de Puebla y Veracruz que se encuentra en peligro de extinción debido, principalmente, a la colecta de los escasos individuos existentes para su venta ilegal en los mercados y calles y a la alteración del medio por las actividades humanas (Figura 2). Ambas situaciones persisten en la actualidad a pesar de que la familia 9 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba Orchidaceae tiene el segundo más alto número de especies protegidas tanto a nivel nacional como internacional (Flores-Palacios y García-Franco, 2004). 2.7.1 Clasificación taxonómica (Dressler, 1993) REINO: Plantae DIVISIÓN: Magnoliophyta CLASE: Liliopsida SUBCLASE: Liliidae ORDEN: Orchidales FAMILIA: Orchidaceae SUBFAMILIA: Epidendroideae TRIBU: Epidendreae SUBTRIBU: Laeliinae ALIANZA: Cattleya GÉNERO: Laelia Figura 2. Laelia anceps Lindl. subsp. anceps f. semialba ESPECIE: Laelia anceps Lindl. SUBESPECIE: anceps 2.7.2 Sinonimias. Amalias anceps (Lindl.) Hoffmsg., Linnaea 16:228. 1842. Cattleya anceps (Lindl.) Beer, Prakt. Stud. Fam. Orch.: 208. 1854. Bletia anceps (Lindl.) Rchb. F., Walp. Ann. 6: 418. 1862 2.7.3 Etimología. Del latín anceps, con dos filos, en referencia a los pseudobulbos lateralmente comprimidos con bordes angulares pero también haciendo referencia a las brácteas florales de doble filo(Halbinger y Soto-Arenas, 1997; Salazar et al., 2006). 10 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba 2.7.4 Nombres comunes. ”Flor de San Miguel”, “Lirio de Todos Santos”, “Vara de San Diego”, “Monjitas”, “Tzicxochtl”, “Guichilla” y “Calavera” (Halbinger y Soto-Arenas, 1997, Figueroa et al., 2005). 2.7.5 Distribución. Laelia anceps subsp. anceps se distribuye en la Sierra Madre Oriental y la Altiplanicie Central de Chiapas. Puede ser encontrada en la vertiente del Golfo de México; en los estados de Nuevo León, Tamaulipas, San Luís Potosí, Hidalgo, Querétaro, Puebla, Veracruz, Oaxaca y Chiapas (Figura 3), y también en Guatemala y Honduras (Soto-Arenas, 1993; Halbinger y Soto-Arenas, 1997; Salazar et al., 2006; Morales-Linares et al., 2008). Figura 3. Distribución geográfica de Laelia anceps subsp. anceps En Veracruz se encuentra en los municipios de Actopan, Banderilla, Coatepec, Córdoba, Cosautlán, Emiliano Zapata, Fortín de las Flores, Ixhuacán de los Reyes, Huatusco, Jalcomulco, Jilotepec, Naolinco, Orizaba, Puente Nacional, San Andrés Tlalnehuayocan, Teocelo, Tepatlaxco, Tlaltetela, Tlilapan, Veracruz, Xalapa y Zongolica (Arguijo et al., 1993; Díaz, 2005; Flores-Palacios, 1995; Landa, 1992; Soto-Arenas, 1993). 11 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba Existen algunas localidades con poblaciones grandes, de cientos o miles de plantas, en otras regiones son mucho más pequeñas, incluso relictuales y donde las semialbas y demás formas son muy apreciadas y buscadas (Halbinger y Soto-Arenas, 1997), motivo por el cual actualmente es muy difícil encontrarlas en su hábitat. 2.7.6 Ecología. Laelia anceps subsp. anceps es una orquídea epífita o litófita que habita en encinares cálidos y húmedos de Quercus peduncularis y Q. polymorpha del centro de Veracruz, desde la región de Zongolica hasta la de Naolinco, en transición de selva baja caducifolia, generalmente por debajo del bosque mesófilo de montaña entre 800 y 1000 m de altitud (Salazar et al., 2006, Hágsater et al., 2005), siendo más abundante en el bosque cálido de encinos que se establece de manera intermedia entre el bosque mesófilo de montaña y el bosque tropical deciduo, a 700-1200 m de altitud, pero puede parecer ubicua, estableciéndose en muchos otros ambientes, desde las selvas tropicales húmedas hasta encinares algo fríos y bosques de neblina (Soto-Arenas, 1993). Los encinares húmedos de la Sierra Madre Oriental son muy variados y diversos; los de altitudes entre 1000 y 1500 m en Tamaulipas y San Luis Potosí están dominados por Quercus germana, Q. laeta, Q. rysophylla y a veces casi no tienen pinos (Hágsater et al., 2005). Crece en bosques cálidos de encino (Quercus conspersa, Q. oleoides, Q. laeta), usualmente con especies tropicales de árboles caducifolios (Acacia, Erythrina y Bursera) y prefiere lugares con precipitación anual promedio de 1200-2100 mm (Soto-Arenas, 1993; Halbinger y Soto-Arenas, 1997)[Figura 4A]. Tanto en Chiapas como en Oaxaca Laelia anceps subsp. anceps es una planta escasa y está completamente ausente en el bosque mesófilo de montaña o en los encinares a mayor altitud; se restringe a las laderas del sotavento o a los cañones donde la sombra orográfica es marcada (Soto-Arenas, 1993). También se encuentra presente en algunas zonas áridas y matorrales, como lo es el Valle de Tehuacán, tomando como hospederos árboles de mezquite (Prosopis laevigata) y compartiendo espacio con Laelia albida (Figura 4B). Florece en los meses de octubre a diciembre (Halbinger y Soto-Arenas, 1997). 12 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba A B Figura 4. Ejemplares de Laelia anceps subsp. anceps f. semialba en estado silvestre. (A) Bosque de Quercus (B) Matorral xerófilo. Existen algunas orquídeas que tienen aproximadamente la misma distribución geográfica que Laelia anceps subsp. anceps. En los encinares del centro de Veracruz es posible encontrarla habitando sobre un mismo árbol con otras especies de orquídeas como son: Brassia verrucosa, Catasetum integerrimum, integerrimum Domingoa purpurea,, Oncidium maculatum, Prosthechea cochleata, Prosthechea ochraceae, ochraceae Rhyncholaelia glauca, glauca Trichocentrum stramineum,, principalmente, entre otras (Flores-Palacios (Flores Palacios y Martínez, 1993; Soto-Arenas, Soto 1993, Flores-Palacios, Palacios, 1995; Díaz). En el bosque mesófilo de montaña abundan plantas epífitas, como lo es el lirio de todos santos, debido principalmente al clima con neblinas frecuentes y humedad relativa elevada durante todo el año. En muchos de los casos Laelia anceps subsp. anceps puede ser vista creciendo en un mismo hospedero con orquídeas en mayor frecuencia que otras especies y son: Brassia verrucosa, verrucosa Dichaea glauca, Elleanthus cynarocephalus, cynarocephalus Epidendum longipetalum, Epidendrum parkinsonianum, Gongora galeata, g Isochilus latibracteatus, latibracteatus Lepanthes avis, Lycaste aromatica, aromatica Lycaste deppei, Maxillaria densa,, Prosthechea varicosa, Sobralia macrantha (Williams-Linera (Williams y Flores-Palacios, 1993; Flores-Palacios Palacios y García-Franco, García 2004). Un ambiente particular derivado dell bosque mesófilo de montaña, montaña en el centro de Veracruz, son los cafetales. Los cafetales albergan una riqueza importante de orquídeas, y esta diversidad está determinada en buena medida por la estructura y riqueza de los 13 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba cafetales. Un solo árbol original dejado en el cafetal puede tener hasta algunas docenas de especies de orquídeas, siendo las más frecuentes: Dinema polybulbon, Jacquiniella teretifolia, Maxillaria densa, Nidema boothii, Prosthechea ochracea, Scaphyglottis fasciculata, etc., las cuales crecen al igual que Laelia anceps subsp. anceps (Hágsater et al., 2005), demostrado en el estudio de García-Franco y Toledo (2008) en donde se observó que algunos sitios cafetaleros albergaron un mayor número de orquídeas que los bosques; sin embargo, para este caso Laelia anceps se encontró representada únicamente por 7 individuos en un par de sitios. Lo anterior es muestra clara de la problemática que existe debido principalmente al cambio de uso de suelo principalmente con fines agrícolas, pues aunque la especie es relativamente abundante, en estos casos las poblaciones se ven seriamente afectadas. 2.7.7 Descripción de Laelia anceps Lindl. subsp. anceps Hierba epífita o litófita, de 25-50 cm de alto sin incluir la inflorescencia. Raíces rollizas, blanquecinas, de 1.0-3.5 mm de grosor. Rizoma alargado, de 3.0-4.5 cm de largo, 5-7.5 mm de grosor, ligeramente comprimido. Pseudobulbos elipsoide-ovoides, alargados, comprimidos, cortamente estipitados (1-2.5 cm), con 3 entrenudos, verde claro, cubiertos por restos de vainas escariosas, fuertemente adpresas, con 5-7 sulcos longitudinales, bien o mal definidos, de 60-100 mm de largo, 18-34 mm de ancho, 12-21 mm de grosor. Hoja 1, apical, oblongo-elíptica a lanceolada, aguda a obtusa, coriáceo-carnosa, rígida, carinada, conduplicada y subpeciolada en la base, verde, de 12.5-23.3 x 2.3-5.4 cm. Inflorescencia terminal, racemosa, erecto-arqueada, usualmente con 2-3 flores, raramente más de 5, raquis de 2-4 cm de largo, pedúnculo comprimido, verde, de 2.5-5 mm de ancho, de 2.5-3.5 mm de grosor, con muchas (ca. 11-16) brácteas del mismo largo o ligeramente más largas que los entrenudos, tubulares, adpresas, dísticas, progresivamente mayores, largamente triangulares, subagudas-obtusas, conduplicadas, carinadas, escariosas en la antesis, pardo-blanquecino, de 29-70 mm de largo, 6-12 mm de ancho. Brácteas florales similares a las del pedúnculo, pero generalmente mayores, revistiendo al ovario, secando en la antesis, más cimbiformes, con los márgenes papiráceos, de 38-58 x 7-20 mm, cubiertas de mucílago transparente. Flores resupinadas, grandes, muy vistosas, 7.3-12 cm de alto, 5.5-8.0 cm de ancho, tépalos rosado a rosa-púrpura, labelo púrpura con el disco amarillo pálido con líneas púrpura, magenta o pardo-rojo, lóbulo usualmente más oscuro que los tépalos, callo amarillo intenso, brillante, columna blanco-verdosa, frecuentemente con líneas y estrías 14 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba púrpura; aroma débil, dulce. Sin embargo, también existen otras tonalidades y características poco usuales de las flores, destacando las albas, lineatas, veitchianas y semialbas, éstas últimas llamadas así por presentar una coloración blanca en los pétalos y sépalos y únicamente una coloración rosa o amarilla en el labelo. Ovario pedicelado, subterete, ligeramente engrosado hacia el ápice, 6-sulcado, erecto-arqueado, ligeramente torcido, glutinoso, no furfuráceo, verde, de 3.4-4.8 cm de largo, 4-5 mm de grosor. Sépalos extendidos, ápices ligeramente engrosados y ligeramente carinados, agudos, no furfuráceos en la superficie externa; el sépalo dorsal oblongo a estrechamente elíptico, 47-63 x 9-14 mm; los sépalos laterales lanceolados a estrechamente elípticos, oblícuos, 44-61 x 9-15 mm. Pétalos extendidos, lanceolados a elípticos, agudos a subagudos, ligeramente convexos, ampliamente cuneados, márgenes ligeramente ondulados, de 49-69 x 17-27 (32) mm. Labelo trilobado, 38-47 mm de largo total, 31-40 mm de ancho entre los lóbulos laterales extendidos; lóbulos laterales erectos, los márgenes imbrincados sobre la columna, oblicuamente oblongo-elípticos, redondeados en la base, obtusos a oblicuamente truncados en el ápice y con el borde algo reflexo en el ápice, de 28-36 x 14-17 mm; lóbulo medio deflexo, conduplicado, difícil de extender, oblongo-elíptico a espatulado, truncado a emarginado en el ápice, margen ondulado, de 18-24 x 12-26 mm; callo formado por una lámina longitudinal engrosada, muy baja, canaliculada en la base, alzada y carnosa en el ápice (en el tercio basal de lóbulo medio), sulcada apicalmente, terminando en 3 quillas, la central más larga, quillas ligeramente irregulares a eroso-dentadas u onduladas, 25-34 mm de largo, 4-5 mm en su parte más ancha, de 1.5-2 mm de alto. Columna ligeramente arqueada, áptera, semiclaviforme, con un nectario seco, cónico, en la base, de 4-5 mm de profundidad, márgenes ventrales prominentes, con dos amplios triángulos pequeños en la base; de 18-21 mm de largo, 5.5-6.5 mm de ancho, clinandrio diminutamente denticulado, con un diente apical lingüiforme, truncado, deflexo. Antera cordiforme-cuadrada, truncada, 8-locular, blanco-crema y pardo, de 3.5 mm de largo, 2 mm de ancho y 2.5 de grosor de 2.0 x 2.5 mm de largo, con 8 polinios amarillos, comprimidos, los superiores cuadrados, redondeados, 1.1 x 1.0 mm; los inferiores triangulares-ovados, de 1.3 x 0.8 mm; unidos a 4 caudículas fusiformes, granulosas. Rostelo una lámina transversa, subcuadrada-semicircular, convexa, blanca, 2.5 x 2.0 mm. Cavidad estigmática transversalmente elíptica-obovada, con los lóbulos laterales evidentes, verde, brillante, de 3 x 4.0-4.5 mm. Cápsula elipsoide-ovoide, con 3 costillas marcadas, planas, y 3 anchas y poco delineadas, verde, de 4.0-4.8 cm de largo, 2.0-2.2 cm de grosor, con un rostro de 7 mm y un pedicelo de 15 mm (Lindley, 1829; Halbinger y Soto-Arenas, 1997)[Figura 5]. 15 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba Figura 5. Ilustración científica de Laelia anceps Lindl. subsp. anceps. Tomada de Halbinger y Soto, 1997. 16 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba 2.8 Estrategias para la conservación de orquídeas La orquideoflora mexicana, así como toda la biodiversidad existente, requiere medidas encaminadas a su conservación y/o recuperación. Ante esto, existen dos modalidades de conservación, es decir, conservación in situ y ex situ. La conservación in situ constituye la manera más apropiada de enfocar la problemática de la conservación, tiene por objetivo permitir que la diversidad biológica se mantenga por si sola en el ecosistema que habita y pueda evolucionar (Wyse y Sutherland, 2000). Sin embargo, este tipo de conservación en muchos casos es muy difícil de llevar a cabo debido a diversos problemas (Hágsater et al., 2005), por lo que es frecuente que se tenga que apoyar o recurrir a la conservación ex situ, la cual se define como el mantenimiento de los componentes de la diversidad biológica fuera de sus hábitats naturales, constituye un proceso que implica tanto el almacenamiento de los recursos genéticos en bancos de germoplasma, así como el establecimiento de colecciones de campo, por lo tanto debe ser considerada en toda estrategia de conservación como un complemento para la preservación de especies y recursos genéticos in situ, principalmente cuando se trata de especies críticamente amenazadas (Hágsater et al., 2005). Los métodos de conservación ex situ implican la recolección de muestras representativas de la variabilidad genética de una especie y su mantenimiento fuera de las condiciones naturales (Iriondo, 2001). Encontrándose que las colecciones vivas de orquídeas tienen un papel importante en la conservación de las mismas (Dixon et al., 2003). Existen diferentes modalidades de conservación ex situ: a) Bancos de germoplasma, b) Centros de tenencia y manejo que se dividen en Centros de Fauna (zoológicos, centros de rescate, centros de tránsito, zoocriaderos) y Centros de Flora (jardines botánicos, viveros y colecciones en campo) (Conabio, 1998). Incluido en las alternativas de conservación ex situ se encuentra el cultivo de tejidos vegetales (CTV), el cual ha demostrado ser una excelente herramienta biotecnológica para la generación y conservación de gran cantidad de especies escasas en la naturaleza, en peligro de extinción o de interés económico, ya que puede proporcionar grandes ventajas sobre los métodos de propagación convencionales (Bueno et al., 2003; Salazar y Mata, 2003; Chawla, 2004; Pedroza-Manrique y Mican-Gutiérrez, 2006; Suárez-Quijada, 2006; Retes-Pruneda et al., 2007). 17 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba 2.8.1 El cultivo de tejidos como alternativa de conservación El CTV o cultivo in vitro, es un conjunto de técnicas que involucra el cultivo bajo condiciones asépticas de prácticamente cualquier estructura vegetal (embriones, semillas, retoños, inflorescencias, tallos, raíces, meristemos, células en suspensión, protoplastos, anteras, granos de polen y ADN) los cuales son llamados explantes, en un medio de cultivo químicamente definido y bajo condiciones ambientales controladas (fotoperiodo, intensidad luminosa, temperatura). Es una herramienta invaluable para la resolución de problemas básicos y aplicados en la biología vegetal, por lo cual ha sido utilizado para la propagación y conservación de los recursos fitogenéticos (Iriondo, 2001). Mediante técnicas de cultivo in vitro es posible la propagación masiva (micropropagación) de especies de interés hortícola, ornamental y silvestres (Thorpe et al., 1991). Existen algunos métodos de conservación de germoplasma in vitro y a un nivel elemental la conservación in vitro se logra mediante subcultivos periódicos, manteniendo el suministro de nutrientes y proporcionando una protección continua contra los ambientes desfavorables y patógenos (Brian, 1990). Por otro lado, dentro de las técnicas de cultivo in vitro, la IBPGR (1986) distingue dos tipos de conservación: 1) banco de germoplasma activo in vitro (conservación a corto mediano plazo) y 2) banco de germoplasma base in vitro (crioconservación, conservación a largo plazo). Los bancos de germoplasma constituyen una reserva invaluable de la diversidad genética (Dixon et al., 2003). Las ventajas dentro de la preservación de colecciones activas in vitro para un amplio rango de especies, incluyen la manutención en un estado libre de enfermedades, tasas de multiplicación relativamente más rápidas, facilidad de enraizamiento, pocos insumos, reducidos labores de mantenimiento, fácil intercambio de germoplasma internamente y entre países (Towill y Roos, 1989). Dentro de la conservación a mediano plazo existen métodos para inducir crecimiento mínimo y pueden requerir el uso de retardantes del crecimiento, como el ácido abscísico, o componentes con efecto osmótico como el sorbitol, manitol y sacarosa los cuales pueden prolongar los periodos entre subcultivos, así como la alteración del medio básico, mediante la omisión o reducción de algún factor esencial para el crecimiento normal del explante y la alteración de las condiciones físicas del cultivo. Estos métodos pueden ser utilizados solos o en combinación y son aplicables a corto o mediano plazo (Touchell y Dixon, 1999; Scocchi y 18 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba Rey, 2004). El almacenamiento a ultra bajas temperaturas (crioconservación) en nitrógeno líquido (-196°C), se reconoce como la única opción disponible para el almacenamiento a largo plazo del germoplasma de especies propagadas vegetativamente y especies con semillas recalcitrantes e intermedias y de aquellas con algún interés particular (hortícola, medicinal, en peligro, transgénicas, etc.) [Villalobos, 1985; Tsukazaki et al., 2000; Sarasan et al., 2006]. La crioconservación permite la suspensión del metabolismo, donde no ocurre división celular y por lo tanto, el material permanece sin modificaciones o alteraciones por periodos extensos de tiempo (Engelmann, 2004). Es considerada una alternativa ideal para evitar la pérdida del potencial embriogénico durante los subcultivos constantes y como una vía para prevenir la variación somaclonal durante un largo mantenimiento de cultivos embriogénicos (Wang et al., 2004). Las técnicas de Cultivo de Tejidos han demostrado ser una excelente opción para la producción de especies silvestres con problemas de propagación por métodos convencionales o con poblaciones extremadamente reducidas, especialmente en las especies raras, amenazadas, endémicas, en peligro de extinción y de importancia comercial (Msikita et al., 1997; Mata-Rosas et al., 2001a; Mata-Rosas et al., 2001b; MoebiusGoldammer et al., 2003; Mata-Rosas et al., 2006; Sánchez-Morán y Pérez-Molphe-Balch, 2007; Tinoco-Juárez, 2006; Gutiérrez et al., 2008). Entre los beneficios del CTV se encuentra la micropropagación, mediante la cual es posible lograr una producción rápida, masiva y libre de patógenos de cualquier planta deseada (Fay, 1994, citado por Mata-Rosas, 2000). 2.8.1.1 Micropropagación La micropropagación consiste en la propagación de un genotipo a gran escala a través del empleo de técnicas de cultivo de tejidos. El cultivo es así una herramienta muy útil en los programas de mejoramiento, ya que tiene el potencial de producir plantas de calidad uniforme a escala comercial, a partir de un genotipo selecto y con una tasa de multiplicación ilimitada en condiciones artificiales (Debergh y Read, 1993; Olmos et al., 2004). Generalmente es la multiplicación asexual de propágulos pequeños, lo cual significa que las plantas que crecen a partir de partes vegetativas no son individuos en el sentido ordinario, porque son partes transplantadas y tales partes son genéticamente idénticas, es decir, son 19 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba clones (Chawla, 2004); sin embargo, también se emplean semillas y esporas como material de siembra (Lozoya, 1985; Stewart y Kane, 2006; Thompson y Edwards, 2006). Esta técnica ofrece la oportunidad de propagar y conservar germoplasma vegetal (Thakur y Karnosky, 2007) y al igual que el CTV en general, está basada en el principio de la totipotencialidad celular, es decir, una célula vegetal tiene toda la información genética necesaria para constituir un individuo completo o desempeñar las funciones de cualquier órgano o tejido vegetal (Pierik, 1990; Pimienta-Barrios et al., 2006). Originalmente en 1974, Murashige describió tres pasos básicos para la micropropagación, posteriormente Deberg y Maene (1981) reconocieron que los problemas de contaminación a menudo están asociados con el establecimiento del explante original y establecieron el estadio 0. Actualmente y como resultado del incremento en la información se tiene que la micropropagación se lleva a cabo en 5 etapas (Kane, 2005; Kane et al., 2008) las cuales son: Etapa 0: Selección de la planta madre. La calidad del explante y su posterior respuesta in vitro está significativamente influenciada por las condiciones fitosanitarias y fisiológicas de la planta donadora. La planta donadora debe elegirse en base a las características deseables. Una vez seleccionados los individuos, es preciso definir el tipo de explante a establecer en condiciones in vitro. En general, los órganos jóvenes o bien rejuvenecidos son los que tienen mejor respuesta en el establecimiento que los obtenidos a partir de materiales adultos (Olmos et al., 2004). Etapa 1: Establecimiento de los cultivos in vitro. El establecimiento aséptico del explante (libre de patógenos) depende del objetivo que se persiga. Los explantes primarios obtenidos a partir de la planta donadora pueden ser meristemos apicales, puntas de brotes o yemas laterales. Un cultivo está establecido cuando únicamente crece el explante sembrado sin la presencia de hongos o bacterias. Etapa 2: Multiplicación. El objetivo de esta etapa es mantener y aumentar la cantidad de brotes para los nuevos ciclos de multiplicación sucesivos y poder destinar parte de ellos a la siguiente etapa de producción (enraizamiento, bulbificación, etc.). En esta etapa, los medios de cultivo, los reguladores de crecimiento como auxinas, citocininas y ácido giberélico, así como las condiciones de crecimiento juegan un papel crítico sobre la multiplicación clonal de los explantes (Olmos et al., 2004), por lo que resulta de vital 20 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba importancia determinar las concentraciones adecuadas de auxinas y citocininas adicionadas al medio de cultivo. Etapa 3: Elongación y enraizamiento. En esta etapa se produce la formación de raíces adventicias. En las especies herbáceas es relativamente fácil mientras que en las especies leñosas es complicado por su limitada capacidad rizogénica. Este proceso involucra la elongación de los brotes y su enraizamiento, necesarios para el futuro establecimiento en suelo de las plántulas obtenidas in vitro para lo cual se requiere en la mayoría de los casos de la aplicación de auxinas. Etapa 4: Establecimiento ex vitro. Esta etapa es crucial pues el principal objetivo de la conservación es obtener plantas capaces de sobrevivir en condiciones ex vitro. La supervivencia depende de la capacidad del cultivo para ser establecido en condiciones de invernadero, en donde se espera que las plántulas crezcan vigorosamente. Las plantas propagadas por esta vía son difíciles de trasplantar por dos razones principales: nutrición heterotrófica y un bajo control de la pérdida de agua. En el primer caso, las plantas cultivadas in vitro en presencia de sacarosa y bajo condiciones limitadas de luz y cambio gaseoso presentan una baja capacidad para realizar la fotosíntesis. Durante la aclimatación, es necesario para las plantas pasar rápidamente del estado heterotrófico-mixotrófico al fotoautotrófico para sobrevivir. Desafortunadamente esta transición no es inmediata. Por otro lado, las características anatómicas y fisiológicas de las plantas propagadas in vitro bajo una humedad relativa cercana al 100%, contribuyen a una limitada capacidad en las plantas de regular la pérdida de agua después del trasplante. Estas características incluyen la reducción en la cera epicuticular de las hojas, mesófilo poco diferenciado, función estomática anormal y una inadecuada conexión vascular entre los brotes y las raíces (Clemente, 1999). Para superar estas limitaciones, las plántulas son trasplantadas a un sustrato estéril bien drenado y mantenidas inicialmente a una humedad relativa alta y luz reducida. La humedad relativa debe ser mantenida con cámaras húmedas. Las plantas son aclimatadas gradualmente durante 1-4 semanas. Durante este estadio, el crecimiento y desarrollo de las plantas pueden ser afectados por las condiciones in vitro de las cuales provenían. El proceso de aclimatación de las plántulas obtenidas por cultivo in vitro es muy complejo, por lo que el control estricto de las condiciones ambientales durante esta fase es 21 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba determinante en un sistema de micropropagación (Martínez-Ruíz et al., 2005) y debido a que todos los cultivos responden de manera distinta durante esta etapa dadas las características tan peculiares que presentan, resulta de gran utilidad, aplicar soluciones nutritivas a las plantas para facilitar y acelerar su aclimatación, con lo cual la supervivencia de las mismas se incrementaría considerablemente (Enríquez et al., 2000; Enríquez et al., 2005). De los problemas más comunes e importantes para el cultivo de orquídeas destaca la nutrición, debido al poco uso de los fertilizantes y desconocimiento de cómo suministrarlos eficientemente para acelerar el crecimiento y desarrollo vegetativo, aumentar la precocidad en la floración, prolongar la vida postcosecha e incrementar la calidad comercial. Por otro lado, la fertilización adecuada de estas plantas permite el establecimiento de una asociación simbiótica entre los hongos endomicorrízicos y las raíces de las orquídeas, que pueden reducir los requerimientos de los fertilizantes y, en consecuencia, los costos de producción (Espinosa-Moreno et al., 2000). El crecimiento de las plantas está en función del aire, luz, temperatura, agua, nutrimentos y la planta depende del suelo o sustrato para obtener estos últimos. Cuando se habla del suministro de nutrimentos se considera que fertilidad es la capacidad inherente que tiene el suelo para suministrar los requerimientos nutrimentales a la planta en cantidades necesarias para su desarrollo. Al hacer referencia a la nutrición de la planta se considera la interrelación que se da entre el cultivo y los nutrimentos, es decir, manejar las cantidades en función de la demanda y el papel que desempeña cada uno de ellos en el crecimiento y desarrollo del cultivo (Rodríguez et al., 2008). Un fertilizante es cualquier sustancia utilizada para enriquecer el suelo y mejorar la productividad de un cultivo (Finck, 1988). La denominación de fertilizante se ha venido dando, generalmente, a los productos químicos inorgánicos que contienen alguno o varios de los tres macroelementos primarios: nitrógeno, fósforo y potasio (Domínguez, 1997). Como fertilizantes minerales o químicos se conocen aquellos productos obtenidos mediante procesos químicos desarrollados a escala industrial, que tienen igualmente unas cantidades mínimas de alguno de los elementos principales. Sin embargo, actualmente y aparte de los fertilizantes químicos se puede hablar de fertilizantes orgánicos, que son los derivados de productos vegetales o animales, que contienen unas cantidades mínimas de alguno de los 22 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba elementos principales indicados. Esto es a efectos de poder ser comercializados. Naturalmente, todos los productos orgánicos contienen cantidades variables de elementos nutritivos que, desde el momento en que se utilicen en la explotación suponen una aportación de dichos elementos que ha de tenerse en cuenta en la fertilización (Domínguez, 1997). Entre éstos se encuentran las compostas que se obtienen por fermentación de diferentes materiales orgánicos como estiércoles, desechos de rastros, residuos vegetales y basuras (Núñez, 2008). También entre éstas se encuentra el humus de lombriz o lombricomposta, que es el producto resultante de la transformación digestiva y metabólica de la materia orgánica en descomposición, mediante la crianza sistemática de poblaciones de lombrices de tierra (CTNNPAP, 2007), la denominación de humus se aplica una vez que se ha perdido la estructura orgánica microscópica original y se hace amorfo. El papel del humus de lombriz es muy importante ya que se trata de un compuesto utilizable por las plantas en su nutrición y funciona como almacén de nutrientes, que impide que éstos se lixivien; los retienen en su superficie, listos para que las plantas puedan hacer uso de ellos (Rodríguez et al., 1998). La aplicación de fertilizantes a plantas producidas in vitro resulta en una aclimatación más acelerada y dependiendo de los requerimientos de cada cultivo se pueden aplicar distintas formulaciones de los mismos, por ejemplo, fertilizantes de fórmula completa triple 17 (Enríquez et al., 2005; Martínez-Ruiz et al., 2005), triple 20, 19-31-17, 15-30-15 (solubles) y 13-13-13 (lenta liberación) con o sin micorrizas (Espinosa-Moreno et al., 2000). A pesar de la gran utilidad que presenta la micropropagación, las 5 etapas que la conforman muestran complejidades y que debido a las diferencias entre los taxa es difícil definir un protocolo sencillo de aplicación amplia. Por esto, es necesario definir experimentalmente los requerimientos necesarios en cada una de ellas para contar con un protocolo eficiente de propagación in vitro por cada especie. Existen tres vías diferentes para la regeneración de plantas in vitro: brotación y proliferación de yemas, embriogénesis somática y organogénesis. Proliferación de yemas preexistentes. Es la estimulación de yemas axilares, las cuales usualmente se encuentran en la base de cada hoja y que desarrollan en un brote, en este caso se parte de meristemos para la obtención a partir de ellos de una o varias plantas 23 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba completas. Ocurre normalmente cuando las yemas axilares son liberadas de la dominancia apical, principalmente por manipulación de los reguladores del crecimiento en el medio nutritivo, principalmente citocininas. Los brotes después son separados y enraizados para producir plantas o los brotes son usados como propágulos para propagaciones futuras (Bonga y Von Aderkas, 1992; Chawla, 2004). Embriogénesis somática. Es un proceso de propagación asexual en el cual células somáticas bajo ciertas condiciones de cultivo in vitro, tienen la capacidad de diferenciarse en estructuras bipolares que poseen el brote y la raíz, es decir, embriones somáticos (Egertsdotter, 1999; Smith, 2000). Los embriones somáticos tienen, al igual que los cigóticos, la capacidad de formar una nueva planta después de un proceso de germinación, con la diferencia de que la embriogénesis somática al ser una vía de propagación asexual permite que la nueva planta sea exactamente igual a la planta donadora de la célula inicial. Para inducir la embriogénesis somática, la célula somática debe ser cultivada en un medio que contenga regularmente auxinas y posteriormente tiene que ser transferida a un medio libre de hormonas para el desarrollo embrionario (Smith, 2000). Existen dos rutas de embriogénesis somática: Embriogénesis somática directa. Los embriones se forman directamente del explante en ausencia de la proliferación de callo. Esto ocurre a través de “células proembriogénicas” donde éstas son confinadas para el desarrollo embriogénico y sólo necesitan ser activadas. Embriogénesis somática indirecta. La forma indirecta implica la necesidad de una inducción para que las células sigan la vía embriogénica, tras pasar por una fase de proliferación (callo) y cambiar su competencia a la expresión de embriogénesis. En la mayoría de los casos la embriogénesis ocurre a través del método indirecto. Organogénesis. El término organogénesis se refiere al proceso de diferenciación a través del cual órganos vegetales como raíces, brotes, yemas florales, etc., son formados a partir de los explantes cultivados in vitro (Chawla, 2004). La regulación in vitro para promover la organogénesis fue demostrada por Skoog y Tsui desde 1948 utilizando callos de tabaco, por su parte Skoog y Miller en 1957, complementaron la participación hormonal de dicho fenómeno, y desde entonces el tabaco ha sido usado como modelo para estudios 24 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba morfogenéticos sobre la regeneración de plantas a partir de tejidos y células (Gaba, 2005). Entre los órganos que se pueden formar están las raíces o los brotes adventicios, los cuales son estructuras muy similares a una yema y tienen la capacidad de originar una nueva planta después de elongarse y formar raíces. La organogénesis es más común que la embriogénesis somática y tiene un gran potencial para la propagación clonal masiva de plantas. De acuerdo a Chawla (2004), la producción de plantas a través de la organogénesis se lleva a cabo por dos vías: 1) la aparición de órganos adventicios directamente del explante y 2) organogénesis a través de la formación de callo. Formación directa de órganos adventicios. Los tejidos somáticos de plantas superiores son capaces, bajo ciertas condiciones, de regenerar plantas adventicias. Los brotes adventicios son los que surgen directamente del explante sin el pasar por la fase de callo. Organogénesis vía formación de callo. También llamada organogénesis indirecta, consiste en la regeneración de plantas a partir del explante en cultivo implicado en la formación de callo y su posterior diferenciación en brotes que al individualizarse se consolidan como plantas completas. 2.8.2 Suplementos naturales Muchas veces por la idea de potenciar el desarrollo de las plantas se recurre a la adición de compuestos orgánicos en el medio de cultivo. Los complejos orgánicos son un grupo de suplementos indefinidos tales como el jugo de naranja, tomate, piña, uva, hidrolizado de caseína, agua de coco (endospermo líquido de coco), savia de abedul, pulpa de plátano, homogeneizado de papa, emulsión de pescado, extracto de germen de cebada, peptona, etc., (Hicks, 2004; Beyl, 2005). Efectos benéficos por la adición de compuestos orgánicos al medio de cultivo han sido reportados en muchos estudios con orquídeas (Lu y Lee; 1990; Chen y Chen, 1998; Shiau et al., 2002; Lo et al., 2004;). Dentro de los compuestos orgánicos que más se han empleado, destacan el endospermo líquido de coco, hidrolizado de caseína y extractos vegetales como la papa. El endospermo líquido de coco es una sustancia muy compleja, ya que cuenta con una amplia gama de componentes orgánicos e inorgánicos, es rico en magnesio y fosfato, tiene un alto contenido en azúcares indispensables para el desarrollo, además de 25 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba aminoácidos, vitaminas, hormonas, ácidos grasos, enzimas y factores de crecimiento (Arditti y Ernst, 1993). La caseína es la proteína más abundante de la leche, es un complejo de proteínas específicas que contienen grupos fosfóricos, esterificados en la serina o treonina. Tienen un carácter fuertemente ácido, debido a grupos carboxilicos libres y a los de ácido fosfórico. Se puede definir, de forma simple, como la proteína precipitada por acidificación de la leche desnatada a ph 4.6 y a 20°C. Es empleada debido a que tiene un alto contenido de aminoácidos esenciales (alrededor de 20), además de asumir un papel importante en el transporte de minerales (Beyl, 2005). La papa es un tubérculo constituido principalmente por agua (80%), dentro de sus componentes también se encuentran los carbohidratos que constituyen el 16-20% entre los que destacan los almidones que representan el 75% de la materia seca de la papa. La concentración de azucares sencillos es baja siendo los más importantes la glucosa, fructosa y sacarosa. Las proteínas son el nutriente más abundante después de los carbohidratos constituyendo el 2% destacando las albúminas (49%) y globulinas (26%) como las fracciones proteicas más abundantes seguidas de prolaminas (4.3%) y glutelinas (8.3%). Asimismo destaca la presencia de gran cantidad de enzimas y aminoácidos libres cuyas concentraciones dependen de la forma de cultivo y almacenamiento. Los lípidos no tienen importancia desde un punto de vista cuantitativo (0.1%). Existe gran cantidad de vitaminas hidrosolubles tales como la vitamina C y algunas del complejo B. También la papa es rica en minerales, los cuales constituyen el 1% del total de la papa, destacando el potasio como elemento mayoritario y cantidades moderadas de fósforo, cloro, azufre, magnesio y hierro (Centro de Estudios Agropecuarios, 2001; Alonso, 2002). Estos y otros compuestos orgánicos son a menudo usados en combinación con otros componentes definidos para promover el crecimiento y desarrollo deseados (Beyl, 2005) y como recomendación de algunos cultivadores (Hicks, 2004). 2.8.3 Retardantes del crecimiento La conservación in vitro de germoplasma se centra en controlar el crecimiento normal de los explantes viables, manipulando ya sea la constitución del medio de cultivo y/o las condiciones de almacenamiento. Existen diferentes métodos para poder lograrlo, tal es el 26 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba caso de la depresión del metabolismo mediante la incubación a temperaturas no óptimas o a través de medios químicos como inductores de estrés osmótico. Los compuestos que se han utilizado para retardar el crecimiento en cultivo de tejidos vegetales son: ácido abscísico, manitol, sorbitol, sacarosa fosfán D., hidrazida málica, diaminazida, clorhidio de trimetil amonio, prolina, entre otros (Wilkins y Dodds, 1983; citado por Mata-Rosas, 1992; Yeoman, 1986; Touchell y Dixon, 1999; Scocchi y Rey, 2004). De manera general, un estresante es cualquier factor ambiental con capacidad de producir un daño químico o causar un daño físico en la planta, teniendo la capacidad de poder revertirse o ser permanente. Un estresante osmótico es capaz de incrementar el potencial osmótico de las células dando un potencial de presión (Tal, 1983). Los carbohidratos (azúcares) constituyen la clase de compuestos que se encuentran en las plantas en mayor cantidad, los cuales desempeñan una función muy importante en el metabolismo vegetal. Los azúcares no son solamente los primeros compuestos orgánicos complejos que se forman en las plantas como resultado del proceso fotosintético, también representan la mejor fuente de energía respiratoria; almacenan energía en forma de sacarosa e intervienen en la formación de las paredes celulares (Taiz y Zeiger, 1998). Dentro de éstos, se encuentran los monosacáridos que pueden reducirse a los correspondientes alcoholes-azúcar, estos son alcoholes acíclicos polihídricos que se estudian junto con los inositoles y se les llama polioles. Se encuentran tanto en forma libre como combinada en gran número de plantas, desde las algas hasta los órdenes superiores, y el más común de los polioles se llama sorbitol (D-glucitol). El manitol (D-manitol) al igual que el sorbitol, se encuentra en muchas plantas, pero a deferencia de éste, sólo se deposita en el exudado de las mismas. Se encuentra en las algas pardas y se usa ampliamente debido a su capacidad como osmoregulador, ya que se asume que éste no penetra las células vegetales y en caso de hacerlo no es metabolizado por las células (Salisbury y Ross, 1978, citado por Miranda, 1992; Scocchi y Rey, 2004; Molassiotis et al., 2006). El sorbitol, junto con la sacarosa, es el principal medio de transporte de carbohidratos en el floema y desempeña una función muy importante en el metabolismo. El manitol y el sorbitol son hexitoles, los cuales son buenos inductores de estrés osmótico para 27 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba el aislamiento de protoplastos (Tokuhara y Mii, 2003; Scocchi y Rey, 2004; Veilleux et al., 2005). En el cultivo de tejidos, las células verdes generalmente no tienen actividad fotosintética y requieren una fuente de carbón. La sacarosa, glucosa, y algunos otros como la fructosa son esenciales como fuente de carbón (Tokuhara y Mii, 2003), pues ayudan en el crecimiento de las células vegetales en cultivo, éstas en 2-5% (w/v) son comúnmente usadas en el cultivo in vitro. Otras fuentes de carbono, tales como la fructosa y el almidón, también pueden ser usados. Concentraciones bajas de carbohidratos pueden ser usadas en el cultivo de protoplastos, pero niveles más altos pueden ser usados en el cultivo de embriones o anteras (Smith, 2000). Se han observado mutantes por utilizar otros azúcares como manosa y galactosa o alcoholes de azúcar incluido el sorbitol (Gamborg y Phillips, 1995). La mayoría de los medios de cultivo vegetales utilizan una concentración de 20-60 g/l de sacarosa, ya que a concentraciones más altas producen estrés osmótico en las células dando como resultado una inhibición en el crecimiento celular (Chawla, 2004; Beyl, 2005; Li et al., 2005). El ácido abscísico (ABA), conocido anteriormente como dormina o agscisina, es un regulador del crecimiento con carácter inhibidor del crecimiento natural presente en plantas, por lo cual no se considera un importante regulador del crecimiento vegetal para el cultivo de tejidos, únicamente para facilitar la maduración de embriones somáticos y cultivar algunas plantas leñosas (Beyl, 2005). Es un sesquiterpenoide de 15 carbonos sintetizados en forma parcial en cloroplastos y otros plastidios por la ruta del ácido mevalónico. Ocasionalmente, el ABA estimula algunos procesos de regeneración y raramente puede también reducir la producción de embriones somáticos (Gaba, 2005). El ABA aumenta la tolerancia de las plantas a varios tipos de estrés de origen biótico y abiótico. Sin embargo, su efecto principal no es la abscisión directa de órganos, sino que su contenido específico puede controlar o disminuir los niveles endógenos promotores. Su acción regula las fases de desarrollo, en concreto el incremento de este regulador favorece la imposición de reposolatencia en órganos y estructuras vegetales (Hopkins y Hüner, 2004; Noodén, 2004; Pimienta-Barrios et al., 2006). Otro método efectivo para el almacenamiento de germoplasma activo in vitro es mediante el empleo de bajas temperaturas (Iriondo, 2001; Sarasan et al., 2006), ya que 28 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba todas las etapas del ciclo de vida de las plantas (germinación, crecimiento y floración) pueden resultar afectadas por éstas, y como cada proceso fisiológico tiene un óptimo particular, no es posible definir una única temperatura óptima para la planta, pero sí, en cambio, un intervalo óptimo de temperaturas, por debajo de las cuales se produce una disminución generalizada de la tasa metabólica (Tognetti y Salerno, 2005). Células o tejidos pueden ser conservados a bajas temperaturas, arriba del punto de congelación, con un crecimiento más lento que en condiciones normales. Los procesos de crecimiento son reducidos al mínimo por una serie de factores limitantes como la temperatura, nutrición, hormonas, etc. Por este método, el agua en los tejidos es mantenido en condiciones líquidas, pero todos los procesos bioquímicos son detenidos. Todos los cultivos en crecimiento lento están estáticos y por consiguiente sólo requieren un espacio adecuado (Chawla, 2004). Plantas nativas de climas cálidos sufren daños cuando son expuestas a bajas temperaturas, no de congelación y los signos externos de daño por exposición a bajas temperaturas toman una variedad de formas, dependiendo de la especie, edad de la planta y duración de la exposición. Plantas jóvenes (recién germinadas) muestran signos de reducción foliar, marchitamiento y clorosis. En casos extremos, ocurre un oscurecimiento y aparición de tejidos muertos (necrosis) y/o muerte de la planta. Síntomas de daño por la exposición a bajas temperaturas reflejan un amplio rango de disfunciones metabólicas en los tejidos, incluyendo: reducción en la respiración, fotosíntesis y síntesis de proteínas y alteración en los patrones de síntesis de proteínas (Hopkins y Hüner, 2004). Yeoman (1986) indicó que la vía más adecuada para suprimir la división celular y la síntesis de DNA a fin de mantener estabilidad genética de cultivos in vitro es mediante la incubación a bajas temperaturas. La reducción de la temperatura ha mostrado ser efectiva para conservar muchas especies de interés, pero debe considerarse que las especies están adaptadas a diferentes condiciones ecológicas y por ello la temperatura empleada tendrá que variar con cada una de ellas (Rublúo, 1985; Thakur y Karnosky, 2007). 2.8.4 Reguladores del crecimiento vegetal Se tiene conocimiento que el crecimiento en las plantas es un proceso dinámico, complejo y que está rigurosamente controlado. En este caso los reguladores del crecimiento, no únicamente dentro de la planta, sino también a nivel de órgano, tejido y célula juegan un 29 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba papel importante en el control del crecimiento (Barba, 1987). Las fitohormonas o reguladores del crecimiento vegetal (PGR) son las responsables del desarrollo de las plantas, ya que ejercen efectos dramáticos a bajas concentraciones (0.001-10µM). El tipo y concentración de los PGR usados varían con el propósito que se tiene hacia el cultivo. Auxinas y citocininas son los principales grupos de reguladores del crecimiento en las plantas, están involucradas en la regulación de la diferenciación y división celular (Fehér et al., 2003), por lo cual la adición de PGR al medio de cultivo modifica el crecimiento y desarrollo del material vegetal in vitro (George y Sherrington, 1984). 2.8.4.1 Auxinas El término “auxina” fue acuñado por F. W. Went en 1982. El significado literal de esta palabra es incrementar o crecer (Pimienta-Barrios et al., 2006). Fue el primer regulador del crecimiento descubierto en plantas (Sinha, 2004). Las auxinas se encuentran en plantas superiores e inferiores (algas, hepáticas y helechos), así como en hongos y bacterias (se localizan principalmente en regiones meristemáticas y órganos en crecimiento tales como coleóptilo, puntas de raíces, yemas apicales y semillas en germinación (Hopkins y Hüner, 2004). Las auxinas tienen una amplia variedad de efectos en el crecimiento vegetal y morfogénesis (Taiz y Zeiger, 1998), son esenciales y juegan un papel muy importante en muchos procesos del desarrollo, incluidos la división celular y el desarrollo tisular, formación de raíces adventicias, y embriogénesis somática. Además inducen la formación de raíces e inhiben el desarrollo o interfieren con la morfogénesis, produciendo órganos anormales, callos o teratomas (Morel, 1974). Generalmente, cuando la concentración de auxinas es baja, el enraizamiento es favorecido, y cuando la concentración es alta, ocurre la formación de callo. Dentro de las auxinas naturales se encuentra el ácido 3-indolacético (AIA), que se ha encontrado en muchísimas especies vegetales incluidas el olivo y tabaco, está involucrado en casi todos los aspectos del crecimiento y desarrollo, así como el ácido 3-indolbutírico (AIB), ácido fenilacético (AFA)[reportado en semillas de legumbres] y el ácido 4-cloroindol-3acético (Hopkins y Hüner, 2004; Pimienta-Barrios et al., 2006). El AIA puede ser reversiblemente convertido en AIB. Estos compuestos al encontrarse naturalmente en la 30 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba planta, tienden a ser metabolizados por los tejidos, por lo que se utilizan frecuentemente en los medios de cultivo (Geetha y Sudheer, 2000; Chung et al., 2005) Las auxinas sintéticas son usadas como reguladores del crecimiento a bajas concentraciones y como herbicidas a altas dosis, las más comúnmente usadas son el ácido naftalenacético (ANA), ácido 2,4 diclorofenoxiacético (2,4-D) y el ácido 4-amino-3,5,6tricloro-2-piridinicarboxílico (pricloram), aunque también pertenecen a este grupo el dicamba (ácido 2-metoxi-3,6 diclorobenzoico), ácido 2,4,5 triclorofenoxiacético (2,4,5-T), y ácido naftoxiacético (NOA), entre otros (Hopkins y Hüner, 2004; Mauri y Manzanera, 2004; Lee et al., 2007). Las auxinas más activas, tales como el AIB, ANA y 2,4-D son ejemplos de auxinas empleadas principalmente para inducir y regular la embriogénesis somática (Beyl, 2005). 2.8.4.2 Citocininas Las citocininas fueron descubiertas como resultado del esfuerzo por encontrar los factores que pudieran estimular la división celular (Hopkins y Hüner, 2004). El nombre genérico de las citocininas es empleado para aquellas sustancias químicas que promueven principalmente la división celular o citocinesis, participan en la diferenciación de brotes y raíces, el desarrollo de cloroplastos, senescencia de las hojas y estimulan el inicio y crecimiento de brotes in vitro (Taiz y Zeiger, 1998; Hopkins y Hüner, 2004; Pimienta-Barrios et al., 2006). Todas las citocininas que ocurren en forma natural tienen una estructura de anillo de adenina con una cadena lateral de carbonos de isopentil. Las citocininas naturales más comunes son la zeatina (Z), la 2-isopentil-adenina (2-iP) y la dihidrozeatina (diHZ), la ortohidroxibenciladenina y la meta-hidroxibenciladenina (Hopkins y Hüner, 2004; Gaba, 2005; Pimienta-Barrios et al., 2006). La metatopolina (mT) es una citocinina aromática con una alta actividad en los tejidos vegetales (Strnad, 1997) ha sido identificada en muchas plantas, tales como el álamo y Arabidopsis. La actividad biológica de la mT y su ribosa es comparable con la observada en las citocininas isoprenoides (Holub et al., 1998). Las citocininas sintéticas son la 6-benciladenina (BA) [también conocida como 6bencilaminopurina (BAP)] y kinetina (6-furfurilaminopurina). Existen algunos herbicidas 31 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba sintéticos derivados de la fenilurea que actúan como citocininas en bajas concentraciones, la 1,3 difenilurea y el tidiazuron o TDZ (N-fenil-N1-1,2,3,-tidiazolil-5-urea) (Gaba, 2005). Las citocininas más usadas son la zeatina, kinetina (K), benciladenina, tidiazuron, y 2isopentil-adenina (2-iP). En altas concentraciones (4-40 µM) inducen la formación de brotes adventicios, pero inhiben la formación de raíces. La BA ha mostrado mayor actividad que la Z de origen natural. Sin embargo, el tidiazuron a concentraciones de 0.05-0.1 µM, es más activo que 4-10 µM de BA, pero el TDZ puede inhibir la formación de raíces, causando dificultades en la regeneración vegetal (Beyl, 2005). Existe evidencia inequívoca de que las citocininas se concentran en tejidos con crecimiento activo, ya que los niveles citocinínicos son muy altos en órganos jóvenes (semillas, frutos y hojas) e inclusive en embriones y en las puntas de las raíces, principalmente (Hopkins y Hüner, 2004). Las puntas o ápices de las raíces son un sitio importante en la síntesis de citocininas, las que después se transportan a través del xilema a todas las partes de la planta (Barba, 1987; Pimienta-Barrios et al., 2006). 2.8.4.3 Interacción en reguladores del crecimiento Los reguladores del crecimiento vegetal (PGR) son uno de los factores endógenos que controlan el crecimiento en plantas (Sinha, 2004), por lo que su interacción es un aspecto muy importante, ya que las auxinas junto con las citocininas regulan la división celular, por lo que el balance entre ellas en el cultivo in vitro, suele ser determinante para el patrón de desarrollo que siga el tejido (George y Sherrington, 1984). Las auxinas estimulan el crecimiento por elongación celular mientras que las citocininas estimulan el crecimiento por división celular. Skoog y Miller demostraron cómo la interacción de citocininas y auxinas producen una variedad de respuestas morfogenéticas, dependiendo de la concentración de PGR y el radio de las concentraciones de auxinas y citocininas exógenas. Las respuestas que pueden esperarse del tejido ante el balance auxinas-citocininas pueden variar notablemente entre especies y tejidos. Sin embargo, se tiene que a concentraciones altas de auxinas en comparación con citocininas ocurre diferenciación de las células hacia raíces. Una alta concentración de citocininas con respecto a las auxinas promueve una gran formación de 32 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba brotes y hojas en tabaco sin la producción de raíces (Gaba, 2005). Cuando los radios son similares, se induce la formación de callo. Se requiere de un balance apropiado entre auxinas y citocininas en el medio de cultivo para lograr la formación de plantas a partir del explante utilizado. Este balance está determinado por las concentraciones endógenas de auxinas y citocininas presentes en el explante, las cuales dependen de la especie y del tipo de explante (Jiménez, 1998, citado por Suárez-Quijada, 2006). La variedad de concentraciones de reguladores empleadas en determinada especie actúan por lo general de manera diferente al ser empleadas con otra especie, es decir, pueden no ser las mismas. Por tal motivo, es necesario determinar mediante estudios las condiciones adecuadas de cultivo. 2.9 Cultivo in vitro de orquídeas El aprecio de las personas hacia las orquídeas ha permitido que éstas sean propagadas asexualmente con ayuda de métodos convencionales como la división de pseudobulbos, cañas o keikis (según sea el crecimiento) a partir de una planta madre (Freuler, 2007), a pesar de esto y como una alternativa más de propagación existen las técnicas del Cultivo de tejidos vegetales (CTV). El CTV está basado en la premisa de que las plantas pueden ser separadas en sus partes (órganos, tejidos o células), los cuales pueden ser manipulados in vitro hasta crecer y formar una planta completa (Caponetti et al., 2005). Los horticultores han sabido desde los 1840’s que las orquídeas viven en estrecha asociación con hongos de quienes su existencia no fue verificada tras su aislamiento y cultivo 60 años después. El biólogo francés Noel Bernard fue el primero que eventualmente cultivó y demostró que la germinación natural ocurre en la presencia de hongos micorrícicos (Mitchell, 1989). Los esfuerzos continuaron para conocer la demanda de las plantas y así lograr su supervivencia y no fue hasta 1917 cuando Lewis Knudson modificó las técnicas de cultivo, demostrando que las semillas de orquídea pueden germinar asimbióticamente en un medio muy simple adicionado con azúcar. Experimentos mostraron que, cuando las semillas eran provistas de una variedad de sales, un azúcar (sacarosa o glucosa) y agua, las semillas germinaban y crecían. Tras la muerte de Bernard en 1911, el orquideólogo Hans Burgeff desarrolló el método de germinación simbiótico para orquídeas pero no fue exitoso. El trabajo de Knudson fue impedido inicialmente por la corta vida de las semillas; muchos 33 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba cultivadores estuvieron poco dispuestos a entregar pequeñas cantidades de éstas por ser un material extremadamente valioso. Eventualmente, Theodore Mead, un cultivador de Florida, lo abasteció con las semillas que requería, resultando en las técnicas que se usan actualmente. Estas técnicas difieren un poco de las descritas por Knudson en 1922 en su publicación titulada “Nonsymbiotic Germination of Orchid Seeds” en el Botanical Gazette (Hicks, 2004). Tras el nuevo aporte de Knudson acerca de la germinación asimbiótica en 1921 se dio paso a la micropropagación de orquídeas. La primer micropropagación involucró la multiplicación clonal de orquídeas y comenzó cuando Gavino Rotor Jr. Propagó con éxito Phalaenopsis por medio del cultivo de extremos nodales en 1949. La propagación de meristemos, permitió la propagación vegetativa (y por lo tanto clonal) de gran cantidad de orquídeas en 1960, producto del trabajo llevado a cabo por Georges M. Morel con meristemos apicales de Cymbidium, en Francia, usando técnicas originales desarrolladas por la firma American Earnest Ball (Caponetti et al., 2005). Posteriormente se llevaron a cabo otras pruebas empleando diferentes explantes (células, protoplastos, hojas, tallos, etc.) para el cultivo in vitro de orquídeas (Arditti y Ernst, 1993). Existe una alta probabilidad de que las orquídeas hayan sido unas de las primeras plantas en propagarse mediante el cultivo in vitro (Arditti, 1977) y ante esto es importante hacer mención de trabajos en donde se emplea el CTV para su propagación, algunas especies como: Cattleya walkeriana (Islam et al., 1999), Dendrobium tosaense (Lo et al., 2004), Oncidium tigrinum (Baltazar, 2004) y Habenaria macroceratitis (Stewart y Kane, 2006) a través de la germinación de semillas, además de Geodorum densiflorum (Sheelavantmath et al., 2000), Laelia speciosa (Ávila-Díaz y Oyama, 2002), Aerides crispum (Murthy, 2005), Cattleya aurantiaca, Encyclia adenocaula, Prosthechea citrina, Epidendrum radicans, Laelia albida, Laelia autumnalis, Laelia speciosa, Oncidium tigrinum y Trichocentrum cavendishianum (Ávila-Díaz y Salgado-Garciglia, 2006) y Cypripedium flavum (Yan et al., 2006) en donde se emplean diversos explantes (segmentos de rizoma, hoja, semillas germinadas [protocormos]) para iniciar el cultivo. 34 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba 2.10 Cultivo in vitro del género Laelia Sin duda las flores más admiradas son las del género Laelia por lo cual durante siglos han sido cultivadas de manera tradicional (Halbinger y Soto-Arenas, 1997; Hágsater et al., 2005) pero recientemente también han sido propagadas mediante el cultivo in vitro y muestra de ello son los trabajos realizados en donde los explantes empleados para la propagación de este género comprenden: yemas apicales, meristemos, semillas, protocormos, etc. (Arditti, 1992; Arditti y Ernst, 1993; Santos-Hernández et al., 2005). Se reportan varios trabajos efectuados, mediante técnicas de cultivo de tejidos, con especies del género Laelia, destacando los realizados en Laelia anceps, sin embargo, no se encontró reporte alguno donde se haya empleado a Laelia anceps subsp. anceps f. semialba como objeto de estudio (a pesar de que es muy rara), sino únicamente la forma típica de la subespecie, es decir, la forma rosa-morada. En el año 2000, Vásquez propuso una metodología para la propagación de Laelia anceps empleando las auxinas ANA y AIA, así como la citocinina BAP y el brasinoesteroide BB-6 en la germinación de semillas, y encontró las condiciones adecuadas para desarrollar plántulas con 16.1 µM de ANA, 17.1 µM de AIA y 13.3 µM de BAP, así como AIB, ANA y BB-6 en la inducción de raíces resultando el AIB el más efectivo. Por su parte, Nahuat (2001) propuso una forma para inducir embriogénesis somática en Laelia rubescens al cultivar entrenudos de tallos florales en medio MS modificado al 50% y adicionado con TDZ, BA, Z y K, la respuesta obtenida fue la formación de PLBs en todas las citocininas a excepción del TDZ. Asimismo, Hernández et al. (2001) desarrollaron un protocolo de propagación para la misma especie a partir de mitades de protocormos cultivados en medio MS, obteniendo la mayor regeneración de plántulas bajo la presencia de 0.5-1 mg/l de BA. Otra especie mexicana propagada por esta vía es Laelia albida, la cual fue obtenida a partir de semillas germinadas en medio KC y su posterior desarrollo a plántulas en el mismo medio adicionado esta vez con extracto de papa; por otro lado, también se logró la formación de PLBs a través del cultivo de meristemos en dicho medio pero adicionándole BA, ANA, agua de coco (endospermo líquido de coco) y extracto de papa (Santos-Hernández et al., 2005), también Tinoco-Juárez (2006) determinó el período de adquisición de competencia celular para la micropropagación de Lirio de todos santos a partir del cultivo de protocormos en medio MS con distintas concentraciones de benciladenina (BA) y ácido 2,4 diclorofenoxiacético (2,4-D) 35 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba en diferentes períodos de inducción, obteniendo como principal respuesta la formación de PLBs y/o brotes adventicios. Otros trabajos realizados con especies del mismo género incluyen: la germinación de semillas de Laelia anceps ssp. dawsonii en medio MS suplementado con ácido naftalenacético (ANA), bencilaminopurina (BAP), kinetina (K) y ácido indolacético (AIA), en donde se obtuvo callo que posteriormente produjo embriones somáticos y éstos más tarde se convirtieron en plantas completas con brotes y raíces (Lee et al., 2007). Estas especies y muchas otras presentan problemas en su conservación y/o son de importancia hortícola, por eso el proponer protocolos de propagación es muy importante pues se puede contar con elementos necesarios para estudiar, propagar y conservar dichas especies. 36 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba 3. JUSTIFICACIÓN Las orquídeas son un enorme grupo de plantas que desde tiempos remotos han despertado el interés de la humanidad debido a sus características tan peculiares y a la gran diversidad existente, por lo que son altamente apreciadas como ornamentales, esto ocasiona la extracción de una gran cantidad de individuos reproductores para su venta ilegal, con lo cual se origina un lento o nulo reclutamiento de nuevos individuos de muchas poblaciones y la disminución de individuos en otras más o como el caso de L. anceps subsp. anceps f. semialba que es casi imposible encontrar en la naturaleza debido que no existen poblaciones silvestres, sino que únicamente se encuentran individuos entremezclados con la forma típica, además de que también son vulnerables a la destrucción de sus hábitats por la quema y tala de los bosques para el establecimiento de campos agrícolas y ganaderos. Por esto, resulta indispensable establecer estrategias para la conservación tanto in situ como ex situ de estas especies de interés hortícola, en las que la presión en su ambiente natural se incrementa diariamente (IUCN/SSC Orchid Specialist Group, 1996). El CTV ha demostrado ser una excelente herramienta biotecnológica para tal fin, contribuyendo a la conservación de este tipo de especies y a la vez puede generar el material suficiente para satisfacer la demanda comercial con lo que se podría minimizar el impacto a las poblaciones silvestres, además de que se puede contar con material para realizar futuras investigaciones en diversas áreas (ecología, fisiología, genética, biología de la conservación, etc.) que pudieran permitir tomar acciones para la reintroducción de individuos en la naturaleza. 37 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba 4. HIPÓTESIS - La adición de complejos naturales (endospermo líquido de coco, homogeneizado de papa e hidrolizado de caseína) al medio de cultivo MS incrementará el crecimiento en plántulas de Laelia anceps subsp. anceps f. semialba. - La modificación del medio de cultivo MS mediante la adición de diferentes concentraciones de carbohidratos (sorbitol, manitol y sacarosa), así como ácido abscísico (ABA) y almacenamiento a 5°C retardará de manera proporcional a la concentración empleada, el crecimiento general de las plántulas de L. anceps subsp. anceps f. semialba. - El uso de diferentes concentraciones de citocininas en combinación con ANA promoverá la formación de PLBs además de brotes y éstas variarán de acuerdo a las concentraciones empleadas. - La supervivencia y desarrollo ex vitro de plántulas de L. anceps subsp. anceps f. semialba obtenidas in vitro, se verán afectadas positivamente por el sustrato y tipo de fertilizante empleado. 38 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba 5. OBJETIVOS OBJETIVO GENERAL Establecer las bases para la propagación y conservación de Laelia anceps subsp. anceps f. semialba (Orchidaceae) a través del cultivo de tejidos OBJETIVOS PARTICULARES - Analizar el efecto del medio de cultivo MS adicionado con diversos compuestos orgánicos (endospermo líquido de coco, homogeneizado de papa e hidrolizado de caseína), en el desarrollo de plántulas de L. anceps subsp. anceps f. semialba. - Definir entre los diferentes métodos de crecimiento lento (aumento de potencial osmótico del medio, adición de inhibidores del crecimiento, bajas temperaturas) cuál permite mantener una viabilidad alta de germoplasma y que permitan su conservación a mediano plazo. - Evaluar el efecto de diferentes concentraciones de ácido α-naftalen acético (ANA) en combinación con citocininas (N6-benciladenina (BA), N6-(meta-hidroxibencil) adenina (mT), N-fenil-N1-1,2,3,-tidiazolil-5-urea (TDZ)), N6-furfuriladenina (K)) sobre la formación de PLBs y brotes. - Evaluar el efecto de dos diferentes sustratos y un par de fertilizantes en la supervivencia ex vitro de las plántulas de L. anceps subsp. anceps f. semialba. 39 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba 6. MATERIAL Y MÉTODO 6.1 Material biológico s utilizaron plántulas de Laelia anceps subsp. anceps f. Como explante original se semialba con 1-3 3 cm de altura, provenientes de semillas previamente germinadas en el Laboratorio de Cultivo de Tejidos Vegetales del Instituto de Ecología, A.C., en medio de cultivo MS (Murashige y Skoog, 1962). 1962) La semillas provenían de una cápsula formada por polinización cruzada de dos ejemplares (ejemplar donador del polinario con número de acceso 83-373-3 3 y la planta receptora del polinario y formadora de cápsula, sin número de registro) ambas pertenecientes a la colección de orquídeas del Jardín Botánico Francisco Javier Clavijero del Instituto de Ecología A. C., Figura 6. A B Figura 6. Ejemplares empleados ados en la formación de fruto. A) A Planta donadora del polinario, B) planta receptora ceptora del polinario (formadora de cápsula). 6.2 Efecto de compuestos orgánicos. Plántulas de una altura 1-3 cm fueron subcultivadas en medio compuesto por las sales y vitaminas del medio MS (Apéndice ( 10.2) y enriquecido con 100 mg/l de myo-inositol, 2 mg/l de glicina y 30 g/l de sacarosa, el medio de cultivo fue adicionado con diferentes compuestos orgánicos: endospermo líquido de coco (EC) 100 ml/l,, homogeneizado de papa (HP) 50 g/l e hidrolizado de caseína (HC) en 2 concentraciones (50 mg/l, 100 mg/l), mg/l) así como 40 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba un control (medio MS sin compuestos orgánicos). Se realizaron subcultivos mensuales a sus respectivos medios de cultivo durante 5 meses. Se evaluó el efecto del EC, HP e HC en el crecimiento y desarrollo de plántulas de L. anceps subsp. anceps f. semialba. Se adquirieron cocos con el exocarpo previamente removido, a los que se les extrajo el endospermo líquido y se filtro en papel filtro para eliminar cualquier partícula mayor. Para el caso del homogeneizado de papa, se colocaron 50 g de papa picada sin cáscara en 200 ml de agua destilada y se coció en una parrilla, posteriormente la papa cocida se molió con ayuda de una licuadora y el homogeneizado resultante se agregó al medio de cultivo. En el caso de la caseína, se pesaron 50 y 100 mg de hidrolizado de caseína (SIGMA®) y se disolvieron cada uno en 200 ml de agua destilada, más tarde se incorporaron al medio de cultivo. En cada ensayo se sembraron 5 plántulas por frasco. Los tratamientos adicionados con endospermo líquido de coco y homogeneizado de papa tuvieron 30 frascos como repetición, y para el caso del hidrolizado de caseína hubo 20 repeticiones por tratamiento. Se realizaron subcultivos mensuales a sus respectivos medios de cultivos durante 6 meses. Por lo tanto, para el primer y segundo caso se contaron con 150 plántulas por tratamiento, mientras que con la caseína hubo sólo 100 por tratamiento. El pH de todos los medios se ajustó a 5.0 con soluciones de Hidróxido de Sodio (NaOH) 1 N y/o Ácido Clorhídrico (HCl) 1 N, previo a la adición de 7 g/l de agar Micropropagation (Phytotechlab®). Los frascos de vidrio conteniendo 30 ml de medio de cultivo se esterilizaron en un autoclave a 120°C con una presión de 1.2 kg/cm2 durante 15 minutos. Los cultivos fueron incubados a una temperatura de 25±1ºC con una intensidad luminosa de 50 µMol/m2/s proporcionada por 2 lámparas fluorescentes (luz de día) de 75 W. 6.3 Ensayos para retardar el crecimiento Para retardar el crecimiento de las plántulas de L. anceps subsp. anceps f. semialba se utilizó el medio MS, suplementado con diferentes concentraciones de manitol (10, 30 y 60 g/l), sorbitol (10, 30 y 60 g/l), sacarosa (10, 20, 40, 50 y 60 g/l), también se evaluó el efecto de incubación a bajas temperaturas (5°C), así como el efecto del ácido abscísico en 4 41 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba concentraciones (1, 3, 5, 10 mg/l). Se realizaron subcultivos mensuales a sus respectivos medios de cultivo durante 5 meses. Se sembraron 5 explantes por frasco con 20 repeticiones, teniendo un total de 100 plántulas por tratamiento. 6.4 Inducción de respuestas morfogenéticas Para inducir respuestas morfogenéticas se emplearon diferentes concentraciones de ANA en combinación con alguna de las siguientes citocininas: BA, mT, TDZ y K. Las concentraciones y combinaciones se muestran en la tabla 1. Tabla 1. Tratamientos hormonales adicionados al medio MS para el cultivo in vitro de plántulas de L. anceps subsp. anceps f. semialba CITOCININAS (µM) ANA (µM) 0 2.2 4.4 8.9 17.8 0 2.7 5.4 En todos los casos se realizaron 15 combinaciones auxina-citocinina, se sembraron 5 explantes por frasco y 5 frascos en cada caso, obteniendo un total de 25 explantes por cada tratamiento, el periodo de inducción fue de 2 meses. Posterior al tiempo de inducción, se realizaron subcultivos mensuales a medio MS sin reguladores del crecimiento (medio basal) durante 3 meses. 6.5 Registro de datos Mensualmente durante un periodo de 5 meses para evaluar el desarrollo in vitro de las plántulas en los diferentes tratamientos se realizó el registro de datos tomando en consideración el número de brotes y/o plbs (cuerpos semejantes a protocormos por sus siglas en inglés) por cada explante y la talla del explante más alto (tomada desde la base del pseudobulbo hasta la punta de la hoja más larga), así como el porcentaje de supervivencia 42 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba de los explantes. Se calculó el incremento real de altura restando la talla final alcanzada menos la talla inicial del explante. Esto fue efectuado para todos los tratamientos excepto para aquellos con reguladores del crecimiento vegetal, en donde sólo se tomó en cuenta el número de brotes y/o plbs formados por explante. Durante la fase de aclimatación, la supervivencia de las plántulas se evaluó quincenalmente durante dos meses, mientras que su desarrollo (altura) se registró mensualmente durante el mismo periodo. La altura se obtuvo midiendo la plántula desde su base hasta la punta de la hoja más larga. 6.6 Establecimiento ex vitro Previo su establecimiento ex vitro y finalizada la etapa de experimentación de 5 meses, las plántulas se individualizaron y subcultivaron en medio MS basal adicionado con 1g/l de carbón activado para que continuaran su crecimiento y después de dos meses fueron empleadas para realizar las pruebas de aclimatación en invernadero. Se analizó el efecto de diferentes sustratos y fertilizantes, así como el efecto de los diferentes tratamientos in vitro, en la supervivencia ex vitro de las plántulas. Para lo cual se extrajeron de los frascos de cultivo un total de 180 plántulas con una talla de entre 3 y 5 cm provenientes de cada complejo orgánico (endospermo líquido de coco, homogeneizado de papa e hidrolizado de caseína), carbohidrato (sorbitol, manitol y sacarosa) y regulador del crecimiento empleados, las cuales se dividieron en lotes de 30 para cada tratamiento. Las plántulas fueron enjuagadas con agua corriente para eliminar el medio de cultivo adherido a las raíces, tratando de no dañarlas y se sembraron en charolas de germinación (Hummert® International) conteniendo 2 diferentes sustratos: 1) mezcla de corteza de pino, carbón vegetal, tepecil (1:1:1) y 2) Tepecil. Los sustratos fueron previamente humedecidos y colocados en bolsas de polietileno de 25 x 35 cm para su esterilización en un horno de microondas durante 15 minutos. Las charolas se cubrieron con domos de plástico transparente para mantener una humedad relativa alta. Los fertilizantes empleados fueron: Nitrofoska®Foliar PS (25-10-17.5-1.5 (MgO) + M. E.) (0.5 g/l) [COMPO AGRO®] y Lombricomposta líquida Finca La Misión (200 m/l) [Apéndice 10.3 y 10.4], así como un control (agua corriente). La aplicación de los fertilizantes se llevó a 43 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba cabo dos veces por semana, y cuando se observó la presencia de hongos se aplicó una solución fungicida de Captan® 3g/l. 6.7 Análisis estadístico Los datos obtenidos, número de brotes por explante y por tratamiento, altura de los brotes, supervivencia, etc., fueron analizados mediante un análisis de varianza (ANOVA) con ayuda del paquete estadístico Statistica ver. 1999 y los tratamientos diferentes significativamente fueron discriminados mediante la prueba de rango múltiple de mínima diferencia significativa (LSD) a un nivel de confianza del 95%. 44 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba 7. RESULTADOS Y DISCUSIÓN 7.1 Efecto de compuestos orgánicos El crecimiento de las plántulas de L. anceps subsp. anceps f. semialba y la formación de brotes adventicios fue estimulado mediante la adición de endospermo líquido de coco (EC), homogeneizado de papa (HP) e hidrolizado de caseína (HC) adicionados al medio de cultivo MS. La respuesta al cultivo in vitro de las plántulas en los diferentes tratamientos en el medio de cultivo MS adicionado con los complejos orgánicos después de 5 meses varío con la concentración y complejo orgánico adicionado al medio de cultivo y después de realizar un ANOVA se pudo establecer diferencia significativa (p≤0.05) [Tabla 2, Figura 7]. Tabla 2. Resultados obtenidos después de cultivar plántulas de Laelia anceps subsp. anceps f. semialba en medio MS adicionado con diferentes compuestos orgánicos. Promedio de Promedio de altura Incremento real Supervivencia brotes por por brote ± E.S Tratamiento por brote (cm) (%) explante ± E.S (cm) CONTROL 90 3.23 ± 0.18 0.47a 7.24 ± 0.63ab EC 100m/l * 90 2.31 ± 0.09 0.36a 5.44 ± 0.37a HP 50 g 93 5.36 ± 0.14 3.75c 8.01 ± 0.56b 75 4.04 ± 0.23 2.23b 12.17 ± 1.02c 80 4.70 ±0.21 1.93b 10.29 ± 0.79c HC 50 mg/l HC 100 mg/l Resultados obtenidos después de 5 meses de cultivo in vitro Letras diferentes indican diferencia significativa (p≤0.05). *: Resultados obtenidos después de 3 meses de cultivo in vitro. EC: Endospermo líquido de coco. HP: Homogeneizado de papa. HC: Hidrolizado de caseína. E.S: Error estándar. 45 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba 7.1.1 Porcentaje de supervivencia de las plántulas de Laelia anceps subsp. anceps f. semialba durante el cultivo in vitro Al término de la fase experimental, se observó en general una supervivencia alta en todos los tratamientos a excepción de los cultivos con EC, ya que después de pasados cuatro meses los cultivos presentaron una contaminación muy elevada, de casi el 100%, por lo cual ya no se pudo continuar con el análisis de su efecto sobre las plántulas. Por otro lado, en el tratamiento con HP se presentó un porcentaje de supervivencia alto (93%), las plántulas cultivadas con las dos concentraciones de HC presentaron el 75% y 80% de supervivencia respectivamente, así como el tratamiento sin complejos orgánicos en donde se observó una supervivencia del 90% (Tabla 2). Durante el cultivo de las plántulas de L. anceps subsp. anceps f. semialba se observó contaminación causada posiblemente por la inadecuada manipulación durante la siembra y sulbcultivo de los explantes, sin embargo, inclusive tras haber sido sembrados y permanecer en condiciones de incubación, los frascos de cultivo presentaban el mismo problema probablemente por la entrada de esporas, ya que se observaba en la superficie del medio la presencia de hongos que iniciaba en la orilla del frasco y se expandía al resto del recipiente. De acuerdo a Smith (2000), la contaminación in vitro ocurre por diversos factores como son: el explante que se emplea, la manipulación del mismo por parte de la persona, el medio de cultivo, los insectos, por las condiciones con las que se trabaja en la campana de flujo laminar y por las condiciones de incubación. Sin embargo, aunque en un porcentaje muy bajo, también la supervivencia se vio afectada por la muerte de las plántulas debido a la liberación de compuestos fenólicos al medio, observándose primero una coloración parda en el mismo y la paulatina muerte de los explantes, lo cual concuerda con lo reportado para algunas orquídeas (Vij et al., 1984; Ferreira et al., 2006; Teixeira et al., 2006) y especies arbóreas (Martin y Madassery, 2005; Reis et al., 2008). 7.1.2 Altura promedio obtenida en las plántulas de Laelia anceps subsp. anceps f. semialba En la tabla 2, puede observarse el crecimiento en promedio que mostraron las plántulas al ser cultivadas con los complejos orgánicos. Las plántulas que presentaron el promedio de altura más alto (5.36 cm) fueron aquellas cultivadas con homogeneizado de 46 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba papa (50 g/l), pues al hacer el análisis se pudo establecer una diferencia significativa (p≤0.05) con respecto a los otros tratamientos. A éste le siguieron los tratamientos adicionados con 100 mg/l y 50 mg/l de HC con alturas de 4.7 cm y 4.04 cm respectivamente. Las plántulas que presentaron las menores tallas fueron aquellas provenientes del tratamiento control y del adicionado con EC donde tan sólo alcanzaron una talla promedio de 3.23 cm y 2.31 cm respectivamente. Es importante mencionar que el promedio de altura de las plántulas del tratamiento suplementado con EC se tomó únicamente en un periodo de cuatro meses debido a la contaminación de los frascos de cultivo. 7.1.3 Incremento de altura en las plántulas de Laelia anceps subsp. anceps f. semialba Los explantes para todos los casos originalmente presentaron en promedio una altura de 1-3 cm al iniciar el cultivo in vitro y tras permanecer 5 meses bajo esas condiciones incrementaron su talla de manera general. El incremento más alto se presentó en las plántulas cultivadas con HP en donde se alcanzaron 3.75 cm más de altura, seguido por los tratamientos adicionados con HC en concentraciones de 50 mg/l y 100 mg/l con 2.23 cm y 1.93 cm respectivamente. Por otra parte, los tratamientos en donde se observó el menor incremento son con el tratamiento testigo y el EC con 0.47 cm y 0.36 cm, respectivamente; sin embargo, de los frascos de cultivo con EC únicamente se tomó registro hasta el cuarto mes de iniciado el cultivo debido a la alta contaminación que se presentó durante este periodo. 7.1.4 Organogénesis La tabla 2 muestra que al concluir 5 meses de cultivo, las plántulas produjeron diferente cantidad de brotes dependiendo del tratamiento al cual estuvieron sujetas. La formación de brotes se presentó desde el primer mes de cultivo para todos los tratamiento; sin embargo, no fue homogénea y al analizar el efecto de los diferentes complejos orgánicos hacia la formación de brotes se pudo establecer una diferencia significativa (p≤0.05), donde a partir de las plántulas cultivadas en medio adicionado con 50 mg/l de HC fue donde se obtuvo el mayor número de brotes por explante, induciendo un promedio de 12.17 brotes por explante, seguido por el tratamiento adicionado con 100 mg/l de HC, logrando la 47 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba formación de 10.29 brotes por explante. A estos tratamientos les siguió el HP, ya que se formaron 8.01 brotes por explante y los tratamientos en donde se presentó el promedio más bajo de formación de brotes corresponde a las plántulas cultivadas en ausencia de compuestos orgánicos (control) con 7.24 brotes y el tratamiento con EC con la formación de 5.44 brotes por plántula. 7.1.5 Análisis por tratamiento El efecto de los diferentes complejos orgánicos en la altura de las plántulas es evidente y tras establecer una diferencia significativa (p≤0.05) se encontró que el mejor tratamiento para acelerar el crecimiento es el homogeneizado de papa (50 g/l) con un incremento de 3.75 cm, además de que permitió a las plantas formar hojas más gruesas, de color verde intenso y muchas raíces de aproximadamente 4 mm de diámetro. Además que en este tratamiento se obtuvo un 93% de supervivencia de los explantes, porcentaje por encima de los demás casos. En un estudio realizado con semillas de Cypripedium flavum previamente germinadas (protocormos), se encontró que el adicionar 20 g/l de homogeneizado de papa al medio de cultivo Harvais y 2.2 µM de BAP promovió la formación de 2.55 ± 0.05 brotes por explante en 95% de los mismos (Yan et al., 2006), pero contrario a lo que ocurrió con L. anceps subsp. anceps f. semialba,en esta especie se observó un lento crecimiento de las plántulas. Santos et al. (2005) encontraron que el agregar 20 g/l de papa al medio de cultivo, es benéfico para los explantes de Laelia albida porque promueve su crecimiento y desarrollo, lo cual concuerda con lo observado en el presente estudio, pues el crecimiento observado en las plántulas cultivadas con HP incrementaron su talla más que con otros tratamientos. Asimismo, Lo et al., (2004) indican que el homogeneizado de papa ayuda al crecimiento vigoroso en Dendrobium tosaense, evidenciado por el incremento de altura, peso en fresco y diámetro del tallo. Lo anterior es interesante porque lo que se busca en el presente estudio al adicionar compuestos orgánicos al medio de cultivo es únicamente acelerar el crecimiento de las plántulas de Laelia anceps subsp. anceps f. semialba, mas no la proliferación de brotes o regeneración de plántulas. El segundo mejor resultado obtenido en el promedio de altura de los explantes fue con hidrolizado de caseína en ambas concentraciones, aunque el promedio de altura 48 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba alcanzado con 50 mg/l fue mayor que con 100 mg/l, el incremento observado fue muy similar; sin embargo, los explantes cultivados con 50 mg/l de caseína incrementaron su talla en 3 mm más que los cultivados con 100 mg/l. También se encontró que el que indujo la mayor brotación fue con la concentración de 50 mg/l. Tanto el incremento de altura como la brotación múltiple probablemente se vieron favorecidas porque este complejo tiene un alto contenido de aminoácidos esenciales y vitaminas, además porque asume un papel importante en el transporte de minerales (Beyl, 2005). Por otro lado, se tiene que el tratamiento con el promedio de altura más bajo se obtuvo con la adición de 100 ml/l de EC, aunque las plántulas se mostraban vigorosas pero sin la formación de pseudobulbo, es decir, estaban muy delgadas y el color era verdeamarillento. En un estudio reciente realizado por Moreno (2007) al adicionar 120 ml/l de agua de coco al medio MS obtuvo un incremento significativo en la talla de Acineta barkeri. Así mismo Lo et al., (2004) indican que el medio MS adicionado con agua de coco promueve el crecimiento foliar y el incremento de raíces en Dendrobium tosaense, por lo cual es posible pensar que si no se hubiera presentado una alta contaminación, a los tres meses, las plántulas hubieran incrementado su talla inclusive más que lo presentado en aquellas tratadas sin la adición de complejos orgánicos (testigo) y tal vez presentarían una formación inicial del pseudobulbo y hojas más gruesas. 49 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba A B C D Figura 7.. Tratamiento con compuestos orgánicos. (A) Plántulas cultivadas en medio MS carente de compuestos orgánicos. (B) Formación de nuevas plántulas en medio adicionado con EC, en donde se observa la presencia de raíces vigorosas. vigorosas (C) Producción de brotes adventicios y desarrollo en plántulas con hojas en medio con HP. (D) Brotes adventicios y PLBs rodeando la plántula original en medio adicionado con HC. 7.2 Ensayos para retardar el crecimiento Para retardar el crecimiento de las plántulas pl de Laelia anceps subsp. anceps f. semialba y disminuir e inclusive inhibir la formación de brotes adventicios, se adicionaron al medio de cultivo diferentes carbohidratos (manitol, sorbitol y sacarosa), así como ácido abscísico (ABA) y la incubación a 5°C (Figura 8, 9, 10 y 11). En la tabla 3, pueden observarse los resultados obtenidos tras realizar un ANOVA y establecer diferencia significativa (p≤0.05). (p 50 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba Tabla 3. Resultados obtenidos después de cultivar plántulas de Laelia anceps subsp. anceps f. semialba en medio MS adicionado con retardantes de crecimiento. Incremento Supervivencia Promedio de altura Tratamiento Promedio de real por brote (%) por brote ± E.S (cm) brotes ± E.S (cm) CONTROL 0 90 3.23 ± 0.18 0.47de 7.24 ± 0.63cd 10 85 2.77 ± 0.14 0.52def 12.54 ± 2.07ef 30 100 2.44 ± 0.10 0.11cd 13.41 ± 1.64f 60 85 0.78 ± 0.07 -1.70a 4.55 ± 0.50abc 10 85 3.50 ± 0.20 1.19gh 12.14 ± 1.67ef 30 100 3.42 ± 0.22 1.22gh 9.53 ± 0.93de 60 95 1.88 ± 0.07 -0.88b 7.55 ± 0.46cd 10 90 4.22 ± 0.18 1.35gh 6.56 ± 0.79bcd 20 90 4.33 ± 0.23 1.50h 14.57 ± 2.37f 40 95 2.74 ± 0.13 -0.10c 6.48 ± 0.99bcd 50 100 2.81 ± 0.18 0.96fg 18.78 ± 1.97g 60 100 1.98 ± 0.12 0.16cd 13.30 ± 1.42f 1 100 2.83 ± 0.09 0.76ef 5.19 ± 0.48abc ABA 3 100 2.83 ± 0.06 0.64ef 3.60 ± 0.23ab (mg/l) 5 95 2.86 ± 0.07 -0.03c 2.33 ± 0.13a 10 75 2.51 ± 0.10 -0.76b 2.19 ± 0.12a MANITOL (g/l) SORBITOL (g/l) SACAROSA (g/l) Resultados obtenidos después de 5 meses de cultivo in vitro Letras diferentes indican diferencia significativa (p≤0.05). ABA: Ácido abscísico. E.S: Error estándar. 7.2.1 Porcentaje de supervivencia de las plántulas de Laelia anceps subsp. anceps f. semialba durante el cultivo in vitro Las plántulas cultivadas en los distintos tratamientos mostraron en general un porcentaje de supervivencia alto que osciló entre 75-100%. La más alta supervivencia se observó en los explantes del tratamiento testigo, el siguiente se presentó con las plántulas cultivadas con sorbitol donde sólo 20 de ellos murieron durante el cultivo in vitro, seguido de 51 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba los diferentes tratamientos con sacarosa en donde se perdieron 25 plántulas. Por otro lado, los casos en los que se presentaron los más bajos porcentajes de supervivencia fue con el manitol y el ácido abscísico (ABA) con la muerte de 30 de los explantes. La pérdida de los explantes antes mencionados se debió en primera instancia a la contaminación por parte de hongos y en algunos casos se presentó una coloración parda en las plántulas al parecer porque se oxidaron. Las plántulas incubadas a baja temperatura murieron a los 15 días de iniciado el cultivo. 7.2.2 Promedio de altura obtenido en las plántulas de Laelia anceps subsp. anceps f. semialba El promedio de altura alcanzado por las plántulas en los diferentes tratamientos puede observarse en la tabla 3, en donde se tiene que el promedio más alto se obtuvo en las plántulas cultivadas con 20 g/l de sacarosa con 4.33 cm, seguido por 4.22 cm alcanzados con el medio de cultivo adicionado con 10 g/l de sacarosa. Los siguientes promedios más altos (3.50 cm y 3.42 cm) obtenidos al final del cultivo in vitro se presentaron en los tratamientos con 10 y 30 g/l de sorbitol y por su parte el tratamiento testigo presentó un promedio general en altura de 3.23 cm. En los demás tratamientos, el promedio de altura logrado fue disminuyendo y se tiene que el tratamiento en donde se presentó el promedio más bajo, 0.78 cm, fue en los explantes cultivados con manitol 60 g/l. Las plántulas incubadas a 5°C no presentaron cambio alguno en la altura mostrada desde el comienzo del cultivo, es decir, conservaron su talla original de 1.72 cm en promedio. 7.2.3 Incremento de altura en las plántulas de Laelia anceps subsp. anceps f. semialba Al término de 5 meses de cultivo in vitro, las plántulas mostraron dos tipos de respuesta: 1) incremento en la talla inicial o 2) un cese de crecimiento, que en algunos casos se registró como un decremento en la talla de las plántulas (Tabla 3). Esta disminución de la talla ocurrió a pesar de que durante el primer mes de cultivo se presentó un crecimiento 52 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba normal; sin embargo, a partir del segundo mes, algunas de las hojas más largas y de las cuales se tomaba la talla comenzaron a secarse, por lo que la talla promedio de los explantes en este tratamiento también disminuyó paulatinamente. Lo anterior, se hizo más notorio a partir de la novena semana de cultivo en donde muchas de las hojas, secas completamente, caían a la superficie del medio, es importante señalar que esto no afecto la supervivencia de las plántulas. El tratamiento en donde las plántulas presentaron una reducción en su talla fue con manitol 60 g/l, con un decremento promedio de la altura de los explantes de 1.70 cm. Otros tratamientos en donde se presentó el mismo fenómeno fueron el sorbitol (60 g/l) en donde se presentó una reducción general de 0.88 cm; los explantes cultivados en una concentración de 10 mg/l de ABA presentaron al término de la fase in vitro un decremento general de 0.76 cm. El tratamiento en donde también se presentó un decremento en la altura de las plántulas fue mediante la adición de 40 g/l de sacarosa, ya que al revisar el incremento alcanzado se encontró que realmente los explantes redujeron su talla en 0.10 cm y por último el caso en donde se presentó un decremento de la talla fue con 5 mg/l de ABA con 0.03 cm. El resto de los tratamientos, aunque mínimo, si mostraron un incremento en la talla de los explantes y se tiene que el tratamiento en donde las plántulas presentaron el incremento más alto (1.50 cm) fue mediante la adición de 20 g/l de sacarosa. Por su parte, las plántulas cultivadas en medio basal e incubadas a 5°C no mostraron ningún signo de crecimiento. 7.2.4 Organogénesis A pesar de que el objetivo era detener el crecimiento de las plántulas en la mayoría de los tratamientos se obtuvo la formación de brotes, la cual comenzó a hacerse evidente desde el primer mes de cultivo. Al término de la fase in vitro y después de realizar un análisis de varianza se estableció una diferencia significativa (p≤0.05), en donde el tratamiento que presentó la mayor formación de brotes por explante (18.78 ± 1.97) fue con 50 g/l de sacarosa, seguido por la adición del mismo carbohidrato pero en una concentración menor (20 g/l) con 14.57 ± 2.37 brotes por explante y el tercer mejor tratamiento en cuestión resultó con la adición de 30 g/l de manitol con la formación de 13.41 ± 1.64 brotes por plántula. Es importante mencionar que en algunos casos hubo la formación de PLBs, y 53 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba éstos se tomaron en cuenta en el total de brotes formados por explante, por frasco de cultivo y por tratamiento, también hubo casos raros de aparición de callo verde claro pero no fue significativo. Por lo contario, los tratamientos en donde se observó la más baja brotación fue con ABA, en concentraciones de 10 mg/l (2.19 ± 0.12), 5 mg/l (2.33 ± 0.13) y 3 mg/l con la formación de 3.60 ± 0.23 brotes por explante. También hubo una baja brotación en las plántulas cultivadas con 60 g/l de manitol (4.55 ± 0.50) y 1 mg/l de ABA con 5.19 ± 0.48. Una nula formación de brotes se presentó en los frascos de cultivo incubados a 5°C. 7.2.5 Análisis por tratamiento Las plántulas cultivadas en medio adicionado con diferentes concentraciones de carbohidratos mostraron una variedad de respuestas, estableciéndose una diferencia significativa (p≤0.05) después de realizar un análisis de varianza, los resultados pueden corroborarse en la tabla 3. De entre todos los tratamientos, se obtuvo el mejor resultado en cuanto al incremento de talla de las plántulas en la concentración de 60 g/l de manitol con un decremento general de 1.70 cm; sin embargo, aunque en este caso hubo una supervivencia del 85%, en otros casos fue del 100%. Además en este tratamiento hubo la formación de 4.55 ± 0.50 brotes por explante, número más bajo que en las demás concentraciones incluido el control, por lo cual esta concentración resultó ser la más adecuada para retardar el crecimiento de los explantes de Laelia anceps subsp. anceps f. semialba, a pesar de que algunos plántulas formaron un número menor de brotes y presentaron una supervivencia mayor; por ejemplo aquellas cultivadas con ABA 3, 5 y 10 mg/l. El segundo mejor resultado en cuestión de incremento de altura se presentó en las plántulas cultivadas con sorbitol (60 g/l) en donde al término de 5 meses hubo un decremento en el promedio de altura final de 0.88 cm, pero al igual que en el caso anterior hubo una formación de brotes aún mayor, 7.55 ± 0.46; sin embargo en este caso hubo una supervivencia del 95%. El tercer mejor resultado en cuanto a incremento se presentó en las plántulas sujetas a la interacción con ABA 10 mg/l, en donde se presentó un decremento de 0.76 cm. Este tratamiento resultó ser adecuado porque el incremento de altura fue bajo y los explantes mostraron una brotación múltiple de tan solo 2.19 ± 0.12 brotes por explante, 54 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba aunque también en este tratamiento se presentó la supervivencia más baja (75%) pero se debió a la contaminación por hongos. A pesar de esto, resulta un tratamiento muy adecuado para aplicarse con especies similares si lo que se desea es retardar su crecimiento y desarrollo con fines conservacionistas, es decir, para el establecimiento de bancos de germoplasma activos in vitro con lo cual se tiene material disponible para estudios futuros y de propagación masiva para su comercialización (Iriondo, 2001), ya que Laelia anceps subsp. anceps f. semialba es también importante desde el punto de vista de la floricultura. Otros tratamientos que también presentaron un decremento en el promedio final de talla en las plántulas corresponden a: sacarosa (40 g/l), en donde se observó un decremento de 0.10 cm y la formación de 6.48 ± 0.99 brotes por explante y por último el tratamiento con 5 mg/l de ABA, con una reducción en la talla promedio de 0.03 cm y la formación de 2.33 ± 0.13 brotes por explante. Engelmann (1991) resaltó que la adición de altas concentraciones de sacarosa reducía la tasa de crecimiento en protocormos de algunas orquídeas mientras que la suplementación con manitol reducía la tasa de crecimiento en brotes de papa y la sacarosa y el manitol combinados extendía el tiempo de almacenamiento. En el resto de los tratamientos, las plántulas mostraron un incremento en su talla que osciló entre 0.11-1.50 cm, pero a diferencia de los tratamientos arriba mencionados la formación de brotes fue alta, encontrándose casos extremos en donde se formaron 18.78 ± 1.97 brotes por explante. Las plántulas incubadas a bajas temperaturas, no mostraron cambio alguno en cuanto al incremento de altura ni formación de brotes, es decir, las plántulas sembradas presentaban en promedio 1.72 cm de altura y no tenían ningún brote; sin embargo, comenzaban a presentar daño por la baja temperatura pues se observaba una coloración blanca en las plántulas, originando en un lapso de 15 días la pérdida total del pigmento verde. Sin embargo, los frascos de cultivo permanecieron bajo las mismas condiciones y no se presentó ningún cambio después de 3 meses, posteriormente se pasó a condiciones de incubación normales, es decir, temperatura de 25±1°C y fotoperiodo de 16 horas luz y 8 de oscuridad, para promover una reactivación del metabolismo y que las plántulas mostraran actividad. Sin embargo, las plántulas no mostraron ningún cambio. La muerte en los explantes se debió a no soportaron el almacenamiento a 5°C., para la conservación de germoplasma de árboles tropicales mediante la técnica de encapsulación 55 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba con alginato de calcio, Maruyama et al., (1997) emplearon temperaturas de incubación de 12, 20 y 25°C, es decir, muy por encima del punto de congelación, lo cual indica que probablemente para retardar el crecimiento de Laelia anceps subsp. anceps f. semialba es necesario emplear temperaturas de incubación no tan bajas, o emplear otra técnica (como la crioconservación) y usar otro tipo de explante, como pueden ser puntas de brotes, embriones o células (Paul et al., 2000; Ishikawa et al., 1997; Miranda, 1992) o protocormos o PLBs en orquídeas. También se podría tratar previamente a los explantes con alguna sustancia crioprotectora como sorbitol, sacarosa, manitol, etc., para promover una mayor resistencia a las células o aplicar directamente al medio de cultivo algún crioprotector como Miranda (1992) que cultivó ápices de ajo en medio MS con diferentes concentraciones de sacarosa y manitol, obteniendo los mejores resultados con manitol 30 g/l y 50 g/l; sin embargo, también encontró que una combinación de baja temperatura con sacarosa y manitol mejoran las condiciones de las plántulas, lo cual puede ser extrapolado con otras especies. Kartha et al. (1981) demostraron que los brotes de Coffea arabica podían ser mantenidos por dos años sin la necesidad de subcultivos en medio de cultivo con la concentración de sus sales al 50% y sin sacarosa. En general, para la conservación in vitro de tejidos vegetales se han empleado diferentes factores, de los cuales el más utilizado es la modificación del medio de cultivo con distintos agentes osmóticos y el carbón activado que elimina o reduce a niveles muy bajos la oxidación fenólica (Roca y Mroginski 1991), aspecto que incide negativamente en el proceso de conservación. 56 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba A B C D Figura 8. Tratamiento con manitol. (A) Plántulas testigo (sin manitol).. (B) Con 10 g/l ocurrió una alta formación de brotes.. (C) Las plántulas cultivadas con 30 g/l presentaron la formación una baja formación de brotes y (D) con 60 g/l de manitol, se observó la formación de raíces adventicias,, la caída de las hojas y una casi nula brotación. 57 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba A B C D Figura 9. Tratamiento con sacarosa. (A) Testigo. (B) Con 10 g/l,, las plántulas produjeron brotes que rápidamente rodearon al explante original, estas plántulas presentan una coloración verde claro. (C) Se observa una alta formación de brotes con la adición adici de 20 g/l de sacarosa, las plántulas aunque pequeñas presentan raíces gruesas. (D) Las plántulas cultivadas con 40 g/l de sacarosa presentan un crecimiento mayor pero una formación de brotes escasa. 58 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba A B C D Figura 10. Tratamiento con ABA. (A) Control. (B) Plántulas en medio MS con una concentración de 1 mg/l,, mostrando la formación de brotes. (C) Las plántulas cultivadas con 3 mg/l presentaron en muchos de los casos la formación de raíces adventicias, lo cual puede constituir una nueva planta. (D) Con 5 mg/l de ABA, los explantes iniciales perdieron sus hojas debido a que estas se secaron. 59 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba A B Figura 11.. Efecto de la incubación a 5°C sobre los explantes de Laelia anceps subsp. anceps f. semialba.. (Ay B) Plántulas muertas debido al daño por el frio. 7.3 Inducción nducción de respuestas morfogenéticas En la figura 12 se observa que las las respuestas morfogenéticas obtenidas durante el cultivo de plántulas de L. anceps ancep subsp. anceps f. semialba in vitro fue la formación de brotes, producción de PLBs (cuerpos semejantes a protocormos por sus siglas en inglés) y en algunos os casos la formación de callo. Después de 60 días en medio adicionado con reguladores del crecimiento, las plántulas fueron subcultivadas a medio basal MS. La formación de brotes y plbs se presentó p desde la fase de inducción, pero después del subcultivo a medio basal ésta sta fue incrementándose paulatinamente y en todos los casos los brotes mostraron un patrón de desarrollo similar, similar es decir, se observó la formación de brotes adventicios en la base del explante. explante Al inicio los nuevos brotes se apreciaban como pequeños nódulos verdes,, los cuales crecían directamente del explante y se desarrollaron laron rápidamente e incrementaron su talla hastaa consolidarse en nuevos brotes con hojas, en algunos casos, los brotes podían desprender con facilidad de la masa original y continuaban su desarrollo. desarrollo Muchos de los brotes desarrollaron desarrolla raíces de manera espontánea,, es decir sin la necesidad de subcultivarlos a otro medio de cultivo para su enraizamiento. enraizamiento 60 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba A B Figura 12. Respuesta morfogenética de las plántulas después de 2 meses de inducción. (A) Formación de brotes adventicios mediante organogénesis directa. (B) Brotación múltiple y formación de raíces. 7.3.1 Efecto de BA y ANA sobre las plántulas de Laelia anceps subsp. anceps f. semialba La tabla 4 muestra el promedio de brotes por explante obtenidos a partir del cultivo de plántulas sujetas a la interacción de distintas concentraciones de BA y ANA, después de 5 meses de cultivo,, al igual que el porcentaje de supervivencia observado en los diferentes diferente tratamientos,, asimismo, en la figura 13 se puede observar que la principal respuesta al cultivo con estos reguladores fue la formación de brotes. La supervivencia de las plántulas sujetas a la interacción de BA y ANA en general fue alta, es decir, del 80 al 100%. La disminución del porcentaje de supervivencia se debió principalmente por contaminación por hongos y/o bacterias y en el menor de los casos por la oxidación de los mismos explantes. 61 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba TABLA 4. Resultados obtenidos después de cultivar plántulas de Laelia anceps subsp. anceps f. semialba en medio MS adicionado con BA y ANA, resultados después de 5 meses de cultivo. Supervivencia (%) Promedio de brotes por explante ± E. S 0 80 % 15.2 ± 4.24abc 2.7 80 % 7.2 ± 1.55ab 5.4 80 % 11.4 ± 2.01abc 0 80 % 18 ± 2.62cd 2.7 100 % 6.6 ± 0.88a 5.4 100 % 9.5 ± 1.33ab 0 80 % 11.5 ± 1.72abc 2.7 100 % 19.1 ± 3.29cd 5.4 100 % 12.0 ± 2.32abc 0 80 % 19.0 ± 4.13cd 2.7 80 % 14 ± 3.62abc 5.4 80 % 24.5 ± 3.59d 0 80 % 19.9 ± 3.70cd 2.7 100 % 9.0 ± 1.46ab 5.4 80 % 15.7 ± 4.64bcd BA/ANA (µM) 0 2.2 4.4 8.9 17.8 Resultados obtenidos después de 5 meses de cultivo in vitro Letras diferentes indican diferencia significativa (p≤0.05). BA: N6-benciladenina ANA: Ácido α-naftalen acético E.S: Error estándar. Al realizar un ANOVA para la formación de brotes se estableció una diferencia significativa (p=0.001118) entre los diferentes tratamientos llevados a cabo, resultando las concentraciones 2.2 µM de BA con 0 µM de ANA, 4.4 µM de BA con 2.7 µM de ANA, 8.9 µM de BA con 0 µM, 17.8 µM de BA con 0 µM de ANA, 8.9 µM de BA con 5.4 µM de ANA y 17.8 µM de BA con 5.4 µM de ANA en donde se presentaron los promedios más altos. Sin 62 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba embargo, estos seis tratamientos no son diferentes significativamente por lo que se tiene que el promedio más alto fue con 8.9 µM de BA con 5.4 µM de ANA ya que se produjeron 24.5 brotes por explante Por otro lado, el control presentó en promedio la formación de 15.2 brotes por explante, promedio más alto que algunos tratamientos como con 2.7 µM de ANA únicamente y 2.2 µM de BA con 2.7 µM de ANA, es decir, se presentaron casos en donde la presencia de BA inhibió la formación de brotes. En los tratamientos adicionados únicamente con: 2.2 µM de BA, 2.2 µM de BA con 2.7 µM de ANA, 2.2 µM de BA con 5.4 µM de ANA, sólo con 4.4 µM de BA y 4.4 µM de BA con 5.4 µM de ANA hubo además de la formación de PLBS la presencia de tejido calloso de color verde. Los resultados obtenidos en el presente estudio en cuanto a producción de brotes son similares a los mostrados en otros trabajos donde se muestra el efecto inductivo de organogénesis de las citocininas-auxina en medio MS. A diferencia de Hernández et al., (2001) quienes indican que el porcentaje más alto en cuanto a formación de brotes en L. anceps se presentó con la adición de 4.4 µM de BA y 0 µM de 2,4-D, en el presente estudio la mayor formación de brotes se obtuvo en el tratamiento que contenía 8.9 µM de BA y 5.4 µM de ANA, es decir, empleando el doble de citocininas y una concentración alta de auxinas. Similar a los resultados aquí presentados, Salazar (2003) al cultivar protocormos de Mormodes tuxtlensis y Cuitlauzina pendula, notó una mayor brotación a concentraciones bajas de auxina y altas de citocinina. De acuerdo a Tinoco-Juárez (2006), ocurrió algo similar con L. anceps pues la mayor formación de brotes y PLBs se presentó en el tratamiento adicionado únicamente con 13.2 µM de BA, aunque uno de los siguientes mejores promedios se presentó en plántulas sujetas a la interación con ANA, es decir, con 4.4µM de BA y 2.7 µM de ANA y el otro adicionado únicamente con 4.4 µM de BA. Zhao et al. (2007) al cultivar delgadas capas celulares de tallo (nudos) de Dendrobium candidum reportan que la mejor formación de brotes se observó en el medio MS adicionado con 6.6 y 8.9 µM de BA con un promedio 17.2 brotes por explante en aproximadamente 50% de los explantes sembrados, pero al combinar 8.0 µM de BA con 2.2 µM de ANA obtuvieron un incremento en el número de brotes por explante (27.3), lo cual es muy similar al tratamiento con 8.9 µM de BA con 5.4 µM de ANA, en donde se obtuvieron en promedio 24.5 brotes por explante. Janarthanam y Seshadri (2008) al cultivar callo generado de hojas de Vanilla planifolia en 63 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba medio MS adicionado con distintas concentraciones de BA (2.2-22.20 (2.2 μM)) y ANA (0.0-26.85 (0.0 μM)) encontraron que el tratamiento más adecuado para la proliferación de brotes brot resultó empleando concentraciones altas de ambos reguladores del crecimiento, es decir, 13.32 μM de BA con 13.43 μM de ANA pues se produjeron en promedio 14 brotes en 70% de los explantes,, lo cual difiere notoriamente a lo observado en el presente caso. caso Aunque también existen algunos reportes que indican que la adición de bajas concentraciones de auxinas promueve un desarrollo más acelerado en algunas especies (George y Sherrington, 1984). A B Figura 13. Plántulas sujetas a la interacción de BA y ANA. (A) Frasco de cultivo con brotación múltiple. (B) Brotes con raíces y formación de PLBs. PLBs 7.3.2 Efecto de mT y ANA sobre las plántulas de Laelia anceps subsp. anceps f. semialba De manera general, se registraron supervivencias entre 80-100% 80 100% en las plántulas cultivadas en medio adicionados con diferentes concentraciones de metatopolina (mT), (mT) aunque también se presentaron casos en donde la supervivencia fue de 10 y 40% (Tabla 5). A pesar de que no se pudo o establecer diferencia significativa (p=0.089) el tratamiento que indujo la mayor formación de brotes por explante fue con 8.9 µM y el que indujo la menor formación fue con 2.2 µM de mT con 5.4 µM de ANA (Figura 14). El segundo mejor promedio de brotes por explante se presentó en el tratamiento adicionado con 4.4 µM de mT únicamente. Otros tratamientos en donde se observó una tendencia similar y por lo que no 64 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba se pudo establecer una diferencia significativa (p≤0.05) corresponden al testigo, 2.2 µM de mT sin ANA, 8.9 µM de mT con 2.7 µM de ANA y 17.8 µM de mT con 5.4 µM de ANA. Lo contario se presentó en los siguientes tratamientos: únicamente con 2.7 µM de ANA y 2.2 µM de mT con 5.4 µM de ANA, de entre los cuales el promedio más bajo corresponde al segundo tratamiento. TABLA 5. Resultados obtenidos después de cultivar plántulas de Laelia anceps subsp. anceps f. semialba en medio MS adicionado con mT y ANA, resultados después de 5 meses de cultivo. Supervivencia (%) Promedio de brotes por explante 0 100 7.6 ± 1.59 2.7 100 5.0 ± 0.71 5.4 80 9.3 ± 2.99 0 100 8.0 ± 1.26 2.7 100 5.8 ± 0.93 5.4 100 3.4 ± 0.54 0 100 9.1 ± 1.80 2.7 100 6.9 ± 1.21 5.4 80 6.0 ± 0.95 0 80 9.5 ± 1.47 2.7 100 7.44 ± 1.33 5.4 10 5.0 ± 0.92 0 100 5.9 ± 0.94 2.7 40 5.7 ± 0.87 5.4 100 8.5 ± 1.11 mT/ANA (µM) 0 2.2 4.4 8.9 17.8 Resultados obtenidos después de 5 meses de cultivo in vitro Nota: Letras diferentes indican diferencia significativa (p≤0.05). mT: Metatopolina E.S: Error estándar. 65 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba Aunque no se encontraron aron trabajos en donde se empleó la mT para promover la brotación múltiple en orquídeas, existen estudios como el de Neeta et al.,., (2002) y SánchezSánchez Morán y Pérez-Molphe-Balch Balch (2007) donde se ha encontrado que la mT puede inducir induc una mayor cantidad de brotes que otras citocininas y con la ventaja que en muchos casos no ha inhibido el desarrollo de raíces (Werbrouck et al., 1996). En el cultivo de Laelia anceps subsp. anceps f. semialba,, aunque la brotación fue muy similar entre tratamientos, tratamientos se observó de manera general que las plántulas correspondientes a los distintos tratamientos tratamientos tenían de 2-4 2 hojas verde claro,, las cuales presentaron también la formación de un sistema radical (1-5 (1 raíces delgadas) de aproximadamente 3 cm de longitud. También en algunos casos, las plántulas presentaron una coloración coloración verde intenso, hojas gruesas y en al menos 8 plántulas se presentó la formación de un pequeño pseudobulbo pero únicamente se presentó en unos cuantos frascos de cultivo. A B Figura 14. Respuestas morfogenéticas en plántulas sujetas a la interacción de mT y ANA. ANA (A) Brotes adventicios. (B) Brotes múltiples y PLB´s. PLB´s 66 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba 7.3.3 Efecto de TDZ y ANA sobre las plántulas de Laelia anceps subsp. anceps f. semialba En la tabla 6 y figura 15 se muestra que después de 5 meses de cultivo, la supervivencia en todos los tratamientos con TDZ y ANA fue del 100%, y al analizar la formación de brotes por efecto del TDZ, se logró establecer una diferencia significativa (p≤0.05) entre los diferentes tratamientos aplicados, encontrándose que el tratamiento adicionado únicamente con 2.2 µM de TDZ (39.6) y los tratamientos con 2.2 µM de TDZ y 2.7 µM de ANA (42.1), 4.4 µM de TDZ con 5.4 µM de ANA (33.5), 17.8 µM de TDZ con 2.7 µM de ANA (37.1) y 17.8 µM de TDZ con 5.4 µM de ANA (32.2) fue donde se logró inducir la mayor formación de brotes. Pero de todos estos tratamientos resultó mejor la adición de 2.2 µM de TDZ con 2.7 µM de ANA pues se produjeron en promedio 42.1 brotes por explante. Al observar la formación de brotes en las plántulas de los diferentes tratamientos se tiene que, a bajas concentraciones tanto de citocininas como de auxinas la brotación múltiple se hace un tanto más evidente que al tratar a los explantes con únicamente un regulador del crecimiento. También se puede observar que al elevar la concentración tanto de citocininas como de auxinas, la formación de brotes se ve afectada negativamente porque se reduce significativamente. El TDZ es útil para la rápida regeneración de varias especies a través de organogénesis o embriogénesis somática (Malik y Saxena, 1992 citados por Malabadi et al., 2004). De acuerdo a algunos estudios con especies de otras familias se tiene que puede estimular la multiplicación de brotes y que si se emplea en combinación con otros reguladores del crecimiento puede favorecer la altura de los brotes (Sauve et al., 2004; Thomas y Philip, 2005). En orquídeas, Malabadi et al., (2004) muestran el efecto favorable del cultivo de puntas de brotes en Vanda coerulea en medio Vacin and Went (VW), pues al realizar un barrido hormonal amplio en concentraciones de 0-45.41 µM encontraron que la mayor formación de brotes (8.9) y PLBs (13) se produjo en la concentración 11.35 µM, con un porcentaje de respuesta alto (96%). Por lo contrario, los extremos superiores e inferiores tuvieron efectos no favorables pues los explantes no mostraron respuesta alguna. En el presente estudio, la producción osciló entre 3.6-42.1 brotes por explante, lo cual indica que el TDZ tiene una alta capacidad en la regeneración de brotes a bajas concentraciones, pero la producción se ve mejorada cuando se combina con alguna auxina que en este caso fue ANA 67 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba y que a concentraciones altas el TDZ por sí solo inhibe la formación de brotes pues al emplear 17.8 µM únicamente se formaron 3.6 brotes. Sin embargo, también se observó que las plantas que se cultivaron únicamente con ANA no presentaron una elevada formación de brotes. También Ferreira et al.. (2006) revelan que la producción producción de brotes en diferentes concentraciones de TDZ fue efectiva en Dendrobium Second Love (D. peace X D. awayuki), el valor más alto se obtuvo en la concentración 1.8 µM con 6.24 brotes por explante. En el caso de Dendrobium aphyllum y Dendrobium moschatum 4.5 µM fue la mejor concentración para la regeneración de brotes (Nayak et al., 1997b). Le et al.. (1999) verificaron que la concentración más efectiva para la proliferación de brotes de Rhynchostylis gigantea fue de 3 µM. A B C D Figura 15.. Respuestas morfogenéticas en plántulas sujetas a la interacción de TDZ y ANA. (A) Frasco de cultivo con brotes adventicios. (B) Brotes múltiples y PLB´s. (C) Estructuras amorfas que presentan entan pequeños “brotes” en la periferia. periferia. (D) Crecimiento y desarrollo de un brote con raíz sobre otro brote formado anteriormente (carente de sistema radical). 68 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba TABLA 6. Resultados obtenidos después de cultivar plántulas de Laelia anceps subsp. anceps f. semialba en medio MS adicionado con BA y ANA, resultados después de 5 meses de cultivo. Supervivencia (%) Promedio de brotes por explante ± E. S 0 100 16.4 ± 2.37b 2.7 100 14.8 ± 2.03b 5.4 100 16.1 ± 2.41b 0 100 39.6 ± 5.09de 2.7 100 42.1 ± 5.28e 5.4 100 15.5 ± 1.73b 0 100 13.4 ± 2.8ab 2.7 100 31.3 ± 4.48cd 5.4 100 33.5 ± 4.85cde 0 100 23.0 ± 2.52bc 2.7 100 23.0 ± 3.0bc 5.4 100 17.0 ± 3.12b 0 100 3.6 ± 0.41a 2.7 100 37.1± 6.05de 5.4 100 32.2 ± 3.81cde TDZ/ANA (µM) 0 2.2 4.4 8.9 17.8 Resultados obtenidos después de 5 meses de cultivo in vitro Nota: Letras diferentes indican diferencia significativa (p≤0.05). TDZ: Tidiazuron En algunos trabajos como el de Ket et al. (2004) se ha observado que los brotes producidos por los explantes sujetos a la interacción con TDZ tienen crecimiento lento y producen hojas muy pequeñas, por lo que se ha sugerido que los brotes posteriormente sean cultivados en un medio libre del regulador. Ante eso, como medida y a fin de que el efecto de la adición del TDZ al medio de cultivo fuera evidente se transfirieron las plántulas y 69 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba brotes formados de Laelia anceps subsp. anceps f. semialba durante la fase de inducción (60 días) a medio MS basal. Observándose ya en el medio sin la citocinina, el crecimiento y desarrollo de brotes y principalmente PLBs; sin embargo, también en algunos casos los explantes cultivados en altas concentraciones de TDZ (17.8 µM), hubo la formación de estructuras amorfas a manera de brotes que al desarrollar mejor formaban brotes individuales que posteriormente se individualizaron para que continuaran con su crecimiento y desarrollo. 7.3.4 Efecto de K y ANA sobre las plántulas de Laelia anceps subsp. anceps f. semialba La supervivencia observada en la mayoría de los tratamientos con diferentes concentraciones de kinetina (K) fue del 100%; sin embargo, en el tratamiento únicamente con 2.2 µM de K se perdieron 5 plántulas debido a la contaminación por hongos, lo que representa un 80% de supervivencia (Tabla 7). Un caso extremo se presentó con la concentración de 17.8 µM de K con 2.7 µM de ANA en donde únicamente sobrevivieron 5 explantes, es decir, murieron 80% de las plántulas (Figura 16). Después de 5 meses de iniciado el cultivo in vitro de las plántulas de L. anceps subsp. anceps f. semialba, la formación de brotes y/o PLBs se vio favorecida, pues al término de la fase de inducción y el subcultivo a medio basal, los explantes mostraron un crecimiento y desarrollo notorios, estableciéndose así una diferencia significativa (p=.000060) entre los tratamientos. El mejor tratamiento para la producción de brotes resultó ser aquel donde únicamente se adicionó 5.4 µM de ANA sin la citocinina, pues crecieron en promedio 10.0 brotes, seguido del tratamiento adicionado únicamente con 4.4 µM de K, y como tercer mejor tratamiento se tiene al que aplicar 8.9 µM de K con2.7 µM de ANA se promueve la formación de 8.0 brotes por explante. La concentración donde se formó un número contrastante de brotes (3.4) fue con 2.2 µM de K y 5.4 µM de ANA, seguida por 2.2 µM de K con 2.7 µM de ANA con la formación de 3.8 brotes y también el tratamiento donde se adicionaron únicamente 2.7 µM de ANA. El efecto de la kinetina sobre la formación de brotes fue evaluado y de acuerdo con otros autores se tiene que la producción de brotes para Laelia anceps subsp. anceps f. semialba es muy similar. Tal y como reportan Zhao et al., (2007) durante el cultivo de 70 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba delgadas capas celulares de Dendrobium candidum, donde el porcentaje de explantes con respuesta fue del 24% con un promedio de 5.3±1.3 brotes formados, en el 2008, los mismos autores, al cultivar protocormos disecados de la misma especie en medio MS 50% encontraron que 32% de los explantes produjeron callo al emplear 6.9 μM de K. TABLA 7. Resultados obtenidos después de cultivar plántulas de Laelia anceps subsp. anceps f. semialba en medio MS adicionado con K y ANA, resultados después de 5 meses de cultivo. Supervivencia (%) Promedio de brotes por explante ± E. S 0 100 6.9 ± 1.40bcd 2.7 100 4.0 ± 1.10ab 5.4 100 10.0 ± 1.46d 0 80 7.0 ± 0.56bcd 2.7 100 3.8 ± 0.36a 5.4 100 3.4 ± 0.61a 0 100 8.9 ± 1.50d 2.7 100 4.7 ± 0.43ab 5.4 100 5.5 ± 0.79abc 0 100 5.8 ± 1.38abcd 2.7 100 8.0 ± 1.33d 5.4 100 7.8 ± 1.04cd 0 100 4.3 ± 0.66ab 2.7 20 5.6 ± 0.60abcd 5.4 100 6.9 ± 1.22bcd K/ANA (µM) 0 2.2 4.4 8.9 17.8 Resultados obtenidos después de 5 meses de cultivo in vitro Nota: Letras diferentes indican diferencia significativa (p≤0.05). K: Kinetina E.S: Error estándar. 71 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba Nayak et al.,., (1997a) mencionan que al cultivar hojas de la orquídea epífita Acampe praemorsa la K promovió, en una concentración de 44 µM, la formación de 4.6 brotes por explante en 35.8% de los mismos y que al adicionar 5.4 µM de ANA el porcentaje de brotes con respuesta aumentó a 37%, sin embargo, el promedio en la producción de brotes no mostró ó un cambio significativo (4.9). El número de brotes obtenidos para L. anceps subsp. anceps f. semialba son muy similares a los observados con otras especies de orquídeas. Sin embargo, la K promueve también una mayor formación de brotes en especies pertenecientes pertenecientes a otros grupos, tal es el caso de Tylophora indica en donde a partir de callo obtenido del cultivo de hojas se formaron 21.2 brotes en medio de cultivo MS adicionado con 6 µM de K con 1 µM de ANA A B C D Figura 16.. Respuestas morfogenéticas en plántulas sujetas a la interacción de K y ANA. (A) Frasco de cultivo con brotes adventicios. s. (B) Brotes múltiples. múlti (C) Brotes adventicios unidos al explante original. (D). Formación de plántulas a partir de PLBs. PLBs 72 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba 7.3.5 Análisis de los reguladores del crecimiento Al analizar juntamente el efecto de la adición de citocininas empleadas (BA, mT, TDZ, K y ANA) sobre la formación de brotes o PLBs por explante se pudo establecer diferencia significativa (p≤0.05). Se observó que las plántulas que presentaron una mayor producción de brotes fueron aquellas en presencia de TDZ, donde los tratamientos como el adicionado únicamente con 2.2 µM, 2.2 µM de TDZ con 2.7 µM de ANA y 17.8 µM de TDZ con 2.7 µM de ANA, indujeron la mayor formación de brotes por explante, 39.6, 42.1 y 37.1 brotes por explante, respectivamente Por lo contrario, los tratamientos que mostraron la más baja producción de brotes corresponden a las siguientes concentraciones: únicamente con 2.7 µM de ANA, 2.2 µM de mT con 5.4 µM de ANA, 8.9 µM de K con 5.4 µM de ANA, con 17.8 µM de TDZ únicamente y tratamientos con K, es decir, adicionando únicamente 2.7 µM de ANA, 2.2 µM de K con 2.7 µM de ANA, 4.4 µM de K con 2.7 µM de ANA y empleando 17.8 µM de K sin ANA. Sin embargo, el tratamiento que resultó menos efectivo para la producción masiva de brotes se presentó en el primer caso con tan sólo 3.4 brotes por explante en promedio. En el presente estudio, de las cuatro citocininas usadas, el TDZ fue el más efectivo para la inducción de PLBs y brotes. Se ha reportado que el TDZ induce la formación de brotes adventicios en muchas plantas y este compuesto ha mostrado ser más efectivo que las citocininas de tipo purina (BA o K) inclusive a bajas concentraciones (Huetteman y Preece, 1993; Nayak et al., 1997; Chen et al., 1999; Roy et al., 2007). Comparativamente, en algunos casos, la presencia de ANA con BA o K incrementó la producción de brotes por cultivo comparado únicamente con BA y K. Los resultados aquí presentados, al igual que otros trabajos reportados en la literatura, muestran que la concentración ideal para la proliferación de brotes varia con el material vegetal bajo estudio (Ket et al., 2004; Malabadi et al., 2004; Chung et al., 2005). También se sostiene la evidencia de que el TDZ juega un papel importante en el desarrollo de yemas axilares y en la formación de brotes adventicios. 7.4 Establecimiento ex vitro Para las pruebas de establecimiento ex vitro se usaron plántulas de casi todos los tratamientos, a excepción de aquellos tratamientos en donde se perdió un porcentaje elevado debido a la contaminación por hongos, es decir, no se hicieron pruebas de las 73 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba plántulas cultivadas con endospermo líquido de coco y metatopolina. En las figuras 17, 18 y 19 se puede observar la apariencia de las plántulas previo su establecimiento ex vitro. Las plántulas al momento de ser extraídas de los frascos de cultivo presentaron 2 hojas, aunque algunas presentaban 3 y éstas eran delgadas y largas. El número de raíces varió desde aquellas que únicamente presentaban 1 hasta las que tenían más de 4 raíces, de manera general muy pocas plántulas presentaban la formación de pseudobulbo y cuando se presentaba éste era duro y pequeño. En la tabla 8, se observa que tras dos meses de haber sembrado las plántulas en los dos sustratos empleados, ambos resultaron adecuados para el establecimiento ex vitro de las mismas. De manera general, se observó una supervivencia alta en ambos casos, es decir, en la mezcla se presentó un porcentaje de supervivencia del 82.92%, mientras que en el tepecil el porcentaje fue de 82.42. Con respecto al incremento de altura de las plántulas, se tiene que el fertilizante que promovió un mejor desarrollo fue la lombricomposta, pues aunque en el caso de la mezcla se observó un crecimiento de 0.16 cm en el tepecil fue de 0.18 cm. Por su parte, las plántulas que fueron sembradas en la mezcla y se asperjaron con fertilizante foliar mostraron un incremento de 0.16 cm, mientras que las sembradas en tepecil incrementaron su talla en 0.13 cm. Por último, las plántulas regadas con agua únicamente (control) y sembradas en la mezcla crecieron 0.18 cm y en tepecil tan solo 0.09 cm. Sin embargo, se tiene que la mezcla permitió un mejor crecimiento y crecimiento de las plántulas presentándose un incremento general, entre todos los tratamientos, de 0.17 cm y en el tepecil ocurrió algo similar pero el incremento general (0.13 cm) no superó el obtenido con la mezcla (Figura 20). Para saber si el incremento de talla en las plántulas estuvo influenciado por el sustrato, fertilizante o procedencia durante el cultivo in vitro, se realizaron análisis de varianza; asimismo para saber si la supervivencia estuvo influenciada por algunos de los factores antes mencionados. Después de realizar un ANOVA, no se pudo establecer diferencia significativa con respecto al incremento de las plántulas para sustrato y fertilizante; sin embargo, en el caso de la procedencia de las plántulas si se logró establecer diferencia significativa (p≤0.05), resultando las plántulas provenientes del cultivo con sacarosa, kinetina y ABA las que más crecieron. Las plántulas cultivadas con sacarosa presentaron un incremento de altura de 0.3 74 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba cm. Por otro lado, las plántulas que mostraron un casi nulo incremento de altura corresponden a aquellas cultivadas con HC (50 g/l), sorbitol, HC (100 g/l), HP y TDZ, pues presentaron en el mejor de los casos un aumento de talla de 0.08 cm. De manera general, las plántulas plántulas mostraron durante este periodo el engrosamiento de sus hojas y se tornaron de un color verde más oscuro del que presentaban previo su establecimiento ex vitro.. También se presentó el surgimiento de raíces gruesas, las cuales comenzaron a adherirse al sustrato y muchas de las plántulas comenzaron a desarrollar un brote secundario que presentó un crecimiento más acelerado (Figura 21). 21) A B C D Figura 17.. Apariencia de las plántulas cultivadas con compuestos orgánicos. (A) Plántulas producidas en medio sin compuestos orgánicos (control), las cuales presentan una coloración amarillo-verdosa verdosa (B) Plántulas vigorosas hasta con cuatro hojas y sistema radical bien representado, obtenidas tras el cultivo con homogeneizado de papa. (C) Plántulas con sistema radical desarrollado y coloración verde oscuro, obtenidas tras el cultivo con hidrolizado de caseína 50 mg/l y (D) Plántulas cultivadas ltivadas en medio adicionado con hidrolizado de caseína (100 mg/l). 75 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba A B C D Figura 18.. Apariencia de las plántulas cultivadas con retardantes de crecimiento. (A) Plántulas muy delgadas y pequeñas con tan sólo 2 raíces obtenidas del cultivo con manitol, anitol, (B) con sorbitol, las plántulas mostraron una coloración verde oscura, la presencia de hasta 4 hojas, aunque la raíz poco representada, (C) las plántulas cultivadas con sacarosa presentaron en algunos de los casos, la formación de pseudobulbo y (D) en ABA las plántulas produjeron hojas gruesas y largas. largas 76 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba A B C D Figura 19. Apariencia de las plántulas cultivadas con reguladores del crecimiento vegetal. vegetal (A) Plántulas control obtenidas tras su cultivo en medio MS sin reguladores del crecimiento. (B)) Plántulas verdes con raíces gruesas producidas tras el cultivo con BA. (C) Las plántulas producidas con TDZ presentan coloración verde-amarillenta verde y el sistema tema radical es escaso. (D)) Plántulas con sistema radical desarrollado, coloración verde oscuro y hojas gruesas, obtenidas tras el cultivo con K. 77 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba A B C D Figura 20.. Aspecto general de las plántulas durante su establecimiento ex vitro. vitro (A) Plántulas recién sembradas en ambos sustratos en donde se aprecia la coloración verde intenso de las hojas.. (B)Tras dos meses de cultivo, cultivo casi todas las plántulas mostraron un aumento nto en su altura y la formación de raíces e inclusive algunas la aparición de brotes secundarios. secundarios. (C) En mezcla, mezcla las plántulas mostraron una supervivencia elevada, y (D) en tepecil ocurrió lo mismo. mismo 78 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba Tabla 8. Porcentaje de supervivencia ex vitro de las plántulas de Laelia anceps subsp. anceps f. semialba en los diferentes sustratos evaluados. MEZCLA TEPECIL TRATAMIENTO AGUA NITROFOSKA LOMBRICOMPOSTA AGUA NITROFOSKA LOMBRICOMPOSTA SV (%) IR (cm) SV (%) IR (cm) SV (%) IR (cm) SV (%) IR (cm) SV (%) IR (cm) SV (%) IR (cm) 73.33 0.20 83.33 0.20 90 0.04 83.33 0.08 76.66 0.28 83.33 0.65 86.66 0.03 76.66 0.02 83.33 0.11 66.66 0.03 90 0.02 83.33 0.01 86.66 0.13 93.33 0.04 86.66 0.02 86.66 0.10 83.33 0.06 86.66 0.10 PAPA 50 g/l 73.33 0.12 83.33 0.04 86.66 0.04 86.66 0.04 86.66 0.10 90 0.16 SORBITOL 86.66 0.02 80 0.04 83.33 0.06 90 0.04 80 0.03 83.33 0.18 MANITOL 76.66 0.11 80 0.08 76.66 0.11 90 0.14 73.33 0.05 86.66 0.15 SACAROSA 70 0.55 80 0.89 76.66 0.42 86.66 0.009 93.33 0.02 86.66 0.008 ABA 93.33 0.38 86.66 0.13 80 0.71 86.66 0.01 70 0.27 83.33 0.16 BA 90 0.24 90 0.08 93.33 0.01 83.33 0.28 80 0.05 83.33 0.14 TDZ 100 0.07 76.66 0.11 73.33 0.006 80 0.08 76.66 0.09 83.33 0.15 K 83.33 0.22 76.66 0.17 80 0.30 76.66 0.27 70 0.52 73.33 0.31 CONTROL CASEÍNA 50 mg/l CASEÍNA 100 mg/l Sustratos: Mezcla de corteza de pino, carbón vegetal y tepecil (1:1:1) y tepecil. Resultados obtenidos después de 60 días de cultivo en invernadero. Números en negritas indican incremento más alto registrado durante el cultivo ex vitro. SV (%): Porcentaje de supervivencia IR (cm): Incremento real ABA: Ácido abscísico. BA: N6-benciladenina 79 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba A B Figura 21. Plántulas aclimatadas tras dos meses bajo condiciones de invernadero. (A) En mezcla, con la presencia de un nuevo brote y la aparición de nuevas raíces. (B) En tepecil, con la formación de pseudobulbo, nuevo brote y la fijación de raíces en el sustrato. La influencia del sustrato en el establecimiento ex vitro de las plántulas, está dada en función de la capacidad de retención de agua y no por la presencia de materiales orgánicos, en las que las raíces únicamente utilizan el sustrato como soporte y no no como fuente de nutrientes (Salazar, 2003). En el presente trabajo es notoria la eficacia de ambos sustratos para el establecimiento ex vitro debido posiblemente a la capacidad que ambos tienen de mantener una alta humedad pero a la vez permiten el drenado adecuado del exceso de agua. Los resultados obtenidos con Laelia anceps subsp. anceps f. semialba, indican que existe una relación entre el tipo de sustrato y fertilizante fertilizante empleado mas no el cultivo del cual provenían las plántulas, pues de manera general todas las plántulas presentaron crecimiento, y aquellas que murieron se debió principalmente a la contaminación por hongos, a pesar de que al mínimo indicio de crecimiento cimiento del hongo se aplicaba la solución fungicida, aunque hubo algunos casos en que la muerte se debió a la deshidratación excesiva. Hernández et al., (2001) reportaron la supervivencia de casi 100% de las plántulas de Laelia anceps después de 2 meses de cultivo ex vitro en la misma mezcla empleada. empleada De acuerdo a Salazar (2003) al estudiar la supervivencia ex vitro de tres especies de orquídeas reportó que la utilización de la mezcla de corteza de pino, carbón vegetal y tepecil (3:1:1) favorece el establecimiento y desarrollo de las plántulas, pues obtuvo porcentajes de supervivencia relativamente altos. Durante la aclimatación de Acineta barkeri, barkeri, Moreno (2007) observó un alto porcentaje de 80 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba supervivencia (92-94%) al emplear como sustrato una mezcla de tepecil y carbón vegetal. En este caso, y tomando en cuenta todos los resultados obtenidos del cultivo de L. anceps subsp. anceps f. semialba en la mezcla, se tiene que es un buen sustrato pues permite el establecimiento adecuado de plántulas logrando niveles altos de supervivencia (89.92%). Lo anterior confirma la eficiencia de la mezcla como sustrato para el proceso de adaptación ex vitro de plántulas de orquídeas. Con respecto al uso de tepecil como sustrato para el establecimiento de orquídeas, Baltazar (2004) logró una supervivencia cercana al 100% en plántulas de Oncidium tigrinum al usar tepecil. También, en el 2006, Tinoco-Juárez reportó porcentajes de supervivencia que van del 82.5-100% para Laelia anceps, es decir, un porcentaje muy similar (82.42%) al obtenido durante la aclimatación de L. anceps subsp. anceps f. semialba. Esto indica que el tepecil es un buen sustrato a pesar de la poca retención y distribución de la humedad que puede presentar, por lo cual es recomendable mantener una humedad relativa alta durante la fase de aclimatación. Una de las fases que reviste gran importancia dentro de la técnica de propagación in vitro es el transplante de las plántulas al suelo, así como la adaptación de éstas al medio ambiente. Pues en el intento de aclimatar las plántulas micropropagadas muchas perecen porque son transferidas a un medio más agresivo, ya que durante cultivo in vitro crecen bajo condiciones controladas, es decir, se encuentran en un medio con abundantes compuestos orgánicos, por lo cual en esas condiciones son plantas mixotróficas, tomando parte de los carbohidratos necesarios por la fijación de dióxido de carbono pero el porcentaje más alto lo obtienen de la sacarosa presente en el medio de cultivo y a la vez porque presenta una alta humedad, además de una baja intensidad luminosa y temperatura constante (Hazarika, 2003; Pospíšilová et al., 1999,). Por lo anterior, es muy probable que el crecimiento insignificante de las plántulas de L. anceps subsp. anceps f. semialba se haya debido a que éstas gastaron energía en sobrevivir y activar o volver funcionales sus estomas al ser transferidas desde un ambiente controlado a un ambiente más extremo. Posterior a la realización de los análisis estadísticos, para saber si la supervivencia estuvo influenciada por algún factor, no se pudo establecer diferencia significativa (p≤0.05) para sustrato y procedencia; sin embargo, ocurre que para la supervivencia ex vitro de las plántulas, el fertilizante juega un papel importante. 81 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba 7.5 Consideraciones finales Las plántulas cultivadas alcanzaron en promedio 4 cm de altura y presentaron la formación espontánea de raíces aunque los pseudobulbos como tal ocurrieron en un porcentaje muy bajo de éstas, pero esto no fue factor limitante para su aclimatación, pues se observó una supervivencia cercana al 100% en todos los casos. Los compuestos orgánicos favorecieron el crecimiento de las plántulas, pero el mejor resultado se observó con el HP. Por otra parte, el uso de carbohidratos promovió el crecimiento lento en la mayoría de los explantes a diferencia del efecto negativo que se observó en las plántulas incubadas a 5°C. El TDZ resulta adecuado para promover formación masiva de brotes que al desarrollarse constituyen material que puede ser comercializado. Ahora bien, para poder obtener una gran cantidad de plantas de esta especie se recomienda emplear la concentración de reguladores del crecimiento antes mencionada y posteriormente subcultivarlos a medio de cultivo con 50 g/l de homogeneizado de papa para incrementar la talla de los explantes. Lo anterior permitirá a las plántulas presentar características deseables para su fácil establecimiento ex vitro ya sea en la mezcla o en tepecil, por lo cual también se sugiere emplear lombricomposta líquida (200 ml/l) para acelerar el proceso de aclimatación en condiciones de invernadero. Sin embargo, para conocer cuál fertilizante resulta realmente más adecuado para incrementar la talla de las plántulas, se hace necesario continuar con el análisis del efecto de los mismos sobre el crecimiento de éstas. Los resultados de este estudio permiten, por una parte, propagar masivamente Laelia anceps subsp. anceps f. semialba, así como acelerar el crecimiento de las plántulas obtenidas para que éstas puedan ser ofrecidas al mercado hortícola; y por otra parte, retardar el crecimiento de las plántulas para el establecimiento de bancos de germoplasma activos in vitro, todo ello con la única finalidad de colaborar en la conservación de los individuos silvestres que puedan existir, sabiendo que es uno de los métodos de conservación ex situ más importantes. Asimismo, los resultados obtenidos pueden ser extrapolados y usados para la propagación de otras especies emparentadas. El cultivo de tejidos vegetales resulta ser una excelente herramienta para la propagación de especies con problemas de conservación ya sea porque se encuentran amenazadas, en peligro de extinción, sean raras o porque son interesantes desde el punto de vista hortícola. A pesar de las orquídeas son plantas muy apreciadas y cultivadas en todo el mundo, no existen suficientes protocolos de propagación, además de que son escasos los trabajos que se enfocan en conservar germoplasma activo in vitro, por lo que proponer alguno es de mucha utilidad para coadyuvar con la problemática que presentan. 82 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba 8. CONCLUSIONES De los compuestos orgánicos adicionados al medio de cultivo, el homogenizado de papa (50 g/l) fue el que indujo el mayor crecimiento de las plántulas, alcanzando, después de 5 meses de cultivo un promedio general en la talla de 5.36 cm. El manitol 60 g/l resultó ser el mejor tratamiento para retardar el crecimiento en las plántulas, de entre los carbohidratos empleados así como del ácido abscísico, pues se presentó un decremento de 1.70 cm en la talla de las mismas. La incubación a 5°C resulta en la muerte de los explantes, debido a que el frío provoca daños en las plántulas de L. anceps subsp. anceps f. semialba. La principal respuesta al cultivo in vitro de plántulas en presencia de reguladores del crecimiento fue la formación de brotes adventicios por organogénesis directa seguida por la formación de PLBs. De los reguladores del crecimiento empleados, el tratamiento con 2.2 µM de TDZ y 2.7 µM de ANA promovió la más alta formación de brotes por explante (42.1). La supervivencia de las plántulas de L. anceps subsp. anceps f. semialba fue similar tanto en la mezcla como en el tepecil, sin embargo, fue más alta para aquellas que fueron asperjadas con agua y lombricomposta líquida. El incremento en la talla de las plántulas una vez establecidas ex vitro se vio afectada por la procedencia de las mismas, resultando las cultivadas in vitro con sacarosa las que presentaron el incremento más alto (0.32 cm). Los resultados obtenidos en el presente trabajo de investigación ofrecen las herramientas necesarias para propagar esta especie de manera masiva y comercializarla legalmente, así como conservarlas in vitro a corto mediano-plazo. 83 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba 9. LITERATURA Aguirre-Leon, E. 2005. Some Considerations for Orchid Conservation in Mexico. Orchid Conservation News. 6: 11-13. Alonso, A. F. 2002. El cultivo de la patata. Segunda edición. Editores Mundi Prensa, Madrid. pp. 17-36. Arditti, J. 1977. Clonal propagation of orchids by means of tissue culture- a manual. pp. 204-293. In: Arditti, J. (ed.). Orchid Biology: Reviews and perspectives I. Cornell University Press. Ithaca and London. Arditti, J. 1992. Fundamentals of Orchid Biology. John Wiley & Sons, Inc. U.S.A. 691 p. Arditti, J. y Ernst, R. 1993. Micropropagation of orchids. Wiley Interscience. New York. 682 p. Arguijo, T. J. C., Hernández, H. F. G., Huerta, A. C. R. y Ruíz, T. J. 1993. Estudio florístico de las orquídeas de la región de Córdoba, Ver. Tesis de Licenciatura (Biología). Universidad Veracruzana. México. 66 p. Ávila-Díaz, I. y K. Oyama. 2002. Manejo sustentable de Laelia speciosa (Orchidaceae). Biodiversitas. 7 (43):9-12. Ávila-Díaz, I. y Salgado-Garciglia, R. 2006. Propagación y mantenimiento in vitro de orquídeas mexicanas, para colaborar en su conservación. Biológicas 8: 138-149. Baltazar, G. R. J. 2004. Micropropagación de Oncidium tigrinum Llave y Lex. (Orchidaceae) a partir de protocormos. Tesis de licenciatura (Biología). Universidad Veracruzana. México 123 p. Barba, Á. A. 1987. Reguladores del crecimiento vegetal. En Hurtado, M. D. V. y Merino, M. M. E. (eds.), Cultivo de Tejidos Vegetales. Editorial Trillas. México. pp. 48-66. Bennet, A. F. 2004. Enlazando el paisaje: el papel de los corredores y la conectividad en la conservación de la vida silvestre. UICN-Unión Mundial para la Naturaleza. San José, Costa Rica. 278 p. Beyl, C. A. 2005. Getting started with tissue culture: media preparation, sterile technique, and laboratory equipment. En Trigiano, R. N. y Gray, D. J (editores). 2005. Plant development and Biotechnology. CRC Press. Florida. pp. 19-37. Brian, W. 1990. Genetic Preservation In Vitro. Pp. 13-22. En (Nijkamp, J., Van der Plas, H. y Van Aartrijk (eds.)), Progress in Plant Cellular and Molecular Biology. Kluwer Academic Publisher, Holanda. Bonga, J. M. y von Aderkas, P. 1992. In vitro culture of trees. Kluwer Academic Publishers, Netherlands. 236 p. Brown, L. H. 1981. The conservation of forest islands in areas of high human density. African Journal Ecology 19:27-32. Bueno, M. A.; Gomez, A. y Manzanera, J. 2003. Propagation and DNA markers characterization of Populus tremula L. and Populus alba L. En: Mohan-Jain, S. and Ishii, K. (eds.) Micropropagation of woody trees and fruits. pp. 37-74 84 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba Caponetti, J. D.; Gray, D. J. y Trigiano, R. N. 2005. History of Plant Tissue and Cell Culture. En Trigiano, R. N. y Gray, D. J (editores). 2005. Plant development and Biotechnology. CRC Press. Florida. pp. 9-15. Centro de Estudios Agropecuarios. 2001. Cultivo de la papa. Grupo Editorial Iberoamérica. 81 p. Comité Técnico de Normalización Nacional de Productos Agrícolas y Pecuarios (CTNNPAP). 2007. PROYNMX-FF-109-SCFI-2007. Humus de lombriz (Lombricomposta)-Especificaciones y métodos de prueba. Challenger, A. 1998. Utilización y conservación de los ecosistemas terrestres de México. Pasado, presente y futuro. Comisión Nacional para el Conocimiento y Uso de la Biodiversidad. México. 847 p. Chapin III, F. S.; E. S. Zavaleta; V. T.Eviner; R. L. Naylor; P. M. Vitousek; H. L. Reynolds; D. U. Hooper; S. Lavorel; O. E. Sala; S. E. Hobbie; M. C. Mack & S. Díaz. 2000. Consequences of changing biodiversity. Nature 405:234-242. Chawla, H. S. 2004. Introduction to Plant Biotechnology. Second Edition. Science Publishers, Inc., Enfield, NH, USA. India. 538 p. Chen, F. C. y Chen, T. C. 1998. Effect of salt strength and organic additives on the in vitro growth of protocorm-like bodies and plantlets of Oncidium grower Ramsey. J. Chinese Soc. Hort. Sci. 44:403– 412. Chen, J. T.; Chang, C. y Chang, W. C. 1999. Direct somatic embryogenesis on leaf explants of Oncidium Gower Ramsey and subsequent plant regeneration. Plant Cell Reports 19:143–149. Chung, H. H.; Chen, J. T. y Chang, W. C. 2005. Cytokinins induce direct somatic embryogenesis of Dendrobium chiengmai pink and subsequent plant regeneration. In Vitro Cell. Dev. Biol.—Plant 41:765–769. Clemente, M. M. 1999. In Vitro Culture (IVC) and Plant Conservation. pp. 77-86. En: Bowes, B. G. A color atlas of plant propagation and conservation. The New York Botanical Garden Press. Conabio. 1998. La diversidad biológica de México: Estudio de País. Comisión Nacional para el Conocimiento y Uso de la Biodiversidad. México. 341 p. Conabio. 2000. Estrategia Nacional sobre Biodiversidad de México. pp. 14, 15. Díaz, T. M. H. 2005. Las orquídeas (Orchidaceae) del municipio de Emiliano Zapata, Veracruz, México. Tesis de Licenciatura (Biología). Universidad Veracruzana. México. p. 126. Deberg, P. C. y Read, P. E. 1993. Micropropagation. En: Debergh, P. C. and Zimmerman, R. H. Micropropagation, technology and application. Micropropagation. Kluwer Academic Publishers, The Netherlands.pp. 1-13. Dixon, K.; Kell, S.; Borret, R. y Cribb, P. 2003. Orchid conservation. Natural History publications (Borneo). Kota Kinabalu, Sabah, Malaysia. 418 p. Domínguez, V. A. 1997. Tratado de fertilización. Tercera edición. Ediciones Mundi-Prensa. Madrid, España. 613 p. 85 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba Dressler, R.L. 1993. Phylogeny and classification of the Orchid family. Dioscorides Press. Hong Kong. 314 p. Engelmann, F. 1991. In vitro conservation of tropical germplasm- a review. Euphytica 57: 227-243. Engelmann, F. 2004. Plant cryopreservation: progress and prospects. In Vitro Cell. Dev. Biol. —Plant 40:427–433. Egertsdotter, U. 1999. Somatic embryogenesis in Picea suspension cultures. En: Hall, R. D. (ed.). Plant cell culture protocols. Humana Press. USA. pp. 51-60. Enríquez, V. J. R.; Carrillo, C. G.; Sánchez, G. P.; Rodríguez, M. M. N. y Mendoza, C. M. C. 2000. Fertilización para la óptima adaptación y vigor de plántulas de tomate (Lycopersicon esculentum Mill.) obtenidos in vitro. Revista Fitotecnia Mexicana. 23:59-67. Enríquez, V. J. R.; Velásquez, T. B.; Vallejo, F. A. R. y Velasco, V. V. A. 2005. Nutrición de plantas de Dendranthema grandiflora obtenidas in vitro durante su aclimatación en invernadero. Revista Fitotecnia Mexicana. 28 (4): 377-383. Espejo, S. A.; García, C. J.; López, F. A.; Jiménez, M. R. y Sánchez, S. L. 2002. Orquídeas del Estado de Morelos. Orq. (Méx.) Vol. 16. Número único, 332 p. Espejo, S. A. y López, F. A. 1998. Las Monocotiledóneas Mexicanas una Sinopsis Florística 1. Lista de Referencia Parte VII. Orchidaceae I. Consejo Nacional de la Flora de México, A. C. Universidad Autónoma Metropolitana-Iztapalapa. Comisión Nacional para el conocimiento y Uso de la Biodiversidad. México. 90 p. Espejo, S. A.; López-Ferrari, A. R.; Jiménez, M. R. y Sánchez, S. L. 2005. Las orquídeas de los cafetales en México: una opción para el uso sostenible de ecosistemas tropicales. Rev. Biol. Trop. 53:73-84. Espinosa-Moreno, J. A.; Gaytán-Acuña, E. A.; Becerril-Román, A. E.; Jaen-Contreras, D. y Trejo-López, C. 2000. Fertilización química y biológica de Phalaenopsis (Orchidaceae) en condiciones de invernadero. Terra 18:125-131. Fehér, A.; Pasternak, T. P. y Dudits, D. 2003. Transition of somatic plant cells to an embryogenic state. Plant Cell, Tisue and Organ Culture. 74:201-228. Ferreira, W. M.; Barbante, K. G. y Pimentel, C. P. 2006. Micropropagation and genetic stability of a Dendrobium hybrid (Orchidaceae). In Vitro Cell. Dev. Biol.—Plant 42:568–571. Figueroa, B, C.; Gil, V, I.; San-Pedro, E. V. y Navarro, L. E. R. 2005. Algunos aspectos del crecimiento in vitro de Laelia anceps Lindl. VII Congreso Nacional Agronómico, Universidad Autónoma de Chapingo. Finck, A. 1988. Fertilizantes y fertilización. Fundamentos y métodos para la fertilización de los cultivos. Editorial Reverté. España. 439 p. Flores, O. y Gerez, P. 1994. Biodiversidad y conservación en México: Vertebrados, Vegetación y Uso del Suelo. CONABIO, UNAM. México 439 p. 86 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba Flores-Palacios, A. y M. Martínez. 1993. Guía de la excursión botánica al cerro de Chavarrillo, Veracruz. Programa y Resúmenes de Exporquídea. V Encuentro Latinoamericano de Orquídeología. Asociación Mexicana de Orquideología, A. C. Xalapa, Ver., México. pp. 45 y 46. Flores-Palacios, A. 1995. Biología reproductiva de Rhyncholaelia glauca (Lindl.) Schltr. (Orchidaceae: Laeliinae) en un encinar del centro de Veracruz. Tesis de licenciatura (Biología). Universidad Veracruzana. 50 p. Flores-Palacios, A. y J. G. García-Franco. 2004. Habitat isolation changes the beta diversity of the vascular epiphyte community in lower montane forest, Veracruz, Mexico. Biodivers Conserv. 17:191–207. Flores-Palacios, A. y García-Franco, J. G. 2004. Effect of isolation on the structure and nutrient content of oak epiphyte communities. Plant Ecology 173:259–269. Flores-Palacios, A. and Valencia-Díaz. 2007. Local illegal trade reveals unknown diversity and involves a high species richness of wild vascular epiphytes. Biological Conservation 136:372-387. Freuler, M. J. 2007. Orquídeas. 1a ed. 1a reimp. Albatros. Buenos Aires. 112 p. Gaba, V. P. 2005. Plant growth regulators in plant tissue culture and development. En Trigiano, R. N. y Gray, D. J (eds.). Plant development and Biotechnology. CRC Press. Florida. pp. 87-99. Gamborg, O. L. y Phillips, G. C. 1995. Media preparation and handling. En: Gamborg, O. L. and Phillips, G. C. (eds.). Plant cell, tissue and organ culture: fundamental methods. Springer-Verlag. Germany. pp. 21-34. García-Franco, J. G. y Toledo, A. T. 2008. Epífitas vasculares: bromelias y orquídeas. Manson, R. H.; Hernández, H. J.; Hernández, S. O. y Mata, R. M. 2001. Regeneración de plántulas a partir del cultivo in vitro de mitades de protocormos de Laelia anceps Lindl. y Catasetum integerrimum Hook. Amaranto 14(1): 3-12. Hernández-Ortíz, V.; Gallina, S. y Mehltreter, K. (editores). En Agroecosistemas cafetaleros de Veracruz: biodiversidad, manejo y conservación, pp. 69-82. Instituto de Ecología A. C. (INECOL) e Instituto Nacional de Ecología (INE-SEMARNAT), México, 348 p. Geetha, S. y Sudheer, A. S. 2000. In vitro propagation of Vanilla planifolia, a tropical orchid. Current Science, vol. 79 (6):886-889. George, E. y Sherrington. 1984. Plant propagation by tissue culture. Handbook and directory of commercial laboratories. Exegetics Ltd. Eversley, Basingstoke, England. 709 p. Gutiérrez, M. F. A.; Domínguez, E. A.; Abud, A. M.; Ayora, T. T. del R. y Dendooven, L. 2008. Optimization of Renealmia mexicana (Klotzsch ex. Petersen) cultivation in vitro. In Vitro Cell.Dev.Biol. —Plant 44:33–39. Halbinger, F. y Soto-Arenas, M. 1997. Laelias of Mexico. Orquídea (Méx.). 15(1):37, 38, 40, 41, 50 y 61. Halffter, G. y Ezcurra, E. 1992. ¿Qué es la biodiversidad? En Halffter, G. (Comp.) La diversidad biológica de Iberoamérica I. Acta Zoológica Mexicana. Volumen Especial. México. pp. 4 87 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba Hágsater, E. y Soto-Arenas, M. A. 1998. Orchid conservation in Mexico. Selbyana 19(1): 15-19. Hágsater, E., Soto, M., Salazar, G., Jiménez, R., López, M. y Dressler, L. 2005. Las Orquídeas de México. Instituto Chinoín. México. 304 p. Hernández, H. J.; Hernández, S. O. y Mata, R. M. 2001. Regeneración de plántulas a partir del cultivo in vitro de mitades de protocormos de Laelia anceps Lindl. y Catasetum intergerrimum Hook. Amaranto. 14(1):3-12. Hernández-Valencia, I. & D. López-Hernández. 2002. Pérdida de nutrimentos por la quema de la vegetación en una sabana de Trachypogon. Rev. Biol. Trop. 50:1013-1019. Hicks, A. J. 2004. Asymbiotic techniques of orchid seed germination. The Orchid Seedbank Project. U.S.A. p. 134. Holub, J.; Hanuš, J.; Hanke, D. E. y Strnad, M. 1998. Biological activity of cytokinins derived from Orthoand Meta-Hydroxybenzyladenine. Plant Growth Regulation 26: 109–115. Hopkins, W. G. y Hüner, N. P. A. 2004. Introduction to Plant Physiology. Third edition. John Wiley & Sons. USA. 560 p. Houghton, R. A. 1994. The worldwide extent of land-use change. Bioscience 44:305-13. Huetteman, C. A. y Preece, J. E. 1993. Thidiazuron: a potent cytokikin for woody plant tissue culture. Plant Cell Tissue Organ Cult. 33:105-119. IBPGR. 1986. Design, Planing and Operation of in vitro gene banks. Rome ICBP. 1992. Putting biodiversity on the map; priority areas for global conservation. Cambridge, U. K.: International Council for Bird Preservation. 90 p. Iriondo, A. J. M. 2001. Conservación de germoplasma de especies raras y amenazadas (Revisión). www.inia.es/gcontrec/pub/germoplasma_1161158274546.pdf Ishikawa, K.; Harata, K.; Mill, M.; Sakai, A.; Yoshimatsu, K. y Shimomura, K. 1997. Cryopreservation of zygotic embryos of a Japanese terrestrial orchid (Bletilla striata) by vitrification. Plant Cell Reports 16:754-757. Islam, M. O.; Matsui, S. y Ichihashi, S. 1999. Effects of light quality on seed germination and seeling growth of Cattleya orchids in vitro. J. Japan. Soc. Hort. Sci. 68:1132-1138. Janarthanam, B. y Seshadri, S. 2008. Plantlet regeneration from leaf derived callus of Vanilla planifolia Andr. In Vitro Cell. Dev. Biol. —Plant. 44:84–89. Jeffries, M. 1997. Biodiversity and conservation. Routledge. Londres, Inglaterra. pp 4-6. Ježek, Z. 2005. La enciclopedia de las orquídeas. Editorial Libsa. Madrid. 304 p. Kane, M. E. 2005. Shoot culture procedures. En: Trigiano, R. N. y Gray, D. J. (editors). 2005. Plant development and Biotechnology. CRC Press. Florida. pp. 145-157. 88 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba Kane, M. E.; Kauth, P. y Stewart, S. 2008. Micropropagation. En: Beyl, C. A. y Trigiano, R. N. (editores). 2008. Plant Propagation Concepts and Laboratory Exercises. CRC Press Taylor & Francis Group, LLC. USA. 462 p. Kartha, K. K.; Mroginski; Pahl, L. A. y Leung, N. L. 1981. Germplasm preservation of coffee (Coffea arabica L.) by in vitro shoot culture of apical meristems. Plant Science Letters 22:301-307. Ket, N. V.; Hahn, E. J.; Park, S. Y.; Chakrabarty, D. y Paek, K. Y. 2004. Micropropagation of an endangered orchid Anoectochilus formosanus. Biologia Plantarum 48 (3): 339-343. Landa, C. M. T. 1992. Inventario de las orquídeas registradas para el estado de Veracruz. Tesis de Licenciatura (Biología). Universidad Veracruzana. México. 174 p. Le, B.; Phuong, N. T. H.; Hong, L. T. A. y Van, K. T. T. 1997. High frequency shoot regeneration from Rhynchostylis gigantea (Orchidaceae) using thin cell layers. Plant Growth Regul. 28:179–185. Lee, E. H. E.; Laguna, C. A.; Murguía, G. J.; Elorza, M. P.; Iglesias, A. L.; García, R. B.; Barredo, P. F. A. y Santana, B. N. 2007. Regeneración in vitro de Laelia anceps ssp. dawsonii. Revista UDO Agrícola 7 (1): 58-67. Li, S.; Kuoh, C.; Chen, Y.; Chen, H. y Chen W. 2005. Osmotic sucrose enhancement of single-cell embryogenesis and transformation efficiency in Oncidium. Plant Cell, Tissue and Organ Culture. 81:183–192. Lindley, J. 1829. Edwards's botanical register. James Ridgway and sons, Piccadilly. London. (www.botanicus.org/page/239977). Lo, S. F.; Nalawade, S. M.; Kuo, C. L.; Chen, C. L. y Tsay, H. S. 2004. Asymbiotic germination of immature seeds, plantlet development and ex vitro establishment of plants of Dendrobium tosaense Makino a medicinally important orchid. In Vitro Cell. Dev. Biol.—Plant 40:528–535. Lozoya, S. H. 1985. Micropropagación de especies herbáceas. En: Robert, M. y Loyola, (compiladores). El cultivo de tejidos vegetales en México. Primera edición. CICY, CONACYT. pp. 65-79. Lu, I. L. y Lee, N. 1990. In vitro germination of Cybidium dayanum J. Chinese. Soc. Hort. Sci: 3:198-209. Lunney, D. 1991. The future of Australia´s forest fauna. Pp. 1-24 in Conservation of Australia´s Forest Fauna. (Ed. D. Lunney). (Royal Zoological Society of New South Wales: Sydney). Magaña, P. y Villaseñor, J. L. 2002. La flora de México. ¿Se podrá conocer totalmente? Ciencias 66:24-26. Malabadi, R. V., G. S. Mulgund y K. Nataraja. 2004. Efficient regeneration of Vanda coerulea, an endangered orchid using thidiazuron. Plant Cell, Tissue and Organ Culture 76: 289-293. Manson, R. H.; Hernández-Ortíz, V.; Gallina, S. y Mehltreter, K. (editores). 2008. Agroecosistemas cafetaleros de Veracruz: biodiversidad, manejo y conservación. Instituto de Ecología A. C. (INECOL) e Instituto de Ecología (INE-SEMARNAT), México, 348 p. Martin, K.P. y Madassery, J. 2005. Direct and indirect somatic embryogenesis on cotyledon explants of Quassia amara L., an antileukaemia drug plant. In Vitro Cell. Dev. —Biol 41: 54–57. 89 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba Martínez-Ruiz, R.; Azpíroz-Rivero, H. S.; Rodríguez-De la O, J. L.; Cetina-Alcalá, V. M. y Gutiérrez-Espinosa, M. A. 2005. Aclimatación de plantas obtenidas in vitro de Eucalyptus urophylla S. T. Blake y Eucalyptus grandis Hill ex Maiden. Ra Ximhai 1:591-597. Maruyama, E.; Kinoshita, I.; Ishii, K. y Ohba, K. 1997. Germplasm conservation of the tropical forest trees, Cedrela odorata L., Guazuma crinita Mart., and Jacaranda mimosaefolia D. Don., by shoot tip encapsulation in calcium-alginate and storage at 12-25°C. Plant Cell Reports. 16:393-396. Mata-Rosas. M. 1992. Efecto de la mezcla de crioprotectores (DMSO-GLICEROL) sobre ápices con placa basal de Allium sativum in vitro, congelados a -196°C. Tesis de licenciatura (Biología). Facultad de ciencias, Nacional Autónoma de México. 102 p. Mata-Rosas. M. 2000. Morfogénesis en Picea chihuahuana Martínez a partir del cultivo de tejidos de estructuras inmaduras. Tesis de Doctorado (Ciencias). División de Estudios de Posgrado de la Facultad de Ciencias. UNAM, México, D. F. 123 p. Mata-Rosas. M.; Chávez, A. V. M. y Bye, R. 2001a. In vitro regeneration of plantlets from immadure zygotic embryos of Picea chihuahuana Martínez, an endemic Mexican endangered species. In Vitro Cell. Dev. Biol. —Plant. 37:73-78. Mata-Rosas, M.; Monroy, R. M. A.; Moebius, G. K. and Chávez, A. V. M. 2001b. Micropropagation of Turbinicarpus laui Glass et Foster, an endemic and endangered species. In Vitro Cell. Dev. Biol. — Plant. 37:400-404. Mata-Rosas, M.; Jiménez-Rodríguez, A y Chávez-Avila, V. M. 2006. Somatic embryogenesis and organogenesis in Magnolia dealbata Zucc. (Magnoliaceae), an endangered, endemic Mexican species. HortScience 41(5):1325-1329. Mauri, P. V. y Manzanera, J. A. 2004. Effect of abscisic acid and stratification on somatic embryo Maturation and germination of holm oak (Quercus ilex L.). In Vitro Cell. Dev. Biol.—Plant 40:495– 498. Miranda, T. L. 1992. Análisis preliminar para bancos activos de germoplasma de Allium sativum L. in vitro. Tesis de maestría (Ciencias). División de Estudios de Posgrado de la Facultad de Ciencias. UNAM, México, D. F. 142 p. Mitchell, R. 1989. Growing Hardy orchids from seeds at Kew. In the Plantsman. Vol II, part 3. pp. 152-169. Mittermeier, R. y Goettsch, C. 1992. La importancia de la diversidad biológica de México, pp. 57-62 en: México ante los retos de la biodiversidad. Conabio, México. Mittermeier, R. C.; Goettsch, C. y Robles, G. P. 1997. Megadiversidad. Los países biológicamente más ricos del Mundo. Cemex. México. Moebius-Goldammer, K. G.; Mata-Rosas, M. and Chávez-Ávila, V. 2003. Organogenesis and somatic embryogenesis in Ariocarpus kotschoubeyanus (Lem.) K. Schum. (Cactaceae) an endemic and endangered mexican species. In Vitro Cell. Dev. Biol. –Plant. 39:388-393. 90 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba Molassiotis, A. N.; Sotiropoulos, T.; Tanou, G.; Kofidis, G.; Diamantidis, G. y Therios, I. 2006. Antioxidant and anatomical responses in shoot culture of the apple rootstock MM 106 treated with NaCl, KCl, mannitol or sorbitol. Biologia Plantarum 50 (1): 61-68. Morales-Linares, J; Castañeda-Zárate, M. y Ramos-Castro, S. E. 2008. Una muestra de las orquídeas de Veracruz. Catálogo Digital. Disco interactivo multimedia, Windows. ACoOS, IMJ. México. Morel, G. M. 1974. Clonal multiplication of orchids. En: Withner, C. L. (ed.) The orchids. Scientific Studies. Wiley-Interscience. USA. 604 p. Moreno, M. D. 2007. Germinación y desarrollo in vitro de Acineta barkeri (Batem.) Lindl. (Orchidaceae) una especie amenazada de México. Tesis de licenciatura (Biología). Universidad Veracruzana. México. 88 p. Morrone, J.; Espinosa, D.; Fortino, A. D. y Posadas, P. 1999. El arca de la biodiversidad. UNAM. México. 87 p. Msikita, W.; Skirvin, R. M. y Chen, S. Y. 1997. Micropropagation of Brassica oleracea (cole crops). En: Bajaj, Y. P. S. (ed.) Biotechnology in Agriculture and Forestry. High-Tech and Micropropagation V. Springer-Verlag Berlin Heidelberg. Germany. pp. 30-47. Murguía, G. J. y Lee, E. H. E. 2007. Manual de Producción de Orquídea. Dirección General. Universidad Veracruzana. Xalapa, Veracruz, México. 75 p. Murashige, T. y Skoog, F. 1962. A revised mediun for rapid growth and bioassays with tobacco tissue culture. Physiologia Plantarum 15:473-497. Murthy, H. N. 2005. In vitro multiplication and ecorehabilitation of rare orchid Aerides crispum. The role of biotechnology. Villa Gualino, Turin, Italy. pp. 191 y 192. Nahuat, S. 2001. Embriogénesis somatic en tres especies de orquídeas: Cattleyopsis lindenii, Myrmecophila tibicinis y Laelia rubescens. Tesis de doctorado. Instituto Tecnológico de Mérida. México Nayak, N. R.; Patnaik, S. y Rath, S. P. 1997a. Direct shoot regeneration from foliar explants of an epiphytic orchid, Acampe praemorsa (Roxb.) Blatter and McCann. Plant Cell Reports. 16:583-586. Nayak, N. R.; Rath, S. P. y Patnaik, S. 1997b. In vitro propagation of three epiphytic orchids. Cymbidium aloifolium (L.) Sw., Dendrobium aphyllum (Roxb.) Fisch. and Dendrobium moschatum (Buch-Ham) Sw. through thidiazuron-induced high frequency shoot proliferation. Sci. Hort. 71:243–250. Neeta, D., George, L. y Eapen, S. 2002. Micropropagation plants of turmeric. Plant Cell, Tisue and Organ Culture 68:143-151. Noodén, L. D. 2004. Plant Cell Death Processes. Elsevier Science. USA. 392 p. Núñez, I., González, G. E. y Barahona, A. 2003. La biodiversidad: historia y contexto de un concepto. Interciencia. 28:387-393. Núñez, E. R. 2008. Correción de deficiencias nutrimentales en el suelo. En Alcántar, G. G. y Trejo-Téllez, L. I. (coord.). Nutrición de cultivos. Segunda reimpresión. Editorial Mundi-Prensa, México. pp. 273-323. 91 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba Olmos, S.; Luciani, G. y Galdeano, E. 2004. Micropropagación. En Echenique, V.; Rubistein, C. y Mroginski, L. (eds.), Biotecnología y mejoramiento vegetal. Instituto Nacional de Tecnología Agropecuaria. Consejo Argentino para la Información y el Desarrollo de la Biotecnología. Buenos Aires. pp. 163172. Osorio-Rosales, M. L. y Mata-Rosas, M. 2005. Micropropagation of ponytail palms (Beaucarnea gracilis Lem. and B. recurvata Lem.), endemic and endangered Mexican species. HortScience 40 (5):14811484. Ospina M. 1996. Orchidology and Biotechnology. Orchids. October. 1072-1074. Paul, H.; Daigny, G. y Sangwan-Norreel, B. S. 2000. Cryopreservation of apple (Malus x domestica Borkh.) shoot tips following encapsulation-dehydration or encapsulation-vitrification. Plant Cell Reports. 19:768-774. Pedroza-Manrique, J. y Mican-Gutiérrez Y. 2006. Asymbiotic germination of Odontoglossum gloriosum Rchb.f. (Orchidaceae) under in vitro conditions. In Vitro Cell. Dev. Biol.—Plant 42:543–547. Pierik, R. L. M. 1990. Cultivo in vitro de las plantas superiores. Ediciones Mundi-Prensa, Madrid. 326 p. Pillon, Y. y Chase, W. W. 2007. Taxonomic exaggeration and its effects on orchid conservation. Conservation Biology. 21(1): 263–265. Portillo, L., F.; Santacruz-Ruvalcaba, A. Gutiérrez-Mora y B. Rodríguez-Garay. 2007. Somatic embryogeneses in Agave tequilana Weber. In Vitro Cell. Dev. Biol.—Plant 43:569–575. Pospíšilová, J.; Tichá, I.; Kadleček, P.; Haisel, D.; Plzáková, Š. 1999. Acclimatization of micropropagated plants to ex vitro conditions. Biol. Plant. 42:481–497. Pimienta-Barrios, B. E.; Muñoz, U. A.; Ramírez, H. B. C. y Méndez, M. L. 2006. Desarrollo vegetal. Universidad de Guadalajara. México. 331 p. Ramírez-Malagon, R.; Aguilar-Ramírez, I.; Borodanenko, A.; Pérez-Moreno, L.; Barrera-Guerra, J. L.; NúñezPalenius, H. G. y Ochoa-Alejo, N. 2007. In vitro propagation of ten threatened species of Mammillaria (Cactaceae). In Vitro Cell. Dev. Biol.—Plant 43:660–665. Reis, E.; Batista, M. T. y Canhoto, J. M. 2008. Effect and analysis of phenolic compounds during somatic embryogenesis induction in Feijoa sellowiana Berg. Protoplasma 232: 193–202. Retes-Pruneda, J. L.; Valadez-Aguilar, M. L.; Pérez-Reyes, M. E. y Pérez-Molphe-Balch. 2007. Propagación in vitro de especies de Echinocereus, Escontria, Mammillaria, Melocactus y Polaskia (Cactaceae). Bol. Soc. Bot. Mex. 81:9-16. Rivera, C. G. 1999. Conceptos Introducción a la fitopatología. Editorial Universidad Estatal a Distancia. San José, Costa Rica. 308 p. Roca, W. M. y Mroginski, L. A. 1991. Cultivo de tejidos vegetales en la agricultura. Fundamentos y aplicaciones. CIAT. Colombia. 953 p. 92 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba Rodríguez, A. C.; Vázquez, G. M. M.; Reines, A. M. y Sierra, P. A. 1998. Lombrices de tierra con valor comercial. Biología y técnicas de cultivo. Universidad de Quintana Roo. México. 61 p. Rodríguez, M. M. N.; Trejo-Téllez, L. I. y Alcántar, G. G. 2008. Acceso, absorción y transporte nutrimental. En Alcántar, G. G. y Trejo-Téllez, L. I. (coord.). Nutrición de cultivos. Segunda reimpresión. Editorial Mundi-Prensa, México. pp. 159-199. Roy, J.; Naha, S.; Majumdar, M. y Banerjee, N. 2007. Direct and callus-mediated protocorm-like body induction from shoot-tips of Dendrobium chrysotoxum Lindl. (Orchidaceae). Plant Cell Tiss Organ Cult 90:31–39. Rublúo, A. 1985. Estrategias para la preservación del germoplasma vegetal in vitro. En: Robert, M. L. y Loyola, V. M. (compiladores). El cultivo de tejidos vegetales en México. Primera edición. Centro de Investigación Científica de Yucatán, A. C.(CICY), Consejo Nacional de Ciencia y Tecnología (CONACYT). Rzedowski, J. 1998. Diversidad y orígenes de la flora fanerogámica de México. En Ramamoorthy, T. P., Bye, R., Lot, A. y Fa, J (Eds.). Diversidad biológica de México: orígenes y distribución. UNAM, México. pp. 129-145. SAGARPA. 2007. Sistema Integral in Información Agroalimentaria y Pesquera (SIAP). Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimento (http://www.siap.sagarpa.gob.mx/ar_comanuar.html). Salazar-Casasa, W.; Rivera-Coto, G. y Corrales-Moreira, G. 2007. Comparación de los problemas fitosanitarios en orquídeas de poblaciones silvestres y de cultivo, como evaluación de riesgos de plagas o epidemias. Lankesteriana 7:362-367. Salazar-Chávez, G. A.; Reyes-Santiago, J.; Brachet, C. y J. Pérez-Crisanto. 2006. Orquídeas y otras plantas nativas de la Cañada, Cuicatlán, Oaxaca, México. Universidad Nacional Autónoma de México. México, D.F. 175 p. Salazar, R. V. M. 2003. Micropropagación de Mormodes tuxtlensis Salazar, Cuitlauzina pendula La Llave & Lex. y Lycaste skinneri (Batem. Ex. Lind.) Lind. (Orchidaceae) a partir de protocormos. Tesis de licenciatura (Biología). Benemérita Universidad Autónoma de Puebla. México. 106 p. Salazar, R. V. M. y Mata, R. M. 2003. Micropropagación y conservación de orquídeas mexicanas en el Jardín Botánico Clavijero. Lankesteriana 7:151-153. Sánchez-Morán, M. R. y Pérez-Molphe-Balch, E. 2007. Propagación in vitro de Browningia candelaris (Cactaceae) usando metatopolina. Bol. Soc. Latin. Carib. Cact. Suc. 4(2):16-18. Santos-Hernández, L.; Martínez-García, M.; Campos, J. E. y Aguirre-León, E. 2005. In vitro propagation of Laelia albida (Orchidaceae) for conservation and ornamental purposes in Mexico. Hortscience 40(2):439-442. 93 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba Santos-Hernández, L.; Martínez-García, M.; Campos, J. E. y Aguirre-León, E. 2006. Conservación in situ de la flora mexicana: Laelia albida, en una Reserva de la Biosfera. Ciencia y desarrollo en internet. Sarasan, V.; Cripps, R.; Ramsay, M.; Atherton, C.; Mcmichen, M.; Prendergast, G. y Rowntree, J. K. 2006. Conservation in vitro of threatened plants-Progress in the past decade. In Vitro Cell. Dev. Biol. — Plant 42:206–214. Sauve, R. J.; Mmbaga, M. T. y Zhou S. 2004. In vitro regeneration of the Tenessee coneflower (Echinacea tennesseensis). In Vitro Cell. Dev. Biol.—Plant 40:325–328. Scocchi, A. y Rey, H. 2004. Conservación de germoplasma in vitro. En Echenique, V.; Rubistein, C. y Mroginski, L. (eds.), Biotecnología y mejoramiento vegetal. Instituto Nacional de Tecnología Agropecuaria. Consejo Argentino para la Información y el Desarrollo de la Biotecnología. Buenos Aires. pp. 179-185. SEMARNAT. 2002. Norma Oficial Mexicana NOM-059-ECOL-2001. Protección ambiental-Especies nativas de México de flora y fauna silvestres-Categorías de riesgo y especificaciones para su inclusión, exclusión o cambio-Lista de especies en riesgo. Diario Oficial (6 de marzo 2002). México, D. F. Shatnawi, M. A.; K. A. Johnson y F. Torpy. 2004. In vitro propagation and cryostorage of Syzygium francissi (Myrtaceae) by the encapsulation-dehidration method. In Vitro Cell. Dev. Biol.—Plant 40:403–407. Sheelavantmath, S. S.; Murthy, H. N. Pyati, A. N.; Ashok-Kumar, H. G. y Ravishankar, B. V. 2000. In vitro propagation of the endangered orchid, Geodorum densiflorum (Lam.) Schltr. through rhizome section culture. Plant Cell, Tissue and Organ Culture 60: 151–154. Shiau, Y. J.; Sagare, A. P.; Chen, U. C.; Yang, S. R. y Tsay, H. S. 2002. Conservation of Anoectochilus formosanus Hayata by artificial crosspollination and in vitro culture of seeds. Bot. Bull. Acad. Sin. 43:123–130. Sinha, R. K. 2004. Modern plant physiology. Alpha Science International. India. 620 p. Smith, R. H. 2000. Plant tissue culture, techniques and experiments. Second edition. Academis Press. U. S. A. pp. 44-54. Sosa-Ortega, V. y Gómez-Pompa, A. 1994. Lista Florística. Flora de Veracruz. No 82. Instituto de Ecología, A.C. Xalapa. 245 p. Sosa, V. y Platas, T. 1998. Extinction and persistence of rare orchids in Veracruz, México. Conservation Biology. 12 (2): 451-455. Soto-Arenas, M. A., 1988. Updated list of the orchids of Mexico. Orquídea (Méx.) 11:273-276. Soto-Arenas, M. A. 1993. Clasificación infraespecífica de Laelia anceps. Orquídea (Méx.) 13 (1-2). México. pp 125-133. Soto-Arenas, M. A. y Salazar, G. A. 2004. Orquídeas. En A. J. García-Mendoza, M. de J. Ordóñez y M. Briones Salas (eds.), Biodiversidad de Oaxaca. Instituto de Biología, Universidad Nacional Autónoma 94 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba de México, Fondo Oaxaqueño para la Conservación de la Naturaleza, World Wildlife Fund, México. pp. 271-295. Soto-Arenas, M. A.; Hágsater, E.; Jiménez-Machorro, R.; Salazar-Chávez G.; Solano-Gómez R.; FloresGonzález, R. y Ruíz-Contreras, I. 2007a. Las Orquídeas de México. Catálogo digital. Disco Interactivo Multimedia, Win-Mac. Herbario AMO. Instituto Chinoín, A. C., México. Soto-Arenas, M. A.; Solano, G. R. and Hágsater, E. 2007b. Risk of extinction and patterns of diversity loss in mexican orchids. Lankesteriana 7 (1-2): 114-121. IUCN/SSC Orchid Specialist Group. 1996. Orchids-Status Survey and Conservation Action Plan. IUCN, Gland Switzerland and Cambridge, UK. pp 53-58. Stern, M.; Quesada, M. y Stoner, K. E. 2002. Changes in Composition and Structure of a Tropical Dry Forest Following Intermittent Cattle Grazing. Rev. Biol. Trop. 50:1021-1034. Stewart, S. L. y Kane, M. E. 2006. Asymbiotic seed germination and in vitro seedling development of Habenaria macroceratitis (Orchidaceae), a rare Florida terrestrial orchid. Plant Cell Tiss Organ Cult. 86:147–158. Strnad, M. 1997. The aromatic cytokinins. Physiol. Plant 101: 674-688. Suárez-Quijada, I. 2006. Regeneración in vitro de Euchile mariae (Ames) Withner, (Orchidaceae), especie endémica de México. Tesis de licenciatura (Biología). Universidad Nacional Autónoma de México. México. 143 p. Taiz, L. y Zeiger, E. 1998. Plant Physiology. Second edition. Sinaver Associates, Inc., U. S. A. 792 p. Tal, M. 1983. Selection for stress tolerance. In: Handbook of plant cell culture, Vol. I. Techniques for propagaction and breeding. (Ed.) Evans, D. A.; Sharp, W. R.; Ammirato, P. V. and Yamada, Y. Mac Millan Publishing Company. New York. pp. 461-488. Taylor, D. L.; Bruns, T. D.; Szaro, T. M. y Hodges, S. A. 2003. Divergence in mycorrhizal specialization within Hexalectris spicata (Orchidaceae), a nonphotosynthetic desert orchid. American Journal of Botany 90 (8):1168-1179. Teixeira, J. A.; Singh, N. y Tanaka, M. 2006. Priming biotic factors for optimal protocorm-like body and callus induction in hybrid Cymbidium (Orchidaceae), and assessment of cytogenetic stability in regenerated plantlets. Plant Cell, Tissue and Organ Culture 84: 135–144. Thakur, R. C. y Karnosky, D. F. 2007. Micropropagation and germplasm conservation of Central Park Splendor Chinese elm (Ulmus parvifolia Jacq. ‘A/Ross Central Park’) trees. Plant Cell Rep. 26:1171– 1177. Thomas, T. D. y Philip, B. 2005. Thidiazuron-induced high-frequency shoot organogenesis from leafderived callus of a medicinal climber, Tylophora indica (Burm. F.) Merrill. In Vitro Cell. Dev. Biol. — Plant.-41:124-128. 95 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba Thompson, D. I. y Edwards, T. J. 2006. Evaluating asymbiotic seed culture methods and establishing Disa (Orchidaceae) germinability in vitro: relationships, requirements and first-time reports. Plant Growth Regul 49:269–284. Thorpe, T. A.; Harry, I. S. y Kumar, P. P. 1991. Application of micropropagation to forestry. En Micropropagation. Debergh PC y Zimmerman RH eds, Kluwer Academic Publishers, Dordrecht, The Netherlands: 311-336. Tinoco-Juárez. M. S. 2006. Adquisición de competencia para la micropropagación de Stanhopea tigrina, Laelia anceps, Epidendrum veroscriptum y Cattleya x esbetts (Orchidaceae). Tesis de licenciatura (Biología). Universidad Nacional Autónoma de México. México. 127 p. Tognetti, J. y Salerno, G. 2005. Las plantas y el frio. Ciencia Hoy. 28:1-4. Tokuhara, K. y Mii, M. 2003. Highly-efficient somatic embryogenesis from cell suspension cultures of Phalaenopsis orchids by adjusting carbohydrate sources. In Vitro Cell. Dev. Biol.—Plant 39:635–639. Toledo, V. M. 1988. La diversidad biológica de México. Ciencia y Desarrollo. Vol. XIV, Núm. 81: 17-30. Toledo, V. y Ordóñez, M. 1993. The biodiversity scenario of Mexico: a review of terrestrial hábitats. En Ramamoorthy, T. P., Bye, R., Lot, A. y Fa, J (Eds.). Biological diversity of México: origins and distribution. Oxford University Press. Oxford. pp 757-777. Toledo, V. M. 1994. La diversidad biológica de México, nuevos retos para la investigación en los noventas. Ciencias. 34:43-59. Touchell, D. H. and Dixon, K. W. 1999. In vitro preservation. Pp. 108-118. En: Bowes, B. G. A color atlas of plant propagation and conservation. The New York Botanical Garden Press. Towill, E. y Roos, E. 1989. Techniques for preserving of plant germplasm. Pp. 379-403. En: L. Knutson and A. Stoner (eds.), Biotic diversity and germplasm preservation, global imperatives. Trapnell, D. W. y Hamrick, J. L. 2005. Mating patterns and gene flow in the neotropical epiphytic orchid, Laelia rubescens. Molecular Ecology 14: 75-84. Tsukazaki, H.; Mii, M.; Tokuhara, K. y Ishikawa, K. 2000. Cryopreservation of Doritaenopsis suspension culture by vitrification. Plant Cell Reports. 19:1160-1164. Vásquez, V. S. J. 2000. Establecimiento de una metodología para la micropropagación in vitro de la orquídea Laelia anceps Lindl. Tesis de maestría (Ciencias). Universidad Veracruzana. México, 89 p. Vázquez-Torres, M. 2006. Las principales familias de plantas productoras de semillas. Universidad Veracruzana. Xalapa, Ver., México. pp. 576-578. Veilleux, R. E.; Compton, M. E. y Saunders, J. A. 2005. Use of protoplast for plant improvement. En: Trigiano, R. N. y Gray, D. J (editores). 2005. Plant development and Biotechnology. CRC Press. Florida. pp. 213-224. Vij, S. P.; Sood, A. y Plaha, K. K. 1984. Propagation of Rhynchostilis retusa Bl. (Orchidaceae) by direct organogenesis from leaf segments cultures. Bot. Gaz. 145:210-214. 96 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba Villalobos, A. V. 1985. Las bases morfogenéticas en la micropropagación de especies perennes. Robert, M. y Loyola, (Eds.). El cultivo de tejidos vegetales en México. Primera edición. CICY, CONACYT. pp. 5564. Vitousek, P. M.; Mooney, H. A.; Lubchenco, J. y Melillo, J. M. 1997. Human domination of Earth´s ecosystems. Science 277:494-499. Vovides, A. P. 1981. Lista preliminar de plantas mexicanas raras o en peligro de extinción. Biotica 2:219228. Vovides, A. P.; Luna, V. y Medina, G. 1997. Relación de algunas plantas y hongos mexicanos raros, amenazados o en peligro de extinción y sugerencias para su conservación. Acta Botánica Mexicana 39:1-42. Wang, Q.; Mawassi, M.; Sahar, N.; Li, P.; Violeta, C.; Gafny, R.; Sela, I.; Tanne, E. and Perl, A. 2004. Cryopreservation of grapevine (Vitis spp.) embryogenic cellsuspensions by encapsulation– vitrification Plant Cell, Tissue and Organ Culture 77: 267–275.Went, F. 1981. Las Plantas. Colección de la Naturaleza de Time-Life. Segunda edición Impresora Editora Mexicana. México. 159 p. Werbrouck, S. P. O.; Strnad, M.; Van Onckelen, H. A. y Debergh, P. C. 1996. Meta-topolin, an alternative to benzyladenine in tissue culture?- Physiol. Plant 98: 291-297. Williams-Linera, G. y Flores-Palacios, A. 1993. Guía de la excursión botánica al bosque mesófilo de montaña de San Andrés Tlalnehuayocan, Veracruz. Programa y resúmenes de Exporquídea. V Encuetro Latinoamericano de orquideología. Asociación Mexicana de Orquideología, A. C. Xalapa, Ver., México. pp. 47 y 48. Wilson, E. 1993. Biodiversity. Tenth reprinted. Matinal Academy Press. U. S. A. pp. 3-7. Wilson, E. 1997. Introduction. En: Reaka et al. (eds.). Biodiversity II. Joseph Henry Press. Washington DC., EEUU. pp 1-3. Wyse, J. P. S. y Sutherland, L. A. 2000. Agenda Internacional para la conservación en Jardines Botánicos. Organización Internacional para la Conservación en Jardines Botánicos (BGCI). U. K. 92 p. Yan, N.; Hu, H.; Huang, J.; Xu, K.; Wang, H. y Zhou, Z. 2006. Micropropagation of Cypripedium flavum through multiple shoots of seedlings derived from mature seeds. Plant Cell, Tissue and Organ Culture 84: 113–117. Yeoman, M. M. 1986. Plant Cell Culture Technology Botanical Monographs. Vol. 23. Blackwell Scientific Publications. London. 115 p. Zhao, P.; Wang, W.; Feng, F.; Wu, F.; Yang, Z. y Wang, W. 2007. High-frequency shoot regeneration through transverse thin cell layer culture in Dendrobium candidum Wall Ex Lindl. Plant Cell Tiss Organ Cult. 90:131–139. 97 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba 10. APÉNDICE 10.1 Protocolo de propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba 1. Utilizar plántulas de Laelia anceps subsp. anceps f. semialba con una altura de 1-3 cm de altura. 2. Sembrar plántulas de L. anceps subsp. anceps f. semialba en frascos conteniendo 25 ml de medio de cultivo MS (pH 5.0). Colocar los frascos en un cuarto de incubación a 25±1ºC, fotoperiodo de 16 horas luz y 8 de oscuridad y una intensidad luminosa de 50 µMol/m2/s. 3. Para retardar el crecimiento de las plántulas adicionar 60 g/l de manitol. 4. Para acelerar el crecimiento de las plántulas, adicionar 50 g/l de homogeneizado de papa. 5. Para la brotación múltiple adicionar 2.2 µM de TDZ y 2.7 µM de ANA y cultivar durante dos meses (inducción). 6. Subcultivar después del periodo de inducción todos los explantes con sus respectivos brotes en medio MS basal (sin reguladores del crecimiento), para la expresión de las respuestas morfogenéticas y después de 5 meses bajo estas condiciones individualizar los brotes y subcultivarlos en medio MS basal suplementado con 1 g/l de carbón activado . 7. Cuando las plantas cumplan 2 meses de haber sido individualizadas, extraerlas del medio de cultivo y lavarlas con agua corriente procurando no dañar las raíces. 8. Colocar las plántulas en domos de plástico con tapas transparentes, usando tepecil o una mezcla de corteza de pino, carbón vegetal, tepecil (1:1:1), previamente esterilizado. Mantener una humedad relativa alta y disminuirla gradualmente después de 1 mes en condiciones ex vitro. 98 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba 10.2 Componentes del medio MS (Murashige y Skoog, 1962) Medio Murashige y Skoog (1962) Macronutrientes NH4NO3 KNO3 MgSO4⋅7H2O KH2PO4 mg/l 1650 1900 370 170 Calcio CaCl2⋅2H2O 440 Micronutrientes Kl H3BO3 MnSO4⋅H2O ZnSO4⋅7H2O Na2MoO4⋅2H2O CuSO4⋅5H2O CoCl2⋅6H2O 0.83 6.2 22.3 8.6 0.25 0.025 0.025 Fierro Na2EDTA FeSO4⋅7H2O 37.3 27.8 Vitaminas Ácido nicotínico Piridoxina HCl (B6) Tiamina HCl (B1) 0.5 0.5 0.1 Inositol 100 Glicina 2 Carbohidratos Sacarosa 30 g/l Gelificante Agar 8 g/l 99 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba 10.3 Fórmula del fertilizante foliar Nitrofoska empleado para las pruebas de establecimiento ex vitro Nitrofoska® Foliar PS Macronutrientes Nitrógeno Fósforo (P2O5) Potasio (K2O) Magnesio (MgO) % 25 10 17.5 1.57 Micronutrientes Hierro (Fe)* Manganeso (Mn)* Cobre (Cu)* Zinc (Zn)* Boro (B) Molibdeno (Mo) *Quelatizados con EDTA g/kg 0.4 0.3 0.05 0.4 0.15 0.005 100 Propagación y conservación de Laelia anceps Lindl. subsp. anceps f. semialba 10.4 Fórmula de la lombricomposta líquida empleada para las pruebas de establecimiento ex vitro CARACTERÍSTICAS FÍSICAS COLOR CAFÉ VERDOSO DENSIDAD 1.021 g/cc. SÓLIDO EN SUSPENSIÓN 100 g/litro CARACTERÍSTICAS QUÍMICAS DETERMINACIÓN RESULTADOS pH 7.26 MATERIA ORGÁNICA 30.37 ÁCIDOS FÚLVICOS 49.0 ÁCIDO HÚMICO 20.0 CARBONO ORGÁNICO 17.6 NITRÓGENO TOTAL 2.69 FÓSFORO TOTAL 1.79 POTASIO TOTAL 2.27 INDOLES TOTALES 1.20 g/litro C/N 6.61 H/F 0.41 CARACTERÍSTICAS MICROBIOLÓGICAS GRUPO MICROBIANO UFC/mililitro BACTERIAS 4.400,000.00 ACTINOMICETOS 441,000.00 HONGOS FILAMENTOSOS 50,000.00 LEVADURAS 6,000.00 TOTAL DE MICROORGANISMOS 101 4,897,000.00