11-Metabolismo de glúcidos 2 parte
Anuncio

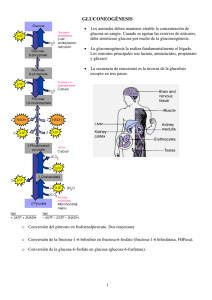
UNLaM-Kinesiología-Bioquímica-Metabolismo de Hidratos de Carbono II Metabolismo de glúcidos 2ª parte UNLaM-Kinesiología-Bioquímica-Metabolismo de Hidratos de Carbono II Principales destinos de la Glucosa en la célula: • Almacenamiento en forma de glucógeno • Obtención de energía: glucólisis • Formación de intermediarios precursores de ácidos nucleicos (ribosa) y NADPH Gluconeogénesis: En el organismo tenemos tejidos que dependen exclusivamente de la glucosa para la producción de energía, como: el cerebro, el sistema nervioso, los eritrocitos, la médula renal y el tejido embrionario; por lo que en momentos de ayuno, donde los niveles de glucosa en sangre son bajos, se requiere la obtención de glucosa a partir de precursores no glucosídicos como aminoácidos, piruvato proveniente de la transaminación de aminoácidos; lactato, glicerol e intermediarios del ciclo de Krebs, esta ruta metabólica se denomina gluconeogénesis. Loa aminoácidos Leucina y Lisina no pueden ser empleados como precursores de la gluconeogénesis ya que en su degradación se produce Acetil-CoA, al igual que en la degradación de los ácidos grasos. El Acetil-CoA no puede emplearse como precursor biosintético de glucosa en animales (si en plantas) dado que no poseen las enzimas para producir oxalacetato a partir del Acetil-CoA. La gluconeogénesis es llevada a cabo en la mitocondria y citosol de las células hepáticas, pancreáticas y de la corteza renal. La estrategia consiste en superar los 3 pasos irreversibles de la glucólisis, el resto de las enzimas y reacciones intervinientes son las mismas y es la diferencia de concentraciones de productos y sustratos lo que desplaza los equilibrios. En primer lugar el piruvato, provenientes de la transaminación de aminoácidos o de la reacción de reducción del lactato, debe formar fosfoenolpiruvato, o sea revertir la reacción de la piruvato quinasa de la glucólisis (Figura 1). Figura 1: formación de fosfoenolpiruvato a partir de piruvato. 1 UNLaM-Kinesiología-Bioquímica-Metabolismo de Hidratos de Carbono II Reacción 1: Producción de oxalacetato a partir de piruvato. Para ello el piruvato debe ingresar en la mitocondria donde por acción de la piruvato carboxilasa se produce oxalacetato (esta es una de las reacciones anapleróticas del ciclo de Krebs). En esta reacción se produce la condensación de piruvato (3 carbonos) con dióxido de carbono, con consumo de ATP, para dar oxalacetato (4 carbonos). Esta enzima requiere biotina como cofactor, el cual actúa como transportador de HCO3- y es regulada positivamente por Acetil-CoA. Reacción2: Producción de malato a partir de oxalacetato Como el oxalacetato no posee transportadores en la membrana mitocondrial se requiere su reducción a malato por acción de la malato deshidrogenasa con oxidación de NADH mitocondrial. La enzima malato deshidrogenasa actúa tanto en el ciclo del ácido cítrico como en la gluconeogénesis, pero en sentidos opuestos. La dirección de la reacción está dada por la concentración de los metabolitos intervinientes. El malato abandona la mitocondria a través de un transportador especifico en la membrana interna, el transportador malato-α-cetoglutarato y en el citosol es oxidado nuevamente a oxalacetato con la producción de NADH citosólico. Reacción 3: Formación del Fosfoenolpiruvato El oxalacetato es convertido en fosfoenolpiruvato por la fosfoenolpiruvato carboxiquinasa con consumo de GTP. En condiciones intracelulares esta es una reacción reversible. Como resumen de esa primera reacción de by-pass tenemos el siguiente balance: Piruvato + ATP + GTP + HCO3- Fosfoenolpiruvato + ADP + GDP + Pi + CO2 ∆Gr0=0.9 kJ/mol Notar que el CO2 agregado al piruvato en la primera reacción es el mismo que se libera en el último paso. Esta reacción de carboxilación es una activación del piruvato, ya que la posterior descarboxilación favorece el pasaje de oxalacetato a fosfoenolpiruvato. Otra cuestión importante a tener en cuenta en este proceso es el NADH consumido en la mitocondria para la reducción del oxalacetato a malato, que luego es restituido en el citosol reduciendo una molécula de NAD+ a NADH. En el citosol los niveles de NADH son aproximadamente 105 veces menores que en mitocondria, por lo que de esta forma se dispone del NADH que posteriormente será empleado en reducción del glicerato 1,3bisfosfato a gliceraldehído 3-fosfato. La gluconeogénesis no puede proceder al menos que haya NADH citosólico disponible. 2 UNLaM-Kinesiología-Bioquímica-Metabolismo de Hidratos de Carbono II Figura 2: Glucolisis Vs Gluconeogénesis La siguiente reacción irreversible de la glucólisis es la fosforilación de fructosa 6fosfato para dar fructosa 1,6-bisfosfato por acción de la fosfofructoquinasa I, con consumo de ATP. La reacción inversa es catalizada por la fructosa 1,6-bisfosfatasa, que cataliza la hidrólisis del grupo fosfato del C1. Sin embargo el grupo fosfato no es transferido a una molécula de ADP, si no que se libera como Pi. La última reacción irreversible que requiere una enzima diferente a las intervinientes en la glucolisis es la fosforilación del la glucosa, a glucosa 6-fosfato, por acción de las enzima hexoquinasa y glucoquinasa (dependiendo del tejido). La fosforilación de la glucosa cumplía la función de fijar la glucosa dentro de la célula, una vez que ingresaba por los diferentes GLUT. La reacción inversa, la desfosforilación de la glucosa 6fosfato es catalizada por la enzima glucosa 6-fosfatasa. La hidrólisis del grupo fosfato genera Pi. Esta enzima se encuentra en lumen del retículo endoplasmático de los hepatocitos y células renales. Eso permite que la glucosa generada en la gluconeogénesis sea liberada al torrente sanguíneo para abastecer de glucosa al resto de los tejidos. Células del cerebro y músculo no poseen esta enzima, de forma que no pueden llevar a cabo la gluconeogénesis. 3 UNLaM-Kinesiología-Bioquímica-Metabolismo de Hidratos de Carbono II Balance global de la Gluconeogénesis: El siguiente es el balance global de la gluconeogénesis: 2 Piruvato + 4ATP +2GTP + 2NADH + 4H+ + 6H2O Glucosa + 4ADP + 2GDP + 6Pi + 2NAD+ Nótese que se trata de un proceso energéticamente costoso, por lo que es necesario que la gluconeogénesis, como la glucólisis se encuentren recíprocamente reguladas. Si ambas ocurrieran en simultáneo el resultado sería el consumo de ATP y la producción de calor. Recordar el balance de la glucólisis: Glucosa + 2NAD+ + 2ADP + 2Pi 2 Piruvato + 2NADH + 4H+ + 2ATP + 2H2O Es así como las enzimas irreversibles, y reguladoras de estas vías metabólicas se regulan mediante la fosforilación y desfosforilación inducidas por hormonas (insulina, glucagón y adrenalina) y por reguladores alostéricos, en forma coordinada y recíproca. Regulación: Cuando el estado energético de la célula es alto, o sea NADH/NAD+ es alto, el ciclo de Krebs se inhibe, y consecuentemente aumente la concentración de Acetil-CoA. La enzima piruvato carboxilasa se ve estimulada por este aumento de Acetil-CoA, generando un aumento de Oxalacetato que induce la activación de la gluconeogénesis. En estado de ayuno las hormonas glucagón y la adrenalina, unidas a membrana activan la producción de AMPc, segundo mensajero que activa enzimas quinasas, produciendo la fosforilación de las enzimas que interviene en la glucólisis y gluconeogénesis. Las enzimas claves de la glucólisis se ven inhibidas por fosforilación, mientras que las enzimas de la gluconeogénesis, fosfoenolpiruvato carboxiquinasa, fructosa 1,6-bisfosfatasa y glucosa 6-fosfatasa, se activan por fosforilación. Figura 3: Regulación hormonal en ayuno Como vimos, en saciedad, la insulina (reduce los niveles de AMPc, estimulando la fosfodiesterasa, que convierte el AMPc en 5'AMP) produce la activación de la fosfofructoquinasa II, que produce fructosa 2,6-bisfosfato. La fructosa 2,6-bisfosfato es un regulador alostérico positivo de la fosfofructoquinasa I (o sea estimula la glucólisis) y a su vez es un regulador alostérico negativo de la fructosa 1,6-bisfosfatasa. Ciclo de Cori: El ciclo de Cori es la circulación cíclica de la glucosa y el lactato entre el músculo y el hígado. 4 UNLaM-Kinesiología-Bioquímica-Metabolismo de Hidratos de Carbono II Figura 4: Ciclo de Cori Durante el trabajo muscular, en presencia de una gran actividad glucolítica anaerobia, se producen grandes cantidades de lactato, que difunde a la sangre para ser llevado al hígado. El lactato en el hígado es convertido nuevamente en glucosa por gluconeogénesis, retornando a la circulación para ser llevada de vuelta al músculo. Ciclo de la alanina: El “Ciclo de la alanina o de Cahill” es un ciclo metabólico muy parecido al ciclo de Cori. En el músculo, cuando los aminoácidos se degradan para ser combustible, los grupos amino son recogidos como glutamato a través de una transaminación. El glutamato entonces entrega su grupo α-amino al piruvato, reacción mediada por la alanina aminotransferasa (GPT). La alanina formada pasa a la sangre y de ahí al hígado. Estando en los hepatocitos, la alanina aminotransferasa pasa el grupo amino de la alanina al αcetoglutarato, formando nuevamente piruvato y glutamato. Aquí el glutamato puede desviarse al ciclo de la urea por la glutamato deshidrogenasa, liberando amonio (NH4+). Por el otro lado, el piruvato por gluconeogénesis se emplea para la producción de glucosa la cual regresa por la sangre hasta el músculo. Figura 5: Ciclo de la alanina 5 UNLaM-Kinesiología-Bioquímica-Metabolismo de Hidratos de Carbono II Vía de las pentosas: Es otra ruta oxidativa de la glucosa, sin fines energéticos. El objetivo de esta ruta es la producción de metabolitos necesarios para la célula: • Formación de ribosa para la producción de RNA y DNA en células de rápida división (como en médula, piel y mucosa) y la producción de ATP, NADH, FADH2 y coenzima A. • Reducción de NADP+ a NADPH, cofactor equivalente al NAD+/NADH, que actúa como dador de electrones en las reacciones de biosíntesis reductivas, por ejemplo en la síntesis de ácidos grasos (en hígado, adipocitos y células mamarias) y de colesterol y hormonas esteroides (en hígado, glándula adrenal y gónadas) o como agente antioxidante en tejidos expuestos a radicales de oxigeno (eritrocitos, cornea). Figura 6: Vía de las Pentosas La primera reacción de esta vía, que ocurre en el citosol es la oxidación de la glucosa 6-fosfato por acción de la glucosa 6-fosfato deshidrogenasa, para producir 6fosfoglucono-δ-lactona, con reducción de una molécula de NADP+ a NADPH. La lactona generada es hidrolizada por la enzima lactonasa para dar fosfogluconato, rompiendo la forma cíclica. Posteriormente se produce una nueva oxidación, con producción de NAPH y descarboxilación. Para dar D-ribulosa 5-fosfato. La isomerización por acción de la fosfopentosa isomerasa genera ribosa 5-fosfato. Balance Global: Glucosa 6–fosfato + 2NADP+ + H2O Ribosa 5-fosfato + CO2 + 2NADPH + 2H+ 6 UNLaM-Kinesiología-Bioquímica-Metabolismo de Hidratos de Carbono II Glucógeno: El glucógeno es un homopolisacárido de reserva energética formado por cadenas de glucosa unidas por enlaces O-glucosídicos α-1,4, ramificadas cada 8 a 12 unidades de glucosa en enlaces α-1,6. Esta estructura es Insoluble en agua. Figura 7: Molécula de glucógeno El glucógeno es el polisacárido de reserva energética en los animales que se almacena principalmente en el hígado y en los músculos. El almacenamiento de la glucosa en forma polimérica presenta la ventaja de reducir la presión osmótica que la glucosa libre podría ocasionar. Glucogenogénesis: La glucogénesis es la generación de glucógeno a partir de glucosa 6-fosfato. El primer paso es el catalizado por la fosfoglucomutasa que produce la migración del grupo fosfato de la posición 6 a la posición 1, obteniéndose glucosa 1-fosfato. Dado que la incorporación de la glucosa 1-fosfato a una cadena de glucosas α1-4 es termodinámicamente desfavorable se requiere una activación más fuerte para que se produzca la polimerización. Con este objetivo UDP-Glucosa pirofosforilasa cataliza la reacción entre el UTP (equivalente a ATP) y la glucosa 1-fosfato para obtener difosfato de uridinaglucosa (UDP-Glucosa) y liberándose pirofosfato, PPi. El ∆G de esta reacción es próximo a cero, es la posterior hidrólisis irreversible y altamente exergónica del pirofosfato lo que hace de esta reacción espontánea e irreversible. El estado de alta energía de la UDP-glucosa le permite ceder espontáneamente la unidad glucosilo a la cadena de glucógeno en formación, reacción catalizada por la 7 UNLaM-Kinesiología-Bioquímica-Metabolismo de Hidratos de Carbono II glucógeno sintasa. Por esta enzima se produce la extensión de la cadena por el extremo no reductor, en la posición 4, formando los enlaces o-glucosídicos α1-4. La glucógeno sintasa no puede unir dos restos de glucosa, solo puede extender una cadena de glucano ya existente. Para iniciar la síntesis de cero se requiere un cebador, la proteína glucogenina. La glucógeno sintasa sólo cataliza la formación de uniones α1-4, las ramificaciones son llevadas a cabo por la enzima ramificante. Esta enzima transfiere segmentos terminales de la cadena principal de aproximadamente 7 restos de glucosa a posición 6 de restos de glucosa de la misma u otra cadena de glucógeno. Figura 8: Gluconeogénesis Glucogenólisis: Figura 9: Glucogenólisis La glucogenólisis, degradación del glucógeno para obtener glucosa, requiere de cuatro enzimas: • Glucógeno fosforilasa que cataliza la ruptura del enlace o-glucosídicos α-1,4 de la unidades glucosilo terminales no reductoras del glucógeno y su sustitución por un grupo fosfato para obtener glucosa 1-fosfato. Esta enzima actúa hasta 4 residuos de la ramificación 8 UNLaM-Kinesiología-Bioquímica-Metabolismo de Hidratos de Carbono II • • • Enzima glucantransferasa actúa transfiriendo un trisacárido unido en posición α-1,4 en una ramificación límite del glucógeno hasta el extremo no reductor de otra ramificación. Sobre este sigue actuando la glucógeno fosforilasa. El enlace α1-6 restante en la ramificación es hidrolizado por la enzima desramificante para dar directamente glucosa (sin fosforilar) Fosfoglucomutasa, convierte la glucosa 1-fosfato en glucosa 6-fosfato que puede bien continuar la vía glucolítica en el músculo; o en el hígado hidrolizarse a glucosa para su distribución por el torrente sanguíneo. Regulación de la Glucogenogénesis/Glucogenólisis: La glucógeno fosforilasa es la enzima reguladora de la degradación del glucógeno y la glucógeno sintasa de la síntesis de glucógeno. La principal vía de regulación es por moduladores alostéricos y modificación covalente (fosforilación/desfosforilación) inducidas por hormonas (InsulinaDesactiva; Glucagon, adrenalina y noradrenalinaActivan). El mecanismo de regulación hormonal es análogo al desarrollado en la regulación de la gluconeogénesis, Figura 3. Tabla 1: Regulación hormonal de los metabolismos de la glucosa Estado Hormona Activa Saciedad Insulina Enzima Activa Fosforilasa Ayuno Quinasa Glucagón/ Adrenalina/ Noradrenalina Produce Metabolismos de la glucosa activos Desfosforilación Glucólisis, Glucogenogénesis, vía de las pentosas Fosforilación Gluconeogénesis, Glucogenólisis 9