Practica 6 Soluciones valoradas
Anuncio

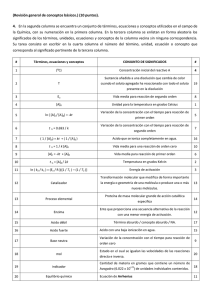
BACHILLERATO QUÍMICA II Práctica 6: Preparación de soluciones valoradas Nombre: _________________________________________________________________________ Actividad previa: 1. Objetivo: 2. Hipótesis experimental: 3. Identifica una variable: 4. Realiza un diagrama de flujo para explicar el desarrollo de la práctica. Fundamento: Las disoluciones rodean nuestro mundo cotidiano, las vemos en los alimentos, bebidas, líquidos de limpieza, cosméticos; Es decir las bebemos al ingerir un refresco o una taza de té, las respiramos al inhalar aire, nadamos en ellas cundo vamos al mar (disolución de sal en agua), incluso estamos compuestos por ellas así como la sangre que constituye gran parte de nuestro organismo. En la industria las soluciones se utilizan cotidianamente en la mayoría de los procesos para la elaboración de productos alimenticios, medicamentos, productos domésticos como limpiadores y detergentes. Por lo que es indispensable conocer algunas unidades de concentración de las sustancias involucradas en dichos procesos a fin de evitar consecuencias letales. En muchas operaciones analíticas, y principalmente en el análisis cuantitativo, es indispensable trabajar con soluciones de concentración exacta a estas soluciones se les denomina soluciones molares y se les designa con la letra M. Se preparan disolviendo una determinada cantidad de moles de la sustancia por cierto volumen de solución en litros. M = n/v Donde: n = (m/PM) M= (m/PM)/V Para preparar las soluciones molares se debe primero determinar el valor del peso molecular, conocer la concentración y el volumen en litros de la solución que se desea preparar y la pureza de las sustancias empleadas. Cuando el soluto es un líquido se debe tomar en cuenta la densidad. Por ejemplo el acido clorhídrico es un liquido, en lugar de pesar la masa calculada se mide el volumen de acido que contendrá los gramos de HCl, de manera que se dividirá la masa entre la densidad del acido. V =m/d Material: _ Matraz volumétrico de 100 mL _ Vidrio de reloj _ Matraz Erlenmeyer de 125 mL _ Balanza analítica o semi-analítica _ Probeta de 50 o 100 ml _ Espátula Agua destilada 1 sobre de saborizante en polvo Azúcar Sal de mesa MATERIAL QUE DEBE PROPORCIONAR EL ALUMNO. Desarrollo: 1. En este experimento prepararás 100 ml de una solución 0.1 M de azúcar Datos: Cálculos: Mueva varias veces hasta disolver el soluto y etiquete el matraz con la fórmula y concentración de la solución. 2.Ahora preparará 100 ml de una solución valorada de NaCl al 0.90% Datos: Cálculos: 3. Mida 150 ml de agua y colóquela en el matraz erlenmeyer, agregue los 0.2 gramos del saborizante en polvo y calcula en ppm la concentración obtenida. ppm = miligramos de soluto / litro de disolución Resultado : 5. Prepara 100 ml de una solución al ____% en peso con el saborizante en polvo. Datos: Cálculos RESUELVE: 1. ¿Cuál es la diferencia entre las soluciones empíricas y valoradas? 2. Exprese algunos usos de las soluciones valoradas 3. Explica como prepararías 2l de solución 0.25 M de NaCI, señala los cálculos. 4.- Explica la forma en que se prepara una disolución al 6% de C6H12O6 Actividad extra: 1. Investiga dos ejemplos donde se usen las partes por millón (ppm) para expresar concentración. 2. Investiga dos ejemplos de sustancias de la vida cotidiana en las que su concentración se exprese en porcentaje en masa. Bibliografía: Rúbrica de evaluación Categoría 1.- Redacción de objetivos 2.- Hipótesis Experimental 3.- Variables 4.- Esquema de desarrollo experimental 5.- Trabajo cooperativo 6.- Seguridad en el laboratorio 7.- Apariencia/Organización del reporte 8.- Componentes del reporte 9.- Fuentes de información 10.- Investigación Total 3 2 1 Comentarios