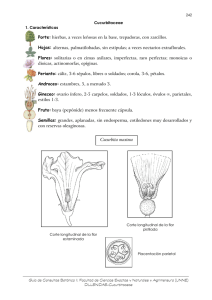
1er. informe - Biodiversidad Mexicana
Anuncio

Proyecto Recopilación y análisis de la información existente de las especies de los géneros Cucurbita y Sechium que crecen y/o se cultivan en México Responsable Dr. Rafael Lira Saade, FES Iztacala, UNAM Co-responsables Dr. Luis Eguiarte Fruns, Instituto de Ecología, UNAM Dr. Salvador Montes Hernández, INIFAP, Campo Experimental Bajío Primer Informe (Mayo 2009) Recopilación y análisis de la información existente de las especies de los géneros Cucurbita y Sechium que crecen y/o se cultivan en México Objetivos del Proyecto y Preguntas a Resolver Este proyecto pretende contribuir a la construcción de una política de estado clara y permanente respecto a la conservación in situ de los recursos genéticos para los que nuestro país es centro de origen y diversidad, mediante la detección de riesgos a la diversidad genética de las especies domesticadas de los géneros Cucurbita y Sechium, tanto por la liberación de organismos genéticamente modificados o por otros aspectos que pudieran promover la pérdida de variedades locales de los taxa domesticados y sus parientes silvestres más importantes. Las preguntas a resolver por el proyecto son: 1. ¿Cuál es la representación taxonómica de ambos géneros en México? 2. Considerando lo señalado por el artículo 87 de la Ley de Bioseguridad de los Organismos Genéticamente Modificados ¿Cuáles son los elementos que permitirían proponer a México como centro de origen de especies domesticadas de los géneros Cucurbita y Sechium? 3. ¿Cuál es la diversidad de las especies domesticadas de los géneros Cucurbita y Sechium que se cultivan en México y cómo está distribuida en el país? 4. ¿Cuáles son las especies silvestres más cercanamente relacionadas con las especies domesticadas de ambos géneros, en donde están distribuidas y cuáles podrían considerarse como áreas de riqueza? 5. ¿Cuál es la situación legal y real en términos de conservación de dichas especies? 6. ¿Existen organismos genéticamente modificados de ambos géneros que ya hayan sido liberados o que estén en posibilidades de serlo? 7. Considerando los modos de reproducción de las especies de ambos géneros ¿cuáles serían los riesgos reales y potenciales relacionados con la posible liberación de organismos genéticamente modificados? 8. Considerando los aspectos señalados en los puntos 2-6 ¿Cuáles podrían ser otros riesgos potenciales para la diversidad genética de las especies silvestres y domesticadas de ambos géneros en México? 2 Contenido del Primer Informe De acuerdo con los compromisos establecidos en el proyecto, en este primer informe se incluye información taxonómica actualizada sobre la representación en México de los géneros Cucurbita y Sechium, las relaciones de las plantas domesticadas con sus parientes silvestres, la importancia de los taxa silvestres, así como también acerca de los elementos que se requieren para proponer a México como centro de origen de especies domesticadas de ambos géneros. Estos aspectos cubren prácticamente en su totalidad las respuestas a las preguntas 1 y 2 de la lista anteriormente presentada y de manera parcial las respuestas a la pregunta 4. Los límites y relaciones reconocidas aquí para los taxa reconocidos para ambos géneros, están basados en la revisión de numerosos estudios en donde se analizaron evidencias morfológicas, ecogeográficas, arqueológicas y de tipo biosistemático. Adicionalmente, se han agregado las observaciones de campo y la revisión de colecciones hechas en otros proyectos por los responsables del proyecto. La información respecto a los temas que se comprometieron para resolverse en este informe y las fuentes consultadas, se presentan por separado para cada género. 3 Cucurbita L. 4 1. Información General del Género Cucurbita El género Cucurbita es bien conocido por sus especies domesticadas, las cuales en los países de habla hispana son comúnmente conocidas con nombres como "calabazas", "zapallos" o mediante numerosos nombres en lenguas indígenas, mientras que en los países anglosajones se les denomina "squashes", "pumpkins" o "gourds". El uso más importante al que se han destinado las especies domesticadas de Cucurbita es el alimenticio, no solo en Latinoamérica, sino también en muchas otras regiones del mundo. Los frutos (inmaduros y/o maduros) y las semillas de estas especies, son las partes más comúnmente empleadas con este propósito, mientras que las flores (generalmente las estaminadas o masculinas) y las partes tiernas de los tallos, conocidas en varios países como “puntas de las guías", se utilizan en menor escala. El valor alimenticio de todas las partes comestibles de las plantas de Cucurbita es bastante aceptable. Por ejemplo, las semillas tienen altos contenidos de aceites (hasta + 39 %), proteinas (+ 44 %) y Fósforo (+ 1 %). Por su parte, las llamadas "puntas de las guías", las flores y los frutos tiernos y maduros, destacan por sus contenidos de Calcio y Fósforo. Adicionalmente, las flores y frutos también son ricos en Tiamina, Riboflavina, Niacina y Acido Ascórbico. Las especies silvestres y domesticadas de Cucurbita son plantas anuales o perennes, monoicas, rastreras a trepadoras (subarbustivas en algunos cultivares comerciales). Sus flores son gamopétalas con corolas tubular-campanuladas y muy vistosas, de color amarillo pálido a amarillo-anaranjado brillante. Las flores de ambos sexos son solitarias. Las masculinas o estaminadas tienen estambres estructurados a manera de una columna, con filamentos libres o más o menos coherentes y anteras soldadas formando una estructura cilíndrica o angostamente piramidal; las flores femeninas o pistiladas tienen ovario ínfero con numerosos óvulos en posición horizontal, estilos fusionados casi en toda su longitud o sólo cortamente libres en el ápice, estigmas grandes, carnosos y más o menos hendidos o lobulados y se observan ligeras modificaciones en cuanto a la estructura del perianto respecto de las estaminadas, principalmente correspondientes a diferencias de tamaño de alguna o algunas de sus partes (p.ej. el receptáculo es siempre mucho más reducido). Las flores de las especies de Cucurbita abren muy temprano por la mañana y son polinizadas por especies de abejas solitarias de los géneros Peponapis y Xenoglossa. Los frutos son del tipo pepo y en las plantas domesticadas se producen en una gran diversidad de formas, tamaños, colores, tipos de superficies etc., mientras que en las plantas silvestres son relativamente uniformes en cuanto a su forma (globosos, ovoides o raramente piriformes), superficie (generalmente lisa o sin ornamentaciones), coloración (blancos, amarillentos o verdes con o sin manchas y/o franjas) y de tamaño comparativamente pequeño. Todas las especies de Cucurbita tienen 20 pares de cromosomas y se ha propuesto que el género es un antiguo tetraploide. 5 2. Taxonomía del Género El género Cucurbita se ubica en la tribu Cucurbiteae, subfamilia Cucurbitoideae, junto con Sicana, Peponopsis, Polyclathra, Schizocarpum, Calycophysum, Tecunumania, Anacaona, Penelopeia, Abobra, Selysia, Cionosicyos y Cayaponia. Su historia taxonómica formal se inició en 1753 con el trabajo clásico de C. Linnaeus, Species Plantarum, en el cual se incluyeron tanto especies pertenecientes a este género (C. pepo, C. verrucosa y C. melopepo), como otras que ya han sido transferidas a géneros totalmente diferentes y poco o nada relacionados con Cucurbita (C. lagenaria = Lagenaria siceraria (Molina) Standley y C. citrullus = Citrullus lanatus (Thunb.) Matsumura & Nakai). Durante muchos años, Cucurbita se consideró como un género formado por 20-27 especies, las cuales, por las características ecológicas de sus hábitats y por la duración de su ciclo de vida, tradicionalmente han sido divididas en dos grandes grupos: Las especies xerofíticas, con raíces tuberiformes perennes de almacenamiento y las especies de hábitas más o menos mesofíticos, anuales o perennes de vida corta, pero cuyas raíces son fibrosas. Dentro de este último grupo se incluyen los cinco taxa de plantas domesticadas, cuya extraordinaria variación morfológica, principalmente a nivel de los frutos y las semillas, ha dado lugar a que una gran cantidad de nombres científicos hayan sido propuestos para designarlas, cuyo análisis de la validez, tipificación, etc. escapa a los objetivos de este proyecto. En la actualidad, Cucurbita se reconoce como un género estrictamente americano, pues todos sus miembros crecen espontáneamente o fueron domesticados en América. Incluye 15 especies o agrupaciones taxonómicas que en total comprenden a 20 taxa, de los cuales 15 crecen espontáneamente o se cultivan en México (Cuadro 1). En cinco de estas agrupaciones se incluyen los taxa domesticados (C. argyrosperma Huber ssp. argyrosperma, C. ficifolia Bouché, C. maxima Duch. ex Lam. ssp. máxima, C. moschata (Duch. ex Lam.) Duch. ex Poir. y C. pepo L. ssp. pepo), las cuales en muchos casos incluyen numerosas razas o variedades locales y cultivares comerciales que en otros trabajos han sido reconocidos en diferentes categorías taxonómicas como subespecies, variedades o formas. En el Nuevo Mundo, los únicos géneros que pueden ser comparables con Cucurbita por el número de especies comestibles domesticadas son, Capsicum (con 3-5 especies) y Solanum (con 7 especies). Una muestra de la diversidad morfológica desplegada por las especies del género, se presenta en la figura 1. 3. Límites Taxonómicos y Relaciones en el Género Cucurbita En esta sección se presenta una síntesis de los avances documentados acerca de la definición de los límites taxonómicos, las relaciones entre los taxa del género y su importancia. La información se presenta para los distintos grupos 6 taxonómicos o especies que se muestran en el cuadro 1, iniciando con aquellos que involucran plantas domesticadas, para posteriormente tratar los grupos (o especies) que sólo incluyen plantas silvestres. Grupo Argyrosperma Origen. Los miembros de este grupo son plantas anuales y en los últimos años han sido investigados muy intensamente. Estudios biosistemáticos y etnobotánicos, han producido una gran cantidad de información acerca de su diversidad morfológica y genética y de sus relaciones con otras especies del género. Este cúmulo de evidencias ha dado como resultado la redefinición de sus límites taxonómicos y afinidades genéticas. Así, en la actualidad se sabe que comprende una mayor diversidad de lo que anteriormente se conocía, la cual ha sido tratada en la literatura como un complejo taxonómico constituido por dos subespecies. Una de ellas es la subespecie argyrosperma, conformada por cuatro variedades, en tres de las cuales (argyrosperma, callicarpa y stenosperma) se incluyen a todos los tipos cultivados, mientras que en la cuarta variedad (palmeri) comprende a las poblaciones espontaneas del noroeste de México y originalmente descritas bajo el nombre Cucurbita palmeri L.H. Bailey. La otra subespecie de este complejo es sororia, la cual ha sido reconocida como el ancestro silvestre del grupo, tanto por su compatibilidad reproductiva y similitud morfológica con los restantes taxa del complejo, como por las características de su distribución ecogeográfica. Esta subespecie comprende las poblaciones silvestres distribuidas desde México hasta Centroamérica, las cuales fueron descritas originalmente bajo el nombre C. sororia L.H. Bailey. Estudios de hibridación han revelado que todos estos taxa son completamente interfértiles y en consecuencia forman parte de la misma especie biológica.Los restos arqueológicos de las plantas domesticadas de este grupo han sido encontrados desde el Este y Suroeste de los Estados Unidos hasta el Centro-Sur de México y sugieren que su domesticación debió llevarse a cabo en esta última región hace más de 7000 años (véase Cuadro 2) y que estuvo presente en los Estados Unidos desde mucho tiempo antes de la llegada de los españoles al continente americano. Los rasgos morfológicos de muchos de los restos corresponden a las variedades que aún se cultivan en las proximidades de los sitios de donde fueron recuperados (var.argyrosperma en Tamaulipas; var. stenosperma en el Valle de Tehuacán; var. callicarpa en el suroeste de Estados Unidos y noroeste de México). Sin embargo, existe una excepción en el Valle de Tehuacán, en donde se han encontrado semillas "tipo taos" (de color pardo obscuro), las cuales son producidas por formas pertenecientes a la variedad callicarpa que actualmente sólo se cultiva en los estados del noroeste de México. De acuerdo con todos estos datos, se han propuesto dos hipótesis para explicar el origen y evolución de la variación existente en las formas domesticadas del grupo. La primera de ellas sugiere que cada una de las variedades domesticadas fue resultado de un proceso independiente de domesticación a partir de poblaciones de la subespecie sororia, mientras que la otra propone a la variedad 7 argyrosperma como la primera en haberse seleccionado y que de ella se derivaron las dos restantes variedades domesticadas. La segunda de estas hipótesis es la más aceptada y está fundamentada en una serie de tendencias observadas en la variación morfológica de los frutos y semillas encontrados en algunas áreas en las que coexisten cuando menos dos de las variedades domesticadas. 1. C. argyrosperma Huber ssp. argyrosperma 2. C. argyrosperma ssp. sororia (L.H. Bailey) Merrick & Bates Grupo Argyrosperma 3. C. pepo L. ssp. pepo 4. C. pepo ssp. fraterna (L.H. Bailey) Andres 5. C. pepo ssp. texana (Scheele) I.A. Filov Grupo Pepo 6. C. maxima Duch. ex Lam. ssp. maxima 7. C. maxima ssp. andreana (Naudin) I.A. Filov 8. C. ecuadorensis Cutler & Whitaker (informalmente sugerida como parte de este grupo) Grupo Maxima 9. C. okeechobeensis (J.K. Small) ssp. okeechobeensis 10. C. okeechobeensis ssp. martinezii (L.H. Bailey) Walters & DeckerWalters Grupo Okeechobeensis 11. C. digitata A. Gray * 12. C. cordata S. Watson * 13. C. palmata S. Watson * Grupo Digitata 14. 15. 16. 17. Grupo Foetidissima C. foetidissima H.B. K. * C. pedatifolia L.H. Bailey * C. scabridifolia L.H. Bailey * C. radicans Naudin * 18. C. lundelliana L.H. Bailey 19. C. ficifolia Bouché 20. C. moschata (Duch. ex Lam.) Duch. ex Poir. Especies sin filiación con algún grupo Cuadro 1. Límites taxonómicos del género Cucurbita propuestos por Lira et al. (1995). Los nombres en negritas corresponden a los taxa domesticados, los marcados con un asterisco a los taxa perennes y los que están en color rojo a aquellos que no están presentes en México. La adición de C. ecuadorensis al grupo Maxima ha sido muy recientemente sugerida, aunque no formalmente propuesta, por Sanjur et al. (2002), quienes apoyan la propuesta original de Nee (1990) en el sentido de que más que tratarse de un taxón silvestre pudiera ser una planta que fue semi-domesticada en tiempos precolombinos pero cuyo cultivo se abandonó. 8 C. argyrosperma C. ficifolia C. maxima C. moschata C. pepo Valle de Tehuacán, Puebla y Coxcatlán, Pue. (antes de 5200 A.C. y 115 A.C.) Ocampo, Tamaulipas (3085 A.C. - 200-900 D.C.) Cuevas del Gallo y La Chagüera, Morelos (290 A.C.) Este y Suroeste de Estados Unidos (380-1490 D.C.) Río Zape, Durango (700 D.C.) Huaca Prieta, Perú (2700-300 A.C.) Valle Casma, Perú (2000-1500 A.C.) Norte de Belice y Tikal, Guatemala (restos de identificación dudosa) (2000 A.C.-850 D.C.) Valle de Oaxaca (700 D.C.) Valle Casma, Perú (2000-1500 A.C.) Valle Viru, Perú (1800 A.C.-600 D.C.) Pampa Grande Norte de Argentina (500-1000 D.C.) Ica, Perú (500-1400 D.C.) San Nicolás, Perú (1200 D.C.) Ocampo, Tamaulipas y Valle de Tehuacán, Puebla (800- aprox 5000 A.C.) Cuevas del Gallo y La Chagüera, Morelos (290 A.C.) Huaca Prieta, Perú (2700-300 A.C.) Norte de Belice y Tikal, Guatemala (2000 A.C.-850 D.C.) Valle Casma, Perú (500 A.C.) Suroeste de Estados Unidos (300 A.C.) Valle Viru, Perú (600-1100 D.C.) Chincha, Perú (1310-1530 D.C.) Great Plains, Oeste del Rio Mississippi (1700 D.C.) Valle de Oaxaca y Coxcatlán, Puebla (8750 A.C.-700 D.C.) Ocampo, Tamaulipas (7000-4360 A.C.) Oeste-Centro de Illinois (5000-2000 A.C.) Ozark Highlands, Missouri (4000 A.C.) Oeste de Kentucky (3000-600 A.C.) Philips Spring Missouri (2300 A.C.) Valle de Tehuacán (2000-1000 A.C.) Suroeste de Estados Unidos (300 A.C.) Río Zape, Durango (600-700 D.C.) Edzna, Campeche (850 D.C.) Great Plains, Oeste del Rio Mississippi (1400 D.C.) Cuadro 2. Síntesis de los registros arqueológicos de las especies domesticadas de Cucurbita. 9 Figura 1. Muestra de la diversidad de los taxa del género Cucurbita 10 Sin embargo, las características morfológicas empleadas para separar a las variedades domesticadas son difíciles de usar en la práctica con propósitos de identificación. En el caso de la variedad palmeri, sus características no difieren mucho de las que pueden encontrarse en las plantas silvestres del grupo, ni tampoco de las de híbridos espontáneos entre estas últimas y las plantas domesticadas del grupo como los reportados entre plantas del grupo argyrosperma para el estado de Jalisco o entre la subespecie. sororia y C. moschata para el estado de Chiapas. Considerando todo lo anteriormente expuesto, en este proyecto se reconoce una clasificación mucho más sencilla en la que el Grupo Argyrosperma corresponde a la especie biológica Cucurbita argyrosperma, la cual incluye dos subespecies: La subespecie argyrosperma, en la que se ubican todos los tipos domesticados del grupo y la subespecie sororia, que comprende a las formas silvestres o espontáneas y que corresponde al ancestro silvestre (véase Cuadro 1). Aspectos ecogeográficos. El área de distribución nativa bajo cultivo de la subespecie argyrosperma comprende del suroeste de Estados Unidos hasta Centroamérica. Dentro de esta amplia región es cultivada en un intervalo altitudinal también relativamente amplio, que abarca desde casi el nivel del mar hasta los 1800-1900 m, generalmente en zonas con climas cálidos y algo secos o con una estación de lluvias bien delimitada. Este cultivo no es tolerante a temperaturas muy bajas lo cual limita su manejo al intervalo de elevación antes mencionado. La distribución ecogeográfica de su ancestro silvestre, C. argyrosperma ssp. sororia, por su parte, comprende desde México hasta Centroamérica (Figura 2), siempre dentro de un intervalo altitudinal y en zonas con condiciones climáticas muy similares a las descritas para su contraparte cultivada. Prospera en las zonas medias y principalmente bajas de ambas vertientes de México (0-1800 m), abarcando las dos principales cordilleras (Sierras Madres Occidental y Oriental) y algunos valles interiores importantes como la Cuenca del Balsas y la Depresión Central de Chiapas. En el Este únicamente se ha registrado en Tamaulipas, Veracruz y zonas aledañas del noroeste de Oaxaca, mientras que en el Oeste está más ampliamente distribuida desde Sonora hasta Chiapas y hacia el sur en Centroamérica, desde Guatemala hasta Panamá. Si se sobrepusiera la distribución ecogeográfica de las dos subespecies, sería evidente que durante largos periodos han existido numerosos sitios en los que pueden coexistir y en consecuencia que ha habido amplias posibilidades de entrecruzamiento entre ellas. Los principales polinizadores reconocidos para el Grupo Argyrosperma son Peponapis utahensis (Cockerell) Hurd & Linsley, P. pruinosa (Say) Hurd & Linsley, P. azteca Hurd & Linsley, P. crassidentata (Cockerell) Hurd & Linsley, Xenoglossa fulva Hurd & Linsley, además de P. atrata (Smith) Hurd & Linsley, la cual se consideraba polinizador específico de C. ficifolia. Importancia del taxón silvestre del grupo. En varios estados de México los frutos y semillas de la subespecie argyrosperma se usan como alimento y para tratar enfermedades de la piel o renales. Para algunas de sus colecciones de 11 germoplasma, además, se ha reportado resistencia a enfermedades virales importantes para las plantas domesticadas como Bean Yellow Mosaic Virus y Tomato Ringspot Virus. Grupo Pepo Origen. Los miembros de este grupo también son plantas anuales y, como los del grupo anterior, han sido intensamente estudiados. Investigaciones biosistemáticas, etnobotánicas y morfométricas, en conjunción con datos arqueológicos, han permitido avanzar en el conocimiento acerca de los procesos de domesticación en el grupo. De acuerdo con los registros arqueológicos, los restos más antiguos de las formas domesticadas de este grupo (véase Cuadro 2) han sido encontrados en México, en el Valle de Oaxaca (8750 AC-700 DC) y en las cuevas de Ocampo, Tamaulipas (7000-5000 AC). Su presencia en los Estados Unidos es también muy antigua y en algunos casos mayor a la atribuida a los restos de otros cultivos importantes domesticados más al sur. En cuanto a las especies silvestres relacionadas, evidencias morfométricas, moleculares y de hibridación artificial y espontánea, han sugerido que las más cercanas son: C. fraterna, sólo conocida de unas cuantas localidades de los estados de Tamaulipas y Nuevo León en el noreste de México y mucho más relacionada con las formas domesticadas mexicanas, y C. texana, endémica del sureste de Estados Unidos y con mayor afinidad con los tipos domesticados de Norteamérica. Como resultado de todos estos estudios, en la actualidad existe un mejor entendimiento de la variación y relaciones de C. pepo y ha conducido a su reclasificación en categorías infraespecíficas. En este proyecto se ha adoptado la propuesta de clasificación de T. Andres, quien en 1987 sugiere que este grupo está constituido por tres subespecies: la subespecie. pepo que incluye a todos los tipos cultivados comestibles y ornamentales y, las subespecies texana y fraterna, correspondientes a los ancestros silvestres del grupo. Estos tres taxa que actualmente no co-existen, es probable que en el pasado hayan conformado un complejo cultivo-maleza-silvestre cuya distribución seguramente fue mucho más amplia y continua que en el presente. Aspectos ecogeográficos. La antigüedad de los restos arqueológicos y otras evidencias, indican que la subespecie. pepo se cultivaba en los Estados Unidos y Canadá desde mucho antes de la llegada de los españoles. Sin embargo, en la actualidad en esos países sólo se manejan cultivares comerciales, mientras que el cultivo de sus razas o variedades tradicionales se restringe a México y el norte de Centroamérica. Por otra parte, aunque generalmente se dice que es un cultivo de altas elevaciones, la realidad es que puede crecer en condiciones ecológicas bastante más amplias. Así, por ejemplo, en México existen variedades nativas que crecen desde muy cerca del nivel del mar, en climas relativamente secos y suelos calizos (p.ej. el llamado "tsol" en la Península de Yucatán), así como otras que son manejados en altitudes mayores a los 2000 m, y en condiciones climáticas más frías y suelos en ocasiones fuertemente erosionados (p.ej. los llamados "güiches" en el estado de Oaxaca). Otro ejemplo es el de Guatemala, en donde las variedades o 12 razas nativas llamados comunmente "güicoy", se cultivan por arriba de los 1800 m, mientras que las llamadas "tsol" son manejadas en las partes bajas y cálidohúmedas del Petén a menos de 500 m de altitud. Al igual que para todas las especies de Cucurbita, sus polinizadores más importantes son especies de abejas de los géneros Peponapis y Xenoglossa, entre las cuales estan P. utahensis (Cockerell), P. azteca Hurd & Linsley, P. crassidentata (Cockerell), P. pruinosa (Say), X. strenua (Cresson) y X. fulva Smith. En cuanto a los parientes silvestres, la subespecie texana se conoce del centro, este y sureste de los Estados Unidos (Texas, Arkansas, Missouri, Alabama e Illinois). Crece en sitios perturbados de baja altitud y comúnmente asociados a corrientes de agua. La subespecie fraterna, por su parte, es endémica del Noreste de México en los estados de Tamaulipas y Nuevo León (Figura 2). Prospera en zonas de baja altitud, con clima seco y en las cuales la vegetación corresponde principalmente a matorrales subinermes, aunque en realidad es mucho más frecuente encontrarla como ruderal y principalmente como arvense en milpas o campos de cultivo. Importancia de los taxa silvestres del grupo. La única subespecie que es utilizada en su área de distribución es fraterna, de la cual en Tamaulipas se emplean sus frutos para aliviar padecimientos hepáticos y cuando están inmaduros junto con las semillas son consumidos como alimento, mientras que los frutos maduros se destinan al forraje. Los agricultores de Tamaulipas le atribuyen resistencia a enfermedades que atacan a las plantas domesticadas que cultivan (C. moschata, C. argyrosperma y C. pepo), pero esto no ha sido corroborado en condiciones experimentales. En contraste, este tipo de información no se ha registrado para la subespecie texana, ni en condiciones experimentales ha mostrado resistencia a ninguna de las enfermedades que atacan a las plantas de los taxa cultivados del género. Grupo Maxima Origen. Al igual que en los dos grupos anteriores, los miembros del Grupo Maxima son plantas anuales. Todos los tipos de evidencias existentes indican claramente que el proceso de domesticación en este grupo ocurrió en América del Sur. Las crónicas históricas, por ejemplo, señalan que durante la época de la conquista del Río de La Plata, la subespecie maxima fue uno de los principales cultivos de los Guaraníes del noreste de Argentina y Paraguay, además de que se sabe que ya en ese entonces, como ahora, existían numerosas variantes cultivándose en los valles andinos. Las evidencias arqueológicas, por su parte, son contundentes al respecto, pues hasta la fecha los únicos restos de esta especie han sido encontrados en esa región del continente, desde Perú hasta el norte de Argentina (véase Cuadro 2). Las relaciones silvestre-domesticada son aun más contundentes, pues las especies silvestres que han mostrado mayor afinidad genética y reproductiva y/o tener más similitudes con este cultivo son C. andreana Naudin y C. ecuadorensis Cutler & Whitaker. La primera de ellas nativa de Argentina y Uruguay, parece ser su 13 ancestro silvestre más probable y, de hecho, ya ha sido formalmente propuesta como tal, asignándosele la categoría de subespecie (C. maxima ssp. andreana Naudin). La segunda, por su parte, es nativa de Ecuador y su inclusión en el Grupo Maxima ha sido muy recientemente propuesta (aunque no de manera formal), sugiriéndose que más que tratarse de un taxón silvestre pudiera ser una planta que fue semi-domesticada en tiempos precolombinos pero cuyo cultivo se abandonó (véase Cuadro 1). Figura 2. Distribución geográfica de los taxa silvestres de los grupos Argyrosperma y Pepo Aspectos ecogeográficos. Dentro del área de distribución nativa bajo cultivo de la subespecie maxima se han registrado diversas variantes o razas locales que se cultivan en sitios ubicados dentro de un amplio intervalo altitudinal, el cual comprende, desde los 100 m (p.ej. en algunas localidades de Brasil), hasta muy cerca los 3000 m (p.ej. en Bolivia). La subespecie andreana, por su parte, crece en bajas altitudes, principalmente como arvense o ruderal. Se distribuye en Argentina, principalmente en las Provincias de Buenos Aires, Entre Rios, Santa Fe, San Luis y Córdoba, así como también en Uruguay (Figura 3 a). En adición a estos datos bastante confiables de la distribución de la subespecie andreana, en algunos trabajos y colecciones se reportan poblaciones del Departamento de Beni, Bolivia, que pudieran corresponder a este taxon, lo cual, de ser correcto, permitiría ampliar considerablemente su área de distribución. Finalmente, Cucurbita ecuadorensis es 14 conocida solamente de las zonas secas de la costa de Ecuador (Figura 3 b), en donde crece en sitios perturbados de una zona de transición entre bosques secos y húmedos, entre los 0 y 400 msnm. Adicionalmente, existe un registro arqueológico de la costa de Perú que parece corresponder a esta especie, pero su identificación es incierta y no se conocen colecciones recientes que confirmen su presencia en la actualidad en dicha región. Importancia del taxón silvestre del grupo. Aunque ningún uso local es reportado para la subespecie andrena, en algunas de sus colecciones de germoplasma se ha encontrado resistencia a virus como los llamados Clover Yellow Vein Virus, Bean Yellow Mosaic Virus y Watermelon Mosaic Virus Tipo2. Cucurbita ficifolia Origen. Aunque frecuentemente se señala que Cucurbita ficifolia es la única especie domesticada que es perenne, estudios biosistemáticos y observaciones de campo, han revelado que es anual y que, dependiendo de ciertas condiciones ecológicas (p.ej. heladas no muy severas), es capaz de sobrevivir por más tiempo que el que corresponde a una especie con este tipo de ciclo de vida. Otro aspecto que ha sido desmentido respecto a esta especie es su probable origen asiático, pues desde cerca de la mitad del siglo XX existe consenso respecto a que se trata de un cultivo de origen americano. No obstante, el conocimiento preciso (o al menos aproximado) de su centro de origen y domesticación, aun representa un enigma por resolver. Algunos autores han propuesto que su origen es centroamericano o surmexicano-centroamericano, mientras que otros sugieren que se ubica en América del Sur y más específicamente en Los Andes. Ninguna de estas hipótesis ha podido ser corroborada, pues la comparación de evidencias de diversos tipos ha fallado en determinar con precisión el probable sitio de domesticación de este cultivo. Así, por ejemplo, mientras la amplia difusión en América de los nombres de origen o influencia Nahuatl como chilacayote y sus derivados como lacayote, sugiere un origen mexicano para esta especie, las evidencias biosistematicas no lo han ratificado, pues se ha encontrado que existe poca o nula relación entre C. ficifolia y los taxa silvestres de Cucurbita nativos de México. Así, hasta la fecha sólo se han logrado algunos híbridos parcialmente fértiles con C. lundelliana, C. foetidissima y C. pedatifolia. La primera de estas especies, sin embargo, además de que prospera en un hábitat completamente diferente (zonas bajas del sur de México a Nicaragua) al que ocupa bajo cultivo C. ficifolia, tiene la misma capacidad de hibridizar con otras especies domesticadas. Las otras dos son especies perennes: C. foetidissima, ampliamente distribuida desde Estados Unidos hasta el centro de México y, C. pedatifolia, endémica de un área relativamente pequeña de México (San Luis Potosí, Hidalgo, Querétaro, Puebla y Oaxaca), en donde en ocasiones se le ha encontrado como arvense en milpas y asociada a C. ficifolia, pero sin ningún reporte de hibridización con ésta última. Las evidencias arqueológicas, por su parte, inclinan la balanza hacia un origen suramericano, ya que los restos más antiguos de C. ficifolia han sido 15 encontrados en Perú (véase Cuadro 2). Sin embargo, estas evidencias tampoco han podido ser apoyadas mediante estudios biosistemáticos que hayan involucrado a taxa sudamericanos como C. maxima ssp. andreana y C. ecuadorensis, además de que ambos prosperan en hábitats diferentes de aquellos en los que se cultiva a C. ficifolia. A todo esto se debe agregar que C. maxima ssp. andreana es ampliamente reconocida como el ancestro de C. maxima, y que la a b Figura 3. Distribución geográfica de C. maxima ssp. andreana (a) y C. ecuadorensis (b). 16 abeja Peponapis atrata (Smith) Hurd & Linsley, hasta hace poco considerada como un polinizador específico de C. ficifolia, aun no ha sido encontrada en América del Sur. Por otra parte, se ha encontrado que C. ficifolia presenta notables diferencias con respecto a todos los taxa del género a nivel de cromosomas, isoenzimas y ADN. Todos estos datos han conducido a proponer que el pariente silvestre de C. ficifolia pudiera corresponder a una especie no descrita (o quizás extinta) que posiblemente prospere (o haya prosperado) en la región oriental de Los Andes. Aspectos ecogeográficos. La distribución bajo cultivo de Cucurbita ficifolia es muy amplia, abarcando las zonas medias a altas (desde 1000 hasta casi 3000 m) de prácticamente todas las cordilleras o cadenas montañosas de Latinoamérica, desde el norte de México hasta Argentina y Chile La restricción al cultivo en altas elevaciones es un carácter que la distingue de las otras especies domesticadas del género, las cuales en general pueden ser manejadas en un intervalo más amplio de condiciones ecológicas. Los polinizadores de C. ficifolia son, además de la ya mencionada Peponapis atrata, P. pruinosa (Say) Hurd & Linsley, P. smithi Hurd & Linsley, P. apiculata (Cresson) Hurd & Linsley, Xenoglossa fulva Smith y X. gabbii (Cresson) Hurd & Linsley. Cucurbita moschata Origen. Esta especie es anual y, como se mencionó para Cucurbita ficifolia, en alguna época también se pensó que tenía un origen asiático. Desde hace más de medio siglo, sin embargo, es claro que se trata de una especie domesticada en América Latina, aunque tampoco existe acuerdo acerca del área precisa de su domesticación. En ocasiones se ha señalado que fue domesticada en el área mesoamericana o bien se ha sugerido a América del Sur, y más específicamente a Colombia, como su centro de origen. Las evidencias disponibles son difíciles de interpretar con propiedad. Los restos arqueológicos más antiguos de esta especie (4900-3500 A.C.) han sido recuperados en las cuevas de Ocampo, Tamaulipas, en el noreste de México, aunque fechamientos relativamente similares han sido registrados también para algunos sitios de Centroamérica y América del Sur (véase Cuadro 2). Considerando la compatibilidad genética de C. moschata con C. lundelliana (especie de las zonas bajas del sur de México a Nicaragua), también se ha propuesto a ésta última como la más relacionada y, de hecho, existen dos hipótesis acerca del origen de C. moschata. En una de ellas se sugiere que este cultivo pudo haberse originado a partir de poblaciones de C. lundelliana, primero por aislamiento y posteriores por procesos de selección humana, mientras que en la otra se propone que ambas especies pudieran proceder de un ancestro común y que, debido a las presiones de selección humana, C. moschata, se separó rápidamente de dicho ancestro y de C. lundelliana. Uno de los principales argumentos en contra de ambas hipótesis es la capacidad de C. moschata para producir híbridos altamente fértiles con los taxa silvestres del grupo C. argyrosperma. Aunado a esto algunas diferencias morfológicas entre C. lundelliana y C. moschata (p.ej. el color azul-grisáceo-verdoso de las semillas de la primera no se ha encontrado en C. 17 moschata), y las evidencias derivadas de estudios de biología molecular han contribuido a que se descarte a esta especie silvestre como el posible ancestro de C. moschata o de algún otro taxón domesticado del género. Las evidencias lingüísticas y de distribución de la variación bajo cultivo de esta especie tampoco son muy claras. Cucurbita moschata es conocida con nombres nativos tanto en la región mesoamericana (principalmente en México), como en América del Sur. Este hecho, por otra parte, apoya la observación de que ambas regiones son a importantes centros de diversificación de este cultivo. La variación morfológica de C. moschata tampoco parece ser un factor que permita sugerir alguna región en particular como centro de origen, pues se ha reportado como sumamente variable en cuanto a las características de sus frutos y semillas para varias zonas dentro de su área de distribución bajo cultivo en América. Reportes de la existencia en Bolivia y Colombia de poblaciones silvestres de Cucurbita que pudieran estar relacionadas con C. moschata, así como otros del que describen una importante diversidad morfológica en las razas locales de esta especie para el norte de Colombia, sugieren que estas áreas pudieran corresponder al centro de origen de este cultivo. Sin embargo, estas regiones del continente no han sido lo suficientemente exploradas con este objetivo como para emitir una conclusión definitiva. Aspectos ecogeográficos. En América Latina, Cucurbita moschata se cultiva desde hace más de 5000-6000 años (véase Cuadro 2) y es frecuente encontrar en la literatura que se trata de un cultivo que se maneja principalmente en zonas de baja altitud y de clima cálido con alta humedad. Dichos límites altitudinales, sin embargo, parecen no ser tan estrictos, pues en algunos trabajos se indica que el límite altitudinal superior de este cultivo en América del Sur está entre los 2200 y 2300 msnm, lo cual ha sido también registrado en el campo por el responsable del proyecto para la región de la Mixteca Alta en el estado de Oaxaca, México. Grupo Okeechobeensis Taxa constituyentes del grupo, distribución y características importantes. Este grupo está conformado por dos taxa anuales: La subespecie. okeechobeensis, endémica de los pantanos con Annona del suroeste del Lago Okeechobee, Florida, y la subespecie martinezii, la cual sólo es conocida de una relativamente amplia región dentro de la vertiente del Golfo de México, que abarca desde el sur de Tamaulipas, este de San Luis Potosí, Puebla y una buena parte de Veracruz, hasta el norte de Oaxaca y Chiapas (Figura 4). Es una planta de notable adaptación a condiciones ecológicas fuertemente contrastantes, pues igualmente prospera a orillas de arroyos o en zonas con vegetación primaria o secundaria, y desde muy cerca del nivel del mar hasta los 1500 m. En Veracruz, es también muy común encontrarla como arvense en zonas de cafetales, plantaciones de caña de azúcar y otros cultivos. En contraste con la subespecie. okeechobeensis, que es considerada como rara, las plantas de la subespecie. martinezii son relativamente abundantes en toda su área de 18 distribución. La característica más notable para distinguir a los taxa de este grupo de los restantes del género es el color amarillo muy pálido a casi blanco o crema de las corolas de sus flores, además de que presentan semillas de color grisáceoverdoso, un rasgo que sólo comparten con Cucurbita lundelliana, de la cual se hablará más adelante. Importancia de los taxa del grupo. Aunque los miembros de este grupo no son ancestros de ninguno de los taxa domesticados del género, al menos la subespecie. martinezii pudiera tener cierta relevancia para el mejoramiento de los cultivos, ya que se ha encontrado que es resistente a virus que provocan enfermedades importantes, como Cucumber Mosaic Virus, Bean Yellow Mosaic Virus y Tobacco Ringspot Virus. Aunado a esto, se ha encontrado que en condiciones experimentales puede producir híbridos de fertilidad variable con miembros del Grupo Pepo, así como también con C. moschata y algunos taxa silvestres como C. lundelliana y C. ecuadorensis. La subespecie martinezii también tiene importancia regional, pues en San Luis Potosí y Veracruz la pulpa de sus frutos se usa como substituto de jabón. En Veracruz, además, la pulpa se emplea para la curación de heridas y quemaduras, mientras que los frutos secos se usan como sonajas. Su uso medicinal se ha registrado de Chiapas, en donde una infusión de los frutos se emplea para aliviar el dolor de estómago. Cucurbita lundelliana Distribución y características importantes. Esta especie se distribuye desde el sur de México (Tabasco y sur de Campeche, Yucatán y Quintana Roo) hasta Centroamérica, cuando menos hasta Nicaragua (Figura 4). Prospera en altitudes cercanas al nivel del mar, generalmente en bosques tropicales perennifolios y subperennifolios y sobre todo en la vegetación secundaria derivada. También es posible encontrarla en vegetación riparia y como arvense en cultivos de milpa mecanizada. El clima en su área de distribución es cálido-húmedo o subúmedo y los suelos son calizos, arcillosos, relativamente profundos, húmedos o de drenaje algo deficiente, los cuales pueden llegar a inundarse temporalmente. Como se indicó anteriormente, el color azul-verdoso-grisáceo de las semillas de C. lundelliana es una característica que sólo comparte con las dos subespecies del Grupo Okeechobeensis, de las cuales difiere en varios rasgos, como los márgenes de la semilla más engrosados y resaltados, las características generales de sus hojas y frutos, la coloración amarillo-anaranjado brillante de su corola y diferencias más o menos claras en sus fenotipos isoenzimáticos. Adicionalmente, su distribución geográfica es completamente diferente y sus poblaciones alcanzan un límite superior altitudinal mucho menor que los taxa del Grupo Okeechobeensis. Importancia del taxón. Como ya se ha señalado, Cucurbita lundelliana ha sido comúnmente mencionada en la literatura como un vínculo importante entre las especies silvestres y las cultivadas e incluso como ancestro de C. moschata. Esta aseveración se fundamenta en su relativamente amplia compatibilidad reproductiva con muchas de las especies del género, pues en condiciones experimentales se 19 obtienen híbridos de fertilidad variable con C. moschata, C. maxima ssp. máxima, las dos subespecies del Grupo Okeechobeensis y C. ecuadorensis. Sin embargo, estudios recientes han demostrado que esta suposición no es del todo real, al menos en lo que corresponde a sus relaciones con el Grupo Argyrosperma y C. moschata. No obstante, su capacidad de hibridizar con plantas domesticadas y silvestres, aunado al hecho de ser moderada a fuertemente resistente a algunas enfermedades de importancia (Cucumber Mosaic Virus y Tobacco Ringspot Virus) y a su capacidad para habitar suelos de drenaje deficiente, son argumentos para que siempre se le considere como una fuente potencial de genes para el mejoramiento de las especies cultivadas. El único dato de uso regional se ha registrado en la Península de Yucatán, en donde la pulpa de sus frutos se emplea como substituto de jabón y la cáscara de los frutos secos como recipientes. Grupo Digitata Taxa constituyentes del grupo, distribución y características importantes. Este grupo lo constituyen tres especies con raíces perennes (Cucurbita digitata, C. palmata y C. cordata), que habitan en condiciones de aridez extrema, en donde los suelos son arenosos, gravillosos y aluviales de los tipos regosol, litosol, yerdmozol o vertisol en diferentes combinaciones de dominancia. La vegetación en esos sitios corresponde, principalmente, a matorrales desérticos micrófilos o crassicaules, mezquitales y bosques tropicales caducifolios. Los climas por su temperatura se pueden definir como cálidos, muy cálidos, semicálidos o aun templados, mientras que por su humedad como áridos o muy áridos, en ocasiones con periodos de sequía mayores a 20 meses. La segunda especie, Cucurbita digitata, se distribuye desde el suroeste de los Estados Unidos (Arizona, Nuevo México, California) al noroeste de México (Baja California, Sonora y Chihuahua). Por su parte, C. palmata crece desde las planicies y colinas áridas desde los Estados Unidos (Valles de San Joaquín y Sacramento, California al este hacia el sur de Nevada y Arizona y hacia el sur en el Desierto de Colorado), hasta México en la zona baja del Desierto Sonorense y en Baja California. Dentro de su área de distribución coexiste con algunas poblaciones de C. digitata y ya se han registrado híbridos naturales entre ambas especies, lo cual confirma la afinidad de estos taxa reportada para cruzamientos experimentales. Finalmente, C. cordata es endémica de la región centro-sur de la Península de Baja California (Figura 5 a). Importancia de los taxa del grupo. Aunque no se tienen datos etnobotánicos que indiquen el uso de las especies de este grupo en los sitios en donde prosperan, vale la pena destacar que sus semillas cuentan con altas cantidades de aceites y proteínas y que algunas de sus colecciones de germoplasma han mostrado ser resistentes a enfermedades virales que afectan severamente a los taxa 20 Figura 4. Distribución geográfica de Cucurbita lundelliana y los taxa del grupo Okeechobeensis. 21 domesticados del género, como Clover Yellow Vein Virus, Bean Yellow Mosaic Virus, Cucumber Mosaic Virus, Tomato Ringspot Virus y Tobacco Ringspot Virus. Desafortunadamente, debido a la incompatibilidad genética que estas especies tienen con las domesticadas, es prácticamente imposible considerarlas de manera inmediata para fines de mejoramiento. Grupo Foetidissima Taxa constituyentes del grupo, distribución y características importantes. En este grupo se incluyen cuatro especies perennes (C. foetidissima, C. pedatifolia, C. radicans y C. x scabridifolia). La primera de ellas, Cucurbita foetidissima, está ampliamente distribuida desde los Estados Unidos (Nebraska, Missouri, Kansas a Colorado y Utah a Nevada, Texas, Nuevo México y California) hasta el centro de México (desde Sonora a Tamaulipas y hasta Guanajuato, Querétaro y los alrededores de la ciudad de México). Cucurbita pedatifolia, por su parte, es endémica de una pequeña área de México que comprende parte de los estados de Guanajuato, Hidalgo, Puebla, Querétaro y Oaxaca. Prospera en zonas secas y frías con altitudes mayores a los 1350 msnm, en donde la vegetación puede ser desde bosques de Pinus-Juniperus-Quercus y algunas Cactaceae, hasta matorrales xerófilos con Opuntia, Cylindropuntia, Myrtillocactus, Ferocactus, Yucca, Zaluzania, Condalia, Prosopis, etc. La tercera especie del grupo, Cucurbita pedatifolia, es también endémica de México y crece al menos en los estados de Michoacán, Jalisco y Estado de México, y en otras épocas llegó a crecer en las inmediaciones de la ciudad de México. Todas estas localidades forman parte del Eje Neovolcánico Transversal Mexicano, en donde se presentan altitudes generalmente mayores a los 1500 m y climas relativamente secos y fríos (Figura 5 b). En la actualidad, Cucurbita radicans prospera generalmente en sitios en los que la vegetación ha sido perturbada por diversas actividades humanas. En algunas regiones de los estados de Michoacán y Jalisco, por ejemplo, es común encontrarla como arvense en milpas con cultivo de maíz y especies domesticadas (C. ficifolia, C. argyrosperma, C. moschata y C. pepo). Sin embargo, no obstante esta frecuente coexistencia con las especies cultivadas, la mayor cantidad de la información etnobotánica recopilada, nuestras observaciones de campo y los estudios de tipo biosistemático indican que Cucurbita radicans no parece ser capaz de hibridizar exitosamente con ninguna de las plantas domesticadas. Finalmente, C. x scabridifolia es también endémica de México y coincide en su área de distribución con C. foetidissima en los estados de Coahuila, Tamaulipas, San Luis Potosí, Querétaro e Hidalgo y en los tres últimos estados también con C. pedatifolia. Su origen híbrido a partir de estas dos especies fue esclarecido desde el siglo pasado y desde entonces se hace evidente mediante la inclusión de la “x” en su nombre científico. Importancia de los taxa del grupo. En el estado de Chihuahua una infusión de los frutos de C. foetidissima se usa para la curación de enfermedades estomacales. También en este estado las semillas se emplean para elaborar bebidas refrescantes y las raíces se emplean en baños como febrífugas y en 22 infusión como emético o para aliviar dolores de cabeza y como substituto de jabón. a b Figura 5. Distribución geográfica de los taxa de los grupos Digitata (a) y Foetidissima (b). 23 Este último uso es también común en los estados de Coahuila y Nuevo León. Adicionalmente, en Hidalgo las semillas se usan para aliviar padecimientos urinarios. Además de estos usos que muestran su importancia regional, los relativamente altos contenidos de aceites (30.4%) y proteínas (35.4%) de sus semillas y de almidones (52%) en sus raíces, han llevado a sugerirla como un recurso potencialmente muy importante para ser explotado como un nuevo cultivo en áreas de extrema aridez. La importancia de las restantes especies del grupo es considerablemente menor a la registrada para C. foetidissima. Por ejemplo, en el Valle de Tehuacán-Cuicatlán los frutos de Cucurbita pedatifolia se usan como substituto de jabón y al parecer en el pasado sus semillas fueron un recurso comestible importante, pues se han encontrado en varios sitios arqueológicos de la región. Adicionalmente, esta especie es resistente a varias enfermedades virales y una de las pocas del género que pueden hibridizar con C. ficifolia. Sin embargo, las progenies obtenidas en estos cruzamientos nunca alcanzan la segunda generación y, al igual que las restantes especies perennes del género, tiene escasa compatibilidad genética con los restantes taxa domesticados, lo cual impide su utilización en su mejoramiento. No se tiene información etnobotánica sobre el uso de C. radicans, mientras que la única información registrada para Cucurbita scabridifolia corresponde al uso de sus frutos como juguete. 4. Conclusiones Los centros de origen de las plantas domesticadas son aquellas regiones donde se inició su proceso de domesticación y de donde son nativos los parientes silvestres de los que se originaron. Las evidencias más importantes que se emplean para documentar estos aspectos son la taxonomía con todas sus herramientas disponibles (anatomía, palinología, macromorfología, ecología, biología molecular, etc.) y la arqueología, referida principalmente al descubrimiento, identificación y fechamiento de materiales de las plantas domesticadas y/o sus parientes silvestres. En el caso de Cucurbita todas estas fuentes coinciden en señalar al continente americano como la región del mundo de donde son originarios los taxa silvestres y domesticados de este género y a México como el centro de origen del género, pues dentro de sus límites geográficos prosperan 15 de los 20 taxa que lo conforman. Entre ellos se incluyen cuatro de los taxa domesticados (C. argyrosperma ssp. argyrosperma, C. pepo ssp. pepo, C. ficifolia y C. moschata), así como dos de sus ancestros silvestres (C. fraterna ssp. fraterna y C. argyrosperma ssp. sororia) y 9 taxa silvestres relacionados con las plantas domesticadas en mayor (C. okeechobeensis ssp. martinezii y C. lundelliana) o menor grado (todas las de los grupos Digitata y Foetidissima). Desde el punto de vista arqueológico, México también es sumamente importante para fortalecer lo anteriormente señalado, pues los restos más antiguos conocidos de tres de las plantas domesticadas del género (C. argyrosperma ssp. argyrosperma, C. pepo ssp. pepo y C. moschata) también se han recuperado dentro de sus límites. Otras 24 fuentes de evidencia que permitirán confirmar estas aseveraciones serán analizadas en los siguientes informes del proyecto. 5. Bibliografía Consultada Alvarado, J.L., R. Lira & F. Sánchez-Martínez. 2000. Calabazas. Domesticación Investigación y Ciencia (España) 290: 36-37. Andres, T. C. 1985. Biosystematic relationship between Cucurbita ficifolia Bouche, a domesticated squash, and the wild species, C. foetidissima HBK and C. pedatifolia Bailey. Amer. J. Bot. 72: 872. Andres, T. C. 1987a. Cucurbita fraterna, the closest wild relative and progenitor of C. pepo. Cucurbit Genet. Coop. Rep. 10: 69-71. Andres, T. C. 1987b. Hybridization of Cucurbita foetidissima with C. pedatifolia, C. radicans, and C.ficifolia. Cucurbit Genet. Coop. Rep. 10: 72-73. Andres, T. C. 1987c. Relationship of Cucurbita scabridifolia to C. foetidissima and C. pedatifolia, a case of natural interspecific hybridization. Cucurbit Genet. Coop. Rep. 10: 74-75. Andres, T. C. 1990. Biosystematics, Theories on the Origin, and Breeding Potencial of Cucurbita ficifolia. In: D. M. Bates, R.W. Robinson, & C. Jeffrey (Eds.), Biology and Utilization of the Cucurbitaceae (pp. 102-119). Cornell Univ. Press, Ithaca, NY. Andres, T. C. & G.P. Nabhan. 1988. Taxonomic rank and rarity of Cucurbita okeechobeensis. FAO/IBPGR Pl. Genet. Res. Newsletter 75/76: 21-22. Anónimo. 1989. Squashes and Their Relatives. In: Anónimo (Eds.), Lost Crops of the Incas. Little Known Plants of the Andes with Promise for Worldwide Cultivation (pp. 203-209). National Academy Press, Washington D.C. Argueta, V.A., (Comp). 1994. Atlas de las Plantas de la Medicina Tradicional Mexicana, vol. 3. Instituto Nacional Indigenista, Mexico. Asch, D. L. & N. E. Asch. 1985. Prehistoric plant cultivation in West-Central Illinois. In: R. I. Ford (Eds.), Prehistoric Food Production in North America (pp. 149-204). Ann. Arbor, Michigan. Azurdia, C. A. & M. González. 1986. Informe Final del Proyecto de Recolección de Algunos Cultivos Nativos de Guatemala. Facultad de Agronomía, Universidad de San Carlos, Guatemala. Ayala Nieto, M., R. Lira & J.L. Alvarado. 1988. Morfología polínica de las Cucurbitaceae de la Península de Yucatán. Pollen et Spores 30: 5-28. Baggett, J. R. 1979. Attempts to cross Cucurbita moschata (Duch.) Poir. "Butternut" and C.pepo L. 'Delicata'. Cucurbit Genetics Cooperative Report 2: 32-34. Bailey, L.H. 1902. A medley of pumpkins. Mem. Hort. Soc. N.Y. 1: 117-124. Bailey, L. H. 1929. The domesticated cucurbitas. First paper. Gent. Herb. 2: 61-115. Bailey, L. H. 1930. Three discussions in Cucurbitaceae. Gent. Herb. 2: 175-186. Bailey, W. K. 1939. Vegetative reproduction of squash types. Science 89: 128-129. Bemis, W. P. & T. W. Whitaker. 1965. Natural Hybridization between Cucurbita digitata and C. palmata. Madroño 18: 39-47. Bailey, L. H. 1943. Species of Cucurbita. Gent. Herb. 7: 267-316. Bailey, L. H. 1948. Jottings in the cucurbitas. Gentes Herbariorum 7: 449-477. 25 Bailey, L. H. 1949. Manual of Cultivated Plants. Macmillan, New York. Bemis, W. P. 1963. Interspecific hybridization in Cucurbita. II. C. moschata Poir. x xerophytic species of Cucurbita. J. Heredity 54: 285-289. Bemis, W. P. 1970. Polyploid hybrids from the cross Cucurbita moschata (Lam.) Poir. x C. foetidissima H.B.K. J. HortScience 95: 529-531. Bemis, W. P. 1973b. Triple haploids in Cucurbita. Journal of Heredity 64: 103-104. Bemis, W. P. 1978. The versatility of the feral buffalo gourd, Cucurbita foetidissima HBK. Cucurbit Genet. Coop. Rep. 1: 25. Bemis, W. P. & J.M. Nelson. 1963. Interspecific hybridization within the genus Cucurbita. I. Fruit set, seed and embryo development. J. Arizona Acad. Sc. 2: 104-107. Bemis, W. P. & T.W. Whitaker. 1965. Natural hybridization between Cucurbita digitata and C. palmata. Madroño 18: 39-47. Bemis, W. P. & T.W. Whitaker. 1969. The xerophytic Cucurbita of northwestern Mexico and southwestern United States. Madroño 20: 33-41. Bemis, W. P., A.M. Rhodes, T.W. Whitaker & S.G. Carmer. 1970. Numerical taxonomy applied to Cucurbita relationships. Amer. J. Bot. 57: 404-412. Bemis, W. P. J.W. Berry, C.W. Weber & T.W. Whitaker. 1978a. The buffalo gourd: a new potential horticultural crop. HortScience 13: 235-240. Bemis, W. P. L.C. Curtis, C.W. Weber & J.W. Berry 1978b. The feral buffalo gourd, Cucurbita foetidissima. Econ. Bot. 32: 87-95. Bemis, W. P., J.W. Berry & C.W. Weber. 1979a. The buffalo gourd: a potential arid land crop. In: G. A. Ritchie (Eds.), New Agricultural Crops (pp. 65-87). Westview Press, Boulder, CO. Bemis, W. P., J.W. Berry & C.W. Weber. 1979b. Domestication studies with the feral buffalo gourd. In: J. R. Goodin & D.K. Northington (Eds.), Arid Land Plant Resources (pp. 371-383). International Center for Arid and Semi Arid Land Studies, Lubbock,TX. Brücher, H. 1989. Useful Plants of Neotropical Origin and Their Wild Relatives. Sprenger Verlag, New York. Bukasov, S. M. 1981. Las Plantas Cultivadas de Mexico, Guatemala y Colombia. CATIE-GTZ, Turrialba, Costa Rica. Canto-Aguilar, M. A. y Parra-Tabla, V. 2000. Importante of conserving alternative pollinators: assesing the pollination efficiency of the squash bee, Peponapis moschata (Cucurbitaceae). Journal of Insect Conservation 4: 203-210. Cárdenas, M. 1944. Las cucurbitas cultivadas de Bolivia. Rev. Agr. (Cochabamba) 2: 3-12. Castetter, E. F. 1930. Species crosses in the genus Cucurbita. Amer. J. Bot. 17: 41-57. Castetter, E. F. & A.T. Erwin. 1927. A systematic study of the squashes and pumpkins. Iowa Agr. Exp. St. Bull. 244: 107-135. Castetter, E. F. & W.H. Bell. 1942. Pima and Papago Indian Agriculture. Univ. of New Mexico Press, Albuquerque. Castetter, E. F. & W.H. Bell. 1951. Yuman Indian Agriculture. Univ. of New Mexico Press, Albuquerque. Castillo, R. et al. 1989. Catálogo de datos pasaporte de colecciones de germoplasma de varios cultivos. INIAP. Quito, Ecuador. 26 Cogniaux, A. 1881. Cucurbitacées. In: A. De Candolle & C. De Candolle (Eds.), Monographiae Phanerogamarum (pp. 325-951). G. Masson, Paris. Conard, N., D.L. Asch, N.B. Asch, D. Elmore, H. Gove, M. Rubin, J.A. Brown, M.D. Wiant, K.B. Farnsworth & T.G.Cook,1984. Accelerator radiocarbon dating of evidence for prehistoric horticulture in Illinois. Nature 308: 443-446. Contardi, H. 1939. Estudios genéticos en Cucurbita y consideraciones agronómicas. Physis 18: 331-347. Contardi, H. G. 1940. Inventario de las variaciones observadas en los frutos de una población de zapallos (Cucurbita pepo L.). An. Inst. Fitotécn. Santa Catalina 1: 187-199. Cutler, H. C. & T.W. Whitaker. 1961. History and distribution of the cultivated cucurbits in the Americas. Amer. Ant. 26: 469-485. Cutler, H. C. & T.W. Whitaker. 1969. A new species of Cucurbita from Ecuador. Ann Missouri Bot. Gard.55: 392-396. Chakravarty, H. L. 1990. Cucurbits of India and Their Role in the Development of Vegetable Crops. In: D. M. Bates, R.W. Robinson & C. Jeffrey (Eds.), Biology and Utilization of the Cucurbitaceae (pp. 325-334). Cornell Univ. Press, Ithaca, NY. Chomko, S. A. & G.W. Crawford. 1978. Plant husbandry in prehistoric eastern North America: New evidence for its development. Amer. Ant. 43: 405-408. Decker, D. S. 1985. Numerical analysis of allozyme variation in Cucurbita pepo. Econ. Bot. 39: 300-309. Decker, D. S. 1986. A Biosystematic Study of Cucurbita pepo. Ph.D., Texas A & M University, College Station, TX. Decker, D. S. 1988. Origin (s), evolution, and systematics of Cucurbita pepo. Econ. Bot. 42: 4-15. Decker, D. S. & H.D. Wilson. 1986. Numerical analysis of seed morphology in Cucurbita pepo. Syst. Bot. 11: 595-607. Decker, D. S. & H.D. Wilson. 1987. Allozyme variation in the Cucurbita pepo complex: C.pepo var. ovifera vs. C.texana. Syst. Bot. 12: 263-273. Decker, D. S. & L.A. Newsom. 1988. Numerical analysis of archaeological Cucurbita seeds from Hontoon Island, Florida. J. Ethnobiology 8: 35-44. Decker Walters, D. 1990. Evidence for Multiple Domestications of Cucurbita Pepo. In: D. M. Bates, R.W. Robinson, & C. Jeffrey (Eds.), Biology and Utilization of the Cucurbitaceae (pp. 96-101). Cornell Univ. Press, Ithaca, NY. Decker Walters, D. S. & T.W. Walters. 1988. 1987 germplasm collections of cultivated cucurbits from China and Hong Kong. Cucurbit Genet. Coop. Rep. 11: 93-94. Decker Walters, D. S. & T.W. Walters. 1989. Cladistics and isozymes: Phylogeny in Cucurbita. Amer. J. Bot., Supplement 76: 236. Decker Walters, D., T. Walters & H. Wilson. 1988. Allozymic evidence of natural hybridization between domesticated species of Cucurbita. Amer. J. Bot. 75: 168-169. Decker-Walters, D. S, T. W. Walters, U. Posluszny & P. G. Kevan. 1990. Genealogy and gene flow among annual domesticated species of Cucurbita. Canadian J. Bot. 68: 782-789. Decker-Walters, D., T.W. Walters, C. W. Cowan & B. D. Smith. 1993. Isozymic 27 chacterization of wild populations of Cucurbita pepo. J. Ethnobiology 13: 5572. Decker-Walters D. S, J. E. Staub, S. M. Chung, E. Nakata & H. D. Quemada. 2002. Diversity in free-living populations of Cucurbita pepo (Cucurbitaceae) as assessed by Random Amplified Polymorphic DNA. Syst. Bot. 27: 19-28. De Vaulx, R. 1980. Realization of the interspecific hybridization (F1 and BC1) between Cucurbita pepo and C.ecuadorensis. Cucurbit Genet. Coop. Rep.3: 42. De Vaulx, R. D. & M. Pitrat. 1979. Interspecific Cross between Cucurbita pepo and C. martinezii. Cucurbit Genet. Coop. Rep.2: 35. De Veaux, J. & E.B. Schultz, J. 1985. Development of buffalo gourd (Cucurbita foetidissima) as a semiarid land starch and oil crop. Econ. Bot. 39: 454-472. Eben, A., M., E. Barbercheck & M. Aluja. 1997. Mexican Diabroticite beetles (Chrysomelidae: Galerucinae): II. Laboratory tests for the preference of cucurbitacins. Entomologia Experimentalis et Applicata 82: 63-72. Ellstrand, N. C., H. C. Prentice & J. F. Hancock. 1999. Gene flow and introgression from domesticated plants into their wild relatives. Ann. Rev. Ecol. Syst. 30: 539-563. Erwin, A. T. 1930. The nativity of the pumpkins. Science 71: 483-484. Erwin, A. T. 1936a. Nativity of Cucurbita maxima. Iowa J. Sci. 10: 441-446. Erwin, A. T. 1936b. Notes on Cucurbita moschata, Duch. Iowa J. Sci. 10: 213-221. Erwin, A. T. 1938. An interesting Texas cucurbit, Cucurbita pepo L. var. ovifera Alef. (C. texana Gray.). Iowa J. Sci. 12: 253-261. Erwin, A. T. & E.S. Haber. 1929. Species and varietal crosses in Cucurbits. Iowa Agr. Exp. St. Bull. 263: 344-372. Erwin, A. T. & E.P. Lana. 1956. The Seminole pumpkin. Econ. Bot. 10: 33-37. Esquinas-Alcazar, J. T. & P. J. Gulick. 1983. Genetic Resources of Cucurbitaceae: A Global Report. IBPGR Secretariat, Rome. Esquivel, M. et al. 1992. Inventory of the Cultivated Plants. In: K. Hammer, M. Esquivel, & H. Knüpffer (Eds.), Origin, Evolution and Diversity of Cuban Plant Genetic Resources (pp. 213-454). Institut für Pflanzengenetik und Kulturpflanzenforschung, Gartesleben, Germany. Ferguson, J. E. et al. 1983. A report of cucurbitacin poisoning in humans. Cucurbit Genet. Coop. Rep.6: 73-74. Ferguson, J. E. & R. L. Metcalf. 1985. Cucurbitacins: plant derived defense compounds for Diabroticites (Coleoptera: Chrysomelidae). J. Chem. Ecol. 11: 311-318. Fritz, G.J. 1994. Precolumbian Cucurbita argyrosperma ssp. argyrosperma in the eastern woodlands of North America. Econ. Bot. 48: 280-292. Fursa, T. B. & A. I. Filov. 1982. Cucurbitaceae. In: O. N. Korovina and T.B. Fursa (Eds.). Flora of Cultivated Plants Kolos, Moscow. Gathman, A. C. & W.P. Bemis. 1990. Domestication of Buffalo Gourd, Cucurbita foetidissima. In: D. M. Bates, R.W. Robinson, & C. Jeffrey (Eds.), Biology and Utilization of the Cucurbitaceae (pp. 335-348). Cornell Univ. Press, Ithaca, NY. Groff, D. & W.P. Bemis. 1967a. Bivalent frequencies in interspecific hybrids from three xerophytic species of Cucurbita. Southw. Naturalist 12: 365-368. 28 Groff, D. & W.P. Bemis. 1967b. Meiotic irregularities in Cucurbita species hybrids. J. Heredity 58: 109-111. Hunziker, A. T. & R. Subils. 1975. Sobre la importancia taxonómica de los nectarios foliares en especies silvestres y cultivadas de Cucurbita. Kurtziana 8: 43-47. Hunziker, A. T. & R. Sublis. 1981. Nuevos datos sobre los nectarios foliares en Cucurbita y su importancia taxonómica. Kurtziana 14: 137-140. Hurd, P. D. & E.G. Linsley. 1964. The squash and gourd bees - Genera Peponapis Robertson and Xenoglossa Smith - Inhabiting America North of Mexico (Hymenoptera:Apoidea). Hilgardia 35: 375-477. Hurd, P. D. & E.G. Linsley. 1967. South American squash and gourd bees of the genus Peponapis (Hymenoptera:Apoidea). Ann. Entomol. Soc. America 60: 647-661. Hurd, P. D. & E.G. Linsley. 1970. A classification of the squash and gourd bees Peponapis and Xenoglossa. Calif. Publ. Entomol. 62: 1-39. Hurd, P. D., Jr., E. G. Linsley & T. W. Whitaker. 1971. Squash and gourd bees (Peponapis, Xenoglossa) and the origin of the cultivated Cucurbita. Evolution 25: 218-234. Jeffrey, C. 1990b. Systematics of the Cucurbitaceae: An Overview. In: D. M. Bates, R.W. Robinson, & C. Jeffrey (Eds.), Biology and Utilization of the Cucurbitaceae (pp. 3-9). Cornell Univ. Press, Ithaca, NY. Jeffrey, C. & B. Trujillo. 1992. Cucurbitaceae. In: G. Morillo (Eds.), Flora de Venezuela (pp. 11-201). Fondo Editorial Acta Científica Venezolana, Caracas, Venezuela. Kay, M., F. B. King & C. K. Robinson. 1980. Cucurbits from Phillips Spring: New evidence and interpretations. Amer. Ant. 45: 806-822. Kirkpatrick, K. J. et al. 1985. Allozyme differentiation in the Cucurbita pepo complex: C.pepo var. medullosa vs. C.texana. Econ. Bot. 39: 289-299. Kirkpatrick, K. J. & H. D. Wilson. 1988. Interspecific gene flow in Cucurbita: C. texana vs. C. pepo. Amer. J. Bot. 75: 519-527. Lentz, D. L., M. Deland-Pohl, J.L. Alvarado, S. Tarighat & R. Bye. 2008. Sunflower (Helianthus annuus L.) as a pre-Columbian domesticate in Mexico. Proc. Natl. Acad. Sci. 105: 6232-6237. Lira, R. 1985. Identidad taxonómica de las calabazas cultivadas (Cucurbita spp.) en la Peninsula de Yucatan. Biotica 10: 301-307. Lira, R. 1990. Estudio Taxonómico y Ecogeográfico de las Cucurbitaceae de Latinoamérica (1er Rep. Semestral). International Board for Plant Genetic Resources. Roma, Italia. Lira, R. 1991a. Estudio Taxonómico y Ecogeográfico de las Cucurbitaceae de Latinoamérica (2o Rep. Semestral). International Board for Plant Genetic Resources. Roma, Italia. Lira, R. 1991b. Estudio Taxonómico y Ecogeográfico de las Cucurbitaceae de Latinoamérica (3er Rep. Semestral). International Board for Plant Genetic Resources. Roma, Italia. Lira, R. 1992. Estudio Taxonómico y Ecogeográfico de las Cucurbitaceae de Latinoamérica (4o Rep. Semestral). International Board for Plant Genetic 29 Resources. Roma, Italia. Lira, R. 1995. Estudios Taxonómicos y Ecogeográficos de las Cucurbitaceae Latinoamericanas de Importancia Económica: Cucurbita, Sechium, Sicana y Cyclanthera. Systematic and Ecogeographic Studies on Crop Gene Pools. 9. International Plant Genetic Resources Institute. Rome, Italy. 281p. Lira, R. 1996. Calabazas de México. Ciencias 42: 52-55. Lira, R. 2001. Cucurbitaceae. In: Flora del Bajío y Regiones Adyacentes. 92. Instituto de Ecología A.C. Centro Regional del Bajío. Pátzcuaro, Mich. 120 p. Lira, R. 2004. Cucurbitaceae de la Península de Yucatán: Taxonomía, Florística y Etnobotánica. Etnoflora Yucatanense 22. Universidad Autónoma de Yucatán / CONACyT. Mérida, Yucatán, México. 312 p. Lira, S. R. & S. Montes-Hernández. 1992. Cucúrbitas (Cucurbita spp.). In: J. E. Hernández B. & J. León. (eds.). Cultivos Marginados, Otra Prespectiva de 1942. Colección FAO: Producción y Protección Vegetal No. 26. (pp. 61-75) Roma, Italia. Lira, R. & R. Bye. 1997. Las cucurbitáceas en la alimentación de los dos mundos. In: Long J. (Coord.). Conquista y Comida. Consecuencias del Encuentro de Dos Mundos (pp 198-226). Universidad Nacional Autónoma de México. México. Lira, R. & I. Rodriguez. 1999. Cucurbitaceae. Fascículo 22. Flora del Valle de Tehuacan-Cuicatlan. Instituto de Biología, UNAM. 61 p. Lira, R. & R. Mcvaugh. 2001. Cucurbita. In: R. McVaugh. Cucurbitaceae. In: W. Anderson (ed.). Flora Novogaliciana. A Descriptive Account of the Vascular Plants of Western Mexico. Vol. 3. (pp. 510-529). University of Michigan Herbarium. Ann Arbor, USA. Lira, R. & J. Caballero. 2002. Ethnobotany of the wild Mexican Cucurbitaceae. Econ. Bot. 56: 380-398. Lira, R., J. Caballero & P. Davila. 1997. A contribution to the generic delimitation of Sechium P.Br. (Sicyinae, Cucurbitaceae). Taxon 46: 269-282. Lira, R., J.L. Villaseñor & P. Davila. 1997. A cladistic analysis of the subtribe Sicyinae (Cucurbitaceae). Syst. Bot. 22: 415-425. Lira, R., J.L. Villaseñor & E. Ortíz. 2002. A proposal for the conservation of the family Cucurbitaceae in Mexico. Biodivers. Conserv. 11: 1699-1720. Lira, R., C. Rodríguez, J.L. Alvarado, I. Rodríguez, J. Castrejón & A. DomínguezMariani. 1998. Diversidad e importancia de la familia Cucurbitaceae en México. Acta Botánica Mexicana 42: 43-77. Mariano, N. & R. Dirzo. 2002. Cucurbita argyrosperma ssp. sororia (L. H. Bailey) Merrick & Bates (Cucurbitaceae). Agüichichi. En: F. Noguera Martínez, J. Vega Rivera, A. N. García Aldrete & M. Quesada Avendaño (eds.). Historia Natural de Chamela. Instituto de Biología, UNAM. México, p 167-170 Martínez-Crovetto, R. 1954. Synopsis des Cucurbitacées de l'Uruguay. Notul. Systematic (París) 15: 47-55. Martínez-Crovetto, R. 1965. Cucurbitaceae. In: A. L. Cabrera (Eds.), Flora de la Provincia de Buenos Aires (pp. 390-407). Colección Científica del I.N.T.A., Buenos Aires. Martínez-Crovetto, R. 1974. Cucurbitaceae. In: A. Burkart (Eds.), Flora Ilustrada de Entre Ríos (Argentina) (pp. 63-94). Colección Científica del I.N.T.A., Buenos 30 Aires. McKay, J. W. 1931. Chromosome studies in the Cucurbitaceae. Univ. Calif. Publ. Bot. 16: 339-350. Merrick, L. C. 1988. Evaluation of patterns of genetic diversity provides insight about the evolutionary history of cultivated Cucurbita. HortScience 23: 676. Merrick, L. C. 1990. Systematics and evolution of a domesticated squash, Cucurbita argyosperma, and its wild and weedy relatives. In: D. M. Bates, R.W. Robinson, and C. Jeffrey (Eds.), Biology and Utilization of the Cucurbitaceae (pp. 77-95). Cornell Univ. Press, Ithaca, NY, USA. Merrick, L. C. 1991. Systematics, evolution, and ethnobotany of a domesticated squash, its wild relatives and allied species in the genus Cucurbita. PhD. Thesis Cornell University, Ithaca, NY, USA, 315 p. Merrick, L. C. 1995. Squash, pumpkins, and gourds: Cucurbita (Cucurbitaceae). In J. Smart and N. W. Simmonds (eds.). Evolution of Crop Plants, 2nd edition Longman. London pp 97-105. Merrick, L. C. & G. P. Nabhan. 1985. Natural hybridization of wild and cultivated Cucurbita in Mexico: implications for crop evolution. Ecol. Soc. Amer. Bull. 66: 231. Merrick, L. C. & D. M. Bates. 1989. Classification and nomenclature of Cucurbita argyrosperma Huber. Baileya 23: 94-102. Millán, R. 1945. Variaciones del zapallito amargo Cucurbita andreana y el origen de Cucurbita maxima. Rev. Argentina Agron. 12: 86-93. Millán, R. 1947. Los zapallitos de tronco de sudamérica extratropical. Darwiniana 7: 333-345. Montes, H. S. 2002. Flujo génico en calabaza (Cucurbita spp.) dentro del sistema milpa en el occidente de México. Tesis Doctoral. Facultad de Ciencias, Universidad Nacional Autónoma de México. 107 p. Montes-Hernández, S. & L. E. Eguiarte. 2002. Genetic structure and indirect estimates of gene flow in three taxa of Cucurbita in western Mexico. Amer. J. Bot. 89: 1156-1163. Montes-Hernández, S., Laura C. Merrick & Luis E. Eguiarte. 2005. Maintenance of squash (Cucurbita spp.) landrace diversity by farmers’ activities in Mexico. Genet. Res. Crop Evol. 52: 697-707. Nabhan, G. P. 1984. Evidence of gene flow between cultivated Cucurbita mixta and a field edge population of wild Cucurbita at Onavas, Sonora. Cucurbit Genet. Coop. Rep. 7: 76. Nee, M. 1990. The domestication of Cucurbita (Cucurbitaceae). Econ. Bot. 44: 5658. Okoli, B. E. 1984. Wild and cultivated cucurbits in Nigeria. Econ. Bot. 38: 350-357. Paris, H. S. 1989. Historical records, origins, and development of the edible cultivar groups of Cucurbita pepo (Cucurbitaceae). Econ. Bot. 43: 423-443. Paris, H. S., N. Yonash, V. Portnoy, N. Mozes-Daube, G. Tzuri, and N. Katzir. 2003. Assessment of genetic relationships in Cucurbita pepo (Cucurbitaceae) using DNA markers. Theor. Appl. Genet. 106: 971-978. Parodi, L. R. 1935. Relaciones de la agricultura prehispánica con la agricultura argentina actual. An. Acad. Nac. Agron. Vet. Buenos Aires 1: 115-167. Provvidenti, R. 1990. Viral Diseases and Genetic Sources of Resistance in 31 Cucurbita Species. In: D. M. Bates, R.W. Robinson, & C. Jeffrey (Eds.), Biology and Utilization of the Cucurbitaceae (pp. 427 435). Cornell Univ. Press, Ithaca, NY. Puchalski, J. T., and R.W. Robinson. 1990. Electrophoretic Analysis of Isozymes in Cucurbita and Cucumis and its Application for Phylogenetic Studies. In: D. M. Bates, R.W. Robinson, and C. Jeffrey (Eds.), Biology and Utilization of the Cucurbitaceae (pp. 60-76). Cornell Univ. Press, Ithaca, NY. Rhodes, A. M. et al. 1968. A numerical taxonomic study of Cucurbita. Brittonia 20: 251-266. Robinson, R. W. & J.T. Puchalski. 1980a. Synonomy of Cucurbita martinezii and C. okeechobeensis. Cucurbit Genet. Coop. Rep. 3: 45-46. Robinson, R. W., and D. S. Decker-Walters. 1997. Cucurbits. Crop Production Science in Horticulture No. 6. CAB International, Cambridge, U. K. 226 p. Rodríguez, I., and R. Lira. 1992. Diversidad, biología reproductiva y relaciones de Cucurbita fraterna L.H. Bailey, con especies cultivadas del género. In: Resúmenes Simposio Etnobotánica 92, (pp. 347). Córdoba, España: Jardines Botánicos de Córdoba. Roy, R. P., and S. Saran. 1990. Sex expression in the Cucurbitaceae. In Biology and utilization of the Cucurbitaceae. Ed. D. M. Bates, R. W. Robinson, C. Jeffrey. Comstock Publishing Associates. Cornell University Press. Ithaca and London. Sánchez Martínez, F., J. L. Alvarado & L. Morett-Alatorre.1998. Las cuevas del Gallo y de la Chagüera. Inventario arquebotánico e inferencias. Arqueología 19: 81–89. Sanjur, O. I., D. R. Piperno, T. C. Andres, and L. Wessel-Beaver. 2002. Phylogenetic relationships among domesticated and wild species of Cucurbita (Cucurbitaceae) inferred from a mitochondrial gene: Implications for crop plant evolution and areas of origin. Proc. Nat. Acad. Sci. 99: 535540. Singh, A.K. 1990. Cytogenetics and evolution in the Cucurbitaceae. In: D.M. Bates, R.W. Robinson, and C. Jeffrey (Eds.), Biology and utilization of the Cucurbitaceae (pp. 10-28). Cornell Univ. Press, Ithaca, NY. Smith, B. 2005. Reassessing Coxcatlan Cave and the early history of domesticated plants in Mesoamerica. Proc. Nat. Acad. Sci. 102: 9438-9445. Tapley, W.T., W.D. Enzie & G.P. van Eseltine 1937. The Vegetables of New York. Part IV. N.Y. Agric. Exp. Sta., Geneva, NY. 131 p. Tepedino, V. J. 1981. The pollination efficiency of the squash bee (Peponapis pruinosa) and the honey bee (Apis mellifera) on summer squash (Cucurbita pepo). J. Kansas Entomol. Soc. 54: 359-377. Turner, B.L. & C. Miksicek. 1984. Economic plant species associated with prehistoric agriculture in the Maya Lowlands. Econ. Bot. 38: 179-193. Walters, T. 1989. Historical overview on domesticated plants in China with special emphasis on the Cucurbitaceae. Econ. Bot. 43: 279-313. Walters,T. W. & D. Decker Walters. 1993. Systematics of the endangered Okeechobee gourd (Cucurbita okeechobeensis: Cucurbitaceae). Syst. Bot. 18: 175-187. Weeden, N. F. 1984. Isozyme studies indicate that the genus Cucurbita is an ancient 32 tetraploid. Cucurbit Genet. Coop. Rep. 7: 84-85. Weeden, N. F., and R. W. Robinson. 1990. Isozyme studies in Cucurbita. In: D. M. Bates, R.W. Robinson, and C. Jeffrey (Eds.), Biology and Utilization of the Cucurbitaceae (pp. 51-59). Cornell Univ. Press, Ithaca, NY. Whitaker, T. W. 1933. Cytological and phylogenetic studies in the Cucurbitaceae. Bot. Gaz. 94: 780-790. Whitaker, T. W. 1947. American origin of the cultivated cucurbits. Ann. Missouri Bot. Gard. 34: 102-111. Whitaker, T. W. 1959. An interspecific cross in Cucurbita (C. lundelliana Bailey x C.moschata Duch.). Madroño 15: 4-13. Whitaker, T. W. 1968. Ecological aspects of the cultivated Cucurbita. HortScience 3: 9-11. Whitaker, T. W. 1980. Cucurbitáceas americanas útiles al hombre. Comisión de Investigaciones Científicas, La Plata. Whitaker, T. W. 1981. Archaeological cucurbits. Econ. Bot. 35: 460-466. Whitaker, T. W. 1983. Cucurbits in Andean prehistory. Amer. Ant. 48: 576-585. Whitaker, T. W. & G. N. Davis. 1962. Cucurbits, Botany, Cultivation and Utilization. Interscience Publishers, Inc. New York. 250 p. Whitaker, T. W. & G. W. Bohn 1950. The taxonomy, genetics, production and uses of the cultivated species of Cucurbita. Econ. Bot. 4: 54-81. Whitaker, T. W. & H. C. Cutler. 1965. Cucurbits and cultures in the Americas. Econ. Bot. 19: 344-349. Whitaker, T. W. & J. B. Bird. 1949. Identification and significance of the cucurbit materials from Hueca Prieta, Peru. Amer. Mus. Notes 1426: 1-15. Whitaker, T. W. & W. P. Bemis. 1965. Evolution in the genus Cucurbita. Evolution 18: 553-559. Whitaker, T. W., H. C. Cutler & R. S. MacNeish. 1957. Cucurbit materials from three caves near Ocampo, Tamaulipas. Amer. Ant. 22: 352-358. Wilson, H. D. 1989. Discordant patterns of allozyme and morphological variation in mexican Cucurbita. Syst. Bot. 14: 612-623. Wilson, H. D. 1990. Gene flow in squash species. Domesticated Cucurbita species may not represent closed genetic systems. BioScience 40: 449-455. Wilson, H. D., J. Doebley & M. Duvall. 1992. Chloroplast DNA diversity among wild and cultivated members of Cucurbita (Cucurbitaceae). Theor. Appl. Genet. 84: 859-865. Wilson, H. D., R. Lira & I. Rodríguez. 1994. Crop-weed gene flow: Cucurbita argyrosperma Huber and C. fraterna L.H. Bailey (Cucurbitaceae). Econ. Bot. 48: 293-300. Yang, S. L. & T. Walters. 1992. Ethnobotany and the economic role of the Cucurbitaceae of China. Econ. Bot. 46: 349-367. Zack, C. D. & J.B. Loy. 1979. The effect of light and fruit development on internode elongation in Cucurbita maxima squash. Cucurbit Genet. Coop. Rep. 2: 4041. Zeven, A. C. & W.A. Brandenburg. 1986. Use of paintings from the 16th to 19th centuries to study the history of domesticated plants. Econ. Bot. 40: 397408. 33 Sechium P.Br. 34 1. Breve Historia Taxonómica del Género Sechium El género Sechium se ubica en la subtribu Sicyinae, tribu Sicyeae, junto con los géneros Microsechium, Parasicyos, Sechiopsis, Sicyosperma y Sicyos. Con todos estos géneros comparte la presencia de polen espinoso y colpado, el ovario con un solo óvulo péndulo y, en consecuencia, frutos con una sola semilla. Durante muchos años Sechium fue considerado como un género monoespecífico, únicamente constituido por la especie domesticada S. edule, la cual fue originalmente descubierta en Jamaica y dada a conocer botánicamente de manera simultánea en 1763 por Jacquin y Adanson, como Sicyos edulis y Chocho edulis respectivamente. Posteriormente, el propio Jacquin en 1788 la transfirió al género Chayota como Ch. edulis y en 1800 Swartz fue el primero en incluir a esta especie dentro de Sechium al proponer formalmente la combinación S. edule (Jacq.) Swartz. Durante el siglo XIX otras tres especies fueron descritas bajo el nombre de Sechium, aunque fuera de los límites taxonómicos considerados para este género y actualmente se encuentran ubicados en la sinonimia de otros géneros o del propio Sechium. Durante los últimos 30 años del siglo XX, los estudios en el género se intensificaron y se incorporaron a Sechium varios taxa de distribución mexicocentroamericana, que originalmente se describieron (o transfirieron) bajo los géneros Cyclanthera, Ahzolia, Frantzia, Microsechium y Polakowskia. Todas estas plantas comparten la presencia de nectarios en la base del receptáculo de las flores de ambos sexos y frutos maduros carnoso-fibrosos, inermes o variadamente espinosos, de tamaño comparativamente mediano a grande y con una sola semilla. Como resultado de esas investigaciones y en diferentes momentos de esa etapa se llegaron a proponer tres sistemas de clasificación para ubicar a las especies del género (Cuadro 1). En la primera de ellas, Jeffrey (1978) incluyó en Sechium a siete especies y las ubicó en dos secciones, a las cuales constituyó con base en las características de los nectarios florales y de manera secundaria en la estructura de los estambres. Así, en la sección Sechium, se ubicaron las especies con nectarios florales desnudos y visibles por arriba, y con estambres con los filamentos total o parcialmente fusionados y anteras libres. En la otra sección, Frantzia, incluyó dos especies en las que los nectarios florales están cubiertos por una estructura esponjosa en forma de almohadilla, cojinete o sombrilla, los estambres con los filamentos fusionados formando una columna y, las anteras coherentes a totalmente fusionadas formando una estructura globosa. La segunda propuesta de clasificación taxonómica de Sechium, es la de Newstrom (1986), quien no acepta la propuesta anterior y sugiere reducir el género a tres especies, así como también propone que los géneros Frantzia y Polakowskia sean reinstalados como géneros independientes. En un trabajo posterior, sin embargo, (Newstrom, 1990), menciona la posibilidad de considerar a Sechium, Polakowskia y Frantzia como secciones de Sechium. Ninguna de estas propuestas, sin embargo, se formalizó taxonómicamente mediante una 35 publicación. La tercera y más reciente propuesta, fue formalmente publicada en varios trabajos (Lira, 1996; Lira& Nee, 1999; Lira & Chiang, 1992; Lira et al., 1999), en los que se concluye que Sechium es un género que incluye 12 taxa correspondientes a 11 especies: nueve silvestres que se distribuyen de México a Panamá y las dos domesticadas por su importancia alimenticia, S. tacaco y S. edule. La primera de estas especies conocida como “tacaco” y únicamente cultivada en Costa Rica y, la segunda, el “chayote”, ampliamente difundida en América y otras regiones del mundo y con poblaciones silvestres en varios estados de México, las cuales se reconocen formalmente a nivel de subespecie (S. edule ssp. sylvestre Lira & Castrejón) y como el más probable ancestro silvestre de las plantas domesticadas. Evidencias muy recientes derivadas del análisis de diversos marcadores moleculares realizados por H. Cross, han revelado que prácticamente ninguna de estas clasificaciones del género son correctas. En síntesis, los resultados de ese trabajo indican que Sechium debiera restringirse para incluir sólo a las plantas domesticadas de S. edule y a su ancestro silvestre, S. edule ssp. sylvestre, así como a las especies silvestres que se distribuyen de México y Guatemala. Así mismo, sugiere que el género Frantzia sea reinstalado para incluir, tanto a la mayoría de las especies reconocidas en las propuestas 1 y 3 anteriormente descritas como parte de la sección del mismo nombre (una de ellas, Sechium mexicanum, incluso se propone que sea reubicada en otro género), como a S. tacaco y S. talamancense, a las cuales en esos sistemas se ubicaron en Sechium sección Sechium. Esta propuesta es la que se ha adoptado en este proyecto. Circunscrito de esta forma, Sechium incluye solamente cinco taxa: Sechium compositum (J.D. Smith) C. Jeffrey, S. chinantlense Lira & Chiang, S. edule (Jacq.) Swartz ssp. edule, S. edule (Jacq.) Swartz ssp. sylvestre Lira & Castrejón y S. hintonii (P.G. Wilson) C. Jeffrey, los cuales, aunque presentan varias similitudes entre sí, pueden ser identificados fácilmente por su características morfológicas. En el cuadro 1 se muestra una síntesis comparativa de las propuestas taxonómicas del género Sechium. 36 Sechium Sección Sechium S. compositum (J.D. Smith) C. Jeffrey S. edule (Jacq.) Swartz S. hintonii (P.G. Wilson) C. Jeffrey S. tacaco (Pittier) C. Jeffrey S. talamancense (Wunderlin) C. Jeffrey Sechium Sección Frantzia S. pittieri (Cogn.) C. Jeffrey S. villosum (Wunderlin) C. Jeffrey Jeffrey (1978) Sechium sensu stricto sin secciones S. compositum (J.D. Smith) C. Jeffrey S. edule (Jacq.) Swartz (wild and cultivated) S. hintonii (P.G. Wilson) C. Jeffrey Polakowskia sensu lato P. tacaco Pittier P. talamancense (Wunderlin) Newstrom Frantzia sensu stricto F. pittieri (Cogn.) Pittier F. panamense Wunderlin F. venosa L.D. Gómez F. villosa Wunderlin Sechium Sección Sechium S. compositum (J.D. Smith) C. Jeffrey S. chinantlense Lira & Chiang S. edule (Jacq.) Swartz ssp. edule S. edule (Jacq.) Swartz ssp. sylvestre Lira & Castrejón S. hintonii (P.G. Wilson) C. Jeffrey S. tacaco (Pittier) C. Jeffrey S. talamancense (Wunderlin) C. Jeffrey Sechium Sección Frantzia S. mexicanum Lira & Nee S. panamense (Wunderlin) Lira & Chiang S. pittieri (Cogn.) C. Jeffrey S. venosum (L.D. Gómez) Lira & Chiang S. villosum (Wunderlin) C. Jeffrey Sechium sensu stricto S. compositum (J.D. Smith) C. Jeffrey S. chinantlense Lira & Chiang S. edule (Jacq.) Swartz ssp. edule S. edule (Jacq.) Swartz ssp. sylvestre Lira & Castrejón S. hintonii (P.G. Wilson) C. Jeffrey Newstrom (1986) Lira (1996) Lira& Nee (1999) Lira & Chiang (1992) Lira et al. (1999) Cross (2003) Cross et al. (2006) Cuadro 1. Comparación de los sistemas de clasificación taxonómica del género Sechium. 37 2. Los Taxa del Género Sechium En esta sección se presenta una síntesis del conocimiento que se tiene de los taxa del género y sus relaciones, así como también de algunos rasgos detectados en ellos que pudieran representar un potencial como recursos genéticos. Sechium edule ssp. edule Orígen y características importantes. El nombre científico correcto de la planta domesticada conocida como “chayote” es Sechium edule (Jacq.) Swartz ssp. edule, el cual, como ya se dijo está basado en Sicyos edulis Jacq y fue formalmente publicado en 1800 para finalmente ser reconocido en 1999 como la subespecie típica por Lira & Castrejón. Bajo este nombre se incluyen todos los tipos domesticados de chayote que son cultivados en muchas partes del mundo y cuyo ancestro silvestre es S. edule ssp. sylvestre, la cual, como se ha mencionado, fue también descrita formalmente en 1999 por Lira & Castrejón. Evidencias muy recientes derivadas de estudios moleculares, han corroborado esta propuesta e incluso han sugerido que las poblaciones de Oaxaca de la subespecie sylvestre son las más cercanas a la subespecie edule y que, en consecuencia, Oaxaca pudiera ser el centro de domesticación del chayote. Las plantas de chayote son monoicas, herbáceas, rastreras a trepadoras vigorosas. Se desarrollan a partir de una raíz principal engrosada tuberiforme, en la cual se producen raíces adventicias delgadas con el ápice masivo y también tuberiforme. Los tallos son anguloso-sulcados y glabros, y hacia la base son engrosados y de aspecto leñoso, mientras que hacia el ápice son muy ramificados, herbáceos y delgados. Las hojas son ovado-cordadas a suborbiculares, ligeramente 3-5-anguloso-lobadas. Las flores estaminadas están dispuestas en inflorescencias racemosas, erectas y presentan 5 sépalos y 5 pétalos, de color verdoso a blanco-verdoso. Los estambres son 5, y tienen los filamentos fusionados casi en toda su longitud para formar una columna engrosada, y separándose hacia el ápice normalmente en 5 (algunas veces 3 o raramente 4) ramificaciones muy breves; las anteras se desarrollan en el ápice de las cortas ramificaciones de los filamentos. En la base del receptáculo floral tienen 10 nectarios en forma de poros rodeando a la columna estaminal y ligeramente o no del todo proyectándose por debajo del receptáculo en forma de saco. Las flores pistiladas se desarrollan en la misma axila que las estaminadas, generalmente son solitarias, aunque ocasionalmente pueden desarrollarse en pares o incluso raramente hasta tres sobre un pedicelo común. El ovario puede ser de muy diversas formas, y desde completamente inerme hasta variadamente armado o indumentado; el perianto es como el de las estaminadas pero más reducido, principalmente en el receptáculo; los estilos están fusionados en una columna delgada y los estigmas forman una estructura subglobosa y obscuramente 2lobada; los nectarios de la base del receptáculo son como los de las flores 38 estaminadas. Los frutos son solitarios o pueden desarrollarse en pares sobre un pedúnculo común, son carnosos o carnoso-fibrosos, pueden o no presentar surcos o crestas longitudinales y son de muy diversas formas (globosos, ovoides, obovoides, piriformes, piriforme-alargados), tamaños (4.3-26.5 cm de largo, 311cm de ancho) y colores (blancos, amarillos pálidos a verde claro u obscuro); pueden ser desde inermes y lisos a diversamente armados, aunque generalmente conservando las características del ovario, y pueden o no presentar estrías leñosas o lenticelas en la superficie, principalmente al madurar; la pulpa es de color verde pálido a blanquecino, de sabor dulce o insípido; la semilla es ovoide, comprimida, lisa y germina dentro del fruto, aun estando el fruto adherido a la planta madre. Los granos de polen de la subespecie edule han sido descritos como eumonada, isopolar, radial; oblados (66.8 x 90.4 µm), estefanocolpados (9-11 colpos), los colpos regulares o continuos. Tectado, espinoso, con espinas de tamaño muy variable (1.3-6.7 µm), ligeramente ensanchadas en la base, ápice obtuso, con una cavidad translúcida; también con algunas clavas y verrugas menos abundantes. Superficie interespinal finamente reticulada. Exina 2.3 µm de grosor; sexina muy ligeramente más gruesa que la nexina, aunque haciéndose más delgada hacia los márgenes de los colpos; el perímetro en vista polar es circular. La variación en el número cromosómico de S. edule ssp. edule es amplia, pues mientras algunos trabajos coinciden en que los números haploide y diploide de esta especie son n = 12 y 2n = 24 respectivamente, en otros se reportan recuentos de n = 13 y 2n = 26, o de 2n = 28 e incluso 2n = 22. Aspectos ecogeográficos. El chayote se cultiva generalmente en los huertos o traspatios y, en términos generales, se puede decir que es manejado preferentemente en zonas con altitudes medias (500-1500 m). Sin embargo, los registros de herbario y las observaciones de campo, indican que en muchas regiones existen razas locales adaptadas a una amplia gama de condiciones ecológicas que comprenden un amplio intervalo altitudinal que va desde el nivel del mar hasta los 2500 m. La amplia distribución del grueso de la diversidad genética de este cultivo, indica que no parece haber restricciones en cuanto al tipo de suelo o bien que estas no son evidentes, tanto porque su cultivo en huertos hace posible tener cuidados más intensivos al respecto, como quizás debido a la existencia de variantes presumiblemente adaptadas a diferentes tipos de suelos. Se trata de un cultivo ampliamente difundido en América, en donde las crónicas de la conquista indican que esta especie fue cultivada por los aztecas desde mucho tiempo antes de la llegada de los españoles. Se dice que fue introducido a Costa Rica por los españoles y que su distribución en la porción norte de Centroamérica se debe a la influencia de las culturas Azteca y Maya. La introducción hacia Las Antillas y América del Sur, se sabe que ocurrió entre los siglos XVIII y XIX. De hecho, como ya se ha mencionado, las primeras 39 descripciones e ilustraciones botánicas del chayote fueron hechas con base en plantas cultivadas en esa región. En estas mismas épocas, el chayote se introdujo en Europa, de donde fue llevado hacia Africa, Asia y Australia, mientras que su introducción en los Estados Unidos se dice que data de finales del siglo XIX. Esta amplia difusión pudiera no ser tan real en la actualidad, principalmente para el Viejo Mundo. Las referencias que consignan su cultivo en muchas de estas regiones son muy antiguas y solo se tienen datos recientes de su cultivo en la India y algunas regiones del sur de Estados Unidos como Louisiana y Florida. En relación con lo anterior, es importante destacar que desde hace algunos años, ciertos países de Europa importan chayote de América Latina, situación que posiblemente no existiría de haberse establecido su cultivo por completo en dichos países. Importancia del taxón. El chayote es usado fundamentalmente como alimento humano o como forraje no sólo en América, sino en muchos otros países. Sus frutos, tallos y hojas tiernas, así como las porciones tuberizadas de las raíces adventicias, han sido y aun son muy apreciadas como verdura, tanto simplemente hervidas, como formando parte de numerosos guisos o postres. La utilidad del chayote, sin embargo, abarca también otros aspectos en distintas regiones del mundo. Así, la pulpa de sus frutos, por su suavidad, se ha empleado para dar consistencia a varios alimentos infantiles, jugos, salsas y pastas, mientras que los tallos por su flexibilidad y resistencia, en alguna época han sido destinados a la fabricación artesanal de cestería y sombreros en algunas regiones como las Islas Reunión. En la India, al igual que en América, sus frutos y raíces además de usarse como alimento humano, son también empleados como forraje para ganado. El valor nutricional de sus partes consumibles es relativamente menor en contenido de fibras, proteínas y vitaminas que el de otros vegetales. Sin embargo, el contenido de calorías y carbohidratos es alto, principalmente en el caso de los tallos jóvenes, la raíz y la semilla respectivamente, en tanto que el aporte de micro y macronutrientes por parte de los frutos es bastante aceptable. Los frutos y semillas, son también ricos en numerosos aminoácidos importantes como ácido aspártico, ácido glutámico, alanina, argidina, cisteina, fenilalanina, glicina, histidina, isoleucina, leucina, metionina (sólo en el fruto), prolina, serina, tirosina, treonina y valina. La aplicación del chayote en la medicina tradicional incluye el uso de infusiones de hojas para disolver cálculos renales y como auxiliar en el tratamiento de la arterioesclerosis e hipertensión. De igual manera, infusiones de los frutos se emplean para aliviar la retención de la orina y los ardores al orinar. Su efectividad en la curación de enfermedades renales se infiere que debe ser alta pues, por ejemplo, en la Península de Yucatán, en donde estos padecimientos son muy comunes, dicho uso está documentado desde la época colonial hasta nuestros días. La efectividad para aliviar este tipo de padecimientos, ha sido corroborada mediante la evaluación de las propiedades diuréticas de sus hojas y semillas. Otras propiedades medicinales del chayote que también han sido comprobadas por estudios farmacológicos, son las cardiovasculares y las antiinflamatorias, contenidas en las hojas y los frutos respectivamente. 40 Con el objeto de ampliar los usos del chayote e incluso llevarlos a una escala industrial, en México y otros países se ha probado una forma de aprovechamiento del fruto, consistente en aumentarle la vida útil mediante su deshidratación. Los resultados obtenidos hasta ahora se dice que han sido buenos, lográndose la elaboración de mermeladas y otros dulces, así como también la conservación de frutos deshidratados susceptibles de usarse como verdura después de cierto tiempo. Por otra parte, se sabe que en Filipinas se ha tenido éxito con la inclusión de plantas de chayote en plantaciones mixtas destinadas específicamente para la recuperación y/o conservación de suelo. Sechium edule ssp. sylvestre Distribución ecogeográfica y características importantes. Como ya se mencionó, bajo esta subespecie quedaron incluidas las poblaciones silvestres con frutos de sabor amargo que hasta la fecha se han documentado formalmente de los estados mexicanos de Querétaro, Puebla, Veracruz y Oaxaca (Figura 2). Las plantas de esta subespecie son conocidas en Veracruz como chayotes de monte o erizos de monte y en Oaxaca con los nombres en Chinanteco nñ y rign-cuá. Las poblaciones de esta subespecie prosperan entre 500 y 1700 m, en zonas muy húmedas como cañadas, caídas de agua, ríos o arroyos. En las partes más altas, la vegetación predominante es el bosque mesófilo y en las más bajas corresponde a zonas de ecotono del bosque mesófilo y el bosque tropical perennifolio o subperennifolio. Poblaciones de chayote descritas como silvestres, también han sido reportadas para Java, las Islas Reunión y Venezuela. Sin embargo, estos reportes no están respaldados por ningún tipo de colecciones y se ha propuesto que pudieran simplemente ser plantas escapadas al cultivo. Las características morfológicas de las plantas de la subespecie sylvestre son muy similares (o en algunos casos casi idénticas) a las que pueden encontrarse en la subespecie edule. Por ejemplo, sus flores, aunque ligeramente más grandes que las de las plantas de la subespecie domesticada, presentan una estructura estaminal idéntica, mientras que sus frutos también se caracterizan por presentar una hendidura apical por la que brota la plántula una vez que la semilla ha germinado. Las diferencias más importantes entre ambas subespecies se encuentran en las dimensiones de las estructuras vegetativas y reproductivas. Así, las plantas de la subespecie sylvestre son más robustas y sus hojas, flores e inflorescencias estaminadas son de mayores dimensiones que las que se pueden encontrar en las plantas cultivadas. Por otra parte, la variación morfológica en sus frutos no es estrictamente comparable a la registrada para los tipos domesticados, pues sus frutos son básicamente subglobosos a obovoides (raramente piriformes u oblongos), de tamaño pequeño a mediano (menos de 10 cm de largo y ancho), de color verde obscuro a raramente verde claro y densamente espinosos (rara vez esparcidamente espinosos o totalmente inermes) y no se han documentado frutos de color amarillo o blanco. En todas estas poblaciones, además, la pulpa de los frutos es de sabor amargo y en varias de ellas se ha observado que la semilla germina hasta que el fruto se ha desprendido de la planta madre. Las diferencias 41 entre las dos subespecies son más acentuadas en las poblaciones de Oaxaca, México, cuyos frutos, además de tener también pulpa fibrosa y de sabor amargo, son mucho más homogéneos en su forma (globosos), coloración (verde obscuros) y espinosidad (siempre densamente espinosos) (Figura 1). Los granos de polen de la subespecie sylvestre han sido descritos como eumonada, isopolar, radial; suboblado (64.0 x 82.7 µm), estefanocolpado (8-9 colpos), los colpos regulares o contínuos. Tectado, espinoso, espinas cónicas, 4.97.2 µm de largo, ensanchadas en la base, ápice agudo con una cavidad translúcida. Superficie interespinal microreticulada. Exina 2.5 µm de grosor; sexina a b c Figura 1. Comparación de la diversidad morfológica de los frutos de la subespecie edule (a), y los de las poblaciones de Oaxaca de la subespecie sylvestre. 42 más gruesa que la nexina; perímetro en vista polar circular. Finalmente es interesante que existe variación en su número cromosómico, pues mientras para las poblaciones de Veracruz se ha reportado un número diploide 2n = 12, para las de Oaxaca el número haploide que se ha determinado es n = 13. Importancia del taxón. No existen datos etnobotánicos que indiquen el uso local de este taxón, ni tampoco estudios que intenten determinar el potencial de estas plantas como recursos para el mejoramiento del chayote domesticado. Respecto a esto último, sin embargo, dada su estrecha relación morfológica y genética, es recomendable que estas poblaciones sean de las primeras en evaluarse cuando menos en cuanto a su resistencia a enfermedades y plagas y desde luego iniciar programas de hibridación con tipos de chayote domesticados. En este contexto, vale la pena señalar que, aunque en condiciones experimentales no existe información de cruzamientos entre las dos subespecies, evidencias moleculares han revelado la existencia de marcadores típicos de las poblaciones de Oaxaca de la subespecie sylvestre en algunas plantas de chayote domesticado de ese mismo estado, lo cual sugiere que sí es posible la hibridación entre estos taxa, aunque se trata de un evento que en la actualidad aparentemente es raro. Sechium chinantlense Distribución ecogeográfica y características importantes. Esta especie es endémica de una pequeña región de México al norte del estado de Oaxaca, muy cerca de los límites con Veracruz (Figura 2), en donde es conocida con los nombres en Español cabeza de chango, chayote cimarrón y chayote de monte y con nombres en idioma Chinanteco como Nñ, rign-cua' y rign-kiu-moo. Prospera en altitudes entre 20 y 800 m. En las zonas más bajas la vegetación corresponde a bosque tropical perennifolio o subperennifolio y en las más altas al ecotono de este último tipo de vegetación con el bosque mesófilo. Las restringidas zonas en las que crece S. chinantlense están siendo fuertemente perturbadas, por lo que debería ser incluida en las listas de especies amenazadas. Materiales de esta especie fueron recolectados por primera vez entre 1940 y 1941 y se identificaron como Ahzolia composita (J.D. Smith) Standley & Steyermark (= Sechium compositum (J.D. Smith) C. Jefrrey). Años más tarde, fueron reconocidas como tipos silvestres de S. edule, señalándose, además, que las características de sus flores estaminadas, la presencia de frutos lisos y algunas características químicas, sugerían una cercana relación con otra de las especies silvestres (Sechium compositum). De hecho, se propuso que las poblaciones de S. chinantlense pudieran corresponder a híbridos entre esta última especie y tipos cultivados de chayote. Las suposiciones que en algún momento se mencionaron acerca de de que esta especie pudiera ser simplemente un tipo silvestre más de chayote de Oaxaca no son realmente descabelladas, pues a simple vista las plantas de estos taxa son realmente similares. Por ejemplo, las flores estaminadas tienen una disposición y estructura bastante similar y los frutos 43 de ambos taxa son los únicos del género que presentan una hendidura apical por la que brota la plántula una vez que la semilla ha germinado. La revisión detallada Figura 2. Distribución geográfica de los taxa silvestres del género Sechium 44 de estas estructuras, sin embargo, muestra que los estambres tienen diferencias muy importantes. Por ejemplo, en S. chinantlense la porción fusionada de sus filamentos es más corta que en S. edule ssp. sylvestre y se divide en el ápice siempre en 5 ramas patentes algo ensanchadas y planas y dispuestas de forma perpendicular a la columna de filamentos (en la subespecie sylvestre son ascendentes), las cuales se vuelven a dividir en dos ramas cortas desiguales en tamaño y algo encorvadas lateralmente dando un aspecto de aspas (rasgo ausente en la subespecie sylvestre); el tejido anterífero, además, sólo es visible en los márgenes y por debajo del ápice de las ramificaciones (en la subespecie sylvestre el tejido anterífero está claramente definido como anteras, las cuales están en el ápice de las ramificaciones de los filamentos). En cuanto a los frutos, las diferencias están en la forma y la espinosidad, pues en S. chinantlense son obovoides, comúnmente muy comprimidos e inermes, lo que contrasta con lo descrito al respecto anteriormente para los de la subespecie sylvestre (frutos subglobosos a obovoides o raramente piriformes u oblongos y generalmente densamente espinosos) (Figuras 3 y 4). La posibilidad de que S. chinantlense sea un híbrido entre S. edule ssp. sylvestre y S. compositum es nula por la ausencia de ésta última especie en Oaxaca (véase Figura 2). Estudios recientes basados en evidencias moleculares también han descartado esta hipótesis. Los granos de polen de esta especie han sido descritos como eumónada, isopolar, isodiamétrico, suboblado, (79.0 x 90.0 µm); estefanocolpado, (8-9 colpos ocasionalmente 10), los colpos regulares o continuos. Tectado, espinoso. Espinas alargadas, 6.2-7.4 µm de largo, de base más ancha que su ápice y éste con una cavidad translúcida. Superficie interespinal microreticulada. Exina 4 µm de grosor; sexina más gruesa que la nexina; perímetro en vista polar circular. El único recuento cromosómico que existe para la especie indica que el número diploide es 2n = 30. Importancia del taxón. Las plantas de esta especie están adaptadas a zonas con muy alta humedad relativa y presentan variación fenológica relacionada aparentemente a las diferencias microclimáticas de los sitios en los que crecen sus poblaciones. La importancia de estas características en el posible mejoramiento del chayote no ha sido determinada, aunque la posibilidad de su uso para estos fines es incierta, en virtud de la poca o nula compatibilidad de Sechium chinantlense con el chayote. Estas incompatibilidad posiblemente esté relacionadas con las diferencias en sus números cromosómicos (2n = 22, 24, 26, entre otros para S. edule ssp. edule y 2n = 30 para S. chinantlense). 45 Figura 3. Características morfológicas de Sechium chinantlense [A) hábito, B) Flores estaminadas mostrando los estambres, C) Flores pistiladas, G) Frutos] y flores estaminadas de otros taxa del género y otros géneros [ D) S. hintonii E) Frantzia pittieri F) S. edule ssp. sylvestre]. 46 Figura 4. Comparación de los frutos de Sechium chinantlense (sin espinas) y S. edule ssp. sylvestre (espinosos). Sechium compositum Distribución ecogeográfica y características importantes. Esta especie se distribuye desde el sur del estado de Chiapas a las zonas vecinas de Guatemala (Quetzaltenango, Escuintla y Suchitepequez) en Centroamérica (Figura 2). Los sitios en donde crece esta especie se ubican dentro de un amplio intervalo altitudinal (50-2100 m) y se caracterizan por estar generalmente asociados a cañadas, orillas de arroyos o cerca de caídas de agua. La vegetación puede ser primaria o secundaria derivada de bosque mesófilo o bosque tropical subperennifolio y también es frecuente encontrarla creciendo entre cafetales. En estas zonas S. compositum es conocida con varios nombres comunes, la mayoría de los cuales destacan su similitud con el chayote. Así, en Chiapas se le conoce principalmente como chayote de caballo o huisquil de cochi y también con los nombres en Mame xmasil o xmasin, cuyo significado se desconoce. Para Guatemala se han recabado los nombres huisquil de monte y huisquil de ratón. En cuanto a las características morfológicas de las poblaciones de S. compositum, vale la pena destacar que aunque en general son muy similares a las 47 de los taxa anteriormente descritos, difieren en la ausencia de la hendidura apical que caracteriza a las dos subespecies de S. edule y a S. chinantlense (Figura 5). Figura 5. Características morfológicas de Sechium compositum. 48 El polen de esta especie se ha descrito como eumonada, isopolar, radial; oblado (60.8 x 81.0 µm), estefanocolpado (8-9 colpos), los colpos regulares o contínuos. Tectado, espinoso, espinas cónicas 4.3-6.3 µm de largo, ensanchadas en la base, ápice agudo con una cavidad translúcida. Superficie interespinal microreticulada. Exina 3.0 µm de grosor; sexina mas gruesa que la nexina; perímetro en vista polar circular. Finalmente, el único recuento de cromosomas de esta especie indica que su número haploide es n = 14. Importancia del taxón. En Chiapas las raíces machacadas con agua se usan como substituto de jabón y para matar piojos en caballos. Por otra parte, algunos de los nombres comunes (v.gr. "chayote de caballo", "chayote de burro" y "huisquil de cochi") sugieren que los frutos, no obstante ser amargos y posiblemente con altos contenidos de cucurbitacinas, pudieran ser consumidos por caballos, burros y cerdos. En cuanto a su importancia potencial, vale la pena destacar que los frutos de S. compositum pueden mantenerse en latencia durante varios meses sin que esto afecte su turgencia y humedad, lo cual pudiera ser una característica de interés para intentar incorporarla al chayote cultivado con el fin de colaborar a resolver problemas de almacenamiento o conservación. Sechium hintonii Distribución ecogeográfica y características importantes. Sechium hintonii es una especie endémica de una pequeña región de México, de la cual hasta hace poco sólo se conocían las colecciones tipo recolectadas dentro del Distrito de Temascaltepec, Estado de México, en donde se le conoce como chayotillo. Recientemente fue re-descubierta en un sitio cercano a una de estas localidades y poco después se encontró una pequeña población un poco más al sur en el estado de Guerrero. Las localidades de estos dos estados se encuentran en altitudes entre 1300 y 1510 msnm, en una zona de transición climáticovegetacional. El clima corresponde al grupo de los cálidos en transición a semicálidos. En la localidad del Estado de México, la vegetación puede ser descrita como una ecotono entre bosque tropical caducifolio y bosque de encinos, sumamente perturbada por actividades agrícolas de temporal, mientras que en la localidad del estado de Guerrero, aunque la vegetación es similar, parece tener más afinidad con el bosque tropical caducifolio, y está bastante más conservada. Hasta hace poco tiempo se dudaba que pudieran también corresponder a esta especie individuos que fueron recolectados en los municipios de Autlán y Cuautitlán, en el estado de Jalisco, principalmente porque muestran algunas diferencias morfológicas respecto a los más típicos. La altitud en los sitios en donde fueron recolectados estos materiales varía entre 750 y 1710 m y la vegetación corresponde a bosque mesófilo, bosque tropical caducifolio y bosque de encinos. Un reciente estudio biogeográfico de los taxa de Sechium y otros géneros de la subtribu Sicynae realizado con marcadores moleculares, ha confirmado la identidad de estos individuos, lo cual amplía de manera considerable la distribución conocida de S. hintonii hacia el noroeste, así como 49 también el conocimiento sobre el intervalo altitudinal en el que crece (Figura 2). Figura 6. Características morfológicas de Sechium hintonii. Las características morfológicas de las poblaciones de S. hintonii son, en general, muy similares a las de los restantes taxa silvestres, aunque al menos en la actualidad no forma poblaciones densas como se observa en aquellos. Otra diferencia muy importante entre especie y los restantes taxa del género es que sus inflorescencias son péndulas, mientras que en los otros taxa son erectas. Por otra parte, sus frutos son también muy diferentes en tamaño (2.5-3.5 cm de largo, 2-2.5 cm de ancho) y otros rasgos (color pardo claro a pardo obscuro y leñosos al madurar), aunque como en S. compositum carecen de la hendidura apical que caracteriza a las dos subespecies de S. edule y a S. chinantlense (Figura 6). Sus granos de polen han sido descritos como eumonada, isopolar, radial; suboblado 50 (52.6 x 68.8 µm), estefanocolpado (9-10 colpos). Tectado; espinoso, espinas cónicas 5.4-6.3 µm de largo, de base ancha y el ápice con una pequeña cavidad translúcida. Superficie interespinal finamente microreticulada. Exina 2.5 µm de grosor; sexina ligeramente más gruesa que la nexina; perímetro en vista polar circular. El único recuento cromosómico que se ha hecho para S. hintonii, indica que al igual que S. compositum, su número haploide es n = 14. Importancia del taxón. No se tienen datos al respecto, pues no existe información etnobotánica que sugiera su importancia regional, ni tampoco acerca de su capacidad de hibridación con el chayote. No obstante, el hecho de que sea una especie endémica de un área relativamente pequeña, cuyas pocas poblaciones conocidas prosperan en hábitats generalmente afectados por la deforestación y diversas actividades agrícolas, aunado a la falta de colecciones de germoplasma que aseguren al menos su conservación ex situ, claramente la ubican como una especie en peligro de extinción. 3. Conclusiones Al igual que se señaló para el género Cucurbita, también todas las fuentes de evidencia que aquí se han descrito, coinciden en señalar a México como el centro de origen del género Sechium , pues dentro de sus límites geográficos prosperan todos los taxa que lo conforman, incluyendo por supuesto al ancestro silvestre de su única especie domesticada, el chayote (S. edule ssp. edule). La diversidad del chayote y otras fuentes de evidencia que permitirán confirmar estas aseveraciones serán analizadas en los siguientes informes del proyecto. 4. Bibliografía Consultada Alvarado, J. L., R. Lira & J. Caballero. 1992. Palynological evidence for the generic delimitation of Sechium sensu lato (Cucurbitaceae) and its allies. Bull. Br. Mus. Nat. Hist. 22: 109-121. Bettencourt, E. & J. Konopka. 1990. Directory of Germplasm Collections. Vegetables. International Board for Plant Genetic Respurces. Rome, Italy. 250 p. Browne, P. 1756. Civil and Natural History of Jamaica. London, England. Brücher, H. 1989. Useful Plants of Neotropical Origin and Their Wild Relatives. Springer Verlag, New York. Bueno, R. R., S. Moura & O.M. Fonseca. 1970. Preliminary studies on the pharmacology of Sechium edule leaves extracts. An. Acad. Cien. Brasil 40: 285-289. Bukasov, S. M. 1981. Las Plantas Cultivadas de Mexico, Guatemala y Colombia. CATIE GTZ, Turrialba, Costa Rica.1a Edición en Español (J. León Traductor). 173 p. Castrejón, J. & R. Lira. 1992. Contribución al Conocimiento de la Relación Silvestre Cultivo en el "Chayote" Sechium edule (Jacq.) Swartz (Cucurbitaceae). In: Resúmenes Simposio Etnobotánica 92. Cordoba, 51 Espana: Jardines Botánicos de Cordoba. pp. 345. Chakravarty, H. L. 1990. Cucurbits of India and Their Role in the Development of Vegetable Crops. In: D. M. Bates, R.W. Robinson, and C. Jeffrey (Eds.), Biology and Utilization of the Cucurbitaceae (pp. 325-334). Cornell Univ. Press, Ithaca, NY, USA. Cogniaux, A. 1881. Cucurbitacées. In: A. De Candolle & C. De Candolle (Eds.). Monographiae Phanerogamarum (pp. 325-951). G. Masson, Paris. Cogniaux, A. 1891. Cucurbitaceae. In: T. Durand & H. Pittier (Eds.), Primitiae Florae Costaricensis (pp. 271-279). Bull. Soc. Roy. Bot. Belgique, Bruxelles. Cook, O. F. 1901. The Chayote: A Tropical Vegetable. USDA Div. Bot. Bull. 18: 131. Costales, E. Jr. & A. B. Costales. 1985. Effects of plant combination on the protection / stabilization of mined waste areas Philippines. Sylvatrop (Philippines) 10: 187-202. Cross, H. 2003. Evolution, systematics and domestication in Sechium and related genera (Sicyeae, Cucurbitaceae). Ph. D. Dissertation. Columbia University, New York. Cross, H. B., R. Lira Saade & T. J. Motley. 2006. Origins and diversifcation of Chayote. In: T. J. Motley, N. J. C. Zerega & H. B. Cross (Eds.).Darwin's Harvest: New Approaches to the Origins, Evolution, and Conservation of Crops (pp. 171-194). Columbia University Press, New York. Cruz León, A. 1985 86. ¿Chayote o cruzas intergenéricas?. Hallazgo y características. Rev. Geogr. Agr. 9-10: 100-106. Cruz León, A. & D. Querol. 1985. Catálogo de Recursos Genéticos de Chayote (Sechium edule Sw.) en el Centro Regional Universitario Oriente de la Universidad Autónoma de Chapingo. Universidad Autónoma de Chapingo, Chapingo. Dieterle, J. V. A. 1976. Cucurbitaceae. Fieldiana Bot. 24 Parte XI: 306-395. Donnell Smith, J. 1903. Undescribed plants from Guatemala and other Centralamerican republics. XXIV. (Microsechium compositum). Bot. Gaz. 35: 2-3. Dubravec, K. 1986. Sechium edule cucurbitaceae: a new adventive species in the flora of Yugoslavia. Poljoprivredna Znanstvena Smotra 72: 53-56. Engels, J. M. 1983. Variation in Sechium edule Sw. in Central America. J.Amer. Soc. Hort. Sci. 108: 706-710. Esquinas Alcazar, J. T. & P.J. Gulick. 1983. Genetic Resources of Cucurbitaceae: A Global Report. IBPGR Secretariat, Rome, Italy. 101 p. Flores, E. 1989. El chayote, Sechium edule Swartz (Cucurbitaceae). Rev. Biol. Trop. 37 (Suplemento 1): 1-54. Giusti, L., M. Resnik, T. del V. Ruiz & A. Grau. 1978. Notas acerca de la biología de Sechium edule (Jacq.) Swartz (Cucurbitaceae). Lilloa 35: 5 13. Goldblatt, P. (Ed.). 1981. Index to plant chromosome numbers (1975-1978). Monogr. Syst. Bot. Missouri Bot. Gard., Missouri. Goldblatt, P. (Ed.). 1984. Index to plant chromosome numbers (1979-1981). Monogr. Syst. Bot. Missouri Bot. Gard., Missouri. Goldblatt, P. (Ed.). 1985. Index to plant chromosome numbers (1982-1983). Monogr. Syst. Bot. Missouri Bot. Gard., Missouri. 52 Goldblatt, P. (Ed.). 1988. Index to plant chromosome numbers (1984-1985). Monogr. Syst. Bot. Missouri Bot. Gard., Missouri. Gómez, L. D. & J. Gómez. 1983. Plantae mesoamericanae novae. IX. Phytologia 53: 447-448. Herrera, A. 1870. Estudio sobre el chayote. La Naturaleza 1: 234-238. Hoover, L. G. 1923. The Chayote: Its Culture and Uses. USDA Dept. Circ. 286: 111. Howard, R. 1973. The enumeratio and selectarum of Nicolaus Von Jacquin. J. Arnold Arbor. 54: 435-470. Jacquin, N. 1788. Selectarum Stirpium Americanarum Historia. Leiden. Jeffrey, C. 1978. Further notes on Cucurbitaceae. IV. Some New World taxa. Kew Bull. 33: 347-380. Jeffrey, C. 1990. Appendix: An outline classification of the Cucurbitaceae. In: D. M. Bates, R.W. Robinson, & C. Jeffrey (Eds.). Biology and Utilization of the Cucurbitaceae (pp. 449-463). Cornell University Press, Ithaca, NY. Lira, R. 1988. Cucurbitaceae de la Peninsula de Yucatan: Taxonomia y Etnobotanica. Tesis Maestria en Ciencias (Ecologia y Recursos Bioticos), Instituto Nacional de Investigaciones sobre Recursos Bioticos. 329 p. Lira, R. 1992. Chayote (Sechium edule). In: E. Hernández Bermejo & J. León (Eds.). Cultivos Marginados. Otra Perspectiva de 1492 (pp.77-82). FAO Plant Production and Protection Series No. 26 en colaboración con el Jardín Botánico de Córdoba. Roma, Italia. Lira, R. 1995. Estudios taxonómicos en el Género Sechium P. Br. (Cucurbitaceae). Tesis Doctorado en Ciencias. Facultad de Ciencias, Universidad Nacional Autónoma de México. 267 p. Lira, R. 1995. Estudios Taxonómicos y Ecogeográficos de las Cucurbitaceae Latinoamericanas de Importancia Económica: Cucurbita, Sechium, Sicana y Cyclanthera. Systematic and Ecogeographic Studies on Crop Gene Pools. 9. International Plant Genetic Resources Institute. Rome, Italy. 281p. Lira, R. 1996. Chayote, Sechium edule (Jacq.) Swartz (Cucurbitaceae). Promoting The Conservation and Use of Underutilized and Neglected Crops. 8. International Plant Genetic Resources Institute. Rome, Italy. 58 p. Lira, R. 2004. Cucurbitaceae de la Península de Yucatán: Taxonomía, Florística y Etnobotánica. Etnoflora Yucatanense 22. Universidad Autónoma de Yucatán / CONACyT. Mérida, Yucatán, México. 312 pp. Lira, R. & J.C. Soto. 1991. Sechium hintonii (P.G. Wilson) C. Jeffrey (Cucurbitaceae). Rediscovery and observations. FAO/IBPGR Plant Genet. Res. Newsletter 87: 5 10. Lira, R. & R. Bye. 1992. Las Cucurbitaceas en la Alimentación de los Dos Mundos. In: Simposio 1492. El Encuentro de Dos Comidas. Puebla, México. 38 p. Lira, R. & F. Chiang. 1992. Two new combinations in Sechium (Cucurbitaceae) from Central America and a new species from Oaxaca, Mexico. Novon 2: 227 231. Lira, R. & M. Nee. 1999. A new species of Sechium sect. Frantzia (Cucurbitaceae, Sicyeae, Sicyinae) from México. Brittonia 51: 204-209. Lira, R., J.L. Alvarado & Castrejón, J. 1994. Nota sobre el polen de Sechium chinantlense Lira & Chiang y Parasicyos dieterleae Lira & Torres 53 (Cucurbitaceae). Bol. Soc. Bot. México. 54: 275-280. Lira, R., J. Castrejón, S. Zamudio & C. Rojas-Zenteno. 1999. Propuesta de ubicación taxonómica para los chayotes silvestres (Sechium edule, Cucurbitaceae) de México.Acta Botánica Mexicana 49: 47-61. Lira, R. & J. Caballero. 2002. Ethnobotany of the wild mexican Cucurbitaceae. Economic Botany. 56: 380-398. Lira, R. En prensa. Cucurbitáceas (Fam. Cucurbitaceae). En: Biodiversidad del Estado de México. (Ed. G. Ceballos et al.). CONABIO y Gobierno del Estado de México. Lira, R. En prensa. Sechium. In: Cucurbitaceae. Flora Mesoamericana Vol. IV. Universidad Nacional Autónoma de México, British Museum of Natural History, Missouri Botanical Garden. Disp. en Internet en: www.mobot.org/MOBOT/FM/ Lozoya, X. 1980. Mexican medicinal plants used for treatment of cardiovascular diseases. Amer. J. Chin. Med. 8: 86-95. Maffioli, A. 1981. Recursos Genéticos de Chayote, Sechium edule (Jacq.) Swartz. (Cucurbitaceae). CATIE/GTZ, Turrialba, Costa Rica. 151 p. Martínez Crovetto, R. 1946. Anormalidades florales en Sechium edule. Lilloa 12: 49-60. Mercado, P. & R. Lira. 1994. Contribución al conocimiento de los números cromosómicos de los géneros Sicana Naudin y Sechium P.Br. (Cucurbitaceae). Acta Bot. Mexicana 27: 7-13. Newstrom, L. E. 1985. Collection of chayote and its wild relatives. FAO/IBPGR Plant Genet. Res. Newsletter 64: 14-20. Newstrom, L. E. 1986. Studies in the Origin and Evolution of Chayote, Sechium edule (Jacq.) Sw. (Cucurbitaceae). Tesis Ph.D. University of California, Berkeley. 149 p. Newstrom, L. E. 1989. Reproductive Biology and Evolution of the Cultivated chayote, Sechium edule (Cucurbitaceae). In: J. H. Bock & Y.B. Linhart (Eds.). The Evolutionary Ecology of Plants (pp. 491-509). Westview Press, Boulder, Colorado. Newstrom, L. E. 1990. Origin and Evolution of Chayote, Sechium edule. In: D. M. Bates, R.W. Robinson, & C. Jeffrey (Eds.). Biology and Utilization of the Cucurbitaceae (pp. 141-149). Cornell University Press, Ithaca, NY. Newstrom, L. E. 1991. Evidence for the origin of chayote Sechium edule (Cucurbitaceae). Econ. Bot. 45: 410-428. Palacios, R. 1987. Estudio Exploratorio del Número Cromosómico del chayote Sechium edule Sw. Tesis Lic. Ciencias Agrícolas. Universidad Veracruzana. 59 p. Perrino, P. & K. Hammer. 1985. Collection of land races of cultivated plants in South Italy, 1984. Kulturpflanze 33: 225-236. Pittier, H. 1910. New and noteworthy plants from Colombia and Central America. Contr. U.S. Natl. Herb. 13: 93-132. Ribeiro, R de A., F. de Barros, M.M.R. Fiuza de Melo, C. Muniz, S. Chieia, G. Wanderley, C. Gomes, & G. Trolin. 1988. Acute diuretic effects in conscious rats produced by some medicinal plants used in the state of Sao Paulo, Brasil. J. Ethnopharmacology 24: 19-29. 54 Salama, A.M., Polo N. A. Enrique, M. CR Contreras & R. L. Maldonado. 1986. Preliminary phytochemical analysis and determination of the anti inflammatory and cardiac activities of the fruit of sechium edule. Rev. Colombiana Cienc. Quim. Farmac. 15: 79-82. Salama, A. M., H. Achenbach, L. M. Sánchez & G.M. Gutiérrez. 1987. Isolation and identification of anti inflammatory glycosides from the fruit of Sechium edule. Rev. Colombiana Cienc. Quim. Farmac. 16: 15-16. Sánchez Martínez, F., J. L. Alvarado & L. Morett-Alatorre.1998. Las cuevas del Gallo y de la Chagüera. Inventario arquebotánico e inferencias. Arqueología 19: 81–89. Singh, A. K. 1990. Cytogenetics and Evolution in the Cucurbitaceae. In: D. M. Bates, R.W. Robinson, & C. Jeffrey (Eds.). Biology and Utilization of the Cucurbitaeae (pp. 10-28). Cornell University Press, Ithaca, NY. Smith, B. 2005. Reassessing Coxcatlan Cave and the early history of domesticated plants in Mesoamerica. Proc. Nat. Acad. Sci. 102: 9438-9445. Sobti, S. N. & S.D. Singh. 1961. A chromosome survey of Indian medicinal plants. Part I. Proc. Indian Acad. Sci. 54: 138-144. Standley, P. C. & J.A. Steyermark. 1944. Studies of Central American plants. IV. Field Mus. Nat. Hist. Bot. Ser. 23: 31-109. Sugiura, T. 1938. A list of chromosome numbers in Angiosperm plants. V. Proc. Imp. Acad. Japan 14: 391-392. Sugiura, T. 1940. Studies on the chromosome numbers in higher vascular plants. Citologia 10: 363-370. Swartz, O. Flora Indiae Occidentalis. Leiden. Vargas, E. 1991. Chayote Sechium edule (Jacq.) Swartz, Cucurbitaceae. In: Aspectos Técnicos sobre Cuarenta y Cinco Cultivos Agrícolas de Costa Rica (pp. 327-336). Ministerio de Agricultura y Ganaderia, Dirección General de Investigación y Extensión Agrícola. San José de Costa Rica. Walters, T. 1989. Historical overview on domesticated plants in China with special emphasis on the Cucurbitaceae. Econ. Bot. 43: 279-313. Whitaker, T. W. & G.N. Davis. 1962b. Cucurbits: Botany, Cultivation, and Utilization. New York. Williams, L. O. 1981. The useful plants of Central America. Ceiba 24: 89 99. Wilson, P. G. 1958. Microsechium hintonii P.G. Wilson. In: Contributions to the Flora of Tropical America. LXIII. Kew Bull. 13: 161. Wunderlin, R. P. 1976. Two new species and a new combination in Frantzia (Cucurbitaceae). Brittonia 28: 239-244. Wunderlin, R. P. 1977. A new species of Frantzia (Cucurbitaceae) from Panama. Bull. Torrey Bot. Club 104: 102-104. Wunderlin, R. P. 1978. Cucurbitaceae. In: R. E. J. Woodson & R.W. Schery (Eds.). Flora of Panamá. Part IX. Ann. Missouri Bot. Gard. 65: 285 368. Yang, S. L. & T. Walters. 1992. Ethnobotany and the economic role of the Cucurbitaceae of China. Econ. Bot. 46: 349-367. 55