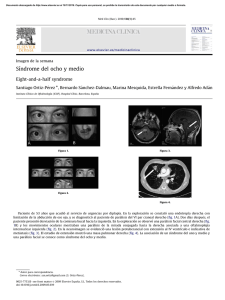
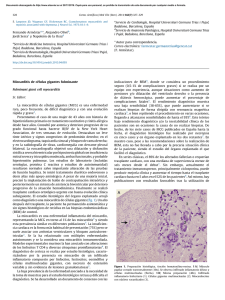
Situación actual del diagnóstico prenatal no invasivo
Anuncio

Órgano oficial de expresión científica y profesional de la Asociación Española de Biopatología Médica, Asociación Española de Farmacéuticos Analistas y Sociedad Española de Bioquímica Clínica y Patología Molecular Comité editorial Director Felip Antoja Ribó (Badalona, Barcelona) Editoras Clara Martínez Gaite (Madrid) María Dolores Ortega de Heredia (Madrid) Roser Ferrer Costa (Barcelona) Consejo editorial José Manuel Egea Caparrós (Murcia) Montserrat González Estecha (Madrid) José María Guardiola Vicente (Madrid) Juan B. Ortolá Devesa (Denia, Alicante) Vicente Peg Rodríguez (Zaragoza) Juan Carlos Vella Ramírez (Burgos) Comité asesor B. Barceló Martín (Palma de Mallorca, España) P. Bermejo Barrera (Santiago de Compostela, España) E. Boquet Jiménez (Manresa, España) L. A. Borque Larrea (Logroño, España) C. A. Burtis (Oak Ridge, EEUU) M. Esteban Salán (Galdakao, España) J. A. Gómez Gerique (Santander, España) B. Gouget (París, Francia) Asociación Española de Biopatología Médica (AEBM) Presidente Miguel García Montes Travessera de Gràcia, 17-21 Tel.: 932 000 711 08021 Barcelona Asociación Española de Farmacéuticos Analistas (AEFA) Presidente Santiago Martínez del Olmo Infanta Mercedes, 90 Tel.: 914 021 212 28020 Madrid Publicación trimestral (4 números al año). © Copyright 2009 Asociación Española de Biopatología Médica, Asociación Española de Farmacéuticos y Analistas y Sociedad Española de Bioquímica Clínica y Patología Molecular Reservados todos los derechos. El contenido de la presente publicación no puede ser reproducido, ni transmitido por ningún procedimiento electrónico o mecánico, incluyendo fotocopia, grabación magnética, ni registrado por ningún sistema de recuperación de información, en ninguna forma, ni por ningún medio, sin la previa autorización por escrito del titular de los derechos de explotación de la misma. ELSEVIER ESPAÑA, a los efectos previstos en el artículo 32.1 párrafo segundo del vigente TRLPI, se opone de forma expresa al uso parcial o total de las páginas de REVISTA DEL LABORATORIO CLÍNICO con el propósito de elaborar resúmenes de prensa con fines comerciales. Cualquier forma de reproducción, distribución, comunicación pública o transformación de esta obra sólo puede ser realizada con la autorización de sus titulares, salvo excepción prevista por la ley. Diríjase a CEDRO (Centro Español de Derechos Reprográficos, www.cedro.org) si necesita fotocopiar o escanear algún fragmento de esta obra. REVISTA DEL LABORATORIO CLÍNICO se distribuye exclusivamente entre los profesionales de la salud. Disponible en internet: www.elsevier.es/LabClin F. Marques (Oporto, Portugal) P. Martínez Hernández (Murcia, España) D. Mazziotta (Buenos Aires, Argentina) N. Nogués Gálvez (Barcelona, España) V. Palicka (Hradec Králové, República Checa) J. J. Picazo de la Garza (Madrid, España) M. Plebani (Padua, Italia) A. San Miguel Hernández (Valladolid, España) Sociedad Española de Bioquímica Clínica y Patología Molecular (SEQC) Presidente Francisco Vicente Álvarez Menéndez Tarifa de suscripción anual Profesiones 94,33 € Instituciones 238,80 € MIR y esdudiantes 56,12 € (IVA incluido. Precios válidos sólo para España) Suscripciones y atención al cliente: Elsevier España, S.L. Travessera de Gràcia, 17-21 • 08021 Barcelona. Tel.: 902 888 740 Correo electrónico: suscripciones@elsevier.com Protección de datos: Elsevier España, S.L., declara cumplir lo dispuesto por la Ley Orgánica 15/1999, de 13 de diciembre, de Protección de Datos de Carácter Personal Papel ecológico libre de cloro. Esta publicación se imprime en papel no ácido. This publication is printed in acid-free paper. Correo electrónico: lclinico@elsevier.com Impreso en España Depósito legal: B-1407-2008 ISSN: 1888-4008 Vol. 2 Núm. 1 Enero-Marzo 2009 Editorial Tiempos difíciles para el área del diagnóstico in vitro 1 F.V. Álvarez Originales Aplicación del modelo Seis-Sigma en la mejora de la calidad analítica del laboratorio clínico 2 C. Ricós, C. Perich, V. Álvarez, C. Biosca, M.V. Doménech, C.V. Jiménez, J. Minchinela, M. Simón, F. Cava, J.V. García Lario y P. Fernández Evaluación del sistema automatizado Sperm Class Analyzer® (SCA) para análisis del semen 8 C. Aulesa, M. Cabrera, R. Alonso, M. Benítez y M. Martínez Plan anual de la calidad en un servicio de análisis clínicos 17 Á. Salas García, C. Gimeno Bosch, M. Buxeda Figuerola y X. Martínez Ollé Nota técnica Utilidad de dos marcadores biológicos de infección bacteriana en niños menores de 2 años 30 J.L. Pascual Gómez, M. Palanca Giménez, F. Bermudo Guitarte, M. Valle Jiménez y F. Gascón Luna Revisión Nuevos marcadores en el síndrome coronario agudo 34 D. Pérez Surribas, M.C. Cárdenas Fernández, M. Cortés Rius, M. Fernández García, M. García Montes, I. Llompart Alabern, T. Rodríguez González, C. Valldecabres Ortiz, J.A. Viedma Contreras, E. Zapico Muñiz y C. Martínez Bru Situación actual del diagnóstico prenatal no invasivo 47 A. Fernández Fernández, B. Prieto García y F.V. Álvarez Menéndez Documento Armonización de resultados de HbA1c en España 56 R. Goberna, M. Aguilar-Diosdado, K. Santos-Rey y J. Mateo Carta al Director Acidosis metabólica grave por intoxicación con etilenglicol 59 M.C. Sanz-Aránguez Felipe y M. Rey Múgica Fe de errores Fe de errores de “Síndrome hemofagocíticio: un caso” B.B. Elorza 61 Vol. 2 Num. 1 January-March 2009 Editorial Difficult times for in vitro diagnosis 1 F.V. Álvarez Original articles Application of the Six-Sigma model to improve analytical quality in the clinical laboratory 2 C. Ricós, C. Perich, V. Álvarez, C. Biosca, M.V. Doménech, C.V. Jiménez, J. Minchinela, M. Simón, F. Cava, J.V. García Lario and P. Fernández Evaluation of automated system Sperm Class Analyzer (SCA) for semen analysis 8 C. Aulesa, M. Cabrera, R. Alonso, M. Benítez and M. Martínez Annual quality plan in a clinical laboratory 17 Á. Salas García, C. Gimeno Bosch, M. Buxeda Figuerola and X. Martínez Ollé Technical note Use of two bacterial infection biomarkers in children under 2 years old 30 J.L. Pascual Gómez, M. Palanca Giménez, F. Bermudo Guitarte, M. Valle Jiménez and F. Gascón Luna Revision New biomarkers in acute coronary syndrome 34 D. Pérez Surribas, M.C. Cárdenas Fernández, M. Cortés Rius, M. Fernández García, M. García Montes, I. Llompart Alabern, T. Rodríguez González, C. Valldecabres Ortiz, J.A. Viedma Contreras, E. Zapico Muñiz and C. Martínez Bru Current state of the non-invasive prenatal diagnosis methods 47 A. Fernández Fernández, B. Prieto García and F.V. Álvarez Menéndez Document Harmonization of the results of HbA1c in Spain 56 R. Goberna, M. Aguilar-Diosdado, K. Santos-Rey and J. Mateo Letter to the Director Severe metabolic acidosis due to ethylene glycol poisoning 59 M.C. Sanz-Aránguez Felipe and M. Rey Múgica Erratum Erratum to “hemofagociticio syndrome: a case” B.B. Elorza 61 Revista del Laboratorio Clínico www.elsevier.es/LabClinlegal NOTA DE AGRADECIMIENTO A LOS REVISORES DE 2008 Relación de revisores que han participado durante el año 2008 en la valoración crítica de artículos presentados a REVISTA DEL LABORATORIO CLÍNICO para su publicación María del Pino Afonso Medina José Ángel Aguilar Doreste María Jesús Alsina Kirchner Luisa Álvarez Francisco V. Álvarez Menéndez Manuel Arroyo Fernández Carmen Betriu Cabecerán Ernest Boquet Jiménez Antonio Buño Soto Ernesto Casis Sáenz María del Patrocinio Chueca Rodríguez Antonio Cruceyra Ventin M. Ángeles Cuadrado Cenzual Aitor Delmiro Magdalena Ramon Deulofeu Piquet María Ángeles Diéguez Junquera María Vicenta Domenech Clar Aureli Esquerda Serrano Margarita Esteban Salan Begoña Ezquieta Zubicaray Carme Farré Masip Xavier Filella Pla Miguel García Montes Ana García Raja José Antonio Garrote Adrados Alba Cecilia Garzón González José Manuel Gasalla Herraiz Nuria Giménez Gómez Ana Godino García José Manuel González de Buitrago Montserrat González Estecha Joaquin González Revalderia José María Hernández Pérez Mercedes Ibarz Escuer Carmen Mar Medina José Luis Marin Soria Cecília Martínez-Brú María Jesús Martínez de Osaba Madariaga Daniel Mazziotta Jesús Molano Mateos Josefina Mora Brugués Raluca Oancea José Manuel Pena Ezquerra M. Rosario Pérez Saldaña David Pérez Surribas Carme Perich Alsina Aída Pitarch Velasco Santiago Prieto Menchero Alfredo Repáraz Andrade Carmen Ricos Aguila Manuel S. Rodríguez Oliva Isabel Sánchez Prieto Rosa Maria Segura Cardona Josep Torres Nicolau Juan Carlos Vella Ramírez Salvador Ventura Pedret Maria Dolors Xirau Vergés Edgar Zapico ARTICLE IN PRESS Rev Lab Clin. 2009;2(1):1 Revista del Laboratorio Clínico www.elsevier.es/LabClin EDITORIAL Tiempos difı́ciles para el área del diagnóstico in vitro ‘‘Difficult times for in vitro diagnosis’’ En la actualidad, desgraciadamente, no soplan vientos favorables en el área del diagnóstico in vitro, laboratorio clı́nico. Desde hace tiempo, en determinadas comunidades autónomas, se han tomado o se están tomando decisiones importantes en el tema de la Sanidad Pública, debido al gasto creciente e insostenible que se está produciendo. Ante este hecho, uno de los objetivos es disminuir el gasto del laboratorio clı́nico. En principio, la idea parece correcta, excepto si se cree que esta medida corregirá y, por lo tanto, resolverá el incremento de gasto en la Sanidad Pública. Por el contrario, serı́a una actuación correcta conseguir una mayor eficiencia no sólo en el laboratorio clı́nico sino también en el resto de los servicios sanitarios. Uno de los principios básicos, quizás el más importante, para conseguir una mayor eficiencia en los servicios sanitarios es tomar decisiones basadas en las opiniones de los profesionales reconocidos por las sociedades cientı́ficas, y digo profesionales, en plural, porque una sola opinión estarı́a sesgada por naturaleza. Es un craso error solicitar la opinión de las sociedades cientı́ficas acerca de un proyecto, cuya decisión ya está tomada, para, a pesar de que dichas sociedades no estén de acuerdo con dicho proyecto, justificar moralmente la decisión ya tomada previamente. La idea, proyecto, de externalización del laboratorio clı́nico es un error, y será un fracaso a largo plazo, aunque por desgracia quien haya tomado esa decisión polı́tica probablemente ya no tendrá responsabilidades y, por lo tanto, quienes sufrirán las consecuencias serán los profesionales sanitarios y los usuarios. Y digo que es un error basándome en que el único objetivo que persigue el polı́tico es el estrictamente económico, ya que el de calidad lo desconoce, pensando que el gasto final debe ser inferior al que se tendrı́a en el hospital público. Ignoran, por desconocimiento, todo el valor añadido que acompaña a un resultado, siendo este último lo único que va a aportar un laboratorio privado. La ausencia de diálogo clı́nico-facultativo del laboratorio en ambas direcciones, la proximidad del laboratorio al clı́nico, la calidad, la investigación, la gestión económica, que ya se realiza en muchos laboratorios, entre otras, dejarán de existir con la mencionada externalización. No es menos cierto que se ha pasado de no exigir una mayor eficiencia a los profesionales del laboratorio clı́nico a decidir que el proyecto ideal es la externalización, porque es más rentable económicamente. En otras palabras, nos vemos obligados a tomar esta decisión porque ustedes no son eficientes. Los profesionales del laboratorio tenemos todos la obligación, dado los vientos desfavorables que soplan, de ser más eficientes. Aquellos que tenemos una mayor responsabilidad debemos ofrecer proyectos a la Administración Pública que demuestren que podemos ser eficientes y competitivos incluso con los laboratorios privados, que son los que pretenden demostrar que en el área del diagnóstico in vitro lo pueden hacer más barato, a secas. Las sociedades cientı́ficas AEBM, AEFA y SEQC tomaron la decisión en los dos últimos años de fusionar sus congresos, con el objetivo de reducir gastos a las empresas del diagnóstico in vitro, para conseguir un congreso más potente en todos los aspectos, fundamentalmente en el cientı́fico. Ası́ mismo, han decidido crear una nueva revista cientı́fica, REVISTA DEL LABORATORIO CLÍNICO, con el objetivo de que satisfaga cientı́ficamente a todos los profesionales del laboratorio clı́nico. Las tres sociedades mencionadas han desarrollado estos proyectos pensando que era la opción correcta y necesaria. La situación actual nos exige demostrar a las instituciones públicas que podemos y debemos ser eficientes, presentando proyectos que demuestren que el laboratorio clı́nico ejerce un papel muy importante en el cuidado del paciente, siendo indispensable que esté al lado del clı́nico y que, por lo tanto, es un craso error su externalización. Francisco V. Álvarez Hospital Universitario Central de Asturias, Oviedo, Asturias, España 1888-4008/$ - see front matter & 2009 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. doi:10.1016/S1888-4008(09)00010-5 ARTICLE IN PRESS Rev Lab Clin. 2009;2(1):2–7 Revista del Laboratorio Clínico www.elsevier.es/LabClin ORIGINAL Aplicación del modelo Seis-Sigma en la mejora de la calidad analı́tica del laboratorio clı́nico Carmen Ricósa,b,, Carmen Pericha,c, Virtudes Álvareza,d, Carmen Bioscaa,e, M. Vicenta Doménecha,f, Carlos Vı́ctor Jiméneza,g, Joana Minchinelaa,g, Margarita Simóna,h, Fernando Cavaa,i, José Vicente Garcı́a Larioa,j y Pilar Fernándeza,k a Comisión de Calidad Analı́tica de la Sociedad Española de Quı́mica Clı́nica y Patologı́a Molecular Laboratoris Clı́nics, Hospital Universitari Vall d’Hebron, Barcelona, España c Laboratori Clı́nic Bon Pastor, Barcelona, España d Laboratori Clı́nic de L’Hospitalet, Barcelona, España e Servicio de Bioquı́mica Clı́nica, Hospital Germans Trias i Pujol, Badalona, Barcelona, España f Laboratori Clı́nic Manso, Barcelona, España g Laboratori Clı́nic Barcelonès Nord i Vallès Oriental, Badalona, Barcelona, España h Consorci Laboratori Intercomarcal, Vilafranca del Penedés, Barcelona, España i Laboratorio Fundación Hospital Alcorcón, Madrid, España j Servicio de Análisis Clı́nicos, Hospital Universitario Virgen de las Nieves, Granada, España k Servicio de Análisis Clı́nicos, Hospital Universitario La Paz, Madrid, España b Recibido el 31 de julio de 2008; aceptado el 30 de octubre de 2008 PALABRAS CLAVE Modelo Seis Sigma; Mejora de la calidad; Laboratorio clı́nico Resumen Introducción: el modelo Seis Sigma es una herramienta de gestión de la calidad que se basa en la medida de la variabilidad de un proceso, en términos de desviación tı́pica o de fallos por millón. Implica haber definido previamente una especificación de la calidad para el proceso que se investiga. Material y método: este trabajo estudia los datos obtenidos en los programas de garantı́a externa de la calidad de la Sociedad Española de Bioquı́mica Clı́nica y Patologı́a Molecular (SEQC), con el propósito de deducir consecuencias prácticas que aseguren el diagnóstico y el seguimiento correctos del paciente, mediante el informe aportado por el laboratorio. Se incluyen magnitudes biológicas con especificaciones de la calidad definidas para situaciones clı́nicas concretas (colesterol, glucosa, glucohemoglobina y antı́geno prostático especı́fico total) y con valores de variación biológica bajos (ión sodio, albúmina), intermedios (colesterol, creatinina, glucosa) y altos (hierro, triglicéridos). El valor sigma se calcula mediante el cociente entre el lı́mite de tolerancia establecido y la variabilidad del proceso. Autor para correspondencia. Correo electrónico: cricos@vhebron.net (C. Ricós). 1888-4008/$ - see front matter & 2008 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. doi:10.1016/j.labcli.2008.10.003 ARTICLE IN PRESS Aplicación del modelo Seis-Sigma en la mejora de la calidad analı́tica del laboratorio clı́nico 3 Resultados: los valores sigma obtenidos son adecuados (X3) si se toman especificaciones muy permisivas, mientras que no lo son cuando se desea cumplir la especificación derivada de la variación biológica. Ello indica que los instrumentos y métodos analı́ticos disponibles en nuestro mercado requieren un procedimiento de control de la calidad muy cuidadoso (procesamiento de varias muestras control, necesidad de realizar repeticiones, etc.). Conclusiones: en ningún caso se debe confundir el objetivo de alcanzar la calidad necesaria para el adecuado uso clı́nico del informe analı́tico con el de conseguir un laboratorio industrialmente productivo; ambos forman parte del concepto de calidad total. & 2008 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. KEYWORDS Six Sigma model; Quality improvement; Clinical laboratory Application of the Six-Sigma model to improve analytical quality in the clinical laboratory Abstract Introduction: The Six Sigma model is a management tool based on measuring process variability, in terms of standard deviation or defects per million. It involves defining the specifications of the quality desired for the process investigated. Material and method: This work uses data obtained by the laboratories participating in the external surveys organized by the Spanish Society of Clinical Biochemistry and Molecular Pathology (SEQC), with the aim of promoting practical recommendations for assuring satisfactory patient diagnosis or monitoring through the laboratory report. The analytes included have quality specifications defined for specific clinical situations (cholesterol, glucose, HbA1C, total PSA) and have narrow (albumin, sodium), medium (cholesterol, creatinine, glucose) and wide (iron, triglyceride) biological variations. Results from control materials with the relevant concentrations to make clinical decisions have been used in this study. Sigma matrix is calculated from the ratio between quality specification and process coefficient of variation. Results: Results obtained show that sigma values are good (X3) when using permissive quality specifications, whereas they are poor if quality specifications are derived from biological variation. This finding indicates that instruments and methods available in our field require a strict quality control procedure (several control samples per run, repeated tests, etc.). Conclusions: The objective of obtaining the quality required for adequate clinical use, must not be confused with that of achieving an economically productive laboratory; both are part of the concept of total quality management. & 2008 AEBM, AEFA y SEQC. Published by Elsevier España, S.L. All rights reserved. Introducción El modelo Seis Sigma es una herramienta de gestión de la calidad que introduce el concepto )mejora* en el clásico ciclo de Deming PDCA (plan, do, check, act) para gestionar un proceso. Se basa en la medida de la variabilidad de un proceso, en términos de desviación tı́pica o de fallos (defectos) por millón. Implica haber definido previamente una especificación de la calidad, también denominado lı́mite de tolerancia, lı́mite de aceptabilidad o requisito de la calidad, para el proceso que se investiga. Éste, en el proceso analı́tico del laboratorio clı́nico, puede estar basado en cualquiera de los criterios aceptados en el acuerdo de Estocolmo, 19991. El valor Seis Sigma ideal implica que la variabilidad de un proceso debe caber 6 veces dentro del lı́mite aceptable preestablecido, para considerar que el proceso funciona perfectamente. Un valor sigma de 3 es considerado como indicativo de calidad mı́nima aceptable para un producto o proceso2. El valor sigma permite comparar la calidad de procesos muy dispares, por ejemplo, la seguridad de una lı́nea aérea, la seguridad de un neumático, la pérdida de equipajes en un aeropuerto, la variabilidad de resultados entre laboratorios usuarios de un mismo método e instrumento, etc. Los valores sigma ideales para estos ejemplos son 6, 5, 4 y 3, respectivamente2. Gras y Philippe3 realizaron una revisión muy completa sobre la aplicación del modelo Seis Sigma en el laboratorio clı́nico. Con el objeto de determinar el valor sigma de las prestaciones analı́ticas en nuestro paı́s, este trabajo estudia los datos obtenidos en los programas de garantı́a externa de la calidad de la Sociedad Española de Bioquı́mica Clı́nica y Patologı́a Molecular (SEQC). El propósito final es deducir consecuencias prácticas que aseguren el diagnóstico y el seguimiento correctos del paciente, mediante el informe aportado por el laboratorio. ARTICLE IN PRESS 4 C. Ricós et al VB 5 CSC 4 3 2 1 sCG ¼ ETT =CVglobal rro H ér ie id o A lic Tr ig l ro PS o te si es ta ol C Io n po sa bA 1c H G lu co in a in in m bú Io n So Las fórmulas utilizadas para calcular los dos parámetros mencionados son: Al – Satisfacción de las necesidades médicas en una situación clı́nica concreta. – Variabilidad biológica. – Criterios de expertos y encuestas a especialistas. – Especificación mı́nima consensuada entre las sociedades cientı́ficas españolas SEQC, AEFA y AEBM6. a 0 d Se define la especificación de la calidad para el error total (ETT) como la desviación de una determinación única de un material control respecto al valor teórico de dicho material5. Para ello se utilizan cuatro de los criterios aceptados internacionalmente en Estocolmo1 que, en orden decreciente en cuanto a utilidad médica, son: 6 at – Calidad global de una prueba (CG), que tiene en cuenta la variabilidad de los resultados obtenidos por todos los laboratorios para una prueba (p. ej., determinación de glucosa en sangre). – Calidad de un instrumento (CI), que es consecuencia de la variabilidad de los resultados producidos por los usuarios de un mismo instrumento y método analı́tico. re Se utilizan los datos obtenidos en el programa de garantı́a externa de la calidad de la SEQC de bioquı́mica en suero, del año 20064. Las magnitudes estudiadas son: albúmina, antı́geno prostático especı́fico (PSA) total, colesterol, creatinina, glucosa, glucohemoglobina (HbA1C), hierro, ión potasio, ión sodio y triglicérido. Para cada magnitud se han tomado los resultados obtenidos para los lotes control de concentración próxima a los valores de decisión clı́nica. Estos datos se encuentran disponibles para los usuarios del programa en la página web (http://www.contcal.org/k3/). El valor sigma se calcula mediante el cociente entre el lı́mite de tolerancia establecido y la variabilidad del proceso. Sobre la base de los resultados obtenidos en los programas de garantı́a externa de la calidad, se calculan los siguientes parámetros: derivadas de la variación biológica (VB) y del Consenso de Sociedades Cientı́ficas (CSC) y en orden creciente respecto al valor derivado de la variación biológica. El valor sigma calculado con las especificaciones de consenso es bastante uniforme entre las diversas magnitudes estudiadas (de 2,2 a 3,5). En cambio, cuando la especificación se basa en la variación biológica, el valor sigma varı́a más (entre 0,4 y 4,9), y es menor para las magnitudes con fuerte regulación homeostática (ión sodio, albúmina y creatinina). En la figura 2 se muestra el error total tolerable según los cuatro tipos de especificaciones de la calidad descritos en el apartado )Material y método*, para la determinación de HbA1C, ası́ como los valores sigma resultantes. En todos los casos el valor sigma eso3. En la tabla 1 se muestran los valores sigma obtenidos con el instrumento más utilizado en los programas de garantı́a externa examinados, calculados sobre la base de los cuatro C Material y método Figura 1 Valores sigma según la variación biológica (VB) y el consenso de sociedades cientı́ficas (CSC), calculados teniendo en cuenta los resultados obtenidos por todos los participantes en cada programa estudiado. HbA1C: glucohemoglobina; PSA: antı́geno prostático especı́fico. 10 Sigma sCI ¼ ETT =CVinstrumento donde CVglobal es el coeficiente de variación obtenido con los resultados de todos los participantes para una magnitud concreta, y CVinstrumento, el coeficiente de variación obtenido con los resultados de los laboratorios que emplean el mismo instrumento. Resultados Para cada magnitud estudiada se han revisado datos de hasta 870 laboratorios, con 12 valores anuales cada uno, por lo que se ha trabajado con un total de 10.440 resultados. En la figura 1 se muestran los valores sigma indicativos de la calidad global de las magnitudes incluidas en este estudio, calculados teniendo en cuenta las especificaciones 8 ET 6 4 2 0 VB (16) Exper tos (19) Opinión clínicos (19) Encuestas (13, 14) Figura 2 Glucohemoglobina. Error total (ET) aceptable según cuatro tipos de especificaciones y valor sigma resultante. ARTICLE IN PRESS Aplicación del modelo Seis-Sigma en la mejora de la calidad analı́tica del laboratorio clı́nico Tabla 1 5 Valores sigma obtenidos con el instrumento más utilizado sobre la base de especificaciones mı́nimas o deseables Magnitud Instrumento y método Situación clı́nica Variación biológica Opinión de expertos/clı́nicos Consenso de sociedades cientı́ficas Albúmina Roche Modular, verde bromocresol Roche Modular, CHOD-POD Roche Modular, picrato compensado Roche Modular, hexocinasa Menarini HA-8160, calibración JDS Roche Modular, ferrocina Roche Modular, potenciometrı́a indirecta Roche Modular, potenciometrı́a indirecta Roche Modular E-170, luminiscencia Roche Modular, lipasa/glicerol cinasa colorimétrico ND 0,6 ND 5,5 0,3, riesgo coronario 3,2 1,1 (NCEP) 3,5 ND 1,3 ND 5,5 1,3, diagnóstico diabéticos 2,4 ND 3,3 1,4, seguimiento diabéticos 1,6 – ND 9,7 1,9 (ADA), 1,5 (encuesta) ND 7 ND 2,7 ND 3,3 ND 0,5 ND 2,8 1,4, detección de cáncer de próstata ND 7,7 ND — 10,6 ND 5,7 Colesterol Creatinina Glucosa Glucohemoglobina Hierro Ión potasio Ión sodio PSA total Triglicérido ND: no disponible; PSA: antı́geno prostático especı́fico. tipos de especificaciones mencionados anteriormente. Para las magnitudes estudiadas, todos los valores sigma son 43 (excepto ión sodio, con muy fuerte regulación homeostática) si se consideran las especificaciones mı́nimas consensuadas entre sociedades cientı́ficas. Por el contrario, sólo lo son en algunos casos en que se definen a partir de la variación biológica, y en ningún caso cuando se hace a partir de las opiniones de expertos o de los clı́nicos. Discusión Las magnitudes biológicas incluidas en el estudio cumplen alguna de las siguientes condiciones: tener especificaciones de la calidad definidas para situaciones clı́nicas concretas (colesterol, glucosa, HbA1C y PSA total), ası́ como valores de variación biológica bajos (ión sodio, albúmina), intermedios (colesterol, creatinina, glucosa) y altos (hierro, triglicéridos). Para cada magnitud evaluada se eligieron los resultados del control de concentración relevante para tomar decisiones clı́nicas. Éstas son: albúmina para decidir tratamiento con nutrición parenteral7, colesterol para determinar el riesgo de enfermedad coronaria8, creatinina como expresión del filtrado glomerular alterado9,10, glucosa para el diagnóstico de la diabetes mellitus11; para HbA1C, hierro, ión potasio, ión sodio, triglicéridos y PSA total se tomaron los valores correspondientes al lı́mite superior del intervalo de referencia poblacional. El valor sigma resultante depende de la especificación de la calidad predeterminada. Si se toman especificaciones muy permisivas, como las consensuadas entre sociedades cientı́ficas españolas6, el valor sigma obtenido para la mayorı́a de las magnitudes estudiadas es aceptable. Por ejemplo, para creatinina el valor sigma del instrumento más utilizado (Roche Modular) es de 5,5 (aceptable) frente a la especificación mı́nima consensuada por sociedades cientı́ficas españolas, mientras que es de 1,3 (inaceptable) si se calcula frente a la especificación derivada de la variación biológica. Las especificaciones consenso (SEQC/AEFA/AEBM) delimitan la calidad mı́nima, por debajo de la cual una prestación no se puede considerar profesionalmente aceptable6. El valor sigma uniforme obtenido en las magnitudes estudiadas es consecuencia del razonamiento utilizado para definir el consenso, que se basa en la prestación obtenida por el 95% de los 1.806 laboratorios participantes en los programas de garantı́a externa de la calidad organizados por estas sociedades, una vez excluidos los valores extremos. Si se asume que un laboratorio alcanza las especificaciones de la calidad basadas en las necesidades médicas para resolver situaciones clı́nicas concretas, el valor sigma obtenido es en general p3. Ejemplos para situaciones clı́nicas especı́ficas son: – En el diagnóstico de diabetes mellitus se acepta un coeficiente de variación analı́tico menor del 4% y error sistemático nulo en la determinación de glucosa en ARTICLE IN PRESS 6 sangre12. Aplicando este concepto al coeficiente de variación del instrumento más utilizado en el programa externo de la SEQC (Roche Modular con método Hexoquinasa) (CV ¼ 3,2%), el valor sigma resultante es 1,3. – La encuesta internacional sobre seguimiento del paciente diabético mediante la determinación de HbA1C indica que el coeficiente de variación deber estar comprendido entre el 3 y el 4%13,14. En el programa de la SEQC, el CV del método más frecuente (HPLC calibración JDS) es del 2,6%, y su valor sigma es 1,4. – En la evaluación del riesgo de enfermedad cardı́aca el error sistemático para la determinación de colesterol debe ser menor del 1%15. En el programa externo de la SEQC, el valor sigma para el método más frecuente (colesterol oxidasa-estearasa-peroxidada en Roche Modular) es 0,3. – En la evaluación del riesgo de cáncer de próstata el error sistemático para la determinación de PSA total debe ser menor del 6%15. En el programa de la SEQC el método con mayor participación es la luminiscencia con el instrumento Roche Modular E-170, que obtiene un CV del 4,4%. El valor sigma es 1,4. En cuanto a las especificaciones derivadas de la variación biológica, si un laboratorio las cumple para imprecisión y sesgo (considerando que las dos fuentes de variabilidad se encuentran en el proceso analı́tico sistemático), los valores sigma obtenidos para las magnitudes biológicas incluidas en este trabajo resultan, en general, menores que 1,6. Mediante revisión realizada por los autores de este trabajo, lo mismo sucede para las 300 magnitudes descritas en la página web de la SEQC16. Si se consiguiera anular el error sistemático, entonces los valores sigma estarı́an situados alrededor de 3 con lo que se conseguirı́a una prestación satisfactoria. Los resultados de este trabajo indican que si la especificación de la calidad analı́tica exigida es amplia, el valor sigma es X3. Mientras que si la especificación es más exigente, el valor sigma no es satisfactorio. Cuando esto sucede en todos los laboratorios usuarios de un mismo sistema analı́tico (instrumento y método), hay que pedir a los fabricantes que dediquen un mayor esfuerzo para producir equipos y reactivos con menor variabilidad. El valor sigma sólo es mayor que 3 cuando las especificaciones a cumplir se corresponden con una exigencia de calidad mı́nima. ¿Es suficiente esta calidad analı́tica para el cuidado de la salud? La respuesta es no, porque el sistema de salud actual, basado en guı́as de práctica clı́nica, requiere que los resultados del laboratorio sean indiscutiblemente seguros. Como aboga Westgard2, no es suficiente cumplir los requisitos mı́nimos de la calidad, como los del CLIA17 o el acuerdo SEQC/AEFA/AEBM6, sino que hay que alcanzar las especificaciones de satisfacción médica. Además, ya se ha visto que si se definen especificaciones que satisfagan las situaciones clı́nicas especı́ficas, la variación biológica y las opiniones de expertos, el valor sigma es inadecuado. Indiscutiblemente, no se puede bajar la guardia y se debe alcanzar la calidad necesaria para fines médicos. Obtener un valor sigma mayor que 3 significa que el sistema analı́tico es productivo desde el punto de vista industrial; requiere poco control, pocas repeticiones y C. Ricós et al resultará poco costoso18. Como se ha visto, esto sólo sucede para las magnitudes biológicas con poca regulación homeostática o bien si se renuncia a alcanzar el estándar de calidad requerido para satisfacer las necesidades médicas. Cuanto menor es el valor sigma obtenido, mejor y más estricto debe ser el control de la calidad, con el propósito de conseguir la máxima potencia de detección de errores (aumentar el número de muestras control, estrechar la regla operativa, implementar otros diseños que aseguren la calidad, utilizar medias de pacientes, etc.). Todo lo expuesto hasta aquı́ se refiere a resultados entre laboratorios. En un laboratorio individual se supone que hay menos fuentes de variación que entre distintos laboratorios y sus valores sigma serı́an ligeramente mejores. No obstante, los razonamientos planteados en este trabajo son igualmente válidos. Por último, aunque se ha postulado que la aplicación del concepto Seis Sigma para reducir los errores es costosa para el laboratorio3, no lo es en absoluto si se utiliza como herramienta de mejora en un laboratorio que tenga implantado un sistema de gestión de la calidad, ya que los datos necesarios son elementos básicos de dicha gestión y suelen ser fácilmente accesibles. Además, conocer el valor sigma facilita la definición de las reglas operativas para el control interno del proceso analı́tico2 mediante programas informáticos de control de la calidad analı́tica disponibles en nuestro mercado (Unity Real Time de Bio-Rad Laboratories, S.A. e Inter QC de Vitro, S.A.). Conclusiones En general, los instrumentos y métodos disponibles en nuestro mercado no son )industrialmente productivos* si se desea cumplir los objetivos de calidad apropiados para el cuidado de la salud. Nuestros sistemas analı́ticos requieren un procedimiento de control de la calidad del proceso analı́tico muy cuidadoso, al que hay que dedicar esfuerzo y recursos para conseguir prestaciones adecuadas (procesamiento de varias muestras control, necesidad de realizar repeticiones, etc.). En ningún caso se debe confundir el objetivo de alcanzar la calidad necesaria para el adecuado uso clı́nico del informe analı́tico con el de conseguir un laboratorio industrialmente productivo; ambos forman parte del concepto de calidad total. Bibliografı́a 1. Kenny D, Fraser CG, Hyltoft Petersen P, Kallner A. Consenso final. En: Estrategias para establecer especificaciones globales de la calidad analı́tica en el laboratorio clı́nico. Barcelona: SEQC; 1999 [raducción de Scand J Clin Lab Invest. 1999;59:585]. 2. Westgard JO. Six sigma basics. En: Six sigma quality design and control. Madison: Westgard QC; 2006. 3. Gras JM, Philipe M. Application of the Six Sigma concept in clinical laboratories: a review. Clin Chem Lab Med. 2007;45: 789–96. 4. Comité de garantı́a de la calidad y acreditación de Laboratorios. SEQC. Quim Clin. 2007;26:87–153. 5. BIPM, IEC, IFCC, ISO, IUPAC, IUPAP, OIML. International vocabulary of basic and general terms in metrology. 3.a ed. Geneva; 2004. ARTICLE IN PRESS Aplicación del modelo Seis-Sigma en la mejora de la calidad analı́tica del laboratorio clı́nico 6. Buño A, Calafell R, Morancho J, Ramón F, Ricós C, Salas A. Consenso sobre especificaciones mı́nimas de la calidad analı́tica. Rev Lab Clin. 2008;1:35–9. 7. Gidden F, Shenkin A. Laboratory support of the clinical nutrition service. Clin Chem Lab Med. 2000;38:693–714. 8. Current status of blood cholesterol measurements in clinical laboratories in the United States: a report from the Laboratory Standardization Panel of National Cholesterol Education Program. Clin Chem. 1988;34:193–201. 9. Myers GL, Miller WG, Coresh J, et al. Recommendations for improving serum creatinine measurement. A report from the laboratory working group of the National Kidney Disease Education Program. Clin Chem. 2006;52:5–18. 10. Coresh J, Astor BC, McQuillan G, et al. Calibration and random variation of the serum creatinine assay as critical elements of using equations to estimate glomerular filtration rate. Am J Kidney Dis. 2002;39:920–9. 11. Sachs JB, Bruns DE, Golldstein DE, et al. Guidelines and recommendations for the analysis in the diagnosis and management of diabetes mellitus. Clin Chem. 2002;48:436–72. 12. Hyltoft Petersen P, Brandslund I, Jorgensen L, et al. Evaluation of systematic and random factors measurement of fasting 13. 14. 15. 16. 17. 18. 7 plasma glucose as the basis for analytical quality specifications in the diagnosis of diabetes. 3. Impact of the new WHO and ADA recommendations on diagnosis of diabetes mellitus. Scand J Clin Lab Invest. 2001;61:191–204. Skeie S, Perich C, Ricós A, et al. Postanalytical external quality assessment of blood glucose and Hemoglobin A1C: an international survey. Clin Chem. 2005;51:1145–53. Perich C, Simón M, Minchinela J, et al. Especificaciones de la calidad analı́tica para glucosa y HbA1C obtenidas a través de encuestas a los clı́nicos. Quim Clin. 2005;24:158–63. Klee GG, Schryver PG, Kisabeth RM. Analytic bias specifications based on analysis of effects of performance of medical guidelines. Scan J Clin Lab Invest. 1999;59:509–12. Comité de garantı́a de la calidad y acreditación de laboratorios. Comisión de calidad analı́tica. SEQC. Base de datos de variación biológica. 2008. Disponible en: http://www.seqc.es/article/ articleview/330/1/170. CLIA Proficiency Testing Criteria & Analytical Quality Requirements. 2008. Disponible en: http://www.westgard.com/ clia.htm. Westgard JO. Assuring the right quality right. Madison: Westgard QC; 2007. ARTICLE IN PRESS Rev Lab Clin. 2009;2(1):8–16 Revista del Laboratorio Clínico www.elsevier.es/LabClin ORIGINAL Evaluación del sistema automatizado Sperm Class Analyzers (SCA) para análisis del semen Carlos Aulesa, M. Cabrera, R. Alonso, M. Benı́tez y M. Martı́nez Unidad de Seminologı́a, Laboratorios Clı́nicos, Ciutat Sanitària Vall d’Hebron, Barcelona, España Recibido el 18 de marzo de 2008, aceptado el 3 de septiembre de 2008 PALABRAS CLAVE Seminograma; Métodos automatizados de análisis de semen CASA (Computer-Assisted Sperm Analysis); Recuento de espermatozoides; Analisis de movilidad y morfologı́a espermática Resumen Objetivo: efectuar la evaluación completa del nuevo analizador Sperm Class Analyzers (SCA v.3.2.0) para la realización del seminograma en sus apartados de recuento y movilidad y de la morfologı́a espermática, que incorpora las últimas mejoras en tecnologı́a y software a este sistema de análisis de semen tipo CASA (Computer-Assisted Sperm Analysis). Material y métodos: se procesaron 150 muestras de semen provenientes de las áreas clı́nicas de esterilidad y urologı́a. Se analizaron 42 muestras en el módulo de concentración del SCA y 65 muestras en el módulo de movilidad, utilizando en ambos la cámara de Leja desechable de 10 mm de profundidad. Paralelamente se realizó el recuento manual de los sémenes por duplicado en cámara de Neubauer Improved y el estudio de la movilidad por el método manual, en porta y cubre 22 22 mm a 37 1C, en 200 espermatozoides y se estudió la imprecisión, la linealidad y la exactitud del SCA con el método manual. El análisis de la morfologı́a espermática se efectuó procesando un total de 50 muestras por el módulo de morfologı́a del SCA; las mismas extensiones ya teñidas fueron evaluadas manualmente a 200 células por un facultativo titulado en EHSRE y calculando su coeficiente de correlación. Resultados: el recuento del SCA ha presentado una imprecisión media intradı́a del 10,13%, con un rango de entre el 3,2 y el 17,1%, dependiendo de la cifra de recuento y su correlación con el método manual ha sido de r ¼ 0,98 (p ¼ 0,001). Se ha comprobado la linealidad en el recuento con el SCA entre 190 millones de espermatozoides hasta 0,5 millones/ml. La movilidad ha presentado una imprecisión mayor en los clasificados como b% y c% de la OMS, con un valor medio de 21,81%, que los a% y d% OMS, con un valor medio del 10,32%, dependiendo también del recuento de la muestra y se ha comprobado la fiabilidad de la medición del parámetro de movilidad hasta una concentración máxima de 120 millones/ml. La morfologı́a utilizando el criterio personal de configuración del SCA, ha presentado una correlación positiva significativa r ¼ 0,899 (p ¼ 0,0001), con el método manual de referencia. Autor para correspondencia. Correo electrónico: caulesa@vhebron.net (C. Aulesa). 1888-4008/$ - see front matter & 2008 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. doi:10.1016/j.labcli.2008.09.001 ARTICLE IN PRESS Evaluación del sistema automatizado Sperm Class Analyzers (SCA) para análisis del semen 9 Conclusiones: se ha validado positivamente el recuento y la movilidad efectuadas con el SCA, utilizando la cámara de Leja desechable de 10 mm de profundidad. Se establecen una serie de premisas para la utilización de la morfologı́a automatizada realizada por el SCA, y se plantea también la utilidad clı́nica de algunos de los nuevos parámetros cinéticos y morfométricos del espermatozoide que proporciona el analizador de semen. & 2008 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. KEYWORDS Spermiogram; Automated Sperm Analysis CASA (Computer-Assisted Sperm Analysis); Sperm count; Sperm motility and morphology analysis Evaluation of automated system Sperm Class Analyzer (SCA) for semen analysis Abstract Objective: Evaluation of the efficiency of the New Sperm Class Analyzers (SCA v.3.2.0) in sperm automated analysis for the calculation of the motility, concentration and morphology parameters using the latest CASA (Computer-Assisted Sperm Analysis) technology in software for spermiogram analysis. Materials and methods: Analysis of 150 semen samples from the clinical areas of Fertility and Urology, 42 samples were analyzed with the SCA concentration module and 65 samples were analyzed with the SCA motility module using a disposable 10 micron deep Leja Chamber in both. At the same time the samples were analyzed by the manual method using the Neubauer Improved chamber for counting and slides with 22 22 mm cover slip heated to 37 1C with an average of 200 spermatozoa for motility, in order to test the precision, linearity and accuracy of SCA system compared with the manual method. The morphology analysis was evaluated using 50 pre-stained slides and evaluating 200 cells both manually by an ESHRE qualified technician and the SCA method and then calculating the correlation coefficient. Results: The counting with SCA system compared with the manual method has shown a within-day imprecision of 10.13% with a range between 3.2% and 17.1% depending on the count level; correlation with the manual method was r ¼ 0.98 (P ¼ 0.001). The linearity of the SCA was shown to be linear between 0.5 million and 190 million sperm/ml. The motility module showed a higher within-day imprecision in counting WHO ‘‘type b’’ and ‘‘type c’’ spermatozoa (21.81%) than the ‘‘type a’’ and ‘‘type d’’, with an average value of 10.32%, also depending on the count rate. The reliability of the motility parameter was evaluated up to a of 120 million sperm/ml. The morphology module, with a customised configuration of parameters, had a significant positive correlation (r ¼ 0.899; P ¼ 0.0001) compared with the manual method. Conclusions: The comparison of the concentration and motility of spermatozoa between the manual method and the SCA modules using 10 microns deep Leja chambers was positively evaluated. A series of premises are established for using the automated morphology performed on the Sperm Class Analyzer. The clinical usefulness of some of the new kinetic and morphometric parameters of sperm provided by the semen analyser is also established. & 2008 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. Introducción La presión asistencial que ha comportado el aumento de la demanda del perfil analı́tico del seminograma al área de andrologı́a, debido al auge de las técnicas de reproducción asistida en nuestros hospitales, ha creado al laboratorio la necesidad de la automatización del seminograma, escogiendo en nuestro caso los denominados métodos CASA (Computer-Assisted Sperm Analysis), para dar la adecuada respuesta a este aumento de la demanda analı́tica1–3. Estos métodos CASA deben cumplir las premisas de homologación establecidas por el grupo especial de andrologı́a de la ESHRE4 y el instrumento debe estar conectado a un sistema de computación que permita la organización de datos y su análisis estadı́stico, ası́ como el cálculo de los nuevos parámetros cinéticos que define la Organización Mundial de la Salud (OMS) en su manual de laboratorio para el examen del semen humano5. Se ha efectuado la evaluación del nuevo analizador Sperm Class Analyzers (SCA V.3.2.0)6 durante 1 año, en una muestra de 150 sémenes de los que se procesaron 42 muestras de recuento, 65 de movilidad y 50 muestras de la morfologı́a espermática. El analizador no contempla aún la realización automatizada de la vitalidad espermática. Se han evaluado los módulos del SCA que se citan a continuación: a) el recuento de espermatozoides, su ARTICLE IN PRESS 10 correlación con el método de referencia manual, la linealidad y los coeficientes de variación; b) la movilidad, su correlación con el método manual, la linealidad y sus coeficientes de variación; c) en el módulo de la morfologı́a, el parámetro de porcentaje de normalidad, sus coeficientes de variación y su correlación con el método manual, realizado por un facultativo con titulación EHSRE (European Society of Human Reproduction and Embriology) y avalado por la experiencia del procesamiento del control externo español (Ceifer) los últimos 2 años y d se plantea finalmente, la utilidad clı́nica de los nuevos parámetros cinéticos y morfológicos que presenta el SCA6. Material y métodos Instrumentación Sperm Class Analyzers (SCA) El SCA es un equipo que permite analizar el semen de manera precisa y objetiva6 y pertenece a la generación de los sistemas de análisis de semen tipo CASA, integrado por los siguientes componentes: 1. Hardware: ordenador, cámara digital Basler (VisionTechnology) 312 FC/C, 25 imágenes/s, microscopio Nikon B-200 con platina termostatizada, placa calefactora Omron. 2. Software: SCA. Es un programa informático compuesto por los siguientes módulos: – Módulo de movilidad y concentración: es el módulo para analizar la movilidad y la concentración espermática que se realiza utilizando las cámaras desechables de Leja, aconsejadas por el fabricante del analizador y utilizadas por varios autores7–10. Este módulo necesita disponer de un microscopio que incorpore una platina termostatizada a 37 1C para efectuar las mediciones. – Módulo de morfologı́a: es el módulo que analiza la morfologı́a y morfometrı́a de los espermatozoides. – Otros módulos: módulo de control base de datos e informes, módulo de concentración OMS, módulo de fragmentación de ADN, módulo contador. Análisis de concentración y movilidad El análisis de la concentración y la movilidad con el SCA se efectúa a la vez con la misma muestra. Se realiza tomando 1–5 ml de semen, que se sitúan en alguna de las cámaras de Leja desechables de varias profundidades disponibles, previamente atemperada a 37 1C en placa calefactora. Concentración. La configuración del tipo de cámara de recuento empleada será muy importante, dado que para los cálculos finales de la concentración, el factor de cálculo empleado dependerá del grosor o profundidad de la cámara escogida. Para este fin hay, en la opción de propiedades, un campo dedicado a seleccionar la cámara de recuento que se usa. Para la realización del análisis, una vez colocada la muestra en la cámara de Leja, el usuario puede visualizar la imagen y capturar hasta 10 campos y un número ilimitado de espermatozoides, dependiendo del recuento de la muestra con un mı́nimo de 200–300 espermatozoides, de acuerdo con lo establecido por la OMS5, o capturar más si lo desea –en C. Aulesa et al nuestro caso 1.000 espermatozoides por muestra–. Finalmente, el SCA permite una configuración personalizada del informe final (centro, NH, etc.), escogiendo los parámetros de impresión deseados. Movilidad. Antes de la realización del análisis se escoge, en la opción de configuración del sistema, el criterio de clasificación de la movilidad según la velocidad de los espermatozoides, siguiendo los criterios prefijados o según criterios personales, para ajustar, en este último caso, el analizador a sus propios valores de referencia. El análisis de movilidad se hace a la vez y con la misma muestra que el de concentración, y ambos resultados se imprimen en un mismo informe. En el análisis de la movilidad además de los parámetros clásicos (a%, b%, c%, d% de la OMS), el SCA obtiene los parámetros morfocinéticos que vienen definidos por el fabricante de la siguiente manera4: a) VCL: velocidad curvilı́nea de los espermatozoides (mm/s); b) VSL: velocidad rectilı́nea de los espermatozoides (mm/s); c) VAP: velocidad media de los espermatozoides (mm/s); d) STR: ı́ndice de rectitud de los espermatozoides (%); e) LIN: ı́ndice de linealidad de los espermatozoides (%); f) WOB: ı́ndice de oscilación de los espermatozoides (%); g) ALH: amplitud del desplazamiento lateral de la cabeza de los espermatozoides (mm/s), y h) BCF: frecuencia de cruce de los espermatozoides (Hz). El SCA informa del porcentaje de espermatozoides denominados hiperactivos (ALH 42,5 mm/s y STR 4 85%)1,4,6. Análisis de morfologı́a El SCA permite la elección del criterio de realización de la morfologia espermática: la OMS5, criterio de Tygerberg (Kruger)3 y personal. Los 2 primeros son criterios definidos y no se pueden modificar; además van ligados a unos valores morfométricos especı́ficos que el fabricante refiere adoptados de las recomendaciones del Grupo de Andrologı́a de la ESHRE en la reunión celebrada en Pisa en 19974. El criterio personal permite que el usuario pueda cambiar y ajustar los valores de clasificación y morfométricos. La configuración de los parámetros morfométricos del analizador se realiza en la opción de configuración del módulo, escogiendo uno de los 3 criterios disponibles ya descritos. El SCA, además del parámetro del porcentaje de espermatozoides normales, presenta el cálculo automatizado de parámetros morfológicos, como los ı́ndices de teratozoospermia, la deformidad5 y la presentación de los valores morfométricos medios de los 100 espermatozoides estudiados (longitud, anchura, tamaño del acrosoma, ángulo de inserción medio de la cola, etc.). Indicar que en el estudio de la morfologı́a del SCA se excluye prácticamente la cola del espermatozoide y no se contempla el análisis de células germinales y leucocitos. Para realizar el análisis de la morfologı́a, el usuario debe colocar, en la platina del microscopio, el porta con la muestra de semen, previamente fijada y teñida correctamente con Diff Quik (Allegiance Healthcare Corp, McGraw Park, IL, EE.UU.). Para este análisis se utiliza el objetivo de 100x y campo claro, por lo que es necesario el cambio de filtro manual, y a continuación se centra y se enfoca la imagen en un ARTICLE IN PRESS Evaluación del sistema automatizado Sperm Class Analyzers (SCA) para análisis del semen espermatozoide y se realiza el fotograma, operación que se repite hasta que se llega a 100 espermatozoides. Para la realización de una morfologı́a manual se precisan de 20–25 min por muestra. Pacientes Se realizó un estudio transversal de 150 pacientes a los que se les habı́a solicitado el seminograma. La normativa de recogida de las muestras se hizo siguiendo las indicaciones del documento de la SEQC11, que aconseja un perı́odo de abstinencia sexual de 3–4 dı́as con un máximo de 7 dı́as y procesar la muestra antes de 1 h de su emisión. De los 150 pacientes procesados, 112 pacientes provenı́an de consultas externas de esterilidad y 38 pacientes de la consulta de urologı́a. Procedimiento (seminograma) Se ha realizado siguiendo la normativa de la ESHRE12,13, y se ha efectuado el recuento de espermatozoides en cámara de Neubauer Improved por duplicado contando un mı́nimo 200 espermatozoides. La movilidad manualmente, según la OMS, se mide en un porta con cubre 22 22 mm a 37 1C, también a 200 espermatozoides5. Finalmente, respecto al estudio de la morfologı́a, la realizó un facultativo de laboratorio titulado por la ESHRE siguiendo el criterio de Kruger (valores normales [VN] 414%)3 y las tinciones fueron efectuadas con la ayuda del método rápido de tinción Diff Quick (Allegiance Healthcare Corp, McGraw Park, IL, EE.UU.) y diferenciación a 200 espermatozoides. Las extensiones se realizaron con ayuda de un extensor automático Hemaprep (Cellvision-Izasa), con el que se consiguen unas extensiones uniformes para evaluar la morfologı́a manualmente y automáticamente con el SCA. 11 Métodos estadı́sticos El cálculo de la correlación, la prueba de la t de Student y de la recta de regresión de Passing-Bablock, habitual en el contexto de los trabajos del laboratorio14,15, se efectuaron con ayuda de los programas estadı́sticos SPSS (SPSS, Chicago, IL, EE.UU.) y MedCalc (MedCalc Software, Mariakerke, Bélgica). Resultados Se ha efectuado la evaluación de los diversos módulos de trabajo de que se compone el analizador SCA. El primer módulo del SCA estudiado fue el de movilidad y concentración, módulo que permite realizar el recuento de espermatozoides y el análisis de la movilidad a la vez, con el procesamiento de una misma muestra de semen. La configuración empleada, en nuestro caso en función de la sensibilidad de nuestra cámara digital (Basler 312FC/C, Vision-technology, 25 imágenes/s) y del microscopio Nikon E-200 de que disponemos, se muestra en la figura 1. Sólo se ha validado la Leja desechable de 10 mm de profundidad con 3 ml de semen (equivalente en altura a la cámara de Makler), ya que en las de mayor espesor (20 mm, 100 mm), la cámara digital no era capaz de efectuar lecturas mı́nimamente coherentes en exactitud. La muestra ası́ preparada se coloca en la platina termostatizada del microscopio, la imagen se enfoca y se ajustan el brillo (50) y el contraste ((406) a un nivel de 5 de la escala de grises del analizador –ajuste muy importante–) y se efectúan las lecturas correspondientes después de prefijados estos parámetros6. En primer lugar, hemos verificado la validez del submódulo de recuento-concentración estudiando la correlación y su linealidad. Para ello, se ha procesado en paralelo un total de 42 muestras con el método manual de recuento Rápidos > 15 micras/sg-tipo a%. OMS VCL-Velocidad curvilinia Medios10-15 micras/sg tipo b%. OMS VAP-velocidad promedio de la trayectoria Lentos 01-0 micras/sg tipo c%. OMS STR% porcentaje de índice de rectitud Estáticos tipo d% OMS Figura 1 Configuración del modulo de movilidad-concentración del SCA. ARTICLE IN PRESS 12 C. Aulesa et al (dilución de la muestra, montaje en Neubauer-Improved y recuento por duplicado) y se ha efectuado el recuento automatizado por el SCA. En la figura 2 se muestra la representación de los resultados obtenidos de la recta de regresión de Passing-Bablock con una p ¼ 1,1261 (intervalo de confianza [IC] del 95%, 1,91 a 0,58) y una ordenada en el origen de b ¼ 1,1261 (IC del 95%, 1,03–1,29). Al no 250 200 SCA (mill/l) = 38,27 mill/ml 150 100 = 33,69 mill/ml 50 0 100 150 200 50 Recuento manual Neubauer (mill esper/ml) 0 250 Recuento concentración mill/ml (teórico) Figura 2 Regresión de Passing-Bablock recuento manual/ recuento SCA. 200 150 100 50 Linealidad recuento 0,5-190 millones/ml 0 0 50 100 150 250 Recuento concentración mill/ml espermatozoides SCA (real) Figura 3 Tabla 1 Estudio de la linealidad del recuento en el SCA. englobar el IC del 95% de la ordenada en el origen, el valor 1 indica, según Bablock14, que hay una media proporcionalmente más alta de los resultados del SCA (media ¼ 38,17 millones/ml) respecto al método manual de recuento (media ¼ 33,69 millones/ml), y aunque esta diferencia estadı́sticamente se considere significativa (11,7%) está dentro de la variación biológica del recuento intra-interindividual del 26,8 y el 56,5%, respectivamente, reseñada por varios autores16–18. El coeficiente de correlación entre ambos resultados presenta una r ¼ 0,98 con una po0,001. Complementando la correlación se ha estudiado la linealidad del recuento del SCA con 5 sémenes, diluyendo muestras de recuentos altos, con pipeta de presión positiva Gilson con solución tampón PBS con un pH de 7,2 .Los resultados se muestran en la figura 3 y nos indican que el recuento se puede considerar lineal desde 190 millones epermatozoides/ml a 0,5 millones/ml; por debajo de esta cifra se considera que el recuento no es fiable, ya que el analizador no efectúa ningún recuento ni distingue de un blanco y por encima de 190 millones/ml es recomendable diluir la muestra multiplicando el resultado por el factor de dilución correspondiente. Complementando los estudios de fiabilidad del recuento, hemos hallado la imprecisión intracámara de un mismo recuento de diversas muestras a varias concentraciones, efectuando 10 lecturas de cada una en una misma cámara; los coeficientes de variación que se han obtenido se muestran en la tabla 1. También se ha calculado la imprecisión intercámara, procesado la misma muestra del semen de un paciente en las 4 subcámaras en que está dividida una cámara de Leja4. Los coeficientes de variación que se obtienen de 4 pacientes distintos se muestran en la tabla 1. Se ha complementado la validación de este módulo con el procesamiento este último año de las muestras de recuento del control de calidad externo de Ceifer por el SCA, y se ha obtenido una inexactitud media del 3,06%, calculada respecto al valor diana del informe Ceifer de control de calidad, que mejora notablemente la inexactitud del 18,48% de este año de nuestro laboratorio con el método manual de la cámara de Neubauer. Seguidamente hemos estudiado la fiabilidad del submódulo de movilidad, dado que el SCA permite la clasificación a la carta de las velocidades del espermatozoide, dependiendo de la resolución de la cámara digital (número de imágenes/s) y la calidad del microscopio de que se dispone. En la figura 1 se muestra nuestra configuración personalizada ajustada la programación de estas velocidades (rápidos, medios, lentos) a nuestra cámara digital de grabación Imprecisión del recuento intracámara e intercámara de Leja n 10 10 10 10 Recuento: imprecisión intracámara de 10 lecturas de una misma muestra X (mill/ml) 13,7 21,8 46,2 Cv% 19,2 13,5 11,2 73,8 7,96 Recuento: imprecisión intercámara de una misma muestra en 4 subcámaras diferentes n 4 4 4 4 X (mill/ml) Cv% 148,6 3,2 6,42 17,1 23,9 12,1 49,4 8,14 10 142 7,1 ARTICLE IN PRESS Evaluación del sistema automatizado Sperm Class Analyzers (SCA) para análisis del semen vista clı́nico y que no ha sido posible ajustar más. Complementando los estudios de correlación también se han calculado los coeficientes de variación intracámara, efectuando 10 lecturas de una misma muestra en 5 pacientes distintos. Los resultados, ordenados por concentraciones crecientes, se muestran en la tabla 3. También hemos calculado el coeficiente de variación intercámara, procesando la misma muestra del semen de 4 pacientes, en las 4 subcámaras en que está dividida la cámara de Leja4. Los resultados, ordenados también en concentraciones crecientes, se muestran en la tabla 3. Hemos comprobado que en muestras con recuentos superiores a 120 millones/ml la correlación con el método manual de referencia disminuye significativamente y es aconsejable diluir estas muestras con solución tampón PBS con un pH de 7,2, para estándar (Basler, Vision-Technology, 312 FC/C, 25 imágenes/ s) y microscopio Nikon E-200 con platina termostatizada a 37 1C para que los clasifique como los tipos a%, b% y c% de la OMS. En primer lugar, se realizó el estudio de la correlación con el método manual de referencia (muestra termostatizada a 37 1C y porcentaje de movilidad a%, b%, c%, d% de la OMS a 200 espermatozoides) realizada por un facultativo diplomado en la EHSRE que procesa el control de calidad exteno de Ceifer. En la tabla 2 se muestran los valores medios con el método manual y los obtenidos con el SCA: su correlación y los parámetros de la recta de regresión de Passing-Bablock de la muestra de 65 pacientes, de los que se deduce que el SCA sobrevalora ligeramente los espermatozoides de movilidad d%, diferencia poco trascendente desde el punto de Tabla 2 13 Regresión de passing-bablock movilidad manual y SCA Parámetro movilidad Manual (x) (n ¼ 65) SCA (x) (n ¼ 65) r (corr) (p) a% (OMS) b% (OMS) c% (OMS) d% (OMS) 20% 22% 6% 52% 18% 21% 6% 55% 0,6229 0,47 0,25 0,82 p (IC del 95%) b (IC del 95%) (0,001) 0,8455 (0,66–1,07) 1,55 (0,001) 1,2 (0,93–1,58) 4,54 (0,04) 1,15 (0,75–1,87) 0,95 (0,001) 1,24 (1,07–1,47) 10,95 (1,03–3,679) (12,8–1-1,47) (4,7–1,20) (–21,7 a –0,58) Diferencia significativa (po0,05). Tabla 3 Imprecisión movilidad intracámara e intercámara de Leja Movilidad a% X (cv%) Movilidad b% X (cv%) Movilidad c% X (cv%) Movilidad d% X (cv%) Movilidad: imprecisión intracámara de 10 lecturas de una misma muestra 4,24 (28) 4,9 (48) 2,7 (56) 8,9 (24,4) 7,92 (34) 5,8 (40) 12,2 (22,8) 14,9 (19,6) 6,9 (35) 19,8 (13,4) 31,9 (13,5) 7,6 (28,2) 26,8 (8,54) 45 (8,5) 10 (18,3) Cv X ¼ 19,42% Cv X ¼ 24,72% Cv X ¼ 35,5% 39,8 (14,2) 58,14 (22,8) 60,8 (14,4) 73,4 (10,2) 80 (7,5) Cv X ¼ 13,83% Movilidad: imprecisión intercámara de una misma muestra en 4 subcámaras diferentes 3,6 (26,11) 9,73 (28,5) 4,15 (26,87) 11,4 (11,95) 19,72 (22,9) 5 (26,23) 20,17 (5,6) 23,3 (18,8) 6,45 (17,92) 23,3 (4,90) 34,35 (17,9) 7,6 (15,37) Cv X ¼ 12,14% Cv X ¼ 22,02% Cv X ¼ 21,6% 37 (16,5) 58,87 (8,1) 65,6 (5,43) 72,47 (3,92 Cv X ¼ 8,51% Tabla 4 Valores de los nuevos parámetros morfocinéticos de 35 pacientes con normozoospermia Velocidad curvilı́nea (VCL) Velocidad rectilı́nea(VSL) Velocidad promedio (VAP) ÍIndice de linealidad (LIN) Índice de rectitud (STR) Índice de oscilación (WOB) Amplitud media oscila cabeza (ALH) Frecuencia batida (BCF) Espermatozoides hiperactivos (%) X (IC del 95%) Unidades 60 31 41 51 74 68 2.6 8.6 8 mm/s mm/s mm/s % % % mm Hz % (57–63) (29–32) (39–43) (49–53) (73–76) (67–70) (2,5–2,7) (8,3–8,8) (3–14) ARTICLE IN PRESS 14 C. Aulesa et al de espermatozoides normales que entraban dentro de estos márgenes, hasta lograr una máxima correlación con el método manual de referencia, realizado por un facultativo diplomado en ESHRE y con la experiencia del procesamiento del control externo del semen de Ceifer. Una vez prefijados estos valores, hemos procesado un total de 41 muestras para verificar la fiabilidad de los resultados. Las medias de los resultados obtenidos con el método manual fue del 13%, con un rango del 3–26%, y la media de los resultados con el SCA, del 14%, con un rango del 1–37%. Aplicando la recta de regresión de PassingBablock se han obtenido los siguientes resultados que se muestran en la figura 5: p ¼ 1,2 (IC del 95%, 1–1,474) con una b ¼ 0,001 (IC del 95%, 3,91 a 2,1), lo que según Bablock permite una intercambiabilidad de resultados y calculando la t de Student para datos apareados se obtiene una t ¼ 1,615; p ¼ 0,1142, lo que indica que no hay diferencias significativas entre las medias de ambos resultados, lo que valida el parámetro de porcentaje de morfologı́a normal para su utilización rutinaria con la ampliación propia de los márgenes morfométricos de normalidad de la OMS, sin descartar su ajuste, a medida que adquiramos más 40 35 Morfología SCA (% normales) disminuir la interacción y las colisiones entre espermatozoides y reducir la sobrevaloración de los espermatozoides de tipo d% y c% de la OMS que se ha observado que se produce con la utilización de la cámara Leja de 10 mm de profundidad. Respecto a los nuevos parámetros cinéticos que nos da el SCA (VCL, VSL, porcentaje de hiperactivos), en la tabla 4 se muestran las medias de los valores obtenidos con 35 pacientes de la consulta de esterilidad que presentaban una normozoospermia, según los criterios de la OMS, entre éstos destaca el parámetro de porcentaje de espermatozoides hiperactivos (STR485% y ALH42,5 mm/s) como el parámetro con mas interés clı́nico, como lo reseñan varios autores1,4. Seguidamente hemos estudiado el módulo de realización de la morfologı́a, que se puede configurar para que realice la morfologı́a con el criterio de la OMS5, de Kruger3 o personal, en función de la amplitud de los márgenes de los parámetros de la cabeza (tamaño, forma y acrosoma, etc.) establecidos para estos criterios, acordados por los fabricantes de sistemas CASA con el grupo de interés en andrologı́a de la ESHRE reunido en Italia en 19974, que permite la clasificación como espermatozoides con morfologı́a normal, si las magnitudes del mismo están dentro de estos márgenes. En la figura 4 se muestra la configuración de estos márgenes del criterio de la OMS y el cálculo de estos parámetros. Hemos efectuado un estudio preliminar escogiendo el criterio de Kruger, ya que para la realización de la morfologı́a manual, nosotros utilizamos este criterio. El estudio mostró diferencias significativas con la aplicación de este criterio con unos valores significativamente más bajos de porcentaje de espermatozoides con morfologı́a normal respecto a nuestro método manual. Parecidos resultados se obtuvieron escogiendo el criterio de la OMS en el SCA, lo que en principio cuestiona la realización de la morfologı́a con el SCA con estos criterios, pero dado que este módulo permite una configuración personal, hemos optado por esta última con la ampliación proporcional de los márgenes de normalidad de los parámetros cabeza (tamaño, forma y acrosoma), y de la zona intermedia (distancia, ángulo de inserción cola, anchura) del criterio menos restrictivo de la OMS. Estos márgenes establecidos se muestran también en la figura 4; con su aplicación hemos conseguido aumentar el porcentaje 30 25 × = 14,02% 20 15 × = 12,95% 10 5 0 0 5 10 15 20 25 30 35 40 Recuento manual Neubauer (mill esper/ml) Figura 5 Regresión de Passing-Bablock morfologı́a manual/ morfologı́a SCA. Figura 4 Configuración y parámetros de la morfologı́a SCA, criterio de la OMS y personal. ARTICLE IN PRESS Evaluación del sistema automatizado Sperm Class Analyzers (SCA) para análisis del semen Tabla 5 15 Valores de los nuevos parámetros en 35 pacientes con normozoospermia Normozoospermia (n ¼ 35) Seminograma anormal (n ¼ 27) x (IC del 95%) x (IC del 95%) t de Student (p) Cabeza Longuitud Anchura Área Perı́metro Acrosoma 4,93 (4,8–5,07) 2,93 (2,84–3,01) 11,9 (11,43–12,5) 13,7 (13,3–14,19 44,34 (41,9–46,7) 5,12 2,94 12,5 14,3 40,5 t ¼ 1,43 (0,16) t ¼ 2,15 (0,83) t ¼ –1,19 (0,24) t ¼ 1,67 (0,10) t ¼ 1,84 (0,052) Pieza intermedia Anchura Área 1,19 (1,14–1,24) 2,56 (2,47–2,65) 1,25 (1,17–1,33) 2,53 (2,37–2,67) t ¼ 1,39 (0,172) t ¼ 0,46 (0,64) Cola Ángulo de inserción 13,8 (12,5–15,1) 17,21 (12,8–20,6) t ¼ –2,0 (0,050) Índices morfométricos Índice de teratozoospermia Índice de deformidad 1,34 (1,29–1,39) 1,14 (1,07–1,209 1,42 (1,32–1,50) 1,3 (0,83–1,56) t ¼ 1,41 (0,169) t ¼ –2,7 (0,01) (4,84–5,39) (2,28–3,05) (11,6–13,6) (13,6–15,0) (37,5–43,5) Diferencia significativa (po0,05). experiencia. Además, la realización de una morfologı́a con el SCA, como hemos comprobado, requiere entre 20–25 min por muestra dependiendo del número de espermatozoides. Complementado estos estudios también llevamos a cabo un estudio de reproducibilidad, escogiendo 2 muestras de diferentes rangos de normalidad y procesando cada muestra 10 veces. La muestra normal con una media del 31% de los espermatozoides normales, ha presentado un coeficiente de variación del 13,06%. La segunda muestra de un rango patológico del 12% de morfologı́a normal, ha presentado un coeficiente de variación del 27%. El conocimiento de estos coeficientes nos permite tener también una idea de la variabilidad del analizador en la realización de morfologı́as. También indicar que el software del SCA no contempla el análisis de la cola del espermatozoide y no permite el recuento de células germinales ni leucocitos, recuento muy importante de la morfologı́a espermática por sus implicaciones clı́nicas. Complementando el estudio del principal parámetro de la morfologı́a que constituye el porcentaje de espermatozoides normales, el SCA proporciona una serie de nuevos e importantes parámetros como los valores morfométricos medios de la cabeza (longuitud, anchura, área) pieza intermedia (anchura, ángulo) de los 100 espermatozoides analizados y permite la visualización de cada espermatozoide analizado con sus magnitudes correspondientes. En la tabla 5 se muestran los valores obtenidos de estos nuevos parámetros que hemos creı́do relevantes, hallados con los 35 pacientes de esterilidad que presentaron una normozoospermia y en esta misma tabla se presentan también los valores obtenidos de los mismos parámetros con los 27 pacientes de esterilidad que presentaron alguna anormalidad en los parámetros del seminograma. Efectuando el análisis estadı́stico de la t de Student entre ambos grupos, se observan diferencias significativas en el tamaño del acrosoma y el ángulo de inserción de la cola y el ı́ndice de deformación, lo que en principio nos podı́a indicar que estos 3 parámetros, junto con el ı́ndice de teratozoospermia de la bibliografı́a, podrı́an tener una cierta significación clı́nica. Finalmente, cabe indicar que este módulo es un buen instrumento de docencia para la enseñanza de la realización de la morfologı́a espermática, hecho que hay que tener muy en cuenta como una de sus principales aplicaciones. Discusión El tiempo medio empleado para efectuar un recuento manual en cámara de Neubauer Improve es de 10–12 min por muestra, ya que tiene que efectuarse la dilución de la muestra, montado en cámara y recuento por duplicado; la imprecisión intradı́a media estimada en nuestro laboratorio es del 19% y la interdı́a del 22%, además, está sujeto a múltiples errores. Hemos validado positivamente el recuento automatizado con el SCA efectuado en cámara de Leja desechable de 10 mm de profundidad y que se realiza en menos de 3 min, con una imprecisión media intradı́a del 10,13% con un rango de 3,2–17,1%, según el recuento. Se ha comprobado la exactitud de la medición comparando los resultados del método manual de recuento con el automatizado en una muestra de 42 pacientes y la aplicación de la recta de regresión de Passing-Bablock a estos resultados y se ha puesto de manifiesto que aunque el SCA presente unos recuentos ligeramente más altos, esta diferencia está dentro de la variación biológica del semen16 y clı́nicamente no es relevante, ya que se produce sobre todo en pacientes con recuentos altos. Hemos comprobado, además, la fiabilidad del recuento con el estudio de la linealidad entre 190 millones de espermatozoides/ml a 0,5 millones/ml. Es importante indicar, además, en este apartado, que la presencia de células germinales o leucocitos puede ocasionar interferencias en el recuento que deben mimetizarse, con un proceso adicional de revisión manual del recuento de cada fotograma, eliminando manualmente estas células. ARTICLE IN PRESS 16 Finalmente, el procesamiento de los controles externos de recuento de Ceifer por el SCA este último año nos ha permitido calcular su inexactitd media con el valor diana del informe de control de calidad, que ha sido del 3,06%, lo que mejora nuestra inexactitud media del 18,48% al año con el método manual, lo que ratifica la fiabilidad del recuento automatizado. Respecto al parámetro de la movilidad espermática, que manualmente se realiza de una manera rápida en unos 3 min, es una técnica que requiere mucha experiencia para formar el personal, para que efectúe la valoración de la movilidad con una cierta fiabilidad, siendo la imprecisión media intradı́a del proceso estimada en nuestro laboratorio de un 22% para la movilidad progresiva. El sistema automatizado SCA con platina termostatizada presenta una imprecisión media intradı́a del 18%, reduciendo notablemente la variabilidad manual con un tiempo de realización de 2–3 min y, además, el SCA nos permite también variar los criterios de clasificación de las movilidades para correlacionarlos con nuestra propia normalidad, cámara digital y microscopio de que dispongamos y nos proporciona una objetividad y una reproducibilidad difı́ciles de conseguir por métodos manuales, calculando, además, los nuevos parámetros cinéticos, como VCL, VSL, ALH, BCF, porcentaje de hiperactivos, etc., que podrı́an aplicarse en ayuda al diagnóstico, como ya se ha descrito para el parámetro de porcentaje de espermatozoides hiperactivos1,4. Finalmente, hemos estudiado el módulo de morfologı́a, el tiempo empleado para la realización de una morfologı́a manual ya teñida es de unos 3–4 min y requiere también una cierta experiencia y tiempo de formación del personal para conseguir llegar a los estándares mı́nimos, siendo la imprecisión intradı́a estimada en nuestro laboratorio procesando una extensión con un valor normal de un 18,87%. El SCA requiere de unos 20–25 min para la realización de una morfologı́a; hemos hallado el coeficiente de variación y se ha visto que se reduce la imprecisión-intradı́a a un 13% para valores normales respecto al manual. El SCA permite para la realización automatizada de la morfologı́a espermática la utilización de criterios prefijados de OMS o de Kruger, y como hemos comprobado son muy estrictos y ocasiona unos valores muy bajos de normalidad respecto al método manual y no son aplicables a su utilización rutinaria, pero nosotros ampliando proporcionalmente los márgenes de normalidad establecidos para el criterio de la OMS, hemos conseguido una correlación aceptable con nuestro método manual, lo que en principio permite su utilización, pero dado que el tiempo de realización de cada muestra es de 20–25 min y que prácticamente en el estudio se excluye la cola del espermatozoide y las células germinales y los leucocitos, creemos que sólo es aplicable para estudiar casos muy especı́ficos de patologı́a andrológica. Es importante destacar, además, que respecto a los nuevos parámetros que calcula el SCA, solamente hemos comprobado que algunos podrı́an tener algún significado clı́nico, como los ı́ndices de teratozoospermia, el ı́ndice de deformidad, el tamaño del acrosoma, el ángulo de inserción y los valores medios de los parámetros morfométricos. También es importante indicar que este módulo es un buen instrumento de docencia en el aprendizaje para la realización de la morfologı́a espermática, lo que hay que tener muy en cuenta como una de sus principales aplicaciones. C. Aulesa et al Finalmente, cabe añadir que queda pendiente de automatización el parámetro de la vitalidad espermática y la aplicación al SCA de una platina móvil para hacer posible el análisis automatizado del control de las vasectomı́as que el SCA no contempla en esta versión, pero que el fabricante nos ha indicado que se han incorporado en el nuevo SCA. En resumen, el estudio efectuado, hemos validado el SCA para realizar los recuentos y los porcentajes de movilidad a%, b%, c%, d% de la OMS, con una reducción de los coeficientes de variación respecto al método manual, lo que aumenta la fiabilidad clı́nica de los resultados obtenidos al reducir la variabilidad y la aplicación de la morfologı́a en el uso rutinario queda postergada hasta que se consiga una reducción técnica del tiempo empleado para cada muestra y se mejoren las prestaciones. Bibliografı́a 1. Irvine Stewarrt D. Computer assisted semen analysis systems: sperm motility assessment. Human Reprod. 1995;10:53–7. 2. Centola GM. Comparison of manual microscopic and computer assisted methods for analysis of sperm count and motility. Arch Androl. 1996;36:1–7. 3. Kruger T. Computed-assisted sperm análisis system: morphometric aspects. Human Repro. 1995;10:46–51. 4. ESHRE Andrology Special Interest Group. Guidelines on the application of CASA technology in the analysis of spermatozoa. Human Reproduction. 1998;13:142–5. 5. WHO Laboratory. Manual for the examination of human semen and sperm-cervical mucus interaction. 3rd ed. Cambridge: Cambridge University Press; 1999. 6. Manual de SCAs (Sperm Class Analyser). Microptic, S.L., Barcelona, junio de 2006. 7. Douglas-Hamilton DH, Smith NG, Kuster CE, Vermeiden JP, Althouse G. Partiche distribution in low-volume capillaryloaded chambers. J Andrology. 2005;26:107–13. 8. Douglas-Hamilton DH, Smith NG, Kuster CE, Vermeiden JP, Althouse GC. Capillary-loaded particle fluid dynamics: efect on estimation of sperm concentration. J Androl. 2005;26:115–22. 9. Bailey E, Fenning N, Chamberlain S, Devlin L. Validation of sperm counting methods using limits of agreement. J Androl. 2007;28:364–73. 10. Tomlinson M, Turner J, Powell G, Sakkas D. One-step disposable chambers for sperm concentration and motility assessment: how do they compare with the World Health Organization’s recommended methods. Hum Reprod. 2001;16:121–4. 11. Aulesa C, Mar C. Recomendaciones en la fase preanalı́tica para el analisis de semen. Quim Clin. 2006;25:416–8. 12. Kvist U, Bjorndahl L, editors. Manual on basic semen analysis. ESHRE Monographs. Oxford: Oxford University Press; 1999. 13. ESHRE Monografı́as. Manual de análisis básico de semen. SEQC. Barcelona: Vigor; 2002. 14. Bablock W. Application of statistical procedures in analytical instrument testing. J Clin Lab Automation. 1985;7:74–9. 15. Swets JA, Pickett RM. Evaluation of diagnostic system: methods from signal detection theory. New York: Academic Press; 1982. 16. Álvarez C, Castilla JA, Martı́nez L, Ramı́rez JP. Biological variation of seminal parameters in healthy subjects. Hum Reprod. 2003;18:1–7. 17. Álvarez C, Castilla JA, Ramı́rez JP, Vergara F, Gaforio JJ. External quality control program for semen analysis: Spanish experience. J Assist Reprod Gen. 2005;22:379–87. 18. Castilla JA, Moracho-Zaragoza J, Aguilar J, Prats-Gimenez R, Gonzalvo M, Fernández-Pardo E, et al. Quality specifications for seminal parameters based on the state of the art. Hum Reprod. 2005;19:1–6. ARTICLE IN PRESS Rev Lab Clin. 2009;2(1):17–29 Revista del Laboratorio Clínico www.elsevier.es/LabClin ORIGINAL Plan anual de la calidad en un servicio de análisis clı́nicos$ Ángel Salas Garcı́aa,, Carmen Gimeno Boschb, Marta Buxeda Figuerolab y Xavier Martı́nez Olléb a Planificació i Qualitat, Hospital de Terrassa, Consorci Sanitari de Terrassa, Terrassa, Barcelona, España Servei d’Anàlisis Clı́niques, Hospital de Terrassa, Consorci Sanitari de Terrassa, Terrassa, Barcelona, España b Recibido el 18 de septiembre de 2008; aceptado el 7 de octubre de 2008 PALABRAS CLAVE Cuadro de mando; Cuadro de mando integral; Indicadores de gestión; Plan de calidad. Resumen Introducción y objetivo: el Servicio de Análisis Clı́nicos del Consorcio Sanitario de Terrassa implantó un Sistema de Gestión de la Calidad en el año 2004. Desde ese año hasta 2006, su Plan Anual de la Calidad ha ido incorporando distintos componentes. El objetivo de este trabajo es presentar el Plan de Calidad del año 2006, en el que se han incluido los ı́tems del sistema que tienen indicadores asociados. Material y método: se elaboran los objetivos anuales de la calidad del laboratorio de acuerdo con la Dirección de Planificación y Calidad del Consorcio. Se agrupan las acciones de mejora, generales o por áreas del laboratorio, dando lugar a un Plan de Mejora. Se agrupan los indicadores de los procesos del laboratorio según: indicadores de procesos y subprocesos estratégicos, indicadores de procesos y subprocesos operativos e indicadores de procesos y subprocesos de soporte formando el cuadro de mando. Se prepara el cuadro de mando integral de acuerdo con las lı́neas estratégicas definidas por la Alta Dirección del Consorcio. Resultados: se ha elaborado el Plan Anual de la Calidad del año 2006 constituido por los objetivos de la calidad, el plan de mejora, el cuadro de mando y el cuadro de mando integrado. Conclusiones: el Plan Anual de la Calidad permite hacer un seguimiento de los objetivos y de los procesos implantados en nuestro servicio. También se puede ver cómo se reflejan las lı́neas estratégicas del Consorci Sanitari de Terrassa en el Servicio de Laboratorio. & 2008 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. $ Parte de este trabajo corresponde a la comunicación cientı́fica )Diseño de un Cuadro de Mando Integral en un Servicio de Análisis Clı́nico*, presentada y premiada en el XXV Congreso de la Sociedad Española de Bioquı́mica Clı́nica y Patologı́a Molecular, celebrado en Bilbao del 9 al 11 de octubre de 2006. Autor para correspondencia. Correo electrónico: asalas@cst.cat (A. Salas Garcı́a). 1888-4008/$ - see front matter & 2008 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. doi:10.1016/j.labcli.2008.09.007 ARTICLE IN PRESS 18 A. Salas Garcı́a et al KEYWORDS Dash board; Balanced scorecard; Strategic plan; Management indicators; Quality plan Annual quality plan in a clinical laboratory Abstract Introduction and objective: The Medical Laboratory of Consorci Sanitari of Terrassa introduced a Quality Management System during the year 2004, with an Annual Quality Plan updated to include different items from 2004 to 2006. The objective of this study is to present the 2006 Annual Quality Plan which includes the items of the System that have associated indicators. Material and method: The annual quality objectives with the Planning and Quality Directorate agreement are prepared. The overall or laboratory areas improvement actions are grouped together to make the Improvement Plan. The laboratory indicators processes are gathered according to: Strategic, operative and support process and sub-process indicators to form the Dash Board. The Balanced Scorecard is then prepared following the Management Board strategic plan. Results: The 2006 Annual Quality Plan is prepared from the annual quality objectives, the Improvement Plan, the Dash Board and the Balanced Scorecard. Conclusions: The Annual Plan allows us to follow the objectives and processes introduced into our Laboratory. It also shows how the Consorci Sanitari Strategic Plan involves the Laboratory. & 2008 AEBM, AEFA y SEQC. Published by Elsevier España, S.L. All rights reserved. Introducción En los últimos años, los servicios de análisis clı́nicos se han implicado en el desarrollo y la implantación de distintos sistemas de calidad. Uno de los retos que se presenta es disponer de un método sistemático para diseñar e implantar un sistema de indicadores. Es importante poder contar con un modelo normalizado, ya que permitirá realizar comparaciones con otros servicios analı́ticos y practicar estrategias de mejora, entre ellas el benchmarking. En nuestro sistema de calidad, hemos ido incorporando, bajo la denominación Plan Anual de Calidad, todos los ı́tems que tienen indicadores asociados. El Plan de 2004 estaba constituido por los objetivos de calidad anuales, los indicadores asociados a los procesos y subprocesos y las primeras acciones de mejora. En 2005 se elaboró el primer cuadro de mando (CM), agrupando los indicadores de los procesos del laboratorio, según los tipos de procesos: estratégicos, operativos y de soporte. También se agrupan las acciones de mejora, generales o por áreas del laboratorio dando lugar al plan de mejora (PM). En 2006 se diseñó y se implantó el primer cuadro de mando integral (CMI). Esto supuso un reto para el laboratorio, ya que es un tema novedoso y en el que se carece de experiencia. Para diseñar un sistema de indicadores que tenga presentes las lı́neas estratégicas del Consorcio Sanitario de Terrassa (CST) y plasmarlas en el dı́a a dı́a del laboratorio, recurrimos a estudiar entidades de campos no sanitarios con más tradición y experiencia en este tema. Esas entidades han optado mayoritariamente por dos modelos: policy deployment (Akao, 1991)1 y balanced scorecard (Kaplan, 1997)2. El primero de ellos tuvo una gran difusión en Japón desde los años sesenta y está relacionado con el Premio Deming a la excelencia, mientras que el segundo se ha impuesto en las empresas de Estados Unidos y es el que se tiene presente a la hora de otorgar el premio Malcom Badrige de excelencia. Los dos tienen ventajas e inconvenientes, que se presentan en el libro de Heredia3. En nuestro caso, nos pareció oportuno basarnos en el modelo de Kaplan como herramienta para diseñar nuestro primer CMI del laboratorio. Según Howard Rohm4 del Balanced Scorecard Institute de Estados Unidos, el CMI es )un sistema de administración de desempeño que puede utilizarse en cualquier organización, grande o pequeña, para alinear la visión y la misión con los requerimientos del cliente y las tareas diarias, administrar las estrategias del negocio, supervisar las mejoras en la eficiencia de las operaciones y crear capacidad organizativa comunicando los progresos a todo el personal*. Según proponen Kaplan et al5, en primer lugar en el CMI se debe plasmar la misión y la estrategia de una organización en un conjunto de medidas de la actuación agrupadas según cuatro perspectivas: finanzas, clientes, procesos internos y empleados, y a continuación se debe definir una serie de factores clave que permitirán mejorar la preparación de los empleados y aumentar su motivación, incrementar la calidad de los servicios mejorando los procesos, mejorar la satisfacción de los clientes y conseguir la mejora de los resultados económicos. A partir de aquı́, hay que proponer una serie de indicadores que nos mostrarán si estamos trabajando en la dirección adecuada para alcanzar los objetivos que se han establecido previamente. Definiciones Benchmarking6: metodologı́a que consiste en comparar los procesos y las prestaciones de los productos y servicios de ARTICLE IN PRESS Plan anual de la calidad en un servicio de análisis clı́nicos una organización con los de los lı́deres reconocidos a fin de identificar oportunidades para la mejora de la calidad. Cuadro de mando6: herramienta de gestión que facilita la toma de decisiones y recoge un conjunto coherente de indicadores que proporcionan a la alta dirección y a las funciones responsables una visión comprensible del negocio o de su área de responsabilidad. La información aportada por el CM permite enfocar y alinear a los equipos directivos, las unidades de negocio, los recursos y los procesos con las estrategias de la organización. Cuadro de mando integral5: herramienta de gestión que, mediante un sistema integrado de objetivos, indicadores e iniciativas, describe la estrategia de una organización y permite controlar cómo se va alcanzando estos objetivos estratégicos. Indicador7: datos o conjunto de datos que ayudan a medir objetivamente la evolución de un proceso o una actividad. Objetivo de la calidad8: lo que se ambiciona o se pretende respecto a la calidad. Plan de la calidad8: documento que especifica qué procedimientos y recursos asociados hay que aplicar y quién y cuándo debe aplicarlos a un proyecto, producto, proceso o contrato especı́fico. Material y método Descripción del servicio de análisis clı́nicos (laboratorio) El laboratorio está situado en el Hospital de Terrassa formando parte del Consorci Sanitari de Terrassa (CST), que pertenece a la Red Hospitalaria de Utilización Pública (XHUP). Es un laboratorio hospitalario de análisis clı́nicos integrado, con procesos programados de rutina y de urgencias que atiende a las extracciones procedentes de los pacientes ingresados en el hospital, con 340 camas de agudos, más las procedentes de las extracciones programadas de consultas externas. También da servicio a un hospital penitenciario con 32 camas, a 34 centros de atención primaria (CAP) y dos centros de atención primaria especializada, con una cobertura de población de 400.000 habitantes. De estos 36 CAP, 6 son gestionados por el CST, y a los demás se proporciona el servicio analı́tico mediante un contrato realizado con el Servei Català de la Salut, dependiente de la Generalitat de Catalunya. Tiene implantado un Sistema de Gestión de la Calidad (SGC) certificado en 2004 por AENOR. Documentación empleada Marc general per establir els objectius i el pressupost 2006. Comitè de Direcció del Consorci Sanitari de Terrassa, 23 de septiembre de 2005. Base de datos del Laboratorio. Registros del Sistema de Gestión de la Calidad del Laboratorio. Informe Anual de la Unidad de Garantı́a de la Calidad del 2005. Informe de la Revisión del Sistema de Gestión de la Calidad correspondiente al año 2005 realizado por el Director del Laboratorio. 19 Misión de la organización (CST)9 )Queremos ser una institución de atención integrada de la salud de las personas, orientada a la población del Vallès Occidental y fuertemente vinculada a los municipios. *Una organización actual, tanto en su modelo de atención (integración de niveles, alternativas a la atención convencionaly) como en su estructura fı́sica y en sus equipamientos, y en sus instrumentos de organización y gestión, que utiliza las alianzas estratégicas como vehı́culo para conseguir sus objetivos.* Lı́neas estratégicas del CST 2004–20089 Hacia una organización sanitaria de atención integrada (OSI): ampliación y reorientación de la oferta de servicios. Actualización del modelo de atención, organización y gestión. Modernización de la estructura fı́sica y de los equipos. Establecimiento de alianzas estratégicas. Misión y visión del servicio de análisis clı́nicos10 )La visión clı́nica integrada de las necesidades de un laboratorio, ası́ como la calidad total en su servicio, son elementos clave para hacer de su labor un soporte eficaz para el diagnóstico clı́nico con una calidad y rentabilidad óptima. *Por este motivo hemos definido que la misión del Servicio de Análisis Clı́nicos del CST es: mediante los análisis clı́nicos de cualquier muestra biológica, obtener resultados correctos y proporcionar información diagnóstica, en un tiempo de respuesta adecuado, en un formato apropiado y participar en la interpretación para que sea útil para el enfermo, tanto para la prevención como para el diagnóstico, pronóstico y control de la evolución de la enfermedad, ası́ como también participar en actividades docentes y de investigación. *Creemos que esta visión integrada de las necesidades de un Laboratorio es la que realmente puede dar soluciones a sus problemas, ası́ como hacer de su trabajo un soporte eficaz para el diagnóstico clı́nico, con una calidad y rentabilidad óptimas. *El Servicio de Análisis Clı́nicos también asume y comparte la misión y visión del CHT ası́ como los suyos propios*. Procedimiento El método de trabajo que se emplea consiste en definir los objetivos de calidad anuales, ası́ como el PM, el CM y el CMI asignando los objetivos correspondientes. En nuestro sistema de gestión de la calidad, hemos agrupado bajo la denominación Plan Anual de la Calidad todos los componentes del sistema que tienen indicadores asociados, que en 2006 son: objetivos de calidad, PM, CM y CMI. Objetivos de la calidad Los objetivos de la calidad surgen de la polı́tica de la calidad y de las lı́neas estratégicas del CST; se utilizarán para el ARTICLE IN PRESS 20 A. Salas Garcı́a et al diseño del CMI. Se pactan anualmente con la Dirección de Planificación y Calidad del CST. Plan de mejora. Acciones de mejora Las acciones de mejora surgen de la revisión del sistema del año anterior. También se ha tenido en cuenta el resultado de la auditorı́a externa del año anterior (2005), realizada para determinar el grado de mejora implantado e identificar opciones de mejora en el servicio11. Se presenta un ejemplo de mejora del área de microbiologı́a: optimización de las determinaciones analı́ticas en las muestras de orina para reducir la actividad analı́tica. El estado inicial es programar sedimento y urinocultivo a todas las peticiones que lo solicitan. Estado final: programar sedimento y urinocultivo en los casos que proceda. Primero, en función del diagnóstico clı́nico se programaba sedimento o no, y posterior cultivo. Segundo, en función del sedimento, se programa cultivo o no. Tabla 1 Objetivo deseable Objetivo aceptable OBJECTIVOS DE CALIDAD 2006 Reubicación de las áreas de Urgencias, Hematologı́a, Hemostasia Depósito de Sangre y Biologı́a Molecular en los espacios nuevos Disminuir el consumo de papel en las peticiones analı́ticas Disminuir el volumen del archivo de las copias de las peticiones hechas en soporte papel Descentralización del TAO del Hospital de Terrassa a los CAP 1.a fase: CAP Terrassa Nord Traspaso pacientes Formación personal 1.a fase: CAP Terrassa Est Traspaso pacientes Formación personal Optimizar la demanda analı́tica en el área de Urgencias Implantación de un programa informático gestor de documentos para la Gestión de la Documentación del Sistema de la Calidad Conseguir el equilibrio presupuestario: Personal Conseguir el equilibrio presupuestario: Consumible Objetivos del cuadro de mando Los objetivos asociados a los indicadores del CM, excepto los que corresponden a los indicadores de gestión — I(PRO-05)**—, proceden del histórico de nuestro sistema de gestión de la calidad. Para cada indicador se asignan dos tipos de objetivos, el objetivo deseable y el objetivo aceptable. Normalmente el objetivo aceptable es el que se alcanzó el año anterior y el deseable es el que supone una implicación en la mejora continua del proceso. El Seguimiento de indicadores 1 trimestre 2 trimestre 3 trimestre 100a 4 trimestre 0b Año 100% Llevarlo a término 100% Llevarlo a término Disminuir el 50% Disminuir el 80% Disminuir el 50% Disminuir el 80% 2,8b 100% 95% NA 100% 100% 95% 95% NA NA 100% Traspasar el 60% Traspasar el 10% POSPUESTO 2007 95% Traspasar el 60% Traspasar el 10% NA 18,6b 0% desviación 0% desviación o4% desviación o4% desviación 100a POSPUESTO Cumplir: objetivos deseable y aceptable. No cumplir: objetivos deseable y aceptable. c No cumplir: objetivo deseable y cumplir: objetivo aceptable. b El diseño del CM de los procesos del laboratorio se realiza siguiendo las directrices del documento UNE 661757. Los indicadores se han agrupado según el tipo de proceso con el que estén asociados: indicadores de procesos y subprocesos estratégicos, de procesos y subprocesos operativos y de procesos y subprocesos de soporte. Listado de objetivos de la calidad del año 2006 Indicador a Cuadro de mando NA –13,51a –11,87a –8,82a 2,63c –8,03a 0,38c 10,7b 34,5b 10,21b 10,05b ARTICLE IN PRESS Plan anual de la calidad en un servicio de análisis clı́nicos seguimiento de los objetivos es trimestral, excepto cuando sólo aparece un dato en la columna anual, en cuyo caso es anual. Durante 2006 se ha participado en el ejercicio de intercomparación )Laboratory Management Index Program (LMIP)*, organizado por el College of American Pathologists12, de donde provienen los objetivos correspondientes a los indicadores de gestión. Cuadro de mando integral Para el diseño del CMI, se procede del siguiente modo13–15: Tomamos cada una de las lı́neas estratégicas del CST. Planteamos las perspectivas a considerar pensando en el Servicio de Laboratorio. Identificamos los factores clave (algunos autores los denominan factores de éxito). En nuestro caso son los objetivos de calidad. Definimos los indicadores asociados y los objetivos para cada factor clave. Se han seguido los cinco principios de gestión indicados por Kaplan et al16: Traducir la estrategia a términos operativos. Alinear la empresa con la estrategia. Hacer de la estrategia el trabajo diario de todo el mundo. Hacer de la estrategia un proceso continuo. Movilizar el cambio a través del liderazgo directivo. Plan Anual de la Calidad 2006 Con los objetivos anuales de la calidad, el plan de mejora que recoge las acciones de mejora generales del servicio y las acciones de mejora especı́ficas de las áreas del 21 laboratorio, el CM y el CMI, se prepara el Plan de Calidad 2006 teniendo como referencia la norma UNE 661746. Implantación del plan anual de la calidad La monitorización del plan forma parte del seguimiento del sistema de gestión de calidad, que además incluye otros aspectos relevantes del sistema como, por ejemplo, las no conformidades. Este seguimiento se realiza trimestralmente, mientras que el análisis se realiza a distintos intervalos, dependiendo del nivel crı́tico de los indicadores y siempre que no surjan situaciones puntuales que requieran una rápida actuación. Puede ser trimestral (indicadores relacionados con la mejora de los procesos), semestral (indicadores relacionados con el control del producto) y anual (indicadores relacionados con la formación, entre otros). Resultados Se presenta el Plan Anual de la Calidad del año 2006, desglosado según sus componentes. En algunos componentes se describe sólo un ejemplo y en otros se presenta de una manera más completa. En la tabla 1 se presenta en forma de resumen el seguimiento de los objetivos de la calidad que se utilizarán para definir los factores clave del CMI. En el PM se recogen las acciones de mejora planificadas. Se tiene en cuenta que estas acciones cubran todas las áreas del laboratorio, con acciones generales o particulares por áreas o estamentos. En la tabla 2 se presenta un ejemplo de acción de mejora que corresponde al área de microbiologı́a. En la tabla 3 se presenta en forma de resumen el seguimiento de los indicadores de procesos del sistema de gestión de la calidad del servicio y que configura el CM del laboratorio. En las tablas 1 y 3, se indica el grado de cumplimiento de los objetivos, según distintas letras (a,b,c) Tabla 2 Plan de mejora. Ejemplo de una acción de mejora: optimización de las determinaciones analı́ticas en las muestras de orina en el área de microbiologı́a Responsable Actividades Recursos Seguimiento Método de evaluación Coordinadores microbiologı́a y administración Cambiar las determinaciones solicitadas en función del diagnóstico Instalación del citómetro UF-100 Técnicos administración y coordinador informática 1.er trimestre 2006 Revisar peticiones Analizador (ROCHE) Evaluación del UF-100 Facultativos y técnicos de microbiologı́a Técnicos administración, facultativos y técnicos de microbiologı́a Coordinador y facultativos microbiologı́a 1.er trimestre 2006 2.1 trimestre 2006 3.er trimestre 2006 Documentación Registros 1.1-4.1 trimestre 2006 Cálculo indicador Instauración de los cambios en las peticiones de rutina, según sedimento Evaluación de los cambios realizados Indicador ¼ (número de peticiones de orina modificadas/número de peticiones totales de orina) 100. Objetivo: modificar un 15% de las peticiones. Revisar peticiones I(PRO-05)20 I(PRO-05)21 % grado de satisfacción del cliente Número de no conformidades en el método o instrumento, una vez implantado, por defectos en el protocolo de validación/evaluación Número de no conformidades en los programas informáticos, una vez implantados, por defectos en el protocolo de validación/evaluación Número de determinaciones realizadas en el laboratorio/número de personas que están trabajando en el área analı́tica Número de determinaciones realizadas en el laboratorio/número de personas que están trabajando en el laboratorio Número de personas que están trabajando en el área analı́tica/número total de personas trabajando en el laboratorio Número de determinaciones realizadas en el laboratorio/número total de horas trabajadas Número de determinaciones realizadas en el laboratorio/número total de horas pagadas Número total de horas trabajadas/número total de horas pagadas Número de determinaciones realizadas en el laboratorio/número de determinaciones totales Número de determinaciones correspondientes a pacientes ingresados/número total de dı́as de ocupación de camas Número de determinaciones correspondientes a pacientes ingresados/número de altas realizadas durante el periodo de estudio Número de determinaciones correspondientes a pacientes externos/número de visitas externas Coste del número de horas analı́ticas pagadas/número de determinaciones realizadas en el laboratorio Coste del número total de horas pagadas en el laboratorio/número de determinaciones realizadas en el laboratorio Coste del material consumible/número de determinaciones realizadas en el laboratorio Coste de la amortización/número de determinaciones realizadas en el laboratorio Coste gestionable/número de determinaciones realizadas en el laboratorio Coste total/número total de dı́as de ocupación de camas Coste total/número de altas realizadas durante el periodo de estudio Coste total/número de visitas externas Coste de las determinaciones realizadas en laboratorios externos/número de determinaciones realizadas en laboratorios externos Coste del material del depósito de sangre/coste total Coste total del laboratorio/coste total del hospital 4 95% 4 99,3% o5 o22 o1,1 o0,56 o0,9 o0,5 o0,01 o1,54 o13,61 o69 o2,9 o2,87 o3,97% o7% o3,5 o15 o1 o0,35 o0,6 o0,4 o0,01 o1 o10 o40 o2 o2,87 o3,97% o5% Anulado 4 19 4 21 4 90,5% 4 9.792 65% o4 reclamaciones/ 100.000 determinaciones 4 85% 2 INC/ validación 2 INC/ validación 4 18.601 95% anual Objetivo aceptable 4 96% 4 99,6% 4 30 4 40 4 90% 4 20.000 85% o2 reclamaciones/ 100.000 determinaciones 4 95% 1 INC/ validación 1 INC/ validación 4 30.000 100% anual Objetivo deseable 2b 1c 27.643b b 46a 0c NA 1,27b 10,4b 49,9b 1,9c 7,3a 6,1a 7,4a 0,57 a NA 1,31b 8,6c 44,6b 1,8c 7,3a 0,58 a 0,7b 0,73b 0,47 0,46 1,5a b 1,3a a 7,9a 6,3a 38 85a 99,3a 89a 99,2a 32,8 38c 37c a 45c 42c a 71,9a 70,5a 19.808 NA 0c 38,9a 2,56b 19.497 40,7a 1,93c 27.527b b 100% 2 trimestre NA 1 trimestre Seguimiento indicadores a a 6a NA 1,42b 11,7b 65,87b 2,8b 7,3a 0,64 0,8a 0,5 a 1,9a 45 8a 81a 99,3a 31c 38b 70,6a 16.088 b 22.773b 5a NA 0c 46a 1,38c NA 3 trimestre 6,7a NA 1,5b 10,3b 50,65b 2,4b 7,3a 0,7 a 0,8b 0,5 a 1,5a 33 a 6,6a 81a 99a 32c 39b 72,4a 16.600 b 22.938a 1c 92b 0c 54,3a 2,11b NA 4 trimestre 6,5 NA NA 1,38 10,26 52,75 2,24 7,3 0,63 0,75 0,48 1,57 37 7,2 84 99,2 34,7 41 71,4 17.998 25.220 2,25 69 0 45 1,99 100% Año 22 I(PRO-05)14 I(PRO-05)15 I(PRO-05)16 I(PRO-05)17 I(PRO-05)18 I(PRO-05)19 I(PRO-05)13 I(PRO-05)12 I(PRO-05)11 I(PRO-05)10 I(PRO-05)09 I(PRO-05)08 I(PRO-05)06 I(PRO-05)07 I(PRO-05)05 I(PRO-05)04 I(PRO-05)03 I(PRO-05)02 I(PRO-05)01 I(PRO-04)02 I(PRO-03/4)01 I(PRO-04)01 % grado de cumplimiento del plan de auditorı́as Procesos y subprocesos operativos % cumplimiento de los tiempos de respuesta por área (programados) Número de reclamaciones referidas a la actividad del laboratorio Procesos y subprocesos estratégicos Nombre indicador Cuadro de mando 2006. Listado de indicadores de procesos del sistema de gestión de la calidad I(PRO-03/1)01 I(PRO-03/3)01 I(PRO-08)01 Código Tabla 3 ARTICLE IN PRESS A. Salas Garcı́a et al % unidades transfusionales rechazadas/descartadas. Incluir las caducidades Demanda adecuada de sangre en reserva para cirugı́a electiva. Por servicios % unidades transfundidas/unidades pedidas Reacciones transfusionales (M: mayores, N: menores) Errores de dispensación Errores de administración Número de pruebas realizadas a la cabecera de la cama del cliente relacionado con el número total de transfusiones realizadas Incidencias motivos % de peticiones mal cumplimentadas (Sintrom) Procesos y subprocesos de soporte % de acciones formativas aprobadas y realizadas % personal que ha recibido algún tipo de formación en el área de trabajo a lo largo del año Eficacia de las formaciones realizadas (en una escala del 1 al 5) Número intervenciones del servicio técnico por averı́as en el laboratorio Número incidencias por proveedor de bienes (total) I(PRO-05/2)03 I(PRO-05/2)04 I(PRO-05/2)06 I(PRO-05/2)07 I(PRO-05/2)08 b No cumplir: objetivos deseable y aceptable. No cumplir: objetivo deseable y cumplir: objetivo aceptable. c Cumplir: objetivos deseable y aceptable. a I(PRO-07)05 I(PRO-09)01 I(PRO-09)02 I(PRO-09)03 I(PRO-10)01 I(PRO-07)03 I(PRO-07)04 I(PRO-07)02 I(PRO-06/1)03 I(PRO-06/2)01 I(PRO-07)01 I(PRO-06/1)01 I(PRO-06/1)02 I(PRO-05/2)09 I(PRO-05/3)01 N.o de productos comprados de 1 a 10 de 10 a 20 de 20 a 30 más de 30 Número de reclamaciones a proveedores de servicios (n.o reclamaciones/ peticiones) % proveedores sin incidencias % cumplimiento del tiempo de respuesta de proveedores de determinaciones analı́ticas % transporte de muestras con incidencias % cumplimiento del plan de calibración/verificación % cumplimiento del plan de mantenimiento % participación en los programas de intercomparación % renovación de la documentación % número de unidades transfundidas/número de unidades solicitadas I(PRO-05/2)02 I(PRO-05/2)05 % incidencias en la introducción de peticiones (pruebas y datos demográficos) % de tubos sobrantes (n tubos/n peticiones dı́a) % incidencias en la recepción de muestras (número muestras con incidencias) % resultados aceptables del programa FPCQLC por equipos en las áreas (exactitud) % resultados aceptables de control interno por equipos en las áreas (precisión CV) % repeticiones de muestras procesadas (biologı́a molecular) Número de incidencias en el subproceso analı́tico en el laboratorio % de hemoderivados caducados. CH concentrado hematı́es, PQ: plaquetas, PF: plasma fresco I(PRO-05/1/1)01 I(PRO-05/1/1)02 I(PRO-05/1/1)03 I(PRO-05/1/2)01 I(PRO-05/1/2)02 I(PRO-05/1/2)03 I(PRO-05/1/2)04 I(PRO-05/2)01 75% 80% o5% 4 90% 4 90% 4 95% 4 20% o3% 100% 100% 100% 4 30% o10% 4 2,5 o36 4 80% 450% o10% M: 0 N:o2% 1% 1% 99 o2% o5% o7% 4 80% 4 95% o4% o80 CH: 3%, PQ: 3%, PF: 5% CH: 70% PQ: 90% PF: 95% CH:o3% PQ:o3% PF:o3% 95% 90% 1 2 3 4 o5% 44 o18 N.o de incidencias permitidas 4 95% 4 70% No calculado o5% M: 0 N:o2% o1% o1% o99% o0,8% 1% Anulado o5% 4 95% 4 98% o3% o40 CH:o1%, PQ:o1%, PF:o2% CH: 80% PQ: 95% PF: 97% CH:o3% PQ:o3% PF:o3% Pospuesto 2007 0c 0c 0c 1c 2c 73,7a 85,15b 21a 100c 100c 73,7a 75,9a 12,8a 100c 100c 27b 0c 0c 0c 0c 100c 3,7 99,01c 98,47c 2,35c 42c 0c 0c 0c 63,9a 92,6b 94,9a 0,25c 0c 1,33c c 0,39c 0c 0c 0c 3c 10b 34b Anulado No calculado 0c 0,28a 0c 0c 100c 4 95,29c 99,72c 1,87c 33c 0c 0c 0c 62,1a 93b 97,1c 0,11c 0c 0,34c c 0,66c 100c 100c 24,3a 78,9b 93,9c 0c 0c 0c 4c 4c 26b 0c 0,24a 0c 0c 100c 3,3 86,79b 98,81c 1,4c 41c 0,85c 0c 0c 73,6b 89,2a 96,7b 0,11c 0c 0,34c c 0,24c 100c 100c 10,2a 78,9b 85,2b 0c 0c 0c 2c 2c 27b 0c 0,56c 0c 0c 100c 3,8 96,3c 98,79c 2,2c 37c 0,13c 0c 0c 63,0a 95,1c 95,4b 0c 0,41c 0c c 0,2c 17,1 77,7a 100 100 34c 76,3 85,04 2,25 4,5 4,58c 28,5 83b 0 0,27 0 0 100 0,37 NA 3,7 94,35 98,95 2 38,25 0,24 0 0 65,65 92,47 96 0,12 0,1 0,5 ARTICLE IN PRESS Plan anual de la calidad en un servicio de análisis clı́nicos 23 ARTICLE IN PRESS 24 A. Salas Garcı́a et al Tabla 4 Percentiles del Laboratory Management Index Program: 2006 Indicador 1. Número de determinaciones realizadas en el laboratorio/número de personas que están trabajando en el área analı́tica 2. Número de determinaciones realizadas en el laboratorio/número de personas que están trabajando en el laboratorio 3. Número de personas que están trabajando en el área analı́tica/número total de personas trabajando en el laboratorio, % 4. Número de determinaciones realizadas en el laboratorio/número total de horas trabajadas 5. Número de determinaciones realizadas en el laboratorio/número total de horas pagadas 6. Número total de horas trabajadas/número total de horas pagadas, % 7. Número de determinaciones realizadas en el laboratorio/número de determinaciones totales, % 8. Número de determinaciones correspondientes a pacientes ingresados/ número total de dı́as de ocupación de camas 9. Número de determinaciones correspondientes a pacientes ingresados/ número de altas realizadas durante el periodo de estudio 10. Número de determinaciones correspondientes a pacientes externos/número de visitas externas 11. Coste del número de horas analı́ticas pagadas(euros)/número de determinaciones realizadas en el laboratorio 12. Coste del número total de horas pagadas en el laboratorio(euros) /número de determinaciones realizadas en el laboratorio 13. Coste del material consumible(euros)/ número de determinaciones realizadas en el laboratorio 14. Coste de la amortización (euros)/número de determinaciones realizadas en el laboratorio 15. Coste gestionable(euros)/número de determinaciones realizadas en el laboratorio 16. Coste total (euros)/número total de dı́as de ocupación de camas 17. Coste total (euros)/número de altas realizadas durante el periodo de estudio 18. Coste total (euros)/número de visitas externas 19. Coste de las determinaciones realizadas en laboratorios externos (euros)/número de determinaciones realizadas en laboratorios externos 20. Coste del material del depósito de sangre (euros)/coste total (euros), % Trimestre 1 Trimestre 2 Trimestre 3 Trimestre 4 5% 95% 5% 95% 5% 95% 5% 95% 4.383 18.601 4.237 24.383 3.525 22.392 3.632 22.986 2.886 9.792 2.621 10.110 2.542 10.131 2.523 9.614 34,9 90,49 34,01 88,53 33,75 88,79 35,9 87,73 6,27 20,68 5,72 21,49 5,59 22,89 5,69 21,27 5,55 18,83 5,04 19,44 4,89 19,49 4,85 18,49 82,02 95,14 79,95 94 79,32 92,42 76,4 93,58 84,36 99,32 86,75 99,37 87,13 99,43 86,86 99,4 4,96 16,17 4,89 16,75 4,35 16,14 4,85 16,71 21,74 78,79 18,77 74,8 18,15 75,44 22,63 80,12 1,08 12,64 1,07 9,72 1,12 11,73 1,04 11,46 0,56 2,33 0,46 2,98 0,48 3,21 0,49 2,65 0,93 4,28 0,78 4,28 0,76 4,61 0,81 4,13 0,50 2,33 0,46 2,15 0,54 2,37 0,49 2,29 0,01 0,21 0,02 0,22 0,01 0,22 0,01 0,21 1,54 6,18 1,51 6,43 1,63 6,69 1,66 6,13 13,61 63,59 21,16 68,24 16,52 64,59 14,16 70,66 68,52 324,69 95,74 329,98 81,25 312,57 65,27 353,97 2,91 31,57 3,40 30,97 3,69 40,39 3,52 33,91 2,87 46,87 1,99 48,88 2,55 49,49 3,91 47,48 3,97 21,94 4,50 19,22 4,57 19,82 4,64 20,81 como superı́ndices. En la tabla 4, se presentan los percentiles del 5% y el 95% del programa de intercomparación del CAP. Estos percentiles son los que se utilizan trimestralmente en el seguimiento de los indicadores de gestión del laboratorio, son aquellos cuyo código es desde I(PRO-05)01 hasta I(PRO-05)21. ARTICLE IN PRESS Plan anual de la calidad en un servicio de análisis clı́nicos Determinaciones/persona análisis I (PRO-05)01 40.000 Nivel deseable Nivel aceptable 30.000 20.000 10.000 1° 2° 3° 4° trimestre trimestre trimestre trimestre Laboratorio Figura 1 27.643 27.527 22.773 22.938 25 frecuencia se hace su seguimiento y el método de evaluación para evidenciar si se realizan o no las actividades. En la tabla 6 se indica la fórmula matemática empleada para calcular el valor del indicador y en cursiva se presentan las evidencias en distintas fechas y el resultado del indicador a final de año. En la tabla 7 se presenta la planificación de otro factor clave: )Conseguir el equilibrio presupuestario*. Se sigue el mismo sistema que en la tabla 6, común para todos los factores clave del CMI. Anual 25.220 Ejemplo de seguimiento trimestral de un indicador. Para los indicadores de productividad —I(PRO-05)01 hasta I(PRO-05)07—, se toma como objetivo aceptable el percentil 95% y para el resto de los indicadores correspondientes a utilización —I(PRO-05)08 hasta I(PRO-05)10— y eficiencia —I(PRO-05)11 hasta I(PRO-05)21— se toma como objetivo aceptable el percentil 5%. Los objetivos deseables se consensúan con el Comité de Calidad y el Jefe de Servicio del laboratorio, y con la Dirección de Planificación y Calidad del CST. En la tabla 3, los objetivos aceptables de los indicadores —I(PRO-05)01 hasta I(PRO-05)21— corresponden al primer trimestre de la tabla 4. Sólo se han aplicado a los resultados del primer trimestre; en los otros tres, se han aplicado los valores de los trimestres correspondientes que aparecen en esa tabla. En la figura 1 se presenta un ejemplo de seguimiento trimestral de un indicador, en este caso uno de productividad: )Número de determinaciones realizadas en el laboratorio/Número de personas que están trabajando en el área analı́tica* —I(PRO-05)01—. En la tabla 5 se presentan las lı́neas estratégicas del CST que tienen una implicación directa con el Laboratorio y a partir de ellas, teniendo presentes los recursos asignados al servicio para ese año y junto con la Dirección de Planificación y Calidad del CST, se pactan los objetivos del año, ası́ como los procesos que se verán afectados, que se recogen en la columna )Perspectiva*. Para llevar a cabo las actividades que afectarán a dichos procesos, se definen las acciones de mejora concretas que se recogen en la columna )Factores clave*. En algunos casos se asigna más de un factor clave a una misma perspectiva o proceso. Para poder seguir la evolución en el tiempo y el grado de cumplimiento de los factores clave, se asignan unos indicadores que aparecen en la columna )Indicadores propuestos*, que a su vez tienen asociados unos objetivos cuantitativos que se agrupan en la columna )Objetivo*. La evaluación del grado de consecución del objetivo en particular para cada uno de los indicadores se realiza mediante un control trimestral de ellos, que se recoge en el Plan Anual, y de este plan se presentan a modo de ejemplo las siguientes dos tablas (tablas 6 y 7). En la tabla 6 se presenta el seguimiento y la planificación detallada del factor clave )Disminuir el volumen del archivo de las copias de las peticiones realizadas en soporte papel*. En dicha planificación se indica quiénes son los responsables de las actividades que se pormenoriza. A las actividades se asocian los recursos que van a ser necesarios y se indica con qué Discusión El Sistema de Gestión de la Calidad del Servicio de Análisis Clı́nicos se certificó en 2004. Conllevó la identificación de los procesos existentes y las primeras definiciones de los indicadores asociados a ellos. En 2005 se dispuso del primer CM y en 2006 se incorporó el CMI al plan de calidad general del laboratorio. Este corto intervalo hace que el nuestro sea un sistema de gestión joven, lo que hace que en algunos casos planifiquemos incurriendo en errores que se manifiestan posteriormente, pero todo este proceso lo consideramos como parte de nuestra propia mejora y nuestro aprendizaje. Creemos oportuno dejar constancia de estos hechos en este trabajo, en el que, como se puede observar, hay indicadores que no hemos podido cumplimentar y acciones que hemos tenido que posponer e incluso anular. En la tabla 3, correspondiente al CM, se observa que el número de indicadores no cumplimentados es proporcionalmente inferior al de los indicadores asociados a los factores clave del CMI (tablas 1 y 5). El indicador I(PRO-05)21 )Coste total del laboratorio respecto al coste total del hospital* no se puede calcular debido a que no se puede disponer del coste total del hospital con frecuencia trimestral y sin demora. El indicador I(PRO-05/1/1)02 )% de tubos sobrantes* ha sido de utilidad en años anteriores, pero debido a la eficacia de las acciones correctoras realizadas se ha decidido anularlo y centrar los recursos en el resto de los indicadores. En cuanto al indicador I(PRO-05/2)04 )Demanda adecuada de sangre en reserva para cirugı́a electiva*, es un indicador compartido con el comité hospitalario de transfusiones del hospital. No se constituyó en su nueva etapa hasta finales de 2006, lo que ha implicado que no se pudiera disponer de datos para calcular el indicador. El indicador I(PRO-05/2)09 )Incidencias motivos*, correspondiente al proceso de depósito de sangre, se recoge en los procesos de esta área con los códigos I(PRO-05/2)05 hasta el I(PRO-05/2)07. El indicador I(PRO-05/3)01 )% de peticiones mal cumplimentadas’’ asociado al proceso de Sintrom no se ha informado, lo que ha supuesto una no conformidad en la auditoria interna que ha dado lugar a la correspondiente acción correctora. Y por último, el indicador I(PRO-06/1)02 )% personal que ha recibido algún tipo de formación en el área de trabajo a lo largo del año* se ha anulado, ya que algunas de las acciones formativas planificadas afectan a todo el personal del laboratorio y se ha considerado que carecı́a de eficacia. El intervalo de revisión y seguimiento trimestral del SGC que se ha mantenido desde el inicio de la implantación del sistema (tablas 1, 3 y 7) nos permite detectar con tiempo las posibles desviaciones para poder actuar y corregirlas. ARTICLE IN PRESS 26 A. Salas Garcı́a et al Tabla 5 Cuadro de mando integral 2006 CST Laboratorio Lı́neas estratégicas Perspectiva Factores clave Indicadores propuestos Objetivo Hacia una organización sanitaria integrada (OSI) Actualización del modelo de atención, organización y de gestión Proceso diagnóstico del Sintrom Descentralizar el TAO del Hospital de Terrassa hacia los CAP % pacientes traspasados Traspasar el 95% de los pacientes Proceso de gestión de la documentación Implantación de un sistema informático de gestión de documentos para la gestión de la documentación del sistema de la calidad Optimizar la demanda analı́tica en el área de urgencias % documentos traspasados Traspasar el 10% de los documentos [(pacientes controlados en el lab. urgencias 2006-enero – pacientes controlados en el lab. urgencias 2006diciembre)/pacientes controlados en el lab. urgencias 2006enero] 100 [(N.o de peticiones en papel del hospital (enero de 2006) – N.o de peticiones en papel del hospital (diciembre de 2006))/N.o de peticiones en papel del hospital (enero de 2006)] 100 [(N.o de archivadores diarios de las copias en papel (enero de 2006) – N.o de archivadores diarios de las copias en papel (diciembre de 2006))/N.o de archivadores diarios de las copias en papel (enero de 2006)] 100 % desviación Traspasar el 60% de la demanda analı́tica programada urgente a rutina preferente % cumplimiento del plan 100% finalizar Disminuir el consumo de papel en las peticiones analı́ticas del hospital Disminuir el volumen del archivo de las copias de las peticiones realizadas en soporte papel Modernización de la estructura fı́sica y de los equipamientos Proceso económicofinanciero Procesos diagnósticos de análisis clı́nicos y depósito de sangre Conseguir el equilibrio presupuestario Reubicación de las áreas de urgencias, hematologı́a, hemostasia, depósito de sangre y biologı́a molecular en los espacios nuevos Se ha modificado la frecuencia del análisis de todo el sistema trimestralmente, ya que suponı́a un consumo de recursos considerable; por ello se optó por realizar el análisis de los indicadores por parte de la Unidad de Garantı́a de la Calidad y del Comité de Calidad, con diferentes frecuencias, según el tipo de indicadores. Este Disminuir en un 50% el número de solicitudes analı́ticas del hospital realizadas en soporte papel y realizarlas en soporte informático Disminuir el volumen del archivo en soporte papel un 80% o4% desviación cambio ha supuesto una mejora en cuanto a la utilización de los recursos por parte de la Unidad de Garantı́a de la Calidad. En la tabla 5 se presenta el primer CMI del servicio y en las tablas 1, 6 y 7, el seguimiento de los factores clave/ objetivos. El factor clave )Descentralizar el TAO del Hospital ARTICLE IN PRESS Plan anual de la calidad en un servicio de análisis clı́nicos Tabla 6 papel 27 Planificación de factor clave: disminuir el volumen del archivo de las copias de las peticiones realizadas en soporte Plan anual de la calidad 2006 Servei d’Anàlisis Clı́niques Plan de calidad Versión 1 Data: 10-3-2006 1. Objetivo: disminuir el volumen del archivo en soporte papel un 80% 2. Planificación del objetivo: Copia n.o: Pág. 14 de 15 Responsable Actividades Recursos Seguimiento Método de evaluación Oficina sin papel/ ROCHE Lectura peticiones por el escáner. Preparar el escáner para leer las peticiones y conexión con el SIL OMEGA Adaptar las tareas de registro de peticiones a la nueva situación y eliminación de las copias ya escaneadas Tiempos de técnicos de la oficina sin papel / ROCHE 1.er semestre 2006 Funcionamiento del escáner Registro formación Técnicos administración 1.1-2.1 semestre 2006 Indicador Análisis Personal administración Indicador: [(N.o de archivadores diarios de las copias en papel (enero de 2006) – N.o de archivadores diarios de las copias en papel (diciembre de 2006))/N.o de archivadores diarios de las copias en papel (enero 2006)] 100 Archivadores diarios a enero de 2006: 1. Archivadores diarios a diciembre 2006: 0. Indicador a 31 de diciembre: [(10)/1] 100 ¼ 100% de Terrassa hacia los CAP* se ha tenido que posponer, ya que posteriormente a su planificación, junto con las personas responsables del nivel de primaria del CST e inicio por parte del personal del laboratorio de acciones formativas en los CAP, dejó de ser objetivo prioritario para los otros servicios externos implicados en su desarrollo junto con el laboratorio. En el caso del factor clave )Implantación de un sistema de gestión de documentos para la gestión de la documentación del sistema de la calidad*, se realizaron las acciones formativas durante el segundo semestre del año, pero no se pudo completarlas; por tal motivo, se decidió posponerlo como uno de los objetivos que incorporar en el plan de calidad de 2007. En cuanto al factor clave )Optimizar la demanda analı́tica en el área de urgencias*, se pudo iniciar en el último trimestre de 2006; esta demora se debió al grado de implicación que supuso para los clı́nicos y a la reorganización correspondiente en los circuitos y procesos del laboratorio. El factor )Disminuir el consumo de papel en las peticiones analı́ticas del hospital* estaba supeditado a la utilización de la petición informatizada por los servicios clı́nicos demandantes, que a su vez dependı́an de la implantación de un programa informático por los responsables del área de gestión de información del CST. En el cuarto trimestre de 2006 empezó a funcionar este sistema en el área de urgencias del hospital, pero no consiguió cubrir el objetivo anual y, por lo tanto, en 2007 se seguirı́a implementado en otros servicios clı́nicos. En el factor clave )Disminuir el volumen del archivo de las copias de las peticiones realizadas en soporte papel*, se ha conseguido cumplir el objetivo fijado. En cuanto al factor clave )Conseguir el equilibrio presupuestario*, que se desglosa en seguimiento del presupuesto de personal y seguimiento de presupuesto de consumible, se ha cumplido el objetivo en el primer apartado, pero en cuanto a consumibles se han presentado desviaciones atribuibles al incremento de demanda analı́tica que se ha producido a lo largo del año. El presupuesto asignado se define en función del gasto de esta partida correspondiente al año anterior. Y en el último factor clave, correspondiente a la )Reubicación de las áreas de urgencias, hematologı́a, hemostasia, depósito de sangre y biologı́a molecular en espacios nuevos*, sólo ha quedado pendiente para 2007 la reubicación del área de biologı́a molecular. Creemos que el proceso de implantación de un sistema de indicadores en el laboratorio hasta la planificación de un CMI ha resultado positivo para el laboratorio, ya que nos permite controlar y mejorar el desempeño. Se puede observar que la utilización del propio sistema de gestión implica una mejora a medida que se usa; este hecho se constata en que la definición de indicadores que se plasmó en el CM está bastante consolidado con la experiencia previa en la participación en programas de intercomparación17, y después de 3 años de implantación del sistema de calidad (2003–2006), aunque la asignación de valores a los objetivos se tiene que mejorar ajustándolos a la realidad a partir de la ARTICLE IN PRESS 28 A. Salas Garcı́a et al Tabla 7 Planificación de factor clave: conseguir el equilibrio presupuestario Plan anual de la calidad 2006 Servei d’Anàlisis Clı́niques Plan de calidad Versión 1 Fecha: 10-3-2006 Copia n.o: 1. Objetivo:o4% de desviación del presupuesto 2006 cerrado respecto al presupuesto 2006 asignado 2. Planificación del objetivo: Pág. 15 de 15 Responsable Actividades Recursos Seguimiento Método de evaluación Director del servicio Coordinadores Seguimiento de la evolución de los recursos económicos Tiempos del personal y datos facilitados por la Dirección Económica del CST 2006 Trimestral Registros datos Indicador Análisis Indicador: [(presupuesto asignado – gastos)/presupuesto asignado] 100 Trimestre 1 Trimestre 2 Trimestre 3 Trimestre 4 Año Seguimiento presupuesto personal Presupuesto asignado 466.131,35 Gasto real 403.144,29 Desviación –62.987,06 % desviación –13,51 477.545,85 420.840,09 –56.705,76 –11,87 505.425,4 460.851,4 –44.574 –8,82 448.519,8 460.316,6 11.798,7 2,63 1.897.622,41 1.745.152,32 –152.470,09 –8,03 Seguimiento presupuesto consumible Presupuesto asignado 590.009,76 Gasto real 592.240,68 Desviación 2.230,92 % desviación 0,38 558.672,77 618.270,93 59.598,16 10,7 440.969,54 592.919,8 151.950,26 34,5 621.030,46 684.453,98 63.423,52 10,21 2.260.651,53 2.487.884,39 227.232,86 10,05 experiencia recogida en los primeros años, ya que no existe bibliografı́a abundante sobre el tema como para poder tener referencias externas. En el primer CMI se nota la falta de experiencia en su diseño, que se refleja en que la tasa de errores en la selección de indicadores es mucho mayor que en el CM, si bien hay un hecho adicional importante que se escapa al control del laboratorio: cuando los factores clave interrelacionan distintos servicios o direcciones del CST, la consecución de los objetivos está supeditada a posteriores cambios de prioridad realizados por la alta dirección del CST o las direcciones implicadas, y esto hace que haya un alto grado de incumplimiento de objetivos. El hecho de seguir los principios de gestión de Kaplan et al ha permitido contribuir a los objetivos comunes del CST y trabajar de una manera coordinada e integrada en los distintos niveles organizativos de la entidad, ası́ como tomar decisiones en función de la evolución de los indicadores. También permite el seguimiento y el control de las lı́neas estratégicas del CST en los aspectos que afectan al laboratorio. Conclusiones Tenemos un método de planificación y trabajo que nos permite hacer un seguimiento de los objetivos y de los procesos e ir mejorando la calidad del laboratorio. Debemos mejorar la planificación de las acciones que impliquen a responsables de otros servicios, y esta mejora vendrá por más compromiso y mejoras en la cultura de sistemas de calidad en otras áreas del CST. Agradecimientos Parte de este trabajo se ha realizado con el soporte del Fondo de Investigación Sanitaria (FIS 04/1905), Ministerio de Sanidad y Consumo, Instituto de Salud Carlos III. España. Bibliografı́a 1. Akao Y. Hoshin Kanri. Police deployment for successful TQM. Cambridge: Productivity Press; 1991. 2. Kaplan RS. The balanced scoredcard: Translating strategy into action. Boston: Harvard Business School Press; 1996. 3. Heredia JA. Sistema de indicadores para la mejora y el control integrado de la calidad de los procesos. Castelló de la Plana: Publicaciones de la Universidad Jaume I; 2001. 4. Howard R. A balancing act [citado 5 May 2007]. Performe Magazine. 2007;2(2). Disponible en: http://www.mercadeo. com/41_scorecard.htm. 5. Kaplan R, Norton D. Cuadro de mando integral. Barcelona: HBS; 1997. 6. Asociación Española de Normalización y Certificación. Guı́a para la evaluación del sistema de gestión de la calidad según la ARTICLE IN PRESS Plan anual de la calidad en un servicio de análisis clı́nicos 7. 8. 9. 10. 11. Norma UNE-EN ISO 9004:2000. Herramientas y planes de mejora. UNE 66174. Madrid: AENOR; 2003. Asociación Española de Normalización y Certificación. Sistemas de gestión de la calidad. Guı́a para la implantación de sistemas de indicadores. UNE 66175. Madrid: AENOR; 2003. Asociación Española de Normalización y Certificación. Sistemas de gestión de la calidad. Fundamentos y vocabulario. UNE-EN ISO 9000:2005. Madrid: AENOR; 2005. [citado Ene 2006]. Disponible en: http://www.cst.cat. Unidad de Garantı́a de la Calidad. Manual de la Calidad del Servicio de Análisis Clı́nicos del CST. Versión 1, 27-4-2004. Salas A, Gimeno C, Buxeda M, Martinez X, Ruiz R. The Certification Model to Excellente in a Medical Laboratory using a new Spanish Guide for the Assessment of Quality Management System. Clin Chem. 2006;52:A149. 29 12. Laboratory management index program. User’s guide. Northfield: College of American Pathologists; 2006. 13. Cuadro de Mando Integral en el Laboratorio Clı́nico. Documentación de Jornada de gestión. Barcelona: SEQC; 2005. 14. Salgueiro A. Indicadores de gestión y cuadro de mando. Madrid: Dı́az de Santos; 2005. 15. Fernández Hatre A. Indicadores de gestión y cuadro de mando integral. Llanera: Instituto de Desarrollo Económico del principado de Asturias; 2004. 16. Kaplan R, Norton D. Mapas estratégicos. Convirtiendo los activos intangibles en resultados tangibles. Barcelona: Gestión; 2004. 17. Salas A, Vilaplana C, Bosch MA, Gimeno C, Fernández R. Utilidad de un programa de evaluación externa de la calidad de indicadores de gestión en los laboratorios clı́nicos. Quim Clin. 2004;23:25–34. ARTICLE IN PRESS Rev Lab Clin. 2009;2(1):30–33 Revista del Laboratorio Clínico www.elsevier.es/LabClin NOTA TÉCNICA Utilidad de dos marcadores biológicos de infección bacteriana en niños menores de 2 años José Luis Pascual Gómez, Matilde Palanca Giménez, Francisco Bermudo Guitarte, Miguel Valle Jiménez y Félix Gascón Luna Servicio de Laboratorio Clı́nico, Hospital Valle de los Pedroches, Pozoblanco, Córdoba, España Recibido el 18 de junio de 2008; aceptado el 31 de octubre de 2008 PALABRAS CLAVE Procalcitonina; Proteı́na C reactiva; Utilidad clı́nica; Niños Resumen Introducción: la procalcitonina (PCT) es una molécula que aumenta en infecciones bacterianas. La proteı́na C reactiva (PCR) se eleva en procesos inflamatorios independientemente de su origen. Debido a la vida media más corta y una elevación más rápida, la PCT ofrece potenciales ventajas sobre la PCR en el diagnóstico precoz de infección bacteriana. Objetivo: evaluar el rendimiento diagnóstico de la PCT y la PCR en infecciones bacterianas en niños menores de 2 años, usando como referencia el cultivo bacteriano positivo. Material y método: se estudió a 68 niños con sı́ndrome febril y sospecha de infección bacteriana aguda. Al ingreso, se determinó su PCT y su PCR, además de cultivos bacteriológicos, virus respiratorio sincitial, rotavirus y adenovirus. Resultados: la PCT presentó una sensibilidad del 50%, una especificidad del 70,8%, un valor predictivo positivo (VPP) del 35% y un valor predictivo negativo (VPN) del 70,8%, todos ellos superiores a los de la PCR. Conclusiones: la PCT presenta una buena especificidad, y una sensibilidad mejorable si su determinación fuese cuantitativa y el valor umbral inferior. Ası́, se detectarı́an infecciones localizadas o una generalizada en sus etapas iniciales. En nuestro estudio, la determinación aislada de PCT ofrece más especificidad y sensibilidad que la PCR, si bien respecto a la sensibilidad hay trabajos que la igualan a la de la PCR y otros indican que esta última serı́a mayor y más practicable. No obstante, la implantación de la PCT como marcador de infección bacteriana en el laboratorio de urgencias nos permitirı́a descartar las infecciones generalizadas bacterianas en niños gracias a su buen VPN y, por lo tanto, racionalizar el uso de antibióticos, costes de tratamiento y estancias hospitalarias. & 2008 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. Autor para correspondencia. Correo electrónico: jlpascualgomez@gmail.com (J.L. Pascual Gómez). 1888-4008/$ - see front matter & 2008 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. doi:10.1016/j.labcli.2008.10.001 ARTICLE IN PRESS Utilidad de dos marcadores biológicos de infección bacteriana en niños menores de 2 años KEYWORDS Procalcitonin; C reactive protein; Clinical usefulness; Children 31 Use of two bacterial infection biomarkers in children under 2 years old Abstract Introduction: Procalcitonin (PCT) increases in bacterial infections. C reactive protein (CRP) rises in inflammatory processes regardless of origin. Due to its shorter half-life and a more rapid increase, PCT offers potential advantages over CRP in the early diagnosis of bacterial infection. Objective: To evaluate PCT and CRP diagnostic performance in children under 2 years old. We used positive bacterial culture as gold standard. Material and method: A total of 68 children with febrile syndrome and a suspected bacterial infection were studied. At admission, PCT and CRP were performed, along with microbiology cultures, respiratory syncytial virus, rotavirus and adenovirus. Results: PCT had a sensitivity of 50%, a specificity 70.8%, a predictive positive value (PPV) of 35% and a predictive negative value (PNV) of 70.8%. All of them higher than CRP. Conclusions: PCT had good specificity and an improvable sensitivity with a quantitative determination and a lower threshold value. Thus, we could detect local or generalised infections at initial stages. In our study, isolated PCT determination had a greater specificity and sensitivity than CRP. Although, there are studies that show that CRP is as sensitive as PCT, there are others that show CRP to have a higher and more practicable sensitivity. However, the introduction of PCT as bacterial infection marker at urgency laboratories could rule out generalised bacterial infections in children due to its better PNV, and therefore, could rationalise the use of antibiotics, and reduce treatment costs and hospital admissions. & 2008 AEBM, AEFA y SEQC. Published by Elsevier España, S.L. All rights reserved. Introducción La procalcitonina (PCT) es un propéptido producido en condiciones metabólicas normales en el interior de las células C del tiroides. Ésta, tras una proteinólisis intracelular especı́fica, se transforma en calcitonina activa y a continuación es secretada a la circulación, por lo que normalmente la PCT en sangre es muy escasa (o0,05 ng/ ml). Aumenta en estados de inflamación sistémica, probablemente originada por macrófagos y monocitos de diversos órganos y tejido parenquimatoso. Es una molécula muy estable, con una vida media de 24–30 h. Se puede detectar a las 2–3 h de inicio de la infección, con un máximo a las 6–12 h. Si no persisten estı́mulos posteriores, los valores se normalizan en 3 dı́as, mientras que la proteı́na C reactiva (PCR) se detecta a las 12 h siguientes al inicio de la infección y tarda de 2 a 7 dı́as en normalizarse1. La PCT aumenta en infecciones bacterianas, pero no aumenta en infecciones virales ni en procesos inflamatorios no infecciosos. En las infecciones fúngicas no está claro el papel de dicho propéptido, ya que los estudios existentes han sido realizados con series de pacientes pequeñas2,3. Cuando una infección bacteriana ocurre, se produce un incremento significativo del valor de PCT (40,5 ng/ml)4,5. La PCR también aumenta en procesos inflamatorios independientemente de la causa que los produzca y su concentración puede permanecer alta incluso después de que la infección sea controlada (440 mg/l)6. Debido a la vida media más corta y una elevación más rápida, la PCT ofrece potenciales ventajas sobre la PCR. Es un marcador de infección bacteriana especı́fico y sensible que nos permite distinguir entre infecciones bacterianas y virales o cualquier otra afección que origine una respuesta inflamatoria sistémica. El objetivo de este trabajo es evaluar el rendimiento diagnóstico de la PCT y la PCR en infecciones bacterianas en lactantes, usando el cultivo bacteriano como referencia. Material y método Instrumental y reactivos Se determinó la PCT y la PCR a todos los pacientes. Además, se realizaron cultivos bacteriológicos de sangre, orina, heces, fluido cerebroespinal y exudado farı́ngeo. Se descartó el cultivo especı́fico en medios selectivos de hongos por las dudosas sensibilidad y especificidad de la PCT en el diagnóstico de infección fúngica invasiva7. Se realizó determinación de virus respiratorio sincitial (VRS), ya que es el más frecuentemente aislado en la población pediátrica; también de rotavirus y adenovirus en heces; se estudió el primero en muestras directas por un test manual de 10 min por inmunocromatografı́a NOW RSVs (Inverness medical, Maine, Estados Unidos) y el segundo mediante test manual de 10 min por inmunocromatografı́a VIKIAs Rota-Adeno (bioMérieux SA, Lyon, Francia). La PCT se analizó semicuantitativamente mediante un test manual por inmunocromatografı́a BRAHMS PCT-Qs (BRAHMS, Hennigsdorf, Alemania), con un tiempo de ejecución de 30 min, y la PCR, cuantitativamente por quı́mica seca en un analizador automático Vitros 250s (Ortho-Clinical Diagnostics, Estrasburgo, Francia) y tiempo de ejecución de 7,5 min. Las unidades utilizadas fueron ng/ml y mg/l respectivamente. ARTICLE IN PRESS 32 J.L. Pascual Gómez et al Para evitar posibles interferencias analı́ticas en la prueba, se descartaron los sueros hemolizados que podrı́an restringir la exactitud de lectura de ambos tests. La lipemia y la ictericia no influyen en el resultado de estas mediciones, por lo que no se las incluyó entre los criterios de rechazo. Muestras y procedimientos empleados El trabajo se ha realizado en el Laboratorio Clı́nico del Hospital Comarcal Valle de los Pedroches. La duración ha sido de 8 meses. Se estudió a 68 niños hospitalizados con sı́ndrome febril y sospecha de infección bacteriana aguda, de edades comprendidas entre 1 y 23 meses (se excluyó a los neonatos por la posibilidad de que tuvieran la PCT falsamente elevada). Al ingreso del paciente, tras valoración clı́nica y antes de recibir tratamiento antimicrobiano alguno, se le realizaba una única extracción para la determinación de PCT. En cada solicitud, el servicio de pediatrı́a debı́a cumplimentar una hoja de petición en la que se informaba de los datos demográficos, edad, si habı́a fiebre o no y si habı́a un foco de infección localizada o no. Los niños con tratamiento antimicrobiano previo, fiebre de más de 8 dı́as de duración o con alguna inmunodeficiencia conocida fueron excluidos del estudio. Tratamiento estadı́stico Se utilizó el paquete estadı́stico SPSSs versión 13.1 de Windows, con el que se registraron las variables: número de historia clı́nica, edad, valor de PCT, valor de PCR, cultivos bacterianos, VRS, rotavirus y adenovirus. Se elaboraron unas tablas de contingencia para el procesamiento de los casos. El cálculo de parámetros de sensibilidad, especificidad, valor predictivo positivo (VPP) y valor predictivo negativo (VPN) se realizó en Microsoft Excels 2003 de Windows. Resultados Del total de 68 niños, 18 fueron descartados del análisis final por falta de pruebas microbiológicas completas. De los 50 restantes, 14 presentaron un cultivo bacteriano positivo (3 con infección sistémica y 11 localizada), 10 una infección por VRS y 2 por rotavirus, y 24 cursaron con cultivo bacteriano, estudio de VRS y rotavirus y adenovirus negativos. En ninguno de los 50 casos se observó crecimiento de hongos en las placas de cultivo. De los 14 cultivos positivos, el 50% mostró un test PCT positivo con valores que fueron todos 40,5 ng/ml; de estos positivos, 2 lo fueron a un valor de PCT X2 yo10 ng/ml y 5 Tabla 1 con PCT 40,5 yo2 ng/ml. El otro 50% presentó valores de PCTo0,5 ng/ml; entre ellos habı́a 1 caso de infección sistémica y otras 6 localizadas (faringe, orina y heces). La PCR fue todavı́a menos sensible, positiva sólo en un 35,7% de los niños con infección generalizada o localizada. De los 24 niños que presentaron un cultivo bacteriano negativo, en un 70,8% de los casos la PCT fue negativa, y la PCR, en un 62,5%. La sensibilidad, la especificidad, el VPP y el VPN de la PCT, la PCR y la combinación de ambas se resumen en la tabla 1. La combinación de ambas técnicas no mejoró los resultados de detección de la infección y la combinación mostró mejores resultados de sensibilidad que el test de PCR solo. De los 12 niños infectados por VRS y rotavirus, no se obtuvieron resultados positivos de PCT en ninguno, pero sı́ un 16,7% de PCR positivas. Discusión Salvando las limitaciones de este estudio, como han sido el número de niños relativamente bajo (50) y la determinación incompleta de etiologı́a viral (no se han buscado virus parainfluenza, rinovirus, enterovirus, virus de la gripe, etc.), la sensibilidad de la PCT al valor de 0,5 ng/ml es baja para una probable infección bacteriana localizada positiva; a pesar de ello, presenta una buena especificidad. Concentracioneso0,5 ng/ml no permiten descartar una infección, ya que algunas infecciones localizadas pueden relacionarse con estas concentraciones bajas o una infección generalizada en sus etapas iniciales (o6 h); hay estudios que proponen reducir el umbral de positividad para ser capaces de detectar en una fase temprana infecciones bacterianas localizadas que no elevan el valor de la PCT por encima de 0,5 ng/ml8. Por lo tanto, si el valor umbral fuese más bajo, se podrı́a incrementar la sensibilidad de esta técnica9,10. Serı́a aconsejable usar un método cuantitativo que ofreciera un valor de discriminación más bajo. En nuestro estudio, 6 de los niños con infecciones bacterianas localizadas y 1 con infección sistémica escaparon a la PCT. Para la PCR, escaparon 8 con infección localizada y 1 con sistémica. En nuestro estudio con niños menores de 2 años, la PCR parece ser peor marcador bioquı́mico por su sensibilidad, su especificidad, su VPP y su VPN menores que la PCT. No podemos afirmar que se haya observado una asociación clara entre infección sistémica y mayores valores de PCT; no obstante, en 2 de los 3 hemocultivos positivos, la PCT fue 40,5 ng/ml, si bien la bibliografı́a hace pensar en que esta asociación efectivamente se produce9–11. La combinación de ambas técnicas no mejora los resultados en la detección de infecciones en comparación Rendimiento diagnóstico de la PCT y la PCR en la detección de infecciones bacterianas (sistémicas o localizadas) Marcador Sensibilidad, % Especificidad, % VPP, % VPN, % PCT PCR Ambas 50 35,7 50 70,8 62,5 – 35 31 32 70,8 62,5 – PCR: proteı́na C reactiva; PCT: procalcitonina; VPN: valor predictivo negativo; VPP: valor predictivo positivo. ARTICLE IN PRESS Utilidad de dos marcadores biológicos de infección bacteriana en niños menores de 2 años con la PCT sola; sin embargo, otros estudios recientes no llegan a esta conclusión, siempre que los tests además se combinen con la valoración clı́nica11. Por todo esto, se puede concluir que la determinación aislada de PCT tiene más especificidad y sensibilidad que la PCR para el diagnóstico de infección bacteriana12,13, por lo menos sin ayuda de la evaluación clı́nica, y presenta un mayor rendimiento diagnóstico en la detección precoz de infección bacteriana en niños febriles. Otros estudios coinciden en afirmar que la PCT tiene más especificidad que la PCR en el diagnóstico precoz de infección bacteriana invasiva (meningitis, infecciones graves, etc.)8,9,14, si bien respecto a la sensibilidad de la PCT sobre la PCR no hay una opinión clara: unos la igualan a la PCR y otros indican que en ésta serı́a mayor y más practicable15. La implantación de la técnica de medición cuantitativa de la PCT y la disminución del valor umbral podrı́an permitirnos detectar la mayorı́a de las infecciones generalizadas y localizadas en niños y, por lo tanto, racionalizar el uso de antibióticos16 y disminuir el desarrollo de resistencias, el coste del tratamiento y la estancia hospitalaria. Bibliografı́a 1. Isaacs D, Moxon ER. Handbook of neonatal infections—a practical guide. London: WB Saunders; 1999. 2. Dornbusch HJ, Strenger V, Kerbl R, Lackner H, Schwinger W, Sovinz P, et al. Procalcitonin—a marker of invasive fungal infection? Support Care Cancer. 2005;13:343–6. 3. Christofilopoulou S, Charvalos E, Petrikkos G. Could procalcitonin be a predictive biological marker in systemic fungal infections? Eur J Intern Med. 2002;13:493–5. 4. Selberg O, Hecker H, Martin M, Klos A, Bautsch W, Köhl J. Discrimination of sepsis and systemic inflammatory response syndrome by determination of circulating plasma concentrations of procalcitonin, protein complement 3a, and interleukin6. Crit Care Med. 2000;28:2793–8. 5. Christ-Crain M, Müller B. Procalcitonin and pneumonia: is it a useful marker? Curr Infect Dis Rep. 2007;9:233–40. 33 6. Bamonde Rodrı́guez L, Caamaño Santos B, Alonso Martı́n MR. La procalcitonina como marcador de infección. Una revisión desde atención primaria. Revista Pediatrı́a de atención primaria. 2002;4:622–70. 7. Huber W, Schweigart U, Bottermann P. Failure of PCT to indicate severe fungal infection in two immunodeficient patients. Infection. 1997;25:377–8. 8. Fernández López A, Luaces Cubells C, Valls Tolosa C, Ortega Rodrı́guez J, Garcı́a Garcı́a JJ, Mira Vallet A, et al. Procalcitonina para el diagnóstico precoz de infección bacteriana invasiva en el lactante febril. An Pediatr. 2001;55:321–8. 9. Hausfater P, Garric S, Ayed SB, Rosenheim M, Bernard M, Riou B. Usefulness of procalcitonin as a marker of systemic infection at emergency department patients: a prospective study. Clin Infect Dis. 2002;35:1275–6. 10. Polzin A, Pletz M, Erbes R, Raffenberg M, Mauch H, Wagner S, et al. Procalcitonin as a diagnostic tool in lower respiratory tract infections and tuberculosis. Eur Respir J. 2003;21:939–43. 11. Simon L, Saint-Louis P, Amre DK, Lacroix J, Gauvin F. Procalcitonin and C-reactive protein as markers of bacterial infection in critically ill children at onset of systemic inflammatory response syndrome. Pediatr Crit Care Med. 2008; 9:407–13. 12. Luzzani A, Polati E, Dorizzi R, Rungatscher A, Pavan R, Merlini A. Comparison of procalcitonin and C-reactive protein as markers of sepsis. Crit Care Med. 2003;31:1737–41. 13. Köksal N, Harmanci R, Cetinkaya M, Hacimustafaoglu M. Role of procalcitonin and CRP in diagnosis and follow-up of neonatal sepsis. Turk J Pediatr. 2007;49:21–9. 14. Gendrel D, Raymond J, Assicot M, Avenel S, Lefèvre H, Ravilly S, et al. Procalcitonin, C-reactive protein and interleukin 6 in bacterial and viral meningitis in children. Presse Med. 1998;27:1135–9. 15. Andreola B, Bressan S, Callegaro S, Liverani A, Plebani M, Da Dalt L. Procalcitonin and C-reactive protein as diagnostic markers of severe bacterial infections in febrile infants and children in the emergency department. Pediatr Infect Dis J. 2007;26:672–7. 16. Christ-Crain M, Jaccard-Stolz D, Bingisser R, Gencay MM, Huber PR, Tamm M, et al. Effect of procalcitonin-guided treatment on antibiotic use and outcome in lower respiratory tract infections: cluster-randomised, single-blinded intervention trial [carta]. Lancet. 2004;363:1555. ARTICLE IN PRESS Rev Lab Clin. 2009;2(1):34–46 Revista del Laboratorio Clínico www.elsevier.es/LabClin REVISIÓN Nuevos marcadores en el sı́ndrome coronario agudo David Pérez Surribasa,b,, Mari Cruz Cárdenas Fernándeza,c, Mariano Cortés Riusa,d, Marı́a Fernández Garcı́aa,e, Miguel Garcı́a Montesa,f, Isabel Llompart Alaberna,g, Teresa Rodrı́guez Gonzáleza,h, Carmen Valldecabres Ortiza,i, José Antonio Viedma Contrerasa,j, Edgar Zapico Muñiza,d y Cecilia Martı́nez Brua,d a Comisión de Proteı́nas de la Sociedad Española de Bioquı́mica Clı́nica y Patologı́a Molecular Laboratori Pasteur, Andorra la Vella, Andorra c Servicio de Análisis Clı́nicos, Hospital Clı́nico San Carlos, Madrid, España d Servicio de Bioquı́mica, Hospital de la Santa Creu i Sant Pau, Barcelona, España e Servicio de Análisis Clı́nicos, Hospital Santiago Apóstol, Miranda de Ebro, Burgos, España f Servicio de Laboratorio, Clı́nica Moncloa, Madrid, España g Servicio de Análisis Clı́nicos, Hospital Son Dureta, Palma de Mallorca, Baleares, España h Servicio de Análisis Clı́nicos, Hospital Universitario Doctor Negrı́n, Las Palmas de Gran Canaria, Las Palmas, España i Servicio de Bioquı́mica, Hospital Universitario de la Ribera, Alzira, Valencia, España j Servicio de Análisis Clı́nicos, Hospital General y Universitario, Elche, Alicante, España b Recibido el 11 de julio de 2008; aceptado el 20 de octubre de 2008 PALABRAS CLAVE Enfermedad coronaria; Sı́ndrome coronario agudo; Albúmina modificada por isquemia; Proteı́na fijadora de ácidos grasos-H; Ligando soluble CD40; Mieloperoxidasa; Proteı́na C reactiva; Péptido natriurético Resumen La cardiopatı́a isquémica supone el 1,3% de los casos de atención en un servicio de urgencias hospitalario en España. El manejo del paciente es complejo por el riesgo de producir una alta médica incorrecta, el beneficio de instaurar una revascularización rápida y el gasto excesivo por admisiones injustificadas. La última década ha permitido un importante avance en el desarrollo de nuevos marcadores cardı́acos. Tradicionalmente los marcadores del sı́ndrome coronario agudo han sido indicadores de necrosis cardı́aca. Esta función se ha ampliado actualmente. Aún hay muchas limitaciones en la medición de estos marcadores, como la falta de un procedimiento estandarizado o materiales de referencia certificados. Además de las troponinas cardı́acas y el electrocardiograma, medir la albúmina modificada por isquemia puede ayudar a excluir un sı́ndrome coronario agudo en pacientes con baja probabilidad de isquemia miocárdica. La proteı́na fijadora de ácidos grasos-H es un marcador de necrosis útil en el diagnóstico precoz del infarto agudo de miocardio. En el pronóstico del sı́ndrome coronario agudo, la proteı́na C reactiva, los péptidos natriuréticos Autor para correspondencia. Correo electrónico: cmartinezb@santpau.cat (D. Pérez Surribas). 1888-4008/$ - see front matter & 2008 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. doi:10.1016/j.labcli.2008.10.002 ARTICLE IN PRESS Nuevos marcadores en el sı́ndrome coronario agudo 35 y la mieloperoxidasa complementan el valor pronóstico de la troponina. El ligando soluble CD40 permite la clasificación e individualización del tratamiento del sı́ndrome coronario agudo. Actualmente no hay suficiente evidencia para que ningún nuevo marcador sustituya a los que recomiendan las sociedades cientı́ficas ni se dispone de procedimientos de medición rápidos para algunos de ellos. Deben establecerse paneles utilizando la evidencia cientı́fica disponible y tomando como objetivo su contribución a una mejor evolución del paciente. & 2008 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. KEYWORDS Coronary disease; Acute coronary syndrome; Ischemia-modified albumin; Heart-type fatty acid-binding protein; Soluble CD40 ligand; Myeloperoxidase; C-reactive protein; Natriuretic peptide New biomarkers in acute coronary syndrome Abstract Myocardical ischemia involves 1.3% of the patients attending emergency departments in Spain. The management of these patients is complex, due to the risk of an incorrect discharge diagnosis, the benefit of rapid revascularization and the excessive cost due to unnecessary admissions. There has been a significant improvement in the development of new cardiac biomarkers over the last ten years. Biomarkers traditionally used for identifying acute coronary syndrome were indicators of myocardial necrosis. This role has currently been expanded. There are still some limitations in the measurement of these biomarkers, due to lack of standardised assays or certified calibrators. Ischemia-modified albumin in conjunction with cardiac troponin and electrocardiogram, can help to rule out an acute coronary syndrome in patients with a low probability of having myocardical ischemia. Heart-type fatty acid-binding protein is a strong necrosis biomarker in the early diagnosis of acute myocardical infarction. C-reactive protein, natriuretic peptides and myeloperoxidase have been shown to complement cardiac troponin in the prognosis of acute coronary syndrome. Soluble CD40 ligand enables the identification of a subgroup of patients who will benefit from a treatment in acute coronary syndrome. There is currently not enough evidence to replace new biomarkers with any of these already been recommended by the scientific societies. Also, the assays of some of them are not sufficiently rapid. A multimarker strategy must be created to take into account the existing scientific-based evidence, with the aim of improving outcomes in patients. & 2008 AEBM, AEFA y SEQC. Published by Elsevier España, S.L. All rights reserved. Introducción Las enfermedades cardiovasculares son la primera causa de muerte en Europa, representando el 42% de los casos y 1,9 millones de fallecimientos por año1. En la Europa occidental la mortalidad por esta causa ha disminuido linealmente entre 1970 y 1990, y esta tendencia se ha extendido a la Europa del este desde 19902. Esta mortalidad es mayor entre pacientes con niveles ocupacionales o educacionales bajos3. En la mujer, el riesgo de enfermedad cardiovascular se desestima a menudo por la falsa percepción de que está protegida de esta enfermedad. Por razones que aún no han sido totalmente aclaradas, en la edad fértil el riesgo de eventos cardı́acos es bajo. Por ello, en el caso de que tenga factores de riesgo frecuentemente no se tratan, y tras la aparición de la menopausia la mujer queda expuesta al riesgo de contraer la enfermedad cardiovascular4. La cardiopatı́a isquémica supone el 1,3% de los casos de atención en un servicio de urgencias hospitalario en España5. Cabe destacar tres circunstancias que resultan decisivas en este contexto: – Hay un riesgo potencial de que se produzca una alta médica incorrecta, hecho que sucede en un 1–4% de los casos de infarto agudo de miocardio y el 2,2% de los casos de angina inestable6. – Hay una clara correlación entre la rapidez de la instauración de la revascularización y la reducción en la mortalidad asociada a la enfermedad7. – Se produce un gasto excesivo por admisiones injustificadas en las unidades coronarias, que puede ser hasta el 50% del total de las admisiones8. El sı́ndrome coronario agudo se define por el conjunto de cuadros clı́nicos por los que se pone de manifiesto de forma aguda la isquemia miocárdica secundaria principalmente a arteriosclerosis coronaria (aunque puede deberse a otras causas)9. Este sı́ndrome incluye la angina inestable, el infarto agudo de miocardio y la muerte súbita, que son tres ARTICLE IN PRESS 36 D. Pérez Surribas et al formas de presentación de un mismo proceso por el que una placa aterosclerótica coronaria se erosiona o se rompe y vierte su contenido protrombótico a la luz de una arteria coronaria. Una vez vertido a la luz, entra en contacto con las proteı́nas del sistema de la coagulación y las plaquetas circulantes, y se forma un trombo intracoronario. En la mayorı́a de los pacientes con sı́ndrome coronario agudo, la oclusión es parcial o transitoria y no se origina una elevación persistente del segmento ST, y se da lugar a una angina inestable o un infarto agudo sin elevación del segmento ST. En los demás pacientes, el trombo ocluye completamente la arteria y origina un infarto agudo de miocardio con elevación del segmento ST en el electrocardiograma10–12 (fig. 1). Entre 1950 y 1960 se describió y se extendió el empleo de la aspartato aminotransferasa (EC 2.6.1.1.) en la detección de la necrosis cardı́aca y, más concretamente, su aplicación en el diagnóstico del infarto agudo de miocardio. Durante las siguientes cuatro décadas se fue mejorando la especificidad de los marcadores del sı́ndrome coronario agudo restringiendo su origen al miocardio13. La última década ha supuesto un importante avance en el desarrollo de nuevos marcadores cardiacos. Existen varios factores que han influido en este proceso: – La realización del proyecto Genoma Humano14 y el desarrollo de nuevas herramientas, como las micromatrices de ADN, microarrays de expresión, la proteómica y la nanotecnologı́a, han permitido el descubrimiento de nuevas moléculas con una utilidad potencial como biomarcadores. A ello hay que añadir los avances en bioinformática que han mejorado el análisis de datos generados por la tecnologı́a antes citada15. – La dilucidación de la fisiopatologı́a de la aterosclerosis y la descripción de los mediadores fisiológicos implicados han permitido su estudio como potenciales marcadores cardı́acos16. Síndrome coronario agudo ECG SCASEST IAMEST MN AI IAMEST Figura 1 Sı́ndrome coronario agudo. El paciente con sı́ndrome coronario agudo puede incluirse en dos categorı́as con base en la imagen de su electrocardiograma, según el segmento ST se eleve persistentemente o no. Los pacientes que no tienen esta elevación pueden tener una angina inestable o un infarto agudo de miocardio sin elevación del ST. La importancia de clasificar por la persistencia del segmento ST radica en la diferente aproximación terapéutica (se ha excluido la muerte súbita en el diagrama)11,12,17. AI: angina inestable; ECG: electrocardiograma; IAMEST: infarto agudo de miocardio con elevación del segmento ST; IAMSEST: infarto agudo de miocardio sin elevación del segmento ST; MN: marcadores de necrosis; SCASEST: sı́ndrome coronario agudo sin elevación del segmento ST. – La definición del infarto agudo de miocardio publicado en el año 200014 ha llevado a la necesidad de reevaluar los marcadores conocidos y al estudio de nuevos marcadores en el sı́ndrome coronario agudo. Algunos de estos marcadores, como es el caso de las troponinas cardı́acas, han sido de gran ayuda en la práctica de la cardiologı́a clı́nica. No obstante, el papel que tienen la mayor parte de los nuevos marcadores en la identificación y la atención de los pacientes con sı́ntomas cardiovasculares aún debe ser establecido18. Nuevos marcadores y su importancia clı́nica La literatura cientı́fica recoge estudios cada vez más numerosos sobre marcadores nuevos o ya conocidos pero de uso emergente15,19, con conclusiones que resultan en ocasiones contradictorias, por lo que parece oportuno presentar una selección de esta información y revisar de forma crı́tica la evidencia cientı́fica de mayor trascendencia (fig. 2). Para ello se hicieron las siguientes búsquedas entre septiembre de 2007 y marzo de 2008: – MEDLINE: ‘‘Serum Albumin’’[Majr] AND ‘‘Myocardial Ischemia’’[Majr]. ‘‘Serum Albumin’’[Majr] AND (‘‘Coronary Disease’’[Majr] OR (‘‘Coronary Disease/blood’’[Majr] OR ‘‘Coronary Disease/complications’’[Majr] OR ‘‘Coronary Disease/diagnosis’’[Majr] OR ‘‘Coronary Disease/drug therapy’’[Majr])). – La búsqueda se repitió para ‘‘fatty acid binding protein’’, ‘‘CD40 ligand’’, ‘‘peroxidase’’, ‘‘c-reactive protein’’, ‘‘natriuretic peptide’’. – National Guideline Clearinghouse: Diseases (MeSH Category) 4 Cardiovascular Diseases. Idealmente, la concentración de los marcadores diagnósticos de sı́ndrome coronario agudo debe elevarse rápidamente y permanecer alta durante un periodo suficientemente amplio (sensibilidad diagnóstica). Los marcadores deben ser especı́ficos del tejido cardı́aco (especificidad diagnóstica). Los marcadores empleados en el cribado deberı́an tener un bajo coste económico, además de una alta sensibilidad diagnóstica. Los marcadores empleados en la monitorización del tratamiento deberı́an poseer una baja variabilidad biológica intraindividual, y serı́an menos importantes su coste, su sensibilidad y su especificidad20. Su procedimiento de medición debe ser exacto y reproducible y estar estandarizado, y el resultado de la medida debe ser fácil de interpretar. En definitiva, el marcador deberı́a ser capaz de incidir en la actitud terapéutica y la evolución del paciente y, en consecuencia, ser coste-efectivo15. Tradicionalmente, los marcadores del sı́ndrome coronario agudo han sido únicamente indicadores de necrosis. Este papel se ha ampliado actualmente debido a que: – En muchos casos los nuevos marcadores detectan el sı́ndrome coronario agudo antes de la necrosis. – En la detección de necrosis, los marcadores actuales intentan mejorar las caracterı́sticas de los marcadores ya conocidos. ARTICLE IN PRESS Nuevos marcadores en el sı́ndrome coronario agudo 37 Enfermedad cardiovascular Síndrome coronario agudo Inflamación Desestabilización placa Ruptura placa Isquemia Necrosis Disfunción miocárdica PCR (u) MPO sCD40L IMA cTn FABP-H BNP NT-proBNP Figura 2 Nuevos marcadores en cada fase de la enfermedad cardiovascular. La enfermedad cardiovascular incluye una serie de respuestas celulares y moleculares asociadas a la inflamación que acaban con la formación de una placa. Después puede tener lugar su desestabilización y ruptura, con liberación del contenido protrombótico en la luz de una arteria coronaria. Este contenido entra en contacto con las proteı́nas del sistema de la coagulación y las plaquetas circulantes, y se forma un trombo intracoronario. El trombo puede interrumpir parcial, transitoria o completamente el aporte de sangre oxigenada al miocardio (isquemia); si ésta persiste, hay una pérdida celular irreversible que lleva a una disfunción cardı́aca. Los marcadores cardı́acos indicados contribuyen a poner de manifiesto estas fases. BNP: péptido natriurético cerebral; cTn: troponinas cardı́acas; FABP-H: proteı́na fijadora de ácidos grasos-H; IMA: albúmina modificada por isquemia; MPO: mieloperoxidasa; NT-proBNP: fragmento aminoterminal del propéptido natriurético B; PCR(u): proteı́na C reactiva ultrasensible; sCD40L: ligando soluble CD40. – Tras la necrosis, proporcionan información sobre la remodelación ventricular. – Tal como sucedı́a para las troponinas cardı́acas y la concentración de masa de la isoenzima 2 de la creatina cinasa, los nuevos marcadores presentan un valor pronóstico evolutivo. Muchos de los estudios publicados sobre estos nuevos marcadores presentan algunos inconvenientes: – Las caracterı́sticas de los procedimientos de medida utilizados no se describen con gran detalle. Las caracterı́sticas preanalı́ticas (toma de muestras, estabilidad de los componentes biológicos) no se definen claramente19. – Deberı́an realizarse estudios transversales del marcador en la población sana y la enferma y se deberı́a estudiar ambas distribuciones. La selección de ambas poblaciones tiene que ser adecuada15 y representativa de las que se va a encontrar en la práctica clı́nica. La bibliografı́a encontrada a menudo emplea grupos reducidos de pacientes que padecen procesos muy bien establecidos que podrı́an sesgar los resultados publicados19. – Para evaluar su eficacia diagnóstica, deberı́a estudiarse el marcador en una amplia gama de valores, hecho que se cumple cuando se utilizan las curvas de rendimiento diagnóstico21. Numerosos trabajos emplean la sensibilidad y la especificidad diagnósticas o el cociente de probabilidades positivo (razón de verosimi- litudes positiva)22, pero estos valores dependen del valor discriminatorio empleado. Además, se puede dar un cociente de probabilidades positivo elevado aunque las poblaciones enferma y sana tengan un gran solapamiento de valores para la concentración del marcador23. – El nuevo marcador deberı́a ser comparado con el mejor modelo de diagnóstico disponible para la enfermedad, y no sólo con un único marcador23. Albúmina modificada por isquemia La albúmina es la proteı́na de mayor concentración plasmática, y entre sus funciones está la del transporte de iones metálicos. Posee cuatro puntos de unión con diferentes especificidades para estos iones. Dos de ellas se hallan en su extremo aminoterminal, y proporcionan la capacidad de unirse a los metales de transición como el cobalto (II)24. No obstante, cuando hay isquemia, en los capilares hipoxémicos se produce un cambio en el octapéptido terminal que reduce esta capacidad de unión. Probablemente las especies de oxı́geno reactivas son el agente causante y la albúmina actúa como un antioxidante con el fin de reducir el daño25. El carácter de marcador de isquemia ha quedado en evidencia en varios estudios. En uno de ellos se sometió a una intervención cardı́aca percutánea a 19 pacientes con angina crónica estable, ası́ como a 11 pacientes control. La concentración de la albúmina modificada por isquemia se ARTICLE IN PRESS 38 D. Pérez Surribas et al elevó en 18 de los 19 pacientes inmediatamente después de la intervención y 30 min tras ella, y se normalizó a las 12 h. En el grupo control esta concentración no varió antes y después de la intervención26. Paralelamente se sometió a un procedimiento idéntico a 34 pacientes con la misma enfermedad, y se hallaron aumentos en la concentración plasmática de la albúmina modificada tras la intervención. Cabe destacar que estas elevaciones fueron mayores en las intervenciones con mayor número de inflados, mayor presión y de mayor duración27. Un trabajo multicéntrico estudió a 224 pacientes con sı́ntomas de sı́ndrome coronario agudo, y una evolución menor a tres horas. Se tomó una muestra en la primera hora (en todos los casos se halló una concentración de troponina I dentro del intervalo de referencia), y otra entre 6 y 24 h después. La albúmina modificada presentó en la primera hora un área bajo la curva de rendimiento diagnóstico de 0,78 en la predicción de una troponina cardı́aca elevada en la segunda muestra. El valor predictivo para un resultado negativo fue del 96%28 (tabla 1). La concentración plasmática de la albúmina modificada es más alta en los pacientes con sı́ndrome coronario agudo que en los pacientes agudos que no presentan enfermedades isquémicas29,30. Además, la concentración plasmática de la albúmina modificada está más elevada en los pacientes con angina inestable que en los pacientes con infarto agudo, y en ambos casos es mayor que en los pacientes sin enfermedades isquémicas29. Su sensibilidad diagnóstica en el sı́ndrome coronario agudo es de un 75–82% y el área bajo la curva de rendimiento diagnóstico, 0,63–0,8929–32. La estrategia diagnóstica comúnmente empleada para el diagnóstico del sı́ndrome coronario agudo por los servicios médicos de urgencias es la medida de la troponina cardı́aca plasmática y la realización de un electrocardiograma, con una sensibilidad diagnóstica del 53%. Si además se emplea la medida de la albúmina modificada plasmática, este valor se eleva hasta el 95%. El valor predictivo de un resultado negativo pasa del 53 al 84%, y el área bajo la curva de rendimiento diagnóstico, de 0,74 a 0,8329. Asimismo, la combinación de la concentración de la albúmina modificada, la isoenzima 2 Tabla 1 Principales aplicaciones clı́nicas de los marcadores de sı́ndrome coronario agudo Marcador Diagnóstico IMA FABP-H sCD40L MPO PCR(u) BNP NT-proBNP + + Pronóstico + + + + + + Individualización del tratamiento de la creatina-cinasa y la troponina I logra una sensibilidad diagnóstica del 97%, con un valor predictivo para un resultado negativo del 92%31. Precisamente este elevado valor predictivo de un resultado negativo le confiere una valiosa utilidad dentro del cuidado al paciente con sı́ndrome coronario agudo: además de las troponinas cardı́acas y el electrocardiograma, medir los marcadores de isquemia puede ayudar a excluir un sı́ndrome coronario agudo en pacientes con baja probabilidad de isquemia miocárdica11. En este mismo sentido, un metanálisis concluye que la coincidencia de un electrocardiograma no diagnóstico con troponina cardı́aca y albúmina modificada negativas tiene un valor predictivo para un resultado negativo del 97,1%33. La albúmina modificada puede estar elevada en cualquier enfermedad que curse con isquemia, como cáncer, infecciones, enfermedad renal crónica, enfermedad hepática e isquemia cerebral. Se han descrito elevaciones de este marcador a las 24–48 h tras una carrera de maratón, probablemente por la isquemia intestinal que tiene lugar durante el ejercicio. En el estudio, paralelamente a este aumento no concurrı́a una elevación en la concentración de la troponina I34. Por todo ello, es un marcador con una especificidad diagnóstica inaceptable, del 13,6%35. Hay discrepancias en cuanto a su valor pronóstico en el sı́ndrome coronario agudo, y se han publicado trabajos a favor36 y en contra35,37. Se han descrito modificaciones estructurales en forma de deleción del dipéptido aminoterminal en la albúmina de varios pacientes. Estos cambios han sido la causa de falsos positivos para la medida de la albúmina modificada por isquemia. Se desconoce la prevalencia de estas deleciones en la población. Asimismo, también se han descrito circunstancias que pueden modificar este extremo in vivo (como la concentración de lactato, la acidosis y la presencia de radicales libres) e in vitro (almacenamiento del plasma a 30 1C)38,39. Se debe interpretar con cautela los resultados de la concentración de este nuevo marcador en pacientes con concentraciones bajas de albúmina, ya que se ha observado una correlación negativa entre ambas mediciones38,40. Si se emplea un ı́ndice que relaciona la concentración de la albúmina modificada por isquemia con la de la albúmina plasmática, la sensibilidad diagnóstica aumenta del 93,0 al 98,4%41. El principio de medida usado para la albúmina modificada por isquemia es la espectrometrı́a de absorción molecular UV-visible. Cuando hay albúmina modificada en el suero, ésta no es capaz de unirse al cobalto añadido. El cobalto libre se une a ditiotreitol y se forma un complejo coloreado. El procedimiento se ha automatizado en diversos analizadores. Actualmente se está desarrollando un inmunoanálisis19,28. + BNP: péptido natriurético cerebral; FABP-H: proteı́na fijadora de ácidos grasos-H; IMA: albúmina modificada por isquemia; MPO: mieloperoxidasa; NT-proBNP: fragmento aminoterminal del propéptido natriurético B; PCR(u): proteı́na C reactiva ultrasensible; sCD40L: ligando soluble CD40. Proteı́na fijadora de ácidos grasos-H Esta proteı́na se une a ácidos grasos de cadena larga, de forma reversible y no covalente. Tiene un peso molecular de 15 kDa y entre 126 y 137 aminoácidos. Su estructura es parecida a un bivalvo, y el ácido graso se fija entre las dos valvas. Se han descrito nueve isoformas, cada una con un patrón caracterı́stico de distribución en un tejido. Se ARTICLE IN PRESS Nuevos marcadores en el sı́ndrome coronario agudo sintetizan en tejidos con metabolismo activo para los ácidos grasos, entre otros, corazón, hı́gado e intestino42. La isoforma H se sintetiza principalmente en el corazón, pero también en el músculo esquelético, las células tubulares distales del riñón, el cerebro, la mama y la placenta. Se encuentra en muy baja concentración en el plasma, y su origen es muscular. Se elimina por vı́a renal, por lo que su uso en caso de insuficiencia renal queda limitado. Hay variaciones por edad y sexo. Como la mioglobina, es una proteı́na de localización citosólica, de bajo peso molecular. Probablemente por ello se libera más rápidamente que las proteı́nas fijadas estructuralmente, como es el caso de las troponinas cardı́acas. Su concentración celular es más alta que la de la mioglobina y las troponinas cardı́acas. Por este motivo su concentración plasmática tras un infarto agudo de miocardio se eleva más que la de los otros marcadores antes referidos. Análogamente a la mioglobina, tiene una concentración máxima a las 8 h de los sı́ntomas y vuelve a los valores de referencia en menos de 36 h43. Es un marcador de necrosis de utilidad en el diagnóstico precoz del infarto agudo de miocardio (en las primeras 12 h tras la aparición de los sı́ntomas). Su sensibilidad diagnóstica oscila en un 69,0–97,6%. En el mismo perı́odo la sensibilidad de la mioglobina es de un 85,4–88,6%, y la de la isoenzima 2 de la creatina-cinasa, un 18,6–96,7%44–47. La proteı́na fijadora de ácidos grasos-H es más sensible en las primeras 6 h que la troponina T46. La especificidad diagnóstica descrita en el perı́odo citado es de un 38,5-74% para la proteı́na fijadora de ácidos grasos-H, el 23,1% para la troponina T, un 34,6–57,1% para la mioglobina y el 98,0% para la isoenzima 2 de la creatina-cinasa44,45,47. Se ha descrito un área bajo la curva de rendimiento diagnóstico significativamente mejor para la proteı́na fijadora de ácidos grasos-H (0,921) que para la mioglobina y la isoenzima 2 de la creatina-cinasa (0,843 y 0,654 respectivamente)44. La proteı́na fijadora de ácidos grasos-H puede ayudar a detectar un daño cardı́aco pero, dada su discreta especificidad diagnóstica, no se puede usarla como único marcador para descartar un infarto47. Tal como sucede con la mioglobina, en la revascularización tras una trombólisis efectiva, la concentración plasmática de la proteı́na fijadora de ácidos grasos-H llega a un valor máximo a las 4 h de la revascularización y vuelve a los valores de referencia en menos de 24 h. Por ello tiene utilidad en la valoración precoz de la efectividad del tratamiento48,49. Este rápido descenso a concentraciones fisiológicas también la hace propicia para la detección de un reinfarto que tiene lugar en las 10 h posteriores al infarto primario50 y para la detección de infartos en intervenciones quirúrgicas cardı́acas51. Recientemente se han descrito cocientes de probabilidades positivos entre 1,6 y 4,5 para evoluciones adversas en los 10 meses posteriores a un sı́ndrome coronario agudo, como son la insuficiencia cardı́aca, el infarto o la muerte52. Probablemente, la proteı́na fijadora de ácidos grasos-H se libera en el curso del remodelado del ventrı́culo izquierdo que tiene lugar tras un daño cardı́aco. Este hecho la convierte en un marcador prometedor para el pronóstico de pacientes con insuficiencia cardı́aca: en el pronóstico de un evento cardı́aco recurrente en los siguientes 90 dı́as, se ha descrito un valor predictivo para un resultado negativo del 81%. Este valor fue del 57% para la troponina I53. Incluso 39 se ha descrito que es mejor marcador que la troponina T (área bajo la curva de rendimiento diagnóstico para la proteı́na fijadora de ácidos grasos-H, 0,779; troponina T, 0,581)54. También es de utilidad para predecir la evolución clı́nica de pacientes hipertensos con valvulopatı́as aórticas entre leves y moderadas55 (tabla 1). Un estudio ha arrojado dudas sobre la habilidad como marcador exclusivo de necrosis, al describir que puede elevarse también en caso de isquemia cardı́aca56. Actualmente no existe un procedimiento de medición estandarizado ni materiales de referencia certificados para la proteı́na fijadora de ácidos grasos-H. En el mercado hay varios procedimientos para medir este marcador, aunque pocos se adaptan a un laboratorio de urgencias, ya que la mayorı́a son enzimoinmunoanálisis. Se han comercializado particuloinmunoanálisis automatizados con micropartı́culas de látex. El calibrador empleado suele ser una proteı́na fijadora de ácidos grasos-H recombinante equivalente a la aislada en muestras de tejidos43,57,58. Ligando soluble CD40 El sistema )receptor CD40-ligando soluble CD40* se expresa en muchas células, entre las que se encuentran las endoteliales, las células del músculo liso y también las plaquetas activadas. Éstas liberan la forma soluble, mientras que los linfocitos T CD4 positivos, los basófilos y los mastocitos la expresan en su superficie. La unión de la forma soluble con el receptor de los linfocitos B lleva a su proliferación, adhesión y diferenciación. La unión con el receptor en las células endoteliales tiene efectos proinflamatorios y promueve la coagulación al inducir la expresión del factor tisular en los monocitos y las células endoteliales. Esta misma unión origina la liberación de metaloproteinasas que desestabilizan la placa aterosclerótica y conducen a una trombosis coronaria. El descubrimiento de que las plaquetas expresan este sistema ha cambiado la idea de que éstas tenı́an un papel exclusivo en la coagulación y la trombosis y ha elucidado su participación activa en la inmunidad y la inflamación. Además se ha puesto en evidencia la importante contribución que tiene el ligando CD40 en la fisiopatologı́a del sı́ndrome coronario agudo59,60. El ligando soluble CD40 está elevado en enfermedades inflamatorias y enfermedades autoinmunes, la esclerosis múltiple, la diabetes mellitus y la hipercolesterolemia y por ello es un marcador inespecı́fico19. La mayor utilidad de esta proteı́na es que permite la individualización del tratamiento: los pacientes con una concentración plasmática elevada que son tratados con antagonistas de receptores de las glucoproteı́nas IIb/IIIa reducen de 2,71 a 0,37 su riesgo de sufrir un infarto o muerte en los siguientes 6 meses11,59. En cuanto a su utilidad pronóstica, se han descrito cocientes de probabilidades positivos modestos (1,8–1,9) para una evolución a infarto o muerte en los 10 meses siguientes a un sı́ndrome coronario agudo. Tan sólo una combinación con la troponina I logra aumentar el riesgo relativo a 4,3–12,161. En la mujer se ha hallado un cociente de probabilidades positivo de 3,3 asociado a una mala evolución en los siguientes 4 meses62. Un estudio reciente ARTICLE IN PRESS 40 concluye que no hay relación entre una concentración plasmática elevada del ligando y las dos evoluciones adversas antes citadas63 (tabla 1). Actualmente, a pesar de que se comercializan varios enzimoinmunoanálisis, no está descrito un principio de medida estandarizado ni materiales de referencia certificados para el ligando soluble CD4019,64. Mieloperoxidasa La mieloperoxidasa (EC 1.11.1.7) es una enzima prooxidante que forma parte del sistema inmunitario innato. Se almacena en los neutrófilos, los monocitos y algunos macrófagos tisulares. En el curso de una inflamación, estas células se activan y liberan la enzima en el foco inflamatorio, con lo que se forman especies reactivas de oxı́geno65. No obstante, la enzima puede tener efectos perjudiciales en la pared arterial66. Se han hallado evidencias a favor de la activación y la desgranulación de los leucocitos en pacientes con angina inestable67. Además, la concentración de mieloperoxidasa se encuentra más elevada en los leucocitos y la sangre de los pacientes con enfermedad cardiovascular68. Los neutrófilos y los macrófagos se encuentran más frecuentemente en placas de pacientes con angina inestable o infarto agudo de miocardio, y expresan en mayor cuantı́a esta enzima65. La mieloperoxidasa utiliza como sustrato el óxido nı́trico, sustancia con propiedades ateroprotectoras66. Contribuye a la peroxidación de los lı́pidos y a la conversión de las lipoproteı́nas de baja densidad a una forma más aterogénica, de manera que son captadas por los macrófagos, que a su vez sufren cambios morfológicos y se convierten en células espumosas. Del mismo modo, oxida las lipoproteı́nas de alta densidad y reduce su capacidad de captación de colesterol y, por lo tanto, su posterior eliminación vı́a biliar66. Existen numerosas hipótesis que tratan de dilucidar el mecanismo por el que los leucocitos y los macrófagos tisulares inciden en la estabilidad de la placa, y la mieloperoxidasa parece jugar un papel importante. En definitiva, esta enzima activa reacciones en cascada de proteasas que afectan directamente a la estabilidad y la trombogenicidad de la placa67. Por otra parte, la mieloperoxidasa se ha relacionado con la inhibición de la función del endotelio microvascular que tiene lugar en la isquemia del miocardio humano69. La principal utilidad clı́nica de la mieloperoxidasa estriba en la estratificación de riesgo del paciente con sı́ndrome coronario agudo. Este paciente tiene mayor incidencia de infarto agudo de miocardio o mortalidad en los siguientes 30 dı́as a 6 meses si presenta concentraciones altas de mieloperoxidasa (cocientes de probabilidades positivos, 2,25–4,7). En los pacientes con troponina T no detectable, estos cocientes son mayores, entre 4,4 y 7,4867,70. Para el pronóstico de mortalidad en los siguientes 5 años, se ha descrito un cociente de 1,871. En la predicción de un infarto o muerte en pacientes que sufren un infarto con elevación del segmento ST, se ha descrito un área bajo la curva de rendimiento diagnóstico de 0,62, cifra algo inferior a la hallada para el fragmento aminoterminal del propéptido natriurético cerebral (0,72). El cociente de probabilidades positivo hallado para la mieloperoxidasa es de 6,9172. Recientemente se ha publicado un estudio en el que no se D. Pérez Surribas et al ha hallado ninguna relación entre una concentración elevada de mieloperoxidasa y una mayor mortalidad, aunque sı́ con episodios cardı́acos recurrentes a los 4 meses63 (tabla 1). También se ha publicado sobre el uso de la mieloperoxidasa en la prevención primaria un cociente de probabilidades positivo de 1,36 para el desarrollo de enfermedad cardiovascular en individuos sanos73. La activación de los neutrófilos y macrófagos puede tener lugar en enfermedades infecciosas e inflamatorias, por lo que el uso de esta proteı́na como marcador se asocia a una especificidad diagnóstica limitada. Por otra parte, la deficiencia en mieloperoxidasa, que se hereda como rasgo autosómico recesivo con una prevalencia de 1:2.000, podrı́a afectar negativamente a su sensibilidad diagnóstica19,74. Los polimorfismos que poseen los alelos –638C4A y V53F en las regiones 50 no codificante y codificante del gen MPO se asocian con una mayor actividad mieloperoxidasa, por lo que éstos podrı́an ser determinantes genéticos para el riesgo de padecer enfermedad cardiovascular75. Las estatinas disminuyen la concentración plasmática de la proteı́na C reactiva y la mieloperoxidasa en pacientes con sı́ndrome coronario agudo, hecho que puede explicar los beneficios que experimentan los pacientes tratados con este grupo de medicamentos76. Asimismo, en un experimento realizado en cerdos, se ha probado que la administración de un antagonista del receptor de endotelina disminuye el tamaño del infarto. El efecto cardioprotector de esta sustancia se debe a una inhibición de la acumulación de los leucocitos en el miocardio o inhibición de su activación. Tal inhibición se manifiesta por una disminución en la actividad mieloperoxidasa77. Actualmente no existe un principio de medida estandarizado ni hay materiales de referencia certificados para la mieloperoxidasa. Existen varios enzimoinmunoanálisis y recientemente se ha comercializado un quimioluminoinmunoanálisis automatizado64,67,78. Proteı́na C reactiva La inflamación tiene un papel fundamental en todas las etapas de la enfermedad cardiovascular, desde el inicio hasta las complicaciones trombóticas. Por ello, los mediadores de inflamación son unos candidatos prometedores a ser marcadores de esta enfermedad. La proteı́na C reactiva es probablemente el marcador de inflamación mejor conocido. Desde 1944 se sabe que el plasma de los pacientes que han sufrido un infarto agudo de miocardio presenta una alta concentración de proteı́na C reactiva79, pero más que la elevación que la concentración de la proteı́na C reactiva pueda sufrir por la respuesta inflamatoria tras una necrosis cardiaca, interesa su elevación antes de esta necrosis. La concentración de proteı́na C reactiva se halla más elevada en los pacientes con angina inestable que en los pacientes con angina estable80. Una posible hipótesis al respecto es que la inflamación que subyace en la enfermedad cardiovascular se exacerba en el sı́ndrome coronario agudo y se desestabilizan las placas vulnerables11. El papel de la proteı́na C reactiva puede ir más allá de ser un simple mediador de la inflamación, para ejercer un papel proaterogénico. Por este motivo ha sido uno de los ARTICLE IN PRESS Nuevos marcadores en el sı́ndrome coronario agudo componentes biológicos más estudiados en la enfermedad cardiovascular81. La proteı́na C reactiva se expresa en las lesiones ateroscleróticas, y hay evidencia de que se produce en las células musculares lisas y los macrófagos del ateroma. No obstante, el hecho de que se halle en la placa no implica que sea un agente causal. Diferentes trabajos le han atribuido propiedades proinflamatorias ligadas a la aterosclerosis, como son la inducción de la expresión monocı́tica de moléculas de adhesión intracelular y vascular del endotelio. También la disminución de la concentración de la óxido nı́trico sintasa y la prostaciclina en las células endoteliales, aumentando a su vez la concentración de endotelina 1 (sustancias que regulan la vasodilatación arterial). Además, los monocitos expuestos a la proteı́na C reactiva aumentan la liberación del factor tisular, estimulando la migración celular y la adhesión a las células endoteliales y la adhesión de lipoproteı́nas de baja densidad oxidadas. No obstante, se ha puesto en duda estos estudios, pues tales acciones también son atribuibles a otras sustancias inflamatorias presentes en el estudio que contaminaban la proteı́na C reactiva usada, como el lipopolisacárido bacteriano o la acida. Otro grupo de trabajos que han atribuido un papel proaterogénico a la proteı́na C reactiva son los que han tratado a esta proteı́na como objetivo terapéutico. Tal como ya se ha indicado anteriormente, las estatinas reducen sustancialmente la concentración de proteı́na C reactiva. En los pacientes tratados con este grupo de fármacos, la reducción se ha correlacionado con una disminución del riesgo de sufrir accidentes coronarios graves y ha resultado ser independiente de la concentración del colesterol de las lipoproteı́nas de baja densidad82–84. La proteı́na C reactiva predice, independientemente de otros marcadores, la evolución a corto y largo plazo en pacientes que han sufrido un sı́ndrome coronario agudo sin elevación del segmento ST12. Los cocientes de probabilidades positivos hallados son muy dispares: 0,17–150 para la evolución a corto plazo, y 1,02–157 a largo plazo. La asociación entre concentraciones altas de proteı́na C reactiva es más fuerte con el riesgo de muerte que con el de eventos cardı́acos recurrentes11,85. Tal como sucedı́a con la mieloperoxidasa, la concentración de proteı́na C reactiva puede estar elevada sin que lo esté la de troponina T; esta alta concentración es pronóstica de una mala evolución en las siguientes 2 semanas86 y en los siguientes 37 meses87 (tabla 1). Un aspecto interesante que tener en cuenta es que, dado que la proteı́na C reactiva se eleva tras la necrosis, resulta especialmente importante conocer el momento en que se realiza la toma de muestra para establecer un pronóstico correctamente. Se ha publicado que ese momento debe ser lo más cercano posible al inicio de los sı́ntomas88. La proteı́na C reactiva es un marcador de riesgo ya conocido en la prevención primaria de la enfermedad cardiovascular. Se han publicado numerosos estudios que demuestran una asociación significativa entre concentraciones plasmáticas elevadas del marcador y el riesgo de un primer evento cardiovascular o de un evento cardiovascular recurrente en los pacientes con una enfermedad cardiovascular ya establecida82. El principio de medición para la proteı́na C reactiva es la inmunoturbidimetrı́a y la inmunonefelometrı́a, y en el mercado hay muchos procedimientos de medida automati- 41 zados. La mayorı́a de ellos tienen un lı́mite de detección entre 3 y 8 mg/l, por lo que no son útiles para predecir el riesgo cardiovascular. Algunos procedimientos emplean un anticuerpo unido a una micropartı́cula de látex. El tamaño de esta partı́cula puede estar aumentado a fin de mejorar la sensibilidad metrológica, con lo que se logra medir esta proteı́na por debajo de 0,3 mg/l. Comúnmente, la medida de esta proteı́na se califica entonces de ultrasensible. Los estándares de todos estos procedimientos deben estar calibrados respecto al material de referencia certificado CRM 47089. Péptidos natriuréticos Se han identificado cuatro péptidos natriuréticos: dos de origen cardı́aco (atrial o A, y cerebral o B), uno de origen endotelial (tipo C) y el péptido tipo D aislado recientemente en serpientes. El péptido natriurético cerebral (BNP) se sintetiza como una preprohormona de 134 aminoácidos (preproBNP). Un estiramiento en la pared ventricular activa la escisión de este péptido formándose el propéptido natriurético cerebral (proBNP), de 108 aminoácidos. Éste es sustrato de una proteasa que lo descompone en su forma activa de 32 aminoácidos (BNP) y un fragmento aminoterminal de 76 aminoácidos (NT-proBNP) en una proporción de 1:1. La semivida de este último fragmento es unas 15 veces mayor que la del péptido natriurético cerebral. Ambas sustancias se liberan en mayor cantidad que el péptido natriurético atrial y su fragmento correspondiente en caso de enfermedad, por lo que se han utilizado más como marcadores cardı́acos90. El péptido natriurético cerebral se libera mayoritariamente por el miocardio ventricular, aunque su origen puede ser auricular según la cardiopatı́a91. Su secreción ejerce acciones fisiológicas beneficiosas como una vasodilatación equilibrada, natriuresis e inhibición del sistema nervioso autónomo simpático y del sistema reninaangiotensina-aldosterona92. El aumento de presión en el ventrı́culo izquierdo y el incremento de su diámetro que tienen lugar en el remodelamiento tras un infarto estiran la pared de esta cavidad, con lo que aumenta en el plasma la concentración de los péptidos natriuréticos. Pero hay evidencia de que también una isquemia miocárdica puede llevar a este aumento, aunque no se produzca una necrosis. Al parecer, una isquemia transitoria aumentarı́a el estrés en la pared induciendo la sı́ntesis y liberación proporcionalmente a la extensión de la zona afectada92. El péptido natriurético cerebral identifica a los pacientes con un sı́ndrome coronario agudo sin elevación del segmento ST que tienen mayor riesgo de morir a corto (para 1 semana se ha descrito un cociente de probabilidades positivo 2,5), medio (para 6 meses un cociente de probabilidad 8,4; para 10 meses, 5,8) y largo plazo (para 3 años, un cociente de 3,6–4,9). También se ha establecido un valor pronóstico para un infarto nuevo o recurrente o insuficiencia cardı́aca, aunque este valor es más débil93–96. Tal como sucedı́a con otros marcadores, este péptido puede tener una concentración plasmática elevada en pacientes con una concentración plasmática normal de troponina cardı́aca16. A su vez, el fragmento aminoterminal del propéptido natriurético cerebral es un indicador de la mortalidad: a) a corto término, los ARTICLE IN PRESS 42 pacientes que murieron en las 6 semanas siguientes al sı́ndrome coronario agudo tenı́an mayor concentración que los que sobrevivieron97; b) también a medio término: para 1 año se ha descrito un cociente de probabilidades positivo de 19,2, y c) largo término: para 4 años, un cociente de probabilidades positivo de 3,0 en pacientes con angina inestable, 5,6 en pacientes con un sı́ndrome coronario agudo sin elevación del segmento ST y 4,7 en pacientes con infarto y elevación de ST96,98 (tabla 1). Al contrario que otros marcadores, los péptidos natriuréticos se asocian a otros factores de riesgo de mala evolución, como edad avanzada, función renal deteriorada, la presencia de arritmias cardı́acas y la existencia previa de una disfunción del ventrı́culo sistólica o diastólica. No obstante, esta asociación logra integrar en un único marcador diferentes factores de riesgo. En realidad, el marcado valor pronóstico de estos péptidos está relacionado con su baja especificidad98. Los péptidos natriuréticos se utilizan en el diagnóstico de la insuficiencia cardı́aca, ya sea debido a una disfunción ventricular izquierda sistólica o diastólica. Para esta enfermedad posee una sensibilidad diagnóstica del 90% y, dado su alto valor predictivo para un resultado negativo (96%), una concentración baja prácticamente excluye una insuficiencia cardı́aca99. En 2004, un comité de expertos publicó una declaración de consenso en la que se emitieron recomendaciones en cuanto al uso del péptido natriurético cerebral en el diagnóstico, el pronóstico, la detección, la monitorización del tratamiento y como agente terapéutico en las enfermedades cardiovasculares100. Los principios de medida para los péptidos natriuréticos son el enzimoinmunoanálisis, el radioinmunoanálisis, el fluoroinmunoanálisis y el quimioluminoinmunoanálisis. Para ambos péptidos las caracterı́sticas metrológicas, el anticuerpo usado y la estandarización de los procedimientos de medida actualmente disponibles en el mercado son diferentes. Por lo tanto, no hay materiales de referencia certificados para ninguno de los dos marcadores. Dado que el laboratorio propietario de la licencia de fabricación del reactivo empleado en la medición del fragmento aminoterminal ha autorizado la fabricación a otros laboratorios, los reactivos son equivalentes y los resultados obtenidos deberı́an estar armonizados. Si bien los procedimientos de medida disponibles comercialmente para el péptido natriurético cerebral utilizan distintos pares de anticuerpos y diferentes calibradores, al menos los reactivos comercializados por dos laboratorios distintos presentan resultados comparables. Recientemente se ha descrito que el propéptido natriurético cerebral interfiere sustancialmente en la medición de la concentración del péptido natriurético cerebral en varios procedimientos. A su vez, el mismo propéptido interfiere de igual forma en la medición de la concentración del fragmento aminoterminal del propéptido. La Federación Internacional de Quı́mica Clı́nica ha establecido las especificaciones de calidad que deberı́an cumplir los laboratorios fabricantes de reactivos64,101–103. Uso de paneles de marcadores El sı́ndrome coronario agudo es una entidad clı́nica compleja en la que intervienen varios factores contribuyentes: D. Pérez Surribas et al ruptura de placa con trombosis aguda, obstrucción mecánica progresiva, inflamación, angina inestable secundaria y vasoconstricción coronaria. En cada paciente el peso especı́fico de estos factores puede variar sustancialmente. La identificación de los más determinantes puede contribuir significativamente a establecer la estrategia terapéutica más adecuada. Asimismo, el riesgo a padecer eventos cardı́acos futuros y el de morir también varı́an en función de la extensión de la necrosis miocárdica, las consecuencias hemodinámicas del infarto y la extensión de la enfermedad cardiovascular13. La aparición de nuevos marcadores que ponen de manifiesto la inflamación, la desestabilización de la placa, su ruptura, la isquemia, la necrosis miocárdica y su disfunción permite identificar la contribución de cada uno de estos procesos en el sı́ndrome coronario agudo19. Diversos autores han apuntado a la conveniencia de emplear paneles de marcadores en el sı́ndrome coronario agudo. Para el pronóstico de este sı́ndrome, el panel deberı́a combinar un marcador de necrosis cardiaca (troponinas) con uno de estrés hemodinámico (péptidos natriuréticos) o de inflamación (proteı́na C reactiva). Una concentración elevada de un péptido natriurético o de proteı́na C reactiva indica un mal pronóstico, aunque no concurra una elevación de la concentración de las troponinas cardı́acas13,85–87. Otro posible panel es el que incluye las tres proteı́nas a la vez: se ha publicado que el riesgo de morir en los siguientes 30 dı́as que un paciente tiene se multiplica por 2 ante la concentración elevada de una ellas, por 5 si son dos las elevadas y por 13 si son las tres. Para otras evoluciones como el infarto agudo de miocardio o la insuficiencia cardı́aca en los siguientes 30 dı́as a 10 meses, se han obtenido resultados similares104. La mieloperoxidasa también es un marcador de desestabilización de la placa que tener en cuenta para su uso en el panel junto con una troponina cardı́aca67,70. En la actualidad no existen recomendaciones sobre qué intervención debe tener el clı́nico ante un resultado elevado de la concentración plasmática de un péptido natriurético, proteı́na C reactiva o mieloperoxidasa, contrariamente a lo que sucede para las troponinas cardı́acas. Probablemente en un futuro próximo se defina esta actitud13. En el diagnóstico del sı́ndrome coronario agudo o la exclusión de este diagnóstico, el panel deberı́a incluir un marcador de isquemia (albúmina modificada por isquemia) y uno de necrosis miocárdica (troponina cardı́aca)11,29–32. Conclusiones Actualmente la aplicación clı́nica de los marcadores del sı́ndrome coronario agudo ya no se limita a confirmar o excluir una necrosis del miocardio. Estos marcadores proporcionan conocimiento de forma no invasiva sobre la causa y las consecuencias de este sı́ndrome para establecer el riesgo de eventos recurrentes y constituyen el objetivo de terapias especı́ficas16. En el diagnóstico del sı́ndrome coronario agudo, la albúmina modificada por isquemia tiene interés si se usa conjuntamente con alguna de las troponinas cardı́acas y el electrocardiograma para descartar la presencia de este sı́ndrome. La proteı́na fijadora de ácidos grasos-H es un marcador de necrosis de utilidad en el diagnóstico precoz del infarto agudo de miocardio, y es más sensible en las ARTICLE IN PRESS Nuevos marcadores en el sı́ndrome coronario agudo primeras horas que la troponina T, la mioglobina y la isoenzima 2 de la creatina cinasa. En cuanto al pronóstico de este sı́ndrome, las troponinas cardı́acas siguen proporcionando una valiosa información. No obstante, la proteı́na C reactiva, los péptidos natriuréticos y la mieloperoxidasa complementan el valor pronóstico de aquéllas. Además de las troponinas cardı́acas, el ligando soluble CD40 permite la clasificación y la individualización del tratamiento del sı́ndrome coronario agudo. Actualmente no hay suficiente evidencia para que ningún nuevo marcador sustituya a los que recomiendan las guı́as de práctica clı́nica de las sociedades cientı́ficas. Por otra parte, no se dispone de procedimientos compatibles con la urgencia médica para algunos de ellos. El uso de paneles fruto de la combinación de los marcadores ya establecidos y los emergentes puede aumentar significativamente el gasto sanitario. Por ello, la implementación de estos paneles debe hacerse utilizando la evidencia cientı́fica disponible y tomando como objetivo su contribución a una mejor evolución del paciente13. Bibliografı́a 1. Parlamento Europeo. Salud pública 12-7-2007. Ref.: 20070710IPR09090. Disponible en: http://www.europarl.europa. eu/news/expert/infopress. 2. Kesteloot H, Sans S, Kromhout D. Dynamics of cardiovascular and all-cause mortality in Western and Eastern Europe between 1970 and 2000. Eur Heart J. 2006;27:107–13. 3. Mackenbach JP, Cavelaars AEJM, Kunst AE, Groenhof AE. Socioeconomic inequalities in cardiovascular disease mortality. An international study. Eur Heart J. 2000;21:1141–51. 4. Stramba-Badiale M, Fox K, Priori S, Collins P, Daly C, Graham I, et al. Cardiovascular diseases in women: a statement from the policy conference of the European Society of Cardiology. Eur Heart J. 2006;27:994–1005. 5. Garcı́a-Castrillo L, Loma AL, Recuerda E, Muñoz P. La cardiopatı́a isquémica en los servicios hospitalarios. Proyecto EVICURE. Emergencias. 2000;12:183–90. 6. Garcia-Castrillo L. Epidemiologı́a del sı́ndrome coronario agudo en los servicios de urgencias. Emergencias. 2002;14:S69–74. 7. Boersma E, Maas AC, Deckers JW, Simoons ML. Early thrombolytic treatment in acute myocardial infarction: reappraisal of the golden hour. Lancet. 1996;348:771–5. 8. Villanueva FS, Sabia PJ, Afrookteh A, Pollock SG, Hwang LJ, Kaul S. Value and limitations of current methods of evaluating patients presenting to the emergency room with cardiacrelated symptoms for determining long-term prognosis. Am J Cardiol. 1992;69:746–50. 9. Braunwald E, Antman E, Beasley J, Califf R, Cheitlin M, Hochman J, et al. ACC/AHA guidelines for the management of patients with unstable angina and non-ST-segment elevation myocardial infarction. J Am Coll Cardiol. 2000:970–1056. 10. Utset JM. Actualización en el tratamiento de los sı́ndromes coronarios agudos. Med Clin (Barc). 1999;113:294–308. 11. National Academy of Clinical Biochemistry. National Academy of Clinical Biochemistry Laboratory medicine practice guidelines: clinical characteristics and utilization of biochemical markers in acute coronary syndromes. Clin Chem. 2007;53: 552–74. 12. Bassand JP, Hamm C, Ardissino D, Boersma E, Budaj A, Fernández-Avilés F, et al. Guidelines for the diagnosis and treatment of non-ST-segment elevation acute coronary syndromes. Eur Heart J. 2007;28:1598–660. 43 13. Morrow D, Braunwald E. Future of biomarkers in acute coronary syndromes. Moving toward a multimarker strategy. Circulation. 2003;108:250–2. 14. Lander ES, Linton LM, Birren B, Nusbaum C, Zody MC, Baldwin J, et al. International human genome sequencing consortium. Inicial sequencing and analysis of the human genome. Nature. 2001;409:n860–921. 15. Vasan R. Biomarkers of cardiovascular disease: molecular basis and practical considerations. Circulation. 2006;113:2335–62. 16. Morrow DA, De Lemos JA, Sabatine MS, Antman EM. The search for a biomarker of cardiac ischemia. Clin Chem. 2003;49: 537–9. 17. The Joint European Society of Cardiology/American College of Cardiology Committee. Myocardial infarction redefined—a consensus document of the Joint European Society of Cardiology/American College of Cardiology Committee for the redefinition of myocardical infarction. J Am Coll Cardiol. 2000;36:959–69. 18. Clerico A. The increasing impact of laboratory medicine on clinical cardiology. Clin Chem Lab Med. 2003;41:871–83. 19. Apple F, Wu A, Mair J, Ravkilde J, Panteghini M, Tate J, et al. Future biomarkers for detection of ischemia and risk stratification in acute coronary syndrome. Clin Chem. 2005;51: 810–24. 20. LaBaer J. So, you want to look for biomarkers. J Proteome Res. 2005;4:1053–9. 21. Hanley JA, McNeil BJ. The meaning and use of the area under a receiver operating characteristic (ROC curve). Radiology. 1982;143:29–36. 22. Dujardin B, Van der Ende J, Van Gompel A, Unger JP, Van der Stuyft P. Likelihood ratios: a real improvement for clinical decisión making? Eur J Epidemiol. 1994;10:29–36. 23. Kattan MW. Judging new markers by their ability to improve predictive accuracy. J Natl Cancer Inst. 2003;95:634–5. 24. Mothes E, Faller P. Evidence that the principal CoII-binding site in human serum albumin is not at the N-terminus: implication on the albumin cobalt binding test for detecting myocardial ischemia. Biochemistry. 2007;46:2267–74. 25. Bar-Or D, Curtis G, Rao N, Bampos N, Lau E. Characterization of the Co(2+) and Ni(2+) binding amino-acid residues of the Nterminus of human albumin. An insight into the mechanism of a new assay for myocardial ischemia. Eur J Biochem. 2001;268: 42–7. 26. Sinha MK, Gaze DC, Tippins JR, Collinson PO, Kaski JC. Ischemia modified albumin is a sensitive marker of myocardial ischemia after percutaneous coronary intervention. Circulation. 2003;107:2403–5. 27. Quiles J, Roy D, Gaze D, Garrido IP, Avanzas P, Sinha M, et al. Relation of ischemia-modified albumin (IMA) levels following elective angioplasty for stable angina pectoris to duration of balloon-induced myocardial ischemia. Am J Cardiol. 2003; 92:322–43. 28. Christenson RH, Duh SH, Sanhai WR, Wu AHB, Holtman V, Painter P, et al. Characteristics of an albumin cobalt binding test for assessment of acute coronary syndrome patients: a multicenter study. Clin Chem. 2001;47:464–70. 29. Sinha MK, Roy D, Gaze DC, Collinson PO, Kask JC. Role of ‘‘Ischemia Modified Albumin,’’ a new biochemical marker of myocardial ischemia, in the early diagnosis of acute coronary syndromes. Emerg Med J. 2004;21:29–34. 30. Roy D, Quiles J, Aldama G, Sinha M, Avanzas P, ArroyoEspliguero R, et al. Ischemia modified albumin for the assessment of patients presenting to the emergency department with acute chest pain but normal or non-diagnostic 12lead electrocardiograms and negative cardiac troponin T. Int J Cardiol. 2004;97:297–301. 31. Anwaruddin S, Januzzi Jr JL, Baggish AL, Lewandrowski EL, Lewandrowski KB. Ischemia-modified albumin improves the ARTICLE IN PRESS 44 32. 33. 34. 35. 36. 37. 38. 39. 40. 41. 42. 43. 44. 45. 46. 47. D. Pérez Surribas et al usefulness of standard cardiac biomarkers for the diagnosis of myocardial ischemia in the emergency department setting. Am J Clin Pathol. 2005;123:140–5. Abadie JM, Blassingame CL, Bankson DD. Albumin cobalt binding assay to rule out acute coronary syndrome. Ann Clin Lab Sci. 2005;35:66–72. Peacock F, Morris DL, Anwaruddin S, Christenson RH, Collinson PO, Goodacre SW, et al. Meta-analysis of ischemia-modified albumin to rule out acute coronary syndromes in the emergency department. Am Heart J. 2006;152:253–62. Apple F, Quist H, Otto A, Mathews W, Murakami M. Release characteristics of cardiac biomarkers and ischemia-modified albumin as measured by the albumin cobalt-binding test after a marathon race. Clin Chem. 2002;48:1097–100. Keating L, Benger JR, Beetham R, Bateman S, Veysey S, Kendall J, et al. The PRIMA study: presentation ischaemiamodified albumin in the emergency department. Emerg Med J. 2006;23:764–8. Aparci M, Kardesoglu E, Ozmen N, Ozcan O, Cebeci BS, Cingozbay BY, et al. Prognostic significance of ischemiamodified albumin in patients with acute coronary syndrome. Coronary Artery Dis. 2007;18:367–73. Worster A, Devereaux PJ, Heels-Ansdell D, Guyatt GH, Opie J, Mookadam F, et al. Capability of ischemia-modified albumin to predict serious cardiac outcomes in the short term among patients with potential acute coronary syndrome. CMAJ. 2005;172:1685–90. Zapico Muñiz E, Santaló Bel M, Mercé Muntañola J, Montiel JA, Martı́nez Rubio A, Ordóñez Llanos J. Ischemia-modified albumin during skeletal muscle ischemia. Clin Chem. 2004; 50:1063–5. Bhagavan N, Lai E, Rios P, Yang J, Ortega-López A, Shinoda H, et al. Evaluation of human serum albumin cobalt binding assay for the assessment of myocardial ischemia and myocardial infarction. Clin Chem. 2003;49:581–5. Gaze DC, Crompton L, Collinson P. Ischemia-modified albumin concentrations should be interpreted with caution in patients with low serum albumin concentrations. Med Princ Pract. 2006;15:322–4. Lee YW, Kim HJ, Cho YH, Shin HB, Choi TY, Lee YK. Application of albumin-adjusted ischemia modified albumin index as an early screening marker for acute coronary syndrome. Clin Chim Acta. 2007;384:24–7. Pelsers M, Hermens W, Glatz J. Fatty acid-binding proteins as plasma markers of tissue injury. Clinica Chimica Acta. 2005; 352:15–35. Azzazzy H, Pelsers M, Christenson R. Unbound free fatty acids and Heart-type fatty acid-binding protein: diagnostic assays and clinical applications. Clin Chem. 2006;52:19–29. Okamoto. Human Heart-type cytoplasmic fatty acid-binding protein (H-FABP) for the diagnosis of acute myocardical infarction. Clinical of H-FABP in comparison with myoglobin and creatine kinase isoenzyme MB. Clin Chem Lab Med. 2000; 38:231–8. Cavus U, Coskun F, Yavuz B, Ciftci O, Sahiner L, Aksoy H, et al. Heart-type, fatty-acid binding protein can be a diagnostic marker in acute coronary syndromes. J Natl Med Assoc. 2006;98:1067–70. Ruzgar O, Bilge AK, Bugra Z, Umman S, Yilmaz E, Ozben B, et al. The use of human heart-type fatty acid-binding protein as an early diagnostic biochemical marker of myocardial necrosis in patients with acute coronary syndrome, and its comparison with troponin-T and creatine kinase-myocardial band. Heart Vessels. 2006;21:309–14. Mad P, Domanovits H, Fazelnia C, Stiassny K, Russmüller G, Cseh A, et al. Human heart-type fatty-acid-binding protein as a point-of-care test in the early diagnosis of acute myocardial infarction. QJM. 2007;100:203–10. 48. Hermens WT. Mechanisms of protein release from injured Herat muscle. Dec Cardiovasc Med. 1998;205:85–98. 49. Ozdemir M, Durakoglugil E, Gülbahar O, Turkoglu S, Sancak B, Pasaoglu H, et al. Heart fatty acid binding protein and myoglobin after reperfusion of acute myocardial infarction. Acta Cardiol. 2007;62:473–8. 50. Van Nieuwenhoven, Kleine AH, Wodzig WH, Hermens WT, Kragten HA, Maessen JG, et al. Discrimination between myocardical and skeletal muscle injury by assessment of the plasma ratio of myoglobin over fatty acid-binding protein. Circulation. 1995;92:2848–54. 51. Hayashida N, Chihara S, Akasu K, Oda T, Tayama E, Kai E, et al. Plasma and urinary levels of Herat fatty acid-binding protein in patients undergoing cardiac surgery. Jpn Circ J. 2000;64: 18–22. 52. O’Donoghue M, De Lemos JA, Morrow SA, Buros JL, Cannon CP, Sabatine MS. Prognostic utility of Heart-type fatty acid binding protein in patients with acute coronary syndromes. Circulation. 2006;114:550–7. 53. Pelsers M. Fatty acid-binding protein as plasma marker for tissue injury [tesis doctoral]. Maastricht: Universidad de Maastrich; 2004. 54. Niizeki T, Takeishi Y, Arimoto T, Takabatake N, Nozaki N, Hirono O, et al. Heart-type fatty acid-binding protein is more sensitive than troponin T to detect the ongoing myocardial damage in chronic heart failure patients. J Card Fail. 2007; 13:120–7. 55. Lida M, Yamazaki M, Honjo H, Kodama I, Kamiya K. Predictive value of heart-type fatty acid-binding protein for left ventricular remodelling and clinical outcome of hypertensive patients with mild-to-moderate aortic valve diseases. J Hum Hypertens. 2007;21:551–7. 56. Tambara K, Fujita M, Miyamoto S, Doi K, Nishimura K, Komeda M. Pericardial fluid level of Herat-type cytoplasmic fatty acidbinding protein (H-FABP) is an indicator of severe myocardial ischemia. Int J Cardiol. 2004;93:281–4. 57. Bertinchant JP, Polge A. [Diagnostic and prognostic value of heart-type fatty acid-binding protein (H-FABP), an early biochemical marker of myocardial injury]. Arch Mal Coeur Vaiss. 2005;98:1225–31. 58. Zaninotto M, Mion MM, Novello E, Altinier S, Rocco S, Cacciavillani L, et al. Analytical and clinical evaluation of a new heart-type fatty acid-binding protein automated assay. Clin Chem Lab Med. 2006;44:1383–5. 59. Heeschen C, Dimmeler S, Hamm C, Van den Brand M, Boersma E, Séller A, et al. Soluble CD40 ligand in acute coronary syndromes. N Engl J Med. 2003;348:1104–11. 60. Mazzei G, Edgerton M, Losberger C, Lecoanet-Henchoz A, Graber P, Durandy A, et al. Recombinant soluble trimeric CD40 ligand is biologically active. JBC. 1995;270:7025–8. 61. Varo N, De Lemos J, Lobby P, Morrow D, Murphy S, Unzo R, et al. Soluble CD40L: risk prediction alter acute coronary syndromes. Circulation. 2003;108:1049–52. 62. Schönbeck U, Varo N, Lobby P, Buring J, Ridker P. Soluble and cardiovascular risk in women. Circulation. 2001;104:2266–8. 63. Apple F, Pearce L, Chung A, Ler R, Murakami M. Multiple biomarker use for detection of adverse events in patients presenting with symptoms suggestive of acute coronary sı́ndrome. Clin Chem. 2007;53:874–81. 64. Apple F, Jaffe A. Cardiac function. En: Burtis C, Ashwood E, Bruns D, editors. Tietz textbook of clinical chemistry and molecular diagnostics. 4.a ed. St. Louis: Elsevier-Saunders; 2006. p. 1619–70. 65. Sugiyama S, Okada Y, Sukhova G, Virmani R, Heinecke J, Lobby P. Macrophage myeloperoxidase regulation by granulocyte macrophage colony-stimulating factor in human atherosclerosis and implications in acute coronary syndromes. Am J Pathol. 2001;158:879–91. ARTICLE IN PRESS Nuevos marcadores en el sı́ndrome coronario agudo 66. Nicholls SJ, Hazen SL. The role of myeloperoxidase in the pathogenesis of coronary artery disease. Jpn J Infect Dis. 2004;57:S21–2. 67. Brennan ML, Penn MS, Van Lente F, Nambi V, Shishehbor MH, Aviles RJ, et al. Prognostic value of myeloperoxidase in patients with chest pain. N Engl J Med. 2003;349:1595–604. 68. Zhang R, Brennan ML, Fu X, Aviles R, Pearce G, Penn M, Topol E, Sprecher D, Hazen S. Association between myeloperoxidase levels and risk of coronary artery disease. JAMA. 2001;286: 1595–603. 69. Baldus S, Heitzer T, Eiserich JP, Lau D, Mollnau H, Ortak M, et al. Myeloperoxidase enhances nitric oxide catabolism during myocardial ischemia and reperfusion. Free Radic Biol Med. 2004;37:902–11. 70. Baldus S, Heeschen C, Meinertz T, Zeiher AM, Eiserich JP, Munzel T, et al. Circulation. 2003;108:1440–5. 71. Mocatta TJ, Pilbrow AP, Cameron VA, Senthilmohan R, Frampton CM, Richards AM, et al. Plasma concentrations of myeloperoxidase predict mortality after myocardial infarction. J Am Coll Cardiol. 2007;49:1993–2000. 72. Khan SQ, Kelly D, Quinn P, Davies JE, Ng LL. Myeloperoxidase aids prognostication together with N-terminal pro-B-type natriuretic peptide in high-risk patients with acute ST elevation myocardial infarction. Heart. 2007;93:826–31. 73. Meuwese MC, Stroes ES, Hazen SL, Van Miert JN, Kuivenhoven JA, Schaub RG, et al. Serum myeloperoxidase levels are associated with the future risk of coronary artery disease in apparently healthy individuals: the EPIC-Norfolk Prospective Population Study. J Am Coll Cardiol. 2007;50:159–65. 74. Gallin J. Quantitative and qualitative disorders of phagocytes. En: Isselbacher K, Braunwald E, Wilson J, Martin J, Fauci A, Kasper D, editors. Harrison’s principles of internal medicine. 13.a ed. New York: McGraw-Hill; 1994. p. 329–39. 75. Chevrier I, Tregouet DA, Massonnet-Castel S, Beaune P, Loriot MA. Myeloperoxidase genetic polymorphisms modulate human neutrophil enzyme activity: genetic determinants for atherosclerosis? Atherosclerosis. 2006;188:150–4. 76. Zhou T, Zhou SH, Qi SS, Shen XQ, Zeng GF, Zhou HN. The effect of atorvastatin on serum myeloperoxidase and CRP levels in patients with acute coronary syndrome. Clin Chim Acta. 2006; 368:168–72. 77. Gonon AT, Gourine AV, Middelveld RJ, Alving K, Pernow J. Limitation of infarct size and attenuation of myeloperoxidase activity by an endothelin A receptor antagonist following ischaemia and reperfusion. Basic Res Cardiol. 2001;96:454–62. 78. Datwyler SA, Matias H, Pacenti D, Shih P, Pucci D. Evaluation of the architecht myeloperoxidase (MPO) assay in development. Trabajo presentado en el 17.1 congreso IFCC-FESCC de Quı́mica Clı́nica, Ámsterdam (Bélgica), junio de 2007. 79. Löfström G. Comparison between the reaction of acute phase serum with pneumococcus C-polysaccharide and with pneumococcus type 27. Br J Exp Pathol. 1944;25:21–6. 80. Berk BC, Weintraub WS, Alexander RW. Elevation of C-reactive protein in )active* coronary artery disease. Am J Cardiol. 1990;65:168–72. 81. Libby P, Ridker P, Maseri A. Inflammation and atherosclerosis. Circulation. 2002;105:1135–43. 82. Scirica B, Morrow D, Verma S, Devaraj S, Jialal I. The verdict is still out. Circulation. 2006;113:2128–51. 83. Patel T, Shishehbor M, Bhatt D. A review of high-dose statin therapy: targeting cholesterol and inflammation in atherosclerosis. Eur Heart J. 2007;28:664–72. 84. Jialal I, Miguelino E, Griffen S, Devaraj S. Concomitant reduction of low-density lipoprotein-cholesterol and biomarkers of inflammation with low-dose simvastatin therapy in patients with type 1 diabetes. J Clin Endocrinol Metab. 2007; 92:3136–40. 45 85. James S, Armstrong P, Barnathan E, Califf R, Lindahl B, Siegbahn A, et al. Troponin and C-reactive protein have different relations to subsequent mortality and myocardial infarction after acute coronary syndrome. J Am Coll Cardiol. 2003;41:916–24. 86. Morrow D, Rifai N, Antman E, Weiner DL, McCabe CH, Cannon CP, et al. C-reactive protein is a potent predictor of mortality independently of and in combination with troponin T in acute coronary syndromes: a TIMI 11A substudy. Thrombolysis in myocardial infarction. J Am Coll Cardiol. 1998;31:1460–5. 87. Lindahl B, Toss H, Siegbahn A, Venge P, Wallentin L. Markers of myocardial damage and inflammation in relation to long-term mortality in unstable coronary artery disease. N Engl J Med. 2000;343:1139. 88. De Winter R, Fischer J, Bholasingh R, Van Straalen J, De Jong T, Tijssen Sanders G. C-reactive protein and cardiac troponin T in risk stratification: differences in optimal timing of tests early after the onset of chest pain. Clin Chem. 2000;46:1597–603. 89. Rifai N, Warnick R. Lipids, lipoproteins, apolipoproteins, and other cardiovascular risk factors. En: Burtis C, Ashwood E, Bruns D, editors. Tietz textbook of clinical chemistry and molecular diagnostics. 4.a ed. St. Louis: Elsevier-Saunders; 2006. p. 1619–70. 90. Almenar L, Martı́nez-Dolz L. Péptidos natriuréticos en insuficiencia cardiaca. Rev Esp Cardiol. 2006;6:15–26. 91. Inoue S, Murakami Y, Sano K, Katoh H, Shimada T. Atrium as a source of brain natriuretic polypeptide in patients with atrial fibrillation. J Card Fail. 2000;6:92–6. 92. De Lemos J, Morrow D. Brain natriuretic peptide measurement in acute coronary syndromes. Ready for clinical application? Circulation. 2002;106:2868–70. 93. Morrow D, De Lemos JA, Sabatine M, Murphy S, Demopoulos L, DiBattiste P, et al. Evaluation of B-type natriuretic peptide for risk assessment in unstable angina/non-ST-elevation myocardial infarction: B-type natriuretic peptide and prognosis in TACTICS-TIMI 18. J Am Coll Cardiol. 2003;41:1264–72. 94. De Lemos JA, Morrow DA, Bentley JH, Omland T, Sabatine MS, McCabe CH, et al. The prognostic value of B-type natriuretic peptide in patients with acute coronary sı́ndromes. N Engl J Med. 2001;345:1014–21. 95. Richards AM, Nicholls MG, Espiner EA, Lainchbury JG, Troughton RW, Elliot J, et al. B-type natriuretic peptides and ejection fraction for prognosis after myocardical infarction. Circulation. 2003;107:2786–92. 96. James S, Lindahl B, Siegbahn A, Stridsberg M, Venge P, Armstrong P. N-terminal pro-brain natriuretic peptide and other risk markers for the separate prediction of mortality and subsequent myocardial infarction in patients with unstable coronary artery disease: a Global Utilization of Strategies To Open occluded arteries (GUSTO)-IV Substudy. Circulation. 2003;108:275–81. 97. Omland T, De Lemos JA, Morrow DA, Antman EM, Cannon CP, Hall C, et al. Prognostic value of N-terminal pro-atrial and probrain natriuretic peptide in patients with acute coronary syndromes. Am J Cardiol. 2002;89:463–5. 98. Omland T, Persson A, Ng L, O’Brien R, Karlsson T, Herlitz J. Nterminal pro-B-type natriuretic peptide and long-term mortality in acute coronary syndromes. Circulation. 2002;106: 2913–8. 99. Maisel AS, Krishnaswamy P, Nowak RM, McCord J, Hollander JE, Duc P, et al. Rapid measurement of B-type natriuretic peptide in the emergency diagnosis of heart failure. N Engl J Med. 2002;347:161–7. 100. Silver MA, Maisel A, Yancy CW, McCullough PA, Burnett JC, Francis GS, et al. BNP Consensus Panel 2004: a clinical approach for the diagnostic, prognostic, screening, treatment monitoring, and therapeutic roles of natriuretic peptides in cardiovascular diseases. Heart Fail. 2004;10(Suppl 3):1–30. ARTICLE IN PRESS 46 101. Mueller T, Gegenhuber A, Poelz W, Haltmayer M. Comparison of the Biomedica NT-proBNP Enzyme Immunoassay and the Roche NT-proBNP Chemiluminescence Immunoassay: Implications for the prediction of symptomatic and asymptomatic structural heart disease. Clin Chem. 2003;49:976–9. 102. Liang F, O’Rear J, Schellenberger U, Tai L, Lasecki M, Schreiner G, et al. Evidence for functional heterogeneity of circulating B-type natriuretic peptide. J Am Coll Cardiol. 2007;49:1071–8. D. Pérez Surribas et al 103. Apple F, Panteghini M, Ravkilde J, Mair J, Wu A, Tate J, et al. Quality specifications for B-type natriuretic peptide assays. Clin Chem. 2005;51:486–93. 104. Sabatine M, Morrow D, De Lemos JA, Gibson M, Murphy S, Rifai N, et al. Multimarker approach to risk stratification in non-ST elevation acute coronary syndromes: simultaneous assessment of troponin I, C-reactive protein, and B-type natriuretic peptide. Circulation. 2002;105:1760–3. ARTICLE IN PRESS Rev Lab Clin. 2009;2(1):47–55 Revista del Laboratorio Clínico www.elsevier.es/LabClin REVISIÓN Situación actual del diagnóstico prenatal no invasivo Alejandra Fernández Fernándeza, Belén Prieto Garcı́ab y Francisco V. Álvarez Menéndezb,c, a Laboratorio de Bioquı́mica, Servicio de Análisis Clı́nicos, Hospital Alvarez Buylla, Mieres, Asturias, España Servicio de Bioquı́mica Clı́nica, Hospital Universitario Central de Asturias, Oviedo, Asturias, España c Departamento de Bioquı́mica y Biologı́a Molecular, Universidad de Oviedo, Asturias, España b Recibido el 1 de septiembre de 2008; aceptado el 20 de noviembre de 2008 PALABRAS CLAVE ADN fetal; Células fetales; Eritroblastos; Diagnóstico prenatal no invasivo KEYWORDS Fetal DNA; Fetal cells; Erithroblasts; Non-invasive prenatal diagnosis Resumen El diagnóstico prenatal se basa en la obtención de tejido fetal, mediante métodos invasivos, para su posterior análisis genético. La amniocentesis y la biopsia corial son las técnicas más utilizadas, cuyo principal inconveniente es que conllevan un riesgo de aborto, entre el 0,5–1% y el 3,9%, respectivamente. El aislamiento de células fetales en sangre materna permite obtener material genético del feto de forma no invasiva, pero su escasez en sangre materna dificulta su utilización como método diagnóstico. La relativa abundancia del ADN fetal en la circulación materna, junto con la sensibilidad de la técnica utilizada para su cuantificación, convierten la detección de ADN fetal en plasma materno en un método alternativo para el diagnóstico de las enfermedades ligadas al cromosoma X o la determinación del estado RhD. En este artı́culo se hace una revisión del estado actual de los métodos de diagnóstico prenatal no invasivo. & 2008 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. Current state of the non-invasive prenatal diagnosis methods Abstract Prenatal diagnosis is based on genetic analysis of invasively obtained fetal tissue. Amniocentesis and chorial biopsy are the most used techniques, but carry a potential risk of miscarriage, from 0.5–1% up to 3.9% respectively. Isolation of fetal cells from maternal blood allows a non-invasive obtention of fetal genetic material, but their scarcity difficults an efficient diagnosis method. The relative abundance of fetal DNA in maternal blood, as well as the sensitivity of quantitative PCR based methods, constitute an attractive Autor para correspondencia. Correo electrónico: falvarezmen@gmail.com (F.V. Álvarez Menéndez). 1888-4008/$ - see front matter & 2008 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. doi:10.1016/j.labcli.2008.11.003 ARTICLE IN PRESS 48 A. Fernández Fernández et al alternative method for X-linked diseases and RhD status diagnosis. In this paper, a review of the present state of non-invasive prenatal diagnosis methods is described. & 2008 AEBM, AEFA y SEQC. Published by Elsevier España, S.L. All rights reserved. Introducción El diagnóstico prenatal reúne un conjunto de estrategias para la identificación de defectos congénitos durante el embarazo, como alteraciones morfológicas, estructurales, funcionales o moleculares del feto. El desarrollo de la amniocentesis a finales de los años sesenta del siglo pasado, y la biopsia corial en los años ochenta, permitió obtener tejido fetal durante el embarazo, y posibilitó el diagnóstico prenatal de defectos congénitos. Sin embargo, estas técnicas invasivas conllevan riesgos para el feto y la madre, por lo que no se ofrecen a todas las gestantes. En las últimas décadas se han desarrollado métodos de cribado que, aunque no aportan un diagnóstico definitivo, seleccionan embarazos de riesgo a edades gestacionales tempranas y permiten racionalizar el uso de los procedimientos invasivos. En la actualidad, el cribado prenatal de cromosomopatı́as incorpora marcadores bioquı́micos y ecográficos, además de la edad materna y otros factores de riesgo de la gestante, e incrementan considerablemente la tasa de detección. No obstante, lo ideal serı́a desarrollar métodos no invasivos para obtener tejido fetal, porque permitirı́an generalizar el diagnóstico de cromosomopatı́as a todas las gestantes, ası́ como minimizar el número de pruebas que comportan riesgo para el feto. Tras el descubrimiento de la presencia de células fetales y ADN fetal en la circulación materna, se ha investigado su posible utilidad para el diagnóstico prenatal no invasivo1–3. En esta revisión se expone la evolución y la situación actual de los métodos no invasivos de obtención de tejido fetal aplicados al diagnóstico prenatal. Células fetales Descubrimiento de células fetales en sangre materna En 1893, el patológo alemán Schmorl4 describió por primera vez la presencia de células trofoblásticas en los pulmones y en la circulación sanguı́nea de gestantes muertas por eclampsia, hallazgo que no fue confirmado hasta 1959 por Douglas et al5. El aislamiento de trofoblastos en sangre periférica materna se publicó 25 años después6. Estas células alcanzan la circulación materna en las primeras semanas de gestación, desaparecen entre las semanas 10 y 12, y presentan una morfologı́a multinuclear caracterı́stica que facilita su identificación pero dificulta el análisis del material genético por hibridación in situ fluorescente (FISH). Por otra parte, dado su origen placentario, no reflejan el cariotipo real del feto en el 1% de los casos en que existe un mosaicismo7, a lo que se añade la dificultad para desarrollar anticuerpos monoclonales especı́ficos para estas células8. En 1969, Walknowska et al9 aislaron linfocitos fetales en sangre de mujeres portadoras de fetos varones, primera evidencia de la presencia de estas células fetales en sangre periférica materna. En los años setenta del siglo pasado, se confirmó este hallazgo, pero la detección de cromatina Y en gestantes portadoras de fetos femeninos originó la falta de consenso sobre la utilidad de los métodos citogenéticos para este fin. La citometrı́a de flujo permitió aislar linfocitos fetales en sangre materna basándose en las diferencias existentes entre antı́genos leucocitarios humanos (HLA) de la madre y el feto10, sin alcanzar el 100% de sensibilidad y especificidad. Se postuló que la pérdida de especificidad podı́a deberse al aislamiento de células fetales de un embarazo anterior o de un aborto espontáneo. En 1996, Bianchi et al11 observaron linfocitos fetales de varón en sangre materna varios años después del parto, lo que representa un gran inconveniente para la utilización de este tipo celular como base para el diagnóstico prenatal. Otra limitación importante es la necesidad de disponer de anticuerpos anti-HLA especı́ficos para cada individuo, lo que requiere no sólo el estudio del HLA paterno sino también que haya diferencias en el HLA de la pareja. En 1990, Bianchi et al12 aislaron eritroblastos fetales en sangre materna mediante anticuerpos monoclonales que reconocı́an el receptor de la transferrina (CD71). A partir de este momento, muchos grupos de trabajo se centraron en el estudio de estas células como fuente de tejido fetal. El eritroblasto: célula diana ideal para el diagnóstico prenatal El eritroblasto posee caracterı́sticas que lo convierten en el candidato ideal para el diagnóstico prenatal no invasivo. En primer lugar, su identificación morfológica es sencilla y, al ser una célula nucleada, contiene toda la información genética del feto. Por otra parte, su corta vida media (25–35 dı́as) y su limitada capacidad proliferativa hacen poco probable el aislamiento de eritroblastos fetales de embarazos previos. Además, posee diversos marcadores celulares que facilitan su aislamiento e identificación. Por último, los eritroblastos forman una fracción importante de las células de la serie roja en la sangre fetal, con un valor máximo a las 8 semanas13, aunque son poco abundantes en la sangre periférica adulta. El paso de eritroblastos fetales a la circulación materna se produce a partir de la sexta semana de gestación. Una cuestión muy debatida ha sido la edad gestacional óptima para su aislamiento. Se ha descrito un aumento del número de eritroblastos fetales en el segundo trimestre de gestación14, ası́ como su porcentaje al pasar del segundo al tercer trimestre de gestación15. Otros autores, en cambio, han observado un descenso16. Recientemente, Hyoda et al17 han descrito la presencia de eritroblastos fetales en sangre ARTICLE IN PRESS Situación actual del diagnóstico prenatal no invasivo materna hasta el momento del parto, ası́ como su rápida desaparición después del nacimiento. La apoptosis serı́a la principal causa de la eliminación de las células fetales tras el parto; su persistencia en la sangre materna, una vez concluido el embarazo, se ha atribuido a progenitores resistentes a la apoptosis o a una regulación deficiente de ésta18. Otro punto controvertido es el porcentaje de eritroblastos fetales en sangre materna. Aunque normalmente no se detectan eritroblastos en sangre periférica de adultos sanos, su presencia durante el embarazo es un hecho constatado. Se ha descrito que entre un 74 y un 85% de los eritroblastos aislados en sangre materna son de origen fetal19,20. Sin embargo, la disparidad de resultados entre los diferentes estudios es llamativa, la mayorı́a de los cuales describen porcentajes mucho más bajos, de un 5021, un 20%22 o incluso inferiores al 5%23,24. No hay, pues, consenso sobre la proporción de eritroblastos fetales en sangre materna, aunque algunos autores estiman que es del orden de 1 célula/ml de sangre materna25. Aislamiento de eritroblastos fetales en sangre materna En condiciones normales, la placenta establece una barrera fetomaterna, de forma que se transfiere un número reducido de células fetales a la circulación materna. La baja proporción de eritroblastos fetales en sangre materna hace necesarios métodos de enriquecimiento y purificación como etapas previas al análisis genético. Enriquecimiento celular. El método más utilizado es la centrifugación en gradiente de densidad discontinuo26, ya sea simple (1077 g/l27 o 1119 g/l28), doble (1077/1119 g/l29) o triple30. Proporciona un buen rendimiento pero una pureza baja, ya que se aı́sla un elevado número de células mononucleadas de la serie blanca. Además, la distribución de los eritroblastos en el gradiente de densidad está afectada por el tiempo transcurrido entre la recogida de la muestra y su procesamiento31. Otra opción es la lisis selectiva de las células de la serie roja con cloruro de amonio32. Los eritroblastos fetales son menos susceptibles a la lisis que los eritrocitos adultos, lo que permite eliminar un gran número de células maternas contaminantes. No obstante, durante la lisis celular los eritroblastos fetales presentan alteraciones de membrana que dificultan su posterior análisis33. Purificación celular. Para la purificación de eritroblastos se han utilizado técnicas, como la separación celular mediante citometrı́a de flujo (FACS)10,12, la separación celular activada magnéticamente (MACS)23,34, la micromanipulación de células individuales35, la separación por flujo de carga (CFS)36, el aislamiento con partı́culas inmunomagnéticas37, la suspensión lı́quida de micropartı́culas de hierro con separación magnética38 o la separación en columnas con avidina39. Los métodos más utilizados (FACS y MACS) se basan en las diferencias antigénicas entre las células de interés y las 49 células contaminantes. Hasta el momento no se han descubierto antı́genos de superficie especı́ficos de eritroblastos fetales, por lo que el uso de anticuerpos anti-CD71 (comerciales40 o no comerciales31,41,42) ha sido la alternativa más frecuente. Para aumentar la especificidad del método, se propuso la combinación con otros anticuerpos, como la glicoforina A (GPA), una sialoproteı́na que se expresa en todas las células de la serie roja. Sin embargo, el anticuerpo anti-GPA produce aglutinación de los eritrocitos, dificultando el análisis de los eritroblastos aislados43. Otros anticuerpos utilizados son el anti-CD36, que reconoce el receptor de la trombospondina25, o los antiCD45 y anti-CD32, que permiten el marcaje de las células contaminantes para su posterior eliminación29,37. Por otra parte, se ha propuesto el marcaje de la cadena gamma de la hemoglobina fetal o la cadena épsilon de la hemoglobina embrionaria44. Sin embargo, durante el embarazo se estimula la sı́ntesis de una pequeña cantidad de hemoglobina fetal en las células maternas, reduciendo la especificidad del método y limitando su aplicación. De Graaf et al32 describieron el origen materno del 20% de los eritroblastos que expresan hemoglobina fetal. La hemoglobina embrionaria sólo se expresa en los eritroblastos fetales pero no se detecta a partir de la semana 14 de gestación45. Por último, se ha descrito la utilización de una lectina que se une especı́ficamente a los residuos de galactosa presentes en la superficie celular del eritroblasto46. Análisis genético. Los métodos más utilizados para determinar el origen fetal de los eritroblastos aislados han sido la FISH y la reacción en cadena de la polimerasa (PCR). Dada su sensibilidad y su especificidad elevadas, la PCR permite detectar secuencias especı́ficas del cromosoma Y47, y demostrar ası́ el origen fetal de la célula si el feto es varón. El análisis genético por PCR puede aplicarse a células individuales seleccionadas mediante microdisección48. Esta estrategia es eficaz pero requiere experiencia del operador, es laboriosa y conlleva pérdidas celulares hasta de un 18%. La FISH con sondas especı́ficas para los cromosomas X, Y, 21, 13 y 18 permite determinar el origen fetal de los eritroblastos aislados (en caso de feto varón) e identificar las aneuploidı́as más frecuentes49,50. Krabchi et al51. describieron la identificación y la cuantificación de células fetales en sangre materna de gestantes portadoras de un feto con sı́ndrome de Down, mediante marcaje in situ cebado (primed in situ labelling [PRINS]), técnica que utiliza un oligonucleótido cebador que se fija al ADN cromosómico. El cultivo selectivo de células precursoras eritroides en sangre materna podrı́a incrementar el número de células fetales disponibles52 y permitir el análisis de las células en metafase para la detección de anomalı́as cromosómicas53. Sin embargo, estos resultados no fueron reproducidos por otros investigadores54,55. En los últimos años, se han descrito métodos para el reconocimiento de los eritroblastos fetales basados en su morfologı́a caracterı́stica (núcleo compacto, condensación asimétrica de la cromatina y patrón de tinción caracterı́stico con la cadena gamma de la hemoglobina fetal)56. La ARTICLE IN PRESS 50 automatización de este método (análisis microscópico y tratamiento de imágenes) permitirı́a el análisis de un gran número de células, y facilitar la identificación de los eritroblastos fetales en sangre materna sin necesidad de enriquecimiento celular. A. Fernández Fernández et al basado en el aislamiento de eritroblastos fetales en sangre materna. ADN/ARN fetal Descubrimiento de ADN fetal libre en la circulación materna Eritroblastos fetales y diagnóstico prenatal El aislamiento de eritroblastos fetales en sangre materna ha demostrado potencial utilidad para la detección de aneuploidı́as20,49,57,58, el estudio del estado RhD fetal59, el diagnóstico de enfermedades genéticas mendelianas como la distrofia muscular de Duchenne60, el diagnóstico de hemoglobinopatı́as61 o la detección de complicaciones obstétricas62,63. En 1997, Bianchi et al47 demostraron que el número de eritroblastos en sangre materna es superior en gestantes con fetos con sı́ndrome de Down. Falcidia et al64 describieron un recuento de eritroblastos 6 veces superior en gestantes con fetos con trisomı́a 21. Este fenómeno no se observa en otras anomalı́as cromosómicas, como las trisomı́as 13 y 18. En Estados Unidos, el estudio NIFTY (National Institutes of Health Fetal Cell Study) valoró la eficacia del aislamiento de células fetales en sangre materna, y describió una sensibilidad del 41% para la detección del sexo fetal y del 74%, para el diagnóstico de aneuploidı́as fetales65. Este estudio evidenció que el sistema MACS proporciona mejor recuperación y mayor detección de células fetales que FACS. El número de eritroblastos también aumenta en sangre materna en casos de crecimiento intrauterino retardado o polihidramnios. Este aumento podrı́a estar asociado a alteraciones estructurales de la placenta66,67. La hipertensión gestacional es una de las complicaciones obstétricas más frecuentes. Aproximadamente, el 20% de las pacientes con hipertensión gestacional presentan criterios de preeclampsia, una de las principales causas de morbimortalidad materna y fetal. En 1994, Ganshirt et al68 describieron un aumento del número de eritroblastos en 43 gestantes con preeclampsia respecto a un grupo control formado por 222 embarazadas sin complicaciones obstétricas. Este hallazgo se confirmó en gestantes portadoras de fetos varones, lo que afirma que una gran proporción de los eritroblastos aislados eran de origen fetal69. Aunque se desconoce la etiologı́a de la enfermedad, parece que los mecanismos responsables de la patogenia se producen en una fase temprana del embarazo, probablemente durante la implantación70,71, y se ha descrito un aumento del número de eritroblastos en gestantes con un Doppler uterino alterado, a partir de la semana 20 de gestación, e incluso antes de que la enfermedad se manifieste clı́nicamente72. Álvarez et al73 observaron un aumento del número de eritroblastos en gestantes que posteriormente desarrollaron preeclampsia, si bien los eritroblastos aislados eran mayoritariamente de origen materno y no fetal. Las investigaciones llevadas a cabo hasta ahora manifiestan la escasez de células fetales en sangre materna, por lo que se requieren métodos de enriquecimiento laboriosos, y la ausencia de marcadores especı́ficos para su identificación. Actualmente, no se dispone, en la práctica clı́nica, de un método de cribado o de diagnóstico prenatal no invasivo En 1997, Lo et al3 demostraron la presencia de ADN fetal en la circulación materna mediante la detección de secuencias del cromosoma Y en plasma materno. La PCR a tiempo real permitió la cuantificación de secuencias de ADN fetal con una sensibilidad y una especificidad próximas al 100%, y reveló que la concentración de ADN en plasma materno es mucho más alta de lo que cabrı́a esperar si todo el ADN fetal detectado procediese de la fracción celular fetal existente en la circulación materna. Se ha detectado ADN fetal en plasma materno a partir de la quinta semana de gestación74. La concentración de ADN total parece aumentar significativamente durante el embarazo75,76, aproximadamente un 29,3% en cada semana de gestación77, pero el ADN fetal supone tan sólo un 5–7% del total78. Tras el parto, el ADN fetal desaparece de la circulación materna en cuestión de minutos79. Botezatu et al75 proponen como posible mecanismo el aclaramiento renal del ADN fetal, dado que se ha detectado en orina de mujeres embarazadas portadoras de un feto varón. Actualmente, se conoce poco sobre las caracterı́sticas biológicas y moleculares del ADN fetal presente en la circulación materna. Un descubrimiento interesante es que el tamaño del ADN fetal es más pequeño que el materno, lo que podrı́a utilizarse como un posible método de enriquecimiento del ADN fetal77. Origen del ADN fetal libre en la circulación materna La degradación de las células fetales intactas presentes en la circulación materna es uno de los posibles mecanismos de liberación de ADN fetal a la circulación materna. Un elevado número de células fetales presentan apoptosis, por interacción con el sistema inmunitario materno80, lo que explicarı́a el aumento del número de eritroblastos y de la cantidad de ADN fetal en gestantes con preeclampsia o con fetos con aneuploidı́as. Sin embargo, dado el bajo porcentaje de eritroblastos fetales en sangre materna, estas células difı́cilmente pueden ser el único origen del ADN fetal en plasma materno. La correlación entre la concentración de ADN fetal en plasma materno tanto con la edad gestacional como con la concentración de hormona gonadotropina coriónica humana (hCG), ası́ como la detección de secuencias de ADN fetal dı́as después de la implantación y la elevación de las concentraciones de dicho ADN fetal en gestantes con preeclampsia, sugieren un origen placentario del ADN fetal en plasma materno, probablemente también por apoptosis de la células trofoblásticas. Por otra parte, la detección de secuencias de ADN fetal en otros fluidos como el lı́quido amniótico81, la orina materna y lı́quidos cefalorraquı́deo y peritoneal maternos82,83 ha llevado a considerar la posibilidad de una transferencia directa de ADN. Es muy probable que los 3 mecanismos coexistan y que la placenta aporte la mayor parte del ADN fetal libre en plasma. ARTICLE IN PRESS Situación actual del diagnóstico prenatal no invasivo Análisis de ADN fetal en plasma materno Hay diferencias importantes entre los métodos descritos para el análisis del ADN en plasma materno lo que explica la falta de homogeneidad en los resultados publicados. En 2004, se describió un protocolo para la comparación de la detección de ADN fetal entre diferentes laboratorios84. Las sensibilidades variaban entre el 31,4 y el 97,1% para la detección de secuencias de ADN del gen SRY con especificidades del 92,8–100%. En dicho estudio se consideraron parámetros crı́ticos para la calidad de los resultados el retraso en el procesamiento de las muestras y la eficacia del proceso de extracción de ADN. El tratamiento inadecuado de las muestras puede conducir a la lisis de células residuales de origen materno en el plasma, que interfieren en la cuantificación de las secuencias de ADN fetal. ADN fetal y diagnóstico prenatal En general, las aplicaciones clı́nicas de la detección de ADN fetal en el plasma materno se basan en la cuantificación de secuencias de ADN fetal o en la detección de secuencias exclusivas del feto. Muchas de las complicaciones del embarazo se asocian a un aumento de la cantidad de ADN fetal en la circulación materna. La principal limitación es la necesidad de marcadores fetales independientes del sexo, como polimorfismos de ADN85, marcadores epigenéticos fetales86 o ARNm de genes expresados en la placenta87. Sin embargo, la determinación no invasiva de enfermedades mendelianas, como la talasemia o la fibrosis quı́stica, parece cada vez más cercana88. La primera aplicación del análisis de ADN fetal en plasma materno fue la detección del sexo fetal, de utilidad para el diagnóstico de enfermedades ligadas al cromosoma X3,89,90. La detección de secuencias especı́ficas del cromosoma Y se ha utilizado también para estudiar la posible relación entre la concentración de ADN fetal y la presencia de complicaciones asociadas al embarazo o de trisomı́as fetales. Se ha descrito un aumento de la concentración de ADN fetal en plasma materno en casos de trisomı́a 2191, hiperemesis gravı́dica92, placenta invasiva93 o preeclampsia94, donde el aumento de la concentración de ADN fetal parece producirse incluso antes de la manifestación clı́nica de la enfermedad y se correlaciona con la gravedad95. La determinación del sexo fetal en las primeras semanas de gestación también es útil en los embarazos con riesgo de hiperplasia adrenal congénita96, puesto que permite iniciar una terapia con dexametasona que evita la virilización de los genitales externos femeninos. El marcador más utilizado para la cuantificación de ADN de varón en plasma materno ha sido el gen SRY. En el primer trimestre de gestación, la concentración de ADN fetal en sangre materna es cercana al lı́mite de detección de la técnica, por lo que se pueden observar falsos negativos. Sin embargo, la amplificación de secuencia multicopia del gen DYS14 ha permitido obtener lı́mites de detección 10 veces inferiores a los descritos con secuencias del gen SRY97. La cuantificación de ADN fetal en plasma materno se ha propuesto como método de diagnóstico prenatal en los casos de aneuploidı́a. No obstante, el ADN fetal representa menos del 10% del ADN circulante en plasma materno, lo que 51 dificulta la detección de loci fetales o polimorfismos. Recientemente, se han desarrollado métodos para la detección de aneuploidı́as basados en la variación alélica entre la madre y el feto. Estos métodos determinan la dosis cromosómica fetal mediante el análisis de ratios alélicas de variantes genéticas, si el feto es heterocigoto para el locus detectado98. La primera demostración empleando marcadores de metilación de ADN utilizó las secuencias hipometiladas de SERPINB5, localizadas en el cromosoma 18, como dianas especı́ficas del feto99. La determinación de la ratio alélica de un polimorfismo de un único nucleótido (SNP) en el promotor hipometilado de SERPINB5 en fetos heterozigotos se conoce como ratio alélica epigenética. Con el reconocimiento de marcadores de metilación de ADN en el cromosoma 21100, esta alternativa podrı́a aplicarse para la detección prenatal no invasiva de la trisomı́a 21. Dhallan et al101 han utilizado alelos especı́ficos fetales para la detección de esta trisomı́a. Sin embargo, estos métodos sólo se pueden aplicar a ciertas poblaciones, ya que dependen de la presencia de poliformismos genéticos en loci especı́ficos. Algunos investigadores proponen la utilización de métodos universales que permitan la cuantificación digital de ADN fetal.102,103 Fan et al104 han desarrollado un método para la cuantificación digital de ADN basado en una secuenciación y mapeo del cromosoma de origen y en la enumeración de los fragmentos por cromosoma, para el diagnóstico de las trisomı́as 21, 13 y 18. Otras aplicaciones de la detección de ADN fetal en la circulación materna son la determinación del estado RhD fetal105, el diagnóstico de la acondroplasia106, la distrofia miotónica107, la betatalasemia108 o la enfermedad de Huntington109. De todas ellas, la más extendida en la actualidad es el diagnóstico no invasivo del RhD fetal en gestantes con riesgo de enfermedad hemolı́tica del recién nacido. Esto permite seleccionar embarazos que requieren una monitorización más exhaustiva, además de racionalizar la administración de la terapia anti-D, lo que requiere que el diagnóstico se realice precozmente110. Estudios recientes han obtenido una sensibilidad del 99%, con una especificidad del 99,9% para la detección de fetos D-positivos en la semana 28 de gestación, lo que significa que el diagnóstico del Rh fetal a gran escala ya es viable111,112. ARN fetal en plasma materno En el año 2000 se demostró la presencia de ARN fetal en plasma materno en gestantes con un feto varón113. Este hecho supuso el punto de partida para la detección de ácidos nucleicos en plasma materno con independencia del sexo fetal y de la existencia de polimorfismos genéticos. En la búsqueda de un marcador fetal independiente del sexo, Ng et al114 desarrollaron un método para la cuantificación de ARN en plasma que pone en evidencia la inesperada estabilidad del ARN circulante y demuestra que la placenta es una fuente importante del ARN fetal presente en la circulación materna. La detección de secuencias de ARNm especı́ficas de la placenta supone una alternativa a la cuantificación de ADN fetal para el diagnóstico de aneuploidı́as. Este método presenta la ventaja de que estas secuencias no se expresan en los tejidos maternos, por lo que son especı́ficas del feto. Lo et al115 han desarrollado un ARTICLE IN PRESS 52 método para la detección de secuencias de ARNm del gen PLAC4, localizado en el cromosoma 21 para la detección de esta aneuploidı́a. Conclusiones y perspectivas de futuro Tras muchos años de investigación, el aislamiento de células fetales en sangre materna prácticamente se ha descartado debido a su escasez, aceptada como un fenómeno biológico, que no se ha solventado eficazmente con los métodos disponibles. Se necesitan 2 cambios en el estado actual para establecer un diagnóstico prenatal basado en la obtención no invasiva de células fetales: un enriquecimiento eficaz de eritroblastos en el primer trimestre de gestación y marcadores fetales especı́ficos. El análisis puede ser optimizado por la detección automatizada al microscopio116. No obstante, estos métodos no parecen los más apropiados para procesar un gran número de muestras. El análisis del ADN y ARN fetal es una alternativa más realista en el futuro del diagnóstico prenatal no invasivo117. La relativa abundancia del ADN fetal en plasma materno facilita su detección. La principal limitación es que actualmente sólo es posible detectar secuencias que difieran del ADN genómico materno. Serán necesarios marcadores independientes del sexo, como la detección de secuencias de ARNm. Aunque aún de manera limitada, en la práctica clı́nica ya se está aplicando el aislamiento de ADN en sangre materna para el diagnóstico del sexo fetal, en parejas con riesgo de enfermedades genéticas ligadas al cromosoma X, y del Rh fetal en embarazos con riesgo de enfermedad hemolı́tica del recién nacido. La exploración de nuevas proteı́nas y tránscritos placentarios probablemente ofrezcan en un futuro nuevas oportunidades como marcadores diagnósticos de cromosomopatı́as. Cabe esperar que surjan alternativas en el campo de la posgenómica con suficiente eficacia como para sustituir los métodos actuales de cribado de cromosomopatı́as por un diagnóstico prenatal en sangre materna sin ningún riesgo para el feto. Financiación Los autores agradecen a la Obra Social y Cultural Cajastur la financiación parcial de su proyecto de investigación. Bibliografı́a 1. Lo YMD. Non-invasive prenatal diagnosis using fetal cells in maternal blood. J Clin Pathol. 1994;47:1060–5. 2. Bianchi DW. Fetal cells in the maternal circulation: feasibility for prenatal diagnosis. Br J Haematol. 1999;105:574–83. 3. Lo YMD, Corbetta N, Chamberlain PF, Rai V, Sargent IL, Redman CW, et al. Presence of fetal DNA in maternal plasma and serum. Lancet. 1997;350:485–7. 4. Schmorl G. Pathologisch-anatomische Untersuchungen über Publeraleklampsie. Leipzig: Vogel; 1893. 5. Douglas GWL, Thomas M, Carr NM, Cullen NM, Morris R. Trophoblasts in the circulating blood during pregnancy. Am J Obstet Gynecol. 1959;58:960–73. A. Fernández Fernández et al 6. Covone AE, Johnson PM, Mutton D, Adinolfi M. Trophoblast cells in peripheral blood from pregnant women. Lancet. 1984;2: 841–3. 7. Hahnemann JM, Vejerslev LO. Accuracy of cytogenetic findings on chrorionic villus sampling (CVS)-diagnostic consequences of CVS mosaicism and non-mosaic discrepancy in centres contributing to EUCROMIC 1986–1992. Prenat Diagn. 1997;17: 801–20. 8. Tjoa ML, Delli-Bevi L, Johnson KL, Bianchi DW. Antibodies to trophoblast antigens HLA-G, placenta growth factor, and neuroD2 do not improve detection of circulating trophoblast cells in maternal blood. Fetal Diagn Ther. 2007;22:85–9. 9. Walknowska J, Conte FA, Whiteacre FE. Practical and theoretical implications of fetal/maternal lymphocyte transfer. Lancet. 1969;1:1119–22. 10. Herzenberg LA, Bianchi DW, Schroder J, Cann HM, Iverson GM. Fetal cells in the blood of pregnant women: detection and enrichment by fuorescence-activated cell sorting. Proc Natl Acad Sci USA. 1979;76:1453–5. 11. Bianchi DW, Zickwolf GK, Weil GJ, Sylvester S, DeMaria MA. Male fetal progenitor cells persist in maternal blood for as long as 27 years postpartum. Proc Natl Acad Sci USA. 1996;93: 705–8. 12. Bianchi DW, Flint AF, Pizzimente MF, Knoll JHM, Latt SS. Isolation of fetal DNA from nucleated erytrocytes in maternal blood. Proc Natl Acad Sci USA. 1990;87:3279–83. 13. Thomas DB, Yoffey JM. Human fetal haemotopoiesis: the cellular composition of fetal blood. Br J Haematol. 1962;8: 290–5. 14. Bischoff FZ, Sinacori MK, Dang DD, Marquez-Do D, Horne C, Lewis DE, et al. Cell-free fetal DNA and intact fetal cells in maternal blood circulation: implications for first and second trimester non-invasive prenatal diagnosis. Hum Reprod Update. 2002;8:493–500. 15. Hamada H, Arinami T, Kubo T, Hamaguchi H, Iwasaki H. Fetal nucleated cells in maternal peripheral blood: frequency and relationship to gestational age. Hum Genet. 1993;91:427–32. 16. Al-Mufti R, Hambley H, Farzaneh F, Nicolaides KH. Fetal erythroblast in maternal blood in relation to gestational age. J Matern Fetal Neonat Med. 2003;14:392–7. 17. Hyoda M, Samura O, Fujito N, Tanigawa M, Miyoshi H, Fujiwra H, et al. No correlation between the number of fetal nucleated cells and the amount of cell-free fetal DNA in maternal circulation either before or after delivery. Prenat Diagn. 2007;27:717–21. 18. Kolialexi A, Tsangaris GT, Anagnostopoulos A, Chondros D, Bagiokos V, Kitsiou S, et al. Two-way trafficking of Annexin V positive cells between mother and fetus: determination of apoptosis at delivery. Prenat Diagn. 2007;27:348–51. 19. Takabayashi H, Kuwabara S, Ukita T, Ikawa K, Yamafuyi K, Igarashi T. Development of non-invasive fetal DNA diagnosis from maternal blood. Prenat Diagn. 1995;15:74–7. 20. Elias S, Price J, Dockter M, Wachtel SS, Tharapel A, Simpson JL, et al. First trimester diagnosis of trisomy 21 in fetal cells from maternal blood [carta]. Lancet. 1992;340:1033. 21. Troeger C, Zhong XY, Burgemeister R, Minderer S, Tercanli S, Holzgreve W, et al. Approximately half of the erythroblasts in maternal blood are of fetal origen. Mol Hum Reprod. 1999;5: 1162–5. 22. Slunga-Talberg A, El-Rifai W, Keinämen M, Kurki T, Klinger K, Ylikorkala O, et al. Maternal origin of nucleated erythrocytes in peripheral venous blood of pregnant women. Hum Genet. 1995;96:53–7. 23. Büsch J, Huber P, Pflüger E, Milteny ST, Holtz J, Radbruch A. Enrichment of fetal cells from maternal blood by high gradient magnetic cell sorting (doubling MACS) for PCR-based genetic analysis. Prenat Diagn. 1994;14:1129–40. ARTICLE IN PRESS Situación actual del diagnóstico prenatal no invasivo 24. Prieto B, Cándenas M, Venta R, Ladenson JH, Álvarez FV. Isolation of fetal nucleated red blood cells in normal and aneuploid pregnancies. Clin Chem Lab Med. 2002;40:667–72. 25. Gänshirt-Ahlert D, Pohlschmidt M, Gal A, Miny P, Horst J, Holzgreve W. Ratio of fetal to maternal DNA is less than 1 in 5000 at different gestational ages in maternal blood. Clin Genet. 1990;38:38–43. 26. Bhat NM, Bieber NM, Teng NNH. One step separation of human fetal lymphocytes from nucleated red blood cells. J Immunol Methods. 1990;131:147–52. 27. Gänshirt-Ahlert D, Burschyk M, Garritsen HSP, Helmer L, Miny P, Horst J, et al. Magnetic cell sorting and the transferrin receptor as potential means of prenatal diagnosis from maternal blood. Am J Obstet Gynecol. 1992;166:1350–5. 28. Sekizawa A, Farina A, Zhen DK, Wang JY, Falco VM, Elmes S, et al. Improvement of fetal cell recovery from maternal blood: Suitable density gradient for FACS separation. Fetal Diagn Ther. 1999;14:229–33. 29. Wang JY, Zhen DK, Falco VM, Farina A, Zheng YL, Delli-Bovi LC, et al. Fetal nucleated erythrocyte recovery: fluorescence activated cell sorting positive selection using anti-gamma globin versus magnetic activated cell sorting using anti-CD45 depletion and anti-gamma globin positive selection. Cytometry. 2000;39:224–30. 30. Oosterwijk JC, Mesker WE, Ouwerkerk CM, Knepflé CFHM, Wiesmeijer KC, Beverstock GC, et al. Fetal cell detection in maternal blood: a study in 236 samples using erythroblast morphology, DAB and HbF staining, and FISH analysis. Citometry. 1998;32:178–85. 31. Prieto B, Alonso R, Paz A, Cándenas M, Venta R, Ladenson JH, et al. Optimization of nucleated red blood cell (NRBC) recovery from maternal blood collected using both layers of a double density gradient. Prenat Diagn. 2001;21:187–93. 32. De Graaf IM, Jakobs ME, Leschot NJ, Ravkin I, Goldbard S, Hoovers JM. Enrichment, identification and analysis of fetal cells from maternal blood: evaluation of a prenatal diagnosis system. Prenat Diagn. 1999;19:648–52. 33. Choolani M, O’Donoghue K, Talbert D, Kumar S, Roberts I, Letsky E, et al. Characterization of first trimester fetal erythroblasts for non-invasive prenatal diagnosis. Mol Hum Reprod. 2003;9:227–35. 34. Milteny S, Müller W, Weichel W, Radbrunch A. High gradient magnetic cell separation with MACS. Cytometry. 1990;11: 231–8. 35. Sekizawa A, Taguchi A, Watanabe A, Kimura T, Saito H, Yanahaira T, et al. Analysis of HLA-DQ alpha sequences for prenatal diagnosis in single fetal cells from maternal blood. Hum Genet. 1998;102:393–6. 36. Wachtel SS, Sammons D, Manley M, Watchel G, Twitty G, Utermohlen, et al. Fetal cells in maternal blood: recovery by charge flow separation. Hum Genet. 1996;98:162–6. 37. Bianchi DW, Klinger KW, Vadnais TJ, DeMaria MA, Shuber AP, Skoletsky J, et al. Development of a model system to compare cell separation methods for the isolation of fetal cells from maternal blood. Prenat Diagn. 1996;16:289–98. 38. Martin B, Bruce J, Smith N, Liu D, Durrant L. A magnetic colloid system for isolation of rare cells from blood for FISH analysis. Prenat Diagn. 1997;17:1059–66. 39. Hall JM, Adams S, Williams S, Rhese MA, Layton TJ, Molesh DA. Purification of fetal cells from maternal blood using an avidinbiotin immnoaffinity column. Ann N Y Acad Sci. 1994;731: 115–27. 40. Wachtel SS, Elias S, Price J, Wachtel G, Phillips O, Shulman L, et al. Fetal cells in maternal circulation: isolation by multiparameter flow citometry and confirmation by PCR. Hum Reprod. 1991;6:1466–9. 41. Álvarez FV, Olander J, Crimmins D, Prieto B, Paz A, Ladenson JH, et al. Development, characterization and use of mono- 53 42. 43. 44. 45. 46. 47. 48. 49. 50. 51. 52. 53. 54. 55. 56. 57. 58. clonal antibodies made to antigens expressed on the surface of fetal nucleated red blood cells. Clin Chem. 1999;45:1614–20. Prieto B, Cándenas M, Ladenson JH, Álvarez FV. Comparison of different CD71 monoclonal antibodies for enrichment of fetal cells from maternal blood. Clin Chem Lab Med. 2002;40: 126–31. Simpson JL, Lewis DE, Bischoff FZ, Elias S. Isolating fetal nucleated red blood cells from maternal blood: The Baylor experience-1995. Prenat Diagn. 1995;15:907–12. Park VM, Bravo RR, Price JO, Simpson JL, Elias S. A model system using fetal haemoglobin to distinguish fetal cells enriched from maternal blood. Ann N Y Acad Sci. 1994;731: 133–5. Zheng YL, Zhen DK, Farina A, Berry SM, Wapner RJ, Williams JM, et al. Fetal cell identifiers: Results of microscope slidebased immunocytochemical studies as a function of gestational age and abnormality. Am J Obstet Gynecol. 1999;180:1234–9. Babochkina T, Mergenthaler S, Lapaire O, Kiefer V, Yura H, Koike K, et al. Evaluation of a soybean lectin-based method for the enrichment of erythroblasts. J Histochem Cytochem. 2005;53:329–30. Bianchi DW, Williams JM, Sullivan LM, Hanson FW, Klinger KW, Shuber AP. PCR quantitation of fetal cells in maternal blood in normal and aneuploid pregnancies. Am J Hum Genet. 1997;61: 822–9. Parano E, Falcidia E, Grillo A, Pavone P, Cutuli N, Takabayashi H, et al. Noninvasive prenatal diagnosis of chromosomal aneuploidies by isolation and analysis of fetal cells from maternal blood. Am J Med Genet. 2001;101:262–7. Bianchi DW, Mahr A, Zickwolf GK, Housel TW, Flint A, Klinger KW. Detection of fetal cells with 47, XY,+21 karyotype in maternal peripheral blood. Hum Genet. 1992;90:368–70. Zheng DK, Wang JY, Falco VM, Weber W, Delli-Bovi L, Bianchi DW. Poly-FISH: a technique of repeat hybridization that improves cytogenetic analysis of fetal cells in maternal blood. Prenat Diagn. 1998;18:1181–3. Krabchi K, Gadji M, Samassekou O, Grégoire MC, Forest JC, Drovin R. Quantification of fetal nucleated cells in maternal blood of pregnant women with a male trisomy 21 fetus using molecular cytogenetic techniques. Prenat Diagn. 2006;26: 28–34. Lo YMD, Morey AL, Wainscoat JS, Fleming KA. Culture of fetal erythroid cells from maternal peripheral blood. Lancet. 1994; 344:264–5. Valerio D, Aiello R, Altieri V, Malato AP, Fortunato A, Canazio A. Culture of fetal erythroid progenitors cells from maternal blood for non-invasive prenatal diagnosis. Prenat Diagn. 1996;16:1073–82. Chen H, Griffin DK, Jestice K, Hackett G, Cooper J, FerfusonSmith MA. Evaluating the cultured of fetal erythroblasts from maternal blood for non-invasive prenatal diagnosis. Prenat Diagn. 1998;18:883–92. Zimmermann B, Holzgreve W, Zhong Y, Hahn S. Inability to clonally expand fetal progenitors from maternal blood. Fetal Diagn Ther. 2002;17:97–100. Cha DH, Khrosrotehrani K, Bianchi DW, Johson KL. The utility of an erythroblast scoring system and gender-independent short tandem repeat (STR) analysis for the detection of aneuploidid fetal cells in maternal blood. Prenat Diagn. 2005;25:586–91. Bischoff FZ, Lewis DE, Nguyen DD, Murrell S, Schober W, Scott J, et al. Prenatal diagnosis with use of fetal cells isolated from maternal blood: five-color fluorescent in situ hybridization analysis on flow-sorted cells for chromosomes X, Y, 13, 18, and 21. Am J Obstet Gynecol. 1998;179:203–9. Mavrou A, Kouvidi E, Antsklis A, Souka A, Kitsiou Tzeli S, Kolialexi A. Identification of nucleated red blood cells in maternal circulation: a second step in screening for fetal ARTICLE IN PRESS 54 59. 60. 61. 62. 63. 64. 65. 66. 67. 68. 69. 70. 71. 72. 73. 74. 75. 76. 77. A. Fernández Fernández et al aneuploidies and pregnancy complications. Prenat Diagn. 2007;27:150–3. Sekizawa A, Watanabe A, Kimura T, Saito H, Yanaihara T, Sato T. Prenatal diagnosis of fetal RhD blood type using a single fetal nucleated erytrhrocyte from maternal blood. Obstet Gynecol. 1996;81:501–5. Sekizawa A, Kimura T, Sasaki M, Nakamura S, Kabayashi R, Sato T. Prenatal diagnosis of Duchenne muscular dystrophy using a single fetal nucleated erythrocyte in maternal blood. Neurology. 1996;46:1350–3. D’Souza E, Kulkarni S, Colah RB, Mohanty D. An improved flow cytometric approach for isolation of fetal cells from maternal blood for non invasive prenatal diagnosis of hemoglobinopathies. Hemoglobin. 2007;31:39–48. Holzgreve W, Hahn S. Prenatal diagnosis using fetal cells and free DNA in maternal blood. Clin Perinatol. 2001;28:353–65. Zhong XY, Seiborn A, Sohn C, Holzgreve W, Hahn S. High levels of circulatory erythroblast and cell-free DNA prior to intrauterine fetal death. Prenat Diagn. 2006;26:1272–3. Falcidia E, Parano E, Grillo A, Pavone P, Takabayashi H, Trifiletti RR, et al. Fetal cells in maternal blood: a six-fold increases in women who have undergone amniocentesis and carry a fetus with Down syndrome a multicenter study. Neuropediatrics. 2004;35:321–4. Bianchi DW, Simpson JL, Jackson LG, Elias S, Holzgreve W, Evans MI, et al. Fetal gender and aneuploidy detection using fetal cells in maternal blood: analysis of NIFTY I data. Prenat Diagn. 2002;22:609–15. Simchem MJ, Barkai G, Lusky A, Guetta E. Fetal hemoglobinexpressing nucleated red blood cell frequencies in pregnancies with intrauterine growth restriction. Prenat Diagn. 2001;21: 31–5. Al-Mufti R, Lees C, Albaiges G, Hambley H, Nicolaides KH. Fetal cells in maternal blood of pregnancies with severe fetal growth restriction. Hum Reprod. 2000;15:218–21. Ganshirt D, Borjesson-Stoll R, Burschyk M, Garritsen HS, Neusser M, Smeets FW, et al. Successuful prenatal diagnosis from maternal blood with magnetic-activated cell sorting. Ann N Y Acad Sci. 1994;731:103–14. Holzgreve W, Ghezzi F, Di Naro E, Ganshirt D, Maymon E, Hahn S. Disturbed fetal-maternal cell traffic in preeclampsia. Obstet Gynecol. 1998;91:669–72. Roberts JM, Redman CWG. Pre-eclampsia: more than pregnancy-induced hypertension. Lancet. 1993;341:1447–51. Dekker GA, Sibai BM. Etiology and pathogenesis of preeclampsia: current concepts. Am J Obstet Gynecol. 1998;179: 1359–75. Holzgreve W, Li JJ, Steinborn A, Kulz T, Sohn C, Hodel M, et al. Elevation in erythroblast count in maternal blood before the onset of preeclampsia. Am J Obstet Gynecol. 2001;184:165–8. Fernández A, Prieto B, Escudero A, Ladenson JH, Álvarez FV. A monoclonal antibody with potential for aiding non-invasive prenatal diagnosis: utility in screening of pregnant women at risk of preeclampsia. J Histochem Cytochem. 2005;53:345–50. Rijnders RJ, Van der Luijt RB, Peters ED, Goeree JK, Van der Schoot CE, Ploos Van Amstel JK, et al. Earliest gestational age for fetal sexing in cell-free maternal plasma DNA. Prenat Diagn. 2003;23:1042–4. Botezatu I, Serdyuk O, Potapova G, Shelepov V, Alechina R, Molyata Y, et al. Genetic analysis of DNA excreted in urine: a new approach for detecting specific genomic DNA sequences from cells dying in a organism. Clin Chem. 2000;46:1078–84. Illanes S, Denbow ML, Smith RP, Overton TG, Soothill PW, Finning K. Detection of cell-free fetal DNA in maternal urine. Prenat Diagn. 2006;26:1216–8. Chan KCA, Zhang J, Hui AB, Wong N, Lau TK, Leung TN. Size distributions of maternal and fetal DNA in maternal plasma. Clin Chem. 2004;50:88–92. 78. Lo YM. Fetal DNA in maternal plasma. Ann N Y Acad Sci. 2000;906:141–7. 79. Lo YM. Recent advances in fetal nucleic acids in maternal plasma. J Histochem Cytochem. 2005;53:293–6. 80. Bischoff FZ, Dang D, Horne C, Márquez-Do D, Brinkley WR, Lewis DE, et al. Fetal DNA in maternal plasma circulated as apoptotic bodies: elucidation of the structural nature of fetal DNA for non-invasive diagnosis. Am J Hum Genet. 2003; 73(Suppl):189. 81. Bianchi DW, LeShane ES, Cowan JM. Large amounts of cell-free fetal DNA are present in amniotic fluid. Clin Chem. 2001;47:1867–9. 82. Angert RM, LeShane ES, Yarnell RW, Johnson KL, Bianchi DW. Cell-free fetal DNA in the cerebrospinal fluid of peripartum women. Am J Obstet Gynecol. 2004;190:1087–90. 83. Cioni R, Bussani C, Scarselli B, Mello G, Mecacci F, Scarselli G. Detection of fetal DNA in the peritoneal cavity during pregnancy. Eur J Obstet Gynecol Reprod Biol. 2003;107:210–1. 84. Johnson KL, Dukes KA, Vidaver J, LeShane ES, Ramı́rez I, Weber WD, et al. Interlaboratory comparison of fetal male DNA detection from common maternal plasma samples by real-time PCR. Clin Chem. 2004;50:516–21. 85. Pertl B, Sekizawa A, Samura O, Orescovic I, Rahaim PT, Bianchi DW. Detection of male and female fetal DNA in maternal plasma By multiplex fluorescent polymerase chain reaction amplification of short tandem repeats. Hum Genet. 2000;106:45–9. 86. Poon LL, Leung TN, Lau TK, Chow KCK, Lo YM. Differential DNA methylation between fetus and mother as astrategy for detecting fetal DNA in maternal plasma. Clin Chem. 2002; 48:35–41. 87. Ng EKO, Tsui TK, Leung TN, Chiu RWK, Panesar NS, Lit LCW, et al. mRNA or placental origin readily detectable in maternal plasma. Proc Natl Acad Sci USA. 2003;100:4748–53. 88. Hahn S, Chitty LS. Noninvasive prenatal diagnosis: current practice and future perspectives. Curr Opin Obstet Gynecol. 2008;20:146–51. 89. Lo YMD, Tein MSC, Lau TK, Haines CJ, Leung TN, Poon PMK, et al. Quantitative analysis of fetal DNA in maternal plasma and serum: implications for non-invasive prenatal diagnosis. Am J Hum Genet. 1998;62:768–75. 90. Finning KM, Chitty LS. Non-invasive fetal sex determination: Impact on clinical practice. Semin Fetal Neonatal Med. 2008;13:69–75. 91. Farina A, LeShane ES, Lambert-Messerlian GM, Canick JA, Lee T, Neveux LM, et al. Evaluation of cell-free fetal DNA as a second-trimester maternal serum marker of Down syndrome pregnancy. Clin Chem. 2003;49:239–42. 92. Sekizawa A, Sugito Y, Iwasaki M, Watanabe A, Jimbo M, Hoshi S, et al. Cell-free fetal DNA is increased in plasma of women with hyperemesis gravidarum. Clin Chem. 2001;47: 2164–5. 93. Sekizawa A, Jimbo M, Saito H, Iwasaki M, Sugito Y, Yukimoto Y, et al. Increased cell-free fetal DNA in plasma of two women with invasive placenta. Clin Chem. 2002;48:353–4. 94. Farina A, Sekizawa A, Iwaski M, Matsouka R, Ichizuka KS, Okar T. Fetal cell-free DNA (beta-globin gene) distribution in maternal plasma at the second trimester: a new propective for preeclampsia screening. Prenat Diag. 2004;24:722–6. 95. Zhong XY, Holzgreve W, Hahn S. The levels of circulatory cell free DNA in maternal plasma are elevated prior to the onset of preeclampsia. Clin Chem. 2001;47:137–9. 96. Rijnders RJP, Van der Schoot E, Bossers B, De Vroede MAMJ, Christiaens GCML. Fetal sex determination from maternal plasma in pregnancies at risk for congenital adrenal hyperplasia. Obstet Gynecol. 2001;98:374–8. 97. Zimmermann B, El Sheikhan A, Nicolaides K, Holzgreve W, Hahn S. Optimized real-time quantitative PCR measurement of ARTICLE IN PRESS Situación actual del diagnóstico prenatal no invasivo 98. 99. 100. 101. 102. 103. 104. 105. 106. 107. male fetal DNA in maternal plasma. Clin Chem. 2005;51: 1598–604. Lo YMD, Chiu RWK. Noninvasive prenatal diagnosis of fetal chromosomal aneuploidies by maternal plasma nucleic acid analysis. Clin Chem. 2008;54:461–6. Chim SSC, Tong YK, Chiu RWK, Lau TK, Leung TN, Chan LYS, et al. Detection of the placental epigenetic signature of the maspin gene in maternal plasma. Proc Natl Acad Sci USA. 2005;102:14753–8. Chim SSC, Jin S, Lee TYH, Lun FMF, Lee WS, Chan LYS, et al. Systematic search for placental DNA-methylation markers on chromosome 21: toward a maternal plasma-based epigenetic test for fetal trisomy 21. Clin Chem. 2008;54:500–11. Dhallan R, Guo X, Emche S, Damewood P, Cronin M, Barry J, et al. A non-invasive test for prenatal diagnosis based on fetal DNA present in maternal blood: a preliminary study. Lancet. 2007;369:474–81. Fan HC, Quake SR. Detection of aneuploidy with digital polymerase chain reaction. Anal Chem. 2007;79:7576–9. Lo YM, Lun FM, Chan KC, Tsui NB, Chong KC, Lau TK, et al. Digital PCR for the molecular detection of fetal chromosomal aneuploidy. Proc Natl Acad Sci USA. 2007;104:13116–21. Fan HC, Blumenfeld YJ, Hudgins L, Quake SR. Noninvasive diagnosis of fetal aneuploidy by shotgun sequencing DNA from maternal blood. Proc Natl Acad Sci USA. 2008;105: 16266–71. Turner MJ, Martin CM, O’Leary JJ. Detection of fetal Rhesus D gene in whole blood of women booking for routine antenatal care. Eur J Obstet Gynecol Reprod Biol. 2003;108: 29–32. Saito H, Sekizawa A, Morindo T, Suzuki M, Yanaihara T. Prenatal DNA diagnosis of a single-gene disorder from maternal plasma. Lancet. 2000;356:1170. Amicucci P, Gennarelli M, Novelli G, Dallapiccola B. Prenatal diagnosis of myotonic dystrophy using fetal DNA obtained from maternal plasma. Clin Chem. 2000;46:301–2. 55 108. Chiu RW, Lau TK, Leung TN, Chow KC, Chui DH, Lo YM. Prenatal exclusion of beta talasemina major by examination of maternal plasma. Lancet. 2002;360:998–1000. 109. González-González MC, Trujillo MJ, Rodrı́guez de Alba M, Garcı́a-Hoyos M, Lorda-Sánchez I, Dı́az-Recasens, et al. Huntington disease-unaffected fetus diagnosed from maternal plasma using QF-PCR. Prenat Diagn. 2003;23:232–4. 110. Van der Schoot CE, Hahn S, Chitty LS. Non-invasive prenatal diagnosis and determination of fetal Rh status. Semin Fetal Neonatal Med. 2008;13:63–8. 111. Van der Schoot CE, Soussan AA, Dee R, Bonsel GJ, De Haas M. Screening for foetal RhD-genotype by plasma PCR in all D negative pregnant women is feasible. Vox Sang. 2004; 87(Suppl):9. 112. Finning K, Martin P, Summers J, Massey E, Poole G, Daniels G. Effect of high throughput RHD typing of fetal DNA in maternal plasma on use of anti-RhD immunoglobulin in RhD negative pregnant women: prospective feasibility study. BMJ. 2008; 336:816–8. 113. Poon LL. Presence of fetal RNA in maternal plasma. Clin Chem. 2000;46:1832–4. 114. Ng EK, Leung TN, Tsui NB, Lau TK, Panesar NS, Chiu RW, et al. The concentration of circulating corticotropin-releasing hormone mRNA in maternal plasma is increased in preeclampsia. Clin Chem. 2003;49:727–31. 115. Lo YM, Tsui NB, Chiu RW, Lau TK, Leung TN, Heung MM, et al. Plasma placental RNA allelic ratio permits noninvasive prenatal chromosomal aneuploidy detection. Nat Med. 2007; 13:218–23. 116. Chitty LS, Van der Schoot CE, Hahn S, Avent ND. SAFE—The Special Non-invasive Advances in Fetal and Neonatal Evaluation Network: aims and achievements. Prenat Diagn. 2008; 28:83–8. 117. Hahn S, Zhong XY, Holzgreve W. Recent progress in noninvasive prenatal diagnosis. Semin Fetal Neonatal Med. 2008; 13:57–62. ARTICLE IN PRESS Rev Lab Clin. 2009;2(1):56–58 Revista del Laboratorio Clínico www.elsevier.es/LabClin DOCUMENTO Armonización de resultados de HbA1c en España Harmonization of the results of HbA1c in Spain R. Gobernaa,, M. Aguilar-Diosdadob, K. Santos-Reya y J. Mateoa a Servicio de Bioquı́mica Clı́nica, Hospital Universitario Virgen Macarena, Sevilla, España Servicio de Endocrinologı́a y Nutrición, Hospital Universitario Puerta del Mar, Cádiz, España b Recibido el 24 de noviembre de 2008; aceptado el 25 de noviembre de 2008 En septiembre de 2007 se publicó un documento de consenso1,2 por parte de la American Diabetes Association (ADA), la International Diabetes Federation (IDF), la European Association for the Study of Diabetes (EASD) y la International Federation of Clinical Chemistry (IFCC), donde se recogen los distintos puntos de acuerdo acerca de la estandarización global y la emisión de resultados analı́ticos de hemoglobina glucosilada (HbA1c). Entre otras medidas, se acordó utilizar el método propuesto por la IFCC para calibrar las distintas técnicas de determinación de HbA1c3, ası́ como emitir los resultados de HbA1c en unidades trazables al ensayo DCCT (NGSP, %) y en unidades IFCC (mmol/mol). Con este antecedente, la Sociedad Española de Diabetes (SED) y la Sociedad Española de Bioquı́mica Clı́nica y Patologı́a Molecular (SEQC) tomaron la iniciativa de organizar un simposio que permitiese, junto con las firmas de diagnóstico in vitro, recomendar una serie de actuaciones que fuesen elevadas posteriormente a la Comisión de Estrategias en Diabetes del Sistema Nacional de Salud del Ministerio de Sanidad y Consumo, a las Consejerı́as de Sanidad de las Comunidades Autónomas y a las Juntas Directivas de las Sociedades Cientı́ficas, las revistas especializadas, etc., con el fin de que los acuerdos tuvieran la máxima difusión posible. Dicho simposio se celebró en Sevilla los dı́as 6 y 7 de noviembre de 2008 y contó con representantes de las principales instituciones y sociedades Autor para correspondencia. Correo electrónico: raimundo.goberna.sspa@juntadeandalucia. es (R. Goberna). cientı́ficas nacionales para el estudio de la diabetes (tabla 1). Se trata de la segunda estrategia a escala europea para la armonización de resultados de HbA1c, sólo precedida por la llevada a cabo en el Reino Unido en enero de 20084 en la que se proponen recomendaciones similares a las del presente documento. Otros paı́ses europeos celebrarán reuniones con el mismo fin en los próximos meses. En el año 2002, el 70% de los resultados de HbA1c emitidos en nuestro paı́s se expresaba en unidades JDS/JSCC (Japón) y el 30% en unidades DCCT/NGSP (Estados Unidos). El número de sistemas que emiten resultados en unidades NGSP ha ido aumentando progresivamente, con una cifra algo superior al 50% en la actualidad, en detrimento del número de informes emitidos en unidades JDS/JSCC5. Las principales guı́as clı́nicas para el control del paciente diabético basan sus recomendaciones en los resultados obtenidos de los ensayos DCCT y UKPDS6,7, por lo que es importante utilizar unidades que sean comparables a estos estudios y, por consiguiente, a estas guı́as clı́nicas. Además, experiencias como la de Estados Unidos nos muestran que es posible llegar a una armonización global de resultados en un plazo inferior a 3 años, de manera que la mayorı́a de los laboratorios emitan los resultados en unidades DCCT/NGSP con una imprecisión inferior al 4%8. Debido a que todos los sistemas de armonización de resultados (JDS/JSCC, Mono-S, NGSP) han demostrado su trazabilidad y estabilidad respecto al método de referencia de la IFCC, la conversión a unidades DCCT/NGSP (%) se realizará mediante las ecuaciones que relacionan los distintos sistemas entre sı́9. Además, siguiendo el consenso 1888-4008/$ - see front matter & 2008 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. doi:10.1016/j.labcli.2008.11.002 ARTICLE IN PRESS Armonización de resultados de HbA1c en España Tabla 1 Instituciones y sociedades cientı́ficas representadas en la reunión de Sevilla Estrategia en Diabetes del Sistema Nacional de Salud (Ministerio de Sanidad y Consumo) Sociedad Española de Diabetes Sociedad Española de Bioquı́mica Clı́nica y Patologı́a Molecular Sociedad Española de Medicina Familiar y Comunitaria Asociación Española de Biopatologı́a Médica Asociación Española de Farmacéuticos Analistas Plan Integral de Diabetes de Andalucı́a (Consejerı́a de Salud, Junta de Andalucı́a) Sociedad Andaluza de Análisis Clı́nicos Sociedad Andaluza de Bioquı́mica Clı́nica Asociación de Analistas Clı́nicos de Extremadura 57 (12-24 meses) tanto en unidades JDS/JSCC (%) como en unidades NGSP/DCCT (%). 7. Las sociedades que suscriban este documento se comprometerán a realizar programas de formación y difusión a sus miembros. 8. La inclusión de la glucosa media estimada (eAG)10 junto con la glucemia y la HbA1c en los informes sobre el estado glucémico no dispone de una evidencia cientı́fica suficiente que permita su utilización en la clı́nica. Se requiere una mayor investigación en todos los grupos de pacientes diabéticos, incluidos pacientes pediátricos, personas de edad avanzada, embarazadas y diversos grupos étnicos, para determinar el papel real que podrı́a desempeñar en la práctica clı́nica.11 Anexo 1 internacional, se acuerda emitir los resultados en unidades DCCT/NGSP (%) y unidades IFCC (mmol/mol). En cuanto a la inclusión de la glucosa media estimada (eAG) en los informes de control del paciente diabético, se recomienda que, a pesar de su posible potencial para ayudar a los pacientes a mejorar la comprensión de su enfermedad, es necesario completar los resultados del estudio ADAG10 con los de otros estudios que incluyan población pediátrica, personas de edad avanzada, gestantes y otras etnias además de la caucásica, para determinar ası́ su utilidad en la práctica clı́nica. El borrador del documento fue elaborado por el Comité Organizador del simposio y remitido a las distintas instituciones y sociedades cientı́ficas participantes, ası́ como a las firmas de diagnóstico in vitro. Se recibieron observaciones al respecto durante los meses de septiembre y octubre, hasta conseguir un texto consensuado que fue presentado en Sevilla el dı́a 7 de noviembre de 2008. Los puntos consensuados fueron los siguientes: 1. Los laboratorios deberán utilizar métodos trazables al método de referencia de la IFCC3. 2. Siguiendo las recomendaciones internacionales, se acuerda emitir los resultados de HbA1c en dos tipos de unidades de manera simultanea en todos los informes de laboratorio: Unidades NGSP/DCCT (%) (con 1 decimal) y IFCC (mmol/ mol) (sin decimales) 3. Las publicaciones y las guı́as clı́nicas elaboradas a partir de la fecha del acuerdo incluirán las dos unidades en sus textos. 4. El paso a unidades DCCT/NGSP (%) se realizará mediante las distintas ecuaciones de conversión9, utilizando los sistemas informáticos propios de cada laboratorio. (Véase anexo 1) 5. Los métodos utilizados deberán tener una imprecisión (coeficiente de variación) inferior al 4%, aunque el objetivo final deberı́a ser conseguir una imprecisión inferior al 2%. 6. En situaciones transitorias, como es el caso de la utilización actual JDS/JSCC (%), se recomienda informar, si se considera necesario, durante un perı́odo transitorio a Si se trabaja con calibración JDS/JSCC (Japón): NGSP (%) = 0,985 × JDS/JSCC (%) + 0,46 b Si se trabaja con calibración Mono-Sweden (Suecia): NGSP (%) = 0,923 × Mono-Sweden (%) + 1,34 c Si se trabaja con calibración IFCC (%): NGSP (%) = 0,915 × IFCC (%) + 2,15 d Para calcular el equivalente en unidades IFCC (mmol/mol) , partiendo de unidades NGSP/DCCT) (%)11 : IFCC (mmol/mol) = (NGSP [%] – 2,15/0,915) ×10 Acciones dentro del Proyecto de Excelencia 2005/CTS-572 de la Consejería de Innovación, Ciencia y Empresa de la Junta de Andalucía. Bibliografı́a 1. Consensus Commitee of The American Diabetes Association, European Association for the Study of Diabetes, International Federation of Clinical Chemistry and Laboratory Medicine, and the International Diabetes Federation. Consensus statement on the worldwide standardization of the HbA1c measurement. Diabetes Care. 2007;30:2399–400. 2. Consensus Commitee of The American Diabetes Association, European Association for the Study of Diabetes, International Federation of Clinical Chemistry and Laboratory Medicine, and the International Diabetes Federation. Consensus statement on the worldwide standarization of the HbA1c measurement. Diabetologia. 2007;50:2042–3. 3. Jeppsson JO, Kobold U, Barr J, Finke A, Hoelzel W, Hoshino T, et al. International Federation of Clinical Chemistry and Laboratory Medicine (IFCC). Approved IFCC reference method for the measurement of HbA1c in human blood. Clin Chem Lab Med. 2002;40:78–89. 4. Barth JH, Marshall SM, Watson ID. Consensus meeting on reporting glycated haemoglobin and estimated average glucose ARTICLE IN PRESS 58 in the UK: report to the National Director of Diabetes, Department of Health. Ann Clin Biochem. 2008;45:343–4. 5. Ramón F, Perich C. Ponencia en el Simposio ‘‘Estrategia de consenso para la armonización de resultados de HbA1c’’. Sevilla, 6 de noviembre de 2008. 6. The Diabetes Control and Complications Trial Research Group. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulindependent diabetes mellitus. N Engl J Med. 1993;329:977–86. 7. UKPDS. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). UK Prospective Diabetes Study (UKPDS) Group. Lancet. 1998;352:837–53. R. Goberna et al 8. CAP Survey Data (5/08). Disponible en: www.ngsp.org/prog/ CAP/CAP08a.pdf. 9. Hoelzel W, Weycamp C, Jeppson JO, Miedema K, Barr JR, Goodall I, et al. IFCC reference system for measurement of hemoglobin A1c in human blood and the National Standarization Schemes in the United States, Japan and Sweden: a methodcomparison study. Clin Chem. 2004;50:166–74. 10. Nathan DM, Kuenen J, Borg R, Zheng H, Schoenfeld D, Heine RJ. Translating the A1c assay into estimated average glucose values. Diabetes Care. 2008;31:1473–8. 11. Nordin G, Dybkaer R. Recommendation for term and measurement unit for ‘‘HbA1c’’. Clin Chem Lab Med. 2007;45: 1081–2. ARTICLE IN PRESS Rev Lab Clin. 2009;2(1):59–60 Revista del Laboratorio Clínico www.elsevier.es/LabClin CARTA AL DIRECTOR Acidosis metabólica grave por intoxicación con etilenglicol Severe metabolic acidosis due to ethylene glycol poisoning Sr. Director: El etilenglicol es un alcohol incoloro, inodoro y no volátil de amplio uso industrial como anticongelante y disolvente. La intoxicación por etilenglicol, aunque poco frecuente, tiene una elevada morbimortalidad si se demora la actuación. El diagnóstico se realiza por la sospecha clı́nica y la interpretación analı́tica. Los valores tóxicos en sangre son 0,5 g/l y los letales, 2 g/l1. Varón de 67 años, alcohólico crónico, que acude al servicio de urgencias traı́do por los familiares por un cuadro de bajo nivel de conciencia. Al ingreso presentaba una presión arterial de 170/95 mmHg; frecuencia cardı́aca, 59 lat/min; SaO2, 99%; estaba afebril. A la exploración fı́sica estaba consciente sin conexión con el medio, fluctuando entre agitación leve y arreactividad total. Pupilas normorreactivas. No habı́a hedor enólico. No habı́a datos de mala perfusión. En las exploraciones complementarias destacaban un hemograma normal y glucosa, urea y creatinina dentro de los valores de referencia. Na: 148 mmol/l; K: 5,3 mmol/l; Cl: 110 mmol/l. Gasometrı́a arterial: pH 7,24; PCO2: 24 mmHg; PO2: 260 mmHg; HCO3: 10,3 mmol/l; BE: 15 mmol/l; pO2(A-a): 67 mmHg; Anión gap, 27,7 mmol/l; osmolaridad medida: 333 mOsm/kg de H2O; osmolaridad Tabla 1 calculada: 311 mOsm/kg: Gap osmolar: 22 mOsm/kg; lactato: 19,9 mmol/l. En el sedimento de orina se observaron escasos cristales de oxalato cálcico. La tomografı́a computarizada craneal y abdominal no mostró hallazgos. Se lo trasladó a unidad de cuidados intensivos, donde se lo intubó por el bajo nivel de conciencia y se aplicaron medidas de soporte. Se inició tratamiento con bicarbonato sódico, anexato y etanol, por sospecha de intoxicación. Además, recibió tratamiento adyuvante con piridoxina, tiamina y ácido fólico. Ante la persistencia de la acidosis metabólica grave y el deterioro progresivo de la función renal, se comenzó sesión de hemodiálisis. El paciente mejoró el nivel de conciencia y el cuadro metabólico. Al ser extubado, refirió haber ingerido etilenglicol con intención suicida, lo que se confirmó posteriormente por determinarse concentración de etilenglicol en sangre en 1,2 g/l. La determinación de etilenglicol se realizó por cromatografı́a de gases en un hospital de otra población. Al cuarto dı́a del ingreso, se trasladó al paciente al servicio de nefrologı́a en anuria, para continuar tratamiento. La evolución posterior fue favorable, y se le dio el alta con función renal normal (tabla 1). También presentaba paresia del sexto par craneal, que remitió totalmente al momento del alta. El etilenglicol se metaboliza en el hı́gado por acción de la enzima alcohol deshidrogenasa. Sus productos metabólicos: ácido glicólico y oxálico, son la causa de la toxicidad. La existencia de acidosis metabólica en un paciente alcohólico obliga a determinar el Anión gap para orientar la etiologı́a del trastorno2. Evolución de los parámetros analı́ticos desde el ingreso hasta el alta Prueba analı́tica Al ingreso Dı́a 1 Dı́a 3 Dı́a 5 Dı́a 7 Dı́a 10 Alta Glucemia (mg/dl) Creatinina (mg/dl) Sodio (mmol/l) Potasio (mmol/l) PH pCO2 (mmHg) HCO3 (mmol/l) pO2 (mmHg) EB (mmol/l) 109 0,8 148 5,3 7,22 17,9 7,2 157 18,1 194 1,5 144 2,9 7,35 19 10,5 190 12,9 98 3,4 135 4,8 7,41 45 28,5 36 3,1 119 6,5 134 4,2 7,45 43 29,9 34 5,4 157 6,2 133 3,7 7,39 45 27,2 41 1,8 83 6,1 133 3,8 7,39 45,9 27,2 29,8 1,7 79 4,8 138 3,5 7,41 42 26,6 48 1,7 1888-4008/$ - see front matter & 2008 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. doi:10.1016/j.labcli.2008.10.005 ARTICLE IN PRESS 60 En las acidosis metabólica con Anión gap elevado y sospecha de una intoxicación, la determinación del Gap osmolar ayuda a detectar la presencia de solutos anormales en la sangre. Un Gap osmolar elevado indica la presencia de una sustancia anormal en la sangre, como ocurre en las intoxicaciones por etilenglicol o metanol3,4. El etanol se utiliza como tratamiento porque también es metabolizado por la enzima alcohol deshidrogenasa con mucha más afinidad que el etilenglicol, por lo que se produce inhibición competitiva. También se podrı́a usar como tratamiento el fomepizol, inhibidor de la enzima alcohol deshidrogenasa; en nuestro caso no se usó por no disponer de ella en nuestro hospital. La tiamina y la piridoxina fomentan la degradación del ácido glioxı́lico a glicina. La hemodiálisis está indicada si hay acidosis grave, insuficiencia renal o elevada concentración del tóxico en sangre5. En las intoxicaciones por etilenglicol, el diagnóstico temprano y el tratamiento oportuno incrementan de forma significativa la supervivencia. Queremos destacar el papel fundamental del laboratorio de urgencias en la orientación diagnóstica. Carta al Director Bibliografı́a 1. Sant LM. Tratamiento de las intoxicaciones por metanol y etilenglicol. Med Intensiva. 2002;26:248. 2. Argelich R, Nogué-Xarau S, Castro P. Acidosis láctica grave por déficit de tiamina. Med Clin (Barc). 2008;130:678. 3. Rose BD, Post TW. Trastornos de los electrolitos y del equilibrio ácido-base. 5.a ed. Madrid: Marbán; 2002. 4. Shapiro BA, Peruzzi WT, Kozlowski-Templin R. Manejo clı́nico de los gases sanguı́neos. 5.a ed. Buenos Aires: Panamericana; 1994. 5. Sant LM. Indicaciones de la hemodiálisis, el etanol y el fomepizol en las intoxicaciones agudas por metanol y etilenglicol. Rev Toxicol. 2005;22:85. Ma. Cristina Sanz-Aránguez Felipe, Marı́a Rey Múgica Servicio de Análisis Clı́nicos, Hospital General de Segovia, Segovia, España Autor para correspondencia. Correo electrónico: cristisg@ole.com (Ma.C. Sanz-Aránguez Felipe) ARTICLE IN PRESS Rev Lab Clin. 2009;2(1):61 Revista del Laboratorio Clínico www.elsevier.es/LabClin FE DE ERRORES Fe de errores de ‘‘Sı́ndrome hemofagocı́ticio: un caso’’ Begoña Basauri Elorza Servicio de Bioquı́mica, Hospital de Cruces, Bilbao, España En el artı́culo ‘‘Sı́ndrome hemofagocı́tico: un caso’’ (Rev Lab Clin. 2008;1[2]:68–70), de Begoña Basauri Elorza, Mercedes Regúlez Uranga, Raquel Pérez Garay, Izaskun Rubio Ollo, Cristina Prieto Valtuille y A. López-Urrutia Fernández, se ha producido un error. En la página 70, en el pie de la tabla 1, las siglas LDH se corresponden en realidad con lácticodeshidrogenasa, no con lipoproteı́na de alta densidad, tal como figuraba en el artı́culo. DOI of original article: 10.1016/j.labcli.2008.06.001 Correo electrónico: MARIABEGONA.BASAURIELORZA@osakidetza.net (B. Basauri Elorza). 1888-4008/$ - see front matter & 2008 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. doi:10.1016/j.labcli.2008.12.001