TEORÍA (33 % de la nota)
Anuncio

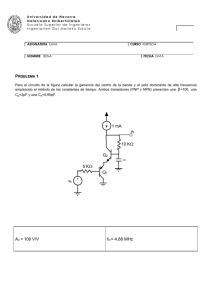
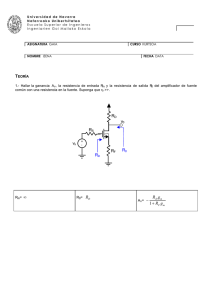
Universidad de Navarra Nafarroako Unibertsitatea Escuela Superior de Ingenieros Ingeniarien Goi Mailako Eskola ASIGNATURA GAIA TERMODINÁMICA (Troncal, 7,5 cr.) CURSO KURTSOA 2º NOMBRE IZENA TEORÍA FECHA DATA 19/09/02 (33 % de la nota) Tiempo máximo: 60 minutos 1. (a) Entalpía: definición. Significado físico de la variación de entalpía en un proceso. Se define como: H ≡ U+PV Significado físico: la variación de entalpía (∆H) es el calor intercambiado en un proceso a presión constante. (Página 3.5 y 3.6 de los apuntes) (b) Enuncie las ecuaciones de estado térmica y energética de un gas ideal. Ecuación de estado térmica: Pv=RT Ecuación de estado energética: u=u(T) (Página 4.1 de los apuntes) (c) Demuestre que si un gas perfecto experimenta un proceso adiabático reversible, la línea de estados del proceso se puede expresar como Pvk = cte., donde k es el cociente de los calores específicos principales del gas (k = cP/cV). (Ejemplo 4.2, página 4.13 de los apuntes). O bien, aplicando el segundo principio: proceso adiabático reversible es isoentrópico: dh = Tds + vdP ⇒ ds = dh v − dP ; para un gas ideal, dh = c P dT , Pv = RT . Por tanto, T T T2 P2 ⇒ = T1 P1 dT dP dT dP ds = c P −R . En un proceso isoentrópico, 0 = c P −R T P T P P2 v 2 / R P2 = P1v1 / R P1 R / cP R P cP v ⇒ 2 = 2 v1 P1 −1 P = 2 P1 R −c P cP − cv P cP P = 2 = 2 P1 P1 R / cP ⇒ −k ⇒ P1v1k = P2 v 2k = Pv k = cte. Universidad de Navarra Nafarroako Unibertsitatea Escuela Superior de Ingenieros Ingeniarien Goi Mailako Eskola 2. (a) Coeficiente de operación máximo de máquinas frigoríficas bitermas. Para una temperatura ambiente de 27 °C (300 K), indicar cuándo el COPmax puede ser =1, >1 ó <1. (Página 6.11 de los apuntes) Qf Qf = COPmax = Wn max Qc − Q f Tf = , T − T c f max pues en un ciclo reversible el calor intercambiado con los focos es proporcional a la temperatura absoluta (la escala de temperaturas absolutas se define en función de máquinas bitermas reversibles). Para T0 = Tc = 300 K, COPmax = Tf 300 − T f COPmax = 1 si Tf = 300 – Tf ⇒ 2Tf = 300 ⇒ Tf = 150 K COPmax > 1 si Tf > 300 – Tf ⇒ 2Tf > 300 ⇒ Tf > 150 K (y Tf < Tc = 300 K, por supuesto) COPmax < 1 si Tf < 300 – Tf ⇒ 2Tf < 300 ⇒ Tf < 150 K (y Tf > 0, por supuesto) (b) En un ciclo de Rankine simple, indicar las tres variables termodinámicas que influyen en el rendimiento energético del ciclo. Aumento de presión en caldera. Sobrecalentamiento del vapor a la salida de caldera. Reducción de la presión en el condensador. (Página 14.5 de los apuntes) Universidad de Navarra Nafarroako Unibertsitatea Escuela Superior de Ingenieros Ingeniarien Goi Mailako Eskola 3. Compresión por etapas con enfriamiento intermedio: P1 T 1 P2 T 2 P2 T 1 P3 T 3 (a) Representar el proceso en un diagrama termodinámico, comparado con el proceso de compresión directa desde P1 T1 a P3. Suponer procesos adiabáticos internamente reversibles, gas perfecto. (b) Demostrar que la presión intermedia óptima viene dada por (Página 8.4 de los apuntes) ( P2 ) opt = P1 P3 . Universidad de Navarra Nafarroako Unibertsitatea Escuela Superior de Ingenieros Ingeniarien Goi Mailako Eskola ASIGNATURA GAIA TERMODINÁMICA (Troncal, 7,5 cr.) NOMBRE IZENA CURSO KURTSOA 2º FECHA DATA 19/09/02 PROBLEMA 1 (33 % de la nota) Tiempo máximo: 60 minutos Una caldera de vapor recién apagada, de 10 m3 de volumen, contiene agua líquida y vapor en equilibrio, a 200 °C. El líquido ocupa un 10 % del volumen de la caldera. La caldera pierde calor lentamente hacia el entorno, que se encuentra a 20 °C. Tras un cierto tiempo, se observa que la caldera ha alcanzado la presión atmosférica, de 101,3 kPa. Puede considerarse que la caldera es un recipiente rígido. Se pide: (a) Masa total de agua contenida en la caldera. kg (b) Porcentaje en peso de vapor en el instante final. % (c) Calor total disipado al ambiente. kJ (d) Entropía generada en el proceso. kJ/K (e) Representar el proceso en un diagrama P-v, indicando claramente la posición de las isobaras y las isotermas. (e) Diagrama P-v: P 1554 kPa 101 kPa 1 2 200 °C 100 °C v Universidad de Navarra Nafarroako Unibertsitatea Escuela Superior de Ingenieros Ingeniarien Goi Mailako Eskola El estado inicial es una mezcla de vapor y líquido en equilibrio, es decir, un vapor húmedo. El sistema es cerrado (masa de agua constante) y rígido (volumen constante). Luego en el proceso, el volumen específico del agua permanece constante. La caldera cede calor hacia el exterior, que se encuentra a 20 °C. Tabla de propiedades (calculadas a lo largo del problema): Estado P, kPa T, °C v, m3/kg h, kJ/kg s, kJ/kgK x, % y, % 1 1554,9 200 0,01072 999,39 2,6414 7,58 10,0 2 101,3 100 =v1 432,13 1,3419 0,579 9,64 (a) Masa de agua: En el estado inicial (1) el líquido ocupa el 10 % del volumen: VL = 1 m3 = mLvf ⇒ mL = 1/vf = 1/0,00116 = 862,1 kg VV = 9 m3 = mVvg ⇒ mV = 9/vg = 9/0,12720 = 70,7 kg ⇒ m = mL+mV = 932,8 kg Propiedades intensivas en el estado 1: P1 = Ps(200 °C) = 1554,9 kPa x1 = mV/m = 70,7/932,8 = 0,0758 = 7,58 % v1 = V/m = 10/932,8 = 0,01072 m3/kg h1 = x1hg+(1–x1)hf = (0,0758)(2790,90)+(1–0,0758)(852,37) = 999,39 kJ/kg s1 = x1sg+(1–x1)sf = (0,0758)(6,4278)+(1–0,0758)(2,3307) = 2,6414 kJ/kgK (b) Título final: P2 = 101,3 kPa ⇒ T2 = Ts(101,3 kPa) = 100 °C v2 = v1 = 0,01072 m3/kg = x2vg+(1–x2)vf ⇒ x2 = (v2–vf)/(vg–vf) = (0,01072-0,00104)/(1,6730–0,00104) = 0,00579 = 0,58 % h2 = x2hg+(1–x2)hf = (0,00579)(2676,0)+(1–0,00579)(419,06) = 432,13 kJ/kg s2 = x2sg+(1–x2)sf = (0,00579)(7,3554)+(1–0,00579)(1,3069) = 1,3419 kJ/kgK (c) Calor disipado: Balance de energía en sistema cerrado, estático y rígido: Q–W=∆E; como W=0 y ∆E=∆U: Q = ∆U = ∆H–∆(PV) = m(h2–h1)–V(P2–P1) = 932,8(432,13–999,39)–10(101,3–1554,9) = = –514604 kJ (d) Entropía generada: Balance de entropía en sistema cerrado: σ = ∆Suniv = ∆S12 + ∆Sentorno = m(s2–s1)–Q12/T0 = 932,8(1,3419–2,6414)–(–514604)/293 = = –1212,2+1755,4 = 543,3 kJ/K Por cada kg de vapor: σ = 543,3/932,8 = 0,5824 kJ/kgK Universidad de Navarra Nafarroako Unibertsitatea Escuela Superior de Ingenieros Ingeniarien Goi Mailako Eskola ASIGNATURA GAIA TERMODINÁMICA (Troncal, 7,5 cr.) CURSO KURTSOA 2º NOMBRE IZENA FECHA DATA 19/09/02 PROBLEMA 2 (33 % de la nota) Tiempo máximo: 60 minutos Se representa el diagrama de flujo de una turbina de gas con ciclo Brayton abierto. Aire del ambiente a 20 °C y 1 bar (1) entra en un compresor adiabático, de donde sale a 300 °C y 8 bar (2). Se mezcla con metano (CH4) en una cámara de combustión adiabática e isobara; el metano se introduce a 8 bar y 25 °C (3). La relación aire/combustible se regula para que los gases de combustión salgan de la cámara a 1000 °C (4). Estos gases se expanden en una turbina adiabática de rendimiento isoentrópico 0,85, hasta 1 bar (5). 3 2 Cámara de combustión Compresor 1 4 Turbina 5 Considerar todos los componentes como gases perfectos, con calores específicos isobaros constantes: cP(O2) = 3,5 R; cP(N2) = 3,5 R; cP(H2O) = 4,4 R; cP(CO2) = 5,5 R; gases de combustión (valor medio): cP = 3,7 R. La potencia calorífica inferior (PCI) del metano es de 802,31 MJ/kmol. Se pide calcular: (a) El rendimiento isoentrópico del compresor. % (b) La relación volumétrica (o molar) aire/combustible empleada en la cámara de combustión. m3/m3 (c) La temperatura de rocío de los humos de combustión, en las condiciones de salida de la turbina (5). °C (d) Trabajo neto obtenido en la instalación, por cada kmol de metano que se quema. kJ/kmol (e) Representar el proceso en un diagrama T-s, indicando claramente la posición de las isobaras e isotermas. Universidad de Navarra Nafarroako Unibertsitatea Escuela Superior de Ingenieros Ingeniarien Goi Mailako Eskola (e) Diagrama T-s: 8 bar T 4 1000 °C 300 °C 20 °C 2s 1 bar 5 2 5s 1 s (a) Rendimiento isoentrópico del compresor: (ηs)12 = (h2s–h1)/(h2–h1) = (T2s–T1)/(T2–T1), pues es un gas perfecto con cP constante. s2s = s1 ⇒ ∆s12s = cP ln(T2s/T1) – R ln(P2/P1) = 0 ⇒ T2s = T1(P2/P1)R/cp = 293 (8/1)1/3,5 = 531 K = 258 °C ⇒ (ηs)12 = (258–20)/(300–20) = 0,85 = 85 % (b) Relación aire/combustible: La temperatura de salida de la cámara (1000 °C) es bastante menor que la temperatura adiabática de llama (del orden de 2000 °C): por tanto, la combustión es con exceso de aire. Podemos suponer reacción completa. Análisis de la reacción real de combustión: por cada kmol de CH4 Balance de materia: CH4 + x(0,21 O2 + 0,79 N2) → a CO2 + b H2O + c O2 + d N2 - Balance de C: 1=a - Balance de H2: 2=b - Balance de O2: 0,21x=a+b/2+c ⇒ c=0,21x–2 - Balance de N2: 0,79x=d Reacción global: CH4 + x(0,21 O2 + 0,79 N2) → CO2 + 2 H2O + (0,21x–2) O2 + (0,79x) N2 x es la relación aire/combustible pedida. Se calcula resolviendo el balance de energía. Balance de energía: Q–Wa=∆H+∆Ec+∆Ep ⇒ 0=∆H=∆Hr°+Σ∆HS–Σ∆HE - Calor de reacción estándar (por kmol de CH4): ∆Hr° = –PCI = –802310 kJ/kmol CH4 - Entalpía de las entradas: Σ∆HE = ΣNcP∆T = x 3,5 R (300–25) = 8002,7 x kJ/kmol CH4 - Entalpía de las salidas: Σ∆HS = ΣNcP∆T = (1+2+0,21x–2+0,79x) 3,7 R (1000-25) = = (x+1) 29994,6 kJ/kmol CH4 Sumando los tres términos: 0 = –802310 + (x+1) 29994,6 – 8002,7 x ⇒ x = 35,12 kmol aire/kmol CH4 Universidad de Navarra Nafarroako Unibertsitatea Escuela Superior de Ingenieros Ingeniarien Goi Mailako Eskola Otro modo de calcular: en función de los moles de O2 (y), en vez de aire (x): Reacción global: CH4 + y(O2 + 79/21 N2) → CO2 + 2 H2O + (y–2) O2 + (3,76y) N2 Balance de energía: Q–Wa=∆H+∆Ec+∆Ep ⇒ 0=∆H=∆Hr°+Σ∆HS–Σ∆HE - Calor de reacción estándar (por kmol de CH4): ∆Hr° = –PCI = –802310 kJ/kmol CH4 - Entalpía de las entradas: Σ∆HE = ΣNcP∆T = y(1+3,76)3,5R(300–25) = 38090 y kJ/kmol CH4 - Entalpía de las salidas: Σ∆HS = ΣNcP∆T = (1+2+y–2+3,76y)3,7R(1000-25) = = (4,76y+1) 29994,6 kJ/kmol CH4 Sumando los tres términos se deduce: y = 7,377 kmol O2/kmol CH4 ⇒ x = y/0,21 = 35,12 kmol aire/kmol CH4 (c) Temperatura de rocío de los humos: La fracción molar de agua en los humos es: xH2O = 2/(1+2+0,21x–2+0,79x) = 2/(x+1) = 0,05537 Presión parcial de agua: pH2O = xH2O P = (0,05537) 100 = 5,537 kPa ⇒ Tr = 34,7 °C (d) Trabajo neto: wn = wcompresor + wturbina = w12 + w45 Compresor y turbina son adiabáticos y sin cambios de Ec ni Ep, luego en ambos casos w=–N∆h: w12 = –N1∆h12 = –x cp,aire (T2–T1) = –(35,12)(3,5)(8,314)(300-20) = –286148 kJ/kmol CH4 w45 = –N4∆h45 = –(x+1) cp,humos (T5–T4) = –(36,12)(3,7)(8,314)(T5–T4) Cálculo de T5: el proceso 4-5s es isoentrópico: s5s=s4 ⇒ ∆s45s = cP ln(T5s/T4) – R ln(P5/P4) = 0 ⇒ T5s = T4(P5/P4)R/cp = 1273 (1/8)1/3,7 = 725,7 K ⇒ T5 = T4–(ηs)45(T4–T5s) = 1273–0,85(1273–725,7) = 808 K = 535 °C Por tanto: w45 = 516669 kJ/kmol CH4 ⇒ wn = –286148 + 516669 = 230521 kJ/kmol CH4 Otro modo de calcular: balance global de energía en todo el sistema, por kmol de CH4: Q–Wa=∆H=∆Hr°+Σ∆HS–Σ∆HE 3 Q=0 2 Compresor Cámara de combustión ∆Hr° = -802310 kJ/kmol CH4 4 Σ∆HE = x 3,5R(20–25) = –5110 kJ/kmol CH4 Turbina Σ∆HS = (x+1)3,7R(535–25) = 566669 kJ/kmol CH4 ⇒ wn = –(-802310 + 566669 + 5110) = 1 5 = 230521 kJ/kmol CH4