Glúcidos - Joaquín Rodríguez Piaya
Anuncio

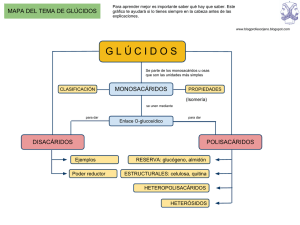
Losglúcidos GLÚCIDOS LosglúcidossonbiomoléculasformadasfundamentalmenteporC,HyO. Tambiénsonconocidosconlosnombresdeazúcaresosacáridos. Muchos glúcidos responden a fórmulas empíricas que se pueden escribir como (CH2O)n, por lo que antiguamente se pensóqueeranalgúntipodecombinacióndecarbonoyaguayselesllamóhidratosdecarbono.Hoysabemosqueesta denominación es químicamente engañosa, pero quizás esté demasiado arraigada como para que sea abandonada definitivamente. Losglúcidossedefinensencillamentedesdeelpuntodevistaquímicocomopolihidroxialdehídosopolihidroxicetonas, o bien sustancias que por hidrólisis dan lugar a este tipo de compuestos. Los polihidroxialdehídos son compuestos orgánicosenlosquetodoslosátomosdecarbonoestánunidosaungrupohidroxiloexceptounodeellosqueforma partedeungrupoaldehído,mientrasquelaspolihidroxicetonassoncompuestosorgánicosenlosquetodoslosátomos decarbonoestánunidosaungrupohidroxiloexceptounoqueformapartedeungrupocetona. Monosacáridosuosas Oligosacáridos Holósidos Homopolisacáridos Glúcidos Polisacáridos Ósidos Heteropolisacáridos Glucoproteínas Heterósidos Glucolípidos MONOSACÁRIDOS Losmonosacáridossonlosazúcaresmássencillos,puesnopuedendescomponerseporhidrólisisparadarlugaraotros azúcares más simples. En la naturaleza se encuentran en estado libre, desempeñando importantes funciones, pero tambiénseencuentranformandopartedeotrosazúcaresmáscomplejos,losósidos,deloscualessonsusmonómeros. Tienensabordulce,formancristalesdecolorblanco,sólidosatemperaturaambiente,cristalinosysonsolublesenagua. Losmonosacáridossonpolihidroxialdehídosopolihidroxicetonas.Lospolihidroxialdehídossoncompuestosorgánicos en los que todos los átomos de carbono están unidos a un grupo hidroxilo exceptounodeellosqueformapartedeungrupoaldehído,mientrasquelas polihidroxicetonassoncompuestosorgánicosenlosquetodoslosátomosde carbonoestánunidosaungrupohidroxiloexceptounoqueformapartede ungrupocetona. Formanunasolamoléculaentre3y7carbonos.Losmásfrecuentescon3,5 y6. Lapresenciadelgrupocarboniloledauncarácterreductor. Sielgrupocarboniloestáenelprimercarbonoseformanlasaldosas;siestá enelsegundo,lascetosas. Desvíanelplanodelaluzpolarizada. Nomenclatura:función–nºC–osaEj.:aldo–tri–osa. Para representar en el plano estas moléculas se utiliza la proyección de Fischer.Lacadenacarbonatadasedisponeenverticalylosgruposunidosa loscarbonosasimétricossesitúanaladerechayalaizquierdadeéstos. 1 JoaquínRodríguezPiaya Losglúcidos Los monosacáridos son capaces de oxidarse, es decir pueden perder electrones. Las moléculas que los aceptan se reducen.Enesteintercambiodeelectronesseproduceunaliberacióndeenergía ElpoderreductorsepuededeterminarconlapruebadeFelhing. ISOMERÍA Cuandodosomáscompuestostienenlamismafórmulamolecularydiferentesfórmulasestructuralessonisómeros. § Isomeríaespacial Loscarbonosasimétricossonaquellosqueestánunidosa4radicalesdiferentes.SesimbolizanconunC*. Todos los monosacáridos son quirales, es decir poseen tienen al menos un carbono asimétrico (excepto la dihidroxiacetona). La presencia de carbonos asimétricos determina la existencia de isomería espacial (estereoisomería), lo que origina la existencia de compuestosque,teniendolamismafórmulaempírica,sediferencianentresípor ladistintacolocacióndesusátomos. Estereoisómerossonlosisómerosespaciales.Ej.elgliceraldehídotienedos. Los estereoisómeros de los monosacáridos se pueden dividir en dos grupos atendiendo a la configuración del carbono asimétrico más alejado del grupo carbonilo.PertenecenalaformaDaquellosquetienenelgrupoOHdelpenúltimoCaladerecha(enelplanodel papel)yalaformaLlosquelotienenalaizquierda.Ejm:D–glucosayL–glucosa. n Unmonosacáridoconncarbonosasimétricospresenta2 estereoisómeros.Anteunmismonúmerodecarbonos, lasaldosaspresentanmásestereoisómerosquelascetosas. Losdosestereoisómerostienenlasmismaspropiedadesfisicoquímicas.Resultamuydifícilsepararloscuandoestán juntos. Los seres vivos (las enzimas) son capaces de diferenciarlos y solamente utilizan uno de ellos (en los monosacáridoselisómeroDcasisiempre).Formapartedeloqueseconocecomolaasimetríadelavida. Enantiomorfos o enantiómeros son aquellas moléculas en las que una es la imagen especular de la otra (no se puedensuperponer).Ej.:DyL-gliceraldehído. Epímeros son aquellos monosacáridos que se diferencian sólo por la configuración de uno de sus carbonos asimétricos(laposiciónqueocupaelgrupohidroxilodeuncarbono).Ej.:D-eritrosayD-treosasonepímerosenelC 2. 2 JoaquínRodríguezPiaya Losglúcidos § Isomeríaóptica Losisómerosópticossecaracterizanpordesviarlaluzpolarizadauncierto ángulocuandoestánendisolución.Larotaciónópticaeselánguloquegira elplanodevibracióndelaluzpolarizadaalatravesarunadisolucióndeuna sustanciaópticamenteactiva. Se debe a la presencia de los carbonos asimétricos. Si lo hace hacia la derechaesdextrógiro(+)ysilohacehacialaizquierdalevógiro(-). NoexisteningunarelaciónentrelaestructuraDoLdeunamoléculayel queéstaseadextrógiraolevógira. FORMASCÍCLICAS RecibenelnombredefórmulasdeHaworth. Sedanenpentosasyhexosas.Noimplicapérdidanigananciadeátomos.Lareacciónintramolecularseproduceentreel grupo carbonilo (C = O) y un hidroxilo (-OH) de la misma molécula relativamente alejado. De esta reacción se puede originar: • unhemiacetal(formashemiacetálicas):grupoquímicoformadoentreunaldehídoyunalcohol • unhemicetal(formashemicetálicas):grupoquímicoformadoentreunacetonayunalcohol Seformananillosfuranosa(con5vértices)yanillospiranosa(con6vértices).Siempreunodelosvérticesestáocupado porunO. Alformarseelanilloapareceunnuevocarbonoasimétrico,aquelque tenía el grupo aldehído o cetona, que recibe el nombre de carbono anomérico.Asíaparecendosnuevosestereoisómeros,querecibenel nombredeanómerosoformasanoméricas(αyβ) Los dos nuevos estereoisómeros (anómeros) se diferencian por la posición del OH hemiacetálico. Si queda hacia abajo es α y si queda haciaarribaesβ. Cada estereoisómero (α y β) exhibirá en disolución una rotación óptica característica. Estas dos formas anoméricas son interconvertibles a través de la forma de cadena abierta. Cuando se prepara una disolución, ya sea de α o de β-D-glucosa, se alcanza al cabo de unos minutos una mezcla de ambas que en el equilibrio estará formada por 2/3 de β-D-glucosa y 1/3 de α-D-glucosa. Esta mezcla en el equilibrio es la que presenta una rotación óptica de +52,7°. CuandosemedíalarotaciónópticadediferentesdisolucionesdeD-glucosasecomprobóconsorpresaqueenunoscasoséstatenía unvalorinicialde+112.2°mientrasqueenotrosestevalorerade+18,7°.Resultabasinembargotodavíamássorprendentequeal cabodeunosminutosdehaberpreparadoladisoluciónlarotaciónópticacambiabaparaestabilizarseentodosloscasosenunvalor de+52,7°.Estecambioenlarotaciónópticasedenominamutarrotación.Elfenómenodelamutarrotaciónsugierequedebenexistir dosformasestereoisómerasdelaD-glucosaconpropiedadesfísicasdiferentes. Nomenclatura: Ø Eltipodeanómero(αoβ) Ø Eltipodeenantiomorfo(DoL) Ø Elnombredelamolécula(glucosa,galactosa,…) Ø Eltipodeestructuracíclica(furanosaopiranosa) El anillo furanosa es casi planar, a diferencia del anillo piranosa que no es plano y tiende a adoptar dos dos configuraciones en el espacio. Forma “cis” o de nave y forma “trans” o de silla. Existen dos tipos de "silla" que se interconviertenatravésdelaforma"nave". 3 JoaquínRodríguezPiaya Losglúcidos Notodoslosmonosacáridospuedendarlugarahemiacetalesohemicetalesintramoleculares.Paraqueéstosseformen esnecesarioquelosdosgruposfuncionales(carboniloehidroxilo)quehandereaccionarseacerquenlosuficientepara hacerlo,yestosólosucedesilacadenacarbonadaeslobastantelargacomoparaquelalibrerotacióndelosenlaces simplespermitaesteacercamiento.Porello,losmonosacáridosde3y4átomosdecarbonoseencuentransiempreen forma de cadena abierta, mientras que los de 5 ó más carbonos tienden a formar anillos de piranosa o furanosa en funcióndecualdeellosseamásestableencadacaso.Enlasiguientetablasemuestranlasformasmásestablesenque aparecenlosmonosacáridosde3a6átomosdecarbono.Obsérvesequelascetosasnecesitanunamayorlongitudde cadenaparapoderdarlugaraformascíclicas;ellosedebeaquesuátomodecarbonocarboníliconoestáalfinaldela cadenacomoenlasaldosas. NºdeC ALDOSAS CETOSAS Cadenaabierta Cadenaabierta 3 Cadenaabierta Cadenaabierta 4 Furanosa Cadenaabierta 5 Piranosa Furanosa 6 • • • • • D–glucosa:oazúcardeuva.Eselmásabundante. D–fructosa:seencuentraenlamayorpartedelosfrutos,juntoconlaglucosa.Enelhígadosetransformaenglucosa. D–galactosa:juntoconlaglucosaformaelazúcardelaleche. D–ribosa:enác.nucleicosyATP. D–ribulosa:intervieneenlafaseoscuradelafotosíntesis,incorporandoelCO2alamateriaviva. DERIVADOSDELOSMONOSACÁRIDOS Seoriginanporcambiosquímicosdeéstospor3procesos: a) Reducción:seformanlosdesoxiazúcares,conlapérdidadeungrupohidroxilo.Ej.:desoxirribosa,quederivadela ribosaporreduccióndelC2. b) Oxidación:seformanlosazúcaresácidos,conungrupocarboxilo(COOH)enelCterminal.Ej.:ácidoglucurónico. c) Sustitución:seformanlosaminoazúcares.Ej.:N–glucosamina,dondesesustituyeunOHporunNH2enelC2 ÓSIDOS HOLÓSIDOS LauniónentremonosacáridossehacemedianteenlacesO-glucosídicos(glicosídicos).Puedeserdedostipos: a) medianteunenlacemonocarbonílico,enelqueintervieneelOH-hemiacetaldeunoyelgrupoalcoholdeotro. ComoelOH-hemiacetaldel2ºmonosacáridoquedalibre,semantieneelpoderreductor. b) mediante un enlace dicarbonílico, en el que el enlace se forma entre los OH-hemiacetal de ambos. En este casosepierdeelpoderreductor. Nomenclatura -osil:sufijoqueseutilizacuandoelprimermonosacáridoestáunidoporelcarbonocarbonílico(-OHhemiacetálico). -osa:cuandoelsegundomonosacáridonoutilizael–OHhemiacetálico. -ósido:cuandoelsegundoazúcartambiénutilizael–OHhemiacetálico.Pierdeelpoderreductor. OLIGOSACÁRIDOS Sondesaboresdulces,blancosycristalizables.Senombransegúnelnúmerodemonosacáridos(di,tri,tetra,etc.),hasta diez. Losoligosacáridosmásabundantesydemayorimportanciabiológicasonlosdisacáridos. Sacarosa: Lactosa: Maltosa: Isomaltosa: Celobiosa: Alfa–D–glucopiranosil(1–2)beta–D–fructofuranósido Beta–D–galactopiranosil(1–4)alfa–D–glucopiranosa Alfa–D–glucopiranosil(1–4)alfa–D–glucopiranosa(porlahidrólisisincompletadelalmidónyelglucógeno) Alfa–D–glucopiranosil(1–6)alfa–D–glucopiranosa(porlahidrólisisincompletadelalmidónyelglucógeno) Beta–D–glucopiranosil(1–4)beta–D–glucopiranosa 4 JoaquínRodríguezPiaya Losglúcidos Ladiversidaddemonosacáridos,juntoalasdiferentescombinacionesquepuedentener,lesdaalosoligosacáridos unagrancapacidaddealmacenarinformación.Deahíqueselocalicenenlasuperficieexteriordelasmembranas celularesinterviniendoenelreconocimientocelular. POLISACÁRIDOS Sonmacromoléculasdeelevadopesomolecularformadasporlaunióndemásdediezmonosacáridos.Nosedisuelven fácilmente(debidoasugrantamaño).Puedenserinsolublesoformardispersionescoloidales.Ni son cristalinos ni tienen sabor dulce. Se forman de la misma manera que los oligosacáridos. La función puede ser reserva energética (enlaces alfa-O-glucosídicos) o estructural (enlaces beta-Oglucosídicos).Ej.reserva:almidónyglucógeno.Estructural:celulosayquitina. § HOMOPOLISACÁRIDOS Los de mayor interés son los polímeros de hexosas (aunque existen de pentosas). Los homopolisacáridos de la D-glucosa, denominados glucanos, son los polisacáridos más abundantesenlanaturalezaylosquetienenunamayorimportanciabiológica. 1- Almidón:eselprincipalalimentodereservadelasplantasyunadelasmásimportantesfuentesprimariasde azúcaresenladietadelosanimales.FormadoporlaunióndemuchasmoléculasdeD-glucopiranosasmediante enlacesalfa(1–4)yalfa(1–6).Danlugaradospolímerosdistintos: Ø Amilosa: cadenas lineales con uniones 1 – 4 exclusivamente, en disposición helicoidal (cada 6 moléculasunahélice).Elnºoscilaentre200y300.Solubleenagua.Sehidrolizaenmaltosa. Ø Amilopectina: cadenas lineales y helicoidales de alfa – D – glucopiranosas unidas con enlaces 1 – 4, conramificacionesunidasconenlaces1–6.Unaramificaciónporcada24–30monómeros.Menos solublequelaamilosa.Sehidrolizaenmaltosaseisomaltosas. Losgranosdealmidónestánformadosporamilosa(30%)ensuparteinterior y amilopectina (70%) en el exterior. Cuando se hidrolizan parcialmente dan lugaradextrinasyluegoamaltosasyglucosas. 2- Glucógeno:polímerodelaalfa–D–glucopiranosaconestructuraparecidaa la amilopectina, pero es mayor y con más ramificaciones (cada 8 – 12 glucosas). Es mucho más compacto que el almidónEs el polisacárido de reservadelosanimalesyselocalizaenelhígado(puderepresentarel7%de su peso) y en el músculo estriado. Pueden tener hasta 15.000 maltosas. Insoluble. Tanto el almidón como el glucógeno tienen muchos extremos no reductores (ramas) y un solo extremo reductor, por lo que estos polisacáridos carecen de poder reductor. Al almacenarse la glucosa en forma de polisacáridos le evita a la célula la elevada presión osmótico que le generaría si se guardaran en forma de monosacáridoslibres. Tanto el almidón como el glucógeno pueden ser degradados en el aparato digestivo de los animales por la accióndeunosenzimasllamadosamilasas. 3- Celulosa:constituyeelcomponentemásimportantedelasparedesvegetales,enunaproporciónquesuperael 50%.Insoluble. Esunpolímerolinealdemoléculasbeta–D–glucopiranosaunidasporenlaces(1–4)enestructurahelicoidal (la unidad que se repite es la celobiosa). Pueden tener entre 150 y 5.000 celobiosas. Una vuelta cada 4 glucosas.LaestructuraapretadaprotegealenlaceO–glucosídicodeataquesdenumerososreactivos,porlo queesinsolubleyrelativamenteinerte. Formacadenasmolecularesnoramificadas,unidasunasaotrasmedianteenlacesdehidrógeno. 5 JoaquínRodríguezPiaya Losglúcidos 4- § Lascadenasnopuedenseratacadasporlosenzimasdigestivosdelosanimales(salvorarasexcepciones),pero sípormuchosmicroorganismosqueposeenunaenzimallamadacelulasa. Quitina: polisacárido nitrogenado en hongos y artrópodos. Polímeros de un derivadodelabeta–D–glucopiranosa:N–acetilglucosamina.Sesustituyeel–OH delC2porelradical–NH–CO–CH3. HETEROPOLISACÁRIDOS La mayoría se encuentra formando parte de la pared celular bacteriana, de la pared celulósicadelascélulasvegetalesodelamatrizextracelulardelascélulasanimales. Son responsables de la forma y rigidez de las células y, en el caso de los organismos pluricelulares, constituyen, además, la sustancia cementante intercelular. Otros sirven para taponar heridas, constituyenellíquidosinovial,etc. 1. Agar-agar:Presenteenlasalgasrojas.Esmuyindigerible.Seusacomomediodecultivodemicroorganismosy enlaindustriaalimenticiacomoespesante 2. Gomaarábiga:exudadosvegetales.Seutilizandepegamento 3. Hemicelulosa:formapartedelaparedcelular 4. Pectina:Estánfundamentalmenteformadasporunpolímerodeunderivadodelagalactosa.Contribuyeala formacióndelaparedcelulardetodaslasplantasterrestres.Tieneunagrancapacidadgelificante,porloque seusaparalafabricacióndemermeladas. HETERÓSIDOS Resultandelacombinacióndelgrupo–OHdelcarbonoanoméricodeunmonosacáridoodeunoligosacáridoconuna cadena o grupo de moléculas no glucídicas denominadas aglucón. Forman parte de este grupo los glucolípidos y las glucoproteínas.Lospeptidoglucanossoncomponentesesencialesdelasparedescelularesbacterianas,constituidospor cadenas paralelas de heteropolisacáridos complejos unidas transversalmente por cadenas de aminoácidos.Ej.: estreptomicina,nucleótidos,etc. FUNCIONESGENERALESDELOSGLÚCIDOS 12345678- Funciónenergética:glucosa Funciónestructural:celulosa,quitina,ribosa,desoxirribosa,etc. Reconocimientocelular Antibiótico:estreptomicina Biocatalizadora:vitaminaC Anticoagulante:heparina Hormonal:hormonasgonadotropas Inmunológica:glucoproteínas CUESTIONARIODEGLÚCIDOS 1 2 3 4 5 6 7 ¿Ladihidroxiacetonaesdextrógiraolevógira? La glucosa es el principal nutriente de las células. ¿Por qué los animales no poseen grandes reservas de polisacáridoscomolosvegetales? ¿CuántasL-aldopentosassonposibles?¿yL–cetohexosas?¿porqué? Escribeunejemplodedosmonosacáridosenantiomorfosydedosmonosacáridosepímeros. Escribelafórmuladedosdisacáridosreductoresyladedosdisacáridosnoreductores Señalaquécarbonodelamanosaessimétricoenlaformalinealyasimétricoenlacíclica. ¿QuénombrerecibeunglúcidocuyafórmulaempíricaesC5H10O5? 6 JoaquínRodríguezPiaya Losglúcidos 8- Dibujalaestructuradeunhexasacáridoconstituidoporcuatroglucosasunidasmedianteenlacealfa(1–4),yotras dosunidasentresíporunenlacealfa(1–4)yunidasalacadenaprincipalporunenlacealfa(1–6)alasegunda glucosadelpolímeroanterior. 9- ¿Quéfórmulaempíricatendráunpolisacáridoformadopor100glucosas?¿yunoformadopor50galactosas? 10- Habrásvistoenanunciospublicitariospapillasinfantilescompuestasabasedecerealesdextrinados.¿Quésignifica esto?¿Québeneficioofrecealosbebés? 11- Formulalossiguientescompuestos Ø eltrisacáridomelicitosa(seencuentraenlasaviadealgunasconíferas)alfa–D–glucopiranosil(1–3)beta–D fructofuranosil(2–1)alfa–D–glucopiranósidoy Ø eltrisacáridorafinosa(seencuentraenalgunasleguminosas,comoengarbanzos,alubias,soja,…):alfa–D– galactopiranosil(1–6)alfa–D–glucopiranosil(1–2)beta–D–fructofuranósido.Razonasitienencarácter reductorono. 12- PorquélasdisolucionesdeD-glucosapresentanelfenómenodelamutarrotación? 13- ¿Porquélaglucosaendisoluciónnoexhibelaspropiedadesquímicasquecabríaesperardeunpolihidroxialdehido? 14- Explicaporquélosmonosacáridosde3y4átomosdecarbononoformanenlacesglucosídicos. 15- PuedeexistirunhomopolisacáridoformadoporunidadesmonoméricasdeD-gliceraldehido?¿Porqué? 16- Porquélospolisacáridossoninsolublesenaguaapesardesersustanciasaltamentehidrofílicas? 17- Aquésedebelaextraordinariaresistenciamecánicadelacelulosa?¿Porquéotrospolisacáridosimportantesno presentanestapropiedad? 18- Díquétiposdecompuestosseobtienenencadacasotrassometerahidrólisiscompletaalossiguientesglúcidos: unhomopolisacárido,unheteropolisacárido,unholósido,unheterósido. 7 JoaquínRodríguezPiaya