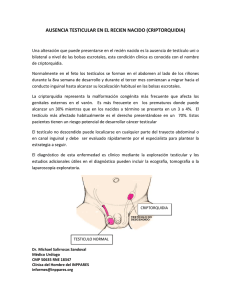
ESTUDIO DE LA PERFUSIÓN TESTICULAR TRAS
Anuncio

UNIVERSIDAD DE GRANADA FACULTAD DE MEDICINA DEPARTAMENTO DE MEDICINA TESIS DOCTORAL ESTUDIO DE LA PERFUSIÓN TESTICULAR TRAS HERNIOPLASTIA PREPERITONEAL Ricardo Belda Lozano Granada, Noviembre 2009 Editor: Editorial de la Universidad de Granada Autor: Ricardo Belda Lozano D.L.: GR 1474-2010 ISBN: 978-84-693-0732-8 Estudio de la perfusión testicular tras hernioplastia preperitoneal AUTOR: DON RICARDO BELDA LOZANO DIRECTORES: PROFESOR RAFAEL RODRÍGUEZ–CONTRERAS PELAYO DOCTOR JOAQUIN SALVELIO PICAZO YESTE PROFESOR FRANCISCO JOSÉ PÉREZ BLANCO II Estudio de la perfusión testicular tras hernioplastia preperitoneal AGRADECIMIENTOS Mi agradecimiento al Dr. Joaquín Picazo Yeste por su interés, apoyo y paciencia constantes desde el inicio de esta empresa. Al Prof. Rafael Rodríguez-Contreras Pelayo por su firme dirección y sabios consejos. Al Prof. Francisco José Pérez Blanco por su ayuda incondicional. Al Dr. Tesifón Parrón Carreño y al Prof. José Antonio Roldan Nofuentes, que encendieron una bombilla en esa oscura habitación que para mi supone la estadística. A los Dres. Felices y Rubio que me ayudaron tanto en quirófano como en el planteamiento inicial de este proyecto. A la Dra. Carolina Carvia Ponsaville, pieza clave del estudio. Gracias por tu comprensión y trabajo. Al Dr. Manuel Ferrer Márquez. Todas las tesis tienen sus altibajos y sus puntos de inflexión. Su fe y su amistad fueron determinantes para que ésta llegase a buen puerto. Al Dr. Reina Duarte, por hacerme querer ser mejor de lo que soy. III Estudio de la perfusión testicular tras hernioplastia preperitoneal Al Dr. Belda Poujoulet, mi padre, que corrigió pacientemente todo el manuscrito. Gracias por enseñarme a amar esta profesión. A Cristina, por sus palabras de ánimo en los momentos más duros y por el tiempo robado. A mi madre, por hacer de mí cuanto soy. A mis pacientes. Gracias por enseñarme. IV Estudio de la perfusión testicular tras hernioplastia preperitoneal A mis abuelos. Ellos sí tuvieron derecho a fracasar… Y no lo hicieron. V Estudio de la perfusión testicular tras hernioplastia preperitoneal “Mais on ne se bat pas dans l´espoir du succés! Non, non c´est bien plus beau lorsque c´est inutile!” Edmond Rostand (Cyrano de Bergerac) VI Estudio de la perfusión testicular tras hernioplastia preperitoneal Índice 1. INTRODUCCIÓN.....................................................................................................3 1.1. ASPECTOS ANATÓMICOS DE LA REGIÓN INGUINAL EN EL ABORDAJE PREPERITONEAL. .............................................................................4 1.1.1 Límites .........................................................................................................4 1.1.2 Región inguinoabdominal. ...........................................................................5 1.1.3 Espacio preperitoneal ....................................................................................6 1.1.4 Vascularización .............................................................................................8 1.1.5 Inervación ................................................................................................... 11 1.1.6 Elementos anatómicos ................................................................................. 13 1.2 HISTORIA SELECTIVA DEL ABORDAJE PREPERITONEAL ..................... 17 1.3 FISIOPATOLOGÍA DE LA HERNIA INGUINAL ...........................................27 1.4 DIAGNÓSTICO ................................................................................................ 31 1.5 CLASIFICACIÓN ............................................................................................ 33 1.6 HERNIORRAFIAS. REVISIÓN Y ESTADO ACTUAL. .................................. 37 1.6.1 Intervención de Bassini. .............................................................................. 37 1.6.2 Intervención de Shouldice. ..........................................................................38 1.6.3 Intervención de Nyhus. ............................................................................... 40 1.6.4 Intervención de Lichtenstein. ......................................................................42 1.6.5 Intervención de Rutkow-Robbins. ............................................................... 43 1.6.6 Intervención de Stoppa ............................................................................... 45 1.6.7 La reparación por vía laparoscópica. ........................................................... 48 1.6.8 La hernioplastia preperitoneal en M ............................................................ 53 1.7 MALLAS Y HERNIA INGUINAL. ................................................................. 57 1.7.1 Mecanismo de acción de las prótesis ........................................................... 58 1.7.2 Tipos de prótesis ......................................................................................... 63 1.7.3 Efectos adversos del polipropileno .............................................................. 64 1.7.4 Infertilidad y lesión deferencial .................................................................. 73 2. HIPÓTESIS DE TRABAJO .................................................................................... 80 3. OBJETIVOS ...........................................................................................................82 4. PACIENTES Y MÉTODOS .................................................................................... 84 4.1 Muestra ............................................................................................................. 85 4.2 Diseño del estudio. ............................................................................................ 88 4.3 Estudio ecográfico ............................................................................................. 89 4.4 Consentimiento del paciente .............................................................................. 92 4.5 Análisis Estadístico ............................................................................................ 93 5. RESULTADOS ....................................................................................................... 94 5.1 Estadística descriptiva ........................................................................................ 95 5.2 Análisis de la homogeneidad de las variables: ANOVA de dos vías. ................ 105 5.2.1 Índice de resistencia de la arteria testicular ................................................ 105 5.2.2 Índice de resistencia del parénquima testicular .......................................... 106 5.2.3 Volumen testicular .................................................................................... 108 5.2.4 Diámetro del cordón.................................................................................. 110 1 Estudio de la perfusión testicular tras hernioplastia preperitoneal 5.2.5 Grosor escrotal .......................................................................................... 112 5.3 Análisis de la homogeneidad de las variables: ANOVA DE 4 VÍAS ................ 114 5.3.1 Índice de resistencia de la arteria testicular ................................................ 114 5.3.2 Índice de resistencia del parénquima testicular .......................................... 115 5.3.3 Volumen testicular .................................................................................... 116 5.3.4 Diámetro del cordón.................................................................................. 121 5.3.5 Grosor del escroto ..................................................................................... 125 6. DISCUSIÓN ......................................................................................................... 130 6.1 Situación actual ............................................................................................... 131 6.2 Consideraciones sobre la ubicación de la prótesis ........................................... 136 6.4 Comentarios sobre la hemodinámica de la región inguinoescrotal .................... 138 6.4.1Efectos sobre el índice de resistencia de la arteria testicular ..................... 138 6.4.2 Efectos sobre el índice de resistencia del parénquima testicular............... 139 6.4.3 Efectos sobre el volumen testicular ........................................................... 142 6.4.4 Efectos sobre el grosor del escroto y el diámetro del cordón ..................... 147 7. CONCLUSIONES................................................................................................. 149 8. BIBLIOGRAFÍA ................................................................................................... 151 2 Estudio de la perfusión testicular tras hernioplastia preperitoneal 1. INTRODUCCIÓN 3 Estudio de la perfusión testicular tras hernioplastia preperitoneal 1.1. ASPECTOS ANATÓMICOS DE LA REGIÓN INGUINAL EN EL ABORDAJE PREPERITONEAL. 1.1.1 Límites Existen multitud de trabajos sobre la anatomía quirúrgica de la región inguinal. La mayoría de ellos enfocan la región inguinal desde una vía anterior. En los últimos años, la difusión del abordaje laparoscópico ha propiciado un interés renovado por el conocimiento de la región inguinocrural posterior, ya que éste es paso obligado para todo cirujano que quiera realizar una hernioplastia preperitoneal, bien sea por vía abierta o videoasistida. Los buenos resultados de esta cirugía se correlacionan estrechamente con el conocimiento de este espacio. La anatomía de la región inguinal está marcada por la complejidad tridimensional de las estructuras que lo conforman. En términos quirúrgicos queda englobada en lo que se denomina el triángulo miopectíneo de Fruchaud. Éste se origina, desde el punto de vista filogenético, por la necesidad de migración testicular fuera de la cavidad abdominal. Este espacio queda limitado por: 1. El tendón conjunto en su parte superior 2. La rama iliopubiana en su parte inferior 3. El músculo recto del abdomen medialmente 4. El músculo psoas ilíaco lateralmente En su cara posterior, este orificio está tapizado por la fascia transversalis que se prolonga por delante del peritoneo hasta alcanzar el conducto femoral. 4 Estudio de la perfusión testicular tras hernioplastia preperitoneal Este espacio queda dividido en dos regiones anatómicamente bien delimitadas por el ligamento inguinal: la región inguinoabdominal y la región inguinocrural. 1.1.2 Región inguinoabdominal. La región inguinoabdominal tiene una configuración de triángulo rectángulo cuyo límite es el pliegue inguinal, que la separa de la región inguinocrural. Por arriba está separada de la región costolumbar por una línea imaginaria horizontal, que se extiende desde la espina iliaca anterosuperior hasta el borde externo del músculo recto anterior del abdomen. Su límite medial lo establece el borde lateral del mismo músculo. La piel suele ser elástica y fácilmente móvil en toda la superficie inguinoabdominal salvo en la región donde se adhiere de forma más intima al arco crural, formando el pliegue inguinal. El tejido subcutáneo presenta varias capas. La más superficial de ellas, es la mal llamada fascia de Camper, debajo de la cual encontraremos la fascia de Scarpa, que consiste en una lámina de tejido de condensación grasa adherida a la piel sin fijación al plano aponeurótico muscular. La fascia de Scarpa deja un espacio entre su inserción en la espina del pubis y el pubis a través del cual discurre el cordón espermático. La fascia innominada queda por debajo de la fascia de Scarpa, de la cual la separa una capa variable de tejido graso que no existe en los sujetos delgados. Ésta recubre la parte externa de la aponeurosis del músculo oblicuo mayor, adherida a la aponeurosis superficial subyacente así como al ligamento inguinal y a la espina iliaca del pubis. A 5 Estudio de la perfusión testicular tras hernioplastia preperitoneal nivel del vértice superior del orificio inguinal superficial determina unas condensaciones fibrosas más o menos numerosas y consistentes. Son las bandas arciformes. A nivel caudal se fusiona con el tejido que la separa del oblicuo mayor contribuyendo a la formación de la fascia espermática. La vascularización a este nivel corresponde a la arteria epigástrica superficial procedente de la femoral superficial que cruza el ligamento inguinal y se extiende por la región. Sus ramificaciones laterales establecen conexiones anastomóticas con ramas de la epigástrica inferior, circunfleja ilíaca y arterias lumbares. Las ramas mediales e inferiores se unen con ramas ascendentes de la arteria pudenda externa superior. Todo este conjunto contribuye a formar todo un círculo arterial anastomótico periabdominal. Las venas de la región constituyen una red de pequeño calibre. Las más gruesas son las venas subcutáneas abdominales visibles en la parte media de la ingle y las venas circunflejas iliacas. Los nervios superficiales son de naturaleza sensitiva y conectan con los nervios intercostales inferiores y a los nervios abdominogenitales mayor y menor. Varios aspectos anatómicos son claves para la comprensión del abordaje preperitoneal: 1.1.3 Espacio preperitoneal Se considera un espacio virtual cuya vía de acceso pasa por la sección transversal de la hoja anterior de la aponeurosis del músculo recto y parcialmente de la de los oblicuos, 6 Estudio de la perfusión testicular tras hernioplastia preperitoneal seguido de la apertura de la fascia transversalis en situación longitudinal y paralela al borde externo del músculo recto hasta su inserción en el pubis. Apenas se abre la transversalis emerge la grasa del espacio retroinguinal de Bogros. Desde esta posición se observa toda la pared inguinal posterior. La dificultad principal en este abordaje está en las diferentes formas de inserción que presenta el músculo transverso ya que hasta en un 20% de los casos se extiende hasta la vaina del recto anterior del abdomen mientras que en otros casos puede desaparecer a pocos centímetro de distancia de la espina iliaca anterosuperior. Esta variabilidad dificulta inicialmente el abordaje, ya que en ocasiones, lo único que se aprecia del músculo transverso es su porción aponeurótica lo que la confunde con la fascia transversalis si es muy delgada. Ello puede desorientarnos en la búsqueda del espacio preperitoneal, conduciendo a una disección demasiado superficial (1). Una vez en el espacio de Bogros se observa desde esta perspectiva toda la pared inguinal posterior, sus puntos o zonas debilitadas, los sacos herniarios y el resto de las estructuras anatómicas que lo conforman. Este espacio queda delimitado por el peritoneo, la fascia transversalis y el músculo transverso y recto con sus respectivas aponeurosis; ocupado por abundante grasa, vasos sanguíneos, linfáticos, nervios y otros elementos del cordón espermático, a ese nivel aún sin su envoltura muscular cremastérica. 7 Estudio de la perfusión testicular tras hernioplastia preperitoneal 1.1.4 Vascularización La arteria iliaca externa discurre medial al borde interno del psoas. Da la rama circunfleja iliaca profunda y la arteria epigástrica inferior antes de pasar bajo el ligamento iliopubiano. En su trayecto, la iliaca externa da ramas al psoas mayor y a los ganglios linfáticos adyacentes. La vena iliaca externa acompaña en su recorrido a la arteria por dentro y posterior a la misma. La arteria epigástrica inferior asciende verticalmente, quedando contenida en el espacio preperitoneal. Desde su origen en los vasos iliacos externos hasta la llegada al músculo recto no da ninguna rama lo que permite realizar una disección con una buena hemostasia. Cerca de su origen, la arteria epigástrica inferior se divide en dos ramas: 1. La arteria espermática externa o cremastérica, que se dirige al anillo inguinal profundo para reunirse con los elementos del cordón. 2. La arteria iliopubiana, que discurre por el ligamento del mismo nombre que acaba en el ligamento de Cooper, donde suele (en el 72% de los casos) dar una arteriola que se dirige hacia abajo hasta su anastomosis con la arteria obturatriz. Esta rama es conocida también como “Corona mortis” por la dificultad de realizar hemostasia en caso de sangrado (2). La vena rectusial se encuentra en la cara posterior del recto anterior del abdomen. Ascendiendo sobre éste da la vena comunicante rectusio-epigástrica que drena en la epigástrica inferior. La anastomosis entre la rama iliopubiana y la vena rectusial completaría un circulo anastomótico de drenaje venoso en la cercanía al tubérculo 8 Estudio de la perfusión testicular tras hernioplastia preperitoneal púbico que constituye un riesgo de sangrado en la disección del espacio preperitoneal (3). Los vasos espermáticos nutren las gónadas. La arteria espermática es rama de la aorta y desciende por el espacio preperitoneal alcanzando el anillo inguinal profundo. El drenaje venoso testicular se inicia en el plexo pampiniforme que asciende por el cordón hasta el anillo profundo; a ese nivel, las venas se reducen a dos o tres vasos que entran en el espacio preperitoneal y siguen a la arteria espermática en su trayecto. En el lado derecho, estas venas drenan en la cava inferior mientras que la izquierda lo hace en la vena renal ipsilateral. La vascularización del testículo procede de tres arterias que presentan distintos orígenes. Estas son: 1. La arteria testicular o espermática. Procedente de la aorta abdominal 2. La arteria deferencial. Rama de arteria seminal inferior. 3. La arteria cremastérica. Rama de la arteria epigástrica inferior. Se sabe que la arteria testicular da numerosas ramas anastomóticas tanto a la arteria deferencial como a la arteria cremastérica en diferentes niveles en su descenso por el cordón espermático al polo superior del teste (4). De hecho, clásicamente se describe cómo la sección alta de la arteria testicular no tiene por qué dar lugar a una isquemia testicular gracias a esta compleja red vascular que tiene lugar en el cordón (5). 9 Estudio de la perfusión testicular tras hernioplastia preperitoneal Las arterias espermáticas son dos largos y finos vasos que se originan en la cara anterior de la aorta, por debajo de las arterias renales. Cada una de ellas discurre oblicuamente hacia abajo y hacia fuera, por debajo del peritoneo y apoyadas en el psoas mayor. La espermática derecha se sitúa por delante de la vena cava inferior y por detrás de la tercera porción duodenal y arterias cólica derecha e ileocólica, raíz del mesenterio e íleon terminal. La izquierda es posterior a la vena mesentérica inferior y colon sigmoide. Cada uno de estos vasos pasa por delante del nervio genitocrural, uréter y parte inferior de la arteria iliaca externa hasta alcanzar el anillo inguinal interno, por donde se introducen en el cordón espermático. Con los demás constituyentes del cordón atraviesan el conducto inguinal y penetran en el escroto. En el extremo superior de la parte posterior del testículo se divide cada una en dos ramas que pasan hacia las superficies interna y externa, perforan la albugínea y finalizan en la túnica vascular. Desde esta última, algunas ramas terminales penetran en la sustancia testicular por varios puntos de la superficie libre. Varias llegan al mediastino testicular y vuelven, mediante un bucle, hacia atrás antes de dar su distribución final. Las venas del testículo, proceden de los lobulillos, van concentrándose hacia el cuerpo de Highmoro, formando una red anastomótica pampiniforme que se integra en el cordón espermático, determinado una buena parte de su contenido y contribuyendo a proteger la arteria espermática y el conducto deferente. La íntima y prolongada relación entre estas venas y la arteria espermática, ha sugerido un posible mecanismo de intercambio de calor a contracorriente a fin de que el testículo reciba su sangre refrigerada (3 grados menos). El entorpecimiento de la circulación venosa funicular conducente al varicocele se ha estimado, por ese motivo, como un factor negativo de la fertilidad. Las venas espermáticas acaban desembocando en la vena cava inferior, directamente la derecha y 10 Estudio de la perfusión testicular tras hernioplastia preperitoneal por medio de la vena renal en el lado izquierdo. Este último hecho está exento de significado clínico, ya que varicoceles izquierdos pueden ser signos de sospecha de alteraciones compresivas a nivel de la vena renal homolateral (6). 1.1.5 Inervación El plexo lumbar queda formado por la unión de ramas anteriores de las raíces L-1, L-2, L-3 y la mayoría de las fibras de L-4, generalmente, una rama comunicante de D-12 a L-1. Posteriormente se divide en múltiples ramas implicadas en el abordaje posterior: - Nervios abdominogenitales (mayor y menor). Proceden básicamente del 1º nervio lumbar, y corren lateralmente y hacia abajo, a través del psoas, hasta alcanzar el espacio preperitoneal. En un punto situado en la parte media de la cresta ilíaca, estos nervios perforan el músculo transverso, para ubicarse entre dicho músculo y el oblicuo menor. Posteriormente a nivel de la espina ilíaca anterosuperior, atraviesan el oblicuo menor y se sitúan por debajo de la aponeurosis del oblicuo mayor. El abdominogenital mayor conduce la inervación del área inguinal anterior y de la región suprapúbica. El abdominogenital menor ausente hasta en el 25% de los casos, tras introducirse en el canal inguinal y alcanzar el anillo inguinal superficial inerva la zona pubiana, da ramas de inervación sensitiva para el cordón espermático y el escroto en el hombre o para los labios mayores en la mujer. Gracias a su ubicación resulta difícil producir una lesión de cualquiera de estos nervios en el campo preperitoneal por lo que éstos son raramente afectados, sobre todo cuando el abordaje es realizado desde la línea 11 Estudio de la perfusión testicular tras hernioplastia preperitoneal media, donde la lesión es prácticamente imposible por la lejanía de estas estructuras al punto de entrada. Sin embargo, en la incisión de Nyhus existe mayor probabilidad de lesión si ésta se alarga en exceso lateralmente - Nervio genitocrural. Es la rama que más frecuentemente se lesiona en cirugía herniaria (7; 8). Tras formarse en L-1 y L-2 aparece entre el psoas y el borde anteromedial del fascículo iliaco descendiendo sobre el mismo hasta dividirse en sus ramas genital y femoral poco antes de atravesar el anillo profundo para penetrar en el conducto inguinal. La rama genital se une al cordón espermático dentro del conducto inguinal proporcionando inervación al músculo cremastérico, inervación escrotal y de las caras mediales de los muslos. Esta rama presenta riesgo de lesión en la movilización de cordón espermático y en las maniobras de reducción de un saco herniario indirecto o cuando la malla abraza con un exceso de tensión el cordón (7). Su lesión es fácil tanto durante un abordaje posterior laparoscópico como en una técnica de Shouldice. Su traumatismo provoca dolor postoperatorio inguinal irradiado al escroto. La rama femoral desciende con el psoas, englobado en la fascia iliaca o por encima de la misma. Pasa por debajo del ligamento inguinal y se distribuye en la piel de la zona anterosuperior del muslo. Este hecho aumenta el riesgo de lesión cuando por la fibrosis de la malla ésta se fija lateral al orificio inguinal profundo, sobre el ligamento inguinal. En ocasiones esta rama se une al trayecto de la arteria femoral y puede reencontrarse o bien dentro del canal femoral o bien fuera de la vaina del mismo. Su lesión produce dolor inguinal irradiado hacia el muslo. 12 Estudio de la perfusión testicular tras hernioplastia preperitoneal El nervio femorocutáneo. Se origina en las raíces L2-L3 y emerge por el borde lateral del músculo psoas ilíaco, justo por encima de la cresta ilíaca. Se sitúa entre el músculo ilíaco y la fascia ilíaca, finalmente alcanza el muslo por debajo del ligamento inguinal; comúnmente medial e inferior a la espina ilíaca antero superior. La vulnerabilidad del nervio femorocutáneo lateral está magnificada cuando existe un incremento del tamaño abdominal: Aumento del contenido pélvico por incremento de la presión abdominal durante el embarazo, obesidad, ascitis o tumores (9). Es prácticamente imposible la lesión de este nervio por la vía anterior. Sin embargo por la vía posterior se tiene visión directa del mismo en la disección del psoas y las lesiones son frecuentes en cirugía laparoscópica (8;10;11). La lesión de este nervio puede ser provocada por la colocación de material de fijación (sutura, agrafes, helicosuturas) en las cercanías de la espina iliaca anterosuperior. La clínica es de dolor inguinal que se irradia sobre la superficie lateral de la nalga (12). Los nervios crural y obturador no tienen riesgo de lesión durante el abordaje posterior. El nervio crural se encuentra bajo la fascia iliaca quedando lejos del campo de disección preperitoneal. El nervio obturador se encuentra en una situación muy inferior, a nivel del agujero homónimo sin relación con el campo operatorio. 1.1.6 Elementos anatómicos A. El anillo inguinal profundo 13 Estudio de la perfusión testicular tras hernioplastia preperitoneal Tras la disección del cordón espermático o del saco herniario indirecto vemos el anillo inguinal profundo que se nos presentará con una morfología diferente según el grado de deformación producido por la hernia. Éste está formado por las fibras aponeuróticas del transverso. En su superficie queda cubierto por la fascia transversalis. B. Ligamento iliopubiano de Thomson Constituye la concentración aponeurótica inguinal del músculo transverso, desde la espina iliaca anterosuperior hasta la rama superior del pubis y del ligamento de Cooper, que se proyecta de forma paralela al ligamento inguinal y con el que podría confundirse. C. Ligamento iliopectíneo de Cooper Es el refuerzo perióstico de la rama ascendente del pubis, entre la rama superior del pubis y la unión entre la fascia transversalis y ligamento iliopubiano quedando por dentro de la línea pectínea. El ligamento de Cooper es de vital importancia en la herniorrafia puesto que soportará los puntos de sutura de la herniorrafia crural. En nuestra técnica su importancia radica en ser referencia anatómica clave en la disección del espacio preperitoneal. Aunque el ligamento de Cooper suele ser de fácil identificación, en ocasiones su localización queda dificultada por grandes hernias directas. Suele percibirse por contacto más que por visión directa, en la base del pliegue umbilical lateral, entre este último y la salida del conducto deferente. En cualquier caso, es preceptivo tener en cuenta la existencia de la vena iliopubiana y, en ocasiones, la vena retropúbica, que 14 Estudio de la perfusión testicular tras hernioplastia preperitoneal discurre por la cara posterior del ligamento y de la rama ascendente del pubis que puede desgarrarse con facilidad si la disección no se lleva a cabo con cuidado (3;13). D. Fascia transversalis La fascia transversalis es la capa de tejido fibroso y celuloadiposo que cubre la cara posterior del músculo transverso y su aponeurosis, separándolos de tejido preperitoneal y formando pared posterior del conducto inguinal. Es densa sobre la aponeurosis del músculo transverso a la que está muy adherida mediante pequeñas fibras que atraviesan los fascículos del músculo aponeurótico del transverso y se unen con la hoja profunda de la fascia interparietal que queda entre este músculo y el suprayacente. Se introduce por el anillo interno del conducto inguinal formando una bolsa de revestimiento del testículo y del cordón. Al llegar a nivel de los vasos femorales se relaciona íntimamente con la vena y cierra el espacio interno de la misma al insertarse en la cresta pectínea. En el resto de la pared inguinal es delgada, frágil e incluso a veces inexistente. En ese área se extiende entre la arcada del transverso por encima y la cintilla iliopubiana y el ligamento de Cooper, por debajo constituyendo la zona de mayor predilección herniaria. La presión intrabdominal y el tono muscular fisiológico tensan la fascia transversalis, acentuando la oblicuidad del cordón y aproximando los pilares que cerrarán el orificio inguinal profundo. La porción inferior e interna de la fascia transversalis se fusiona con el músculo transverso y forman una bandeleta arqueada de concavidad inferior hasta su inserción 15 Estudio de la perfusión testicular tras hernioplastia preperitoneal en la rama superior de pubis. Es el llamado arco de Douglas o arcada del transverso. En el mismo lugar se inserta con las fibras del discutido (13; 14) tendón conjunto. E. El conducto deferente El conducto deferente sigue su camino desde el testículo hasta el anillo inguinal profundo incorporándose al cordón espermático. Una vez atravesado el anillo inguinal profundo desvía su camino dirigiéndose en dirección posterior y medial alejándose del resto de los elementos del cordón. Después cruzará los vasos iliacos externos por encima, entrando en la pelvis menor. La arteria deferencial, saliendo de la arteria seminal inferior, acompaña al deferente rodeándolo en su camino. La deformación a la que se ve sometido el anillo inguinal profundo por la existencia de una gran hernia indirecta y las adherencias de este saco al cordón espermático pueden hacer difícil la identificación del conducto deferente. El ligamento de Hesselbach, que se encuentra medial al anillo inguinal profundo, entre las fositas inguinales externa y media, pueden servirnos como referencia para localizar el deferente ya que queda inferior y lateral a éste una vez abierto. El área entre el conducto deferente medialmente y los vasos espermáticos internos lateralmente se ha dado en llamar el triángulo de la sentencia o de la perdición (triangle of doom) (15). Su nombre viene dado en referencia a la seriedad de la lesión de los vasos iliacos externos, por lo que se debe tener especial cuidado en la disección de la zona, teniendo en cuenta la existencia de la vaina femoral que, por su grosor, hace difícil de identificar estos vasos. Lateral a esta región se encuentra el triángulo del dolor 16 Estudio de la perfusión testicular tras hernioplastia preperitoneal o zona de riesgo eléctrico (“electric hazard zone”), ya que el uso de electrocauterio y/o helicosuturas sobre el iliopsoas puede lesionar estructuras nerviosas (femorocutáneo, rama femoral del genitocrural y nervio crural), y ocasionar secuelas neurológicas incapacitantes. F. Músculo psoas ilíaco. El interés que tiene esta estructura se justifica por ser un elemento de referencia en el abordaje preperitoneal. Dicho músculo marca el límite de la superficie de disección que debemos explorar en busca de sacos herniarios. Sobre él descansan importantes nervios a su llegada al espacio preperitoneal como el genitocrural y el femorocutáneo por lo que habrá que evitar la colocación de elementos de fijación sobre dichas estructuras. 1.2 HISTORIA SELECTIVA DEL ABORDAJE PREPERITONEAL La historia del abordaje preperitoneal de la hernia inguinal puede dividirse en dos partes: la historia de la anatomía del espacio preperitoneal y la historia de la herniorrafia preperitoneal. La primera alusión conocida sobre la hernia corresponde al papiro de Ebers (1500 a. de C.) “un tumor en los genitales, en el que se mueven los intestinos”. 17 Estudio de la perfusión testicular tras hernioplastia preperitoneal En la era Brahmánica (800-500 a. de C.) existen referencia de celiotomías realizadas por los hindúes. La primera mención relativa abordaje preperitoneal se fecha en 1743, cuando M. Jonquières traduce un artículo original de Demetrio de Cantemir en el que habla de la sobresaliente habilidad de los habitantes de Albania para el tratamiento de la hernias: “El operador comienza con una incisión en la parte baja del abdomen, abriendo inmediatamente el peritoneo; después de reducir el contenido herniario, el orificio peritoneal es suturado fuertemente. La herida frotada con manteca de cerdo y cauterizada con un hierro al rojo vivo, es dejada abierta hasta su cierre por segunda intención en el plazo de 20 a 40 días. Esta operación la realizan sobre cualquier paciente y a cualquier edad. Aunque su método es rudo, ellos aseguran que rara vez mueren más de dos pacientes de cada cien que intervienen….” (16). Los griegos fueron los primeros en utilizar maniobras de taxis para la reducción herniaria. Aulio Cornelio Celso desarrolló una intervención que implicaba la disección del saco de las estructuras del cordón con el sacrificio del testículo (17). Dos médicos bizantinos, Aecio de Amida (siglo VI A.D.) y Pablo de Egina (siglo I A.D.) describieron dos técnicas para el tratamiento de la hernia inguinal, mediante la resección del peritoneo prolapsado y la cauterización de la ingle. Estos métodos probablemente se derivaron de los textos de cirujanos griegos anteriores, a los cuales ellos añadieron sus propias y muy precisas observaciones. El estudio de los textos médicos y literarios bizantinos demuestra que las técnicas quirúrgicas para el tratamiento de la hernia inguinal fueron practicadas en aquel entorno y luego ejercieron influencia sobre la cirugía árabe y europea (18). 18 Estudio de la perfusión testicular tras hernioplastia preperitoneal Jean-Annet Bogros (1786-1825), anatomista y cirujano francés, fue el primero en describir un espacio triangular en la región iliaca. Este espacio fue redescubierto por Bendavid que habló del espacio de Bogros como una extensión del espacio de Retzius. Según Bogros, este espacio se ubica entre el peritoneo y la lámina anterior de la fascia transversalis. Sin embargo en el concepto moderno de espacio de Bogros, éste se encuentra entre el peritoneo y la lámina posterior de la fascia transversalis. El espacio prevesical de Retzius fue descrito por Retzius en su tesis (19). El acceso posterior o transperitoneal al espacio preperitoneal se conoce desde el imperio romano (20). Varios cirujanos deben ser nombrados en este aspecto. Hutchinson (21) fue el primero que trató una hernia inguinal incarcerada abriendo la cavidad abdominal (1878). La primera laparotomía electiva para el tratamiento de una hernia inguinal fue realizada por Keetley (22) en 1886. Robert Lawson Tait (1845-1899), enemigo de Lister, se negó a ver ninguna relación entre las bacterias y las infecciones de herida quirúrgica. Fue el precursor en el acceso intrabdominal para el tratamiento de la hernia comunicando un caso de reparación de una hernia no complicada a través de una incisión abdominal. En este trabajo presentó lo que consideró lo principios básicos de esta reparación: no agrandar en exceso el orificio tendinoso por el cual protruye la víscera estrangulada y cerrar tanto el defecto herniario con el peritoneo (23). El uso del espacio preperitoneal por la vía anterior fue descrito por Bogros en su tesis sobre el tratamiento de aneurismas de la arteria iliaca interna con el fin de evitar complicaciones infecciosas por laparotomía (19). 19 Estudio de la perfusión testicular tras hernioplastia preperitoneal No se conoce con certeza cuál fue el primer cirujano en realizar una reparación herniaria utilizando el espacio preperitoneal. Read (20) afirma que fue Annandale, en 1876, el primer cirujano en usar este espacio, pero siempre por vía anterior y realizando importantes aportaciones a la antisepsia y en el uso de las ligaduras. Bassini, en 1887 accede al espacio preperitoneal por la vía anterior, seccionando la fascia transversalis y respetando los vasos epigástricos inferiores. Concluye que la razón del fracaso de la cirugía herniaria es su dependencia de una sola capa de tejido que ocluye el orificio herniario. Así, Bassini razona que reconstruyendo la pared posterior del canal inguinal fijando la aponeurosis de la transversalis y el músculo oblicuo interno al ligamento ilioinguinal puede reconstruir fisiológicamente el canal inguinal (24). Marcy (1837-1924) realizó el mismo abordaje que Bassini pero sin respetar los vasos epigástricos. La era moderna de la cirugía herniaria es la de la cirugía en general. Coincide con el desarrollo revolucionario de la anestesia y la antisepsia. Ambas permiten a los cirujanos ejecutar técnicas regladas que abren una nueva era en el tratamiento eficaz de las hernias de la región inguinal (25). Mahorner y Goss (26) utilizaron por primera vez injertos de piel en la reparación herniaria en pacientes con destrucción de los ligamentos de Cooper y Poupart (1962). Introdujeron la innovación de colocar un injerto en el espacio preperitoneal desde un abordaje anterior. 20 Estudio de la perfusión testicular tras hernioplastia preperitoneal La vía de abordaje posterior al espacio preperitoneal fue descrita por Cheatle (18651951), cirujano inglés del King´s College, quien en 1920, en un artículo en el British Medical Journal titulado “An operation for the radical cure of inguinal and femoral hernia”. En él describe el uso de una incisión paramediana para acceder al espacio de Bogros, con el paciente en posición de Trendelenburg. En 1921, en la misma revista, describe el abordaje preperitoneal por línea media, por donde accede al espacio de Retzius, desplazando lateralmente el músculo recto del abdomen. Cierra el anillo interno con suturas. También llegó a usar incisiones de Pfannestiel para la exploración y reparación de hernias inguinofemorales por vía preperitoneal. Cuando encuentra una hernia incarcerada describe la apertura del peritoneo para la exploración de las asas intestinales. No aconsejaba el uso de esta técnica para las hernias directas ya que el defecto aponeurótico quedaba oculto por la pared posterior del conducto inguinal y se deformaba por la retracción de los músculos rectos. Si trataba hernias crurales, tras la reducción del saco cubría el defecto con un colgajo de periostio procedente de la sínfisis púbica. Cheatle tuvo un impacto mínimo en su época de modo que después de su experiencia, el abordaje preperitoneal prácticamente no se uso durante muchos años. El acceso extraperitoneal debe su origen a este cirujano. George Paul La Roque (1876-1934) llegó a ser jefe del departamento de Cirugía del Medical College of Virginia. Su contribución al tratamiento quirúrgico de la hernia fue una técnica personal (27) que consistía en abrir el peritoneo separando las fibras musculares por encima del orificio inguinal, exponiendo la hernia y el saco desde el interior de la cavidad. Posteriormente, realizaba la disección del mismo, completando la reconstrucción de la pared posterior como Bassini. Aconsejaba el acceso transabdominal porque ofrecía garantía absoluta de lograr una ligadura alta y eliminar el 21 Estudio de la perfusión testicular tras hernioplastia preperitoneal saco herniario, invaginándolo, desde el interior del abdomen, La técnica de La Roque o el acceso intrabdominal a través de un acceso anterior a la hernia se aplicó a las hernias deslizadas y a las estranguladas. En 1936, Henry, cirujano en la universidad de El Cairo, en Egipto, redescubre el abordaje de Cheatle. Conocía bien el espacio anatómico por tratar muchos casos de lesiones ureterales causadas por bilharziosis. Realiza herniorrafias femorales usando la fascia pectínea a modo de colgajo, realizando el cierre alto del saco y suturando la parte inferior del ligamento de Poupart para cerrar el canal femoral (28). Este tipo de cirugía para la reparación herniaria fue llamado de Cheatle-Henry hasta la expansión del abordaje por Nyhus. Es importante destacar que estos autores fueron los primeros en recomendar el abandono del saco distal, evitando los potenciales hematomas y tejido de cicatrización en el trayecto inguinal y escrotal. En 1947, Williams defiende el abordaje de la Roque frente a la incisión mediana de Cheatle-Henry por su mayor simplicidad y mejor visión y acceso al saco herniario (29). Otros muchos cirujanos realizaron herniorrafias por vía preperitoneal: Musgrove y McCready (1948) suturan el anillo inguinal al ligamento ileopectíneo. B.V. McEvedy (30) sutura el tendón conjunto al ligamento iliopectíneo de Cooper. Incide la vaina del recto del abdomen oblicuamente y rechaza el músculo medialmente 22 Estudio de la perfusión testicular tras hernioplastia preperitoneal (no lateralmente) llegando al orificio crural y tratando la hernia (1950). Varios cirujanos americanos en esa época recomendaron esta vía para la hernia crural. Todos estos trabajos influyeron directamente en Nyhus, Condon y Harkins para el desarrollo y el estudio de la técnica que hoy conocemos. Es, por tanto, a través de Nyhus (31) cuando el abordaje preperitoneal conoce su expansión contribuyendo a una mejor comprensión de la anatomía preperitoneal, lo que motivó el acercamiento de otros cirujanos a la técnica. No todo lo que se publicaba era favorable al abordaje preperitoneal. McVeigh et al (32) publicaron algunas desventajas: imposibilidad de usar anestesia local y de realizar incisiones de relajación, la dificultad para resecar completamente grandes sacos indirectos, inexistencia de una fascia transversalis suficientemente consistente para ser la base de la reparación, imposibilidad para usar aponeurosis del oblicuo mayor en la reparación y persistencia del anillo inguinal externo abierto. Estos autores concluían dicha argumentación estableciendo la hernia crural bilateral como la única indicación para este tipo de abordaje. En 1954, Mikkelsen y Berne (33) presentan 113 pacientes intervenidos de hernia crural según acceso de Cheatle-Henry, con resultado satisfactorios. Modificaron la operación de Cheatle anclando la fascia transversalis y la aponeurosis del músculo transverso al ligamento iliopectíneo de Cooper. Estos autores no consideran como contraindicación absoluta la obesidad. Este abordaje llegó a ser el preferido por todos los cirujanos y residentes del Hospital del Condado de Los Ángeles. 23 Estudio de la perfusión testicular tras hernioplastia preperitoneal En 1954, Condon (13) explica cómo, en una reunión de la Society of University of Surgeon en el departamento de cirugía de la University of Southern California, los doctores Harkins y Nyhus tuvieron la oportunidad de discutir con los doctores Berne y Mikkelsen el reciente aporte de estos últimos (33) en relación al abordaje a las hernias femorales . Lloyd Nyhus intuyó rápidamente las posibilidades y de vuelta a Seattle comienza un programa de investigación en el que estudia la aplicación de este sistema a todas las formas de hernia. En 1959, estimulados por el trabajo anterior, Nyhus et al. (34) presentan su experiencia inicial con 50 pacientes operados de hernia a través de una incisión Cheatle-Henry, en los que, tras abandonar el saco distal in situ, cerraban el canal inguinal mediante sutura del tracto iliopúbico de Thomson al ligamento de Cooper. Aunque en algunos casos habían recurrido al empleo de una prótesis esponjosa de alcohol polivinílico, en general no recomendaban el uso de ésta. En la discusión de este articulo (34), Bruce plantea la sustitución de la incisión media por una incisión lateral tipo Mc Evedy, en un intento de solucionar las dificultades de exposición planteadas. Quizá por ello en 1960 publican una nueva serie en que utilizaba una incisión de McEvedy modificada (31). En este trabajo se hace especial énfasis en la fascia transversalis, gracias a un estudio anatómico sobre 20 cadáveres varones “en fresco” en los que se analizaron ambas áreas inguinales. La incisión descrita fue transversa, de unos 3 cm por encima del ligamento inguinal facilitando la exposición de la pared posterior así como la identificación, reducción y tratamiento de la hernia. 24 Estudio de la perfusión testicular tras hernioplastia preperitoneal Este trabajo de Nyhus et al. (31) constituyó el punto de inflexión en el abordaje preperitoneal a partir del cual el abordaje la vía se popularizó a nivel mundial. En 1959, Mansfield en 1959 (35) publicó su experiencia personal durante más de 20 años en 38 pacientes con hernias complejas sin tener constancia de recidiva en un tiempo de seguimiento de 4 años. Mansfield no suturaba el anillo inguinal interno siempre y cuando el saco peritoneal se ligara lo más alto posible. Los cirujanos pediátricos contribuyeron de forma importante al desarrollo del abordaje preperitoneal. La vía preperitoneal fue preconizada por Fowler (36;37). Utilizó la incisión de Mc Evedy ya que le daba la solución a las dificultades encontradas en la cirugía por vía transinguinal, como criptorquidias altas, desgarros peritoneales, estrangulaciones, hernias deslizadas, con lo que evitaba las complicaciones propias de sacos residuales inadvertidos o retracciones testiculares. Fowler (36) describió las ventajas de este abordaje en el tratamiento del testículo no descendido ya que en ocasiones la vía transinguinal es insuficiente para conseguir que el testículo quede fijo en el escroto. Sin embargo mediante la vía preperitoneal puede realizarse la movilización de los vasos testiculares facilitando la ubicación escrotal de la gónada. En 1963, Estrin (38) es el primero en colocar material protésico en el espacio preperitoneal. 25 Estudio de la perfusión testicular tras hernioplastia preperitoneal A partir de 1965 comienzan a aparecer varios trabajos que advierten sobre la alta incidencia de recurrencia tras la realización de una herniorrafia según Nyhus. Así, Dyson y Pierce (39) presentan una recidiva del 35% en hernias directas; Robertson (40) obtuvo un 17% de recidivas en un tiempo de seguimiento muy corto. Tanto Margolis y Braun (41) como Dyson y Pierce (39) descartaron seguir practicando la técnica. En 1975, Stoppa et al (42) aplica el concepto de Presión hidrostática de Pascal a la cirugía de la pared abdominal según la cual no sería necesario la fijación de una gran prótesis de poliéster por la propia presión intrabdominal. La colocación de una gran prótesis preperitoneal constituye, según sus introductores, el “arma absoluta” contra la recidiva (43). Esta técnica está especialmente indicada en pacientes con gran alto riego de recidiva, en hernias bilaterales y hernias recidivadas (44). Nyhus con su abordaje lateral y Stoppa con su técnica desde la línea media suman un gran impulso para el desarrollo de la vía preperitoneal, el cual alcanza su clímax con la aparición de la cirugía laparoscópica en el campo de las reparaciones herniarias. La anatomía preperitoneal se presenta como una entidad poco conocida por los cirujanos generales, lo que ha provocado la proliferación de trabajos sobre el cadáver que rechazan la existencia de algunas estructuras descritas clásicamente como el tendón conjunto (13;15). Actualmente el papel de la cirugía laparoscópica en el tratamiento de la hernia inguinal no está bien está bien establecido. Existen evidencias de sus buenos resultados en cuanto a menor dolor postoperatorio inmediato e incorporación más rápida en el terreno laboral. Sin embargo la curva de aprendizaje es de hasta 250 casos, requiere anestesia 26 Estudio de la perfusión testicular tras hernioplastia preperitoneal general y está asociada a mayores complicaciones intraoperatorias que la técnica abierta (45). Existe una necesidad urgente de realizar estudios clínicos aleatorizados multicéntricos comparando el abordaje laparoscópico y el abierto (46; 47). 1.3 FISIOPATOLOGÍA DE LA HERNIA INGUINAL Aún no ha quedado establecida una etiología definitiva en la fisiopatología de la hernia inguinal, pero parece ser de origen multifactorial. Todos los individuos presentan unas características anatómicas comunes por lo que resulta difícil de explicar cómo tan sólo el 5% de los seres humanos presenta una hernia inguinal (48). Las hernias inguinales en lactantes y niños son siempre hernias indirectas congénitas por persistencia del conducto peritoneovaginal, muchas veces asociadas a otras alteraciones congénitas que afectan a los genitales. Todas las hernias presentan defectos de la fascia transversalis. El orificio miopectíneo de Fruchaud es un área débil limitada por el músculo oblicuo interno, el músculo transverso, el iliopsoas, el músculo recto y la espina del pubis. La integridad de la pared abdominal en la región inguinal depende, por tanto, de la fascia tranversalis, de la disposición oblicua del canal inguinal y de la estructura cuasi esfinteriana del anillo interno (49). Existen numerosos factores predisponentes que incluyen características anatómicas como la persistencia del conducto peritoneo vaginal o la inserción alta del arco 27 Estudio de la perfusión testicular tras hernioplastia preperitoneal transverso; o bien factores asociados a otras enfermedades como la obesidad, la enfermedad pulmonar obstructiva crónica, la hiperplasia de próstata, la ascitis, el embarazo, la estenosis colónica y el estreñimiento (49). Podría pensarse que todos estos factores de riesgo afectan tan solo a las hernias de tipo directo ya que las hernias indirectas han sido descritas clásicamente como congénitas. Sin embargo, el impacto etiológico de la persistencia del conducto peritoneo vaginal no está claro ya que todos los niños con una hernia indirecta presentarán una persistencia peritoneovaginal pero no todos lo que presentarán dicha persistencia tendrán una hernia. Así el proceso vaginal permanece abierto entre el 15% y el 37% de los varones (50). Sólo un pequeño porcentaje de éstos presentarán una hernia inguinal. La continencia del anillo inguinal profundo ha sido relacionada con la forma en “U” que adquiere la fascia transversalis ha dicho nivel. La contracción abdominal produce la movilización del anillo ubicándolo en una posición más superior y lateral, ocluyendo así el anillo inguinal profundo durante los aumentos de presión abdominal. Así mismo, la contracción del músculo oblicuo mayor y del músculo transverso acerca el ligamento inguinal al orificio inguinal profundo, ocluyéndolo. Por tanto, la aparición de una hernia indirecta en el adulto y el anciano puede ser debida al fallo de alguno de estos mecanismos, como el debilitamiento de la fascia transversalis en los bordes del anillo inguinal profundo (31). La edad es un factor importante en la aparición de hernias inguinales. Se ha logrado evidenciar que la edad está asociada a un aumento progresivo en la proporción de fibras de elastina que presenta el ligamento interfoveolar de Hesselbach (50). Estas fibras pueden alterarse estructuralmente con la edad. Además las fibras responsables de la 28 Estudio de la perfusión testicular tras hernioplastia preperitoneal resistencia de este tejido se presentan en menor proporción en sujetos ancianos. Estas alteraciones podrían ser la base de una deformación en la estructura colágena que terminaría por disminuir la resistencia del mismo facilitando la hernia. Excepto en raras ocasiones el trauma y la actividad física extrema no suelen ser causa de hernia inguinal. En cualquier caso la causa que subyace en el desarrollo de todas las hernias es de naturaleza biológica. La investigación moderna está evaluando el papel de ciertos factores biológicos en posibles alteraciones del metabolismo del tejido conectivo. Las enfermedades como los síndromes de Marfan y Ehlers-Danlos, el cutis laxo, la osteogénesis imperfecta y la luxación congénita de cadera se han asociado a una mayor frecuencia de patología herniaria (51). Algunos autores han intentado sin éxito observar algún grado de hipermovilidad articular en pacientes afectados de hernia inguinal por lo que, el hipotético metabolismo alterado no tiene repercusión clínica articular (52), aunque se ha encontrado una irregular distribución del colágeno en el tejido conjuntivo de la dermis profunda en pacientes afectados de hernia inguinal (53). Varios trabajos estudian la expresión de ciertos tipos de colágeno así como ciertas disfunciones enzimáticas en este tipo de pacientes. En ellos se relaciona las características estructurales con la actividad colágena en pacientes con hernia inguinal, así como su degradación a través de metaloproteasas, de la cual se observa una expresión aumentada (54). Esta enzima participa en la degradación de matriz extracelular, actuando sobre ciertos tipos de colágeno y elastina. Su expresión también está aumentada en entidades como el prolapso genitourinario y el aneurisma de aorta (55). Además, estas enfermedades presentan una incidencia mayor de hernia inguinal 29 Estudio de la perfusión testicular tras hernioplastia preperitoneal (56) , lo que orienta hacia un mecanismo común que explique cómo algunos pacientes presentan la fascia transversalis sin alteraciones y otros presenten defectos que impliquen patología herniaria. Algunos autores sugieren incluso realizar screening ecográfico de la población de más de 55 años, fumadores que presenten una hernia inguinal para el diagnóstico precoz de un posible aneurisma de aorta (56). Existiría por tanto un grupo de pacientes jóvenes que, sin patología o factores de riesgo asociados presentarían un defecto estructural en la fibra colágena que puede facilitar la aparición de una hernia inguinal. Estos hallazgos podrían invitar a valorar la fisiopatología de la hernia desde una perspectiva sistémica que tendría un punto de expresión a nivel inguinal. Ello podría servir de argumento para aquellos que sugieren la utilización de material protésico en este tipo de pacientes (57). Muy recientemente se ha descrito como la concentración de TIMP-2 (inhibidor tisular de metaloproteasas) está disminuida en la fascia transversalis de sujetos con hernia inguinal directa lo que explicaría la mayor expresión de metaloproteasas a éste nivel (58). Así mismo, se describen factores ambientales como el tabaquismo, capaz de de generar proteasas y elastasas que degradan las fibras colágenas en los distintos tejidos conectivos y que por esta vía se asocian al desarrollo de hernias inguinales (59). 30 Estudio de la perfusión testicular tras hernioplastia preperitoneal 1.4 DIAGNÓSTICO El diagnóstico de una hernia inguinal suele ser clínico. Muchos dolores inespecíficos en la región inguinal o incluso más altos pueden deberse al inicio de la aparición de una hernia por lo que es importante la exploración de los orificios herniarios. Este es el primer gesto clínico a realizar en caso de obstrucción intestinal. El diagnóstico diferencial de la tumoración inguinal implica la presencia de hiperplasias de adenopatías linfáticas por enfermedades hematológicas, tumorales, venéreas o como reacción a infecciones de herida en miembro inferior. La transiluminación constituye un elemento diferenciador entre el hidrocele y la hernia inguinoescrotal. La exploración manual del paciente conviene hacerla en bipedestación. El dedo del explorador debe colocarse en la parte más baja del escroto, invaginando el mismo hacia el conducto inguinal podemos tocar el anillo inguinal externo y en ocasiones el interno. Provocando un aumento de presión abdominal (Valsalva) podremos notar el saco sobre la punta del dedo. La hernia directa casi nunca, por definición, baja al escroto y la sensación de choque proviene de la pared posterior. Un cirujano experimentado podría diferenciar una hernia directa de una indirecta en un 70% de los casos (49). La exploración de la región crural es más dificultosa sobre todo en enfermos obesos. Resulta más fácil su diagnóstico en caso de hernia incarcerada en la que se observa una 31 Estudio de la perfusión testicular tras hernioplastia preperitoneal tumoración por debajo del ligamento inguinal y dos traveses de dedo por dentro de la arteria femoral. En ambos sexos, las hernias inguinales muy pequeñas o incipientes pueden convertirse en un reto diagnóstico. Su exploración es difícil incluso con maniobras de Valsalva, sobre todo en pacientes obesos o con cirugía previa. La ecografía, acompañada de Valsalva, es capaz de distinguir una hernia inguinal con una sensibilidad y especificidad cercana al 90% (49). Mientras que su capacidad para diferenciar una hernia directa de una indirecta no es mayor del 73%. Dada su eficacia e inocuidad, la ecografía constituye una buena prueba diagnóstica en estas situaciones. Permite una exploración de forma fisiológica aunque suele ser explorador-dependiente. Los errores habituales pueden minimizarse estandarizando la técnica del examen. Como causa habitual de falsos positivos encontramos los lipomas del cordón espermático. Los falsos negativos pueden estar relacionados con la naturaleza intermitente de la hernia (60). La peritoneografía o herniografía has sido utilizada con cierto éxito en el estudio de la hernia inguinal oculta y es de utilidad en pacientes con dolor inguinal crónico y exploración negativa (61). Esta técnica identifica hasta el 45% de éstas hernias ocultas aunque la técnica también es operador dependiente. Es una técnica cruenta, ya que se realiza tras inyectar un medio de contraste yodado en la cavidad peritoneal para examinar las regiones inguinales y el suelo pélvico (62). Tras inyectar el contraste se realizan las radiografías en diversas proyecciones, permitiendo que el paciente deambule como medio de aumentar la sensibilidad de la prueba. No está exenta de reacciones adversas como la punción accidental de un asa intestinal, rash cutáneo por 32 Estudio de la perfusión testicular tras hernioplastia preperitoneal la solución yodada y falsos negativos asociados al taponamiento del orificio de entrada por la grasa abdominal (63). Las técnicas tomográficas permiten observar el anillo inguinal profundo y el femoral, y sus estructuras. Tanto la tomografía computerizada como la resonancia magnética presentan una alta sensibilidad para detectar alteraciones en la zona. Permiten la detección de complicaciones asociadas como la isquemia o la obstrucción intestinal. Estas técnicas presentan, cuando se realizan asociadas a maniobras de Valsalva, una sensibilidad y especificidad para el diagnóstico de hernias inguinales muy altas (95 %) (64). Actualmente, en caso de que la exploración no sea reveladora y el paciente presente clínica compatible con hernia inguinal se considera que la ecografía es la prueba de elección por motivos de su alta especificidad y sensibilidad así como bajo coste (60). Algunos autores justifican en parte el uso de la vía laparoscópica en el tratamiento de la hernia inguinal primaria porque está puede ser utilizada para el diagnostico de la hernia inguinal oculta contralateral (65). 1.5 CLASIFICACIÓN En el último siglo, los cirujanos han clasificado comúnmente las hernias inguinales como indirectas, directas o crurales. El interés por una clasificación más científica de las 33 Estudio de la perfusión testicular tras hernioplastia preperitoneal hernias inguinales aumentó en a partir de 1950 cuando aparece un nueva generación de herniorrafias que desafían la reparación de Bassini (66). El resultado de una reparación herniaria está muy relacionado con la localización y el tamaño del defecto herniario. Así, el riesgo de recurrencia en una gran hernia directa es 5 veces mayor al de una pequeña hernia indirecta (49). Todas las hernias deben, por tanto, clasificarse de una forma precisa y uniforme con el objeto de realizar estudios reproducibles y comparables. Una clasificación inequívoca es la clave para un control de las técnicas empleadas y de las tasas de recurrencia. La clasificación ideal debe describir claramente la localización y el tamaño del defecto, así como presentar la posibilidad de encajar cualquier tipo de hernia inguinal en su marco. Describiremos las más utilizadas en la actualidad. La clasificación que Gilbert publica en 1989 en el American Journal Surgery (67) describe criterios anatómicos y funcionales que establece perioperatoriamente el cirujano. Éste, con su dedo introducido a través del orificio inguinal interno tras la disección completa del saco en una hernia indirecta, valora el tamaño dicho orificio y la contención del mismo una vez reintroducido el saco con el paciente bajo anestesia local o regional, haciéndole toser en las hernias indirectas. La valoración del piso del conducto inguinal, en el caso de las directas, permite reconocer un fallo total o pequeños defectos. Contempla cinco tipos. Tipo I Se trata de una hernia con un anillo interno pequeño, estrecho, apretado con capacidad de contención tras la introducción del saco y colocación por encima de una prótesis de polipropileno de 6 x 11 cm en forma de paraguas o cucurucho. Tipo II 34 Estudio de la perfusión testicular tras hernioplastia preperitoneal El anillo inguinal profundo está moderadamente aumentado de tamaño y no mide más de 4 cm. Aún tiene capacidad de contención de la prótesis reparadora. Tipo III Anillo inguinal profundo de más de 4 cm y el saco a menudo tiene un componente de deslizamiento escrotal que puede incidir sobre los vasos epigástricos. Tipo IV Es una hernia directa. Todo el piso del canal inguinal está defectuoso. Forma una completa protrusión del mismo a pesar de que el anillo inguinal profundo esté indemne. Tipo V Presenta también defecto directo, pero no de todo la pared posterior, sino de pequeños defectos diverticulares de no más de 1 ó 2 cm. de diámetro. La clasificación de Nyhus, basada en los descubrimientos de la anatomía preperitoneal ya comentados por parte de éste y de Condon (31) se basa en criterios anatómicos que comprenden, tanto el calibre del orificio inguinal interno como la consistencia de la pared posterior. Tipo I Hernia inguinal indirecta con anillo interno normal Tipo II Hernia inguinal indirecta con anillo interno aumentado de tamaño Tipo III 3a: Hernia inguinal directa 3b: Hernia inguinal mixta o en pantalón 3c: Hernias crurales Tipo IV 35 Estudio de la perfusión testicular tras hernioplastia preperitoneal Todas las hernias recurrentes La clasificación de Rutkow y Robbins (68) es una ampliación de la propuesta por Gilbert, añadiendo 2 tipos más: Tipo VI: Hernias con componentes directo e indirecto (mixtas, en pantalón). Tipo VI: Todas las hernias crurales. La Clasificación de Aachen, descrita por Shumpelick (49) es simple, fácilmente usable con cualquier técnica (incluso laparoscópica). Primero se clasifica la localización del defecto: M: para defectos mediales, directos L: para defectos laterales, indirectos F: para defecto femorales Posteriormente se clasifica el defecto según su tamaño en tres categorías: I: defecto menor de 1.5 cm II: defecto entre 1.5-3 cm III: defecto mayor de 3 cm Los autores estiman que como referencia para la medida del defecto por término medio el dedo del cirujano mide, con un variabilidad pequeña, 1.5 cm. Por vía laparoscópica, la longitud de las tijeras es de 1.5 cm por lo que puede utilizarse como estándar de referencia en esta técnica. 36 Estudio de la perfusión testicular tras hernioplastia preperitoneal 1.6 HERNIORRAFIAS. REVISIÓN Y ESTADO ACTUAL. 1.6.1 Intervención de Bassini. Bassini presentó su operación por primera vez ante la Sociedad Italiana de Cirugía reunida en Génova el 7 de abril de 1887 (24). En esa ocasión leyó un trabajo titulado "Sulla cura rodicalle dell´ Ernia Inguinale". Fundamentó su exposición en 42 hernioplastías realizadas en 38 pacientes, 22 de las cuales habían sido seguidas en el postoperatorio desde 6 a 28 semanas, sin advertir recidivas. Los restantes tenía menos de 6 meses de intervenidos. No habría en la serie mortalidad. Esta técnica revoluciona el tratamiento de la hernia inguinal. Basándose en el exacto conocimiento de la anatomía inguinal, pretende restaurar la oblicuidad del canal inguinal. La exposición del campo implica una incisión tomando como referencia la espina iliaca anterosuperior y el pubis. Tras la disección del tejido celular subcutáneo se procede a la incisión de la aponeurosis del oblicuo mayor hasta el orificio inguinal superficial. Se realiza la disección de los dos colgajos de la aponeurosis del oblicuo mayor seguido del aislamiento del cordón espermático. Se procede a la disección del cremáster y extirpación del mismo. Se aísla el saco herniario con ligadura y sección del mismo a nivel del orificio inguinal interno. Se abre la fascia transversalis desde el orificio inguinal profundo hasta el pubis, separando la misma de la grasa preperitoneal. La reparación en si implica la realización de puntos sueltos de material irreabsorbible que incluye la “triple capa”, formada por el oblicuo menor, transverso y fascia 37 Estudio de la perfusión testicular tras hernioplastia preperitoneal transversalis. Esta “triple capa” es suturada al borde externo seccionado de la fascia transversalis y al ligamento inguinal. Tras reponer los elementos del cordón se sutura la aponeurosis del oblicuo mayor, dejando el orificio inguinal superficial para la salida de los elementos. Es difícil evaluar con rigor los resultados obtenidos con la operación de Bassini ya que en la mayoría de los casos se emplean modificaciones de la técnica que no se ciñen a su descripción original (69). Bassini realizó 262 intervenciones entre 1885 y 1890 con sólo un 2.7% de recurrencias al año (70). 1.6.2 Intervención de Shouldice. También llamada herniorrafia canadiense, fue desarrollada por el Dr. E.E. Shouldice y sus colaboradores. Empezó a realizarse a comienzos de los años cincuenta, pero no sería hasta finales de la década cuando se dio a conocer en la literatura quirúrgica (69;71). Desde que esta operación se dio a conocer en 1945, se han reparado 280000 hernias en el Hospital Shouldice. En un estudio del autor, de 3799 reparaciones sólo 2.2 % de las hernias tratadas recurrieron (72). Esta técnica está considerada en el momento actual como el gold estándar de las técnicas de reparación anatómica. La comparación con los resultados de esta técnica es obligatoria para la validación de toda técnica novedosa (73). 38 Estudio de la perfusión testicular tras hernioplastia preperitoneal Esta técnica suele realizarse bajo anestesia local y sedación. La intervención se inicia con la infiltración de la piel y del tejido celular subcutáneo mediante una solución de lidocaína, bupivacaína y adrenalina. Se procede al bloqueo de los nervios ilioinguinal e iliohipogástrico, infiltrando el anestésico por debajo de la aponeurosis del oblicuo mayor. Tras la apertura del oblicuo mayor se individualiza el cordón, que se realiza en las proximidades del pubis. Se realiza una sección longitudinal de la musculatura cremastérica llegando hasta el orificio inguinal profundo. La extirpación del cremáster tiene como objeto la identificación de los elementos del cordón, visualizando así los posibles sacos herniarios indirectos y ofreciendo una perfecta visión de la pared posterior. En los sacos indirectos, éstos no tienen porque extirparse en caso de dificultades en la individualización del mismo ya que la extirpación no tiene consecuencias en la recidiva y si aumenta el dolor postoperatorio. Se realiza la apertura de la fascia transversalis (ya preconizada por Bassini como se ha mencionado) en todo su trayecto desde el orificio inguinal profundo hasta el pubis. Se separa la grasa preperitoneal de las estructuras subyacentes, procediendo a la individualización y visualización del arco aponeurótico transverso. La reparación implica varias líneas de sutura. La primera de ellas se inicia con una sutura de nylon monofilamento de 2/0, que comenzando en las proximidades del pubis aproxima el tracto iliopubiano al arco aponeurótico del transverso. Esta sutura llega hasta el orificio inguinal profundo a cuyo nivel se incorpora el muñón cremastérico, creando una verdadera corbata que hace las veces de esfínter al cordón. Esta sutura vuelve para finalizar en el pubis. La segunda línea de sutura se aproxima el músculo oblicuo menor al ligamento inguinal. 39 Estudio de la perfusión testicular tras hernioplastia preperitoneal El cierre de la aponeurosis del oblicuo mayor comienza con la reconstrucción del orificio inguinal superficial, procurando no constreñir el cordón. La simplicidad, los excelentes resultados y la relación coste-efectividad de ésta técnica hacen que sea una técnica de referencia para técnicas protésicas y laparoscópicas (73). La mayoría de los estudios indican que el dolor postoperatorio inmediato es mayor en el Shouldice que en la laparoscopia (74;75) aunque parece no existir relación entre la técnica usada y los dolores crónicos (76). Existe aún gran controversia acerca de si aún tiene aplicabilidad en la hernia inguinal primaria (77) o debe realizarse hernioplastia en todos los casos (57). En cualquier caso, parece lógico admitir que el coste de esta reparación es muy inferior al de la cirugía por laparoscopia e incluso al de la cirugía protésica. A cualquier técnica le será difícil ofertar menor coste que el Shouldice en cuanto a materiales desechables (12.87 dólares por paciente) (72). 1.6.3 Intervención de Nyhus. Desde la descripción de la técnica original (31), Nyhus y sus colaboradores han intervenido más de 1200 hernias primarias con la reparación del ligamento iliopubiano (78). La técnica original de Nyhus comienza con una incisión transversa a unos 3 traveses de dedo por encima de la sínfisis púbica, lateralizada del lado herniario. Diseca el tejido celular subcutáneo y realiza una incisión similar a la anterior sobre la aponeurosis del 40 Estudio de la perfusión testicular tras hernioplastia preperitoneal recto, prolongada unos 2 cm. sobre la aponeurosis de los músculos oblicuo y transverso, lo que permite la apertura de la fascia transversalis seguido de la disección roma del espacio preperitoneal en sentido lateral y ascendente, hasta identificar el saco herniario. Los vasos epigástricos inferiores pueden ser ligados y seccionados si es necesario para una mejor disección del saco. En la hernia indirecta, tras disecar el saco peritoneal y separarlo de los vasos gonadales y del deferente en su totalidad, Nyhus lo abre sólo para explorarlo o devolver su contenido a la cavidad abdominal. Si la porción distal permite una disección fácil se tiende a liberarla y a resecar previa ligadura o sutura. Si por el contrario, la porción distal del saco está muy adherida, no lo diseca, solo lo secciona y liga proximalmente, abandonando distalmente el saco in situ. Después repara el defecto herniario identificando la cintilla iliopubiana de Thompson y la sutura al arco transverso, empezando desde la espina iliaca hasta el anillo inguinal profundo, dejando los vasos gonadales y el deferente en la posición más lateral posible haciendo un “neoorificio” inguinal profundo. Realiza de forma sistemática una incisión de relajación (tipo Lampe) sobre la aponeurosis del músculo recto, antes de proceder a la herniorrafia. En la hernia directa, el contenido del saco es reducido por tracción y abandonado en el espacio intraperitoneal. El saco se invagina, plica o reseca según su tamaño. El cierre del defecto herniario lo realiza de igual forma, con puntos de nylon monofilamento desde la fascia transversalis y el músculo transverso a la cintilla iliopubiana. Nyhus sólo utiliza malla de polipropileno en las hernias recidivadas o en las hernias difíciles. En el resto de la hernias realiza una herniorrafia simple como se ha descrito. Cuanto implanta una prótesis, primero hace la herniorrafia y luego añade la prótesis de polipropileno. 41 Estudio de la perfusión testicular tras hernioplastia preperitoneal En nuestro país, Dávila et al cuentan con una dilatada experiencia en el campo preperitoneal (79). Han introducido algunas modificaciones en cuanto a la indicación: Dávila utiliza en todo momento una malla en la reparación lo que en su experiencia disminuye ampliamente el número de recidivas guardando una equivalencia en porcentaje de recidivas similar a otras técnicas protésicas de la vía anterior. Sus resultados en 576 hernioplastias en hernia inguinal primaria muestran un 0.52% de recurrencia. La recurrencia en reintervenciones por vía preperitoneal de hernias recidivadas por la vía inguinal anterior es de 0% en 128 casos. 1.6.4 Intervención de Lichtenstein. Varios años antes del uso sistemático de mallas en la reparación de la hernia inguinal primaria, Lichtenstein (80) aconsejó el uso sistemático de la anestesia local, deambulación inmediata y corta estancia hospitalaria. En 1989, Lichtenstein (81) publica la aplicación de una técnica protésica, la llamada hernioplastia libre de tensión. Informan del tratamiento de 1000 enfermos con complicaciones mínimas y tasa nula de recurrencia después de un seguimiento de entre 1-5 años. Propone el uso universal de las mallas en el tratamiento de la hernia inguinal. En 1992, se publican los resultados de 3019 reparaciones de hernia efectuadas en cinco centros diferentes bajo la dirección del grupo de Lichtenstein, que revelaron cifras de recidiva del 0.2% (82). En 1995 se confirma la idea que cirujanos no expertos obtienen muy buenos resultados con la técnica (83). La técnica comienza con la anestesia local de la zona con lidocaína y bupivacaína complementada con sedación intravenosa. Se realiza la incisión sobre el surco cutáneo 42 Estudio de la perfusión testicular tras hernioplastia preperitoneal transverso hasta llegar a la aponeurosis del oblicuo externo. Antes de abrir el mismo se infiltran 5-10 ml de anestésico bajo el músculo. Se moviliza el cordón espermático. Los sacos directos se invierten con material de sutura absorbible con objeto de aplanar la pared posterior. Los sacos indirectos se resecan o se invierten tras su disección hasta la grasa preperitoneal. Se inserta un cono de polipropileno en el anillo profundo dilatado. En los sacos inguinoescrotales la porción distal se deja abandonada si su disección es difícil (84). Se cubre la pared posterior con una pieza de polipropileno de (6 x 10 cm) hendida parcialmente en sentido longitudinal desde el borde lateral hacia el medial para obtener una hoja más baja que abarque 1/3 de la pieza y otra más alta que abarque 2/3 de ésta. El borde inferior de la malla se fija al ligamento inguinal con una sutura continua no isquemiante y el borde superior se fija bajo la hoja superior de la aponeurosis del oblicuo mayor. Se aplican 2 puntos a los cabos de la malla que cruzan por los lados del cordón para garantizar el ajuste de ésta. 1.6.5 Intervención de Rutkow-Robbins. En 1989, animado por los buenos resultados de Lichtenstein y Gilbert con los tapones en forma de sombrilla realizados manualmente, Rutkow y Robbins comienzan a tratar las hernias inguinales por este sistema. En un principio encabezaron la idea de una técnica sin sutura del tapón al defecto herniario, pero rápidamente abandonaron esta idea por el temor a la migración del plug en el espacio preperitoneal como ya se han descrito (85). En 1993 desarrollan, junto a la empresa C.R. Bard, un tapón para hernias 43 Estudio de la perfusión testicular tras hernioplastia preperitoneal diseñado en forma de sombrilla lista para usarse, con una capa exterior ondulada que se combinaba con una distribución interior en forma de ocho “pétalos”. En contraste con el tapón de polipropileno enrollado a mano, el tapón PerFix de Rutkow-Robbins no experimenta colapso sobre sí mismo ya que los pétalos conservan el dispositivo abierto y con forma de cono, garantizando la reparación. El diseño exterior ondulado permite al tapón adaptarse con facilidad a la forma de cualquier defecto herniario (86). La anestesia preferida es la epidural. Se efectúa una incisión de 4 a 6 cm de longitud que se inicia sobre el tubérculo púbico y se dirige hacia la espina iliaca anterosuperior. Se abre la aponeurosis del músculo oblicuo externo se moviliza el cordón espermático a nivel del pubis y se aísla. En las hernias indirectas se procede a la disección de las fibras del músculo cremáster en sentido longitudinal a lo largo del cordón espermático. Considera clave la disección alta del saco pero no su ligadura. Rutkow estima innecesario identificar todos los elementos anatómicos del conducto inguinal ya que ello contribuye a aumentar el dolor postoperatorio. En la medida de lo posible, no secciona el saco, sino que simplemente lo libera e invagina lo que en su opinión evita el desarrollo de una “peritonitis en miniatura” a nivel de la ligadura. El tapón de Perfix se coloca en su posición final justo por debajo de los pilares del anillo interno. La fijación de la prótesis no debe ser isquemiante debe realizarse con material reabsorbible. El tapón protésico no debe volverse visible cuando el paciente tosa a petición del cirujano. 44 Estudio de la perfusión testicular tras hernioplastia preperitoneal En las hernias directas, se diseca de forma limitada el defecto, permitiendo que el tejido graso preperitoneal sea visible. Es en este espacio preperitoneal donde descansará el tapón PerFix. Se considera fundamental la fijación del plug a los bordes del tejido con 8 a 10 puntos separados. En las hernias en pantalón es oportuna la colocación de 2 o incluso más tapones PerFix. Todas las hernioplastias, tanto directas como indirectas, se refuerzan con una segunda pieza plana de polipropileno que se coloca sobre la superficie de la pared posterior del conducto inguinal desde el anillo interno hasta la espina del pubis. La porción superior de este parche esta hendida, permitiendo que la malla abrace al cordón. Rutkow afirma que, a pesar de la colocación de un parche sobrepuesto, el procedimiento no debe confundirse con un Lichtenstein ya que, según Rutkow, el tapón PerFix es mucho más simple, requiere una incisión más pequeña, implica una disección de tejidos muy limitada y disminuye el tiempo operatorio (87). 1.6.6 Intervención de Stoppa. Descrita en 1969, la técnica de René Stoppa como procedimiento para suprimir las hernias de la región inguinal propone el refuerzo del saco visceral colocando una prótesis irreabsorbible en el espacio preperitoneal. Según Stoppa, la resistencia perfecta de la fascia transversalis se puede restablecer colocando una malla en el espacio preperitoneal evitando así, de forma preventiva, la aparición de recidivas o de nuevas hernias. También pretende disminuir la atrofia testicular y las secuelas dolorosas 45 Estudio de la perfusión testicular tras hernioplastia preperitoneal atribuidas a la reparación herniaria ya que se elude la vía anterior, evitando las lesiones de los nervios inguinales así como la disección del cordón espermático. La incisión descrita en primera instancia por el autor (88) es una incisión media, sin embargo la incisión de Pfannenstiel ha sido aceptada por sus beneficios estéticos y la supresión del riesgo de eventraciones en la línea media. Tras la incisión de la piel se incide sobre la aponeurosis del recto anterior del abdomen y parte de la del oblicuo mayor. Se penetra en el espacio preperitoneal tras abrir la fascia transversalis, rechazando el peritoneo parietal hasta alcanzar el pubis. La disección se prosigue hasta el orificio obturador y lateralmente hasta el psoas. Es fácil separar los espacios preperitoneales de ambas ingles con disección roma, aunque en situaciones de cirugía previa es necesaria la utilización del electrocauterio para liberar el peritoneo cicatricial. Esta disección deja al descubierto el espacio retropúbico de Retzius, se avanza hacia abajo por detrás de la rama iliopubiana en el espacio de Bogros, aislando así el pedículo herniario. Los sacos se tratan de distinta forma según adherencias y tamaño, resecando parte del saco en hernias grandes. Cuando el saco peritoneal distal es seccionado se deja abierto y abandonado en su unión al cordón. En hernias deslizadas e incarceradas puede ser necesario para liberarlas al acceder por vía anterior. Se diseca hasta que ningún elemento cruce el espacio prevesical preperitoneal. Se extirpan los lipomas preperitoneales y del cordón. 46 Estudio de la perfusión testicular tras hernioplastia preperitoneal Se diseca el conducto deferente y los vasos testiculares del cordón espermático, separándolos de su inserción en el peritoneo. Esto permite la llamada “parietalización de cordón” de manera que los dos componentes: vasos espermáticos y conducto deferente con trayectorias distintas, descansen sobre la pelvis y que la prótesis envuelva el peritoneo parietal sin tener que hendir la prótesis para su paso. No repara el orificio miopectíneo defectuoso. La malla se coloca primero sobre el lado opuesto del cirujano. Deprimiendo el saco peritoneal con la mano izquierda, abriendo así el espacio parietoperitoneal. Primero se coloca la parte entre el pubis y la vejiga y luego los lados lateroinferiores, zona lateromedial y lateral superior. Extiende completamente la prótesis en el lado opuesto al cirujano y, tras cambiar de posición, se extiende en el lado contralateral. La prótesis se orienta de forma transversa, donde el ancho de la malla es igual a la distancia que existe entre ambas espinas ilíacas anterosuperiores menos 2 cm, y la altura es igual a la distancia entre la sínfisis del pubis y el ombligo. En pacientes obesos, la malla deberá ser lógicamente, más ancha. Stoppa demuestra cómo, siguiendo el principio hidrostático de Pascal, no es necesario fijar la prótesis siempre que ésta sea lo suficientemente grande. Si se considera necesario se colocarán drenajes frente a la prótesis y el cierre de pared se realiza según la técnica habitual. 47 Estudio de la perfusión testicular tras hernioplastia preperitoneal En 1989, Stoppa, publica una serie de 270 casos de hernias recidivadas tratadas con esta técnica con sólo un 1.1% de recidivas (89) lo que la mantiene como una gran técnica para la cirugía de la recidiva herniaria. 1.6.7 La reparación por vía laparoscópica. La primera hernioplastia por vía laparoscópica fue realizada por Ralph Ger en 1982 (90), pero no fue hasta 1990 cuando toma esta opción toma relevancia en el panorama quirúrgico internacional. En la década de los noventa la evolución de la cirugía hacia técnicas mínimamente invasivas culmina con la cirugía laparoscópica. La patología herniaria no escapa a este fenómeno y la laparoscopia añade nuevas posibilidades a un ya saturado campo de posibilidades terapéuticas. Esta expansión, aunque limitada, es ayudada por la amplia aceptación de la colecistectomía laparoscópica y por la incorporación de las mallas a la cirugía herniaria. Existen varias modalidades de abordaje laparoscópico en el tratamiento de la hernia inguinal. La reparación preperitoneal transabdominal (TAPP) requiere la perforación del peritoneo parietal y la penetración en la cavidad abdominal lo que sugiere un aumento teórico del riesgo de perforación vascular e intestinal. La TEP realiza un abordaje totalmente extraperitoneal que evitaría este riesgo. Sin embargo se han realizado varios estudios prospectivos que comparan ambas técnicas y les atribuyen similares morbilidades postoperatorias (91-94). En líneas generales estos estudios reflejan que la TAPP requiere un tiempo de aprendizaje algo menor que la TEP. La TAPP podría estar más indicada que la TEP en casos de prostatectomías donde el 48 Estudio de la perfusión testicular tras hernioplastia preperitoneal abordaje preperitoneal y la colocación de una malla dentro del mismo produce adherencias tanto el espacio de Retzius como en el de Bogros por lo que dificultarían, así mismo posibles intervenciones urológicas (95;96). En cualquier caso hay autores que comunican su experiencia satisfactoria con el uso de la TEP en este tipo de enfermos (97). La TAPP es despreciada por autores que ven como un error la entrada dentro de la cavidad abdominal por la posibilidad de iatrogenia y aunque los metaanálisis realizados hasta la fecha no muestran con claridad ventajas de la TEP con respecto a la TAPP (98;99). Algunos autores manifiestan que con el TEP, el tratamiento de las hernias inguinales vuelve a ser una reparación “intraparietal”. Se debe asumir que lo único que aporta la vía laparoscópica es la opción de completar dicho tratamiento de una forma mínimamente invasiva, con un demostrado beneficio. Por todo ello, se debe empezar a situar el abordaje laparoscópico en el lugar que le corresponde dentro del tratamiento de las hernias y comenzar a hablar en singular, entendiendo con ello que sólo existe una técnica (TEP) y un recurso táctico (TAPP) para casos especiales (reconversión o fracasos de la TEP) (100). El abordaje preperitoneal laparoscópico presenta diversas ventajas sobre los abordajes abiertos convencionales, en especial en lo referente al dolor postoperatorio y al periodo recuperación. Permite tratar el defecto herniario con las ventajas ya enumeradas de cualquier abordaje preperitoneal, como tratar la hernia en el lugar donde se produce cubriendo el orificio miopectíneo con una prótesis y el ya comentado juego de presiones entre el peritoneo, la malla y la pared abdominal (101). Debe considerarse por tanto un avance en la vía de acceso de una técnica clásica más que una nueva técnica en si misma (8;8;45;46;75;102). Así mismo estas ventajas se ven potenciadas cuando se nos presenta un defecto bilateral, ya que la cirugía laparoscópica permite el acceso a ambas 49 Estudio de la perfusión testicular tras hernioplastia preperitoneal regiones inguinales desde la posición media, disminuyendo notablemente la morbilidad postoperatoria. Los autores que manejan esta técnica suelen, además, esgrimir un mejor resultado estético (103). A pesar de estas ventajas el abordaje laparoscópico está lejos ser admitido como patrón de oro en el tratamiento de la hernia inguinal primaria. Varios estudios randomizados se han realizado en este campo, comparando la cirugía abierta y la endoscópica (12;44;45;75;104-107). El VA Cooperative Study (45) es uno de los estudio randomizados recientes con mayor número de casos que comparan ambas técnicas. En él se concluye que la cirugía inguinal abierta es superior a la laparoscópica en el tratamiento de la hernia inguinal abierta. Basan su conclusión en la mayor tasa de recurrencia presentada por el grupo tratado por laparoscopia (10% vs 4.9%). Esto ha llevado a algunos autores a plantearse la posibilidad de que esta vía de acceso deba quedar restringida a grupos muy seleccionados de pacientes como los tratados por expertos en este campo (108) y las hernias bilaterales (109). A pesar de no existir suficiente nivel de evidencia en este punto (por la muestra tan baja de las mayoría de los estudios) este abordaje es preconizado por muchos autores como ideal en el tratamiento de las hernias recidivadas; siempre en la misma línea argumentativa de la virginidad del espacio preperitoneal y del acceso mínimamente invasivo. Otro gran problema añadido del abordaje laparoscópico es la curva de aprendizaje tan importante que implica su implantación y que es reflejo de su dificultad técnica. Si, tal como sugiere Neumayer (45), la curva de aprendizaje implica unos 250 pacientes y un cirujano realiza unas 50 hernias al año de media, se necesitarían unos 5 años para completar el aprendizaje del procedimiento. De hecho las mayores tasas de recidiva publicadas son de estudios realizados al comienzo de la andadura de esta técnica. En 1994 aparecen dos trabajos (110;111) informando de recurrencias del 22 y 50 Estudio de la perfusión testicular tras hernioplastia preperitoneal el 26% respectivamente, haciendo que la comunidad científica al completo dudase de la eficacia de la técnica. Las dos causas más frecuentes de recurrencia son la disección incompleta del orificio musculopectíneo de Fruchaud y el tamaño insuficiente de la malla (12). En cualquier caso, parece útil la realización de la técnica abierta para reducir esta curva de aprendizaje (112). Se ha realizado un estudio detallado del coste (113; 115). Estos estudios son difíciles de diseñar y en ocasiones también lo es su interpretación. Hammond y Arregui han señalado que no sólo se hace frente a los costos directos conocidos, sino también a los indirectos (administrativos, equipo quirúrgico necesario y otros aspectos). Se estima que los costes adicionales por paciente intervenido por vía laparoscópica se basan en el mayor tiempo operatorio y en la mayor necesidad de esterilización de material. Se intenta también calcular costos de impacto social, reflejados en días perdidos de trabajo productivo. Los resultados que añade este último componente apoyan a la cirugía laparoscópica. Sin embargo, hemos de ser conscientes de la enorme dificultad que supone esta evaluación del impacto social, dado que en ocasiones, éste depende más de variables propias del sujeto (interés en retomar actividades laborales, trabajo por cuenta ajena, etc.) que de la técnica quirúrgica en sí. Heikkinen (116) presenta un estudio bien diseñado acerca del coste, pero con el problema fundamental de una potencia estadística baja, con un número de pacientes inferior a 50. Realiza un esfuerzo importante por disminuir el coste adicional que supone el instrumental laparoscópico, sustituyendo materiales caros como los “tackers” o los globos de disección por otro tipo de instrumentos con lo que consigue una aproximación al coste de las reparaciones abiertas y en algunos casos, como en las hernias bilaterales una reducción en el mismo. 51 Estudio de la perfusión testicular tras hernioplastia preperitoneal La lesión vascular es de una incidencia rara pero de gran importancia (8;45) La lesión nerviosa puede ocurrir dando lugar a un dolor inguinal crónico, tanto por lesión del abdominogenital como del femorocutáneo con una incidencia de 0.5-0.6% (12;117) aunque estas lesiones han mejorado en su incidencia en los últimos años dado el mejor conocimiento de los cirujanos acerca de la anatomía de los nervios desde una perspectiva preperitoneal. En el abordaje laparoscópico la fijación de la malla con grapas o cualquier otro material puede dar lugar a un número no despreciable de complicaciones con atrapamiento nervioso, neuralgias, hematoma y osteítis. La incidencia de estas complicaciones puede reducirse sin la fijación de la malla. Ello se consigue a expensas de aumentar el tamaño de la malla para cubrir con seguridad todos los orificios herniarios. En un estudio reciente realizado sobre cadáver humano se elabora un modelo físico-matemático que representa la presión máxima abdominal realizada sobre una malla de 10 x 15 y se concluye que dicha malla es lo suficientemente amplia como para poder prevenir recurrencias sin necesidad de fijarla, siempre y cuando la colocación sea correcta (11). Algunos autores (104;118;119) han dejado de dejado de fijar la malla, especialmente en pacientes con defectos menores de 4 cm (118), recomendando la fijación medial en hernias bilaterales y directas (119). De esta forma, obtienen buenos resultados en cuanto a recidiva con un menor riesgo de neuralgia y coste. Otros autores fijan la prótesis con pegamentos biológicos, evitando la migración y con buenos resultados en cuanto a dolor postoperatorio (118;120) (121). 52 Estudio de la perfusión testicular tras hernioplastia preperitoneal En resumen, la hernioplastia vía laparoscópica puede ofrecer al paciente un menor dolor postoperatorio y como consecuencia de ello una reincorporación laboral temprana. Sin embargo, requiere más tiempo para efectuarse, es más difícil de aprender y es más cara. La hernioplastia laparoscópica está especialmente indicada en pacientes con hernias bilaterales y recurrentes. 1.6.8 La hernioplastia preperitoneal en M La operación se realiza bajo anestesia raquídea en la mayoría de los casos. Se utiliza profilaxis antibiótica mediante Amoxiclavulánico, 2 gr en la inducción, y otras 2 dosis de 1 gr cada 8 h si la cirugía ha sido larga, por dificultad técnica. El abordaje de la región preperitoneal se realiza mediante una incisión transversa tal y como Nyhus describe (31), a dos traveses de dedo por encima del pubis de modo que quede frente al anillo inguinal interno . La disección se realiza sucesivamente a través de piel, subcutáneo y fascia anterior del recto. La exposición del anillo inguinal externo puede ser útil para valorar la posición del anillo inguinal interno. La incisión se realiza a la altura del recto anterior con la apertura bajo electrocauterio de la musculatura oblicua. La disección prosigue de forma roma por la superficie anterior del recto anterior y del músculo piramidal hasta llegar al pubis, permitiendo la identificación del ligamento de Cooper. La fascia transversalis es expuesta e incidida hasta ver grasa preperitoneal con cuidado de no abrir el peritoneo. Éste y la grasa preperitoneal son rechazadas hacia atrás por disección roma. En hernias indirectas, si la movilización de porción distal del saco herniario requiere una disección exhaustiva éste se deja abierto y se liga saco 53 Estudio de la perfusión testicular tras hernioplastia preperitoneal proximal. En hernias directas y crurales el saco se reduce por completo. Los defectos herniarios no se cierran para evitar tensión. La malla colocada se confecciona a partir de una mayor de 15 × 15 cm. obteniendo una pieza final de 12 ×10 cm. aproximadamente que se adapta individualmente a la anatomía de cada paciente. Esta malla se coloca sin fijación, cubriendo todos los potenciales orificios herniarios. La pieza se corta en dirección ascendente mediante dos incisiones que alcanza la mitad de la malla, obteniendo tres divisiones inferiores o prolongaciones: A, B y C. La lengüeta A queda en posición medial, descendiendo caudal al ligamento de Cooper consiguiendo por un lado evitar una posible hernia crural y por otro servir como elemento de fijación de la malla. La presión abdominal fija esta prolongación de la malla contra la rama ascendente del pubis por lo que disecamos 3-4 cm. por debajo del Cooper para que ésta descienda con facilidad hasta su posición definitiva. La lengüeta B queda en posición central y es la más ancha de las tres que configuran la malla. Ésta es plegada hacia atrás en un ángulo de 90º en su colocación de modo que queda situada entre el peritoneo, por arriba y los vasos espermáticos e ilíacos externos por debajo en una extensión de 4-5 cm. Así evitamos abrir un ojal en la malla para el paso del deferente y los vasos gonadales, realizando una parietalización del cordón en sentido craneal, separándolos del peritoneo parietal posterior tras la sección de las adherencias laxas a éste. Esta prolongación cumple la función, al igual que la interior, de servir como punto de fijación de la malla así como para evitar la aparición de una hernia indirecta. 54 Estudio de la perfusión testicular tras hernioplastia preperitoneal La lengüeta C es la más externa de las tres y se encuentra por encima del músculo psoas. Ésta también cumple funciones de autofijación y prevención de recidivas laterales. La anchura de las prótesis está en función tanto de la anatomía del paciente como del tipo de defecto herniario. En una hernia directa grande, utilizaremos una lengüeta A lo suficientemente ancha como para reconstruir la pared posterior del trayecto inguinal, insertando parte de la prótesis por detrás incluso del recto anterior del abdomen. Tras la confección de la prótesis se procede a su colocación en el espacio tridimensional que supone la anatomía preperitoneal. Este punto es clave para el éxito de la cirugía, ya que será la particular anatomía inguinal la que proporcionará los puntos de apoyo a las tres prolongaciones de la malla para que ésta no pueda migrar o deslizarse. Previa a la inserción de la prótesis en el campo operatorio se dobla la prolongación B hacia atrás y hacia arriba. Mientras el cirujano retrae el peritoneo hacia atrás se coloca la malla en esta posición haciendo coincidir la prolongación central con la parte inferior del orificio inguinal interno. Después se suelta la prolongación central colocando la misma en la zona retroperitoneal en contacto directo con los vasos espermáticos asegurando que no quede plegada. La disección del plano retroperitoneal es, por tanto, de una importancia vital para la buena colocación de la malla. La porción C de la malla se despliega sobre el músculo psoas teniendo cuidado de que cubra el saco peritoneal en su porción más lateral. La porción A se coloca en el espacio que queda por detrás del ligamento de Cooper tomando con una pinza de disección el extremo inferior de la malla para descenderla hasta la pelvis menor disecada. Tras la comprobación de la hemostasia se retira la mano que retrae el peritoneo permitiendo que éste comprima la malla sobre la pelvis ósea. El último paso implica asegurar que la 55 Estudio de la perfusión testicular tras hernioplastia preperitoneal malla sobrepase en varios centímetros los orificios herniarios para que estos queden completamente protegidos. De este modo la presión abdominal ejercida sobre la malla hace que esta quede fija en su posición. Es la denominada “autofijación” de Picazo (122). La malla queda en su posición sin tensión, sin haber colocado puntos de sutura y sin ojal para el cordón. El extremo superior de la prótesis se ancla por debajo del la única sutura usada para el cierra de la aponeurosis de polipropileno La indicación más reconocida para la técnica preperitoneal es la reparación de la hernia recurrente ya que el espacio de disección se mantiene libre de adherencias aún a pesar de una cirugía previa por vía anterior. Las hernias deslizadas tratadas por vía anterior suponen, en ocasiones, un problema importante durante la reparación. En la vía preperitoneal este problema es de solución fácil ya que se tiene acceso a la cavidad peritoneal de ser éste necesario. Las hernias incarceradas y estranguladas se resuelven fácilmente pues el abordaje y control de la entrada del saco en la pared inguinal posterior es total. Cualquier tipo de maniobra quirúrgica a este nivel como la quelotomía, la exploración y/o resección del asa serán siempre más seguras a este nivel. En cualquier caso, cuando se acumula experiencia en este abordaje las indicaciones se extienden a prácticamente la totalidad de las hernias inguinales del adulto. 56 Estudio de la perfusión testicular tras hernioplastia preperitoneal 1.7 MALLAS Y HERNIA INGUINAL. En los últimos quince años el empleo de biomateriales para la reparación de la hernia inguinal ha producido un cambio radical en la estrategia quirúrgica. Dos hitos marcan, en nuestra opinión, el devenir de este campo: En 1958, el Dr. Francis Usher (123;124) introdujo el polipropileno en la cirugía de la hernia inguinal. A pesar de la positividad de su experiencia, los cirujanos de la época se mostraron muy escépticos en cuanto a la inclusión de materiales protésicos en el manejo de la hernia inguinal, en parte por la mala experiencia con otro tipo de materiales como el tantalio y en parte por el miedo a la infección que cabria esperar con la introducción de un cuerpo extraño. La aparición de materiales altamente biocompatibles, representados fundamentalmente por el polipropileno (Marlex®) y el teflón modificado en forma de politetrefluoroetileno expandido (PTFE) suponen un importante cambio en la utilidad de los biomateriales. Poco a poco, los biomateriales se fueron usando con mayor profusión, sobre todo el polipropileno, cuya consolidación se produjo tras los trabajos de Lichtenstein y Stoppa (42;80). 57 Estudio de la perfusión testicular tras hernioplastia preperitoneal 1.7.1 Mecanismo de acción de las prótesis Según Stoppa (125), la característica más importante de una malla protésica es su tamaño. De modo que otras cualidades como su grosor, rigidez y porosidad son secundarias. Estudios experimentales y clínicos muestran que las actuales mallas cumplen ampliamente los criterios de Cumberland y Scales (126;127). Tabla 1 Criterios de biocompatibilidad de las prótesis No modificarse ni física ni químicamente por los fluidos tisulares Ser químicamente inerte No producir fenómenos inflamatorios ni reacción de cuerpo extraño No ser carcinogenética No crear fenómenos de alergia ni de hipersensibilidad Tener resistencia mecánica Poder ser esterilizadas Poder ser fabricado o preparado como requiera su uso Las mallas macroporosas son rápidamente incorporadas al tejido de cicatrización de la herida quirúrgica. Son capaces de superar la infección si la colección es drenada y si se instaura medicación antibiótica. Estudio experimentales sugieren que las mallas tienen 58 Estudio de la perfusión testicular tras hernioplastia preperitoneal una función esencial de guía del tejido fibrótico responsable del mecanismo de curación de la hernia (126;127). Como ya se ha comentado en apartado de fisiopatología de la presente introducción, al margen de la perspectiva terapéutica puramente mecánica que implica el uso de material protésico, se han descubierto alteraciones metabólicas en la fascia transversalis de los enfermos de hernia inguinal. Ello supone un dato más que orienta hacia el uso de las mallas. El abordaje posterior ha contribuido particularmente al uso de mallas. Así, tanto en la técnica clásica de Nyhus como en las actuales reparaciones por laparoscopia el uso de mallas es de gran importancia. Actualmente, el uso sistemático de material protésico ha sido valorado de forma crítica (125;128). Estos autores opinan que incluso suponiendo que la integración de una capa plana de polipropileno dentro del tejido de granulación sea óptima, la parte central de un tapón o plug cilíndrico se comportaría como un cuerpo extraño ya que el tejido conectivo no llegaría a dicho nivel. Incluso algunos autores rechazan la utilización del plug por considerarla innecesaria (129). La superficie de total de malla usada difiere según la técnica utilizada (130;131). Así, esto resulta evidente cuando comparamos técnicas como el parche de Trabucco (132) en el que se utiliza un área protésica aproximada de entre 40-50cm2 hasta los 400 cm2 de la prótesis bilateral de Stoppa (133) pasando por los 200 cm2 del parche usado en la técnica laparoscópica. A pesar de tener en común un procedimiento libre de tensión, el mecanismo por el que las mallas ejercen su acción varía según la técnica utilizada. 59 Estudio de la perfusión testicular tras hernioplastia preperitoneal Según Stoppa (125) existen tres grandes grupos de técnicas en cuanto a el modo de acción: 1) Reemplazando la fascia transversalis en el espacio retrofascial usando un parche de entre 100-200 cm2 protegiendo así el área de mayor debilidad del orificio de Fruchaud. Ésta es usada tanto desde una vía anterior por Usher (124;125) como desde la vía posterior por Rives (134). 2) Transformando el peritoneo parietal en una superficie rígida sin posibilidad de albergar saco herniario alguno. Esta es la que más cantidad de malla usa y corresponde a las técnicas de Stoppa (125) y Picazo (122), realizadas desde un abordaje preperitoneal. En esta línea de acción es importante el principio de Pascal ya que gracias a la repartición hidrostática de presiones la malla queda fijada contra la pared abdominal por lo que no es necesario ni la fijación de la malla ni el cierre del defecto herniario. Este tipo de técnica es “el arma absoluta” (125) contra las recidivas y está especialmente indicada en hernias complejas y multirecidivadas. 3) Con la publicación de la técnica de Lichtenstein (81) se inicia un nuevo tipo técnica que usa mallas más pequeñas que rondan los 50 cm2 de superficie, lo que corresponde aproximadamente con la extensión del orificio miopectíneo de Fruchaud. El mecanismo de acción de esta técnica es sutilmente diferente al de las dos primeras descritas ya que ésta malla no puede llamarse un “parche” propiamente dicho; más bien se trata de un mecanismo de “bloqueo” del mecanismo de aparición y crecimiento del saco herniario. Existen varios puntos que conviene subrayar dentro de cada una de estas líneas generales de acción. 60 Estudio de la perfusión testicular tras hernioplastia preperitoneal Cuanto mayor sea el tamaño de la prótesis mayor será su estabilidad y menor la probabilidad de recurrencia. Las grandes prótesis tienen, por tanto, una función mecánica que depende directamente de su tamaño. Las pequeñas mallas colocadas por delante del orificio de Fruchaud producen una fibrosis que será el limitante final de mecanismo de herniación. En estas técnicas, la malla en sí, no constituye un mecanismo de freno a la hernia. De hecho, Stoppa (125) opina que múltiples variantes son posibles en cuanto al tamaño de la zona de debilidad, dependientes de estructuras musculares y sus inserciones, así como de las modificaciones anatómicas propias de las hernias recurrentes que orientan al uso de malla de tamaño variable. Por si fuera poco, existen evidencias ya comentadas de factores metabólicos y bioquímicos (48;53;54;135) implicados en la etiología de la hernia inguinal. Estos factores no serían corregidos por la colocación una malla y por ello, si ésta es de pequeño tamaño, se podría suponer una mayor probabilidad de recidiva a largo plazo (136). Según Shein et al (137), un material protésico debe contar con tres propiedades básicas: Tabla 2 PROPIEDADES BÁSICAS DE UN MATERIAL PROTESICO Buena integración tisular Buen comportamiento cuando está en contacto con el peritoneo Buena resistencia mecánica post-implante En general, las prótesis reticulares suelen tener un buen comportamiento en interfase tejido-tejido de modo que su integración óptima les confiere una buena resistencia 61 Estudio de la perfusión testicular tras hernioplastia preperitoneal biomecánica. Las diferentes variaciones existentes en el mercado actual en cuanto a la disposición espacial de los filamentos de la malla no modifican la integración ni la biomecánica de la malla (138;139). Las diferencias en el tejido de reacción durante la fase de integración son debidas la textura y porosidad de cada material. Así, prótesis con estructura macroporosa (poros de más de 75 µm) tienen una mayor capacidad de integración por las posibilidades de anidamiento que ofrecen a macrófagos, fibroblastos, vasos sanguíneos y fibras colágenas (139). Sin embargo, las mallas microporosas presentan una mayor resistencia a la integración y más facilidad para el encapsulamiento rápido. Aunque aún no se ha conseguido la prótesis ideal, el polipropileno es el más usado en USA (140) por su rigidez y excelente capacidad de integración. Presenta el inconveniente de no poder ser utilizadas por debajo del peritoneo ya que pueden producirse adherencias, con cuadros de obstrucción intestinal. Existen trabajos que informan de una menor capacidad adhesiva de estas mallas si se utilizan tapizadas de derivados de la carbometilcelulosa (141;142). La creencia ampliamente difundida entre los cirujanos de que las mallas “encogen” con el paso del tiempo es sólo parcialmente cierta. Se ha demostrado que en contacto con varios productos químicos las prótesis no sólo pueden encoger sino que también pueden aumentar su tamaño. Aunque se necesitan más estudios para determinar hasta qué punto sucede dicha retracción y cuál puede ser la repercusión en el resultado final de la reparación herniaria, los datos existentes hasta este momento parecen aconsejar el empleo de prótesis que superen ampliamente el defecto, con el fin de reducir el riesgo de recidiva. 62 Estudio de la perfusión testicular tras hernioplastia preperitoneal 1.7.2 Tipos de prótesis a) Prótesis reticulares. Están representadas fundamentalmente por un grupo de materiales no reabsorbibles como el polipropileno (Marlex®, Prolene®, Surgipro®) o el poliéster poliéster (Dacron®, Mersilene®) y otro de materiales reabsorbibles como el ácido poliglicólico (Dexon®) y el poliglactin (Vycril®). Todas ellas tienen en común su conformación en forma de red o malla. Algunas prótesis de última generación intercalan en su estructura biomateriales como el polipropileno con materiales irreabsorbibles (Vypro®). b) Prótesis laminares. Representadas sobre todo por el politetrafluoroetileno extendido (Dual Mesh®) y por el Surgisis® que consiste en una prótesis de origen natural a partir de la submucosa intestinal de cerdo. c) Prótesis compuestas o “composites”. Mezclan los dos tipos anteriores tratando de llevar una función complementaria, según el lugar del implante. Las más extendidas son: - Malla PROCEED® ; compuesta por tres capas: la más interna, que queda en contacto con el peritoneo, de celulosa oxigenada regenerada, la segunda, de polidioxanona, de reabsorción lenta, y la tercera, de polipropileno -Malla PARIETENE®: es de Poliéster con una capa de gel hidrófilo reabsorbible que es el que contacta con las vísceras. 63 Estudio de la perfusión testicular tras hernioplastia preperitoneal 1.7.3 Efectos adversos del polipropileno a) Infección. La infección es una de las complicaciones que causa mayor morbilidad en las cirugías con implantación de material protésico. Puesto que las mallas suponen un cuerpo extraño, desde el principio de su andadura el riesgo de infección ha estado presente en las mentes de los cirujanos. Un hecho comúnmente aceptado es que cuanto más énfasis se ponga en encontrar infecciones más se encontrarán. Así, Bailey et al (143) registraron una tasa de infección de herida quirúrgica del 3% cuando estudiaron de forma restrospectiva historias clínicas hospitalarias. Esta tasa aumento a un 9% cuando se aplicó un programa de vigilancia postoperatoria de la infección. La prevención de la infección quirúrgica tiene un valor indiscutible por los cuidados prolongados que supone esta complicación. La hemostasia se hace esencial, ya que la sangre es un medio de cultivo ideal para las contaminaciones bacterianas, sobre las que destacan el Staphyloccocus Aureus y Staphyloccocus Epidermidis. Debe evitarse la electrocauterización excesiva, así como dejar espacios muertos en los que pueda acumularse tejido desvitalizado. El uso sistemático de la profilaxis antibiótica no parece haber probado su evidencia (144-146) aunque en algunos medios sí ha demostrado su eficacia (147). Si a pesar de la preparación cutánea de la región y una técnica quirúrgica exquisita la infección quirúrgica ocurre, el tratamiento suele ser relativamente simple. Muchas de estas heridas están inflamadas pero no necesariamente infectadas. De hecho, muchas de estas heridas “infectadas” se resolverán con tratamiento antibiótico. En las heridas francamente infectadas el tratamiento supone la apertura de la herida quirúrgica, sin llegar a la exteriorización o extracción de la malla, drenaje y cultivo de la secreción 64 Estudio de la perfusión testicular tras hernioplastia preperitoneal encontrada. De cualquier modo la infección altera el proceso normal de cicatrización e integración, lo que implica un aumento de la probabilidad de recurrencia. La sepsis inguinal crónica es una entidad poco frecuente (entre 1‰ (148) y el 1% (147). Las lecturas anteriores suscitan varias preguntas ¿Cuál es el motivo de estas oscilaciones? ¿Por qué los especialistas en cirugía herniaria no describen y prácticamente desprecian la infección de la malla? Un metaanálisis reciente encontró solo dos casos de infección de la malla en 7000 hernias reparadas por distintos grupos de cirujanos (149). Algunos autores opinan que la tasa de infección en cirugía herniaria es mayor de la publicada (150). Por último, es conveniente aclarar que las tasas de infección del sitio quirúrgico no dependen de la técnica utilizada (ya sea ésta preperitoneal o no) (85). b) Recidiva En la actualidad el uso de mallas en cirugía herniaria está ampliamente extendido y parece ser el patrón oro en el tratamiento de la hernia inguinal sobre todo si comparamos las tasas de recidiva de las técnicas con tensión (151). Los resultados obtenidos en centros especializados muestran tasas de recurrencia espectaculares (0.5%) (152;153). Un metanálisis reciente ya citado (154) recoge las recidivas producidas en 7000 participantes, intervenidos por diferentes cirujanos. Se observa cómo a partir del primer año el numero de recidivas en los pacientes en lo que se no se ha usado malla aumenta de forma marcada. No se observan diferencias significativas en la tasa de recidivadas entre las diferentes hernioplastias. 65 Estudio de la perfusión testicular tras hernioplastia preperitoneal c) Dolor La incidencia reportada oscila en 0 y el 12 % (62;76;117;155-161) La neuralgia inguinal crónica es una de las complicaciones más significativas que acontecen tras una reparación herniaria (162;163). En una revisión reciente se encuentra una incidencia de hasta el 54% (117). La posibilidad de lesión iatrógena de algún nervio es distinta según el abordaje utilizado, pero las probabilidades de lesión no son diferentes por el uso de la malla. La lesión de ciertos nervios inguinofemorales es una complicación clásica y bien conocida en las reparaciones tradicionales, particularmente en lo que se refiere al nervio genitofemoral en el momento de la disección entre el oblicuo externo y el tendón conjunto en una técnica de Bassini o Shouldice (7). Mientras los elementos nerviosos son reconocidos durante la intervención estos pueden ser protegidos, pero el desconocimiento de una lesión nerviosa o la formación de un neuroma pueden dar lugar a secuelas (164). La cirugía laparoscópica ha impulsado el estudio pormenorizado de la distribución de los nervios a través del espacio preperitoneal, sobre todo por la aparición de complicaciones neurológicas en hasta el momento infrecuentes (165) que alcanzan una incidencia del 2%, particularmente en la TAPP (166). Esta es la razón por la cual algunos grupos han dejado de fijar la malla (104;118;119). Algunos otros la fijan con pegamentos biológicos, evitando la migración y con buenos resultados en cuanto a neuralgias (118;120). Rutkow (86) considera muy poco probable que la etiología de la inguinodinia sea la lesión o el atrapamiento de estructuras nerviosas que se consideran a menudo como directamente responsables; advirtiendo que a menudo la neuralgia postoperatoria se 66 Estudio de la perfusión testicular tras hernioplastia preperitoneal diagnostica en individuos que presentaban dolor inguinal previo a la cirugía. Este puede reaparecer tras la cirugía sin tener relación con la hernioplastia en sí misma, sino con la lesión o distensión de un ligamento o músculo de la región o incluso un problema de cadera con dolor referido la ingle (86). La introducción del uso de mallas ha mejorado el dolor postoperatorio de los pacientes (140;154;167) a pesar de que algunos autores también confirmen un aumento en la respuesta inflamatoria en comparación con las técnicas clásicas con tensión (168). El dolor postoperatorio se denomina crónico cuando este afecta al enfermo por más de 4 semanas (159). Este puede alterar gravemente la calidad de vida del paciente. En la mayoría de los pacientes el dolor crónico se resuelve a los 4-6 meses pero en algunos casos el dolor se estabiliza. La incidencia del dolor crónico no es bien conocida por la falta de estudios prospectivos con seguimientos amplios. La causa más frecuentemente expuesta en la literatura corresponde a la lesión de nervios sensitivos (iliohipogastrico, ilioinguinal y la rama genital del genitofemoral) (169). En cuanto a la fijación de la mallas y su relación con el dolor inguinal, algunos estudios afirman que la no fijación de las mallas o la utilización de pegamento biológicos en lugar de elementos de fijación como los clásicos puntos o los más modernos “tackers” endoscópicos (ver apartado correspondiente a la técnica endoscópica), puede reducir la incidencia de dolor postoperatorio crónico. Existen estudios de modelos físicomatemáticos que presentan una malla de 10 x 15 cm en el espacio preperitoneal confirmando que es lo suficientemente amplia como para evitar su fijación sin aumentar el riesgo de recidiva y consiguiendo menos dolor (11). Algunos autores sugieren que el 67 Estudio de la perfusión testicular tras hernioplastia preperitoneal uso de la vía preperitoneal para la colocación de material protésico podría tener menor incidencia de dolor crónico postoperatorio (170) e incluso que el tipo de malla utilizada podría tener una influencia en la fisiología de la transmisión nerviosa (171). El riesgo de neuralgia crónica esta aumentado en aquellos enfermos que se reintervienen por recidiva herniaria (160). d) Migración La migración del material protésico es una complicación muy poco frecuente como reconoce la literatura , con casos casi siempre de naturaleza anecdótica y se reducen a migraciones del plug o tapón utilizado según la técnica de Rutkow-Robbins que migra hasta colocarse por fuera del anillo inguinal (85). De hecho, las últimas revisiones que el propio Rutkow realiza de su técnica incluyen la fijación del Plug por dos suturas reabsorbibles en pequeñas hernias indirectas (86). En cualquier caso, es posible que éste fenómeno este subestimado y que la frecuencia real sea mayor que la publicada (172). e) Efectos sobre la fertilidad La infertilidad masculina supone el 25% de las consultas que se realizan en clínicas de infertilidad. La oligospermia severa y la azoospermia tienen, en general, muy mal pronóstico. A pesar de que la incidencia de la lesión incidental del deferente se estima en un 0.3% (173), la reparación herniaria es la causa más frecuente de lesión iatrogénica del conducto deferente (174). La incidencia de infertilidad en los pacientes intervenidos de hernia inguinal es mayor que en la población general. La reparación herniaria bilateral también tiene implicaciones en cuanto a las lesiones del cordón espermático dado que una lesión unilateral puede resultar inadvertida y por 68 Estudio de la perfusión testicular tras hernioplastia preperitoneal ello subestimada. Es importante tener en cuenta que una gran parte de los varones intervenidos de hernia inguinal no presentan intención reproductiva por lo que la fertilidad es un factor no valorado (175). Dados los buenos resultados que se obtiene en las unidades de reproducción muchos de estos individuos no son ni tan siquiera valorados por el urólogo o el cirujano y por tanto no se llega a investigar las causas de esta azoospermia (176). Ocasionalmente el patólogo puede identificar en el saco herniario resecado una porción del deferente (177). Las lesiones bilaterales pueden manifestarse con alteraciones de la fertilidad (178). Actualmente, tanto la incidencia y la fisiopatología de las lesiones del cordón espermático no son bien conocidas. En la literatura predominan los estudios de casos y pequeñas series. Shin et al (176), recogen 14 casos de azoospermia procedentes de varias instituciones y relacionados con hernioplastia previa ya sea por vía abierta o preperitoneal laparoscópica. En todos los casos se identifica una importante reacción fibroblástica. La publicación de Shin ha suscitado diferentes reacciones en la literatura ya que sus conclusiones finales orientan al lector a cuestionarse la validez de una técnica que se ha tenido por segura desde el comienzo de su uso. Paradójicamente, uno de los argumentos clásicos a favor del empleo de las mallas es la preservación de la fertilidad ya que, al disminuir el número de recidivas disminuye el número de reintervenciones. ¿Tiene validez esta afirmación? Sin duda, nuevos estudios multicéntricos deben desarrollarse para estudiar este aspecto con mayor detalle. La vía preperitoneal, tanto en su vertiente abierta como laparoscópica permite la visualización de importantes estructuras que deben ser valoradas en el momento de fijar la malla y que enmarcan áreas de peligro como el ya descrito triangulo del peligro o de “doom” (15). En cualquier caso, la lesión unilateral, de no existir otro tipo de patología contralateral puede presentarse como un factor predisponente a la infertilidad aunque la 69 Estudio de la perfusión testicular tras hernioplastia preperitoneal literatura describe casos donde la lesión unilateral es causa de infertilidad en ausencia de lesión contralateral (177). Incluso en pacientes en los que se asume que el testículo contralateral es normal existen datos en la literatura que sugieren que un infarto o trauma de un testículo pueden afectar a la capacidad del contralateral para la normal producción de esperma. Fisiopatológicamente ello se explica por la mediación de anticuerpos citotóxicos anti-esperma cuya especificidad puede verse alterada, dando lugar a verdaderos anticuerpos antitesticulares. Este mecanismo podría ser el responsable de la disminución de la producción de esperma en ausencia de reacción celular (179). El tipo de compresión que se realiza sobre el conducto deferente también influye sobre una posible lesión y puede ser mediado por una mala manipulación del mismo, tensión en la colocación de la malla alrededor del cordón o la inducción de una reacción fibroblástica añadida por parte de la malla. Este tipo de lesiones ha sido estudiado de forma experimental sobre ratas (180) , mostrando como el grado de manipulación es proporcional al daño funcional a los 6 meses, confirmando que una lesión del deferente no implica necesariamente la sección completa del mismo, sino que diferentes forma de distorsión de la estructura histológica pueden tener una repercusión funcional a largo plazo. Otro estudio de Ceylan et al. (181) demuestra, en un modelo animal experimental, como el estiramiento o manipulación excesiva del cordón puede llegar a provocar una disminución de la capa muscular lisa del conducto deferente Debemos, por tanto, tomar una actitud de extrema exquisitez técnica en la manipulación de las estructuras del cordón inguinal. En cualquier caso, y al margen de la depuración técnica con la que se maneje el cordón, la colocación de una malla de propileno en contacto con el conducto deferente ha sido estudiada desde el punto de vista experimental encontrando cambios histológicos en el 70 Estudio de la perfusión testicular tras hernioplastia preperitoneal deferente que podrían condicionar una obstrucción a la salida de los espermatozoides (182). f) Carcinogénesis Existe evidencia experimental de la capacidad carcinogenética de determinados materiales protésicos, pudiendo inducir sarcomas de partes blandas en modelos animales (183-185). Este fenómeno está más relacionado con las características físicas del implante que con su estructura química. Este fenómeno, llamado de Oppenheimer (186) por su descubridor, consiste en que si se implanta una película o lámina con una superficie plana, ésta inducirá un sarcoma en el 50 % de los animales de experimentación. Cuando el mismo material es insertado con una textura porosa la incidencia de sarcoma fue menor del 1%. La media de tiempo transcurrido hasta la formación del tumor fue de entre 1 y 2 años según Oppenheimer. Este fenómeno sugiere que el polipropileno, al tener una superficie porosa, no generará tumores. Whiterspoon et al han estudiado el potencial carcinogénico de varios materiales protésicos comúnmente usados en la reparación herniaria en un modelo animal sin encontrar evidencias de formación de sarcomas. (154;187;187). Existen publicaciones anecdóticas de confusión entre sospechas radiológicas de metástasis que corresponden a fibrosis originada por la hernioplastia que nada tienen que ver con la capacidad carcinogenética del polipropileno (188). Así mismo, el análisis de marcadores moleculares de proliferación y apoptosis no revela potencial tumoral (189). 71 Estudio de la perfusión testicular tras hernioplastia preperitoneal g) Atrofia testicular La respuesta inflamatoria que ocurre tras la colocación de una malla no está sólo relacionada con un proceso de cicatrización normal, sino que a éste se asocia una reacción especifica de la malla. De hecho, la respuesta inflamatoria existente en las reparaciones herniarias sin uso de injertos es de una importancia mucho menor frente a la de las actuales hernioplastias donde se observa elevación significativa de citokinas (168). Esta reacción, considerada de vital importancia para la normal integración del polipropileno, es resultante de una respuesta fibroblástica limitada, cuya duración es de aproximadamente 7 días en su fase aguda (190). La respuesta inflamatoria se reduce enormemente en los siguientes 6 meses (191) sugiriendo una optima capacidad de integración aunque se han descrito casos de reacción inflamatoria incluso años después de la cirugía (192). Se ha demostrado la variabilidad interindividual existente en cuanto a este tipo de reacciones, de modo que la reacción inflamatoria subyacente depende básicamente de la cantidad de malla colocada y de su textura lisa o porosa. Se considera de forma general que el polipropileno sufre procesos de retracción en la integración en el tejido conectivo, aunque algunos autores apuntan la posibilidad tanto de acortamiento como de “expansión” de estas mallas (193). Como consecuencia de estos fenómeno de cicatrización, ciertas publicaciones valoran la repercusión de la fibrosis de las mallas en el flujo testicular(194) valorando atrofia (195) y función sexual (196). Estos estudios serán comentados con mayor profundidad en la discusión del estudio. 72 Estudio de la perfusión testicular tras hernioplastia preperitoneal La atrofia testicular es una complicación importante de la hernioplastia inguinal. Su frecuencia es mayor tras un abordaje anterior que después de hernioplastia preperitoneal. La razón la encontramos en que durante el abordaje anterior es necesario la disección del cordón espermático mientras en este procedimiento se obvia por la vía posterior (169). La arteria testicular discurre por el cordón espermático, suponiendo el aporte primario sanguíneo al testículo y dando a ramas capsulares e intratesticulares que recorren el parénquima de forma bidireccional. Se ha estudiado como, tras la implantación de una malla en la región inguinal, pueden existir disminuciones del flujo testicular medido por ecografía, aunque éstas parece consecuencia de un edema traumático más que el resultado de una reacción inflamatoria crónica (194). 1.7.4 Infertilidad y lesión deferencial La reparación herniaria es la causa más frecuente de lesión iatrogénica del conducto deferente (174). La incidencia de infertilidad en los pacientes intervenidos de hernia inguinal es mayor que en la población general (175), a pesar de que la incidencia de la lesión incidental del deferente se estima en un 0.3% (173). La reparación bilateral herniaria también tiene implicaciones en cuanto a las lesiones del cordón espermático dado que una lesión unilateral puede resultar inadvertida y por ello subestimada. Es importante tener en cuenta que una gran parte de los varones intervenidos de hernia inguinal no presentan intención reproductiva por lo que la fertilidad es un factor no valorado (175). Actualmente, tanto la incidencia como la fisiopatología de las lesiones del cordón espermático no son bien conocidas. En la literatura predominan los estudios de casos y pequeñas series (226). Shin et al (176), 73 Estudio de la perfusión testicular tras hernioplastia preperitoneal muestra 14 casos azoospermia recogidos de varias instituciones y relacionados con hernioplastia previa ya sea por vía abierta o preperitoneal laparoscópica. En todos los casos se identifica una reacción fibroblástica importante que puede estar relacionada tanto con el deferente como con el testículo. Sus conclusiones finales orientan al lector a cuestionarse la validez de una técnica que se ha tenido por segura desde el comienzo de su uso. Paradójicamente, unos de los argumentos clásicos a favor del empleo de las mallas es la preservación de la fertilidad, ya que, al disminuir el número de recidivas disminuye el número de reintervenciones. En cualquier caso, parece oportuno tener en cuenta que la vía de acceso anterior a la región inguinal no permite el fácil reconocimiento de la compleja anatomía de esta zona. Abasiyanik (180) muestra cómo el grado de manipulación es proporcional al daño funcional a los 6 meses, confirmando que una lesión del deferente no implica necesariamente la sección completa del mismo, sino que diferentes formas de distorsión de la estructura histológica pueden tener una repercusión funcional a largo plazo. La incidencia de la orquitis isquémica en pacientes intervenidos por vía anterior es del 0.6% (169) mientras que la literatura refleja un 0.08% para las reparaciones por vía laparoscópica (227). Esta proporción aumenta considerablemente en el caso de las hernias recurrentes, alcanzando el 5% de incidencia. Este hecho está posiblemente relacionado con la movilización del cordón que se realiza en esta cirugía y con las dificultades en el reconocimiento de la anatomía. Existen muy pocos datos acerca de los efectos de las prótesis utilizadas y de la fibrosis resultante sobre el cordón espermático, en concreto sobre el flujo testicular. Actualmente, y dado el interés creciente en el tratamiento precoz de la hernia inguinal en personas jóvenes, la preocupación sobre la garantía de mantener la fertilidad ha crecido surgiendo la necesidad de nuevos estudios al respecto (228) 74 Estudio de la perfusión testicular tras hernioplastia preperitoneal Varios estudios , pretenden realizar un acercamiento a la preservación de la función testicular y fertilidad en el tratamiento de la hernia inguinal. Por tanto, todo lo relacionado con este tratamiento debe ser tenido en cuenta, especialmente la técnica quirúrgica y el uso de mallas. El primer autor que mostró interés por este campo fue Taylor (232) investigando el efecto de la contracción de la malla sobre el flujo testicular y femoral tras hernioplastia abierta y laparoscópica sin encontrar efectos adversos tras la cirugía. A pesar de que este tipo de comunicaciones son poco frecuentes en la literatura, puede que nos encontremos frente a un problema subestimado considerando que: 1. La fertilidad depende de los dos testículos, por lo que en caso de lesión el testículo contralateral puede compensar, solapando la situación real del paciente. Sólo los pacientes que por alguna razón tuviesen una lesión bilateral o en el límite superior de los patrones considerados como azoospermia, podrían ser valorados en este sentido. 2. Una parte considerable de los pacientes sometidos a cirugía de la hernia inguinal son de una edad superior a los cuarenta años, edad a partir de la cual el deseo de tener descendencia se ve lógicamente disminuido. Shin et al (176) comunicaron catorce casos de azoospermia entre pacientes intervenidos según la técnica de Liechtenstein, concluyendo que la infertilidad estuvo en relación con el uso de mallas de polipropileno que habían favorecido la oclusión del conducto deferente, provocando un gran interés por parte de otros autores como Yavetz et al (175) que estudiaron ocho mil quinientos varones infértiles, encontrando que 75 Estudio de la perfusión testicular tras hernioplastia preperitoneal quinientos sesentaicinco de aquellos (6.65%) habían sido intervenidos de hernia inguinal. En cualquier caso, parece oportuno señalar que la incidencia de infertilidad entre pacientes intervenidos de hernia inguinal es superior a la de la población general. Aún no se ha establecido claramente cuál es la fisiopatología de estos casos de infertilidad. Es por tanto necesario preguntarse si la reacción fibroblástica normal, generada por la prótesis, puede ser capaz de alterar la permeabilidad del conducto deferente o la vascularización testicular. Varias comunicaciones se han hecho a este respecto (233;234), llegando en algunos casos a recomendar la indicación restrictiva en la colocación de malla (235) o incluso la criopreservación de esperma en sujetos jóvenes a los que se propone realizar una hernioplastia bilateral (236). Ello ha llevado a algunos autores a plantear la conveniencia de informar específicamente a los pacientes del riesgo de infertilidad en la reparación con malla de la hernia inguinal (176;237). También se ha señalado el hecho de que la hernia inguinal, por sí misma, puede ser capaz de alterar la fertilidad. Así, se han comunicado alteraciones de la espermatogénesis en estos pacientes, sobre todo cuando presentan hernia inguinal bilateral (238). Incluso, muy recientemente se ha encontrando que la mutación del gen 1090 >T puede ser un factor de riesgo para el desarrollo de hernia inguinal que puede estar también asociado a infertilidad (239). El conducto deferente presenta una gruesa capa muscular que representa las tres cuartas partes de su grosor. Su integridad es crítica para una eyaculación óptima permitiendo que los espermatozoides sean rápidamente transmitidos a la uretra. Cualquier alteración 76 Estudio de la perfusión testicular tras hernioplastia preperitoneal de esta capa muscular podría alterar la fertilidad. Así, Ceylan et al (181) realizan un estudio experimental sobre ratas sometiendo al cordón espermático a un estiramiento horizontal controlado durante 60 segundos mediante diferentes instrumentos quirúrgicos. En el estudio histológico posterior encuentran una disminución del grosor del conducto deferente y atrofia testicular. En otro estudio experimental en ratas, Abasiyanik et al (180) observaron una fibrosis periductal en el conducto deferente a los 6 meses de haber sufrido un pinzamiento con un instrumento quirúrgico. En relación a la reacción de la malla, Uzzo et al (228) observaron en perros que las prótesis de polipropileno pueden dar lugar a una reacción fibrótica que cause importantes adherencias entre la malla y el cordón espermático. Así mismo, observaron cambios en el volumen testicular, niveles de testosterona y diámetro del deferente que atribuyeron a una reacción de cuerpo extraño mediada por la prótesis. Según estos autores también podría verse afectada la movilidad y morfología de los espermatozoides. Varios estudios similares, orientan a pensar en un aumento del riesgo de infertilidad a causa de alteraciones en la espermatogénesis (182;235;240) aunque otros no encuentran esta diferencia (194). En este sentido, Klinge et al (241), reoperaron a 17 pacientes con hernioplastia inguinal observando reacción de cuerpo extraño, granuloma con células epiteliales y células gigantes, necrosis fibrinoide en algunos casos y depósitos de colágeno. Según estos autores la contracción de la malla redujo la superficie original de misma en un 60%. 77 Estudio de la perfusión testicular tras hernioplastia preperitoneal Se ha estudiado los efectos de la malla sobre la anatomía inguinal. Así, Goldenberg et al (202), en un estudio llevado a cabo en 10 perros, observaron los efectos del polipropileno sobre el testículo, epidídimo y conducto deferente. Las prótesis fueron implantadas en la región inguinal de los animales y tres días después se les reintervino para la extirpación del testículo y el cordón espermático. Estos autores concluyen que ocurrió una reducción del 20% de la espermatogénesis y que existía un proceso inflamatorio que envolvía el deferente en el 60% de los animales. De mismo modo, Maciel et al (182) realizaron la disección los conductos deferente de 40 ratas. En un lado se implantó una malla de polipropileno mientras que el otro se realizó la disección del deferente sin implantación de material alguno, utilizando este lado como control. Hubo una reacción de cuerpo extraño en el grupo en el que se implantó la malla pero no en el grupo control. Existió una diferencia estadísticamente significativa en cuanto a la dilatación proximal del deferente entre el grupo de implante y el grupo control, a favor del primero, así como menor número de espermatozoides en el grupo de implante. La reacción provocada por la malla podría ser diferente según varíen sus características. Así, algunos autores realizan estudio experimentales en ratas comparando la reacción en el cordón testicular provocada por polipropileno de bajo peso con polipropileno estándar: Berdsen et al (242) no encuentran diferencias entre las reacciones provocada por los dos tipo de mallas, mientras que Junge et al (243) concluyen que el número e intensidad de adherencias provocada por el polipropileno de bajo peso es menor, recomendando este tipo de mallas para su utilización en sujetos jóvenes. 78 Estudio de la perfusión testicular tras hernioplastia preperitoneal Kolbe at al (244) no encontraron diferencias entre la reacción provocada por mallas de Vypro II® y por Prolene® en contacto con el cordón espermático, en un estudio experimental con 20 ratas, no existiendo obstrucción o inflamación de la mucosa del deferente. Los efectos en el metabolismo y la función testicular también han sido estudiados a nivel experimental. Taneli et al (245) investigan el efecto a largo plazo de las mallas de polipropileno en la cirugía de la hernia inguinal, para ello seleccionan 40 ratas que reparten aleatoriamente en dos grupos. En el primer grupo, implantan a las ratas una malla por detrás del cordón inguinal. En el segundo grupo se realiza la misma disección y no se implanta malla. Se realiza la medición de oxido nítrico y niveles de LH y FSH, pre y postoperatoriamente. No encuentran alteraciones funcionales, sin embargo, las ratas del grupo 1 presentaron una tasa de oxido nítrico más importante que las del grupo 2, aunque esta diferencia no suponga un mayor riesgo de infertilidad 79 Estudio de la perfusión testicular tras hernioplastia preperitoneal 2. HIPÓTESIS DE TRABAJO 80 Estudio de la perfusión testicular tras hernioplastia preperitoneal La introducción de materiales protésicos en la cirugía herniaria ha disminuido el índice de recidivas y ha mejorado el dolor postoperatorio de los pacientes; sin embargo, las hernioplastias están lejos de ser una cirugía libre de complicaciones. Fistulas, infección, dolor crónico, migración de la prótesis a intestino delgado o vejiga, así como adherencias peritoneales han sido descritas como complicaciones tras el uso de prótesis (117;173;188;197). La malla produce una reacción inflamatoria específica previa a su normal integración por el tejido fibroblástico, lo que en contacto con los vasos testiculares podría alterar la vascularización del testículo. Varios estudios relacionan el uso de mallas con posibles alteraciones de la irrigación testicular (181;194-196;199-204). En la técnica de hernioplastia en M, la malla es colocada en el espacio preperitoneal en contacto directo con los vasos testiculares y sin la protección del músculo cremáster que tiene lugar en las técnicas que utilizan un abordaje anterior (198). En la actualidad no se conoce cuál es la influencia de la reacción inflamatoria sobre la vascularización testicular en una técnica preperitoneal abierta. Parece pues necesaria la realización de estudios que evalúen el impacto de dicha reacción sobre la vascularización del testículo. 81 Estudio de la perfusión testicular tras hernioplastia preperitoneal 3. OBJETIVOS 82 Estudio de la perfusión testicular tras hernioplastia preperitoneal OBJETIVO GENERAL: Conocer la relación existente entre la cirugía de la hernia inguinal mediante técnica preperitoneal (hernioplastia preperitoneal en M) con prótesis de polipropileno y su repercusión sobre la vascularización del testículo. OBJETIVOS ESPECÍFICOS: a) Valorar ecográficamente los efectos potenciales de la hernia sobre la perfusión testicular. b) Conocer los cambios del índice de resistencia de la arteria testicular y del parénquima testicular inmediatamente después de la cirugía y a los tres meses de la misma. c) Señalar si se producen cambios en el volumen testicular inmediatamente después de la cirugía y a los tres meses. d) Analizar los posibles cambios del diámetro y del grosor escrotal inmediatamente después de la cirugía y a los tres meses. 83 Estudio de la perfusión testicular tras hernioplastia preperitoneal 4. PACIENTES Y MÉTODOS 84 Estudio de la perfusión testicular tras hernioplastia preperitoneal 4.1 Muestra Está compuesta por 34 pacientes intervenidos por el mismo cirujano en el Hospital Torrecárdenas, en Almería. Se incluyeron en un estudio de casos observacional prospectivo. A todos ellos se realizó una hernioplastia preperitoneal en M, de forma programada, bajo anestesia raquídea, con prótesis de polipropileno Bard . Se realizaron tres ecografías de la región inguino-escrotal en tres momentos de la evolución (preoperatoria, postoperatoria inmediata y a los tres meses de la cirugía). Se toma como medida de control las del lado contralateral (sano por la hernia) en la primera ecografía. Los criterios de inclusión del estudio fueron: Varones > 20 años Hernia inguinal primaria Flujo testicular previo normal Los criterios de exclusión del estudio fueron: Edad > 60 años o < de 20 años Neoplasia concomitante Diabetes tipo I o tipo II Antecedentes de patología urológica Hipertensión arterial Atrofia testicular Índice de masa corporal >40 85 Estudio de la perfusión testicular tras hernioplastia preperitoneal Uso de braguero Intervenciones abdominales previas Hernia recidivada Diálisis peritoneal Patología vascular concomitante Radioterapia pélvica 86 Estudio de la perfusión testicular tras hernioplastia preperitoneal Gráfico 1 Esquema del estudio 87 Estudio de la perfusión testicular tras hernioplastia preperitoneal 4.2 Diseño del estudio. Estudio de casos observacional prospectivo Las variables clínicas estudiadas en los pacientes fueron: Edad Tipo de hernia según su relación con los vasos epigástricos Tamaño de la hernia según clasificación de Aachen Duración de la intervención en minutos Presencia de hematoma en el postoperatorio inmediato Necesidad de analgesia fuera del protocolo Recidiva a los 2 años Infección del sitio quirúrgico Las variables ecográficas estudiadas en los pacientes fueron: 1. EN EL PREOPERATORIO a) Índice de resistencia de la arteria testicular del lado afectado y del lado sano. b) Índice de resistencia del parénquima testicular del lado afectado y del lado sano. c) Volumen testicular del lado afectado y del lado sano. d) Diámetro del cordón afectado en mm y del lado sano. e) Grosor del escroto en mm del lado afectado y del lado sano. 2. EN EL POSTOPERATORIO INMEDIATO a) Índice de resistencia de la arteria testicular del lado afectado b) Índice de resistencia del parénquima testicular del lado afectado 88 Estudio de la perfusión testicular tras hernioplastia preperitoneal c) Volumen testicular del lado afectado d) Diámetro del cordón del lado afectado e) Grosor del escroto del lado afectado 3. A LOS TRES MESES DE LA CIRUGÍA a) Índice de resistencia de la arteria testicular del lado afectado b) Índice de resistencia del parénquima testicular del lado afectado c) Volumen testicular del lado afectado d) Diámetro del cordón del lado afectado e) Grosor del escroto del lado afectado La técnica quirúrgica empleada en todos los pacientes es la hernioplastia preperitoneal en M que ya ha sido comentada en el capítulo correspondiente de la introducción. De especial importancia en lo que se refiere a nuestro estudio son los detalles técnicos relacionados con la manipulación del cordón y el contacto de éste con la malla. 4.3 Estudio ecográfico La ecografía en escala de grises y doppler color ha probado su utilidad en el diagnóstico de diversas patologías escrotales (205). El compromiso de la vascularización arterial testicular o el drenaje venoso del testículo pueden ser valorados por ecografía mediante escala de grises. De este modo, un infarto testicular aparece como un nódulo de ecogenicidad disminuida o heterogénea, de contornos definidos y que puede ser 89 Estudio de la perfusión testicular tras hernioplastia preperitoneal imposible de diferenciar de un tumor testicular. Al margen de su uso en patología propiamente testicular, la ecografía ha mostrado su ventajas en el diagnóstico postoperatorio de las complicaciones relacionadas con la cirugía de la hernia inguinal, pudiendo discriminar entre colecciones y la recidiva de la propia hernia (206). Pues bien, entre 6 y 48 horas previas a la cirugía se realiza la primera ecografía. A las 24h de la cirugía se realiza la segunda ecografía (postoperatorio inmediato) y la tercera se realiza a los tres meses de la cirugía de forma ambulatoria. Las variables tomadas como control son las del lado contralateral, tomadas en la primera ecografía. Las exploraciones ecográficas se han llevado a cabo en el Servicio de Radiología del Hospital Torrecárdenas, todas realizadas por el mismo especialista, previamente seleccionado y conocedor en detalle de los pormenores de la técnica quirúrgica y de la ubicación de la prótesis. Los pacientes elegidos para el estudio permanecen al menos 30 min en reposo antes de pasar a la sala de ecografía, cuya temperatura ambiente se ha mantenido constante entre 20 y 25º. Mediante ecografía de escala de grises se procede a la toma de 3 medidas consecutivas de las dimensiones testiculares en los aspectos anteroposterior, mediolateral y craneocaudal que posteriormente serán procesados para calcular una aproximación del volumen testicular mediante la fórmula del volumen de un elipsoide, multiplicandos los tres diámetros por 0.71 (207). Se midió el diámetro del cordón espermático y se localizó la arteria espermática a 1-2 cm de su entrada en el testículo, tomando especial precaución para no realizar medidas 90 Estudio de la perfusión testicular tras hernioplastia preperitoneal de otras arterias de la red anastomótica testicular como la arteria deferencial o la cremastérica. A lo largo de toda la exploración se procuró no aplicar demasiada presión en el escroto mediante el transductor para evitar interferir con la exactitud de las medidas tomadas y con una angulación menor de 60º. El flujo sanguíneo testicular puede representarse como el índice de resistencia (IR); (IR= pico de velocidad sistólica – pico de velocidad al final de la diástole ÷ pico de velocidad sistólica). El IR proporciona un valor de gran exactitud para la medida global del flujo testicular. Es usado como marcador para valorar el compromiso renal en el transplante y como marcador precoz de rechazo del injerto. Cuanto mayor es el IR, mayor es la impedancia testicular. Así, pacientes con varicocele e hidroceles tienen un elevado índice de resistencia, dos condiciones asociadas a una función testicular disminuida. Los índices de resistencia raramente son inferiores a 0,5 en sujetos sanos, pero en más de la mitad de los pacientes afectados de epidídimo-orquitis inflamatoria el índice de resistencia es menor de 0,5 (208). En un estudio de Biagiotti et al (209), se relacionó el índice de resistencia de la arteria testicular con la espermatogénesis, siendo su medida una alternativa al contaje bioquímico habitual. 91 Estudio de la perfusión testicular tras hernioplastia preperitoneal Ilustración 1 Valoración ecográfica arteria testicular 4.4 Consentimiento del paciente Realizado de acuerdo a las normas vigentes de la Conferencia de Helsinki y otros tratados internacionales, con autorización de la comisión de investigación hospitalaria. La hernioplastia por vía preperitoneal está ampliamente extendida en el tratamiento de la hernia inguinal y se usa de forma estándar en muchos centros. Se realiza el consentimiento informado por parte de todos los pacientes seleccionados para el estudio. La ecografía es una técnica radiológica no cruenta y sin efectos secundarios. Incluso puede tener un beneficio adicional para el cirujano aportando información previa al acto operatorio. 92 Estudio de la perfusión testicular tras hernioplastia preperitoneal 4.5 Análisis Estadístico Tras la estadística descriptiva, la metodología aplicada ha sido: Análisis de la varianza de dos vías. Cuando el test global ha sido significativo, la búsqueda de las causas de la significación se ha realiza aplicando el método de Tukey y el método secuencial de Newman-Keuls. Análisis de la varianza de cuatro vías. En todos los casos los contrastes se han resuelto aplicando el método de Greenhouse-Geiser. Cuando algún contraste sobre interacciones ha sido significativo, la investigación se ha realizado aplicando el método de Tukey (para muestras del mismo tamaño) o el método de Bouferroni (para muestras de distinto tamaño), junto con el método secuencial de Newman-Keuls, fijando el nivel de significación en el 10% debido a los desequilibrios entre los distintos tamaños muestrales. El análisis estadístico se realizará con el paquete estadístico “SPSS versión 15”. 93 Estudio de la perfusión testicular tras hernioplastia preperitoneal 5. RESULTADOS 94 Estudio de la perfusión testicular tras hernioplastia preperitoneal 5.1 Estadística descriptiva La edad media de los pacientes intervenidos fue de 43,13 años. El 42.1% se localizaron en el lado izquierdo, mientras que en el lado derecho se situaron el 57%. La estancia media fue de 2.11 días. El tiempo operatorio medio fue de 37,71 minutos. Durante el postoperatorio inmediato, el 10,5 % de los pacientes desarrolló un hematoma del sitio quirúrgico diagnosticado ecográficamente y el 3% requirió analgesia suplementaria. El 5.3% desarrolló una infección de la herida quirúrgica. Tabla 3 Distribución muestral según el tipo de hernia Frecuencia Porcentaje Directa 14 41,2 Indirecta 20 58,8 Total 34 100,0 El 58% de los pacientes presentó una hernia indirecta, mientras que el 41% tenían una hernia directa. 95 Estudio de la perfusión testicular tras hernioplastia preperitoneal Tabla 4 Distribución muestral según el tamaño de la hernia Frecuencia Porcentaje Menor de 1.5 cm 13 38,2 Igual o mayor de 1.5 cm 21 61,8 Total 34 100,0 Fue necesario agrupar el tamaño de la hernia en dos grupos. El 61% presento un orificio herniario mayor o igual a 1,5 cm. Tabla 5 Distribución de la muestra según el tipo y el tamaño de la hernia Frecuencia Porcentaje Hernia directa menor de 1.5 cm 5 14,7 Hernia directa igual o mayor de 1.5 cm 9 26,5 Hernia indirecta menor de 1.5 cm 8 23,5 Hernia indirecta igual o mayor de 1.5 cm 12 35,3 Total 34 100,0 El 35,3 % de los pacientes presentaron una hernia indirecta mayor o igual a 1,5 cm. 96 Estudio de la perfusión testicular tras hernioplastia preperitoneal Tabla 6 Índice de resistencia de la arteria testicular en cada determinación N Media Desviación típica Preoperatorio 34 0,786 0,067 Postoperatorio inmediato 34 0,769 ,0522 A los tres meses 34 0,762 ,0699 Lado sano 34 0,763 ,0692 Lado afectado En la medida del índice de resistencia de la arteria testicular en lado afectado encontramos que en la determinación preoperatoria la media es de 0,786 disminuyendo en el postoperatorio inmediato (0,769) y a los tres meses de la cirugía (0,762). Realizando dicha determinación en el lado sano nos encontramos como resultado una media de 0,763. Tabla 7 Índice de resistencia del parénquima testicular en cada determinación N Media Desviación típica Preoperatorio 34 0,693 0,0743 Postoperatorio inmediato 34 0,644 0,0639 A los tres meses 34 0,684 0,0699 34 0,692 0,692 Lado afectado Lado sano 97 Estudio de la perfusión testicular tras hernioplastia preperitoneal En la medida del índice de resistencia testicular en el lado afectado encontramos que antes de la intervención su valor medio es de 0,693; dicho valor disminuye en el postoperatorio inmediato hasta 0,644. Finalmente, a los tres meses se sitúa a niveles parecidos a los del lado sano (0,691) con un índice de resistencia de 0,684 Tabla 8 Volumen testicular en cada determinación N Media Desviación típica Preoperatorio 34 17,542 3,456 Postoperatorio inmediato 34 18,955 3,482 A los tres meses 34 17,809 2,972 34 16,163 2,229 Lado afectado Lado sano Cuando medimos el volumen testicular en el lado afectado encontramos que en la determinación preoperatoria la media es de 17,54 ml, en el postoperatorio inmediato es de 18,95 ml y a los tres meses de la cirugía es de 17,80 . El valor del lado sano la media del volumen testicular fue de 16,16. 98 Estudio de la perfusión testicular tras hernioplastia preperitoneal Tabla 9 Diámetro del cordón en cada determinación N Media Desviación típica Lado afectado Preoperatorio 34 7,682 5,907 Postoperatorio inmediato 34 8,809 2,711 A los tres meses 34 5,965 2,917 34 5,762 2,402 Lado sano En la medida del diámetro del cordón en el lado afectado encontramos una media de 7,68 mm que aumenta ligeramente en el postoperatorio inmediato a valores 8,80 mm y disminuye hasta los 5,96 a los tres meses de la cirugía, situándose en valores similares a los del lado sano, con una media de 5,76 mm (n=34). Tabla 10 Grosor escrotal en cada determinación N Media Desviación típica Preoperatorio 34 3,000 0,572 Postoperatorio inmediato 34 3,097 0,916 A los tres meses 34 2,876 0,486 34 2,965 0,688 Lado afectado Lado sano Como puede apreciarse, la medida del grosor escrotal medio varía muy poco en las cuatro determinaciones. 99 Estudio de la perfusión testicular tras hernioplastia preperitoneal Tabla 11 Índice de resistencia de la arteria testicular en cada determinación según el tipo de hernia N Media Desviación típica Preoperatorio 34 0,776 0,079 Postoperatorio inmediato 34 0,766 0,054 A los tres meses 34 0,788 0,059 Lado sano 34 0,761 0,048 INDIRECTA N Media Desviación típica Preoperatorio 34 0,793 0,060 Postoperatorio inmediato 34 0,771 0,052 A los tres meses 34 0,744 0,051 34 0,765 0,082 DIRECTA Lado afectado Lado afectado Lado sano Observamos como las hernias directas en el preoperatorio presentan un menor índice de resistencia de la arteria testicular (0,776) que las hernias indirectas (0,793). El mayor descenso a los tres meses de la cirugía se da en las hernias indirectas (0,744). 100 Estudio de la perfusión testicular tras hernioplastia preperitoneal Tabla 12 Índice de resistencia testicular según el tipo de hernia N Media Desviación típica Preoperatorio 34 0,699 0,074 Postoperatorio inmediato 34 0,664 0,071 A los tres meses 34 0,687 0,072 Lado sano 34 0,708 0,064 INDIRECTA N Media Desviación típica Preoperatorio 34 0,688 0,076 Postoperatorio inmediato 34 0,629 0,056 A los tres meses 34 0,682 0,070 Sano 34 0,680 0,084 DIRECTA Lado afectado Lado afectado Puede observarse como la mayor variación existe en la determinación del postoperatorio inmediato, tanto para hernias directas como indirectas. 101 Estudio de la perfusión testicular tras hernioplastia preperitoneal Tabla 13 Volumen testicular según el tipo de hernia en cada determinación N Media Desviación típica Preoperatorio 34 16,090 3,032 Postoperatorio inmediato 34 17,353 2,999 A los tres meses 34 16,985 2,537 Lado sano 34 16,290 1,984 INDIRECTA N Media Desviación típica Preoperatorio 34 18,559 3,436 Postoperatorio inmediato 34 20,076 3,418 A los tres meses 34 18,385 3,175 34 16,075 2,432 DIRECTA Lado afectado Lado afectado Lado sano Obsérvese como el lado sano tanto en hernias directas como en indirectas, especialmente en éstas últimas, presenta menor volumen que en el lado afectado por la hernia. 102 Estudio de la perfusión testicular tras hernioplastia preperitoneal Tabla 14 Diámetro del cordón testicular según el tipo de hernia N Media Desviación típica Preoperatorio 34 4,725 2,530 Postoperatorio inmediato 34 8,507 2,414 A los tres meses 34 4,657 2,170 Lado sano 34 5,185 1,787 INDIRECTA N Media Desviación típica Preoperatorio 34 9,752 6,729 Postoperatorio inmediato 34 9,020 2,944 A los tres meses 34 6,880 3,069 34 6,165 2,724 DIRECTA Lado afectado Lado afectado Lado sano Obsérvese como en las hernias directas el diámetro del cordón testicular en el lado sano es muy similar al del lado afectado 103 Estudio de la perfusión testicular tras hernioplastia preperitoneal Tabla 15 Grosor escrotal según el tipo de hernia N Media Desviación típica Preoperatorio 34 2,936 0,573 Postoperatorio inmediato 34 3,385 1,067 A los tres meses 34 2,943 0,574 Lado sano 34 2,971 0,543 INDIRECTA N Media Desviación típica Preoperatorio 34 3,045 0,581 Postoperatorio inmediato 34 2,895 0,758 A los tres meses 34 2,830 0,422 Laso sano 34 2,960 0,788 DIRECTA Lado afectado Lado afectado Las oscilaciones del grosor escrotal son mínimas y se producen fundamentalmente en el postoperatorio inmediato para igualarse a los valores preoperatorios a los tres meses de la cirugía. 104 Estudio de la perfusión testicular tras hernioplastia preperitoneal 5.2 Análisis de la homogeneidad de las variables: ANOVA de dos vías. Para estudiar la homogeneidad de las variables (índice de resistencia de la arteria testicular, índice de resistencia del parénquima testicular, volumen testicular, diámetro del cordón escrotal, grosor escrotal ) en las cuatro determinaciones (preoperatorio, postoperatorio inmediato, a los tres meses de la cirugía y en el lado sano), se ha realizado un análisis de la varianza de dos vías considerando las determinaciones como un factor fijo y los sujetos como un factor aleatorio con n=34. 5.2.1 Índice de resistencia de la arteria testicular Una vez realizado el análisis de la varianza de dos vías para la resistencia de la arteria testicular se ha obtenido que no se puede rechazar la hipótesis de igualdad de medias del índice de resistencia de la arteria testicular en las 4 determinaciones (Fexp=1,604, 3 y 99 grados de libertad, p=0,193). Por consiguiente no se han encontrado diferencias significativas entre las medias de la resistencia testicular en las 4 determinaciones, tal y como puede observarse en el siguiente gráfico. 105 Estudio de la perfusión testicular tras hernioplastia preperitoneal Gráfico 2 Evolución de índice de resistencia de la arteria testicular de lado afectado en relación al lado sano 5.2.2 Índice de resistencia del parénquima testicular Una vez realizado el análisis de la varianza de dos vías para la resistencia del parénquima testicular se rechaza la hipótesis de igualdad de medias de la resistencia testicular en las cuatro determinaciones (Fexp=5,487, P= 0,002). Para investigar las causas de la significación se aplicado el método de Turkey y el método secuencial de Neuman-Keuls, obteniéndose los resultados siguientes: 106 Estudio de la perfusión testicular tras hernioplastia preperitoneal Tabla 16: Comparaciones por parejas para el índice de resistencia del parénquima testicular. Comparaciones texp Grados de libertad (k,f) Resultado Preoperatorio-postoperatorio inmediato 3,655 (4,34) Significativo (p=0,004) Preoperatorio - 3 meses de la cirugía 0,620 (3, 34) NS (p=0,935) Preoperatorio - lado sano 0,053 (3,34) NS (p=1) Postoperatorio inmediato- 3 meses 3,035 (4,34) Significativo (p=0,024) Postoperatorio inmediato-lado sano 3,602 (4,34) Significativo (p=0,005) 3 meses de la cirugía- lado sano 0,567 (3,34) NS (p=0,949) (NS= No significativo) Por tanto, el índice de resistencia del parénquima testicular medio es significativamente mayor en el preoperatorio que en el postoperatorio inmediato (p=0,004). El índice de resistencia del parénquima testicular medio es significativamente mayor a los tres meses de la cirugía que en el postoperatorio inmediato (p=0,0024). El índice de resistencia del parénquima testicular medio es significativamente mayor en el lado sano que en postoperatorio inmediato (p=0,005) No se han encontrado diferencias significativas en el resto de comparaciones por parejas. Estos cambios pueden observarse en el gráfico 3. 107 Estudio de la perfusión testicular tras hernioplastia preperitoneal Gráfico 3 Evolución del índice de resistencia testicular de lado afectado en relación al sano 5.2.3 Volumen testicular Realizado el análisis de la varianza de dos vías para el volumen testicular, se rechaza la hipótesis de igualdad de los volúmenes medios del escroto en las 4 determinaciones (Fexp 18,612; 3 y 99 grados de libertad, p< 10 -4). Para investigar las causas de la significación se ha utilizado el método de Tukey , obteniéndose los siguientes resultados: 108 Estudio de la perfusión testicular tras hernioplastia preperitoneal Tabla 17- Comparaciones por parejas del volumen testicular texp Grados de libertad (k,f) Resultado Preoperatorio-postoperatorio inmediato 3,758 (4,34) Significativo (p=0,02) Preoperatorio-a los tres meses 0,709 (4,34) NS Preoperatorio-lado sano 3,668 (4,34) Significativo (p=0,002) Postoperatorio inmediato-a los tres meses 3,049 (4,34) Significativo (p=0,002) Postoperatorio inmediato-lado sano 7,426 (4,34) Significativo (p<10-4) A los tres meses-lado sano 4,377 (4,34) Significativo (p<10-4) Comparaciones NS: No significativo Existen diferencias significativas entre el preoperatorio y el postoperatorio inmediato en cuanto al volumen medio del testículo (p=0,002). El volumen testicular medio es significativamente mayor en el postoperatorio inmediato que en el preoperatorio. Existen diferencias significativas entre el preoperatorio y el lado sano en cuanto al volumen medio testicular (p=0,002). El volumen medio testicular es significativamente menor en el lado sano que en el preoperatorio. Existen diferencias significativas entre el postoperatorio inmediato y a los tres meses de las cirugía en cuanto al volumen testicular medio (p=0,015). El volumen medio del testículo es significativamente menor a los tres meses que en el postoperatorio inmediato. 109 Estudio de la perfusión testicular tras hernioplastia preperitoneal Existen diferencias significativas entre el postoperatorio y el lado sano en cuanto al volumen testicular medio (p<10-4). El volumen testicular es significativamente menor en el lado sano que en el postoperatorio inmediato. Existen diferencias significativas entre las determinaciones medias del volumen testicular a los tres meses de la cirugía y en lado sano (p<10-4). El volumen medio del testículo es significativamente menor en el lado sano que a los tres meses. No se han encontrado diferencias significativas entre los volúmenes medios del testículo en el preoperatorio y a los tres meses de la cirugía (p=0,89). Estos cambios pueden observarse en el grafico 4. Gráfico 4 Evolución de medias del volumen testicular Eeeea ee 5.2.4 Diámetro del cordón Para el diámetro del cordón, el análisis de la varianza de dos vías se ha realizado sobre el logaritmo neperiano del diámetro del cordón. Una vez realizado el análisis de la varianza se rechaza la hipótesis de igualdad de las medias en las cuatro determinaciones (texp= 11’166, 3 y 99 grados de libertad, p<10-4). Para investigar las causas de la 110 Estudio de la perfusión testicular tras hernioplastia preperitoneal significación se ha aplicado el método de Tukey y el método secuencial de NewmanKeuls, obteniéndose los siguientes resultados: Tabla 18- Comparaciones por parejas para el diámetro del cordón testicular Comparaciones texp Grados de libertad (k,f) Resultado Preoperatorio-postoperatorio inmediato 3,999 (4,34) Significativo (p<10-4) Preoperatorio-a los tres meses 0,973 (3,34) NS (p=0,765) Preoperatorio-lado sano 0,938 (3,34) NS (p=0,787) Postoperatorio-a los tres meses 4,972 (4,34) Postoperatorio-lado sano 3,999 (4,34) A los tres meses-lado sano 0,041 (3,34) Significativo (p<10-4) Significativo (p<10-4) NS (p=1) NS: No significativo Por tanto, el Logaritmo neperiano del diámetro medio del cordón es significativamente mayor en el postoperatorio inmediato que en el preoperatorio (p<10 -4). El Logaritmo neperiano del diámetro medio del cordón en significativamente menor a los tres meses de la cirugía que en el postoperatorio inmediato (p<10 -4). No se han encontrado diferencias significativas en el resto de comparaciones por parejas. Estos cambios puede observarse en el gráfico 5. 111 Estudio de la perfusión testicular tras hernioplastia preperitoneal Gráfico 5 Evolución de medias del diámetro del cordón espermático 5.2.5 Grosor escrotal Realizado el análisis de la varianza de dos vías para el grosor del escroto se ha obtenido que no se puede rechazar la hipótesis de igualdad de medias del grosor del escroto en las cuatro determinaciones (Fexp=0,926, 3 y 99 grados de libertad, p=0,431). Por tanto no se han encontrado diferencias significativas entre los medias del grosor del escroto en las cuatro determinaciones, tal y como puede observarse en el gráfico 6. 112 Estudio de la perfusión testicular tras hernioplastia preperitoneal Gráfico 6 Evolución del grosor escrotal 113 Estudio de la perfusión testicular tras hernioplastia preperitoneal 5.3 Análisis de la homogeneidad de las variables: ANOVA DE 4 VÍAS Una vez realizado el análisis de la varianza sobre cada una de las variables, se ha realizado un análisis de la varianza de cuatro vías considerando las cuatro determinaciones como factores fijos y considerando a los sujetos, el tipo de hernia y el tamaño de la hernia como factores aleatorios. 5.3.1 Índice de resistencia de la arteria testicular Realizado el análisis de la varianza de cuatro vías se ha obtenido que todos los contrastes sobre las interacciones han sido no significativos: Tabla 19 Análisis de la varianza de cuatro vías para el índice de resistencia de la arteria testicular Fexp g.l. p-valor Índice de resistencia de la arteria testicular 1,092 1,698; 59,026 0,357 Índice de resistencia x tipo de hernia 1,946 1,968; 59,026 0,153 Índice de resistencia x tamaño de la hernia 0,882 1,968; 59,026 0,418 Índice de resistencia x tipo de la hernia x tamaño de la hernia g.l.: grados de libertad 0,376 1,968; 59,026 0, 685 En el gráfico 7 puede observarse los cambios del índice de resistencia de la arteria testicular del lado afectado, según el tipo de hernia. 114 Estudio de la perfusión testicular tras hernioplastia preperitoneal Gráfico 7 Cambios en el índice de resistencia del la arteria testicular del lado afectado según tipo de hernia 5.3.2 Índice de resistencia del parénquima testicular Realizado el análisis de la varianza de cuatro vías, se ha obtenido que todos los contrastes sobre las interacciones son no significativos: Tabla 20 Análisis de la varianza de cuatro vías para el índice de resistencia del parénquima testicular Método de Greenhouse-Geisser Fexp g.l. p-valor Índice de resistencia del parénquima testicular 4,779 1,860; 55,801 0,014 Índice de resistencia del parénquima testicular x tipo de hernia 0,482 1,860; 55,801 0,696 Índice de resistencia del parénquima testicular x tamaño de la hernia 0,828 1,860; 55,801 0,482 Índice de resistencia del parénquima testicular x tamaño de la hernia x tipo de hernia g.l.: grados de libertad 0,587 1,860; 55,801 0,625 115 Estudio de la perfusión testicular tras hernioplastia preperitoneal Tanto el tipo de hernia como el tamaño de la hernia no tienen ningún efecto significativo sobre la resistencia testicular media del parénquima testicular. En cuanto al índice de resistencia del parénquima testicular, se obtienen las mismas conclusiones que en el análisis de la varianza de dos vía, como puede observarse en el gráfico 8. Gráfico 8 Cambios en el índice de resistencia del parénquima testicular del lado afectado según tipo de hernia 5.3.3 Volumen testicular Aplicado el análisis de la varianza de cuatro vías se han obtenido los siguientes resultados: 116 Estudio de la perfusión testicular tras hernioplastia preperitoneal Tabla 21 Análisis de la varianza de cuatro vías para el volumen testicular Fexp g.l. p-valor Volumen 17,903 2,315; 69,460 <10-4 Volumen x tipo de hernia 5,537 2,315; 69,460 0,004 Volumen x tamaño 1,334 2,315; 69,460 0,271 Volumen x tipo de hernia x tamaño 0,958 2,315; 69,460 0,400 Método de Greenhouse-Geisser Los dos únicos contrastes significativos son el volumen y la interacción entre el volumen y el tipo de hernia. El tamaño de la hernia no tiene ningún efecto significativo sobre el volumen testicular. En cuanto al volumen testicular, la investigación de las causas de la significación da lugar a los mismos resultados obtenidos en el análisis de la varianza de dos vías para esta misma variable. En cuanto a la interacción entre el volumen testicular y el tipo de hernia, la búsqueda de las causas de la significación se ha realiza haciendo todas las comparaciones por parejas al error α=10% (debido al desequilibrio de los tamaños muestrales) y se ha empleado el método secuencial de Newman-Keuls. Los resultados obtenidos son: 117 Estudio de la perfusión testicular tras hernioplastia preperitoneal Tabla 22 Comparaciones por parejas del volumen testicular en hernias directas Texp g.l. (k; f) Resultado Preoperatorio-postoperatorio inmediato 1,518 (4; 38,29) NS (p>10%) Preoperatorio- a los tres meses 1,108 (4; 38,29) NS (p>10%) Preoperatorio- lado sano 0,182 (4; 38,29) NS (p>10%) Postoperatorio inmediato- a los tres meses 0,411 (4; 38,29) NS (p>10%) Postoperatorio inmediato- lado sano 1,700 (4; 38,29) NS (p>10%) A los tres meses-lado sano 1,289 (4; 38,29) NS (p>10%) Método de Tukey y método de Newman-Keuls En los sujetos con hernia directa no se han encontrado diferencias significativas entre los volúmenes medios testiculares en las cuatro determinaciones. Tabla 23 Comparaciones por parejas del volumen testicular en hernias indirectas Texp g.l. (k; f) Resultado Preoperatorio-postoperatorio inmediato 2,269 (2; 38,29) Significativo (p<10%) Preoperatorio- a los tres meses 0,282 (2; 38,29) NS (p>10%) Preoperatorio- lado sano 3,959 (4; 38,29) Significativo (p<10%) Postoperatorio inmediato- a los tres meses 2,552 (4; 38,29) Significativo (p<10%) Postoperatorio inmediato- lado sano 6,228 (4; 38,29) Significativo (p<10%) A los tres meses-lado sano 3,676 (4; 38,29) Significativo (p<10%) Método de Tukey y método de Newman-Keuls 118 Estudio de la perfusión testicular tras hernioplastia preperitoneal Por tanto, se han encontrado diferencias significativas en cuanto a los volúmenes medios testiculares en las determinaciones preoperatorio-postoperatorio inmediato, preoperatorio-sano, postoperatorio- a los tres meses, postoperatorio inmediato-sano, a los tres meses-postoperatorio inmediato. De esta forma, en el grupo con hernia indirecta se ha obtenido que: El volumen medio testicular es significativamente mayor en el postoperatorio inmediato que en el preoperatorio (p<10%). El volumen medio testicular es significativamente menor en el lado sano que en el preoperatorio (p<10%). El volumen medio testicular es significativamente menor a los tres meses que en el postoperatorio inmediato (p<10%). El volumen medio testicular es significativamente menor en el lado sano que en el postoperatorio inmediato (p<10%) El volumen medio es significativamente menor en el lado sano que a los tres meses (p<10%). No se han encontrado diferencias significativas entre los volúmenes en el preoperatorio y a los tres meses de la cirugía (p>10%). 119 Estudio de la perfusión testicular tras hernioplastia preperitoneal Tabla 24 Comparaciones del volumen testicular medio entre los dos tipos de hernia en cada determinación Determinación Tipo de hernia Texp g.l. (k;f) Resultado Preoperatorio Directa-Indirecta 2,912 (4; 38,29) Significativo (p<10%) Postoperatorio inmediato Directa-Indirecta 3,325 (4; 38,29) Significativo (p<10%) A los tres meses Directa-Indirecta 1,455 (2; 38,29) NS (p>10%) En el lado sano Directa-Indirecta 0,483 (2; 38,29) NS (p>10%) Método de Bouferroni y método de Newman-Keuls Por tanto, existen diferencias significativas entre los pacientes con hernia directa e indirecta en el preoperatorio y en el postoperatorio inmediato en cuanto al volumen testicular medio. No se han encontrado diferencias significativas ni a los tres meses ni en el lado sano. Por consiguiente: En el preoperatorio, el volumen testicular medio es significativamente mayor en los sujetos con hernia indirecta que en los que la tienen directa (p<10%). En el postoperatorio inmediato, el volumen testicular medio es significativamente mayor en los sujetos con hernia indirecta que en los que la tienen directa (p<10%). No se han encontrado diferencias significativas entre los sujetos con hernia directa y los sujetos con hernia indirecta en cuanto al volumen testicular medio a los tres meses y en el lado sano. Estos hallazgos pueden observarse en el gráfico 9. 120 Estudio de la perfusión testicular tras hernioplastia preperitoneal Gráfico 9 Cambios en el volumen testicular afectado según tipo de hernia Las hernias indirectas presentan ligeramente mayor volumen preoperatorio que las indirectas aunque a los tres meses de la cirugía alcanzan valores similares a los de las hernias directas. 5.3.4 Diámetro del cordón El análisis de la varianza de cuatro vías se ha realizado sobre el logaritmo neperiano del diámetro del cordón, obteniéndose los siguientes resultados: Tabla 25 Análisis de la varianza de cuatro vías para el volumen testicular Fexp Grados de libertad p-valor Ln del diámetro 11,918 2,315; 69,460 <10-4 Ln del diámetro x tipo de hernia 5,541 2,315; 69,460 0,006 Ln del diámetro x tamaño 0,742 2,315; 69,460 0,486 Ln del diámetro x tipo de hernia x tamaño 1,155 2,315; 69,460 0,323 Método de Greenhouse-Geisser 121 Estudio de la perfusión testicular tras hernioplastia preperitoneal Los dos únicos contrastes que son significativos son el de los efectos principales (logaritmo del diámetro) y el de la interacción entre el logaritmo del diámetro y el tipo de hernia. El tamaño de la hernia no tiene ningún efecto significativo sobre el diámetro del cordón. En cuanto al logaritmo del diámetro, la investigación de las causas de la significación da lugar a las mismas conclusiones que en el análisis de la varianza de dos vías para esta mismas variable. En cuanto a la interacción entre el logaritmo neperiano del diámetro y el tipo de hernia, la investigación de las causas de la significación se ha realizado haciendo todas las comparaciones por parejas al error α=10% (debido al desequilibrio de los tamaños muestrales) y se ha empleado el método secuencial de Newman-Keuls. Los resultados obtenidos son: Tabla 26 Comparaciones por parejas del diámetro del cordón en hernias directas Texp g.l. (k; f) Resultado Preoperatorio-postoperatorio inmediato 3,080 (4; 35,13) Significativo (p<10%) Preoperatorio- a los tres meses 0,188 (2; 35,13) NS (p>10%) Preoperatorio- lado sano 1,116 (2; 35,13) NS (p>10%) Postoperatorio inmediato- a los tres meses 2,892 (4; 35,13) Significativo (p<10%) Postoperatorio inmediato- lado sano 1,963 (2; 35,13) Significativo (p<10%) A los tres meses-lado sano 0,928 (2; 35,13) NS (p>10%) Método de Tukey y método de Newman-Keuls En los pacientes con hernia directa se han encontrado diferencias significativas entre las determinaciones pre-post, post-3 meses y post-sano en cuanto al logaritmo del diámetro medio. 122 Estudio de la perfusión testicular tras hernioplastia preperitoneal No se han encontrado diferencias significativas en el resto de comparaciones por parejas. Por tanto, El logaritmo del diámetro medio es significativamente mayor en el postoperatorio inmediato que en el preoperatorio (p<10%). El logaritmo del diámetro medio es significativamente mayor en el postoperatorio inmediato que a los tres meses de la cirugía (p<10%). El logaritmo del diámetro medio es significativamente mayor en el postoperatorio inmediato que en lado sano (p<10%). No se han encontrado diferencias significativas en las determinaciones preoperatorio-a los tres meses de la cirugía, preoperatorio-sano, y 3 meses-sano. Tabla 27- Comparaciones por parejas del diámetro del cordón en hernias indirectas Texp g.l. (k; f) Resultado Preoperatorio-postoperatorio inmediato 0,485 (4; 35,13) NS (p>10%) Preoperatorio- a los tres meses 0,878 (4; 35,13) NS (p>10%) Preoperatorio- lado sano 1,483 (4; 35,13) NS (p>10%) Postoperatorio inmediato- a los tres meses 1,362 (4; 35,13) NS (p>10%) Postoperatorio inmediato- lado sano 1,968 (4; 35,13) NS (p>10%) A los tres meses-lado sano 0,605 (4; 35,13) NS (p>10%) Método de Tukey y método de Newman-Keuls 123 Estudio de la perfusión testicular tras hernioplastia preperitoneal En los sujetos con hernia indirecta no se han encontrado diferencias significativas entre las 4 determinaciones en cuanto al logaritmo del diámetro. Tabla 28 Comparaciones del logaritmo del diámetro medio entre los dos tipos de hernia en cada determinación Determinación Tipo de hernia Texp g.l. (k;f) Resultado Preoperatorio Directa-Indirecta 3,042 (4; 35,13) Significativo (p<10%) Postoperatorio inmediato Directa-Indirecta 0,142 (3, 35,13) NS (p>10%) A los tres meses Directa-Indirecta 2,042 (3, 35,13) NS (p>10%) En el lado sano Directa-Indirecta 0,486 (3, 35,13) NS (p>10%) Método de Bouferroni y método de Newman-Keuls De los resultados se obtiene que en el preoperatorio existen diferencias significativas entre el logaritmo del diámetro medio en los pacientes con hernia directa y los pacientes con hernia indirecta (p<10%). Por tanto, el logaritmo del diámetro medio es significativamente mayor en los sujetos con hernia indirecta que en los sujetos con hernia directa. En el resto de determinaciones no se han encontrado diferencias significativas entre los pacientes con hernia directa y los pacientes con hernia indirecta en cuanto al logaritmo del diámetro medio. Estos cambios quedan reflejados en el gráfico 10 124 Estudio de la perfusión testicular tras hernioplastia preperitoneal Gráfico 10 Cambios en el diámetro del cordón afectado según tipo de hernia 5.3.5 Grosor del escroto Aplicado el análisis de la varianza de 4 vías se han obtenido los siguientes resultados: Tabla 29 Análisis de la varianza de cuatro vías para el grosor escrotal Fexp g.l. p-valor Grosor escrotal 1,818 1,846; 55,37 0,174 Grosor escrotal x tipo de hernia 2,636 1,846; 55,37 0,085 Grosor escrotal x tamaño de la hernia 1,310 1,846; 55,37 0,277 Grosor escrotal x tipo de hernia x tamaño de la hernia g.l: grados de libertad 1,743 1,846; 55,37 0,187 Por tanto la interacción entre el grosor del escroto y el tipo de hernia es el único contraste significativo. Para buscar las causas de la significación se han realizado todas las comparaciones por parejas con un error α=10% debido al importante desequilibrio 125 Estudio de la perfusión testicular tras hernioplastia preperitoneal de los tamaños muestrales y se ha empleado el método secuencial de Newman-Keuls. Los resultados han sido: Tabla 30- Comparaciones por parejas del grosor en hernias directas Texp g.l. (k; f) Resultado Preoperatorio-postoperatorio inmediato 2,209 (3; 76,21) Significativo (p<0,1) Preoperatorio- a los tres meses 0,202 (2; 76,21) NS (p>0,1) Preoperatorio- lado sano 0,033 (2; 76,21) NS (p>0,1) Postoperatorio inmediato- a los tres meses 2,410 (4, 76,21) Significativo (p<0,1) Postoperatorio inmediato- lado sano 2,242 (3, 76,21) Significativo (p<0,1) A los tres meses-lado sano 0,169 (2, 76,21) NS Método de Tukey y método de Newman-Keuls Por tanto, en los sujetos con hernia directa se han encontrado diferencias significativas entre las determinaciones en el preoperatorio y el postoperatorio inmediato, postoperatorio inmediato y a los tres meses de la cirugía y en el postoperatorio y el lado sano. Por tanto, en los sujetos con hernia directa: El grosor escrotal medio es significativamente menor en el preoperatorio que en postoperatorio inmediato (p<0,10). El grosor escrotal medio del escroto es significativamente menor a los tres meses que el postoperatorio (p<0,10). El grosor escrotal medio es significativamente menor en el lado sano que en el postoperatorio inmediato (p<0,10). No se han encontrado diferencias significativas entre el resto de comparaciones por parejas 126 Estudio de la perfusión testicular tras hernioplastia preperitoneal Tabla 31 Comparaciones por parejas del grosor en hernias indirectas Texp g.l. (k; f) Resultado Preoperatorio-postoperatorio inmediato 0,967 (4; 76,21) NS (p>10%) Preoperatorio- a los tres meses 1,146 (4; 76,21) NS (p>10%) Preoperatorio- lado sano 0,704 (4; 76,21) NS (p>10%) Postoperatorio inmediato- a los tres meses 0,179 (4; 76,21) NS (p>10%) Postoperatorio inmediato- lado sano 0,263 (4; 76,21) NS (p>10%) A los tres meses-lado sano 0,441 (4; 76,21) NS (p>10%) Método de Tukey y método de Newman-Keuls Por tanto, todas las comparaciones por parejas son no significativas (p>10%) y por tanto en los sujetos con hernia indirecta no existen diferencias significativas entre la cuatro determinaciones en cuanto al grosor escrotal medio. 127 Estudio de la perfusión testicular tras hernioplastia preperitoneal Tabla 32 Comparaciones del grosor testicular medio entre los dos tipos de hernia en cada determinación Determinación Tipo de hernia Texp g.l. (k;f) Resultado Preoperatorio Directa-Indirecta 0,788 (3; 76,21) NS (p>10%) Postoperatorio inmediato Directa-Indirecta 2,485 (4; 76,21) Significativo (p<10%) A los tres meses Directa-Indirecta 0,033 (3; 76,21) NS (p>10%) En el lado sano Directa-Indirecta 0,184 (3; 76.21) NS (p>10%) Método de Bouferroni y método de Newman-Keuls De los resultados se obtiene que en el postoperatorio inmediato existen diferencias significativas entre el grosor testicular medio en los sujetos con hernia directa y en los sujetos con hernia indirecta. En el resto de determinaciones no se han encontrado diferencias significativas entre los pacientes con hernia directa y hernia indirecta en cuanto al grosor medio del escroto (p<10%). Estos resultados pueden observarse en el gráfico 11. 128 Estudio de la perfusión testicular tras hernioplastia preperitoneal Gráfico 11 Cambios del grosor escrotal tras cirugía según tipo de hernia 129 Estudio de la perfusión testicular tras hernioplastia preperitoneal 6. DISCUSIÓN 130 Estudio de la perfusión testicular tras hernioplastia preperitoneal 6.1 Situación actual La cirugía de la hernia inguinal es una de las que con más frecuencia se realizan en el mundo (210). Este hecho implica una importante repercusión sociosanitaria y un creciente interés, causa de la aparición de múltiples trabajos elaborados por grupos de especialistas que profundizan en todos los aspectos de la técnica. Los principales objetivos en la cirugía de la hernia inguinal podrían ser la disminución de los gastos de intervención y días de hospitalización, la reducción de la incapacidad laboral transitoria (210) y el descenso del porcentaje de recidivas. La creación de unidades de cirugía ambulatoria ha permitido conseguir parte de estos objetivos. En ellas el paciente puede ser intervenido y marcharse a las pocas horas a su domicilio. La anestesia locorregional, el uso de técnicas sin tensión y la evolución de los implantes protésicos han permitido un mayor confort para el enfermo y una reducción sustancial del tiempo de incapacidad transitoria (211). Entre los años 1890 y 1980, la cirugía de las hernias inguinales consistió fundamentalmente en reparaciones suturadas (Anderson, Bassini, Ferguson, Halsted, Mc Vay, Shouldice, Taner). Todas estas técnicas de reparación con tejido autólogo tenían en común la desventaja de crear tensión sobre la línea de sutura. Su evolución se dirigió hacia una mayor complejidad y se usaron en ellas colgajos o injertos tisulares, transposición de diversos tejidos y distintas incisiones relajantes. Sin embargo, todas ellas tenían en común su dificultad técnica, que producían tensión tisular, incorporación tardía al trabajo, mayor número de complicaciones y altas tasas de recidiva. 131 Estudio de la perfusión testicular tras hernioplastia preperitoneal En la década de los 50 comienza la investigación de materiales protésicos para la reparación de grandes defectos herniarios buscando una menor tasa de recidiva (123;212;213). Desde la primera publicación de Usher acerca del uso del polipropileno en el tratamiento de la hernia inguinal (124) se han sucedido varias décadas de avances. Lichtenstein, en 1986 presenta su hernioplastia abierta (214) y algunos años después se establece el abordaje endoscópico preperitoneal (118). El uso de mallas en el tratamiento de la hernia inguinal ha supuesto una reducción de la duración de la intervención y de la estancia hospitalaria. Estas mallas suponen el primer material aloplástico usado rutinariamente incluso en sujetos jóvenes a pesar de la existencia de alternativas “naturales”. Numerosos ensayos clínicos han descrito los excelentes resultados con dichas técnicas, que han disminuido el índice de recidivas entre 30 y el 40 por ciento (215). Su uso no garantiza el buen pronóstico en todos los pacientes. Incluso algunos autores manifiestan la opinión de que las técnicas sin sutura se limitan a retrasar la aparición de las recidivas de modo que la tasa de recurrencias sufre un ascenso lineal años después de la cirugía (136). Las reacciones de cuerpo extraño constituyen un problema específico a menudo infraestimado del uso de material protésico. La respuesta inflamatoria que ocurre tras la colocación de una malla no está sólo relacionada con un proceso de cicatrización normal, sino también con una reacción especifica de la malla. De hecho, esta respuesta inflamatoria también existe en las reparaciones herniarias sin uso de injertos, pero son de una importancia mucho menor frente a las actuales hernioplastias donde se una observa elevación significativa de citokinas (168). 132 Estudio de la perfusión testicular tras hernioplastia preperitoneal Esta reacción es vital para la normal integración del polipropileno e implica una respuesta fibroblástica limitada de aproximadamente 7 días en su fase aguda (190). La respuesta inflamatoria se reduce enormemente en los 6 meses siguientes (191) sugiriendo una buena capacidad de integración aunque se han descrito casos de reacción inflamatoria incluso años después (192). El prolipropileno sufre procesos de retracción al integrarse en el tejido conectivo, aunque también puede, teóricamente, sufrir procesos de “expansión” (193). Ciertos estudios analizan la repercusión de la fibrosis de las mallas sobre el flujo testicular (194) valorando atrofia (195) y función sexual (196), incluso, de forma muy infrecuente, el desarrollo de tumores (187). La irrigación arterial y el drenaje venoso del testículo se aseguran por múltiples anastomosis que lo protegen de la isquemia (220). La preservación de estos vasos pasa por una disección cuidadosa para mantener estas anastomosis durante la cirugía. La extirpación de la capa del músculo cremastérico a nivel del anillo profundo facilita esta preservación y aumenta la viabilidad testicular (221). Una disección amplia del cordón distal al pubis (realizada en la maniobra de extirpación de un gran saco herniario distal en la que a menudo el testículo se extrae de la bolsa escrotal) puede producir roturas en las anastomosis existentes entre las arterias escrotal, pudenda y testicular e incluso producir la obstrucción del flujo venoso secundaria a trombosis del seno pampiniforme, dando lugar a un infarto testicular y ulteriormente una atrofia testicular. 133 Estudio de la perfusión testicular tras hernioplastia preperitoneal Esta circulación colateral es tan rica que la sección completa del cordón espermático a nivel del anillo inguinal profundo puede no provocar de forma sistemática una atrofia testicular, siempre y cuando no se manipule el testículo sacándolo del escroto (222; 223). En cualquier caso, en la cirugía herniaria es muy importante la preservación de estos vasos. De hecho, recientemente, Wantz (224) ha descrito el no aislamiento del saco herniario distal y el manejo de la porción proximal del mismo en la parte más alta del canal inguinal para reducir la morbilidad asociada. Asimismo, la reparación del anillo inguinal profundo con maniobras a tensión puede estrangular el cordón espermático produciendo así fenómenos isquémicos. La obstrucción venosa también puede ser causada en parte por un hematoma en la región inguinal que aumente la presión a dicho nivel. La disección extrema del cordón, dejando bien identificadas las estructuras que lo conforman (el deferente, una arteria y venas) hace que al menos una tercera parte de los casos presente una isquemia testicular (225) lo que nos orienta sobre las posibles consecuencias de una excesiva reacción fibroblástica a dicho nivel producida por la colocación de una malla de polipropileno. De entre los abordajes preperitoneales, la hernioplastia preperitoneal en M descrita por Picazo et al (122) resuelve prácticamente la totalidad de las hernias de cualquier tipo (inguinal, crural, primaria o recidivada, multirrecurrente, bilateral, o complicada) con la ventaja en esta última de poder prescindir de la laparotomía para la revisión y potencial resección de asas intestinales. Todo ello sin la utilización de suturas en la colocación de la malla que queda autofijada con la presión intrabdominal. 134 Estudio de la perfusión testicular tras hernioplastia preperitoneal Existen dos aspectos importantes en la hernioplastia preperitoneal en M: El considerable tamaño de la prótesis colocada obliga a prestar especial atención por sus posibles efectos en la vascularización testicular. La posición anatómica de la misma, presentando una relación directa con las estructuras del cordón espermático. La recurrencia es la complicación más importante tras la realización de una reparación herniaria. La reparación quirúrgica de la hernia recidivada supone un importante aumento del coste, es técnicamente compleja e implica una mayor morbilidad. La recurrencia precoz parece ser fruto de errores técnicos o de la aparición de tensión en la línea de sutura. Las recurrencias tardías pueden ser consecuencia de una alteración en el metabolismo del colágeno en el caso de pacientes de edad avanzada. En estos pacientes tanto la debilidad del suelo pélvico como la aparición de hernias recurrentes podrían estar en relación con el metabolismo colágeno (217). La introducción de materiales protésicos en la reparación de la hernia inguinal primaria han disminuido mucho los índices de recidiva, aunque han aparecido nuevos problemas, como la recurrencia en pacientes sometidos a reparaciones previas con mallas. El abordaje preperitoneal podría ser el más adecuado para intervenir este tipo de hernias ya que se evitan estructuras manipuladas en la primera cirugía. Por ello, diversos autores recomiendan el acceso preperitoneal no sólo en hernias recurrentes sino también en pacientes sometidos a cirugías escrotales, como vasectomía o hidrocelectomía, puesto que éstas pueden afectar al cordón y predisponer a los pacientes a la orquitis isquémica si debe disecarse nuevamente el cordón espermático (169). 135 Estudio de la perfusión testicular tras hernioplastia preperitoneal 6.2 Consideraciones sobre la ubicación de la prótesis La localización de la prótesis también sería un factor a tener en cuenta en la valoración del potencial de agresión sobre estructuras del cordón. Aunque la fisiopatología de la posible relación entre mallas e infertilidad aun no está clara el efecto que tiene sobre el cordón testicular no deber ser ignorado. El músculo cremáster puede ser una ventaja a este respecto, especialmente en la técnica de Lichtenstein, donde realizaría una función de protección de los elementos del cordón, mientras que en otras técnicas como la preperitoneal la prótesis permanece en contacto directo con vasos y nervios. Así, encontramos como, al menos teóricamente, las técnicas que ponen en contacto la malla con los elementos del cordón con la interfase protectora del músculo cremáster (como la técnica de Lichtenstein) podrían ser menos lesivas. En la vía preperitoneal la fascia espermática retroparietal podría tener algún tipo de función protectora. Sin embargo, en nuestra técnica habitual se realiza la sección de esta fascia puesto que facilita la disección craneal de los elementos del cordón, permitiendo la identificación de los vasos ilíacos externos y la correcta colocación de la prótesis. Aydede et al (194) y Akbulut (195) et al hallaron diferente tipo de repercusión de la prótesis según su localización. Aydede et al (194) estudian la perfusión y función testicular en un ensayo clínico randomizado con 30 pacientes. En el grupo I se usó la técnica de Lichtenstein y en el grupo II se utilizó una técnica endoscópica totalmente extraperitoneal (TEP). Se observaron alteraciones del flujo sanguíneo testicular en el tercer día postoperatorio en ambos grupos, pero no hubo diferencias a los tres meses de la cirugía. 136 Estudio de la perfusión testicular tras hernioplastia preperitoneal Akbulut et al (195) también evalúan los efectos de las prótesis en la función y el volumen testicular usando la técnica de Lichtenstein y el TEP. Concluyen que existen cambios significativos en los niveles de testosterona y de volumen testicular en el grupo que usó TEP. Según estos autores la localización de la prótesis vía preperitoneal podría afectar con mayor intensidad al flujo testicular que un abordaje anterior tipo Lichtenstein, aunque estos cambios se produjeron dentro de límites normales. Sin embargo, este mismo grupo de trabajo (246), 2 años más tarde advierte que en lo que respecta a las variables hemodinámicas no hay afectación tras la cirugía en ninguno de los dos grupos. Ersin (201) estudia los cambios hemodinámicos precoces usando estas dos técnicas realizando las ecografías antes de la cirugía, a las 24 horas y a la semana de la intervención, concluyendo que el flujo testicular es influenciado en el abordaje laparoscópico, en comparación con el abordaje anterior que no presenta cambios significativos, pero no investiga si estos cambios se mantienen a medio o largo plazo. En contraste con estos datos Beddy et al (199) afirman que la propia hernia inguinal podría alterar la fertilidad, provocando cambios en el flujo testicular y que estos cambios mejoran tras la cirugía. Este grupo realiza un estudio en el que se interviene a 37 pacientes mediante hernioplastia de Lichtenstein (n=17) o hernioplastia totalmente extraperitoneal (n=20). En el preoperatorio existió un aumento de índice de resistencia en el lado afectado comparado con el lado normal (0,0601, 0,569; p<0,001). Esta diferencia se invirtió tras la cirugía en un seguimiento de 6.1 meses. No hubo diferencias entre las técnicas en cuanto a la función testicular. 137 Estudio de la perfusión testicular tras hernioplastia preperitoneal En esta misma línea, Turgut et al (204), en un estudio que persigue la valoración de la afectación de la perfusión testicular por la hernia en 26 varones sin cirugía, encuentra datos sugerentes de que la hernia podría afectar al flujo testicular debido a una compresión mecánica intermitente de la hernia. Lima y Nieto (247) estudian de forma prospectiva los efectos del implante de una malla de polipropileno según la técnica de Lichtenstein en pacientes con hernia inguinal. Los pacientes fueron evaluados ecográficamente antes de la cirugía y a los 3 y 6 meses después de la intervención. No encontraron alteraciones en el volumen y flujo testicular durante este periodo. 6.4 Comentarios sobre la hemodinámica de la región inguinoescrotal 6.4.1Efectos sobre el índice de resistencia de la arteria testicular El flujo arterial testicular es fundamental para mantener el volumen y la función testicular (225). Los valores normales en la arteria testicular están entre 0.63 y 1. Aydede et al (194) observaron que en grupo preperitoneal, el índice de resistencia de la arteria testicular en el postoperatorio inmediato fue significativamente superior al tomado en el preoperatorio (P<0,001). Ersin et al (201), comparando una técnica preperitoneal laparoscópica y una técnica anterior abierta, hallaron diferencias estadísticamente significativas entre el índice de 138 Estudio de la perfusión testicular tras hernioplastia preperitoneal resistencia de la arteria testicular preoperatorio y el tomado a las 24 horas de la cirugía (0.70±0.06 vs 0.68±0.1) en el grupo preperitoneal. Dilek et al (246) no encontraron diferencias al comparar los cambios de índice de resistencia de la arteria testicular entre pacientes intervenidos de hernia inguinal mediante técnica abierta o laparoscópica. Lima et al (247) encuentran que el índice de resistencia de la arteria testicular fue mayor en el lado de la hernia que en lado sano, aunque esta diferencia no fue estadísticamente significativa (p=0,582) y no observan corrección de esta diferencia a los tres o a los seis meses de la cirugía, por lo que asumen que las diferencias de flujo preoperatorias nos pueden ser atribuidas a la hernia. En nuestro estudio, no se observan diferencias significativas comparando las cuatro determinaciones de la resistencia de la arteria testicular. Estos valores están dentro de los límites considerados normales, que se encuentran entre 0 ,63 y 1 (248). Así mismo, no existen diferencias significativas si agrupamos los datos según el tipo y/o el tamaño de la hernia lo que coincide con otros autores (200;249). 6.4.2 Efectos sobre el índice de resistencia del parénquima testicular El índice de resistencia testicular es un indicador de una disminución de la microvascularización del parénquima testicular lo que conllevaría una alteración de la espermatogénesis (250). Por tanto, el hallazgo de un índice de resistencia alterado de 139 Estudio de la perfusión testicular tras hernioplastia preperitoneal las arterias intratesticulares puede relacionarse con de un recuento de espermatozoides patológico (251). Ello ha motivado el interés de los autores para valorar las posibles alteraciones funcionales que implique la hernioplastia. Turgut (204), encuentra que el índice de resistencia intratesticular previo a la cirugía fue significativamente mayor en el lado de la hernia en comparación con el lado contralateral (0,66± 0,06 versus 0,63± 0,05; P< 0,05, Student test ). Beddy et al (199) observan que el índice de resistencia testicular está aumentado en lado afectado preoperatoriamente en comparación con el control (p<0,001) y que existe una reducción significativa del mismo tras la cirugía (Grupo laparoscópico, p=0.016 y grupo de cirugía abierta p<0,001) que sin embargo no se correlaciona con cambios en el volumen testicular. Ersin (201) encontró diferencias estadísticamente significativas entre el índice de resistencia testicular preoperatorio y el tomado a las 24 horas de la cirugía (0.64±0.1 vs 0.61±0.1) en los pacientes intervenidos por vía preperitoneal laparoscópica. En este sentido, en nuestro estudio el único cambio significativo observado sobre este parámetro fue en la comparación entre el postoperatorio inmediato y el resto de las determinaciones aunque siempre dentro de parámetros normales, al igual que Ramadan et al (249) que encuentra una diferencia de 0,77 vs 0,74 entre la medición pre y postoperatoria con p>0,05. Algunos autores observan que esta disminución se mantiene en el tiempo(199;200), lo que interpretan como una mejora de la perfusión tras la cirugía. Nosotros encontramos también una leve mejoría en el índice de resistencia testicular a los tres meses de la cirugía aunque ésta no llegue a ser significativa (0,69 vs 140 Estudio de la perfusión testicular tras hernioplastia preperitoneal 0,68 con p=0,935), ni siquiera cuando se analizan por separado hernias directas e indirectas. Es probable que la mejoría inmediata tras la cirugía del flujo dentro del parénquima testicular tenga más relación con la hiperemia e inflamación postraumática que con una mejoría real del flujo a nivel testicular. En caso contrario esta disminución del índice resistencia se mantendría estable en el tiempo, lo que no pueden confirmar nuestros datos. El índice de resistencia testicular se mantiene relativamente estable a largo plazo probablemente gracias al concurso de la rica red anastomótica testicular que se produce distalmente, a la entrada de la arteria testicular en el testículo que podría no verse afectada por la hernia. Tanto el tipo de hernia como el tamaño de la hernia no tienen efecto significativo sobre la resistencia testicular media del testículo en nuestros resultados. El flujo testicular es relativamente constante aunque se cree que la distribución regional dentro del testículo varía en grado significativo según las necesidades metabólicas locales (6). Se postula que la sangre del sistema venoso testicular tiende a estancarse porque la pared de la vena espermática es muy delgada, tiene poco cantidad de músculo y carece de válvulas efectivas, aunque este tema aun hoy es controvertido. Al margen de este hecho, la obstrucción de los conductos linfático en el cordón espermático siempre es seguida por la dilatación del intersticio (252). En nuestra investigación tampoco se ha valorado la obstrucción linfática lo que supone una limitación de estudio. 141 Estudio de la perfusión testicular tras hernioplastia preperitoneal 6.4.3 Efectos sobre el volumen testicular El volumen testicular es un importante marcador de atrofia testicular tras la cirugía herniaria. Wantz (222) describe la atrofia testicular como consecuencia de una orquitis que puede ocurrir tras la corrección de una hernia. La mayor parte del volumen testicular (80%) viene dada por los túbulos seminíferos y los elementos germinales. En los casos de reducción del número de estas células, ésta se manifiesta por una reducción del volumen testicular o una atrofia testicular. Existe controversia en literatura sobre si la colocación de una malla en contacto directo con los elementos del cordón testicular, tal y como se lleva a cabo en la vía preperitoneal, puede afectar al volumen testicular. Lógicamente, la técnica depurada en el manejo de los tejidos es condición importante para evitar atrofias testiculares iatrógenas (176;181). En nuestro estudio, el volumen testicular es significativamente mayor en el postoperatorio inmediato que en el preoperatorio (p=0,002) en posible relación con los cambios inflamatorios tras la cirugía. Algunos estudios a nivel experimental revelan hallazgos de trombosis a nivel del cordón testicular que pueden ser explicados por cambios inflamatorios e incluso sugieren que 142 Estudio de la perfusión testicular tras hernioplastia preperitoneal tras la disección del cordón inguinal pueden existir cambios a nivel de volumen testicular sin verse afectada la función testicular (253). Ello refleja una posible limitación de nuestro estudio, en el que no existe medición de datos venosos ecográficos qué podría ayudarnos a valorar congestión testicular tal y como afirman otros autores (249). En nuestro estudio el volumen medio testicular es significativamente menor en el lado sano que en el lado afectado (p=0,002), tal y como observan otros autores, como Turgut et al (204) en el que en un estudio sin cirugía, la media de los volúmenes testiculares ± su desviación estándar fue significativamente mayor en el lado afectado por la hernia que en lado contralateral (15,46±4,49 versus 14,45 ± 3,65ml, respectivamente; P<0,05, Student test). En nuestros resultados el volumen testicular sigue siendo significativamente menor en el lado sano que a los tres meses (p<10-4), no existiendo diferencias significativas entre el volumen preoperatorio y a los tres meses de la cirugía (p=0,89). Estos hallazgos son compartidos por Brisinda et al (200) que no encuentran cambios significativos de volumen testicular a los 9 meses de la cirugía utilizando la técnica de Lichtenstein. En otros estudios en los que se analizan cambios de volumen testicular tras cirugía del varicocele, se observó un aumento significativo del volumen testicular (207). Cuando analizamos los cambios en el volumen testicular según el tipo de hernia, encontramos que en los sujetos con hernia directa no se han encontrado diferencias 143 Estudio de la perfusión testicular tras hernioplastia preperitoneal significativas entre los volúmenes testiculares medidos en las cuatro determinaciones, por lo que podemos decir que la afectación del volumen testicular depende del tipo de hernia. Observamos como en el preoperatorio, el volumen testicular medio es significativamente mayor en los sujetos con hernia indirecta que en los que la tienen directa (p<10%). Una posible causa es que el testículo se vea influido por la hernia indirecta por presentar una relación inmediata con los vasos, aumentado ligeramente su tamaño a modo compensatorio. Por el contrario, Beddy et al (199) observan como no existieron diferencias significativas entre el volumen testicular preoperatorio entre hernias directas e indirectas (p =0.120; Student). No observaron cambios de volumen tras la cirugía aunque no se realizó un análisis estadístico de esta asociación utilizando como variable de agrupación el tipo de hernia. En este sentido, Mihmanli et al (254), encuentran una asociación entre la presencia de hidrocele testicular y su tamaño y resistencias vasculares que atribuyen a un aumento de la impedancia del flujo venoso y linfático por la compresión del hidrocele. Sin embargo, tras la corrección del hidrocele el volumen testicular disminuyó significativamente (p<0.001). En cualquier caso no está claro que los datos hallados en estudios de hidrocele o varicocele sean comparables a los de la hernia inguinal porque presenta una etiopatogenia y fisiopatología diferentes. En nuestro estudio no encontramos una disminución significativa a los tres meses de la cirugía con respecto al volumen 144 Estudio de la perfusión testicular tras hernioplastia preperitoneal preoperatorio (p>10%) de forma global y tampoco se han encontrado diferencias significativas entre los sujetos con hernia directa y los sujetos con hernia indirecta. Sin embargo, en el postoperatorio inmediato, el volumen testicular medio es significativamente mayor en los sujetos con hernia indirecta frente a los que padecen una hernia directa (p<10%), lo que podría sugerir una mayor agresión quirúrgica para el cordón cuando la reparación se realiza sobre hernias indirectas. En cuanto a su relación con el tamaño de la hernia encontramos que no tiene efecto sobre el volumen testicular, probablemente debido a que la mayoría de los pacientes presentaba hernia de pequeño o medio tamaño. En los sujetos con hernia directa no se evidenciaron diferencias significativas entre los volúmenes de las cuatro determinaciones, mientras que en aquellos con hernia indirecta, el volumen testicular del lado de la hernia fue significativamente mayor en comparación con el lado sano (p<10%). La razón por la que a pesar de los escasos cambios en el índice de resistencia testicular, el volumen testicular se modifica de forma significativa en hernias indirectas en el postoperatorio inmediato (aún dentro de parámetros normales) no es bien conocida. Algunos autores apuntan la posibilidad de que la obstrucción del flujo venoso, ya sea por una excesiva disección del cordón o por microtrombosis venosas puede causar cierto grado de infarto testicular (246) o bien por cambios inflamatorios derivados del trauma quirúrgico. Estos hallazgos son compartidos por Brisinda et al (200) que no encuentran cambios significativos de volumen testicular los 9 meses de la cirugía utilizando la técnica de 145 Estudio de la perfusión testicular tras hernioplastia preperitoneal Lichtenstein. En otros estudios en los que se analizan cambios de volumen testicular tras cirugía del varicocele se observó un aumento significativo del volumen testicular (207). Akbulut et al (195) encuentran que el volumen testicular disminuye significativamente en la técnica preperitoneal laparoscópica mientras en la técnica anterior no hay cambios (p=0,02) . Lima et al (247) no encuentran cambios en el volumen testicular en las tres ecografía realizadas (p=0.197) Uzzo (228) en su estudio experimental con perros observan como el volumen testicular tiende a descender ligeramente aunque sin significación estadística, aunque en otro estudio de este tipo se observó un aumento del volumen testicular de hasta el 10 por ciento al mes de la cirugía (240) Se desconoce si la cirugía de la hernia inguinal puede afectar de alguna forma al testículo contralateral. Este efecto se ha comprobado en otras patologías como el varicocele (255). Una posible limitación de nuestro estudio es la medición de las variables hemodinámicas del testículo no afecto por la hernia únicamente en el preoperatorio (utilizados como control). 146 Estudio de la perfusión testicular tras hernioplastia preperitoneal 6.4.4 Efectos sobre el grosor del escroto y el diámetro del cordón El edema escrotal es secundario a un proceso localizado o generalizado. La estructura elástica y flexible de los tejidos escrotales reacciona con edema ante cualquier tipo de proceso inflamatorio del sistema vascular o linfático. En su etiología aparecen multitud de causas médicas que pueden ir desde el fallo cardiaco, la hipoalbuminemia a la obstrucción venosa y/o linfática del drenaje pélvico. En muchos casos el diagnóstico de edema escrotal está realizado por la exploración, aunque la ecografía se ha descrito como prueba de alta sensibilidad y especificidad, aportando datos sobre la etiología del edema. El drenaje linfático se realiza a los ganglios linfáticos pélvicos e inguinales superficiales (256). En nuestro estudio, aparecieron diferencias significativas en el grosor escrotal tan sólo cuando se comparó la medida del postoperatorio inmediato con el resto de las determinaciones (p<0,10) en probable relación con una reacción inflamatoria pasajera. Es importante tener en cuenta que el drenaje venoso de la pared escrotal no se realiza a través de la vena testicular, sino a través de las venas pudendas externas hacia las venas safenas, así como vía las venas pudendas internas, hacia las venas ilíacas internas(256) por lo que una afectación leve de la vascularización venosa del cordón podría no afectar al grosor escrotal Nuestros resultados revelan que el diámetro medido es significativamente mayor en los sujetos con hernia indirecta que en los sujetos con hernia directa. El diámetro medio es significativamente mayor en el postoperatorio inmediato que el preoperatorio (p<10%) lo que estaría en relación con la manipulación quirúrgica del cordón y una reacción 147 Estudio de la perfusión testicular tras hernioplastia preperitoneal inflamatoria acompañante. Esta inflamación desparece a los tres meses de la cirugía no encontrando diferencias significativas entre el diámetro preoperatorio y a los tres meses de la cirugía (p>10%). 148 Estudio de la perfusión testicular tras hernioplastia preperitoneal 7. CONCLUSIONES 149 Estudio de la perfusión testicular tras hernioplastia preperitoneal 1. El volumen testicular del lado afectado por la hernia en pacientes con hernias indirectas es mayor que el lado sano contralateral y, a su vez, mayor que en los pacientes con hernias de tipo directo. 2. Mientras que el índice de resistencia de la arteria testicular no se modifica, el índice de resistencia del parénquima testicular disminuye en el postoperatorio inmediato para posteriormente normalizarse a los tres meses de la cirugía. 3. El volumen testicular no se modifica en los sujetos con hernia directa mientras que aumenta de forma significativa en el postoperatorio inmediato en los sujetos con hernia indirecta. 4. El diámetro del cordón y el grosor escrotal aumentan de forma transitoria con la cirugía para normalizarse a los 3 meses. Con todo ello podemos responder al objetivo general enunciado señalando que: No se han encontrado alteraciones permanentes en los parámetros analizados, por lo que puede descartarse un hipotético efecto adverso de la hernioplastia preperitoneal abierta en "M" sobre la perfusión testicular ipsilateral. 150 Estudio de la perfusión testicular tras hernioplastia preperitoneal 8. BIBLIOGRAFÍA 151 Estudio de la perfusión testicular tras hernioplastia preperitoneal (1) Condon RE. Surgical anatomy of the transversus abdominis and transversalis fascia. Ann Surg 1971 Jan;173(1):1-5. (2) Hong HX, Pan ZJ, Chen X, Huang ZJ. An anatomical study of corona mortis and its clinical significance. Chin J Traumatol 2004 Jun;7(3):165-9. (3) Bendavid R. The space of Bogros and the deep inguinal venous circulation. Surg Gynecol Obstet 1992 May;174(5):355-8. (4) Yalcin B, Komesli GH, Ozgok Y, Ozan H. Vascular anatomy of normal and undescended testes: surgical assessment of anastomotic channels between testicular and deferential arteries. Urology 2005 Oct;66(4):854-7. (5) Fowler R, STEPHENS FD. The role of testicular vascular anatomy in the salvage of high undescended testes. Aust N Z J Surg 1959 Aug;29:92-106. (6) Jiménez Cruz. Tratado de urología. Barcelona: 2007. (7) Chevallier JM, Wind P, Lassau JP. [Damage to the inguino-femoral nerves in the treatment of hernias. An anatomical hazard of traditional and laparoscopic techniques]. Ann Chir 1996;50(9):767-75. (8) Felix EL, Harbertson N, Vartanian S. Laparoscopic hernioplasty: significant complications. Surg Endosc 1999 Apr;13(4):328-31. (9) Van DT, Camann W. Meralgia paresthetica in the parturient. Int J Obstet Anesth 1995 Apr;4(2):109-12. (10) Stark E, Oestreich K, Wendl K, Rumstadt B, Hagmuller E. Nerve irritation after laparoscopic hernia repair. Surg Endosc 1999 Sep;13(9):878-81. (11) Totte E, Van HR, Kox G, Hendrickx L, van Zwieten KJ. Surgical anatomy of the inguinal region: implications during inguinal laparoscopic herniorrhaphy. Eur Surg Res 2005 May;37(3):185-90. (12) Fitzgibbons RJ, Jr., Camps J, Cornet DA, Nguyen NX, Litke BS, Annibali R, et al. Laparoscopic inguinal herniorrhaphy. Results of a multicenter trial. Ann Surg 1995 Jan;221(1):3-13. (13) Condon RE. Reassessment of groin anatomy during the evolution of preperitoneal hernia repair. Am J Surg 1996 Jul;172(1):5-8. (14) McVay CB. The anatomic basis for inguinal and femoral hernioplasty. Surg Gynecol Obstet 1974 Dec;139(6):931-5. (15) Spaw AT, Ennis BW, Spaw LP. Laparoscopic hernia repair: the anatomic basis. J Laparoendosc Surg 1991 Oct;1(5):269-77. 152 Estudio de la perfusión testicular tras hernioplastia preperitoneal (16) Histoire d´agrandisement de l´empire Othoman. Jonquieres M, editor. 397401. 1743. (17) Johnson J, Roth JS, Hazey JW, Pofahl WE. The history of open inguinal hernia repair. Curr Surg 2004 Jan;61(1):49-52. (18) Lascaratos JG, Tsiamis C, Kostakis A. Surgery for inguinal hernia in Byzantine times (A.D. 324-1453): first scientific descriptions. World J Surg 2003 Oct;27(10):1165-9. (19) Mirilas P, Colborn GL, McClusky DA, III, Skandalakis LJ, Skandalakis PN, Skandalakis JE. The history of anatomy and surgery of the preperitoneal space. Arch Surg 2005 Jan;140(1):90-4. (20) Read RC. Preperitoneal herniorrhaphy: a historical review. World J Surg 1989 Sep;13(5):532-9. (21) Hutchinson E. Case of strangulated hernia operated on by abdominal section laparotomy. Ohio Med Surg J 1878 Dec 12;3:499-502. (22) Keetley CB. On laparotomy in the treatment of strangulated hernia. Ann Surg 1886;3:459-68. (23) Tait R.L. A discussion on the treatment of hernia by median abdominal section. Br Med J 1891;(2):685. (24) Thomas AD, Rogers A. Edoardo Bassini and the wound that inspires. World J Surg 2004 Oct;28(10):1060-2. (25) Stoppa R. [The history of surgical management of hernias]. Ann Chir 2001 Apr;126(3):254-63. (26) Mahorner H, GOSS CM. Herniation following destruction of Poupart's and Cooper's ligaments: a method of repair. Ann Surg 1962 May;155:741-8. (27) Roque GP. The permanene cure of inguinal and femoral hernia: A modification of the standar operative procedures. Surg Gynecol Obstet 1919;(29):507-11. (28) Henry A. Operation for femoral hernia by midline extraperitoneal aproach. Lancet 1936;1:531-3. (29) WILLIAMS C. Repair of sliding inguinal hernia through the abdominal aproach (La Roque). Ann Surg 1947;(126):612-4. (30) McEVEDY PG. Femoral hernia. Ann R Coll Surg Engl 1950 Dec;7(6):484-96. (31) Nyhus LM, Condon RE, HARKINS HN. Clinical experiences with preperitoneal hernial repair for all types of hernia of the groin, with particular 153 Estudio de la perfusión testicular tras hernioplastia preperitoneal reference to the importance of transversalis fascia analogues. Am J Surg 1960 Aug;100:234-44. (32) McVEIGH HJ, BARKER WF. The midline extraperitoneal approach for the repair of inguinal and femoral hernias. West J Surg Obstet Gynecol 1954 Oct;62(10):534-8. (33) Mikkelsen WP, BERNE CJ. Femoral hernioplasty: suprapubic extraperitoneal (Cheatle-Henry) approach. Surgery 1954 May;35(5):743-8. (34) Nyhus LM, STEVENSON JK, LISTERUD MB, HARKINS HN. Preperitoneal herniorrhaphy; a preliminary report in fifty patients. West J Surg Obstet Gynecol 1959 Jan;67(1):48-54. (35) MANSFIELD RD. A "new" approach to the treatment of hernias of the groin. Am J Surg 1960 Sep;100:462-4. (36) Fowler R. The applied surgical anatomy of the peritoneal fascia of the groin and the "secondary" internal inguinal ring. Aust N Z J Surg 1975 Feb;45(1):814. (37) Fowler R. Preperitoneal repair of inguinal hernias in infancy and childhood. Aust Paediatr J 1973 Apr;9(2):85-9. (38) Estrin J LSBIR. The posterior approach to inguinal and femoral hernias. Surg Gynecol Obstet 1963;116:547-50. (39) Dyson WL, Pierce WS. Changing concept of inguinal herniorrhaphy; experience with preperitoneal approach. Arch Surg 1965 Dec;91(6):971-5. (40) Robertson HT. Preperitoneal approach in the repair of inguinal hernias. Am J Surg 1966 Nov;112(5):627-31. (41) Margoles JS, Braun RA. Preperitoneal versus classical hernioplasty. Am J Surg 1971 Jun;121(6):641-3. (42) Stoppa R, Petit J, Henry X. Unsutured Dacron prosthesis in groin hernias. Int Surg 1975 Aug;60(8):411-2. (43) Stoppa R. [Hernia surgery 1996]. J Chir (Paris) 1996 Sep;133(6):244-6. (44) Champault GG, Rizk N, Catheline JM, Turner R, Boutelier P. Inguinal hernia repair: totally preperitoneal laparoscopic approach versus Stoppa operation: randomized trial of 100 cases. Surg Laparosc Endosc 1997 Dec;7(6):445-50. (45) Neumayer L, Giobbie-Hurder A, Jonasson O, Fitzgibbons R, Jr., Dunlop D, Gibbs J, et al. Open mesh versus laparoscopic mesh repair of inguinal hernia. N Engl J Med 2004 Apr 29;350(18):1819-27. (46) O'Dwyer PJ. Current status of the debate on laparoscopic hernia repair. Br Med Bull 2004;70:105-18. 154 Estudio de la perfusión testicular tras hernioplastia preperitoneal (47) Douek M, Smith G, Oshowo A, Stoker DL, Wellwood JM. Prospective randomised controlled trial of laparoscopic versus open inguinal hernia mesh repair: five year follow up. BMJ 2003 May 10;326(7397):1012-3. (48) Rodrigues Junior AJ, Rodrigues CJ, da Cunha AC, Jin Y. Quantitative analysis of collagen and elastic fibers in the transversalis fascia in direct and indirect inguinal hernia. Rev Hosp Clin Fac Med Sao Paulo 2002 Nov;57(6):265-70. (49) Schumpelick V, Treutner KH, Arlt G. Inguinal hernia repair in adults. Lancet 1994 Aug 6;344(8919):375-9. (50) Quintas ML, Rodrigues CJ, Yoo JH, Rodrigues Junior AJ. Age related changes in the elastic fiber system of the interfoveolar ligament. Rev Hosp Clin Fac Med Sao Paulo 2000 May;55(3):83-6. (51) Uden A, Lindhagen T. Inguinal hernia in patients with congenital dislocation of the hip. A sign of general connective tissue disorder. Acta Orthop Scand 1988 Dec;59(6):667-8. (52) Pans A, Albert A. Joint mobility in adult patients with groin hernias. Hernia 2003 Mar;7(1):21-4. (53) Borquez P, Garrido L, Manterola C, Pena P, Schlageter C, Orellana JJ, et al. [Study of collagen and elastic fibers of connective tissue in patients with and without primary inguinal hernia]. Rev Med Chil 2003 Nov;131(11):1273-9. (54) Bellon JM, Bajo A, Ga-Honduvilla N, Gimeno MJ, Pascual G, Guerrero A, et al. Fibroblasts from the transversalis fascia of young patients with direct inguinal hernias show constitutive MMP-2 overexpression. Ann Surg 2001 Feb;233(2):287-91. (55) Palombo D, Maione M, Cifiello BI, Udini M, Maggio D, Lupo M. Matrix metalloproteinases. Their role in degenerative chronic diseases of abdominal aorta. J Cardiovasc Surg (Torino) 1999 Apr;40(2):257-60. (56) Pleumeekers HJ, De GA, Hofman A, Van Beek AJ, Hoes AW. Prevalence of aortic aneurysm in men with a history of inguinal hernia repair. Br J Surg 1999 Sep;86(9):1155-8. (57) Vrijland WW, Jeekel J. Prosthetic mesh repair should be used for any defect in the abdominal wall. Curr Med Res Opin 2003;19(1):1-3. (58) Abci I, Bilgi S, Altan A. Role of TIMP-2 in fascia transversalis on development of inguinal hernias. J Invest Surg 2005 May;18(3):123-8. (59) Sorensen LT, Friis E, Jorgensen T, Vennits B, Andersen BR, Rasmussen GI, et al. Smoking is a risk factor for recurrence of groin hernia. World J Surg 2002 Apr;26(4):397-400. 155 Estudio de la perfusión testicular tras hernioplastia preperitoneal (60) van den Berg JC, de Valois JC, Go PM, Rosenbusch G. Detection of groin hernia with physical examination, ultrasound, and MRI compared with laparoscopic findings. Invest Radiol 1999 Dec;34(12):739-43. (61) Heise CP, Sproat IA, Starling JR. Peritoneography (herniography) for detecting occult inguinal hernia in patients with inguinodynia. Ann Surg 2002 Jan;235(1):140-4. (62) Gwanmesia II, Walsh S, Bury R, Bowyer K, Walker S. Unexplained groin pain: safety and reliability of herniography for the diagnosis of occult hernias. Postgrad Med J 2001 Apr;77(906):250-1. (63) Hamlin JA, Kahn AM. Herniography: a review of 333 herniograms. Am Surg 1998 Oct;64(10):965-9. (64) van den Berg JC, de Valois JC, Go PM, Rosenbusch G. Dynamic magnetic resonance imaging in the diagnosis of groin hernia. Invest Radiol 1997 Oct;32(10):644-7. (65) Koehler RH. Diagnosing the occult contralateral inguinal hernia. Surg Endosc 2002 Mar;16(3):512-20. (66) Zollinger RM, Jr. Classification systems for groin hernias. Surg Clin North Am 2003 Oct;83(5):1053-63. (67) Gilbert AI. An anatomic and functional classification for the diagnosis and treatment of inguinal hernia. Am J Surg 1989 Mar;157(3):331-3. (68) Rutkow IM, Robbins AW. Demographic, classificatory, and socioeconomic aspects of hernia repair in the United States. Surg Clin North Am 1993 Jun;73(3):413-26. (69) Wexler MJ. The repair of inguinal hernia: 110 years after Bassini. Can J Surg 1997 Jun;40(3):186-91. (70) Banks SB, Cotlar AM. Classic groin hernia repair...lest we forget. Current Surgery 2005;62(2):249-52. (71) McGillicuddy JE. Prospective randomized comparison of the Shouldice and Lichtenstein hernia repair procedures. Arch Surg 1998 Sep;133(9):974-8. (72) Shouldice EB. The Shouldice repair for groin hernias. Surg Clin North Am 2003 Oct;83(5):1163-87, vii. (73) Bendavid R. The Shouldice technique: a canon in hernia repair. Can J Surg 1997 Jun;40(3):199-205, 207. (74) Schmedt CG, Leibl BJ, Bittner R. Endoscopic inguinal hernia repair in comparison with Shouldice and Lichtenstein repair. A systematic review of randomized trials. Dig Surg 2002;19(6):511-7. 156 Estudio de la perfusión testicular tras hernioplastia preperitoneal (75) Liem MS, van der GY, van Steensel CJ, Boelhouwer RU, Clevers GJ, Meijer WS, et al. Comparison of conventional anterior surgery and laparoscopic surgery for inguinal-hernia repair. N Engl J Med 1997 May 29;336(22):15417. (76) Cunningham J, Temple WJ, Mitchell P, Nixon JA, Preshaw RM, Hagen NA. Cooperative hernia study. Pain in the postrepair patient. Ann Surg 1996 Nov;224(5):598-602. (77) Arroyo A, Perez F, Ferrer R, Garcia P, Serrano P, Candela F, et al. Hernia surgery for the third millennium. Does classical herniorraphy still play a role? Ambulatory Surgery 2001 Jul;9(2):73-5. (78) Nyhus LM. The posterior (preperitoneal) approach and iliopubic tract repair of inguinal and femoral hernias - an update. Hernia 2003 Jun;7(2):63-7. (79) Fernando Carbonell Tatay. Hernia inguinocrural. 212-213. 2001. (80) Lichtenstein IL. Immediate ambulation and return to work following herniorrhaphy. Ind Med Surg 1966 Sep;35(9):754-9. (81) Lichtenstein IL, Shulman AG, Amid PK, Montllor MM. The tension-free hernioplasty. Am J Surg 1989 Feb;157(2):188-93. (82) Shulman AG, Amid PK, Lichtenstein IL. The safety of mesh repair for primary inguinal hernias: results of 3,019 operations from five diverse surgical sources. Am Surg 1992 Apr;58(4):255-7. (83) Shulman AG, Amid PK, Lichtenstein IL. A survey of non-expert surgeons using the open tension-free mesh patch repair for primary inguinal hernias. Int Surg 1995 Jan;80(1):35-6. (84) Kurzer M, Belsham PA, Kark AE. The Lichtenstein repair for groin hernias. Surg Clin North Am 2003 Oct;83(5):1099-117. (85) Moorman ML, Price PD. Migrating mesh plug: complication of a wellestablished hernia repair technique. Am Surg 2004 Apr;70(4):298-9. (86) Rutkow IM. The PerFix plug repair for groin hernias. Surg Clin North Am 2003 Oct;83(5):1079-98, vi. (87) Rutkow IM, Robbins AW. "Tension-free" inguinal herniorrhaphy: a preliminary report on the "mesh plug" technique. Surgery 1993 Jul;114(1):3-8. (88) Stoppa R, Quintyn M. [Deficiencies of the abdominal wall in aged persons]. Sem Hop 1969 Jul 10;45(31):2182-4. (89) Stoppa RE. The treatment of complicated groin and incisional hernias. World J Surg 1989 Sep;13(5):545-54. 157 Estudio de la perfusión testicular tras hernioplastia preperitoneal (90) Ger R. The management of certain abdominal herniae by intra-abdominal closure of the neck of the sac. Preliminary communication. Ann R Coll Surg Engl 1982 Sep;64(5):342-4. (91) Leibl BJ, Jager C, Kraft B, Kraft K, Schwarz J, Ulrich M, et al. Laparoscopic hernia repair-TAPP or/and TEP? Langenbecks Arch Surg 2005 Apr;390(2):7782. (92) McCormack K, Wake BL, Fraser C, Vale L, Perez J, Grant A. Transabdominal pre-peritoneal (TAPP) versus totally extraperitoneal (TEP) laparoscopic techniques for inguinal hernia repair: a systematic review. Hernia 2005 May;9(2):109-14. (93) Wake BL, McCormack K, Fraser C, Vale L, Perez J, Grant AM. Transabdominal pre-peritoneal (TAPP) vs totally extraperitoneal (TEP) laparoscopic techniques for inguinal hernia repair. Cochrane Database Syst Rev 2005;(1):CD004703. (94) Czechowski A, Schafmayer A. [TAPP versus TEP: a retrospective analysis 5 years after laparoscopic transperitoneal and total endoscopic extraperitoneal repair in inguinal and femoral hernia]. Chirurg 2003 Dec;74(12):1143-9. (95) Hsia M, Ponsky L, Rosenblatt S, Jones JS. Laparoscopic inguinal hernia repair complicates future pelvic oncologic surgery. Ann Surg 2004 Nov;240(5):9223. (96) Katz EE, Patel RV, Sokoloff MH, Vargish T, Brendler CB. Bilateral laparoscopic inguinal hernia repair can complicate subsequent radical retropubic prostatectomy. J Urol 2002 Feb;167(2 Pt 1):637-8. (97) Dulucq JL, Wintringer P, Mahajna A. Totally extraperitoneal (TEP) hernia repair after radical prostatectomy or previous lower abdominal surgery: is it safe? A prospective study. Surg Endosc 2006 Mar;20(3):473-6. (98) Wake BL, McCormack K, Fraser C, Vale L, Perez J, Grant AM. Transabdominal pre-peritoneal (TAPP) vs totally extraperitoneal (TEP) laparoscopic techniques for inguinal hernia repair. Cochrane Database Syst Rev 2005;(1):CD004703. (99) Klein AM, Banever TC. Enterocutaneous fistula as a postoperative complication of laparoscopic inguinal hernia repair. Surg Laparosc Endosc 1999 Jan;9(1):60-2. (100) Moreno-Egea A, Torralba JA, guayo Albasini JL. [The laparoscopic approach in inguinal hernia: a single technique and tactical resource]. Cir Esp 2005 Apr;77(4):179-80. (101) Horgan LF, Shelton JC, O'Riordan DC, Moore DP, Winslet MC, Davidson BR. Strengths and weaknesses of laparoscopic and open mesh inguinal hernia repair: a randomized controlled experimental study. Br J Surg 1996 Oct;83(10):1463-7. 158 Estudio de la perfusión testicular tras hernioplastia preperitoneal (102) Lal P, Kajla RK, Chander J, Saha R, Ramteke VK. Randomized controlled study of laparoscopic total extraperitoneal versus open Lichtenstein inguinal hernia repair. Surg Endosc 2003 Jun;17(6):850-6. (103) McCormack K, Scott NW, Go PM, Ross S, Grant AM. Laparoscopic techniques versus open techniques for inguinal hernia repair. Cochrane Database Syst Rev 2003;(1):CD001785. (104) Ferzli GS, Frezza EE, Pecoraro AM, Jr., Ahern KD. Prospective randomized study of stapled versus unstapled mesh in a laparoscopic preperitoneal inguinal hernia repair. J Am Coll Surg 1999 May;188(5):461-5. (105) Johansson B, Hallerback B, Glise H, Anesten B, Smedberg S, Roman J. Laparoscopic mesh versus open preperitoneal mesh versus conventional technique for inguinal hernia repair: a randomized multicenter trial (SCUR Hernia Repair Study). Ann Surg 1999 Aug;230(2):225-31. (106) Liem MS, van Duyn EB, van der GY, van Vroonhoven TJ. Recurrences after conventional anterior and laparoscopic inguinal hernia repair: a randomized comparison. Ann Surg 2003 Jan;237(1):136-41. (107) Wright D, Paterson C, Scott N, Hair A, O'Dwyer PJ. Five-year follow-up of patients undergoing laparoscopic or open groin hernia repair: a randomized controlled trial. Ann Surg 2002 Mar;235(3):333-7. (108) Grunwaldt LJ, Schwaitzberg SD, Rattner DW, Jones DB. Is laparoscopic inguinal hernia repair an operation of the past? Journal of the American College of Surgeons 2005 Apr;200(4):616-20. (109) McCormack K, Wake B, Perez J, Fraser C, Cook J, McIntosh E, et al. Laparoscopic surgery for inguinal hernia repair: systematic review of effectiveness and economic evaluation. Health Technol Assess 2005 Apr;9(14):1-iv. (110) Tetik C, Arregui ME, Dulucq JL, Fitzgibbons RJ, Franklin ME, McKernan JB, et al. Complications and recurrences associated with laparoscopic repair of groin hernias. A multi-institutional retrospective analysis. Surg Endosc 1994 Nov;8(11):1316-22. (111) Schultz LS, Cartuill J, Graber JN, Hickok DF. Transabdominal Preperitoneal Procedure. Semin Laparosc Surg 1994 Jun;1(2):98-105. (112) Lal P, Kajla RK, Chander J, Ramteke VK. Laparoscopic total extraperitoneal (TEP) inguinal hernia repair: overcoming the learning curve. Surg Endosc 2004 Apr;18(4):642-5. (113) Schurz JW, Arregui ME, Hammond JC. Open vs laparoscopic hernia repair. Analysis of costs, charges, and outcomes. Surg Endosc 1995 Dec;9(12):13117. 159 Estudio de la perfusión testicular tras hernioplastia preperitoneal (114) Beldi G, Ipaktchi R, Wagner M, Gloor B, Candinas D. Laparoscopic ventral hernia repair is safe and cost effective. Surg Endosc 2006 Jan;20(1):92-5. (115) Heikkinen TJ, Haukipuro K, Koivukangas P, Sorasto A, Autio R, Sodervik H, et al. Comparison of costs between laparoscopic and open Nissen fundoplication: a prospective randomized study with a 3-month followup. J Am Coll Surg 1999 Apr;188(4):368-76. (116) Heikkinen TJ, Haukipuro K, Koivukangas P, Sorasto A, Autio R, Sodervik H, et al. Comparison of costs between laparoscopic and open Nissen fundoplication: a prospective randomized study with a 3-month followup. J Am Coll Surg 1999 Apr;188(4):368-76. (117) Poobalan AS, Bruce J, Smith WC, King PM, Krukowski ZH, Chambers WA. A review of chronic pain after inguinal herniorrhaphy. Clin J Pain 2003 Jan;19(1):48-54. (118) Lau H, Patil NG. Selective non-stapling of mesh during unilateral endoscopic total extraperitoneal inguinal hernioplasty: a case-control study. Arch Surg 2003 Dec;138(12):1352-5. (119) Moreno-Egea A, Torralba Martinez JA, Morales CG, guayo Albasini JL. Randomized clinical trial of fixation vs nonfixation of mesh in total extraperitoneal inguinal hernioplasty. Arch Surg 2004 Dec;139(12):1376-9. (120) Katkhouda N, Mavor E, Friedlander MH, Mason RJ, Kiyabu M, Grant SW, et al. Use of fibrin sealant for prosthetic mesh fixation in laparoscopic extraperitoneal inguinal hernia repair. Ann Surg 2001 Jan;233(1):18-25. (121) Novik B, Hagedorn S, Mork UB, Dahlin K, Skullman S, Dalenback J. Fibrin glue for securing the mesh in laparoscopic totally extraperitoneal inguinal hernia repair: a study with a 40-month prospective follow-up period. Surg Endosc 2006 Mar;20(3):462-7. (122) Picazo JS, Seoane JB, Moreno C, Moreno E. Description of M-shaped preperitoneal hernioplasty for inguinocrural hernias. Am J Surg 2003 Feb;185(2):108-13. (123) USHER FC, WALLACE SA. Tissue reaction to plastics; a comparison of nylon, orlon, dacron, teflon, and marlex. AMA Arch Surg 1958 Jun;76(6):9979. (124) USHER FC, OCHSNER J, TUTTLE LL, Jr. Use of marlex mesh in the repair of incisional hernias. Am Surg 1958 Dec;24(12):969-74. (125) Stoppa R. About biomaterials and how they work in groin hernia repairs. Hernia 2003 Jun;7(2):57-60. (126) Cumberland VH. A preliminary report on the use of prefabricated nylon weave in the repair of ventral hernia. Med J Aust 1952 Feb 2;1(5):143-4. 160 Estudio de la perfusión testicular tras hernioplastia preperitoneal (127) Scales JT. Tissue reactions to synthetic materials. Proc R Soc Med 1953 Aug;46(8):647-52. (128) Schumpelick V. Does every hernia demand a mesh repair? A critical review. Hernia 2001 Mar;5(1):5-8. (129) Adamonis W, Witkowski P, Smietanski M, Bigda J, Sledzinski Z. Is there a need for a mesh plug in inguinal hernia repair? Randomized, prospective study of the use of Hertra 1 mesh compared to PerFix Plug. Hernia 2006 Apr 1. (130) Pelissier EP, Marre P, Damas JM. [Inguinal hernia: what is the optimal size of prosthetic patch?]. J Chir (Paris) 2002 Oct;139(5):257-9. (131) Pelissier EP. Inguinal hernia: the size of the mesh. Hernia 2001 Dec;5(4):16971. (132) Festa V, Rollino R, Baracchi F, Morino M, Morino F, Trabucco E. [Use of the "flat mesh" T4r in the Trabucco inguinal hernioplasty. Technical note]. Minerva Chir 2002 Oct;57(5):707-10. (133) Stoppa RE. Wrapping the visceral sac into a bilateral mesh prosthesis in groin hernia repair. Hernia 2003 Mar;7(1):2-12. (134) Rives J. Surgical treatment of the inguinal hernia with dacron patch. Int Surg 1967 Apr;47(4):360-1. (135) Schumpelick V. Does every hernia demand a mesh repair? A critical review. Hernia 2001 Mar;5(1):5-8. (136) Flum DR, Horvath K, Koepsell T. Have outcomes of incisional hernia repair improved with time? A population-based analysis. Ann Surg 2003 Jan;237(1):129-35. (137) Schein M, Wittmann DH, Aprahamian CC, Condon RE. The abdominal compartment syndrome: the physiological and clinical consequences of elevated intra-abdominal pressure. J Am Coll Surg 1995 Jun;180(6):745-53. (138) Bellon JM, Contreras LA, Bujan J, Palomares D, Carrera-San MA. Tissue response to polypropylene meshes used in the repair of abdominal wall defects. Biomaterials 1998 Apr;19(7-9):669-75. (139) Greca FH, de Paula JB, Biondo-Simoes ML, da Costa FD, da Silva AP, Time S, et al. The influence of differing pore sizes on the biocompatibility of two polypropylene meshes in the repair of abdominal defects. Experimental study in dogs. Hernia 2001 Jun;5(2):59-64. (140) Gonzalez R, Ramshaw BJ. Comparison of tissue integration between polyester and polypropylene prostheses in the preperitoneal space. Am Surg 2003 Jun;69(6):471-6. 161 Estudio de la perfusión testicular tras hernioplastia preperitoneal (141) Felemovicius I, Bonsack ME, Hagerman G, Delaney JP. Prevention of adhesions to polypropylene mesh. J Am Coll Surg 2004 Apr;198(4):543-8. (142) Dinsmore RC, Calton WC, Jr. Prevention of adhesions to polypropylene mesh in a rabbit model. Am Surg 1999 Apr;65(4):383-7. (143) Bailey IS, Karran SE, Toyn K, Brough P, Ranaboldo C, Karran SJ. Community surveillance of complications after hernia surgery. BMJ 1992 Feb 22;304(6825):469-71. (144) Aufenacker TJ, Koelemay MJ, Gouma DJ, Simons MP. Systematic review and meta-analysis of the effectiveness of antibiotic prophylaxis in prevention of wound infection after mesh repair of abdominal wall hernia. Br J Surg 2005 Oct 27. (145) Perez AR, Roxas MF, Hilvano SS. A randomized, double-blind, placebocontrolled trial to determine effectiveness of antibiotic prophylaxis for tensionfree mesh herniorrhaphy. Journal of the American College of Surgeons 2005 Mar;200(3):393-7. (146) Aufenacker TJ, Koelemay MJ, Gouma DJ, Simons MP. Systematic review and meta-analysis of the effectiveness of antibiotic prophylaxis in prevention of wound infection after mesh repair of abdominal wall hernia. Br J Surg 2006 Jan;93(1):5-10. (147) Yerdel MA, Akin EB, Dolalan S, Turkcapar AG, Pehlivan M, Gecim IE, et al. Effect of single-dose prophylactic ampicillin and sulbactam on wound infection after tension-free inguinal hernia repair with polypropylene mesh: the randomized, double-blind, prospective trial. Ann Surg 2001 Jan;233(1):2633. (148) Taylor SG, O'Dwyer PJ. Chronic groin sepsis following tension-free inguinal hernioplasty. Br J Surg 1999 Apr;86(4):562-5. (149) Repair of groin hernia with synthetic mesh: meta-analysis of randomized controlled trials. Ann Surg 2002 Mar;235(3):322-32. (150) Zuvela M, Milicevic M, Galun D, Lekic N, Basaric D, Tomic D, et al. [Infection in hernia surgery]. Acta Chir Iugosl 2005;52(1):9-26. (151) Kapral W, Auer H, Obermaier A. [Rate of recurrence in Bassini inguinal hernia operation]. Zentralbl Chir 1993;118(4):215-7. (152) Donati M, Gandolfo L, Privitera A, Cavallaro G, Brancato G. [Inguinal hernia recurrence after prosthetic repair: our experience]. Chir Ital 2003 Jul;55(4):609-15. (153) Rutkow IM. The recurrence rate in hernia surgery. How important is it? Arch Surg 1995 Jun;130(6):575-6. 162 Estudio de la perfusión testicular tras hernioplastia preperitoneal (154) Repair of groin hernia with synthetic mesh: meta-analysis of randomized controlled trials. Ann Surg 2002 Mar;235(3):322-32. (155) Alfieri S, Rotondi F, Di GA, Fumagalli U, Salzano A, Di MD, et al. Influence of Preservation Versus Division of Ilioinguinal, Iliohypogastric, and Genital Nerves During Open Mesh Herniorrhaphy: Prospective Multicentric Study of Chronic Pain. Ann Surg 2006 Apr;243(4):553-8. (156) Bay-Nielsen M, Perkins FM, Kehlet H. Pain and functional impairment 1 year after inguinal herniorrhaphy: a nationwide questionnaire study. Ann Surg 2001 Jan;233(1):1-7. (157) Callesen T, Bech K, Nielsen R, Andersen J, Hesselfeldt P, Roikjaer O, et al. Pain after groin hernia repair. Br J Surg 1998 Oct;85(10):1412-4. (158) Callesen T, Bech K, Andersen J, Nielsen R, Roikjaer O, Kehlet H. Pain after primary inguinal herniorrhaphy: influence of surgical technique. J Am Coll Surg 1999 Apr;188(4):355-9. (159) Callesen T, Kehlet H. Postherniorrhaphy pain. Anesthesiology 1997 Nov;87(5):1219-30. (160) Callesen T, Bech K, Kehlet H. Prospective study of chronic pain after groin hernia repair. Br J Surg 1999 Dec;86(12):1528-31. (161) Oberg E, Jacobsen B, Rosenberg J. Chronic pain and recurrence after laparoscopic inguinal herniorrhaphy. Surg Laparosc Endosc Percutan Tech 2005 Oct;15(5):267-70. (162) Dittrick GW, Ridl K, Kuhn JA, McCarty TM. Routine ilioinguinal nerve excision in inguinal hernia repairs. Am J Surg 2004 Dec;188(6):736-40. (163) Heise CP, Starling JR. Mesh inguinodynia: a new clinical syndrome after inguinal herniorrhaphy? J Am Coll Surg 1998 Nov;187(5):514-8. (164) Alfieri S, Rotondi F, Di GA, Fumagalli U, Salzano A, Di MD, et al. Influence of Preservation Versus Division of Ilioinguinal, Iliohypogastric, and Genital Nerves During Open Mesh Herniorrhaphy: Prospective Multicentric Study of Chronic Pain. Ann Surg 2006 Apr;243(4):553-8. (165) Bueno J, Serralta A, Planells M, Rodero D. Inguinodynia after two inguinal herniorrhaphy methods. Surg Laparosc Endosc Percutan Tech 2004 Aug;14(4):210-4. (166) Rosenberger RJ, Loeweneck H, Meyer G. The cutaneous nerves encountered during laparoscopic repair of inguinal hernia: new anatomical findings for the surgeon. Surg Endosc 2000 Aug;14(8):731-5. (167) Rutkow IM, Robbins AW. "Tension-free" inguinal herniorrhaphy: a preliminary report on the "mesh plug" technique. Surgery 1993 Jul;114(1):3-8. 163 Estudio de la perfusión testicular tras hernioplastia preperitoneal (168) Gurleyik E, Gurleyik G, Cetinkaya F, Unalmiser S. The inflammatory response to open tension-free inguinal hernioplasty versus conventional repairs. Am J Surg 1998 Mar;175(3):179-82. (169) Wantz GE. Testicular atrophy and chronic residual neuralgia as risks of inguinal hernioplasty. Surg Clin North Am 1993 Jun;73(3):571-81. (170) Nutley MT, Mulloy RH, Hagen N. Minimal postoperative pain using properitoneal nontension sutured repair of direct inguinal hernias. Am J Surg 2006 Apr;191(4):479-82. (171) Ozkan N. Effects of two different meshes used in hernia repair on nerve transport. 2008 Nov. (172) Valenti G, Baldassarre E. Re: Mesh plug hernia repair complications. Am Surg 2005 Jul;71(7):613-4. (173) Pollak R, Nyhus LM. Complications of groin hernia repair. Surg Clin North Am 1983 Dec;63(6):1363-71. (174) Seifman BD, Ohl DA, Jarow JP, Menge AC. Unilateral obstruction of the vas deferens diagnosed by seminal vesicle aspiration. Tech Urol 1999 Jun;5(2):113-5. (175) Yavetz H, Harash B, Yogev L, Homonnai ZT, Paz G. Fertility of men following inguinal hernia repair. Andrologia 1991 Nov;23(6):443-6. (176) Shin D, Lipshultz LI, Goldstein M, Barme GA, Fuchs EF, Nagler HM, et al. Herniorrhaphy with polypropylene mesh causing inguinal vasal obstruction: a preventable cause of obstructive azoospermia. Ann Surg 2005 Apr;241(4):553-8. (177) Sheynkin YR, Hendin BN, Schlegel PN, Goldstein M. Microsurgical repair of iatrogenic injury to the vas deferens. J Urol 1998 Jan;159(1):139-41. (178) Ridgway PF, Shah J, Darzi AW. Male genital tract injuries after contemporary inguinal hernia repair. BJU Int 2002 Aug;90(3):272-6. (179) Lewis-Jones DI, Richards RC, Lynch RV, Joughin EC. Immunocytochemical localisation of the antibody which breaches the blood-testis barrier in sympathetic orchiopathia. Br J Urol 1987 May;59(5):452-7. (180) Abasiyanik A, Guvenc H, Yavuzer D, Peker O, Ince U. The effect of iatrogenic vas deferens injury on fertility in an experimental rat model. J Pediatr Surg 1997 Aug;32(8):1144-6. (181) Ceylan H, Karakok M, Guldur E, Cengiz B, Bagci C, Mir E. Temporary stretch of the testicular pedicle may damage the vas deferens and the testis. J Pediatr Surg 2003 Oct;38(10):1530-3. 164 Estudio de la perfusión testicular tras hernioplastia preperitoneal (182) Maciel LC, Glina S, Palma PC, Nascimento LF, Netto NR, Jr. Histopathological alterations of the vas deferens in rats exposed to polypropylene mesh. BJU Int 2007 Jul;100(1):187-90. (183) OPPENHEIMER BS, OPPENHEIMER ET, STOUT AP, WILLHITE M, DANISHEFSKY I. The latent period in carcinogenesis by plastics in rats and its relation to the presarcomatous stage. Cancer 1958 Jan;11(1):204-13. (184) Brand KG, Buoen LC, Brand I. Multiphasic incidence of foreign body-induced sarcomas. Cancer Res 1976 Oct;36(10):3681-3. (185) McGregor DB, Baan RA, Partensky C, Rice JM, Wilbourn JD. Evaluation of the carcinogenic risks to humans associated with surgical implants and other foreign bodies - a report of an IARC Monographs Programme Meeting. International Agency for Research on Cancer. Eur J Cancer 2000 Feb;36(3):307-13. (186) OPPENHEIMER BS, OPPENHEIMER ET, STOUT AP, WILLHITE M, DANISHEFSKY I. The latent period in carcinogenesis by plastics in rats and its relation to the presarcomatous stage. Cancer 1958 Jan;11(1):204-13. (187) Witherspoon P, Bryson G, Wright DM, Reid R, O'Dwyer PJ. Carcinogenic potential of commonly used hernia repair prostheses in an experimental model. Br J Surg 2004 Mar;91(3):368-72. (188) Staiano JJ, Savage P, Stephenson BM, Milling MA. Mesh mimics metastasis. Lancet 2005 Jul 23;366(9482):341. (189) Ghadimi BM, Langer C, Becker H. [The carcinogenic potential of biomaterials in hernia surgery]. Chirurg 2002 Aug;73(8):833-7. (190) Di VG, Milano S, Frazzetta M, Patti R, Palazzolo V, Barbera C, et al. Tensionfree hernia repair is associated with an increase in inflammatory response markers against the mesh. Am J Surg 2000 Sep;180(3):203-7. (191) Ferrando JM, Vidal J, Armengol M, Gil J, Manero JM, Huguet P, et al. Experimental evaluation of a new layered prosthesis exhibiting a low tensile modulus of elasticity: long-term integration response within the rat abdominal wall. World J Surg 2002 Apr;26(4):409-15. (192) Klinge U, Klosterhalfen B, Muller M, Schumpelick V. Foreign body reaction to meshes used for the repair of abdominal wall hernias. Eur J Surg 1999 Jul;165(7):665-73. (193) Coda A, Bendavid R, Botto-Micca F, Bossotti M, Bona A. Structural alterations of prosthetic meshes in humans. Hernia 2003 Mar;7(1):29-34. (194) Aydede H, Erhan Y, Sakarya A, Kara E, Ilkgul O, Can M. Effect of mesh and its localisation on testicular flow and spermatogenesis in patients with groin hernia. Acta Chir Belg 2003 Nov;103(6):607-10. 165 Estudio de la perfusión testicular tras hernioplastia preperitoneal (195) Akbulut G, Serteser M, Yucel A, Degirmenci B, Yilmaz S, Polat C, et al. Can laparoscopic hernia repair alter function and volume of testis? Randomized clinical trial. Surg Laparosc Endosc Percutan Tech 2003 Dec;13(6):377-81. (196) Zieren J, Beyersdorff D, Beier KM, Muller JM. Sexual function and testicular perfusion after inguinal hernia repair with mesh. Am J Surg 2001 Mar;181(3):204-6. (197) Tetik C, Arregui ME, Dulucq JL, Fitzgibbons RJ, Franklin ME, McKernan JB, et al. Complications and recurrences associated with laparoscopic repair of groin hernias. A multi-institutional retrospective analysis. Surg Endosc 1994 Nov;8(11):1316-22. (198) Picazo JS. Hernioplastias preperitoneales en M. Técnica y resultados en una serie de 280 casos. Cir Esp 2003;74(4):221-7. (199) Beddy P, Ridgway PF, Geoghegan T, Peirce C, Govender P, Keane FB, et al. Inguinal hernia repair protects testicular function: a prospective study of open and laparoscopic herniorraphy. J Am Coll Surg 2006 Jul;203(1):17-23. (200) Brisinda G, Cina A, Nigro C, Cadeddu F, Brandara F, Marniga G, et al. Duplex ultrasound evaluation of testicular perfusion after tension-free inguinal hernia repair: results of a prospective study. Hepatogastroenterology 2008 May;55(84):974-8. (201) Ersin S, Aydin U, Makay O, Icoz G, Tamsel S, Sozbilen M, et al. Is testicular perfusion influenced during laparoscopic inguinal hernia surgery? Surg Endosc 2006 Apr;20(4):685-9. (202) Goldenberg A, Paula JF. Effects of the polypropylene mesh implanted through inguinotomy in the spermatic funiculus, epididium and testis of dogs. Acta Cir Bras 2005 Nov;20(6):461-7. (203) Taylor SG, Hair A, Baxter GM, O'Dwyer PJ. Does contraction of mesh following tension free hernioplasty effect testicular or femoral vessel blood flow? Hernia 2001 Mar;5(1):13-5. (204) Turgut AT, Olcucuoglu E, Turan C, Kilicoglu B, Kosar P, Geyik PO, et al. Preoperative ultrasonographic evaluation of testicular volume and blood flow in patients with inguinal hernias. J Ultrasound Med 2007 Dec;26(12):1657-66. (205) Lopez-Milena A. Utilidad de la ecografía doppler.color y la determinación de los índices de resistencia como indicadores de precoces de infarto testicular secundario a orquiepididimitis. Actas Urol Esp 2000;24(1):43-7. (206) Crespi G, Giannetta E, Mariani F, Floris F, Pretolesi F, Marino P. Imaging of early postoperative complications after polypropylene mesh repair of inguinal hernia. Radiol Med (Torino) 2004 Jul;108(1-2):107-15. 166 Estudio de la perfusión testicular tras hernioplastia preperitoneal (207) Sakamoto H, Ogawa Y. Does a clinical varicocele influence the relationship between the testicular volume by ultrasound and the testicular function in patients with infertility? Fertil Steril 2008 Oct 16. (208) Dogra VS, Gottlieb RH, Oka M, Rubens DJ. Sonography of the scrotum. Radiology 2003 Apr;227(1):18-36. (209) Biagiotti G, Cavallini G, Modenini F, Vitali G, Gianaroli L. Spermatogenesis and spectral echo-colour Doppler traces from the main testicular artery. BJU Int 2002 Dec;90(9):903-8. (210) Rutkow IM. Demographic and socioeconomic aspects of hernia repair in the United States in 2003. Surg Clin North Am 2003 Oct;83(5):1045-vi. (211) Amid PK, Shulman AG, Lichtenstein IL. Local anesthesia for inguinal hernia repair step-by-step procedure. Ann Surg 1994 Dec;220(6):735-7. (212) HORWICH M. Hernia repair using nylon tricot implant. Br J Surg 1958 Jan;45(192):320-2. (213) STOCK FE. Repair of large herniae with nylon mesh. Lancet 1954 Feb 20;266(6808):395-6. (214) Lichtenstein IL, Shulman AG. Ambulatory outpatient hernia surgery. Including a new concept, introducing tension-free repair. Int Surg 1986 Jan;71(1):1-4. (215) Macintyre IM. Best practice in groin hernia repair. Br J Surg 2003 Feb;90(2):131-2. (216) Schumpelick V, Klinge U. Prosthetic implants for hernia repair. Br J Surg 2003 Dec;90(12):1457-8. (217) Lowham AS, Filipi CJ, Fitzgibbons RJ, Jr., Stoppa R, Wantz GE, Felix EL, et al. Mechanisms of hernia recurrence after preperitoneal mesh repair. Traditional and laparoscopic. Ann Surg 1997 Apr;225(4):422-31. (218) Langenbach MR, Schmidt J, Zirngibl H. Comparison of biomaterials in the early postoperative period. Surg Endosc 2003 Jul;17(7):1105-9. (219) David Dávila. La reparación de las hernias de la ingle por la via preperitonal "corta". Técnica de Nyhus. 2005. Ethicon. La hernia inguino crural. (220) Fong Y, Wantz GE. Prevention of ischemic orchitis during inguinal hernioplasty. Surg Gynecol Obstet 1992 May;174(5):399-402. (221) Tons C, Klinge U, Kupczyk-Joeris D, Rotzscher VM, Schumpelick V. [Controlled study of cremaster resection in Shouldice repair of primary inguinal hernia]. Zentralbl Chir 1991;116(12):737-43. 167 Estudio de la perfusión testicular tras hernioplastia preperitoneal (222) Wantz GE. Testicular atrophy as a risk inguinal hernioplasty. Surg Gynecol Obstet 1982 Apr;154(4):570-1. (223) Heifetz CJ. Resection of the spermatic cord in selected inguinal hernias. Twenty years of experience. Arch Surg 1971 Jan;102(1):36-9. (224) Wantz GE. Testicular atrophy as a sequela of inguinal hernioplasty. Int Surg 1986 Jul;71(3):159-63. (225) Reid I, Devlin HB. Testicular atrophy as a consequence of inguinal hernia repair. Br J Surg 1994 Jan;81(1):91-3. (226) Meacham RB. From androlog. Potential for vasal occlusion among men after hernia repair using mesh. J Androl 2002 Nov;23(6):759-61. (227) Vanclooster P, Smet B, de GC, Segers K. Laparoscopic inguinal hernia repair: review of 6 years experience. Acta Chir Belg 2001 May;101(3):135-8. (228) Uzzo RG, Lemack GE, Morrissey KP, Goldstein M. The effects of mesh bioprosthesis on the spermatic cord structures: a preliminary report in a canine model. J Urol 1999 Apr;161(4):1344-9. (229) Bingener J, Dorman JP, Valdes G. Recurrence rate after laparoscopic repair of recurrent inguinal hernias: have we improved? Surg Endosc 2003 Nov;17(11):1781-3. (230) Diarra B, Coulibaly A, Ehua-Somian F, Soro KG, Souaga KA, Kanga-Miessan JB. [Experience with preperitoneal hernioplasty using Stoppa's procedures in the Ivory Coast]. Ann Chir 2001 May;126(4):325-9. (231) Kingsnorth AN, Porter CS, Bennett DH, Walker AJ, Hyland ME, Sodergren S. Lichtenstein patch or Perfix plug-and-patch in inguinal hernia: a prospective double-blind randomized controlled trial of short-term outcome. Surgery 2000 Mar;127(3):276-83. (232) Taylor SG, Hair A, Baxter GM, O'Dwyer PJ. Does contraction of mesh following tension free hernioplasty effect testicular or femoral vessel blood flow? Hernia 2001 Mar;5(1):13-5. (233) Meacham RB. From androlog. Potential for vasal occlusion among men after hernia repair using mesh. J Androl 2002 Nov;23(6):759-61. (234) Seifman BD, Ohl DA, Jarow JP, Menge AC. Unilateral obstruction of the vas deferens diagnosed by seminal vesicle aspiration. Tech Urol 1999 Jun;5(2):113-5. (235) Peiper C, Junge K, Klinge U, Strehlau E, Ottinger A, Schumpelick V. Is there a risk of infertility after inguinal mesh repair? Experimental studies in the pig and the rabbit. Hernia 2006 Mar;10(1):7-12. 168 Estudio de la perfusión testicular tras hernioplastia preperitoneal (236) Yamaguchi K, Ishikawa T, Nakano Y, Kondo Y, Shiotani M, Fujisawa M. Rapidly progressing, late-onset obstructive azoospermia linked to herniorrhaphy with mesh. Fertil Steril 2008 Aug 1. (237) Fitzgibbons RJ, Jr. Can we be sure polypropylene mesh causes infertility? Ann Surg 2005 Apr;241(4):559-61. (238) Siziakin DV. [Spermatogenesis at inguinal hernias]. Khirurgiia (Mosk) 2007;(8):66-8. (239) Ribarski I, Lehavi O, Yogev L, Hauser R, Bar-Shira MB, Botchan A, et al. USP26 gene variations in fertile and infertile men. Hum Reprod 2009 Feb;24(2):477-84. (240) Peiper C, Junge K, Klinge U, Strehlau E, Krones C, Ottinger A, et al. The influence of inguinal mesh repair on the spermatic cord: a pilot study in the rabbit. J Invest Surg 2005 Sep;18(5):273-8. (241) Klinge U, Klosterhalfen B, Muller M, Ottinger AP, Schumpelick V. Shrinking of polypropylene mesh in vivo: an experimental study in dogs. Eur J Surg 1998 Dec;164(12):965-9. (242) Berndsen FH, Bjursten LM, Simanaitis M, Montgomery A. Does mesh implantation affect the spermatic cord structures after inguinal hernia surgery? An experimental study in rats. Eur Surg Res 2004 Sep;36(5):318-22. (243) Junge K, Binnebosel M, Rosch R, Ottinger A, Stumpf M, Muhlenbruch G, et al. Influence of mesh materials on the integrity of the vas deferens following Lichtenstein hernioplasty: an experimental model. Hernia 2008 Jul 2. (244) Kolbe T, Lechner W. Influence of hernioplastic implants on male fertility in rats. J Biomed Mater Res B Appl Biomater 2007 May;81(2):435-40. (245) Taneli F, Aydede H, Vatansever S, Ulman C, Ari Z, Uyanik BS. The longterm effect of mesh bioprosthesis in inguinal hernia repair on testicular nitric oxide metabolism and apoptosis in rat testis. Cell Biochem Funct 2005 May;23(3):213-20. (246) Dilek ON, Yucel A, Akbulut G, Degirmenci B. Are there adverse effects of herniorrhaphy techniques on testicular perfusion? Evaluation by color Doppler ultrasonography. Urol Int 2005;75(2):167-9. (247) Lima Neto EV, Goldenberg A, Juca MJ. Prospective study on the effects of a polypropylene prosthesis on testicular volume and arterial flow in patients undergoing surgical correction for inguinal hernia. Acta Cir Bras 2007 Jul;22(4):266-71. (248) Valenti G, Baldassarre E, Torino G. Vas deferens obstruction due to fibrosis after plug hernioplasty. Am Surg 2006 Feb;72(2):137-8. 169 Estudio de la perfusión testicular tras hernioplastia preperitoneal (249) Ramadan SU, Gokharman D, Tuncbilek I, Ozer H, Kosar P, Kacar M, et al. Does the presence of a mesh have an effect on the testicular blood flow after surgical repair of indirect inguinal hernia? J Clin Ultrasound 2008 Jul 18. (250) Schurich M, Aigner F, Frauscher F, Pallwein L. The role of ultrasound in assessment of male fertility. Eur J Obstet Gynecol Reprod Biol 2009 May;144 Suppl 1:S192-S198. (251) Pinggera GM, Mitterberger M, Bartsch G, Strasser H, Gradl J, Aigner F, et al. Assessment of the intratesticular resistive index by colour Doppler ultrasonography measurements as a predictor of spermatogenesis. BJU Int 2008 Mar;101(6):722-6. (252) Desjardins C. The microcirculation of the testis. Ann N Y Acad Sci 1989;564:243-9. (253) Lee SL, DuBois JJ, Rishi M. Testicular damage after surgical groin exploration for elective herniorrhaphy. J Pediatr Surg 2000 Feb;35(2):327-30. (254) Mihmanli I, Kantarci F, Kulaksizoglu H, Gurses B, Ogut G, Unluer E, et al. Testicular size and vascular resistance before and after hydrocelectomy. AJR Am J Roentgenol 2004 Nov;183(5):1379-85. (255) Ku JH, Son H, Kwak C, Lee SE, Lee NK, Park YH. Impact of varicocele on testicular volume in young men: significance of compensatory hypertrophy of contralateral testis. J Urol 2002 Oct;168(4 Pt 1):1541-4. (256) Grainger AJ, Hide IG, Elliott ST. The ultrasound appearances of scrotal oedema. Eur J Ultrasound 1998 Sep;8(1):33-7. 170