12_guia_1_estructura_atomica
Anuncio
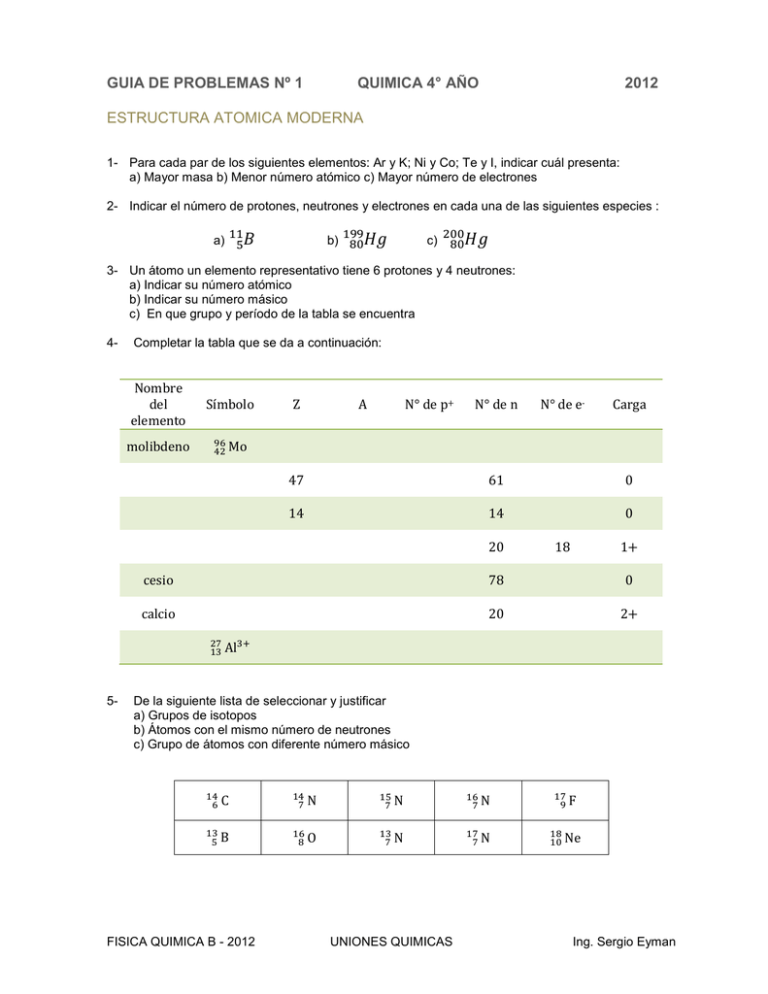
GUIA DE PROBLEMAS Nº 1 QUIMICA 4° AÑO 2012 ESTRUCTURA ATOMICA MODERNA 1- Para cada par de los siguientes elementos: Ar y K; Ni y Co; Te y I, indicar cuál presenta: a) Mayor masa b) Menor número atómico c) Mayor número de electrones 2- Indicar el número de protones, neutrones y electrones en cada una de las siguientes especies : 11 a) 5𝐵 199 b) 80𝐻𝑔 c) 200 80𝐻𝑔 3- Un átomo un elemento representativo tiene 6 protones y 4 neutrones: a) Indicar su número atómico b) Indicar su número másico c) En que grupo y período de la tabla se encuentra 4- Completar la tabla que se da a continuación: Nombre del elemento Símbolo molibdeno 96 42 Mo Z A N° de p+ N° de n N° de e- Carga 47 61 0 14 14 0 20 18 1+ cesio 78 0 calcio 20 2+ 27 3+ 13 Al 5- De la siguiente lista de seleccionar y justificar a) Grupos de isotopos b) Átomos con el mismo número de neutrones c) Grupo de átomos con diferente número másico 14 6C 14 7N 15 7N 16 7N 17 9F 13 5B 16 8O 13 7N 17 7N 18 10 Ne FISICA QUIMICA B - 2012 UNIONES QUIMICAS Ing. Sergio Eyman GUIA DE PROBLEMAS Nº 1 QUIMICA 4° AÑO 2012 ESTRUCTURA ATOMICA MODERNA 6- Los átomos de un elemento neutro tienen 2 electrones con n = 1, 8 electrones con n = 2, 8 electrones con n = 3 y 1 electrón con n = 4. Suponiendo que los átomos de este elemento están en su estado fundamental, indicar: a) Número atómico, nombre y símbolo del elemento. b) Número total de electrones en orbitales s en un átomo del elemento. c) Número total de electrones en orbitales p en un átomo del elemento. 7- Dados los siguientes elementos de símbolos hipotéticos: X, cuyo átomo tiene una CEE 3s2 3p4 Q, cuyo átomo tiene un total de 12 electrones R, cuyo átomo tiene una CE 1s2 2s2 2p6 3s2 3p6 a) ¿Cuántos electrones tiene en total un átomo del elemento X y del R? b) Ordenen los elementos según su número atómico decreciente. c) ¿Cuál o cuáles de estos elementos tiene en sus átomos el máximo número de electrones en el nivel 3 de energía? 8- Indicar cuáles de las siguientes configuraciones electrónicas no corresponden al estado fundamental del átomo que representan justificando en forma sintética. a) 1s1 2s1 b) 1s2 2p1 c) 1s2 2s1 2p1 d) 1s2 2s2 2p1 9- Clasificar las siguientes configuraciones electrónicas como estado fundamental o excitado a) 1s2 2s2 2p5 3s1 b) 1s2 2s2 2p6 3s1 3p1 c) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 d) 1s2 2s2 2p6 3s2 3p5 4s1 10- Escribir la configuración de X2- sabiendo que 32 X tiene 15 neutrones en su núcleo. Indicar el elemento. 11- Escribir las configuraciones electrónicas de los átomos e iones que se dan a continuación indicando número atómico de cada uno. a) N g) Sr 4+ b) O h) Br c) O2i) Br-1 d) Na j) S e) Na+ k) S2- f) Sr 2+ l) S2+ 12- El elemento M forma un ión mononegativo isoelectrónico con el 86 R 2+, que a su vez tiene 50 neutrones. Determinar el número atómico de M y su símbolo. 13- Determinar el número de neutrones que tiene el núcleo de termina en 5p4. Indicar nombre y símbolo de X. 126 X si su configuración electrónica 14- Determinar el número de masa de X sabiendo que tiene 45 neutrones en su núcleo y que es isótopo del elemento T que tiene 44 neutrones en el núcleo y cuya configuración electrónica termina en 4p5. Indicar el nombre de X y su símbolo. 15- Determinar el Z de un elemento X sabiendo que la molécula de compuesto SnX 4 tiene en total 118 protones y que la configuración electrónica externa de Sn es 5p2. FISICA QUIMICA B - 2012 UNIONES QUIMICAS Ing. Sergio Eyman








