Efecto del Ion Común - Blog de ESPOL
Anuncio

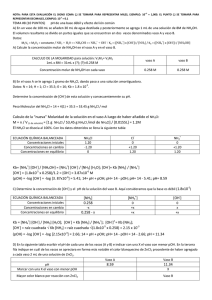
ESCUELA SUPERIOR POLITÉCNICA DEL LITORAL (ESPOL) DEPARTAMENTO DE CIENCIAS QUÍMICAS Y AMBIENTALES (DCQA) Práctica N° 12 Título: EFECTO DEL ION COMÚN Estudiante: Johnny Eduardo Puente Muñoz Profesor: Dr. Mariano Montaño Fecha: 21 de Enero del 2014 Paralelo: 33 1) INTRODUCCIÓN En la práctica realizada referente Al efecto del ion común daremos a conocer los datos obtenidos a partir de los experimentos realizados en el laboratorio de química general I donde debemos tener conocimiento de los términos de pH. Estos conceptos nos serán clave previa a la ejecución de la práctica y así lograr los cálculos respectivos para poder determinar el pH de una base o un ácido y compararlo con el pH experimental de las soluciones preparadas a diferentes concentraciones. 2) OBJETIVO Conocer los términos claves acerca de la práctica como que es: o pH o Soluciones Buffer o Equilibrio químico o Principio de Le Chatelier o Efecto del ión común Estudiar el efecto de la adición del ión NH4+ proveniente del NH4 Cl sobre una solución de NH4OH. 3) TEORÍA a) pH: Medida de acidez o alcalinidad de una disolución, indica la concentración de iones hidronio presentes en determinadas sustancias. b) Soluciones Buffer: Disoluciones que están compuestas por el ion común de un ácido débil o una base débil y el mismo ion común en una sal conjugada c) Equilibrio químico: Formación de un estado dinámico en el que las concentraciones de todas productos)son constantes las especies reaccionantes(reactivos y d) Principio de Le Chatelier: Establece que si una reacción en equilibrio es perturbada desde el exterior, el sistema evoluciona en el sentido de contrarrestar los efectos de dicha perturbación e) Efecto del ión común: Desplazamiento de un equilibrio iónico cuando cambia la concentración de uno de los iones que están en dicho equilibrio, debido a la presencia de una sal que se encuentra disuelta en él 4) MATERIALES Y REACTIVOS ITEM 01 02 03 04 05 06 07 08 09 10 11 DESCRIPCION Pipeta y pera Muestra de NH4OH, 8 M Muestra de NH4CL Muestra de ZnCl2 Agitador Agua Vaso de precipitados (100 mL) Papel indicador Tabla de indicadores Espátula Balanza, CANTIDAD 2 1 1 1 1 1 2 1 1 1 1 5) PROCEDIMIENTOS: 1. Disponer 30 ml de H2O en un vaso de precipitado 2. Agregar 1.0 ml de hidróxido de amonio 8 M en el vaso 3. Mezclar y distribuir la solución en partes iguales en dos vasos de 100 ml. identifíquelos como A y B 4. Añadir y disolver 1 g de NH4 Cl en el vaso A 5. Medir el Ph a las dos soluciones (vasos A y B) utilizando papel indicador y la escala de color. anotar los resultados 6. Agregar 2 ml de ZnCl2 a cada uno de los vasos, observar y anotar los resultados 7. Contestar el siguiente cuestionario Cual de las soluciones del numeral 5 tendrá mas OH Como aplicaría las ecuaciones para calcular la OH en cada uno de los recipientes Que reacciones ocurren al añadir ZnCl2 Cual de las dos soluciones forman más precipitado 8. Llenar el cuadro indicado , tomando en cuanta el numeral 7. Gráfico 1. Procedimiento ilustrado de la práctica. 6) TABLA DE DATOS 1. Concentración de la solución 8M 2. Volumen de NH4OH 1 mL 3. Volumen total de disolución del NH4OH (vaso A) 31 mL 4. Masa de NH4Cl 1g 5. Volumen de disolución del NH4Cl 15.5 mL 6. pH de soluciones de vaso A y B A=9 y B=11 7) CÁLCULOS Solución A 𝑛 𝑀= 𝑉(𝐿) 1𝑔 53.45𝑔/𝑚𝑜𝑙 𝑀= = 1.2𝑀 0.0155𝐿 NH 3 H 2O NH 4 OH NH OH Kb 4 NH 3 H 2O OH K b NH 3 NH 4 OH OH 1.8 *105 * 0.258 1.2 3.87 *106 Solución B V1 * M 1 V2 * M 2 1m l * 8M 31m l * M 2 M 2 0.258 NH OH Kb 4 NH 3 H 2O OH 2 Kb NH 3 OH Kb NH 3 OH 1.85 * 10 5 * 0.258 OH 2.15 *103 pOH logOH pOH log0.00215 pOH 2.66 pH 14 2.66 pH 11.34 pOH log OH pOH log(3.87 *106 ) pOH 5.41 14 pH pOH pH 14 pOH pH 8.59 8) TABLA DE RESULTADOS Soluciones OH pH Experimental (observado) pH Teórico (calculado) 3.87*10-6 8 8.59 2.16*10-3 10 11.33 calculado Solución Vaso A Solución Vaso B Reacción con ZnCl2 OBSERVACIONES Y COMENTARIOS No pasa nada, lo que indica que es irreversible Se forma como un líquido lechoso. Lo que quiere decir que es reversible. 9) RECOMENDACIONES Y OBSERVACIONES Solo se debe humedecer un poco el papel indicador y tomar el color de inmediato. Tener cuidado al manipular el hidróxido de amonio, ya que estos son peligrosos. Tener cuidado al manipular los instrumentos del laboratorio Se deben anotar todos los detalles que puedan apreciarse en los indicadores. 12) CONCLUSIONES La práctica se realizó con éxito, en la solución B al agregar ZnCl2 la solución tomo un color como leche, esto quiere decir que la solución es reversible. En la solución A no pasó nada, siguió igual que como estaba entonces no es reversible. Determinamos el pH de la base y el ácido respectivo. Se estudió el concepto de indicadores y pH. Se estableció algunas aplicaciones de los indicadores y el pH. Obtuvimos los pH experimentales y teóricos, fueron muy aproximados por lo tanto el margen de error de la práctica fue mínimo. 10) BIBLIOGRAFÍA - http://es.wikipedia.org/wiki/PH - http://quimicacotidiana.blogspot.es/1243907160/ - http://www.mcgraw-hill.es/bcv/guide/capitulo/844816962X.pdf - http://web.educastur.princast.es/proyectos/fisquiweb/Videos/EquilibrioQ/ - http://quimica.laguia2000.com/reacciones-quimicas/efecto-del-ion-comun