11efecto del ion comun
Anuncio

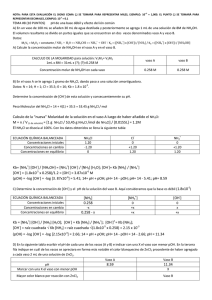
ESCUELA SUPERIOR POLITÉCNICADEL LITORAL PRÁCTICA N° 11 Título: EFECTO DEL IÓN COMÚN Asignatura Laboratorio De Química General I Paralelo - Grupo: 16 - C Autor: Melissa Aguilera Chuchuca Profesor: Ing. Ana Avilés Tutivén, Ms.C Fecha: 13 de Agosto 2014 1.- Objetivo Reconocer el efecto de la adición del ión común NH4+ proveniente del cloruro de amonio (NH4Cl) sobre una solución de hidróxido de amonio (NH4OH). 2.- Marco teórico El Principio de Le Chatelier establece que si una reacción en equilibrio es perturbada desde el exterior, el sistema evoluciona en el sentido de contrarrestar los efectos de dicha perturbación. Cuando algún factor que afecte al equilibrio varía, éste se altera al menos momentáneamente, entonces el sistema comienza a reaccionar hasta que se reestablece el equilibrio, pero las condiciones de este nuevo estado de equilibrio son distintas a las condiciones del equilibrio inicial. Se dice que el equilibrio se desplaza hacia la derecha (si aumenta la concentración de los productos y disminuye la de los reactivos con respecto al equilibrio inicial), o hacia la izquierda (si aumenta la concentración de los reactivos y disminuye la de los productos). El efecto de ion común se lo conoce como al desplazamiento de un equilibrio iónico cuando cambia la concentración de uno de los iones que están implicados en dicho equilibrio, debido a la presencia en la disolución de una sal que se encuentra disuelta en él. Algunas veces sucede que en una misma disolución hay presentes dos tipos de sustancias, que se encuentran disociadas en sus respectivos iones, procediendo uno de éstos a su vez de la disociación de las dos sustancias. Soluciones Buffer, un tampón, buffer, solución amortiguadora o solución reguladora, es la mezcla en concentraciones relativamente elevadas de un ácido débil y su base conjugada, es decir, sales hidrolíticamente activas. Tienen la propiedad de mantener estable el pH de una disolución frente a la adición de cantidades relativamente pequeñas de ácidos o bases fuertes. 3.- Materiales y reactivos 1. 2. 3. 4. 5. Vaso precipitado. Agitador. Pipeta con pera. Espátula. Balanza. 1) y 2) 6. 7. 8. 9. 7) 6) NH4OH 5) 4) 3) 8) NH4Cl Muestra NH4OH. Muestra NH4Cl. Muestra ZnCl2. Indicador de pH. 9) ZnCl2 4.- Procedimiento 1) Disponer 30 ml de H2O en un vaso precipitado. 2) Agregar 1.0 ml de hidróxido de amonio (NH4OH) 8 M en el vaso. 3) Mezclar y distribuir la solución en partes iguales en dos vasos de 100 ml. Identifíquelos como A y B. 4) Añadir y disolver 1 g de NH4Cl en el vaso A. 5) Medir el pH a las dos soluciones (vaso A y B) utilizando papel indicador y la escala pH de color. Anotar resultados. 6) Agregar 3 ml de ZnCl2 a cada uno de los vasos. Observe y anote. 7) Contestar el siguiente cuestionario: a. ¿Cuál de las soluciones del numeral 5 tendrá mayor [OH-]? b. ¿Cómo aplicaría las ecuaciones para calcular la [OH-] en cada uno de los recipientes? c. ¿Qué reacción ocurre al añadir ZnCl2? d. ¿Cuál de las soluciones formas más precipitado? Justifique su respuesta. e. Dé el nombre y la fórmula del precipitado. 8) Elaborar la tabla de datos y llene el cuadro de resultados, ayudándose con lo respondido en el numeral 7. 5.- Tabla de datos Concentración de la solución NH4OH Volumen del NH4OH Volumen total de disolución del NH4OH (vaso A) Masa de NH4Cl Volumen de disolución del NH4Cl pH de soluciones de vasos Ay B 6.- Cálculos 7.- Tabla de resultado CUADRO DE RESULTADOS pH [OH-] pH teórico experimental calculado (calculado) (observado) Comportamiento con el ZnCl2 Solución vaso A NH4OH + NH4Cl Solución vaso B NH4OH 8.- Observaciones 9.- Recomendaciones No dejar caer el papel indicador en la solución para ensayar el pH; sólo debe humedecer el papel indicador con una gota de la solución dispuesta en el agitador. La lectura del pH debe ser inmediatamente después de humedecer el papel indicador; teniendo en la mano la escala pH, para no dar tiempo que se volatilice el NH3. No olvidar enjuagar el agitador para cada uso. 10.- Conclusiones BIBLIOGRAFÍA Matamoros, D., & Morante, F. (2012). Manual de prácticas, Química general 1. En D. Matamoros, & F. Morante, Manual de prácticas, Química general 1 (Tercera ed., págs. 43-44). Guayaquil-Ecuador: Comité editorial. Méndez, A. (2010). efecto del ion común. Recuperado el 2014, de http://quimica.laguia2000.com/reacciones-quimicas/efecto-del-ion-comun QUÍMICA COTIDIANA. (2009). SOLUCIONES BUFFER. Recuperado el 2014, de http://quimicacotidiana.blogspot.es/1243907160/soluciones-buffer/ S/a. (2010). Equilibrio químico. Recuperado el 2014, de http://web.educastur.princast.es/proyectos/fisquiweb/Videos/EquilibrioQ/ S/a. (2011). PRINCIPIO DE LE CHATELIER. Recuperado el 2014, de http://thales.cica.es/cadiz2/ecoweb/ed0765/capitulo6.html ANEXOS 1. ¿El principio de Le Chatelier se evidencia es esta práctica? Explique. Sí, ya que en la práctica hay un cambio de volumen y de concentración que altera el estado de equilibrio del sistema. El principio de Le Châtelier se utiliza para valorar los efectos de tales cambios.