Polaridad de Compuestos Orgánicos
Anuncio

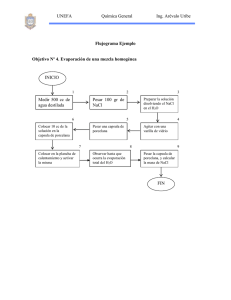
GUÍA Nº 5 “SOLUCIONES QUIMICAS” 1.- Introducción Cuando dos sustancias se mezclan y estas se distribuyen en forma homogénea, esparciéndose las moléculas de una entre las moléculas de la otra (difusión), se está frente a una Solución Química. A la sustancia que se disuelve se le denomina: Soluto y a la que disuelve: Disoluto o Disolvente. De lo dicho anteriormente, un soluto se distribuye en un disolvente hasta alcanzar una concentración constante en todo el volumen de la solución. Por otro lado, debido a que generalmente las reacciones químicas ocurren en solución, es importante conocer las formas más comunes de expresar su composición y aprender a preparar soluciones de una determinada concentración. En este laboratorio, se prepararán soluciones de una sal como el NaCl (cloruro de sodio), de determinada concentración en % m/m, % m/v y molaridad (M). Para ello se medirán masas y volúmenes, utilizando instrumentos o materiales de vidrio volumétricos. Recuerde que debe preparar con anterioridad el laboratorio, ya que es fundamental que usted sepa perfectamente qué y cómo se va a realizar, incluyendo los cálculos involucrados. 2.- Aprendizajes Esperados • Prepara soluciones, reconociendo propiedades y características del estado líquido 2.1.- Criterios de Evaluación • • • Prepara una solución de NaCl de concentración conocida. Reconoce que las soluciones químicas son mezclas homogéneas, que presentan una concentración cuantificable que se puede expresar de distintas formas. Utiliza algunos aparatos volumétricos, como probetas y matraces de aforo. 3.-Materiales a) b) c) d) e) f) g) h) i) j) k) l) 1 vaso de pp. de 250 mL. 1 vaso de pp. de 50 mL. 1 espátula de acero. Balanza granataria. 1 probeta de 100 mL. 1 varilla de vidrio para agitación. 3 frascos de unos 150 mL con tapas. 2 matraces de aforo de 100 mL con sus tapas. 1 embudo pequeño. 3 rótulos engomados. 10.0 g de NaCl. Agua destilada. Asignatura: ZQ0201 Química General Área Ciencias Básicas Responsable: Jacqueline Alea Pessa Fecha Actualización: Primavera 2008 4.- Actividades 4.1.- Procedimiento Experiencia 1: “Preparación de 100 mL de una solución al 10 % m/m de NaCl”. a) Mase un vaso de 250 mL en la balanza, con una precisión de ± 0.1 g y anote la masa resultante. b) Agregue al vaso porciones de NaCl hasta que la masa adicional corresponda a 10.0 g, medidos con la misma precisión anterior. c) Mida 90 mL de agua destilada con la probeta (suponga que la densidad del agua es igual a 1.0 g/mL) y agréguelos al vaso con el NaCl para obtener la solución. Agite la mezcla con la varilla de vidrio hasta disolución total. d) Una vez disuelto todo el NaCl, proceda a guardarla en uno de los frascos, limpio y seco. Tápelo y entregue la solución a su profesor perfectamente rotulada. 4.2.- Procedimiento Experiencia 2: “Preparación de 100 mL de una solución 2.0 M de NaCl”. a) Calcule la masa de NaCl necesaria para preparar 100 mL de una solución 2.0 M. Recuerde que para 100 mL de una solución al 2.0 M, se requieren 0.2 moles de NaCl. b) Mase un vaso de pp. pequeño de 50 mL ó 100 mL en la balanza, con una precisión de ± 0.1 g y anote la masa resultante. c) Agregue al vaso porciones de NaCl con una espátula de acero, hasta que la masa adicional corresponda a la cantidad calculada por usted, con la misma precisión anterior. d) Agregue al vaso utilizado unos 10 mL de agua destilada y disuelva la sal, agitando el vaso en forma circular, una vez disuelta la sal, traspase el líquido a un matraz de aforo de 100 mL, cuidadosamente con el embudo, para no derramarla. Repita esto tres veces, con iguales volúmenes de agua destilada. e) Sea cuidadoso, para así no perder solución. f) Luego, agregue cuidadosamente porciones de agua destilada al matraz de aforo, agitando paulatinamente la mezcla, de tal forma que la disolución sea completa, antes de alcanzar el nivel de aforo que posee el matraz. g) Finalmente, tape el matraz y agite, sosteniendo la tapa, invirtiéndolo varias veces para homogeneizar completamente la solución. h) Vierta la solución obtenida en un frasco, rotúlela convenientemente y entréguela al profesor. 4.3.- Análisis de datos y resultados. a.- Calcule la concentración % m/m y molar de las soluciones preparadas para cada una de las experiencias, mostrando los cálculos completos. Recuerde que: % m/m = M= masa de soluto masa de soluto + disolvente X 100 % Moles de soluto Litros solución Asignatura: ZQ0201 Química General Área Ciencias Básicas Responsable: Jacqueline Alea Pessa Fecha Actualización: Primavera 2008 b.- Debe concluir en referencia al método o procedimientos utilizados, indicando las fuentes de error al preparar las soluciones y cómo poder evitarlas. 4.3.- Investigación Previa al Experimento: a) Las soluciones químicas y la concentración. b) Expresión de la concentración de una solución: • % p/p. • % p/v. • Molaridad, M • Normalidad, N. • Partes por millón, ppm. Asignatura: ZQ0201 Química General Área Ciencias Básicas Responsable: Jacqueline Alea Pessa Fecha Actualización: Primavera 2008