QMC- 106
Anuncio
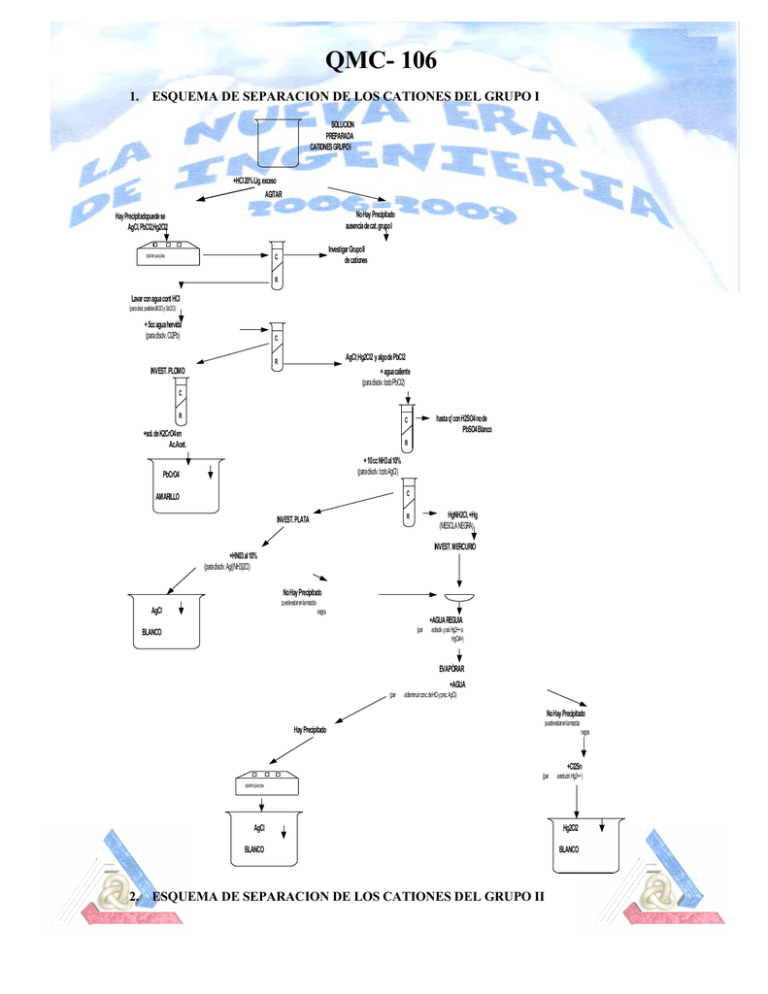
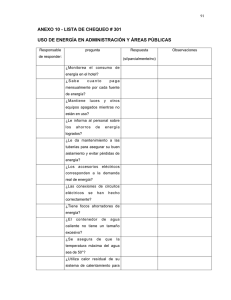
QMC- 106 1. ESQUEMA DE SEPARACION DE LOS CATIONES DEL GRUPO I SOLUCION PREPARADA CATIONES GRUPO I +HCl 20% Lig. exceso AGITAR No Hay Precipitado ausencia de cat. grupo I Hay Precipitadopuede se AgCl, PbCl2,Hg2Cl2 Investigar Grupo II de cationes C CENTRIFUGADORA R Lavar con agua cont HCl (para disol. posibles BiOCl y SbOCl) + 5cc agua hervida (para disolv. Cl2Pb) C AgCl;Hg2Cl2 y algo de PbCl2 R INVEST. PLOMO + agua caliente (para disolv. todo PbCl2) C R hasta q' con H2SO4 no de PbSO4 Blanco C +sol. de K2CrO4 en Ac.Acet. R + 10 cc NH3 al 10% (para disolv. todo AgCl) PbCrO4 C AMARILLO HgNH2Cl, +Hg (MESCLA NEGRA) R INVEST. PLATA INVEST. MERCURIO +HN03 al 10% (para disolv. Ag((NH3)2Cl) No Hay Precipitado puedeestar en lamezcla AgCl negra +AGUA REGUIA (par BLANCO adisolv. y oxi.Hg2++ a HgCl4=) EVAPÒRAR +AGUA (par adisminuir conc.deHCl y prec. AgCl) No Hay Precipitado puedeestar en lamezcla Hay Precipitado negra +Cl2Sn (par areduciri. Hg2++ ) CENTRIFUGADORA AgCl Hg2Cl2 BLANCO BLANCO 2. ESQUEMA DE SEPARACION DE LOS CATIONES DEL GRUPO II QMC- 106 SOLUCION PREPARADA CATIONES GRUPO I Ajustar pH 0.6 (añadiendo NH4OH o HCl) +CH3CSNH2 al 8% Baño Maria (para completar la precipitacion) No Hay Precipitado No Hay Precipitado ( no existen cationes grupo II) Calentar Si hay precipitado no se filtra C R Cationes del grupo I Lavado con dos porciones de sol. 5% NH4NO3 De terminacion de cationes grupo I I separacion en dos subgrupos + KOH 6 M Agitar y calentar en Baño Maria C sub grupo cationes I - B R sub grupo cationes I - A 3. ESQUEMA DE SEPARACION DE LOS CATIONES DEL GRUPO IIA QMC- 106 CATIONES GRUPO II - A + HNO3 al 20 % ( parea disol. sulfuros) Calentar y ajitar por 2 min. C +5cc H2SO4 con. R calentar hasta que desaparescan los humos blancos investigar Hg enfriar +agua + agua regia (un exeso precipita (BiO)2SO4) Agitar y calentar en Baño Maria C +NH4OH con. C (para neutralizar H2SO4) + sol.SnCl2 R +NaOH + AcH + K2CrO4 C R Se desecha R Hg2Cl2 PbCrO4 BLANCO investigar bismuto +sol Na2HSnO2 o SnCl4-- y NaOH incoloro azul (Cd(NH3)4 )++ enegrecimiento (Cu(NH3)4 )++ Bi NEGRO confirmar cobre investigar plomo investigar cadmio C C R R + AcH +Sol. K4(Fe(CN)6) + K(CN) + CH3CSNH2 K4(Fe(CN)6) CdS ROJO PARDUZCO AMARILLO 4. ESQUEMA DE SEPARACION DE LOS CATIONES DEL GRUPO IIB AMARILLO QMC- 106 CATIONES GRUPO I -B + HCl 6 N (hasta pH = 4) decantar se desecha C lavar con 2 porc. de agua R C R +HCl conc. (para disolver Sb2S5 y Sn S2) Agitar y calentar en Baño Maria + agua calentar C (eliminar H2S) R investigar Arsenico C C C R R R C R 5 cc HNO3 conc. Agitar y calentar en Baño Maria +H3AsO4 + H2SO4 +NH3 + MgCl2 ( ebullicion) investigar estaño investigar antimonio + HCl conc. si no has SnCl6= BLANCO si hay SnCl6= + gotas de H2 C2O4 + Fe en varilla + agua + CH3CSNH2 Agitar y calentar en Baño Maria + HgCl2 o HgCl4 -- (mezcla magneciana) MgNH4AsO4 investigar antimonio Hg2Cl2 Sb2S3 BlANCO ROJO ANARANJADO (para formar complejos estables) + agua + CH3CSNH2 Agitar y calentar en Baño Maria Sb2S3 ROJO ANARANJADO 5. ESQUEMA DE SEPARACION DE LOS CATIONES DEL GRUPO IIIA QMC- 106 GRUPO I I (A - B) DE CATIO NES + HNO 3 c ++ (para oxidar Fe a Fe +++ ) CALENTAR EN BAÑO MARIA (para elim inar el aire disuelto que precipitaria H 2 Se amortig ua con NH 4 (para disminuir los oxidrilos + NH (gota a gota 4 Cl y NH 4 ) MnO 3 ) OH OH c ) CALENTAR EN BAÑO MARIA (para elim inar el exceso nde NH3) (C o(N H Catio nes del grupo I I B ) ) ++ (N i(N H 3 ) 4 ) ++ (Z n(N H 3 4 ) ) ++ Mn(oH) 3 4 C 2 Catio nes del grupo I I A Fe(oH) 3 Cr(oH) R 3 Al(oH) 3 y Cr(O H) 3 + NH4Cl al 1% para la var + sol. conc. NaOH (para disolver Al(O H) + 1 g de Na para oxidar CrO 2O 2 o (NaOH+H 2 a CrO 3 2O 2) = 4 CALENTAR EN BAÑO MARIA C R investig ar aluminio + HCl Investig ar Hierro + HCl para elim inar oxidrilos que evitarin la precipitacion del Aluminio + NH CALENTAR EN BAÑO MARIA + NH 4 CALENTAR Cl c + sol K 4 OH c Fe 4 Fe( CN) Azul de Prusia C Al(OH) Investig ar Cromo R + sol BaCl Ba CrO 2 3 Bla nco Gela tinoso 4 amaril o 6. ESQUEMA DE SEPARACION DE LOS CATIONES DEL GRUPO IIIB 4 Fe( CN) 6 6 QMC- 106 Cationes del grupo I I B (Co(NH ) ) ++ (Ni(NH 3 4 (Zn(NH ) ) ++ Mn(oH) 3 4 ) ) ++ 3 4 2 + NH 4 OH c Baño Maria + CH 3 CSNH para formar en la misma solucion (NH 2 4)2S Baño Maria C Investigar Cationes Grupo IV y V R CoS NiS ZnS MnS Lavar conAgua Caliente al 5% en ClNH + ClH 4 (para disoplver ZnS y MnS) C Calentar en Baño Maria +NaOH sol. c. Lavado con HCl dil. Investigar Cinc +CH 3 CSNH R C 2 + agua regia Evaporar casi hasta la sequedad ( en capsula de porselana) + agua R ZnS Blanco Investigar Manganeso Con el oxigeno del aire se oxida H 2 MnO C 3 Pardo Asufre R CoCl +HNO 3 sol. c. + Pb 3 O 3 2 + NiCl 2 Calentar +HMnO sol. Purpura 4 investigar Cobalto + NH 4 OH c +Ac Acetico +KNO 2 sol. c Baño Maria K 3 (Co(NO 2 Investigar Niquel + NH 4 OH c +Sol. Alcoholica de dimetilglioxioma ) 6) Amaril o Cristalino 7. ESQUEMA DE SEPARACION DE LOS CATIONES DEL GRUPO IV dimetilglioxioma niquelosa rojo Rubi QMC- 106 Cationes grupo IV Calentar a Ebullicion No hay Precipitado no hay gran exceso de NH + + NH 4 + sol. de + sol. de (NH Hay Precipitado ) 4 Cl cristalizado es (NH 4 y algo de Azufre Cl NH 4 OH c ) CO 4 2 C 3 Calentar En Baño Maria R DESECHAR C Determinacion de Cationes del Grupo V BaCO R Mas Agua + sol de K 2 CrO SrCO 3 3 CaCO 3 Lavar Con Agua Caliente + Ac acetico C 4 R Desechar Impurezas C + NH + (NH 4 OH 4 ) 2 CO Confirmar Bario R 3 +ClH al 50% ensayo coloracion de la llama C Se Desecha Llama Verde SrCO 3 CaCO Lavar con Agua Caliente R 3 +Ac. Acetico C R Se Desecha Investigar Estroncio Investigar Calcio No Hay Estroncio +Agua de Yeso (CaSO 4) Blanco Confirma Estroncio Ensayo Coloracin a la Llama + sol. (NH Lavar Con Agua Caliente + NH 4 OH c +(NH4) 2C 2O Hay Precipitado SrSO Hay Estroncio No Hay Precipitado investigar Calcio 4 Ca C 2 O Blanco Confirma Calcio Ensayo Coloracin a la Llama Llama Rojo Carmin Llama Naranja 4 4 ) 2 SO 4 C 4 R Desechar QMC- 106 8. ESQUEMA DE SEPARACION DE LOS CATIONES DEL GRUPO V Cationes del grupo V Investigar Amoniaco Calentar con Hidroxido de sodio +(NH 4 ) 2 SO 4 +(NH 4 ) 2 C 2 O 4 Calentar en Baño Maria C HNO 3 c (para eliminar NH Calcinar a Sequedad + 4 R ) Reciduo Desechar Disilver en agua C C C R R R Investigar Sodio + HMg(UO NaMg(UO ) (C 2 H 3 O 2 ) 9 2 3 Investigar Potacio + NH 4 OH + Ac. Acetico +Na 3 Co(NO ) 2 6 K 2 NaCo(NO 2 6 Investigar Manganeso ) (C 2 H 3 O 2 ) 9 2 3 Amaril o Verde Prueba a la Llama color Amaril o ) + NH 4 OH + Na 2 HPO +MgNH Blanco Amarillo Cristalino Prueba a la Llama color Violeta 4 PO 4 4