Actividad 5 de desarrollo. Secuencia 2 Forma equipo con algunos
Anuncio

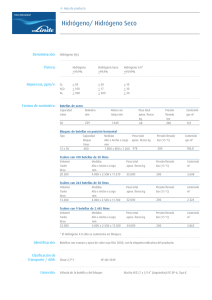
Actividad 5 de desarrollo. Secuencia 2 Forma equipo con algunos compañeros y resuelvan los siguientes ejercicios en sus libretas: 1. De acuerdo con la siguiente ecuación química balanceada, calcula los litros de hidrógeno que se producen si se hacen reaccionar 0.325 moles de aluminio a TPE. 2Al + 2NaOH + 2H2O 2NaAlO2 + 3H2 2. Cuando se hace reaccionar hierro metálico con ácido sulfúrico se obtiene sulfato ferroso y gas hidrógeno. Fe + H2SO4 FeSO4 + H2 ¿Cuántos litros de gas hidrógeno se pueden formar si se hace reaccionar 68.5 g de hierro con un exceso de ácido sulfúrico? 3. El agua por electrólisis se descompone en gas oxígeno y gas hidrógeno. 2H2O 2H2 + O2 ¿Cuántos litros de oxígeno y de hidrógeno se producen cuando se hace la electrólisis de 1525 litros de agua destilada? 4. Calcula el volumen en litros de nitrógeno que se necesitan para Mg + N2 Mg3N2 sin balancear 5. Calcula la cantidad de mililitros de gas hidrógeno que se producen al hacer reaccionar 2.520 moles de calcio con ácido clorhídrico en exceso. Ca + HCl CaCl2 + H2 sin balancear