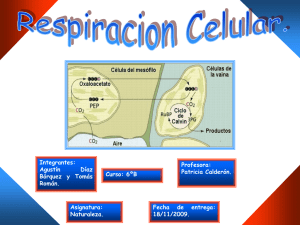
GIMNASIO DOMINGO SAVIO
Anuncio

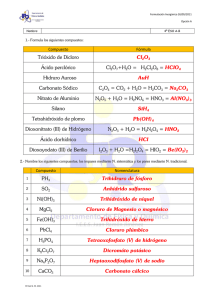
GIMNASIO DOMINGO SAVIO® “En Unión y Compromiso Formamos Líderes Dominguino” TALLER DE REFUERZO PREPARATORIO A LA PRUEBA DE SUPERACIÓN ESTUDIANTE: ____________________________________________________________________ ASIGNATURA QUÍMICA PERIODO: 1 Y/Ó 2 GRADO: ONCE FECHA: ______________________ PROFESOR (A): JACQUELINE GODOY GARCIA CRITERIOS DE EVALUACIÓN ESTE TALLER DE REFUERZO PRUEBA DE SUPERACIÓN 10% 90% ACTIVIDADES DEL TALLER: VERIFICA CONCEPTOS 1. Define los siguientes términos: Equilibrio químico. Reacción reversible. Catalizador. Constante de equilibrio. Ley de acción de masas. Principio de Le Chátelier. a) b) c) d) e) f) 2. Establece la diferencia entre: a. Cinética y equilibrio. b. Velocidad de reacción y equilibrio. c. Constante de equilibrio y posición de equilibrio. d. Equilibrio homogéneo y equilibrio heterogéneo. 3. Escribe la expresión de la velocidad de reacción para cada una de las ecuaciones químicas: a) 2H2 (g) + O2 (g) → 2H2O (g) b) CO (g) + 2H2 (g) → CH3OH (g) c) 4NH3 (g) + 3O2 (g) → 2N2 (g) + 6H2O (g) d) H2 (g) + Br2 (g) → 2HBr (g) e) 2N2O5 (g) → 4NO2 (g) + O2 (g) 4. Escriba la constante de equilibrio para cada una de las ecuaciones anteriores. 5. En la preparación del hexeno C6H12 se reaccionar el benceno con hidrógeno gaseoso tal como aparece en la siguiente reacción: C6H6 (g) + 3H2 (g) → C6H12 (g) + 206 kJ. En qué dirección se desplazará el equilibrio cuando ocurren los siguientes cambios: Un incremento en la concentración de benceno Una disminución en la concentración de benceno Un aumento en la concentración de hidrógeno Una disminución de la concentración de hidrógeno Un incremento en la concentración del hexeno Una disminución de la concentración de hexeno Un aumento en la presión por compresión Una reducción en la presión por expansión Un incremento en la temperatura. a) b) c) d) e) f) g) h) i) 6. Predice el efecto sobre el equilibrio de las siguientes reacciones al aumentar la temperatura y la presion a) 4HCl(g) + O2(g) → 2Cl2(g) + 2H2O(g) ∆H= 2117,15 KJ b) PCl5 (g) → Cl2(g) + PCl3(g) ∆H= 192,9 KJ c) A(g) + B(g) → 2C ∆H= 300 KJ d) N2(g) + 3H2 (g) → 2NH3(g) ∆H= -92 KJ 7. Las plantas al absorber energía radiante solar (fotosíntesis) sintetizan el azúcar dextrosa según la siguiente reacción: → C6H1206(s) + 6 02(g) ¿Un aumento de temperatura tenderá a favorecer o a reducir la producción de C6H1206(s)? 6 C02 (g) + 6H20(g) 8. Supon que una reacción tiene una constante de equilibrio K = 1,5 x 10 7. ¿Qué indica la magnitud de esta constante acerca de las concentraciones de los productos y reactivos presentes una vez que se ha alcanzado el equilibrio? ¿Es probable que esta reacción sea una buena fuente de producto? GIMNASIO DOMINGO SAVIO® “En Unión y Compromiso Formamos Líderes Dominguino” 9. Una solución presenta una concentración en iones hidronio de 1,43 x 10-12, su pH es: a. 2,15 b. 13,20 c. 8,66 d. 9,75 e. 11,85 10. De acuerdo con el resultado del problema anterior, la solución se considera como: a. b. c. d. e. Ácido fuerte Ácido débil Base fuerte Base débil Neutra 11. Una solución con pH = 3, es considerada: a. b. c. d. e. Ácido fuerte Base débil Ácido débil Neutra Base fuerte 12. Un catalizador: a. b. c. d. e. Orienta las moléculas Disminuye la energía de activación Aumenta el número de colisiones Aumenta o disminuye la velocidad de una reacción Cambia el valor de Ke 13. La energía activación de la reacción se disminuye por: a. b. c. d. e. Incremento de la presión Aumento de la temperatura Disminución de la temperatura Presencia de un catalizador Aumento de Ke 14. escriba los ácidos conjugados y las bases conjugadas según corresponda. Ejemplos de ácidos y bases de Brönsted -Lowry Ácido1 conjugado + Base2 conjugada Ácido2 conjugado + Base1 conjugada HNO3 + H2O H3O+ + NO3- H2SO4 + H2O H3O+ + HSO4- H2S + H2O + CH3COOH + H2O + NH4+ + H2O + H2O + CN- + 15. La fórmula general de la serie de los alcanos es C n + H2n+2 donde n es el número de átomos de carbono presentes en la molécula. Si una molécula tiene 12 átomos de hidrógeno, la fórmula molécular del alcano probablemente sería A. CH C. C6H12 B. C5H12 D. C12H12 16. En el análisis elemental de un compuesto orgánico se estableció que existe la siguiente relación entre los átomos de carbono e hidrógeno que lo conforman: por cada átomo de carbono en una molécula del compuesto hay 2 de hidrógeno. De acuerdo con el análisis, es probable que la fórmula del compuesto sea: GIMNASIO DOMINGO SAVIO® “En Unión y Compromiso Formamos Líderes Dominguino” RESPONDA LAS PREGUNTAS 17 Y 18 DE ACUERDO CON LA SIGUIENTE INFORMACIÓN. Se tienen 4 tubos: El ácido reacciona con los metales, observándose desprendimiento de burbujas (de hidrógeno) mientras disminuye la cantidad de metal a través del tiempo, a diferente velocidad en cada tubo. De las observaciones, se establece que el orden de velocidad de reacción del ácido con los metales de mayor a menor es: Mg, Zn, Fe y Cu 17. De lo anterior, es correcto afirmar que el factor que afecta la velocidad de reacción en el experimento es la a. concentración b. temperatura c. naturaleza de los reaccionantes d. presencia de catalizadores 18. En general, la temperatura afecta, en forma directa, la velocidad de reacción. Si el experimento se realiza 3 veces, primero a 90°C, después a temperatura ambiente (20°C) y por último a 0°C, lo más probable es que la velocidad de reacción sea a. igual en los tres casos b. mayor cuando se realiza a 90°C c. menor cuando se realiza a 90°C d. igual, a 20°C y a 0°C 19. De acuerdo con la ecuación anterior, si reaccionan 10 moles de agua con 3 moles de calcio probablemente a. b. c. d. los reactivos reaccionarán por completo sin que sobre masa de alguno el calcio reaccionará completamente y permanecerá agua en exceso se formarán 13 moles de hidrógeno se formará un mol de hidróxido de calcio 20. observa la imagen y resuelve 21. escriba la formula de los siguientes compuestos a. b. c. d. e. f. g. h. 2- metilhexano 2,3 dimetilbutano 1- cloro- 3- metilpentano 2,2,4-trimetilpentano 2,2-dicloropropano Metilciclopentano 1-cloro 1-metil ciclohexano 2,2dicloro-3-bromo -3- metilheptano