Reacciones Químicas.
Anuncio
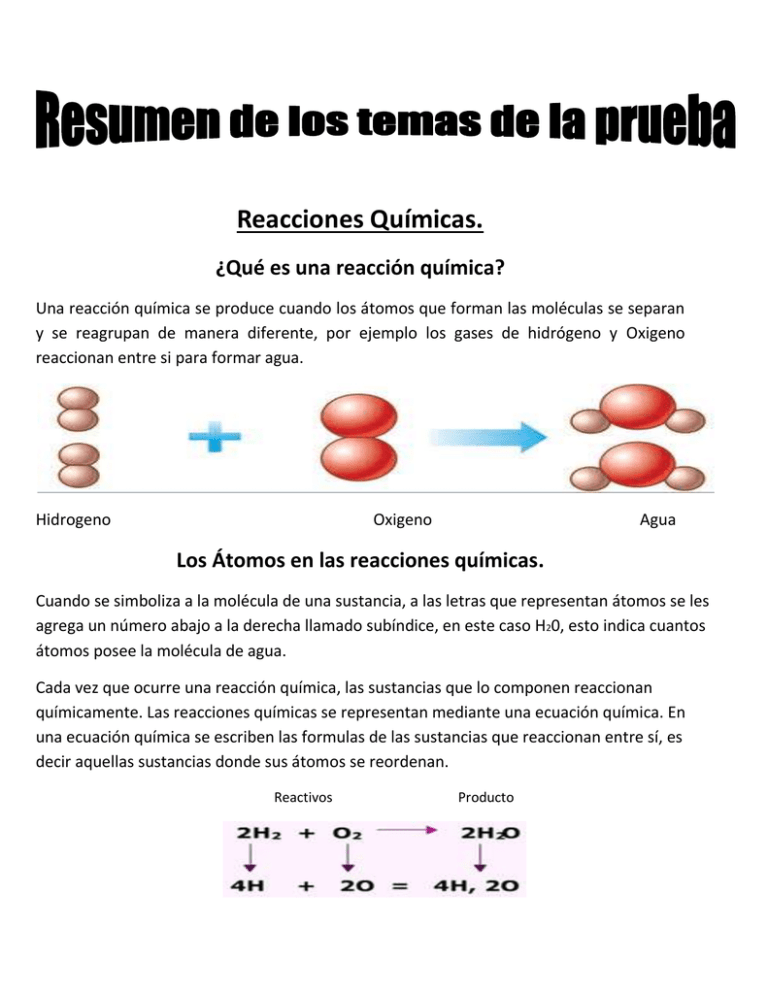
Reacciones Químicas. ¿Qué es una reacción química? Una reacción química se produce cuando los átomos que forman las moléculas se separan y se reagrupan de manera diferente, por ejemplo los gases de hidrógeno y Oxigeno reaccionan entre si para formar agua. Hidrogeno Oxigeno Agua Los Átomos en las reacciones químicas. Cuando se simboliza a la molécula de una sustancia, a las letras que representan átomos se les agrega un número abajo a la derecha llamado subíndice, en este caso H20, esto indica cuantos átomos posee la molécula de agua. Cada vez que ocurre una reacción química, las sustancias que lo componen reaccionan químicamente. Las reacciones químicas se representan mediante una ecuación química. En una ecuación química se escriben las formulas de las sustancias que reaccionan entre sí, es decir aquellas sustancias donde sus átomos se reordenan. Reactivos Producto Para realizar las ecuaciones químicas hay que tener en cuenta la idea central para la ciencia que es ¨La Ley De Conservación De La Materia¨ o¨Lavoisier¨ que dice que la masa consumida de los reactivos es igual a la masa obtenida de los productos. Tipos de Reacciones Químicas. En la química existen varios tipos de reacciones químicas, pero las más frecuentes son 3. Reacción de Síntesis: En este tipo de reacciones dos o más sustancias se combinan para dar un solo producto (A+B=C): H2+O2= 2H2O. Reacción de Descomposición: En este caso de un único elemento se obtienen dos sustancias (C=A+B): H20= H2+O2. Reacción de Intercambio: En esta transformación un elemento se traslada de un compuesto a otro (A+BC=AC+B) Cu+2AgNO3=Cu(NO3)2+2Ag. Reacciones Especiales Reacción de Combustión: Este tipo de reacciones pertenece a un grupo más amplio en las reacciones. Se caracterizan por estar acompañadas de luz y una gran elevación de temperatura. Las más frecuentes son combinaciones con oxigeno y los productos más habituales son dióxido de carbono y agua. Si en una combustión hay suficiente oxigeno se dice que es una combustión completa y si no posee el oxigeno necesario es una combustión incompleta. Combustión Completa Combustión Incompleta CH4+2O2=CO2+2H20 2CH4+3O2=2CO+4H2O Metano+Oxigeno=Dióxido de Metano+Oxigeno=Dióxido de Carbono+Vapor de Agua. Carbono+Vapor de Agua. Corrosión: La corrosión es la oxidación de un metal que lo puede llevar a la destrucción. El hierro es un metal que se oxida fácil al estar en contacto con el aire. Una de las maneras de proteger el metal es colocando una capa de plástico, pintura, aceite o grasa para que no entre en contacto con la atmosfera. Otra forma es colocando una capa de otro metal más activo químicamente de que el que se quiere proteger. En el caso del hierro el otro metal puede ser el Zinc. Electrólisis: La Electrólisis es un cambio químico donde una sustancia se descompone en los elementos que la compone o viceversa a través de la energía eléctrica. Ej: La electrólisis del agua. Óxidos Los óxidos son compuestos binarios formados por oxigeno y otro elemento químico. Si este otro elemento es un no metal resulta ser un oxido acido, por lo contrario sería un oxido básico. ALGUNOS EJEMPLOS DE ÓXIDOS: Óxido de Carbono (IV) (CO2), el óxido de hierro(II) (FeO) y óxido de calcio (II) (CaO). La valencia del oxigeno siempre es 2 excepto en condiciones especiales como el Peróxido de oxígeno, también conocido como el ¨Agua Oxigenada¨ donde la valencia es 1.







