la energía libre de la oxidación de los alimentos , y esto se
Anuncio

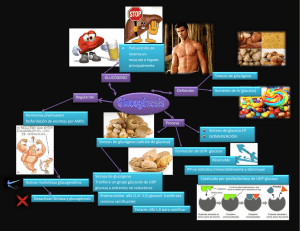
RESEÑA CLUB DE REVISTA POSGRADO DE MEDICINA DE LA ACTIVIDAD FÍSICA Y EL DEPORTE - FUCS TÍTULO DEL ARTÍCULO AUTOR BIBLIOGRA FÍA El metabolismo de hidratos de carbono, y la formación de ATP Guyton y Hall Libro de texto de Fisiología Médica , edición 12. CAPÍTULO 67, 809-818 Copyright © 2011, 2006, 2000, 1996, 1991, 1986, 1981, 1976, 1966, 1961, 1956 por Saunders, un sello editorial de Elsevier Inc. La liberación de energía de los alimentos, y el concepto de "energía libre" La mayoría de las reacciones químicas en las células están dirigidas a recuperar la energía en los alimentos disponibles para los diferentes sistemas fisiológicos de la célula. Por ejemplo, se requiere energía para la actividad muscular, la secreción por las glándulas, el mantenimiento de los potenciales de membrana por las fibras nerviosas y musculares, la síntesis de las sustancias en las células, la absorción de alimentos en el tracto gastrointestinal, y muchas otras funciones. Reacciones acopladas Todos los alimentos (CHOS, grasas, proteínas) se pueden oxidar en la célula, y durante este proceso, las grandes cantidades de energía se liberan. La energía necesaria por los procesos fisiológicos de las células no es el calor pero la energía para provocar el movimiento mecánico en el caso de la función muscular, para concentrar los solutos en el caso de la secreción glandular, y para efectuar otras funciones celulares. Para proporcionar esta energía, las reacciones químicas deben ser "acoplados" con los sistemas responsables de estas funciones fisiológicas. Este acoplamiento se realiza mediante sistemas de transferencia de la enzima celular y especiales de energía. "Energía Libre" La cantidad de energía liberada por la oxidación completa de un alimento se llama la energía libre de la oxidación de los alimentos , y esto se representa generalmente por el símbolo G. Energía libre por lo general se expresa en términos de calorías por mol de sustancia. Por ejemplo, la cantidad de energía libre liberada por la oxidación completa de 1 mol (180 gramos) de glucosa es 686 000 calorías. ATP es la "moneda energética" del Cuerpo La adenosin trifosfato (ATP) es un vínculo esencial entre las funciones de producción de energía del cuerpo (utilización de la energía y la Figura 67-1 ). Por esta razón, la ATP ha sido llamada la moneda de energía del cuerpo, y puede ser ganar y perder repetidamente. La energía derivada de la oxidación de CHOs, proteínas, grasas y se utiliza para convertir ADP a ATP, que luego se consume por las distintas reacciones del cuerpo que son necesarias para: Transporte activo de moléculas a través de las membranas celulares La contracción de los músculos y el rendimiento de trabajo mecánico Diversas reacciones sintéticas que crean hormonas, las membranas celulares, y muchas otras moléculas esenciales del cuerpo La conducción de los impulsos nerviosos La división celular y el crecimiento ATP es un compuesto químico lábil que está presente en todas las células. ATP es una combinación de adenina, ribosa y tres radicales fosfato como se muestra en la Figura 67-2 . Los dos últimos radicales fosfato se conectan con el resto de la molécula mediante enlaces de alta energía, que se indican por el símbolo ~ . La cantidad de energía libre en cada uno de estos enlaces de alta energía por mol de ATP es de aproximadamente 7300 calorías en condiciones estándar y cerca de 12.000 calorías en las condiciones habituales de temperatura y concentraciones de los reactivos en el cuerpo. Por lo tanto, en el cuerpo, la eliminación de cada uno de los dos últimos radicales fosfato libera aproximadamente 12.000 calorías de energía. Después de la pérdida de un radical fosfato de ATP, el compuesto se convierte en ADP, y después de la pérdida del segundo radical fosfato, se convierte en monofosfato de adenosina (AMP). Las interconversiones entre ATP, ADP, AMP y son los siguientes: ATP está presente en todas partes en el citoplasma y núcleo-plasma de todas las células, y esencialmente todos los mecanismos fisiológicos que requieren energía para la operación de obtener directamente a partir de ATP (u otro compuesto de alta energía similar, trifosfato de guanosina [GTP]). A su vez, la comida en las células se oxida gradualmente, y la energía liberada se utiliza para formar nuevo ATP, manteniendo así siempre un suministro de esta sustancia. Todas estas transferencias de energía se llevan a cabo por medio de reacciones acopladas. Objetivo: Explicar cómo la energía de los CHOs puede ser utilizado para formar ATP en las células. Normalmente, el 90% o más de todos CHOs utilizados por el cuerpo se utilizan para este propósito. Papel central de la glucosa en el metabolismo de los CHOs Los productos finales de la digestión de CHOs en el tracto digestivo son casi en su totalidad de glucosa, fructosa y galactosa-con la glucosa que representa, en promedio, alrededor del 80% de éstos. Después de la absorción desde el tracto intestinal, gran parte de la fructosa y casi toda la galactosa se convierten rápidamente en glucosa en el hígado. Por lo tanto, poca fructosa y galactosa están presentes en la sangre circulante. Glucosa se convierte así en la vía común final para el transporte de casi todos los CHOS a las células del tejido . En las células del hígado, las enzimas apropiadas están disponibles para promover interconversiones entre los monosacáridos glucosa, fructosa y galactosa -como se muestra en la Figura 67-3. Además, la dinámica de las reacciones son tales que cuando el hígado libera los monosacáridos de nuevo en la sangre, el producto final es casi en su totalidad de la glucosa. La razón para esto es que las células del hígado contienen grandes cantidades de glucosa fosfatasa. Por lo tanto, la glucosa-6-fosfato se puede degradar a la glucosa y fosfato, y la glucosa puede entonces ser transportado a través de la membrana celular de hígado de nuevo en la sangre. Una vez más, debería hacerse hincapié en que por lo general más de 95% de todos los monosacáridos que circulan en la sangre son el producto de conversión final, la glucosa. Transporte de glucosa a través de la membrana celular Antes que la glucosa pueda ser utilizada por las células del tejido del cuerpo, debe ser transportado a través de la membrana celular del tejido en el citoplasma celular. Sin embargo, la glucosa NO puede difundirse fácilmente a través de los poros de la membrana celular debido a que el peso molecular máximo de partículas que pueden difundir fácilmente es de aproximadamente 100, y la glucosa tiene un peso molecular de 180. Sin embargo, la glucosa NO pasa al interior de las células con un razonable grado de libertad por el mecanismo de la difusión facilitada. Penetrando a través de la matriz lipídica de la membrana celular son un gran número de proteínas portadoras moléculas que pueden unirse con la glucosa. En esta forma ligada, la glucosa puede ser transportado por el portador de un lado de la membrana hasta el otro lado y luego se libera. Por lo tanto, si la concentración de glucosa es mayor en un lado de la membrana que en el otro lado, más glucosa se transporta desde la zona de alta concentración a la zona de baja concentración que en la dirección opuesta. El transporte de glucosa a través de las membranas de la mayoría de las células del tejido es bastante diferente de la que se produce a través de la membrana gastrointestinal o a través del epitelio de los túbulos renales. En ambos casos, la glucosa es transportada por el mecanismo de sodio-glucosa co-transporte activo , en el que el transporte activo de sodio proporciona la energía para la absorción de la glucosa en contra de una diferencia de concentración. Este mecanismo de co-transporte sodio glucosa funciona sólo en ciertas células epiteliales especiales que se adaptan específicamente para la absorción activa de glucosa. En otras membranas de las células, la glucosa se transporta sólo de mayor concentración hacia la concentración más baja por difusión facilitada , posible gracias a las propiedades de unión especiales proteína transportadora de glucosa de la membrana. La Insulina aumenta la difusión facilitada de la glucosa La tasa de transporte de glucosa, así como el transporte de algunos otros monosacáridos, se ↑ en gran medida por la insulina. Cuando grandes cantidades de insulina son secretados por el páncreas, la tasa de transporte de glucosa en la mayoría de las células aumenta a 10 o más veces la velocidad de transporte cuando no se segrega insulina. Por el contrario, las cantidades de glucosa que pueden difundirse a la parte interior de la mayoría de las células del cuerpo en ausencia de insulina, con la excepción de las células del hígado y el cerebro, son demasiado poco para suministrar la cantidad de glucosa que normalmente se requiere para el metabolismo energético. La tasa de utilización de CHOs por la mayoría de las células es controlado por la tasa de secreción de insulina del páncreas. Fosforilación de la glucosa Inmediatamente después de la entrada en las células, la glucosa se combina con un radical fosfato de acuerdo con la siguiente reacción: Esta fosforilación se promueve principalmente por la enzima glucoquinasa en el hígado y por la hexoquinasa en la mayoría de otras células. La fosforilación de la glucosa es casi completamente irreversible, excepto en las células hepáticas, las células epiteliales tubulares renales, y las células epiteliales intestinales; en estas células, otra enzima, la fosfatasa de la glucosa , también está disponible, y cuando este se activa, se puede revertir la reacción. En la mayoría de los tejidos del cuerpo, la fosforilación sirve para capturar el nivel de glucosa en la célula. Es decir, debido a su casi instantánea unión con el fosfato, la glucosa NO se difundirá de vuelta, excepto de aquellas células especiales, especialmente células hepáticas, que tienen fosfatasa. El glucógeno se almacena en el hígado y músculo Después de la absorción en una célula, la glucosa se puede utilizar inmediatamente para la liberación de energía a la célula, o puede ser almacenada en forma de glucógeno , que es un gran polímero de la glucosa. Todas las células del cuerpo son capaces de almacenar al menos algo de glucógeno, pero ciertas células pueden almacenar grandes cantidades, especialmente las células del hígado , que pueden almacenar hasta 5 a 8% de su peso en forma de glucógeno, y células musculares , que puede almacenar hasta 1 a 3% de glucógeno. Las moléculas de glucógeno se pueden polimerizar a casi cualquier peso molecular, con el peso molecular promedio es de 5 millones o mayor; la mayor parte del glucógeno se precipita en forma de gránulos sólidos. Esta conversión de los monosacáridos en un compuestos de alto peso molecular precipitado (glucógeno) hace que sea posible almacenar grandes cantidades de CHOS SIN alterar significativamente la presión osmótica de los fluidos intracelulares. Las altas concentraciones de monosacáridos solubles de bajo peso molecular puede generar caos o estragos en las relaciones osmóticas entre los fluidos intracelulares y extracelulares. Glicogénesis (formación de glucógeno) Las reacciones químicas para la glucogénesis se muestran en la Figura 67-4 . A partir de esta figura, se puede observar que la glucosa-6-fosfato puede convertirse en glucosa-1fosfato ; este se convierte en uridina difosfato glucosa , que finalmente se convierte en glucógeno. Se requieren varias enzimas específicas para causar estas conversiones, y cualquier monosacáridos que se pueda convertir en glucosa puede entrar en las reacciones. Ciertos compuestos más pequeños, incluyendo ácido láctico, glicerol, ácido pirúvico , y algunos aminoácidos desaminados , también se pueden convertir en glucosa o compuestos estrechamente afines y luego se convierte en glucógeno. Glucogenolisis (degradación del glucógeno almacenado) Glucogenólisis significa la degradación del glucógeno almacenado de la célula para volver a formar la glucosa en las células. La glucosa se puede utilizar para proporcionar energía. Glucogenolisis no se produce por la reversión de las mismas reacciones químicas que forman glucógeno; En cambio, cada molécula sucesiva glucosa en cada rama del polímero glucógeno se divide a distancia por la fosforilación, catalizada por la enzima fosforilasa. En condiciones de reposo, la fosforilasa está en una forma inactiva, por lo que el glucógeno permanecerá almacenado. Cuando es necesario volver a formar glucosa a partir del glucógeno, la fosforilasa primero debe activarse. Esto se puede lograr de varias maneras, incluyendo las siguientes dos. La activación de la fosforilasa por la epinefrina o mediante glucagón Dos hormonas, adrenalina y glucagón , pueden activar la fosforilasa y por lo tanto causar la glucogenólisis rápida. El efecto inicial de cada una de estas hormonas es el de promover la formación de AMP cíclico en las células, que entonces inicia una cascada de reacciones químicas que activa la fosforilasa. La epinefrina es liberada por las médulas suprarrenales cuando se estimula el SNS. Por lo tanto, una de las funciones del SNS es ↑ la disponibilidad de glucosa para el metabolismo de energía rápida. Esta función de la epinefrina se produce notablemente tanto en las células del hígado y el músculo, lo que contribuye, junto con otros efectos de la estimulación simpática, a la preparación del cuerpo para la acción. El glucagón es una hormona secretada por las células alfa del páncreas cuando la concentración de glucosa en la sangre cae demasiado bajo. Se estimula la formación de AMP cíclico principalmente en las células del hígado, y esto a su vez promueve la conversión de glucógeno en glucosa hepática y su liberación en la sangre, elevando así la concentración de glucosa en sangre. La liberación de energía de la glucosa por la vía glucolítica Debido a la oxidación completa de 1 gramo-mol de glucosa libera 686.000 calorías de energía y sólo 12.000 calorías de energía son necesarios para formar 1 gramo-mol de ATP, la energía se perdería si la glucosa se descompone de una vez en agua y dióxido de carbono, mientras forma sólo una única molécula de ATP. Afortunadamente, las células del cuerpo contienen enzimas especiales de proteínas que hacen dividir la molécula de glucosa un poco a la vez en muchos pasos sucesivos, de modo que su energía se libera en paquetes pequeños para formar una molécula de ATP a la vez, formando un total de 38 moles de ATP por cada mol de glucosa metabolizada por las células. Las siguientes secciones describen los principios básicos de los procesos por los cuales la molécula de glucosa se divide progresivamente y su energía es liberada para formar ATP. La glucólisis-Splitting (división)-glucosa para formar ácido pirúvico El medio más importante de liberación de energía de la molécula de glucosa se inicia por glucólisis . Los productos finales de la glucólisis son luego oxidados para proporcionar energía. La glucólisis una molécula de glucosa se divide para formar dos moléculas de ácido pirúvico . La glucólisis se produce por diez reacciones químicas sucesivas, mostradas en la Figura 67-5. Cada paso es catalizado por al menos una enzima (proteína específica). Tenga en cuenta que la glucosa se convierte primero en fructosa-1,6-difosfato y luego se divide en dos moléculas de tres átomos de carbono, gliceraldehído-3-fosfato, cada uno de los cuales se convierte entonces a través de cinco pasos adicionales en ácido pirúvico. La formación de ATP durante la glicólisis A pesar de las muchas reacciones químicas en la serie glucolítica, sólo una pequeña parte de la energía libre en la molécula de glucosa se libera en la mayoría de los pasos. Sin embargo, entre el ácido 1,3-difosfoglicérico y las etapas de ácido 3-fosfoglicérico, y otra vez entre el ácido fosfoenolpirúvico y las etapas de ácido pirúvico, los paquetes de energía liberada son mayores que 12.000 calorías por mol, la cantidad requerida para formar ATP, y las reacciones se acoplan de una manera tal que se forma ATP. Por lo tanto, se forman un total de 4 moles de ATP por cada mol de fructosa 1,6-difosfato que se divide en ácido pirúvico. Sin embargo, se requieren 2 moles de ATP para fosforilar la glucosa inicial para formar fructosa 1,6-difosfato-antes de que pudiera comenzar la glucólisis. Por lo tanto, la ganancia neta de moléculas de ATP por todo el proceso de glucolítica es de sólo 2 moles por cada mol de glucosa utilizada . Esto equivale a 24.000 calorías de energía que se convierte transferidos a ATP, pero durante la glucólisis, un total de 56.000 calorías de energía se pierde de la glucosa original, dando un total de eficiencia para la formación de ATP de sólo el 43%. El 57% restante de la energía se pierde en forma de calor. La conversión del ácido pirúvico a A cetil coenzima A La siguiente etapa en la degradación de la glucosa es una conversión de dos pasos de las dos moléculas de ácido pirúvico a partir de la Figura 67-5 en dos moléculas de Acetil coenzima A (acetilCoA), de acuerdo con la siguiente reacción: Dos moléculas de CO2 y 4H átomos de hidrógeno son liberados de esta reacción, mientras que las porciones restantes de las dos moléculas de ácido pirúvico se combinan con la coenzima A, un derivado de la vitamina ácido pantoténico, para formar dos moléculas de acetil-CoA. En esta conversión, NO se forma ATP, pero hasta 6 moléculas de ATP se forman cuando los 4 átomos de hidrógeno liberados son oxidados más tarde. Ciclo del ácido cítrico (ciclo de Krebs) La siguiente etapa en la degradación de la molécula de glucosa se denomina el ciclo del ácido cítrico (también llamado ciclo de Krebs ). Esta es una secuencia de reacciones químicas en las que la porción de acetilo de la acetil-CoA es degradado a CO2 y H. Estas reacciones ocurren todas en la matriz de la mitocondria . Los átomos de hidrógeno liberado se añaden a la cantidad de estos átomos que posteriormente se oxidan, liberando de enormes cantidades de energía para formar ATP. La figura 67-6 muestra las diferentes etapas de las reacciones químicas en el ciclo del ácido cítrico. Las sustancias se añaden a la izquierda durante las reacciones químicas, y los productos de las reacciones químicas se muestran a la derecha. Note en la parte superior de la columna que comienza con el ciclo de ácido oxalacético , y en la parte inferior de la cadena de reacciones, ácido oxaloacético se forma de nuevo. Por lo tanto, el ciclo puede continuar una y otra. En la etapa inicial del ciclo del ácido cítrico, acetil-CoA se combina con ácido oxalacético para formar ácido cítrico . La parte de la coenzima A de la acetil-CoA se libera y se puede utilizar una y otra vez para la formación de todavía más cantidades de acetil-CoA a partir de ácido pirúvico. La porción acetilo, sin embargo, se convierte en una parte integral de la molécula de ácido cítrico. Durante las etapas sucesivas del ciclo del ácido cítrico, se añaden varias moléculas de agua, como se muestra a la izquierda en la figura, y de dióxido de carbono y átomos de hidrógeno son liberados en otras etapas en el ciclo, como se muestra a la derecha en la figura. Los resultados netos de la ciclo del ácido cítrico se dan en toda la explicación en la parte inferior de la Figura 67-6 , lo que demuestra que por cada molécula de glucosa metabolizada originalmente, 2 moléculas de acetil-CoA reductasa entran en el ciclo del ácido cítrico, junto con 6 moléculas de agua. Estos se degrada en 4 moléculas de dióxido de carbono, 16 átomos de hidrógeno, y 2 moléculas de la coenzima A. 2 moléculas de ATP se forman. La formación de ATP en el ciclo del ácido cítrico El ciclo del ácido cítrico en sí no causa una gran cantidad de energía para ser liberada; en sólo una de las reacciones químicas-durante el cambio a partir de ácido α-cetoglutárico a succínico ácido- es una molécula de ATP formada. Así, por cada molécula de glucosa metabolizada, dos moléculas de acetil-CoA pasan a través del ciclo del ácido cítrico, formando cada uno una molécula de ATP, o un total de dos moléculas de ATP formadas. Función de Deshidrogenasas y NADH en provocar la liberación de átomos de hidrógeno en el ciclo del ácido cítrico Como ya se ha señalado en varios puntos de esta discusión, los átomos de hidrógeno se liberan durante las diferentes reacciones químicas del ciclo del ácido cítrico, 4 átomos de hidrógeno durante la glucólisis, 4 durante la formación de acetil-CoA a partir del ácido pirúvico y 16 en el ciclo del ácido cítrico; esto hace un total de 24 átomos de hidrógeno liberado por cada molécula original de la glucosa . Sin embargo, los átomos de hidrógeno no son simplemente soltados en el fluido intracelular. En su lugar, se liberan en paquetes de dos, y en cada caso, la liberación es catalizada por una enzima específica llamada deshidrogenasa . 20 de los 24 átomos de hidrógeno se combinan inmediatamente con nicotinamida adenina dinucleótido (NAD + ), un derivado de la vitamina niacina, de acuerdo con la siguiente reacción: Esta reacción no se producirá sin la intermediación de la deshidrogenasa específica o sin la disponibilidad de NAD + para actuar como un portador de hidrógeno. Tanto el ion hidrógeno libre y el hidrógeno unido con NAD + posteriormente celebran múltiples reacciones químicas oxidativas que forman enormes cantidades de ATP. Los restantes cuatro átomos de hidrógeno liberados durante la descomposición de la glucosa-los cuatro liberados durante el ciclo del ácido cítrico entre las etapas de ácido succínico y fumárico - se combinan con una deshidrogenasa específica pero no son liberados posteriormente a NAD + . En lugar de ello, pasan directamente de la deshidrogenasa en el proceso oxidativo. Función de descarboxilasas para provocar la liberación de dióxido de carbono Haciendo referencia de nuevo a las reacciones químicas del ciclo del ácido cítrico, así como a aquellos para la formación de acetil-CoA a partir de ácido pirúvico, nos encontramos con que hay 3 etapas en el que se libera dióxido de carbono. Para causar la liberación de dióxido de carbono, otras enzimas específicas, llamadas descarboxilasas , dividen el dióxido de carbono del sustrato. El dióxido de carbono se disuelve en los fluidos corporales y se transporta a los pulmones, donde ha espirado del cuerpo. Formación de grandes cantidades de ATP por oxidación del hidrógeno- el proceso de la Fosforilación Oxidativa Después de todos las complejos procesos de: 1. La glucólisis 2. El ciclo del ácido cítrico 3. Deshidrogenación 4. La descarboxilación Se forman pequeñas cantidades de ATP durante todos estos procesos -sólo 2 moléculas de ATP en el esquema de la glucólisis y otros 2 en el ciclo del ácido cítrico por cada molécula de glucosa metabolizada. En lugar de ello, se forma casi el 90% de la ATP total creado a través de metabolismo de la glucosa durante la posterior oxidación de los átomos de hidrógeno que se liberan en las primeras etapas de la degradación de la glucosa. De hecho, la función principal de todas estas etapas anteriores es hacer que el hidrógeno de la molécula de glucosa disponible en formas que pueden ser oxidados. La oxidación de hidrógeno se lleva a cabo, como se ilustra en la Figura 67-7 , por una serie de reacciones catalizadas enzimáticamente en las mitocondrias . Estas reacciones: Dividir cada átomo de hidrógeno en un ion hidrógeno y un electrón Utilizar los electrones finalmente para combinar el oxígeno disuelto de los fluidos con las moléculas de agua para formar iones hidroxilo. A continuación, los iones hidrógeno e hidroxilo se combinan entre sí para formar agua. Durante esta secuencia de reacciones oxidativas, enormes cantidades de energía son liberados para formar ATP. La formación de ATP de esta manera se llama la fosforilación oxidativa . Esto se produce enteramente en la mitocondria mediante un proceso altamente especializado llamado el mecanismo quimiosmótico . Mecanismo quimiosmótico de la mitocondria para formar ATP La ionización del hidrógeno, la cadena de transporte de electrones, y de formación de agua El primer paso en la fosforilación oxidativa en la mitocondria es para ionizar los átomos de hidrógeno que han sido retirados de los sustratos de alimentos. Como se ha descrito anteriormente, estos átomos de hidrógeno se eliminan en pares: Uno se convierte inmediatamente en un ion hidrógeno, H + Los otros se combina con NAD + para formar NADH. La porción superior de la Figura 67-7 muestra el destino posterior del NADH y H + . El efecto inicial es para liberar el otro átomo de hidrógeno del NADH para formar otro ion hidrógeno, H + ; este proceso reconstituye también NAD + que será reutilizado una y otra vez. Los electrones que se retiran de los átomos de hidrógeno para causar la ionización de hidrógeno entran inmediatamente en una cadena de transporte de electrones de aceptores de electrones que son una parte integral de la membrana interna de la mitocondria. Los receptores de electrones pueden ser reducidos o de forma reversible oxidados por aceptar o donar a los electrones. Los componentes importantes de esta cadena de transporte de electrones incluyen flavoproteína , varias proteínas de sulfuro de hierro, ubiquinona y citocromos B, C 1, C , A , y A 3. Cada electrón se transportó de uno de estos aceptores a la siguiente hasta que finalmente llega citocromo A3, que se llama la citocromo oxidasa , ya que es capaz de dar 2 electrones y por lo tanto reducir el oxígeno elemental para formar oxígeno iónico, que luego se combina con los iones de hidrógeno y formar agua. La Figura 67-7 muestra el transporte de electrones a través de la cadena de electrones y luego su uso final por el citocromo oxidasa para causar la formación de moléculas de agua. Durante el transporte de estos electrones a través de la cadena de transporte de electrones, se libera energía que se utiliza para provocar la síntesis de ATP. Bombeo de iones de hidrógeno en la cámara externa de la mitocondria causadas por la cadena de transporte de electrones Como los electrones pasan a través de la cadena de transporte de electrones, grandes cantidades de energía son liberados. Esta energía se utiliza para bombear iones de hidrógeno de la matriz interna de la mitocondria (a la derecha en la Figura 67-7 ) en la cámara exterior entre las membranas mitocondriales interna y externa (a la izquierda). Esto crea una alta concentración de iones de hidrógeno cargados positivamente en esta cámara; también crea un fuerte potencial eléctrico negativo en la matriz interior. La formación de ATP El siguiente paso en la fosforilación oxidativa es convertir el ADP en ATP. Esto ocurre en conjunción con una molécula de proteína grande que sobresale todo el camino a través de la membrana mitocondrial interna y proyectos con una cabeza en la matriz mitocondrial interna. Esta molécula es una ATPasa, la naturaleza física de que se muestra en la Figura 67-7 . Se llama ATP sintetasa . La alta concentración de iones de hidrógeno cargados positivamente en la cámara exterior y la gran diferencia de potencial eléctrico a través de la membrana interna hacen que los iones de hidrógeno fluyan en la matriz mitocondrial interna a través de la sustancia de la molécula de ATPasa . Al hacerlo, la energía derivada de este flujo de iones de hidrógeno es utilizado por ATPasa para convertir el ADP en ATP mediante la combinación de ADP con un radical (Pi) de fosfato iónico libre, añadiendo así otra fosfato de enlace de alta energía a la molécula. El paso final en el proceso es la transferencia de ATP desde el interior de la mitocondria de nuevo al citoplasma de la célula. Esto se produce por difusión facilitada hacia fuera a través de la membrana interna y luego por simple difusión a través de la membrana mitocondrial externa permeable. A su vez, ADP se transfiere continuamente en la otra dirección para la conversión continua en ATP. Para cada dos electrones que pasan a través de toda la cadena de transporte de electrones (que representa la ionización de dos átomos de hidrógeno), hasta tres moléculas de ATP se sintetizan . Resumen de Formación de ATP durante la descomposición de la glucosa Ahora podemos determinar el número total de moléculas de ATP que, en condiciones óptimas, se pueden formar por la energía de una molécula de glucosa. 1. Durante la glucólisis, se forman 4 moléculas de ATP y 2 se gastan para hacer que la fosforilación inicial de la glucosa para que el proceso en marcha. Esto da una ganancia neta de 2 moléculas de ATP . 2. Durante cada revolución del ciclo del ácido cítrico, se forma una molécula de ATP. Sin embargo, debido a que cada molécula de glucosa se divide en dos moléculas de ácido pirúvico, hay dos revoluciones del ciclo para cada molécula de glucosa metabolizada, dando una producción neta de 2 moléculas de ATP más . 3. Durante todo el esquema de degradación de la glucosa, un total de 24 átomos de hidrógeno son liberados durante la glicólisis y durante el ciclo del ácido cítrico. 20 de estos átomos se oxidan en conjunción con el mecanismo de quimiosmótica se muestra en la Figura 67-7 , con la liberación de tres moléculas de ATP por dos átomos de hidrógeno metabolizados. Esto le da un adicional de 30 moléculas de ATP . 4. Los restantes cuatro átomos de hidrógeno son liberados por su deshidrogenasa en el esquema quimiosmótico oxidativo en la mitocondria más allá de la primera etapa de la Figura 677 . 2 moléculas de ATP son generalmente liberados por cada dos átomos de hidrógeno oxidado, dando así un total de 4 más moléculas de ATP . Ahora, la adición de todas las moléculas de ATP formadas, nos encontramos con un máximo de 38 moléculas de ATP formadas por cada molécula de glucosa degradado a dióxido de carbono y agua. Por lo tanto, 456.000 calorías de energía pueden ser almacenados en forma de ATP, mientras que 686.000 calorías son liberados durante la oxidación completa de cada gramomolécula de glucosa. Esto representa un total máximo de eficiencia de transferencia de energía de un 66%. El 34% restante de la energía se convierte en calor y, por lo tanto, NO puede ser utilizado por las células para realizar funciones específicas. El control de la Energía liberada del glucógeno almacenado cuando el cuerpo necesita energía adicional: Efecto de las concentraciones de ATP y ADP celulares en controlar la tasa de glucólisis La liberación continua de energía de la glucosa cuando las células NO necesitan energía sería un proceso extremadamente derrochador. En lugar de ello, la glucólisis y la posterior oxidación de los átomos de hidrógeno se controla continuamente de acuerdo con la necesidad de las células por el ATP. Este control se lleva a cabo por múltiples mecanismos de control de retroalimentación dentro de los esquemas química. Entre los más importantes de estos son los efectos de las concentraciones celulares de tanto ADP y ATP en el control de las velocidades de las reacciones químicas en la secuencia de metabolismo de la energía. Una manera importante en que ATP ayuda a controlar el metabolismo energético es inhibir la enzima fosfofructoquinasa . Debido a que esta enzima promueve la formación de la fructosa-1,6difosfato, uno de los pasos iniciales en la serie de reacciones glucolítica, el efecto neto del exceso de ATP celular es ralentizar o incluso detener la glucólisis, que a su vez detiene el metabolismo de CHOS. Por el contrario, ADP y el AMP hace que el cambio opuesto en esta enzima, lo que aumenta en gran medida su actividad. Cada vez que el ATP es utilizado por los tejidos para energizar una fracción importante de casi todas las reacciones químicas intracelulares, esto reduce la inhibición de ATP de la enzima fosfofructoquinasa y al mismo tiempo aumenta su actividad como resultado del exceso de ADP formado. Así, el proceso glucolítico se pone en movimiento, y el almacenamiento celular total de ATP se repone. Otro enlace de control es el ion citrato formado en el ciclo del ácido cítrico. Un exceso de este ión también inhibe fuertemente la fosfofructoquinasa . Una tercera manera por la cual el sistema de ATP-ADP-AMP controla el metabolismo de CHOS, así como el control de la liberación de energía a partir de grasas y proteínas, es el siguiente: Con referencia a las diversas reacciones químicas para la liberación de energía, vemos que si todo el ADP celular ya se ha convertido en ATP, simplemente no se puede formar ATP adicional. Como resultado, se detiene toda la secuencia implicada en el uso de los productos alimenticios -glucosa, grasas y proteínas para formar ATP. Entonces, cuando el ATP es utilizado por la célula para activar las diferentes funciones fisiológicas en la célula, el ADP y AMP recién formados activan a su vez el proceso energético de nuevo, y ADP y AMP se devuelven casi instantáneamente al estado ATP. De esta manera, esencialmente un completo almacenamiento de ATP se mantiene automáticamente, excepto durante la actividad celular extrema, como el ejercicio muy intenso. Liberación anaeróbica de energía - "Glucólisis Anaeróbica" De vez en cuando, el oxígeno bien puede estar inexistente o insuficiente, por lo que la fosforilación oxidativa NO puede tener lugar. Sin embargo, incluso en estas condiciones, una pequeña cantidad de energía puede todavía ser liberada a las células de la etapa de la glucólisis de la degradación de carbohidratos, debido a que las reacciones químicas para la descomposición de la glucosa en ácido pirúvico NO requieren oxígeno. Este proceso es extremadamente derrochadora de glucosa debido a que sólo 24.000 calorías de energía se utilizan para formar ATP por cada molécula de glucosa metabolizada, que representa sólo un poco más de 3% de la energía total en la molécula de glucosa. Sin embargo, esta liberación de energía glucolítica de las células, que se llama energía anaeróbica , puede ser una medida para salvar vidas durante un máximo de unos minutos cuando el oxígeno NO está disponible. La formación de ácido láctico durante la glucólisis anaeróbica permite la libera ción de energía extra anaeróbica La ley de acción de masas indica que a medida que los productos finales de una reacción química se acumulan en un medio de reacción, la velocidad de la reacción disminuye, acercándose a cero. Los dos productos finales de las reacciones glucolíticas (ver Figura 67-5 ) son: El ácido pirúvico Átomos de hidrógeno combinados con NAD + para formar NADH y H + . La acumulación de uno o ambos de estos debería detener el proceso glucolítico y prevenir la formación de ATP. Cuando sus cantidades comienzan a ser excesivo, estos dos productos finales reaccionan entre sí para formar ácido láctico, de acuerdo con la siguiente reacción: Por lo tanto, en condiciones anaeróbicas, la mayor parte del ácido pirúvico se convierte en ácido láctico, que se difunde fácilmente fuera de las células en los fluidos extracelulares e incluso en los fluidos intracelulares de otras células menos activas. Por lo tanto, el ácido láctico representa un tipo de "sumidero" en el que los productos finales glucolíticos pueden desaparecer, permitiendo así a la glucólisis para continuar mucho más tiempo que el que sería posible. De hecho, la glicólisis podría continuar durante unos pocos segundos sin esta conversión. En lugar de ello, se puede proceder durante varios minutos, suministrando el cuerpo con considerables cantidades adicionales de ATP, incluso en ausencia de oxígeno respiratorio. Reconversión de ácido láctico a ácido pirúvico cuando oxígeno vuelve a estar disponible Cuando una persona comienza a respirar oxígeno de nuevo después de un período de metabolismo anaeróbico, el ácido láctico se reconvierte rápidamente a ácido pirúvico y NADH + H+ . Gran parte de estos se oxidan rápidamente a grandes cantidades de ATP. Este exceso de ATP provoca entonces que casi tres cuartas partes del exceso de ácido pirúvico restante se convierta de nuevo en glucosa. Por lo tanto, la gran cantidad de ácido láctico que se forma durante la glucólisis anaeróbica no se pierde del cuerpo, ya que, cuando el oxígeno está disponible de nuevo, el ácido láctico puede ser ya sea reconvertido a la glucosa o se utilizado directamente para obtener energía. Con mucho, la mayor parte de esta reconversión se produce en el hígado, pero una pequeña cantidad también puede ocurrir en otros tejidos. El uso de ácido láctico por el Corazón para producir energía El músculo cardíaco es especialmente capaz de convertir el ácido láctico en ácido pirúvico y luego usar el ácido pirúvico para la energía. Esto ocurre en gran medida durante el ejercicio intenso, cuando grandes cantidades de ácido láctico se liberan en la sangre de los músculos esqueléticos y se consumen como fuente de energía adicional por el corazón. La liberación de energía de la glucosa por la Vía Pentosa- fosfato En casi todos los músculos del cuerpo, esencialmente todos los CHOS utilizados para la energía se degradan en ácido pirúvico por la glucólisis y luego son oxidados. Sin embargo, este esquema glucolítica NO es el único medio por el cual la glucosa puede ser degradada y utilizada para proporcionar energía. Un segundo mecanismo importante para la descomposición y la oxidación de la glucosa se denomina la vía de las pentosas fosfato (o vía fosfogluconato ), que es responsable de casi un 30% de la degradación de la glucosa en el hígado e incluso en las células grasas . Esta vía es especialmente importante ya que puede proporcionar la energía independientemente de todas las enzimas del ciclo del ácido cítrico y por lo tanto es una vía alternativa para el metabolismo de energía cuando se producen ciertas anormalidades enzimáticas en las células. Tiene una capacidad especial para proveer de energía a múltiples procesos de síntesis celular. La liberación de dióxido de carbono y de hidrógeno por la vía pentosa-fosfato La Figura 67-8 muestra la mayoría de las reacciones químicas básicas en la vía de las pentosas fosfato. Muestra que la glucosa, durante varias etapas de conversión, puede liberar una molécula de dióxido de carbono y cuatro átomos de hidrógeno, con la formación resultante de un azúcar de cinco carbonos, D -ribulosa. Esta sustancia puede cambiar progresivamente en varios otros azucares de cinco, cuatro, siete, y tres carbonos. Por último, varias combinaciones de estos azúcares pueden resintetizar glucosa. Sin embargo, sólo cinco moléculas de glucosa son resintetizadas por cada seis moléculas de glucosa que inicialmente entran en las reacciones . Es decir, la vía Pentosa-fosfato es un proceso cíclico en el que una molécula de glucosa se metaboliza por cada revolución del ciclo. Por lo tanto, repitiendo el ciclo una y otra vez, toda la glucosa puede eventualmente ser convertido en dióxido de carbono y de hidrógeno, y el hidrógeno puede entrar en la vía de la fosforilación oxidativa para formar ATP; más a menudo, sin embargo, se utiliza para la síntesis de grasa u otras sustancias. El uso del hidrógeno para sintetizar grasa; la función de nicotinamida adenina dinucleótido fosfato El hidrógeno liberado durante el ciclo de la pentosa fosfato NO se combina con NAD + como en la vía glucolítica, pero se combina con nicotinamida adenina dinucleótido fosfato (NADP + ), que es casi idéntica a NAD + a excepción de un radical fosfato adicional. Esta diferencia es extremadamente importante, ya que sólo el hidrógeno unido con NADP + en forma de NADPH se puede utilizar para la síntesis de grasas a partir de CHOS y para la síntesis de algunas otras sustancias. Cuando la vía glucolítica para el uso de la glucosa se vuelve lento debido a la inactividad celular, la vía Pentosa-fosfato permanece operativa (principalmente en el hígado) para descomponer cualquier exceso de glucosa para continuar siendo transportada dentro de las células, y NADPH se convierte en abundante para ayudar a la conversión de Acetil CoA, también derivado de la glucosa, a ácidos grasos de cadena larga. Esta es otra manera en que la energía en la molécula de glucosa se para otro fin que para la formación de ATP-en este caso, para la formación y el almacenamiento de grasa en el cuerpo . La conversión de la glucosa en glucógeno o grasa Cuando no se requiere inmediatamente la glucosa para la energía, el exceso de glucosa que entra continuamente las células o bien se almacena en forma de glucógeno o se convierte en grasa. La glucosa se almacena preferentemente en forma de glucógeno hasta que las células depositen glucógeno tanto como les sea posible una cantidad suficiente para abastecer las necesidades de energía del cuerpo para sólo de 12 a 24 horas. Cuando el almacenamiento celular de glucógeno se saturan con glucógeno, la glucosa adicional se convierte en grasa en las células del hígado y las cellas grasa y, se almacena como grasa en las células grasas. La formación de CHOS a partir de proteínas y grasa "gluconeogénesis" Cuando las reservas corporales de carbohidratos disminuyen por debajo de lo normal, cantidades moderadas de glucosa pueden formar a partir de los aminoácidos y la porción glicerol de la grasa. Este proceso se llama gluconeogénesis . La gluconeogénesis es especialmente importante en la prevención de una reducción excesiva en la concentración de glucosa en sangre durante el ayuno. La glucosa es el sustrato primario para la energía en tejidos tales como el cerebro y las células rojas de la sangre, y cantidades adecuadas de glucosa debe estar presente en la sangre durante varias horas entre las comidas. El hígado juega un papel clave en el mantenimiento de los niveles de glucosa en sangre durante el ayuno mediante la conversión del glucógeno almacenado en glucosa (glucogenólisis) y por la síntesis de glucosa, principalmente de lactato y aminoácidos (gluconeogénesis). Aproximadamente el 25% de la producción de glucosa del hígado durante el ayuno es de la gluconeogénesis, ayudando a proporcionar un suministro constante de glucosa al cerebro. Durante el ayuno prolongado, los riñones también sintetizan cantidades considerables de glucosa a partir de aminoácidos y otros precursores. Alrededor del 60% de los aminoácidos en las proteínas del cuerpo se pueden convertir fácilmente en CHOS; el 40% restante tienen configuraciones químicas que hacen de este difícil o imposible. Cada aminoácido se convierte en glucosa mediante un proceso químico ligeramente diferente. Por ejemplo, la alanina se puede convertir directamente en ácido pirúvico simplemente por desaminación; el ácido pirúvico se convierte a continuación en glucosa o glucógeno almacenado. Varios de los aminoácidos más complicadas se puede convertir en diferentes azúcares que contienen de tres, cuatro, cinco, o siete átomos de carbono; entonces pueden entrar en la vía fosfogluconato y eventualmente formar glucosa. Así, por medio de desaminación más varias interconversiones simples, muchos de los aminoácidos puede convertirse en glucosa. Efecto de la corticotropina y los glucocorticoides sobre la gluconeogénesis Cuando las cantidades normales de los CHOS NO están disponibles para las células, la adenohipófisis, por razones NO completamente entendidas, comienza a secretar mayores cantidades de la hormona corticotropina . Esto estimula la corteza suprarrenal para producir grandes cantidades de hormonas glucocorticoides , especialmente cortisol . A su vez, el cortisol moviliza proteínas de esencialmente todas las células del cuerpo, haciendo que estos estén disponibles en forma de aminoácidos en los fluidos corporales. Una alta proporción de estos son inmediatamente desaminados en el hígado y proporcionar sustratos ideales para la conversión en glucosa. Por lo tanto, uno de los medios más importantes por la que se promueve la gluconeogénesis es a través de la liberación de glucocorticoides por la corteza suprarrenal. Elaborado por Nieves Liliana Salamanca Gómez, MD. Residente Tercer Año Medicina de la actividad Física y el Deporte Fecha 19/08/2014 Bogotá - Colombia