Fórmula Mayo y Junio 2016
Anuncio

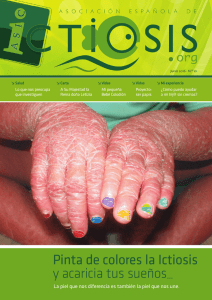
Boletín nº 46 • Mayo y Junio 2016 V Edición Premio Acofarma a la Innovación en Formulación Magistral El próximo 12 de mayo tendrá lugar la entrega del premio a los ganadores de la V Edición del Premio Acofarma a la Innovación en Formulación Magistral. El jurado de esta edición ha premiado el trabajo “Bases científicas para la elaboración del primer formulario podológico”, cuyo autor es Santiago Gómez. El presente trabajo propone la elaboración de un formulario donde se recojan las formulaciones magistrales más frecuentes en podología con una valoración de su idoneidad farmacológica y galénica así como su adaptación a los activos y excipientes actuales que se utilizan en las oficinas de farmacia para la elaboración de las mismas. Asimismo, se han premiado dos accésits. Por un lado, el trabajo “Estudio de estabilidad fisicoquímica y microbiológica de dos nuevas formulaciones de clorhidrato de clonidina para uso pediátrico”, realizado por Vicente Merino Bohórquez y Álvaro Pascual Hernández del H. U. Virgen Macarena. El objetivo de este trabajo es desarrollar un estudio de estabilidad fisicoquímica y microbiológica de una solución de clonidina 20 μg/mL en distintas condiciones de almacenamiento para determinar el periodo de validez de la misma siguiendo las recomendaciones de la Farmacopea Americana (United States Pharmacopeia, USP), y con ello obtener los datos de estabilidad fisicoquímica y microbiológica necesario para garantizar la calidad de las fórmulas elaboradas en forma de solución oral para uso pediátrico. Por otro, el trabajo “Análisis de la homogeneidad de las dosis en fórmulas magistrales líquidas orales de uso pediátrico para el aseguramiento de su calidad” de José Bruno Fariña, Ana María Santoveña Estévez y Javier Suárez González de la Universidad de La Laguna. Los objetivos de este trabajo se centraron en dos aspectos fundamentales: primero, analizar la utilidad de los ensayos uniformidad de masa de las dosis obtenidas de envases multidosis y el ensayo de uniformidad de contenido de preparaciones unidosis de la Real Farmacopea Europea (RFE), adaptados a fórmulas magistrales líquidas orales multidosis de uso pediátrico para comprobar la homogeneidad del principio activo en las dosis recogidas con el dispositivo dosificador; y segundo, detectar las variables de los procesos utilizados en el procedimiento que puedan incidir en la homogeneidad de las dosis de las fórmulas magistrales elaboradas. Para alcanzar dichos objetivos el estudio se ha realizado con diferentes formulaciones pediátricas orales de ranitidina, flecainida y acetazolamida. Fórmula magistral tópica de n-acetilcisteína 10% + urea 5% O/W en el tratamiento de la ictiosis lamelar. Introducción La ictiosis laminar es una enfermedad rara, autosómica recesiva, que afecta a la función barrera de la piel debido a un trastorno de la queratinización. Los pacientes que la padecen se caracterizan por presentar el cuerpo cubierto de escamas (en griego ichthys, pez) debido a la hiperqueratosis, sin una eritrodermia significativa. La enfermedad conlleva un fuerte impacto en la calidad de vida, debido a la alteración de la apariencia física, la sintomatología asociada y las restricciones derivadas de la enfermedad y del tratamiento. La piel suele ocasionar prurito o dolor debido a la formación de grietas, la movilidad puede verse reducida como consecuencia de la rigidez de la piel y los pacientes están expuestos a deshidratación e infecciones. Otros hallazgos asociados incluyen: ectropion persistente (párpados evertidos), eclabion (labios evertidos), complicaciones oculares, distrofia ungueal, alopecia cicatricial, queratodermia palmo-plantar, retraso en el desarrollo, baja estatura, hipohidrosis con intolerancia al calor y déficit auditivo. Aunque la enfermedad es debida a mutaciones en varios genes, la mayoría se localizan en el gen TGM1, lo que provoca la ausencia de la enzima transglutaminasa1, cuya función contribuye a la correcta formación del estrato corneo. La ausencia de esta enzima es la responsable de la hiperqueratosis que forma las escamas. La enfermedad puede ser especialmente virulenta en las primeras semanas y meses de vida. Los recién nacidos (“bebe colodión”) suelen estar envueltos por una gruesa membrana que cubre toda la superficie corporal con aspecto de celofán. En esta etapa, existe un riesgo aumentado de sepsis y de trastornos hidroelectrolíticos. El fenotipo de los pacientes puede evolucionar con el tiempo, con expresividad clínica variable, de acuerdo con la extensión, la localización y las complicaciones que pueda presentar el enfermo y sobre todo, el cuidado que se tenga con ellos. La prevalencia de esta enfermedad se estima en aproximadamente 1/100.000 - 1/1.000.000 individuos por lo que está clasificada como enfermedad rara (nº ORPHANET: ORPHA313 y CIE-10: Q80.2). El tratamiento paliativo para la sintomatología cutánea se realiza con emolientes, lubricantes y queratolíticos tópicos, que tienen como objetivo la hidratación y queratolisis de las áreas afectadas. En las formas más graves se utilizan los retinoides por vía oral. En la tabla I se describen los medicamentos empleados: Hidratantes Lubricantes Queratolíticos Cloruro sódico Glicerol Urea (≤ 5%) Parafina Urea (> 5%) Vaselina (petro- α-hidroxi-ácidos Ácido glicólico latum) Ácido salicílico Propilenglicol Queratolíticos con control de la proliferación y diferenciación epidérmica N-acetilcisteína Análogos de la vitamina D (calcipotriol y tacalcitol) Retinoides tópicos (tazaroteno, adapaleno, liarozol) Aranegui B., Hernández-Martín, A. Tratamiento de las ictiosis congénitas. Piel. 2014; 29:43-8 La elección de las diferentes alternativas viene condicionada por los efectos secundarios a largo plazo puesto que son tratamientos crónicos. La N-acetilcisteína (NAC) esta comercializada en España como tratamiento coadyuvante en los procesos respiratorios que cursan con hipersecreción mucosa excesiva o espesa y como antídoto para la sobredosis por paracetamol. La NAC es un derivado aminoacídico hipoalérgico y atóxico. Se ha constatado que inhibe la proliferación de fibroblastos NIH3T3, con la consecuente inhibición de la proliferación de los queratinocitos. Es de utilidad en procesos que cursan con trastornos hiperproliferativos cutáneos. Aunque solo hay publicados pequeñas series de casos, se presenta como una opción terapéutica válida y segura para el tratamiento de la hiperqueratosis producida en la ictiosis lamelar. La investigación y desarrollo de nuevos fármacos en este tipo de patologías de muy baja prevalencia en la mayoría de los casos es prácticamente inexistente, por lo que la elaboración de medicamentos por parte de los servicios de farmacia y farmacia comunitaria es prácticamente la última oportunidad que tienen estos pacientes de recibir un tratamiento farmacológico. Caso clínico Paciente de 4 años diagnosticado de ictiosis lamelar con falta de respuesta al tratamiento convencional. Recibe tratamiento tópico con emolientes y queratolíticos, y se plantea el tratamiento tópico con N-acetilcisteína con el objeto de retrasar el tratamiento oral con retinoides. El servicio de dermatología solicita tratamiento tópico con N-acetilcisteína 10% + urea 5% por su eficacia y escasa toxicidad en el tratamiento de ictiosis lamelar, previo consentimiento informado. Desarrollo de la fórmula Se realiza una revisión bibliográfica y estudio galénico para la elaboración de la fórmula magistral teniendo en cuenta las propiedades físico-químicas de la NAC, las características de la patología y la edad del paciente. Puesto que la fórmula debe aplicarse por gran parte de la superficie corporal incluyendo el cuero cabelludo, se decide seleccionar una base de absorción O/W no iónica (Neo PCL O/W autoemulsionable) ya que mejora la extensibilidad en la aplicación sin dejar residuo apreciable y es fácilmente lavable. Puesto que la NAC es muy soluble en agua, se incorpora a la fase acuosa, consiguiendo así una excelente homogeneidad en la emulsión. Se decide además la incorporación de glicerina en la formulación por sus propiedades emolientes. Tras la aplicación de la fórmula se refiere una intensa mejoría tanto en la hiperqueratosis como en la descamación que caracterizaban el curso clínico del paciente. A pesar de la buena respuesta, los progenitores refieren un intenso olor muy desagradable tras la aplicación. Este olor responde a la presencia de grupos sulfidrilo en la molécula de NAC. Como consecuencia la calidad de vida del paciente se ve disminuida debido al rechazo que provoca dicho efecto, incluso en su entorno más próximo. Tras la petición familiar para una posible corrección de las propiedades organolépticas de la fórmula, se estudian varias alternativas y se incluye esencia de romero en una proporción de 1,5mL por 100g de crema. Se consigue un aceptable enmascaramiento del olor. Además se introduce hidróxido sódico para corregir el pH ácido de la formulación y obtener un valor más acorde con el pH de la piel. La fórmula patrón modificado y actual para 1.000g: N-acetilcisteina 10% + Urea 5% crema O/W Fase acuosa N-acetilcisteina Urea Glicerina Hidroxido sódico lentejas Agua purificada 100g 50g 50g 20g 515mL Fase oleosa Neo PCL O/W Esencia de romero 250g 15mL Modus operandi 1. Pesar y medir los componentes de la fase acuosa. Reservar aproximadamente 50mL de agua y disponer en un vaso de precipitados para disolver el hidróxido sódico. 2. En otro vaso de precipitados disolver la Nacetilcisteína y la urea. Añadir posteriormente la glicerina y calentar a una temperatura entre 50-60º. 3. Incorporar la solución con hidróxido sódico sobre la fase acuosa de forma progresiva y con agitación. Medir el pH, que debe estar comprendido entre 4 y 5. 4. Pesar el Neo PCL y fundir en otro vaso de precipitados a las misma Tª que la fase acuosa. Una vez fundido incorporar la esencia de romero y homogeneizar. 5. Cuando las fases alcancen la misma temperatura incorporar la fase acuosa sobre la oleosa, de forma progresiva y bajo agitación. 6. Finalmente proceder a estabilizar la emulsión mediante agitación moderada durante la fase de enfriamiento. 7. Envasar y etiquetar. Características del producto acabado: crema consistente blanca de olor intenso. pH comprendido entre 4 y 5. Plazo de validez: 30 días Tª ambiente (Guía de Buenas Prácticas de Preparación de Medicamentos, Servicios de Farmacia Hospitalaria). Condiciones de conservación: mantener protegido de la humedad y a Tª inferior a 30ºC. Posología y modo de aplicación La posología establecida es de una aplicación dos veces al día durante los primeros 15 días de tratamiento. Posteriormente continuar con una aplicación diaria preferentemente nocturna después del baño. Se recomienda que la duración del baño sea de 15 a 30 minutos, ya que facilitará el desprendimiento de las escamas por exfoliación. Después del secado de la piel se procederá a la aplicación de la crema. Comentarios finales / Discusión El tratamiento tópico con NAC consigue retrasar el tratamiento oral con retinoides y disminuir el número de tratamientos tópicos con emolientes y queratolíticos. Tras los primeros días de tratamiento, se produce una notoria mejoría en la hiperqueratosis y en el proceso de desprendimiento de las escamas cutáneas que se mantiene a lo largo de toda la duración del tratamiento. En la actualidad, en nuestro hospital hay 5 pacientes que reciben la fórmula con buena respuesta y tolerancia, 3 de los cuales son pediátricos. La fórmula patrón actual puede aplicarse por toda la superficie corporal procurando evitar las grietas (ya que puede producir prurito). En las zonas más queratinizadas como las palmas de las manos y las plantas de los pies sería recomendable elaborar una crema o pomada W/O con un 20% de vaselina ya que favorece la penetración del fármaco. Es muy importante destacar el grado de desamparo y olvido que sufren muchos colectivos de pacientes con enfermedades raras, para los cuales la industria farmacéutica no investiga, desarrolla ni comercializa medicamentos. Como profesionales tenemos una gran responsabilidad y debería ser prioritario el proporcionar la máxima cobertura a los pacientes afectados con enfermedades raras, para que puedan recibir un tratamiento paliativo que alivie su situación y mejore su calidad de vida. Además de establecer y facilitar mecanismos de colaboración entre las instituciones sanitarias, profesionales de la salud y colectivos de pacientes. Autor: Carmela Dávila Pousa Servicio de Farmacia Complexo Hospitalario Universitario Pontevedra “Ponte en nuestra piel” Lema de la Asociación Española de ictiosis: http://www. ictiosis.org/ Imagen cedida por la Asociación Española de Ictiosis ¡Ampliamos nuestra gama de material de laboratorio para tu laboratorio! Consulte por nuestra gama completa de material para el laboratorio a su delegado o al departamento de atención al cliente llamando al 902 36 22 03 o escribiendo a info@acofarma.com. Ya disponible Base ungüento emulsificable no iónico Propiedades y usos Se trata de una base anhidra para FM. Es una masa cérea blanca o blanquecina, exenta de fase acuosa. Idónea para formar emulsiones untuosas. Sin conservante. Al tratarse de un excipiente autoemulsionable no-iónico, se pueden formular también pomadas hidrófilas no-iónicas o pomadas lavables. Químicamente es inerte, por lo que es compatible con la mayoría de principios activos. Disponible en presentación de 1,5kg. Más detalles del producto en la sección “ficha técnica” de nuestra web Fórmula del mes Agenda Nombre de la fórmula: IX Fórum APROFARM: “20 años junto al formulador” Emulsión de glicopirrolato Composición: Glicopirrolato, 1 %, Emulsión o/w csp, 50 g, “Aplicar en las palmas de las manos” Diseño de la fórmula La base emulsión o/w debe ser evanescente dada la zona de aplicación (palma de las manos) y patología (hiperhidrosis). Una vez aplicada y adecuadamente extendida apenas debe dejar residuo graso sobre la piel. Otro requisito importante es que debe ser una base no iónica ya que las aniónicas podrían experimental ruptura con el glicopirrolato, debido a su naturaleza iónica (sal de amonio cuaternaria). La base acofar crema cetomacrogol cumple con los requisitos indicados: es evanescente, no grasa y estable frente al glicopirrolato. Además hay que destacar que tiene óptima extensibilidad y consistencia. El INCI es el siguiente: Aqua, Petrolatum, Dodecane, Cera alba, Cetyl alcohol, Dimethicone, Glyceryl stearate, Propylene glicol, Steareth 21, Steareth 211, Methylparaben, Ethylparaben, Propylparaben, Phenoxyethanol. El glicopirrolato se incorpora sobre la emulsión disuelto previamente en un 10 % de agua purificada. Al diluir la base emulsiva se aumenta más si cabe su grado de evanescencia, evitando la sensación grasa tras la aplicación en las palmas de las manos. La fórmula final deberá ajustarse a pH 3-4 con ácido láctico. Rango de pH en donde el glicopirrolato manifiesta máxima eficacia terapéutica. La base acofar crema cetomacrogol es estable frente a este pH. No es necesario añadir conservantes, ya que la base acofar crema cetomacrogol los contiene. Queremos repasar nuestra trayectoria, paralelamente a la evolución de la Formulación Magistral durante estos 20 años pero también mirar hacia el futuro y a nuestro alrededor. Acercarte más la asociación para que te sientas partícipe de esta celebración. ¿Qué fórmulas han perdurado tras estos 20 años? ¿Cómo han evolucionado las prescripciones? ¿Qué herramientas hemos conseguido? ¿Cuántas inquietudes nos quedan por resolver? Sin olvidar nuestro día a día. Fecha: 10 de junio Horario: 10 a 18h Lugar: Colegio Oficial de Farmacéuticos, Barcelona La asistencia es gratuita aunque es necesario inscribirse. Más info: montse@aprofarm.org Formulación cosmética en la oficina de farmacia Fecha: 21 de junio Horario: 16 a 18h Lugar: Cecofar, Madrid Más info: www.cecofar.es Tel: 954 44 98 03 Desarrollo de la fórmula Glicopirrolato, 0,5 g Agua purificada, 5 g Acido láctico, II gotas Base acofar crema cetomacrogol csp, 50 g Más detalles de la fórmula y fotos disponibles en nuestra web 40% de descuento en productos con caducidad corta. Consulte en nuestra web las ofertas vigentes en dos pasos: 1. ingrese en su cuenta de compra online 2. busque el producto que le interese todos los productos químicos, toda la calidad farmacéutica Acofarma pone a disposición de sus clientes la cer tificación GMP-II acofarma distribución, S.A. Atención al cliente 902 36 22 03 info@acofarma.com www.acofarma.com @acoformuladores facebook.com/acofarmaformuladores